高级醇又称杂醇油(higher alcohols),是指碳原子数大于2的醇类,具有醇甜和助香功能,同时也是形成酯类和醛类等风味物质的重要前体,在酒类风味物质组成中占有重要地位。白酒中常见的高级醇包括正丙醇、正丁醇、异丁醇、异戊醇、活性戊醇、己醇和苯乙醇等。研究发现,高级醇代谢途径主要有氨基酸降解途径(Ehrlich pathway)和合成代谢途径(Harris pathway)(图1)。其中,Ehrlich pathway是支链氨基酸在转氨酶作用下形成相应的α-酮酸,α-酮酸经脱羧和还原,形成比原氨基酸少一个碳的高级醇[1]。如苏氨酸(Thr)生成正丙醇、亮氨酸(Leu)生成异戊醇、缬氨酸(Val)生成异丁醇、异亮氨酸(Ile)生成活性戊醇(2-甲基丁醇)、苯丙氨酸(Phe)生成苯乙醇等[2-3]。Harris pathway是由糖通过糖酵解途径生成丙酮酸(α-酮酸),丙酮酸经脱羧还原形成高级醇[4]。
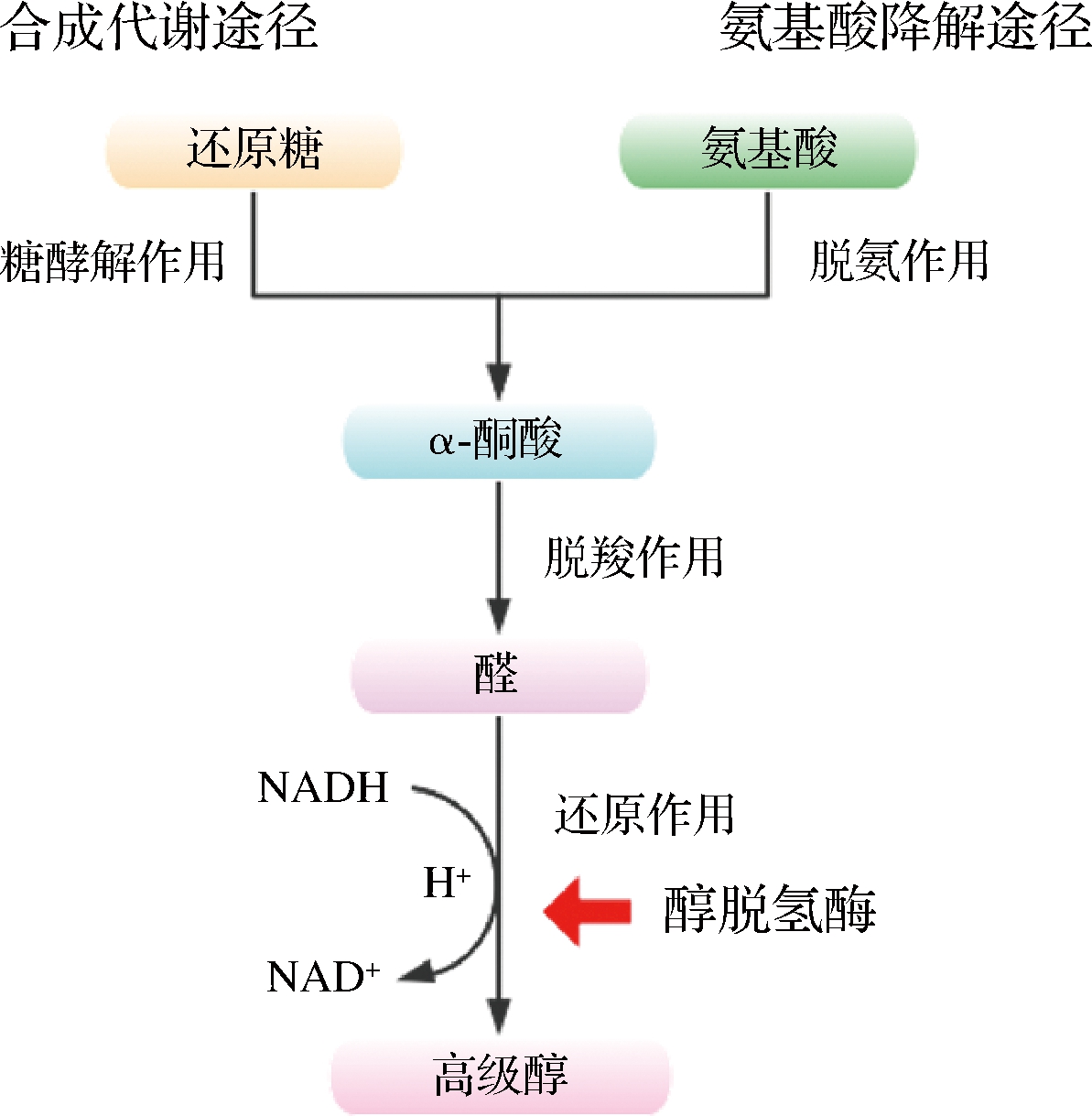
图1 高级醇代谢途径
Fig.1 Higher alcohol metabolic pathway
氨基酸是微生物生长代谢所需氮源之一,在发酵过程中主要由蛋白质经芽孢杆菌、乳酸菌、醋酸菌等微生物和酶作用下代谢生成[5-6]。当游离氨基酸含量较高时酵母菌主要利用Ehrlich pathway合成高级醇,而游离氨基酸耗尽时主要利用Harris pathway合成高级醇[7]。在葡萄酒发酵过程中添加丙氨酸(Ala)和缬氨酸(Val)能显著增加异丁醇的含量[8]。黄酒酿造中添加缬氨酸(Val)可增加异丁醇和异戊醇的含量[9]。因此,氨基酸种类和含量是影响酒类发酵过程中高级醇生成的重要因素之一[10-12]。
微生物合成高级醇的生理目的之一是平衡细胞内的氧化还原稳态,即将NADH的H+传递给醛转变为醇,以平衡NADH/NAD+的比例[13]。因此,氧化还原状态是影响微生物合成高级醇的另一重要原因。目前清香型白酒发酵过程中游离氨基酸含量变化,以及在混合微生物作用下游离氨基酸与高级醇合成的相关性尚不清楚,并且在发酵过程中Ehrlich pathway和Harris pathway对高级醇合成的贡献性尚不明确。基于以上,本研究以清香型白酒为研究对象,通过测定发酵过程中高级醇含量、氧化还原电位和游离氨基酸含量变化,分析高级醇与氧化还原电位和游离氨基酸之间的关系,探究清香型白酒发酵过程中高级醇生成规律。
1 材料与方法
1.1 材料
1.1.1 样本采集
酒醅样品采集于北方某清香型白酒厂,地缸发酵,采集发酵周期为28 d的大楂样品,采集时间为发酵 0、3、5、7、10、12、15、18、21、24、28 d,每个时间点分别采集3个发酵缸的酒醅样品。
1.1.2 试剂和仪器
盐酸、氯化钠、磷酸(分析纯),国药集团化学试剂有限公司;磺基水杨酸,天津永晟精细化工有限公司;标准品Amino Acids Mixture Standard Solution(Type H),日立高新科学公司;仲辛醇(色谱纯),上海易恩化学技术有限公司;甲醇(色谱纯),赛默飞世尔科技公司。
TR-901土壤ORP电位计,上海仪电科学仪器股份有限公司;SCIENTZ-IID超声破碎仪,宁波新芝生物科技股份有限公司;3-18KS Sigma高速离心机,上海成贯仪器有限公司;LA8080高速氨基酸自动分析仪,日立高新科学公司;TriPlus 500VL顶空进样器、Trace 1300气相色谱仪、ISQ7000质谱仪,赛默飞世尔科技公司;BCD-249CF美菱冰箱,合肥美菱股份有限公司。
1.2 实验方法
1.2.1 高级醇含量测定
准确称取2.5 g(准确至0.01 g)酒醅样品到顶空瓶中,加入10 mL基体改性剂;并加入10 μL的内标溶液(2.2 g/L),立即拧紧瓶盖,混匀待测。GC-MS测定条件[14]:初始温度为35 ℃,保持2 min,以5 ℃/min的速率升高至150 ℃并保持5 min,再以5 ℃/min 的速率升高至230 ℃ 并保持2 min。载气为高纯度氦气,气体流速为1.0 mL/min,进样器温度250 ℃,传输线温度260 ℃,离子源温度280 ℃。质谱仪EI发射电流为50 μA,EI的离子能量为70 eV。m/z扫描35~450 amu的总离子流,使用NIST 2.3谱库比对。进样方式为不分流进样,进样量为1.0 mL。根据GC-MS 检测的高级醇和内标的峰面积计算不同发酵时期酒醅中高级醇含量。
1.2.2 氧化还原电位测定
取样前使用土壤ORP电位计测定酒醅氧化还原电位,参比电极位于发酵缸中心位置,ORP电极位于参比电极两侧并且与参比电极的距离相等,待仪器测定数值锁定后记录数值。
1.2.3 游离氨基酸含量测定
称取1 g(准确至0.01 g)酒醅样品,准确加入5 mL水,在25 ℃条件下超声处理10 min(100 W,40 kHz),于10 000 r/min离心10 min。取上清液5 mL加入5 mL 10%磺基水杨酸,混合均匀置4 ℃冰箱冷藏静置60~120 min,于12 000 r/min离心15 min,取上清液经0.22 μm滤膜过滤后上机分析[5]。使用高速氨基酸分析仪测定酒醅中游离氨基酸含量。以峰面积定量,根据标准氨基酸的校正因子和样品稀释因子计算酒醅中氨基酸的含量。
1.2.4 统计分析
使用SPSS 24.0对氧化还原电位、高级醇和游离氨基酸含量进行单因素方差分析和聚类分析,使用R语言(Psych)计算Spearman相关性系数,使用Origin Lab 2017及R语言(ggplot2)绘图。
2 结果与分析
2.1 发酵过程中高级醇含量变化
在整个发酵过程中,高级醇含量在发酵0 d时最低,发酵0~3 d含量迅速升高,此后随发酵进行呈现先降低再增加的规律,不同高级醇最高含量出现时间有所不同(图2)。丙醇在发酵0 d时未检测出,在发酵3 d时达到最高(360.89 μg/kg),发酵28 d时含量为269.37 μg/kg。异戊醇和异丁醇在发酵24 d时含量最高(5 163.06、3 310.56 μg/kg),此后略有下降,发酵28 d时含量分别为5 091.24、3 100.37 μg/kg。2-甲基丁醇(活性戊醇)在发酵7 d时含量最高(1 437.46 μg/kg),发酵28 d时含量为1 350.88 μg/kg。苯乙醇在发酵28 d时含量最高为279.36 μg/kg。正戊醇、正丁醇和正己醇的含量相对较低,在发酵24 d时含量最高(7.88、26.22、33.26 μg/kg),此后略有下降,发酵28 d时含量分别为7.46、24.64、29.57 μg/kg。整体来看,在发酵结束时(发酵28 d)各高级醇累计含量之间的关系为异戊醇>异丁醇>2-甲基丁醇>丙醇> 苯乙醇>正己醇>正丁醇>正戊醇。

图2 不同发酵时期酒醅高级醇含量
Fig.2 Content of higher alcohols in Jiupei at different fermentation stages
注:不同小写字母表示具有显著差异(P<0.05)(下同)
通过比较单位发酵时间内高级醇的积累量发现,发酵0~3 d高级醇的变化最大,远高于其他发酵阶段。发酵0~3 d、5~7 d和18~24 d是高级醇主要产生的3个阶段,其中发酵0~3 d为高级醇合成主要阶段,而发酵3~5 d和10~15 d为高级醇主要减少的两个阶段(图3)。苯乙醇在发酵18~21 d时积累最快,其余高级醇在发酵前期(0~3 d)积累最快。研究表明固态发酵白酒的高级醇含量会随发酵时间的增加呈现上升趋势[12,14-15]。本研究中,高级醇在发酵0~3 d积累最快,正戊醇、正丁醇和正己醇的含量在发酵周期内含量远低于其他高级醇,且存在较大波动。白酒酿造中化学因素(乙醇和还原糖)对微生物的影响较大,而微生物种类和数量又影响环境因素的改变[16]。酵母是产高级醇的主要微生物,其丰度随发酵发生改变,并且在清香型白酒中发现酵母和细菌“二次增长”的现象[17]。因此,高级醇含量随发酵进行呈现波动变化,可能与发酵过程中多种微生物参与和环境因素有关。
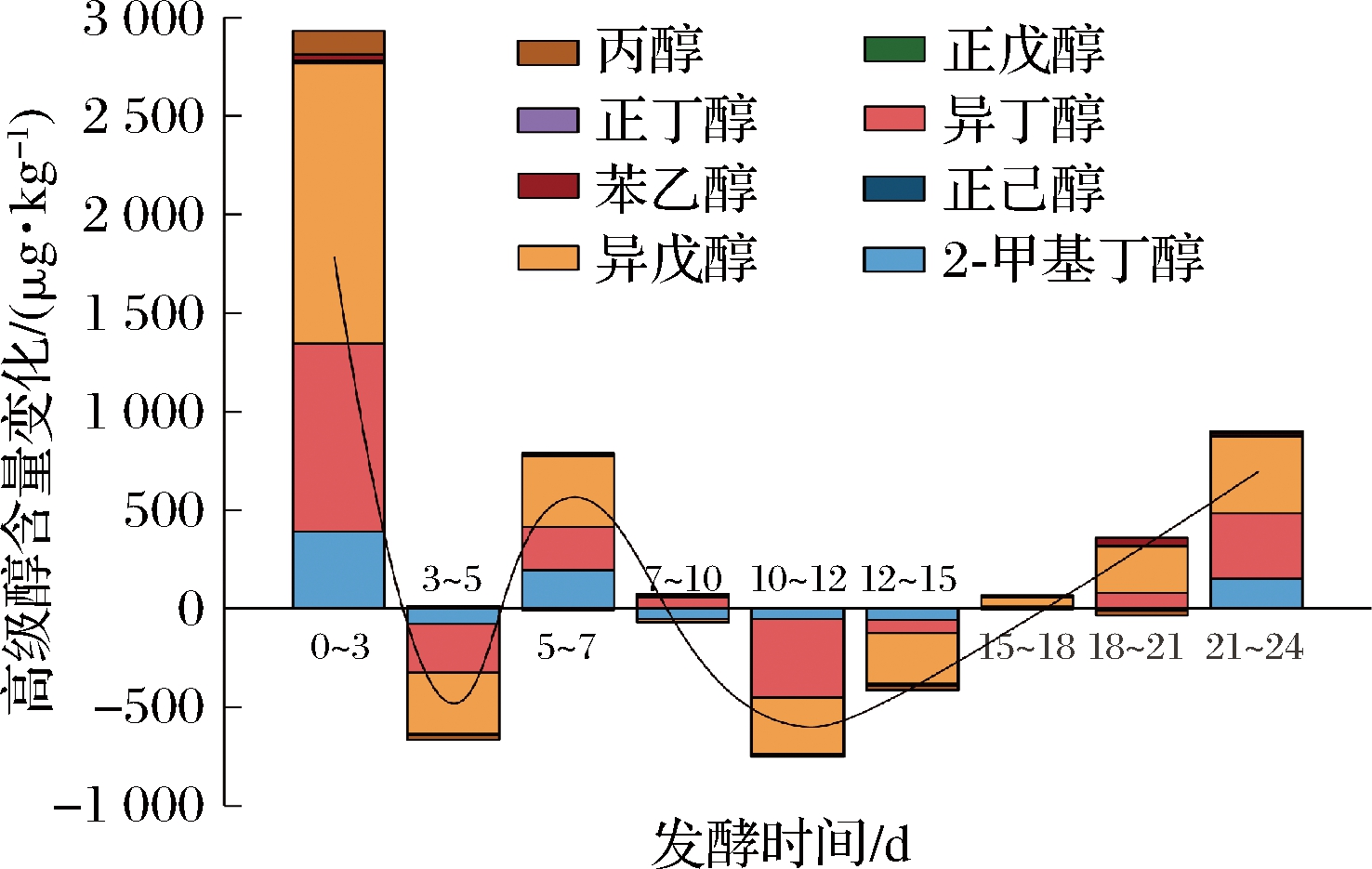
图3 单位时间内高级醇含量的平均变化
Fig.3 Change of average content of higher alcohols per unit time
2.2 发酵过程中氧化还原电位变化
为探究整个发酵过程中氧化还原状态,对整个发酵过程中氧化还原电位(Eh)的变化进行跟踪测定,结果如图4所示。发酵0 d时Eh最高(391.50 mV),发酵3 d时Eh最低(223.67 mV),此后随发酵进行氧化还原电位不断增加,并在发酵24~28 d稳定[(350±1) mV]。发酵0~5 d Eh差异显著(P<0.05),发酵7~21 d、发酵24~28 d Eh差异不显著(P>0.05)。发酵起始时Eh较高,此时氧气含量较高,随着发酵的进行,好氧微生物繁殖使环境的氧含量下降,使得Eh快速下降,而后随发酵进行产生氧化态物质,使得Eh再次升高[18]。
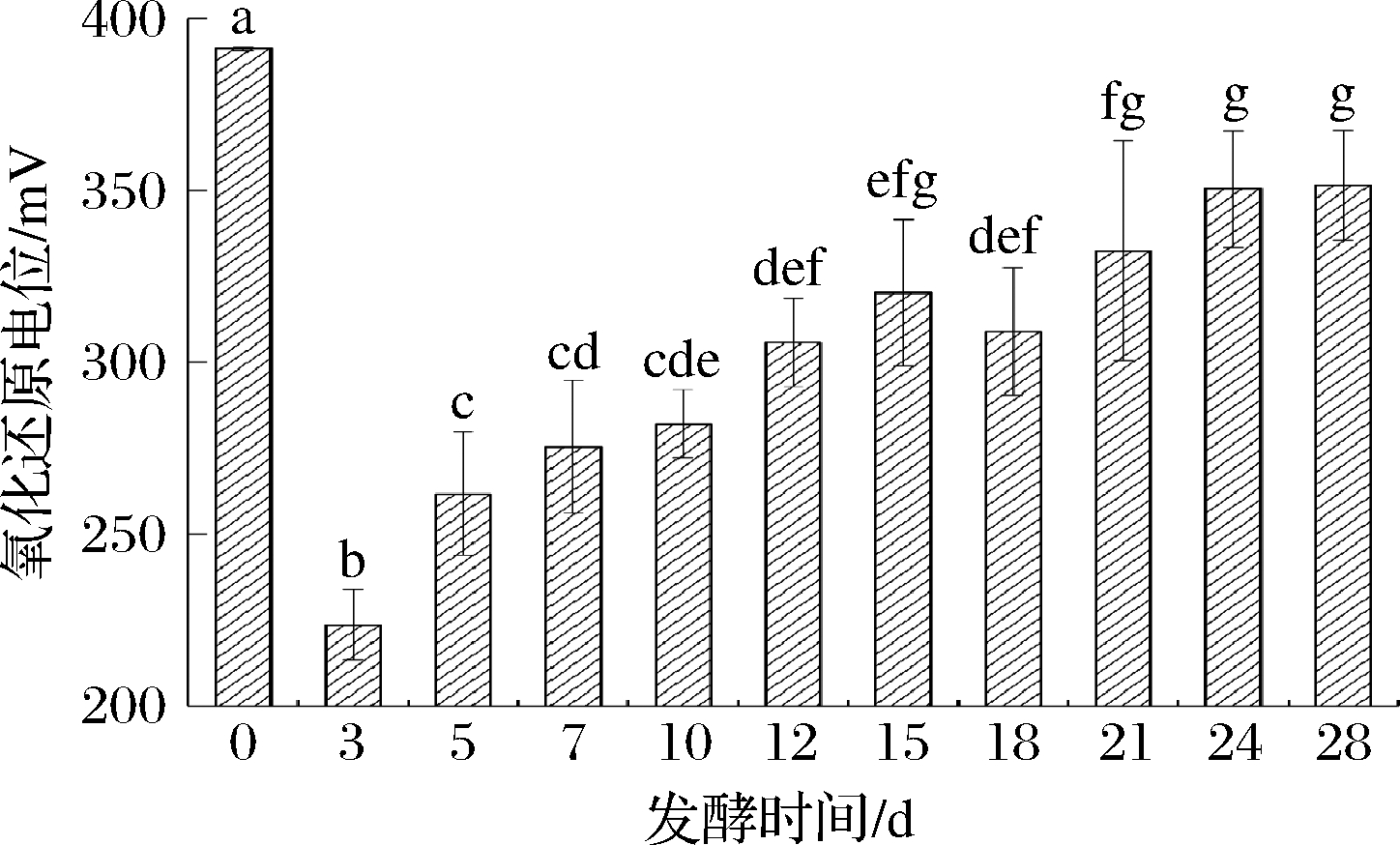
图4 不同发酵时期酒醅氧化还原电位变化
Fig.4 Changes of oxidation-reduction potential in Jiupei at different fermentation stages
微生物合成高级醇的生理功能相关研究显示,高级醇可以抑制其他微生物的生长[19]、平衡微生物的氧化还原稳定[20]和作为信号物质引诱捕食者的作用[21]。其中,维持细胞内氧化还原态的稳定性可能是白酒发酵中微生物合成高级醇的主要目的。由醛生成醇的过程需要辅酶NADH的参与,NADH经氧化产生H+和NAD+,H+与醛结合生成相应的高级醇。在有氧条件下有利于NAD+向NADH生成,如NADH可在碳水化合物、脂肪、蛋白质代谢等途径中生成,而较高含量的NADH可促进高级醇的生成[13, 22]。发酵起始Eh值高为微生物生长提供有利环境,使得酒醅原料得以降解,在碳水化合物、脂肪、蛋白质代谢等途径中获得NADH。因此,在白酒发酵前期氧气可能是产生大量高级醇的主要驱动因素。随发酵进行,酒醅中的氧气被利用,微生物代谢所产生的还原态物质增加,使得Eh下降,高级醇合成速率降低。发酵后期随Eh再次升高,并且酵母菌作为优势微生物存在[23],可能是发酵后期高级醇含量再次上升的原因。
2.3 发酵过程中游离氨基酸含量变化
从整个发酵过程来看,17种游离氨基酸中有16种游离氨基酸的含量在发酵0~3 d迅速升高(P<0.05),并随发酵进行整体呈现上升趋势,只有精氨酸(Arg)含量随发酵进行下降(图5)。高级醇合成的前体氨基酸,亮氨酸(Leu)、缬氨酸(Val)、苏氨酸(Thr)和异亮氨酸(Ile)在发酵28 d时含量最高为4.39、4.03、3.09、2.29 mg/100g,但苯丙氨酸(Phe)在发酵15 d时含量达到最高(3.35 mg/100g)。此外,丙氨酸(Ala)、谷氨酸(Glu)、赖氨酸(Lys)、甘氨酸(Gly)、酪氨酸(Tyr)、天冬氨酸(Asp)、丝氨酸(Ser)、组氨酸(His)和蛋氨酸(Met)含量在发酵28 d时达到最高,分别为7.53、6.13、5.24、2.35、2.12、1.82、1.56、1.07、0.69 mg/100g。半胱氨酸(Cys)在发酵10 d时含量最高(0.43 mg/100g)。脯氨酸(Pro)在发酵18 d时含量最高(4.88 mg/100g),精氨酸(Arg)在发酵0 d时含量最高(0.42 mg/100g)。综上所述,酒醅发酵过程中游离氨基酸含量随发酵进行整体呈现上升趋势,并且有13种游离氨基酸含量在发酵28 d达到最高。
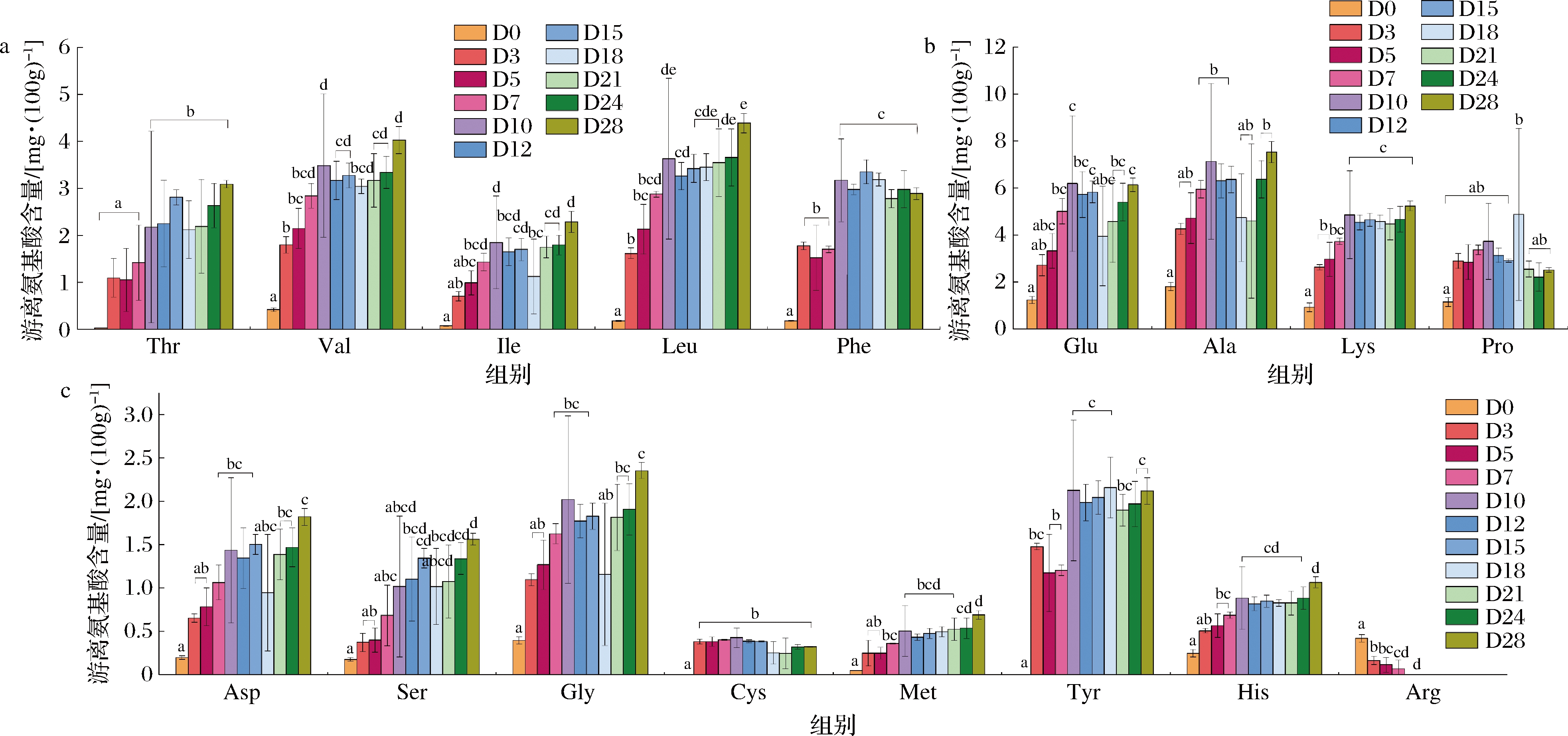
a-Thr、Val、Ile、Leu、Phe;b-Glu、Ala、Lys、Pro;c-Asp、Ser、Gly、Cys、Met、Tyr、His、Arg
图5 不同发酵时期酒醅游离氨基酸含量
Fig.5 Content of free amino acids in Jiupei at different fermentation stages
报道显示,在白酒发酵过程中游离氨基酸主要在堆积发酵和窖池发酵过程产生,并且大多数游离氨基酸的含量逐步增加[24]。糖化阶段和入池发酵前期是白酒酿造过程中Tyr和Phe的主要生成阶段[25]。对青稞酒和黄酒发酵过程中游离氨基酸研究表明,其总含量随发酵时间的增加而增加[5, 26]。本研究中共有16种游离氨基酸含量随发酵时间的增加逐步增加,这与前人的研究结果类似。发酵前期微生物大量增殖,蛋白质在芽孢杆菌、乳酸菌、醋酸菌等微生物和酶的作用下水解产生游离氨基酸是造成发酵前期游离氨基酸含量迅速上升的主要原因[5-6]。
2.4 高级醇和游离氨基酸聚类分析
发酵过程中高级醇游离氨基酸聚类分析结果如图6所示。基于高级醇含量的聚类分析可将发酵过程分为2个大类(图6-a),第1类由发酵0 d组成,第2类由发酵3、5、7、10、12、15、18、21、24、28 d组成,这一结果也进一步说明发酵前与发酵后高级醇含量存在显著不同。基于游离氨基酸含量的聚类分析可将发酵过程分为3个大类(图6-b),第1类由发酵0 d组成,该时间点的游离氨基酸含量最低。第2类由发酵3、5、7 d组成,该时间段内游离氨基酸含量不断增加,说明随发酵进行微生物大量繁殖并代谢产生了游离氨基酸,使得游离氨基酸含量增加。第3类由发酵10、12、15、18、21、24、28 d组成,该时间段内大多数游离氨基酸含量呈现先降低后升高的规律。

a-高级醇;b-游离氨基酸
图6 基于高级醇含量和游离氨基酸含量聚类树状图
Fig.6 Clustering tree based on content of higher alcohol and free amino acid
2.5 发酵过程中游离氨基酸与高级醇的相关性分析
为进一步明确发酵过程中高级醇与游离氨基酸之间的关系,利用Spearman相关系数计算发酵过程中高级醇与游离氨基酸之间的相关性。部分高级醇与游离氨基酸具有显著正相关性(P<0.05)。虽然游离氨基酸与高级醇之间相关性显著,但是从相关系数看(|r|<0.5),相关关系程度普遍较弱(图7)。本研究选取具有中等相关性的(|r|>0.4)高级醇与游离氨基酸进行了进一步的分析。结果显示,异戊醇与Gly和Ala,正丁醇与Asp、Thr、Ser、Glu、Gly、Val、Met、Leu、Lys和His,正戊醇与Asp、Thr、Ser、Glu、Gly、Ala、Val、Met、Ile、Leu、Lys和His,苯乙醇与Asp、Thr、Ser、Gly、Val、Met、Ile、Leu、Lys和His,丙醇与Cys均呈显著正相关(P<0.05),苯乙醇与Arg呈显著负相关(P<0.05)。

图7 高级醇与游离氨基酸相关性分析热图
Fig.7 Heatmap of correlation analysis between higher alcohols and free amino acids
注:*表示具有显著差异(*为P<0.05,**为P<0.01)
酵母代谢中特定的氨基酸可以通过氨基酸降解代谢途径形成特定的高级醇,如Thr生成正丙醇、Leu生成异戊醇、Val生成异丁醇、Ile生成活性戊醇(2-甲基丁醇)、Phe生成苯乙醇、Tyr生成酪醇、Trp生成色醇等[2-3]。张文叶等[27]研究表明在山楂酒发酵中Val、Phe和Leu通过分解代谢生成对应高级醇,且Gly可作为异戊醇的前体物质在发酵中使异戊醇含量升高。在黄酒酿造中添加Val增加了异丁醇和异戊醇的含量[9]。在果酒发酵中,氨基酸在第一阶段可被完全消耗掉[28],但在固态发酵白酒中,游离氨基酸逐步产生并且含量随发酵的进行而增加[5, 26]。本研究中游离氨基酸含量随发酵呈现积累的趋势,说明有氨基酸源源不断的产生。因此,可以进一步推断在后期发酵过程中,由氨基酸代谢途径产生高级醇的可能性较大。此外,高粱中Asp、Glu、Pro、Ala、Val、Leu和Phe含量较高[29],这些都是高级合成的直接前体,且氨基酸间的相互转化也改变氨基酸的种类和含量,这可能是使得非高级醇合成前体氨基酸与高级醇存在相关性的一个原因。由于白酒发酵涉及众多微生物参与,高级醇的代谢更为复杂多样,需要进一步利用其他策略深入研究。
3 结论与讨论
高级醇作为酒类中重要的风味物质,其形成规律一直是该领域的研究热点。由多种微生物参与的传统白酒发酵过程中高级醇合成规律更为复杂多变。本研究从高级醇合成的环境条件(氧化还原电位)和物质条件(游离氨基酸)两个角度分析传统清香型白酒发酵过程中高级醇合成规律。结果显示,高级醇含量在发酵0~3 d快速升高,并且发酵0~3 d是高级醇合成的主要阶段,但发酵3~5 d和10~12 d时高级醇含量有所下降。研究表明,高级醇在酶的作用下可转化为醛或酸[30]或与酸类物质形成酯类[31],且乳酸菌能够降低高级醇的含量[15]。因此,微生物和酶的作用可能使得高级醇含量下降。Eh在发酵0 d时最高,说明发酵0 d适合好氧微生物的繁殖代谢。并且有氧条件下有利于环境中NAD+向NADH转化,较高含量的NADH可促进高级醇的生成,并达到平衡NADH/NAD+比例的目的[13,22]。游离氨基酸含量在发酵0 d时较低(0~1.8 mg/100g),随发酵进行游离氨基酸逐渐积累。相关性结果表明异戊醇、正丁醇、正戊醇、苯乙醇和丙醇均与游离氨基酸呈现显著相关。
研究表明高级醇合成途径与游离氨基酸的含量有关,当游离氨基酸缺乏时,酿酒酵母主要通过Harris pathway形成高级醇,当游离氨基酸浓度较高,主要通过Ehrlich pathway形成高级醇[7]。而在发酵0 d Eh值较高,游离氨基酸含量较低。此外,取样的生产企业白酒生产工艺中有堆积过程,即在入缸发酵前低温大曲与原料混合后堆放一段时间,在这一过程中淀粉开始降解[32]。经测定发现,在发酵0 d时还原糖含量为4.21%,高于其他发酵时间,这为发酵初始阶段由Harris pathway途径合成高级醇提供有利条件。基于以上,推测发酵初期受氧气、游离氨基酸的低含量和还原糖的高含量的影响使得高级醇主要通过Harris pathway途径合成。但白酒发酵是一个复杂的生物转化过程,除酿酒酵母以外,其他微生物也具有产高级醇的能力,解析混合微生物发酵过程中高级醇合成规律有待进一步深入研究。
[1] HAZELWOOD L A, DARAN J M, VAN MARIS A J, et al.The Ehrlich pathway for fusel alcohol production:A century of research on Saccharomyces cerevisiae metabolism[J].Applied and Environmental Microbiology, 2008, 74(8):2 259-2 266.
[2] 曾朝珍, 张永茂, 康三江, 等.发酵酒中高级醇的研究进展[J].中国酿造, 2015, 34(5):11-15.
ZENG C Z, ZHANG Y M, KANG S J, et al.Research progress of higher alcohols in fermented wine[J].China Brewing, 2015, 34(5):11-15.
[3] 陈思妘. 酒精发酵中高级醇的形成途径及影响因素[J].食品与发酵工业, 1981, 7(1):76-81.
CHEN S Y.Formation pathway and influencing factors of higher alcohols in alcohol fermentation[J].Food and Fermentation Industries, 1981, 7(1):76-81.
[4] HOLT S, MIKS M H, DE CARVALHOL B T, et al.The molecular biology of fruity and floral aromas in beer and other alcoholic beverages[J].FEMS Microbiology Reviews, 2019, 43(3):193-222.
[5] 王宇乔, 黄和强, 王石垒, 等.氨基酸对青稞酒酿造微生物群落演替及风味代谢的驱动[J].微生物学通报, 2021, 48(2):414-425.
WANG Y Q, HUANG H Q, WANG S L, et al.Effects of amino acids on microbial community succession and flavor metabolism in highland barley Baijiu fermentation[J].Microbiology China, 2021, 48(2):414-425.
[6] 张巧玲, 吕锡斌, 秦兴, 等.酱香型白酒高温大曲游离氨基酸比较分析[J].中国酿造, 2019, 38(4):53-57.
ZHANG Q L, LYU X B, QIN X, et al.Comparative analysis of free amino acids in high temperature Daqu of Moutai-flavor Baijiu[J].China Brewing, 2019, 38(4):53-57.
[7] 孙中贯, 刘琳, 王亚平, 等.酿酒酵母高级醇代谢研究进展[J].生物工程学报, 2021, 37(2):429-447.
SUN Z G, LIU L, WANG Y P, et al.Higher alcohols metabolism by Saccharomyces cerevisiae:A mini review[J].Chinese Journal of Biotechnology, 2021, 37(2):429-447.
[8] 侯阳阳, 杨哲皓, 张梦瑶, 等.不同氨基酸对模拟葡萄汁发酵的影响[J].中国酿造, 2021, 40(10):95-101.
HOU Y Y, YANG Z H, ZHANG M Y, et al.Effects of different amino acids on simulated grape juice fermentation[J].China Brewing, 2021, 40(10):95-101.
[9] 李智慧, 金建顺, 唐雅凤, 等.不同种类可同化氮素对黄酒酵母产高级醇能力的影响[J].食品工业科技, 2018, 39(11):85-89;98.
LI Z H, JIN J S, TANG Y F, et al.Effects of different kinds of assimilation nitrogen on the high alcohol production of Chinese rice wine yeast[J].Science and Technology of Food Industry, 2018, 39(11):85-89;98.
[10] 程度,曹建兰,王珂佳,等.高粱对酱香型白酒品质影响的研究进展[J].食品科学,2022,43(7):356-364.
CHENG D, CAO J L, WANG K J,et al. Progress in understanding the effect of sorghum on the quality of Maotai-flavor Baijiu[J]. Food Science,2022,43(7):356-364.
[11] 曹苗文, 相里加雄, 曹瑞红, 等.高粱性质对酿造清香型白酒的影响[J].酿酒科技, 2020(5):53-59.
CAO M W, XIANGLI J X, CAO R H, et al.Effects of sorghum properties on the fermentation of Qingxiang Baijiu[J].Liquor-Making Science & Technology, 2020(5):53-59.
[12] 吴海静, 钟继仁, 田晓林, 等.大黄米白酒高级醇产生规律的研究[J].中国酿造, 2016, 35(11):99-102.
WU H J, ZHONG J R, TIAN X L, et al.Regularity of higher alcohols production during fermentation of glutinous millet Baijiu[J].China Brewing, 2016, 35(11):99-102.
[13] SCHADEWEG V, BOLES E.Increasing n-butanol production with Saccharomyces cerevisiae by optimizing acetyl-CoA synthesis, NADH levels and trans-2-enoyl-CoA reductase expression[J].Biotechnology for Biofuels, 2016, 9:257.
[14] 孙乐平, 张伟, 徐嘉良, 等.燕麦黄酒发酵过程中微生物群落结构变化及对高级醇的影响[J].食品科学技术学报, 2020, 38(1) 43-52.
SUN L P, ZHANG W, XU J L, et al.Changes of microbial community structure and effects on higher alcohols in oat Huangjiu fermentation process[J].Journal of Food Science and Technology, 2020, 38(1) 43-52.
[15] 曲冠颐, 唐洁, 姜健, 等.小曲清香型白酒发酵过程微生物菌群合成高级醇代谢特征[J].食品与发酵工业, 2021, 47(11):32-37.
QU G Y, TANG J, JIANG J, et al.Metabolism characteristics of higher alcohols synthesized by microbiota in the fermentation process of light aroma type Baijiu started by Xiaoqu[J].Food and Fermentation Industries, 2021, 47(11):32-37.
[16] 王鹏, 吴群, 徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报, 2018, 58(1):142-153.
WANG P, WU Q, XU Y.Core microbiota in Chinese liquor fermentation and associations with environmental factors[J].Acta Microbiologica Sinica, 2018, 58(1):142-153.
[17] 贾丽艳, 郭晋田, 刘帅, 等.清香型白酒发酵过程中微生物及理化指标的变化规律[J].中国食品学报, 2020, 20(8):6.
JIA L Y, GUO J T, LIU S, et al.The changes of microbiology and physicochemical indexes during the brewing process of mild flavour baijiu[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(8):6.
[18] OLSEN M J, PÉREZ-D AZ I M.PÉREZ-D
AZ I M.PÉREZ-D AZ.influence of microbial growth on the redox potential of fermented cucumbers[J].Journal of Food Science, 2009, 74(4):M149-M153.
AZ.influence of microbial growth on the redox potential of fermented cucumbers[J].Journal of Food Science, 2009, 74(4):M149-M153.
[19] CHANG P K, HUA S S T, SARREAL S B L, et al.Suppression of aflatoxin biosynthesis in aspergillus flavus by 2-phenylethanol is associated with stimulated growth and decreased degradation of branched-chain amino acids[J].Toxins (Basel), 2015, 7(10):3 887-3 902.
[20] BLOEM A, SANCHEZ I, DEQUIN S, et al.Metabolic impact of redox cofactor perturbations on the formation of aroma compounds in Saccharomyces cerevisiae[J].Applied and Environmental Microbiology, 2015, 82(1):174-183.
[21] DAVIS T S, CRIPPEN T L, HOFSTETTER R W, et al.Microbial volatile emissions as insect semiochemicals[J].Journal of Chemical Ecology, 2013, 39(7):840-859.
[22] ZHOU J J, SHEN J T, WANG X L, et al., Metabolism, morphology and transcriptome analysis of oscillatory behavior of Clostridium butyricum during long-term continuous fermentation for 1,3-propanediol production[J].Biotechnology for Biofuels, 2020, 13(1):191.
[23] 贾丽艳, 田宇敏, 王晓勇, 等.传统清香型白酒发酵过程中真菌群落结构及其动态演替[J].中国食品学报, 2020, 20(10):303-308.
JIA l Y,TIAN Y M,WANG X Y,et al.Community and change of fungi in fermentation process of the traditional light-aroma Baijiu[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(10):303-308.
[24] 吴钱弟, 周榆林, 王久明, 等.酱香型白酒第四、五轮次基酒中游离氨基酸分析[J].中国酿造, 2020, 39(5):54-59.
WU Q D, ZHOU Y L, WANG J M, et al.Analysis of free amino acids in the fourth and fifth rounds base liquor of sauce-flavor Baijiu[J].China Brewing, 2020, 39(5):54-59.
[25] 聂元皓, 徐岩, 吴群, 等.芳香族化合物前体物质酪氨酸和苯丙氨酸在白酒中的来源解析[J].食品与发酵工业, 2018, 44(10):1-6.
NIE Y H, XU Y, WU Q, et al.Analysis on source of tyrosine and phenylalanine as precursors of aromatic compounds in Baijiu(Chinese liquor)[J].Food and Fermentation Industries, 2018, 44(10):1-6.
[26] 龚金炎, 单之初, 潘兴祥, 等.传统手工黄酒发酵过程中常见游离氨基酸和γ-氨基丁酸的变化研究[J].中国食品学报, 2017, 17(5):232-238.
GONG J Y, SHAN Z C, PAN X X, et al.Studies on common free amino acid and γ-aminobutyric acid contents change in the fermentation process of manual chinese rice wine[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(5):232-238.
[27] 张文叶, 吴庆伟, 吴刚, 等.氨基酸种类与添加量对山楂酒中主要高级醇生成量的影响[J].轻工学报, 2017, 32(3):1-7.
ZHANG W Y, WU Q W, WU G, et al.Effects of amino acid variety and addition amount on the formation of main higher alcohols in hawthorn wine[J].Journal of Light Industry, 2017, 32(3):1-7.
[28] L PEZ-RITUERTO E, AVENOZA A, BUSTO J H, et al.Evidence of metabolic transformations of amino acids into higher alcohols through (13)C NMR studies of wine alcoholic fermentation[J].Journal of Agricultural and Food Chemistry, 2010, 58(8):4 923-4 927.
PEZ-RITUERTO E, AVENOZA A, BUSTO J H, et al.Evidence of metabolic transformations of amino acids into higher alcohols through (13)C NMR studies of wine alcoholic fermentation[J].Journal of Agricultural and Food Chemistry, 2010, 58(8):4 923-4 927.
[29] 张俊, 张三杉, 叶丹, 等.发芽对高粱氨基酸及抗营养因子含量的影响[J].食品工业科技, 2022, 43(1):87-92.
ZHANG J, ZHANG S S, YE D, et al.Effects of germination on the content of amino acids and anti-nutritional factors of sorghum grain[J].Science and Technology of Food Industry, 2022, 43(1):87-92.
[30] 鞠建松, 马宁, 赵冉冉, 等.假坚强芽胞杆菌中乙醇降解相关酶的克隆、表达及酶学特性[J].微生物学报, 2013, 53(4):363-371.
JU J S, MA N, ZHAO R R, et al.Cloning, expression and characterization of alcohol dehydrogenase and aldehyde dehydrogenase from Bacillus pseudofirmus OF4[J].Acta Microbiologica Sinica, 2013, 53(4):363-371.
[31] 宫春杰, 李安军, 刘源才, 等.白酒杂醇油酯化酶的高效表达[J].中国酿造, 2020, 39(2):158-161.
GONG C J, LI A J, LIU Y C, et al.Efficient expression of fusel oil esterase in Baijiu[J].China Brewing, 2020, 39(2):158-161.
[32] 李小东, 高大禹, 田庆贞, 等.芝麻香型白酒堆积发酵对入窖发酵过程及原酒品质的影响[J].食品与发酵工业, 2018, 44(5):63-69.
LI X D, GAO D Y, TIAN Q Z, et al.Effects of sesame-flavor liquor accumulation on cellar fermentation process and liquor quality[J].Food and Fermentation Industries, 2018, 44(5):63-69.