乳酸菌(lactic acid bacteria, LAB)指一类可利用碳水化合物发酵产生大量乳酸的细菌[1],常被用于食品发酵。我国是最早开始使用乳酸菌发酵食品的国家之一[2]。近年来,有大量研究挖掘出乳酸菌益生性菌株,这些菌株除可用于生产发酵食品外,还具有保护人类免受氧化和化学诱导的DNA损伤及恶性疾病的潜力。目前,已有许多科学家提出乳酸菌、乳酸菌细胞破碎液、发酵液上清液具有清除超氧阴离子自由基![]() 羟自由基(·OH)、H2O2等的能力。LEE 等[3]研究发现Lactobacillus casei KCTC3260对Fe2+和Cu2+的螯合力分别为10.6 mg/kg和21.8 mg/kg。ZHANG等[4]也发现乳酸菌的无细胞提取物具有良好的清除自由基能力,还原活性最高时相当于305、294 μmol/L L-半胱氨酸。流行病学研究指出,在日常生活中摄入抗氧化物质可以有效降低患病风险[5]。基于合成抗氧化物质对健康的影响,寻找安全、有效和经济的天然抗氧化物质是非常必要的。其中作为益生菌的乳酸菌能够在体内定殖并具有抗氧化活性,引发了人们的关注。
羟自由基(·OH)、H2O2等的能力。LEE 等[3]研究发现Lactobacillus casei KCTC3260对Fe2+和Cu2+的螯合力分别为10.6 mg/kg和21.8 mg/kg。ZHANG等[4]也发现乳酸菌的无细胞提取物具有良好的清除自由基能力,还原活性最高时相当于305、294 μmol/L L-半胱氨酸。流行病学研究指出,在日常生活中摄入抗氧化物质可以有效降低患病风险[5]。基于合成抗氧化物质对健康的影响,寻找安全、有效和经济的天然抗氧化物质是非常必要的。其中作为益生菌的乳酸菌能够在体内定殖并具有抗氧化活性,引发了人们的关注。
本研究从新疆伊犁、哈密、塔城地区具有代表性奶酪样品中分离出乳酸菌株并进行筛选,分别测定乳酸菌菌悬液、细胞破碎液、发酵上清液的DPPH自由基清除能力、羟自由基清除能力、超氧阴离子清除能力、还原能力及金属离子螯合能力,选出具有高抗氧化性的菌株,为进一步开发具有抗氧化特性的乳制品和发酵制品提供理论支持。
1 材料与方法
1.1 材料与试剂
乳酸菌:自新疆伊犁、哈密、塔城地区具有代表性奶酪样品中分离纯化出的161株活性乳酸菌株,均保藏于石河子大学食品学院畜产品加工与安全控制研究中心实验室。
培养基:MRS液体培养基和MRS固体培养基均购自北京奥博星生物技术有限责任公司。
试剂:三氯乙酸、过氧化氢、O-菲罗啉、硫酸亚铁、DPPH、铁氰化钾、邻苯三酚、氯化铁、二乙三胺五乙酸,北京奥博星生物技术有限责任公司;细菌DNA基因组抽提试剂盒,生工生物工程股份有限公司。
1.2 仪器与设备
22331型高速冷冻离心机,德国Eppendorf AG公司;T100TTMhermal 型PCR扩增仪,HP1020型凝胶成像系统,美国Bio-Rad公司;BYY-BC型电泳仪,北京六一生物科技有限公司;DNP-3272型电热恒温培养箱,上海精宏实验设备有限公司;SW-JV2D型双人单面洁净工作台,苏州苏洁净化设备有限公司;LDZX-30KBS型立式压力蒸汽灭菌锅,上海申安医疗器械厂。
1.3 实验方法
1.3.1 菌株活化
将实验室-80 ℃冰箱保存的菌株取出,每株菌按2%的接种量接种至MRS液体培养基中,于37 ℃培养箱中恒温培养18~24 h活化3代后备用。
1.3.2 抗氧化乳酸菌初筛
按照林祥娜等的方法[6],挑取菌株单菌落接种于含15 mmol/L H2O2的MRS液体培养基中,37 ℃培养2 h后,吸取150 μL菌液进行涂布并计算活菌数。
1.3.3 抗氧化乳酸菌复筛
1.3.3.1 样品制备
按高利娥[7]的方法分别制备菌株发酵上清液、菌悬液及细胞破碎液。
1.3.3.2 DPPH清除能力测定
取2 mL待测样品,加入2 mL DPPH无水乙醇溶液(0.2 mmol/L)混匀,室温避光反应30 min,8 000×g离心10 min,于517 nm处测定吸光度值。DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A0为等体积无水乙醇代替样品组吸光度值;A1为实验组吸光度值;A2为等体积无水乙醇代替DPPH无水乙醇溶液吸光度值。
1.3.3.3 ·OH清除能力测定
根据刘珊春[8]的方法。·OH清除率计算如公式(2)所示:
·OH清除率![]()
(2)
式中:A1为等体积蒸馏水代替H2O2的吸光度值;A2为等体积样品代替蒸馏水的吸光度值。
1.3.3.4 ![]() 清除能力
清除能力
将1 mL Tris-HCI(150 mmol/L,pH=8.2)、1 mL二乙三胺五乙酸(3 mmol/L)、1 mL邻苯三酚(1.2 mmol/L)充分混匀,加入0.5 mL待测样品,25 ℃水浴10 min,在325 nm处测吸光值。![]() 清除率计算如公式(3)所示:
清除率计算如公式(3)所示:
![]() 清除率
清除率![]()
(3)
式中:A0为不含样品和邻苯三酚的吸光度值;A1为不含样品、含邻苯三酚的吸光度值;A2为含样品、不含邻苯三酚的吸光度值;A3为含样品和邻苯三酚的吸光度值。
1.3.3.5 还原力的测定
参考刘珊春[8]的方法进行测定。
1.3.3.6 亚铁离子螯合能力测定
参考蒋琰洁[9]的方法进行测定。
1.3.3.7 菌株的人工胃肠液及胆盐耐受性
根据云月英等[10]的方法,测定菌株对人工胃肠液耐受性。
根据张悦等[11]的方法,测定菌株对胆盐耐受性并作改动,将2%的菌液分别接种至含有质量分数为0.1%、0.2%、0.3%及0.5%牛胆盐的MRS液体培养基中,以未接种的培养基为对照,37 ℃培养24 h后计算活菌数。
1.3.3.8 乳酸菌DNA提取、PCR扩增及16S rDNA测序
用生工生物工程(上海)股份有限公司细菌DNA基因组抽提试剂盒,提取DNA。
依照李晓楠等[12]的反应条件,进行PCR扩增。PCR扩增产物送至生工生物工程(上海)股份有限公司测序,测序结果提交 NCBI 进行 BLAST 比对分析。
1.3.4 抗氧化乳酸菌培养条件优化
1.3.4.1 菌株最适培养时间的确定
将MRS液体培养基调节初始pH值为7.0,接种量2%,培养温度37 ℃,根据预实验测定的菌株生长曲线结果将培养时间调整为18、20、24、28、30 h,测定乳酸菌活菌数。
1.3.4.2 菌株培养初始pH的确定
用1 mol/L HCl调整培养基,pH值分别调至5.5、6.0、6.5、7.0、7.5,接种量2%,培养温度37 ℃,培养时间18 h(对数期),计算活菌数。
1.3.4.3 菌株最适培养温度的确定
将培养基pH调节为7.0,接种量2%,置于不同培养温度27、32、37、42 ℃培养18 h,测定活菌数。
1.3.4.4 菌株最适接种量的确定
将培养基pH调节为7.0,以1%、2%、3%、4%、5%的接种量接种,培养温度37 ℃,培养时间18 h,计算活菌数。
1.4 数据分析
实验均重复3次,所得结果以平均值±标准差的形式表示,使用SPSS 26.0软件数据进行显著性差异分析,图表的绘制用Origin 9.0软件作图。
2 结果与分析
2.1 抗氧化乳酸菌的初筛
初筛结果如表1所示(菌落数<10的未列出),161株乳酸菌中大部分菌株对H2O2耐受力较差,其中41株菌表现出活性,26株菌活性良好,说明菌株对H2O2有耐受能力,氧化应激状态中可存活,具备进一步试验的条件。
表1 菌株对H2O2耐受结果
Table 1 Results of hydrogen peroxide tolerance in strains

注:“+”代表菌落数为1~100;“++”代表菌落数为101~200;“+++”代表菌落数为200以上
菌株编号菌落数菌株编号菌落数B1-5++S2-6+B2-1+++S2-7+++B2-3+++S3-2+B2-4++S3-5+B3-1+++S4-10+++B3-3+++S4-11+++B3-4+S4-12+++B5-3++S4-14+++B5-8+++S4-16+++B6-4+++S4-4+++B7-4+S4-7+++B7-5++S4-9+++E3-2+S5-10++F2-16++S5-7+++F2-6+++S5-8++F2-7+++T1-2+++F5-1+T1-4+++H2-1+++T1-7+++H2-6+++T2-8+++S2-3+T2-10+++S2-5+++
2.2 抗氧化乳酸菌的复筛
2.2.1 乳酸菌的·OH清除能力
如图1所示,41株乳酸菌的菌悬液、发酵上清液、细胞破碎液都对羟自由基有清除能力。发酵上清液组中S2-7的清除率最高(P<0.05),为95.28%,T1-4、T1-2次之且无显著差异;细胞破碎液组S4-14的清除能力最强(P<0.05),为57.98%,菌株B7-4、F2-6几乎无清除能力;菌悬液组S5-7、B2-1的清除能力最大(81.56%、81.07%)。菌株发酵上清液的清除能力较好,与张开屏等[13]对乳酸菌清除羟自由基研究结果相似,说明乳酸菌清除羟自由基的物质可能来自胞内,当菌体存活时通过代谢作用释放,进而起到清除羟自由基的效果;而菌株之间的清除能力各不相同,可能因为不同菌株生成清除自由基的活性物质的种类或含量不同。

图1 菌株对·OH的清除率
Fig.1 Hydroxyl radical scavenging rate of strains
2.2.2 乳酸菌的![]() 清除能力
清除能力
如图2所示,41株菌发酵上清液组的超氧阴离子清除能力整体较好。B5-8、B3-2、S2-7的发酵上清液清除能力最强且差异不大,为90%~91%,;细胞破碎液组B1-5、S4-10的清除能力较好(P<0.05),为19.79%、19.68%。研究发现[14],发酵上清液组的清除率远高于其余两组,说明乳酸菌通过向胞外分泌了氧化酶等活性物质来清除![]() 本实验中菌株B5-8、B3-2、S2-7三株的发酵上清液清除率在90%以上,而细胞破碎液组及菌悬液组的清除率较低,表明菌株对
本实验中菌株B5-8、B3-2、S2-7三株的发酵上清液清除率在90%以上,而细胞破碎液组及菌悬液组的清除率较低,表明菌株对![]() 的清除主要靠胞外分泌物。
的清除主要靠胞外分泌物。
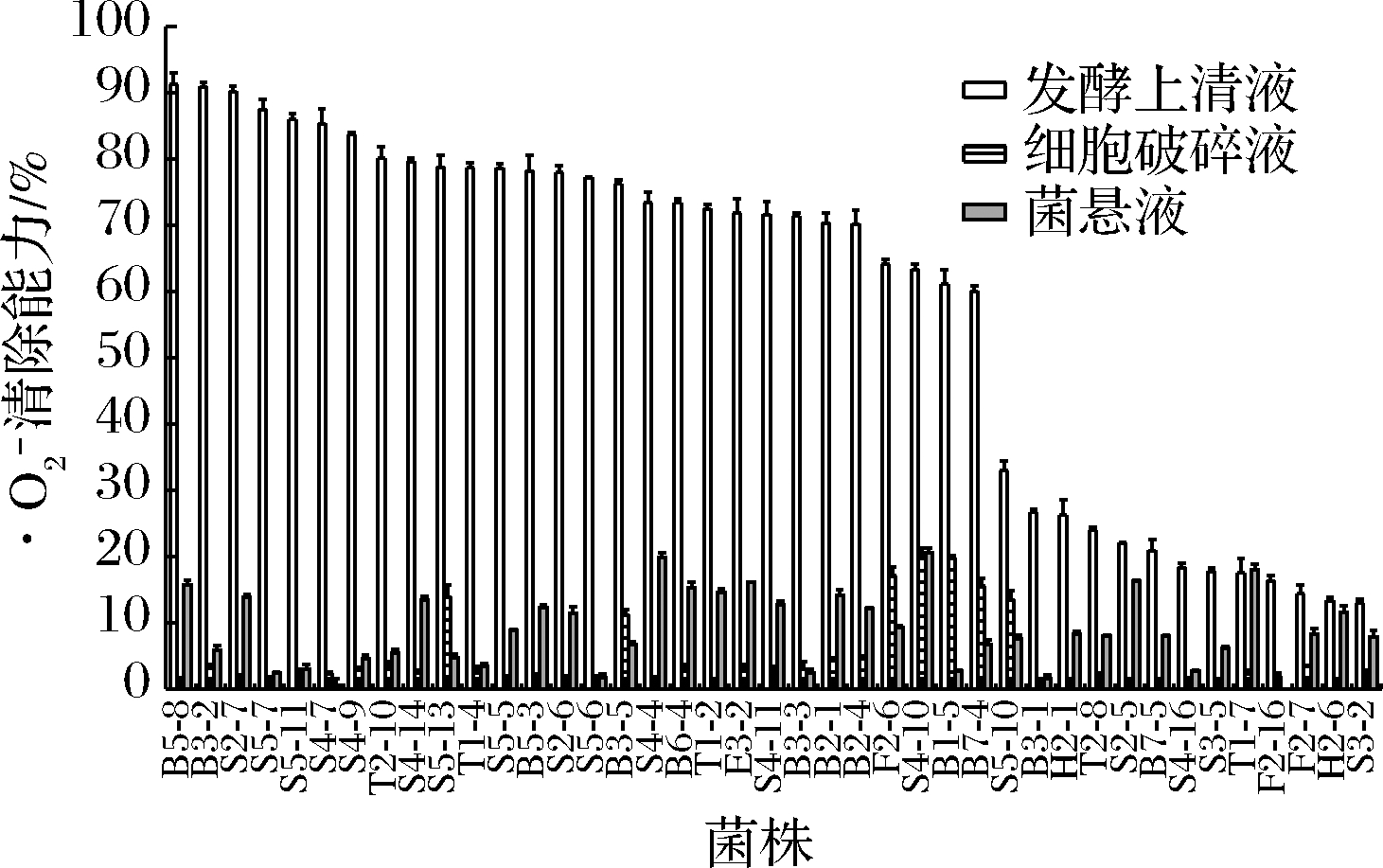
图2 菌株对![]() 清除率
清除率
Fig.2 Superoxide anion scavenging rate of strains
2.2.3 乳酸菌的还原能力
41株菌的还原能力差异较大,如图3所示,S5-11发酵上清液展现出较好的还原能力,为95.48%,T1-4、B3-2次之;S4-14细胞破碎液的还原能力最高(67.62%,P<0.05);菌悬液组B6-4的还原能力最高(92.75%,P<0.05)。发酵上清液组及菌悬液组高于细胞破碎液组,由此推测乳酸菌的还原能力与菌株表面活性物质和胞外释放物有关,细胞破碎液中的还原活性可能来自于菌体内部的酶等。

图3 菌株的还原能力
Fig.3 Reducing ability of the strains
2.2.4 乳酸菌的亚铁离子螯合能力
如图4所示,B7-5发酵上清液的螯合能力最大(P<0.05),为87.18%,S4-9、B3-2稍弱;B3-2细胞破碎液最高(58.54%,P<0.05);菌悬液组S5-7、B3-3、S4-14的螯合能力最强且无明显差异,为94.33%~95.85%。发酵上清液组与菌悬液组的螯合能力相差不大,细胞破碎液的螯合能力较弱,与黄煜等[15]类似,可以看出乳酸菌的活性影响着金属离子的螯合能力。
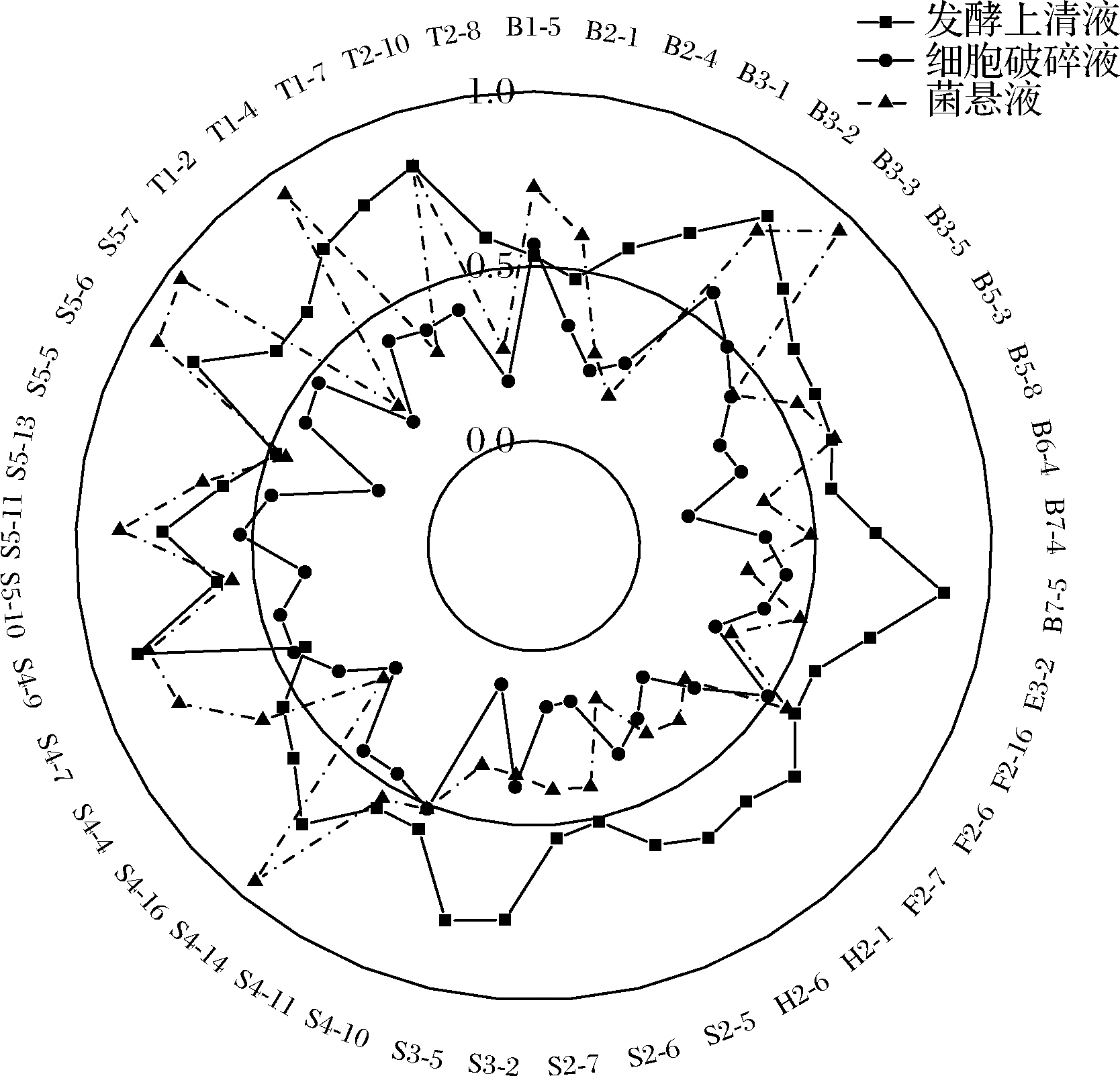
图4 菌株对亚铁离子的螯合能力
Fig.4 Ferrous ion chelating ability of strains
2.2.5 乳酸菌的DPPH自由基清除能力
根据以上实验结果,去除发酵上清液、细胞破碎液、菌悬液三部分的抗氧化活性低于整组平均水平的菌株,以下实验选取综合抗氧化活性较高的前15株进行,分别是菌株B2-1、B3-2、B3-3、B5-8、E3-2、S2-7、S4-14、S4-4、S4-7、S4-9、S5-11、S5-6、S5-7、T1-4、T2-10。
DPPH自由基清除率与抗氧化能力呈正相关。如图5所示,发酵上清液组清除能力最强的是菌株S2-7,为88.22%;菌悬液组最强是T1-4(74.95%);细胞破碎液组清除能力最强的是菌株B3-2,为74.28%。在此实验中,菌株发酵上清液组清除能力82%~88%,菌悬液组清除率为31%~60%,具有显著差异,细胞破碎液清除率为7%~74%,差异显著,这可能说明不同菌株之间抗氧化活性的胞内分泌物迥异,影响其抗氧化能力。大多数菌株的发酵上清液显示出更高的清除能力[16],可能是乳酸菌产生的胞外多糖释放到周围环境中,提供的电子与DPPH自由基中和,达到猝灭的效果。

图5 菌株对DPPH自由基的清除率
Fig.5 DPPH radical scavenging rate of strains
注:不同小写字母表示显著(P<0.05)(下同)
2.2.6 菌株的人工胃肠液耐受性
如图6所示,菌株在模拟胃液中培养3 h后,8株菌的存活率在80%以上,其中B2-1、S4-9、T2-10的存活率最高,为96.26%~97.35%(P<0.05),菌株T1-4的存活率最低,为23.08%。经人工肠液处理后的菌株有8株存活率在80%以上,其中B2-1(98.79%,P<0.05)存活率最高,最低为菌株T1-4(37.89%),高于夏海燕等[17]从酢辣椒中分离出的6株乳酸菌在人工肠液中的存活率。通过模拟胃肠液实验可知,12株菌株对胃肠液都有耐受性,4株菌的适应能力较差,难以在胃肠液中长时间生存,分别是菌株B3-3、S4-14、S5-11、T1-4。
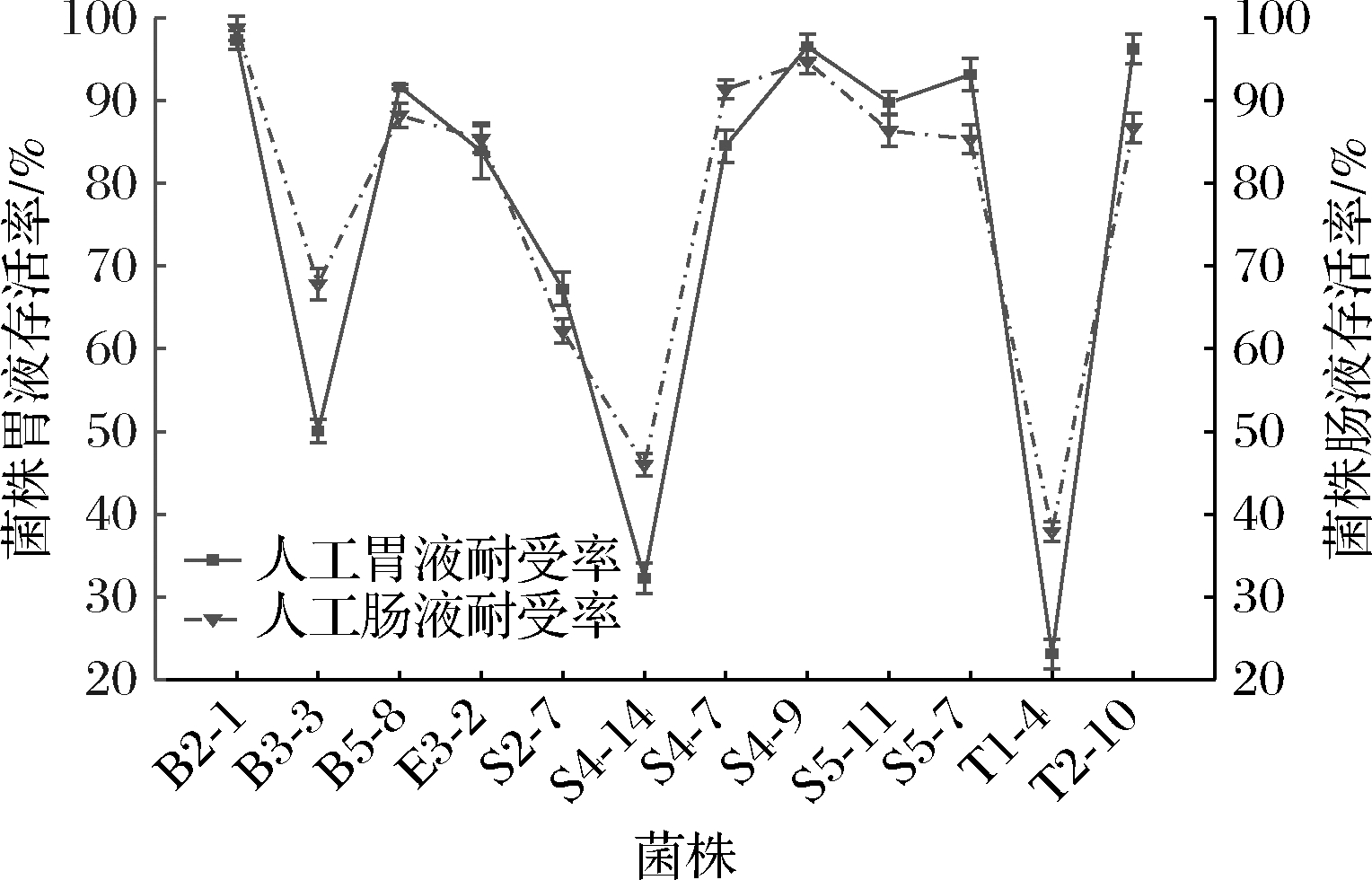
图6 乳酸菌人工胃肠液耐受率
Fig.6 Lactic acid bacteria artificial gastrointestinal fluid tolerance rate
2.2.7 菌株的胆盐耐受性
乳酸菌的存活率与胆盐浓度成反比,由图7可知,胆盐质量分数为0.1%时,对菌株的生长无明显影响,均表现出良好耐受性;胆盐质量分数为0.2%时,有7株存活率在90%以上;胆盐质量分数为0.3%时,有4株菌的存活率仍在90%以上,其中S4-9的存活率最高,为96.89%(P<0.05);当胆盐质量分数为0.5%时,有4株菌的存活率在80%以上,分别是菌株S2-7、S4-7、S5-11、T1-4。王祎然等[18]分离出的6株乳酸菌在0.3%的胆盐质量分数下处理3 h后的存活率在87.37%~92.65%。本实验的12株菌对胆盐耐受性均较好,在低浓度胆盐胁迫中保持较高的存活率,高质量分数(0.5%)胁迫中逐渐下降。结合上述实验,挑选以下8株菌进行后续实验:B2-1、B5-8、E3-2、S4-7、S4-9、S5-7、S5-11、T2-10。
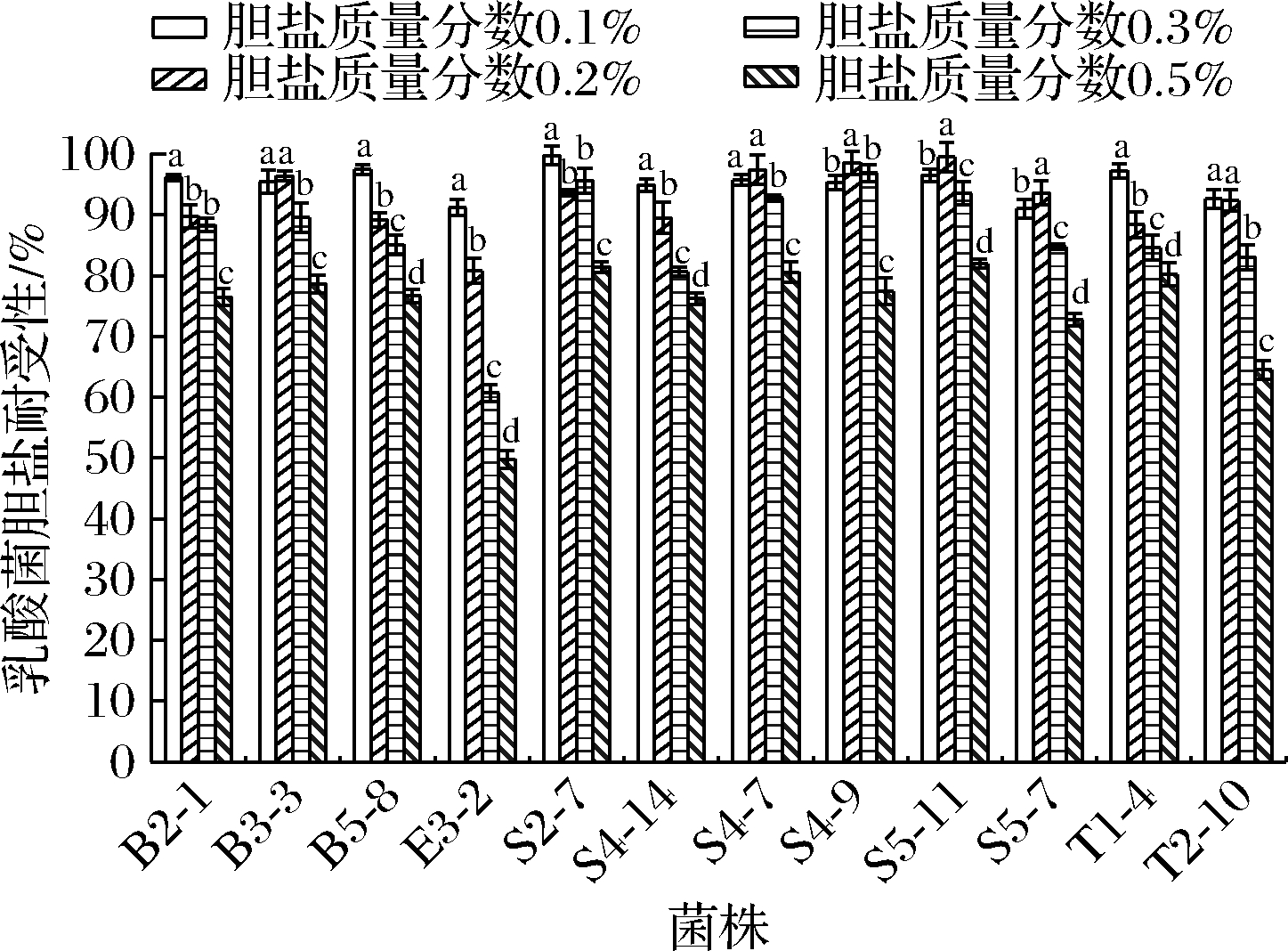
图7 乳酸菌的胆盐耐受性
Fig.7 Bile salt tolerance of lactic acid bacteria
2.2.8 PCR扩增及16S rDNA测序
将筛选出的8株菌经16S rDNA测序,通过NCBI数据库比对,结果如图8所示,菌株S5-7、E3-2、B5-8、S4-7、S4-9、B2-1、T2-10为乳酸片球菌;S5-11为干酪乳杆菌。

图8 乳酸菌16S rDNA基因序列系统发育树
Fig.8 The phylogenetic tree of lactic acid bacteria based on 16S rDNA gene sequences
2.3 抗氧化乳酸菌培养条件优化
2.3.1 菌株培养初始pH的确定
由表2可知,不同初始pH下菌株的生长活性不同。在pH=7.0时,B2-1、S4-7、S4-9、S5-11长势较好,菌株E3-2、B5-8在pH=5.5~7.5活性变化不大,说明它们具有良好的耐酸能力,菌株S5-7和T2-10在pH=6.5时长势好(P<0.05)。每菌株的适宜初始pH值有差异,在一定pH范围内能快速繁殖,这8株菌在pH为7.0左右时有大量生长。
表2 不同初始pH活菌数
单位:109 CFU/mL
Table 2 Number of live bacteria at different initial pH
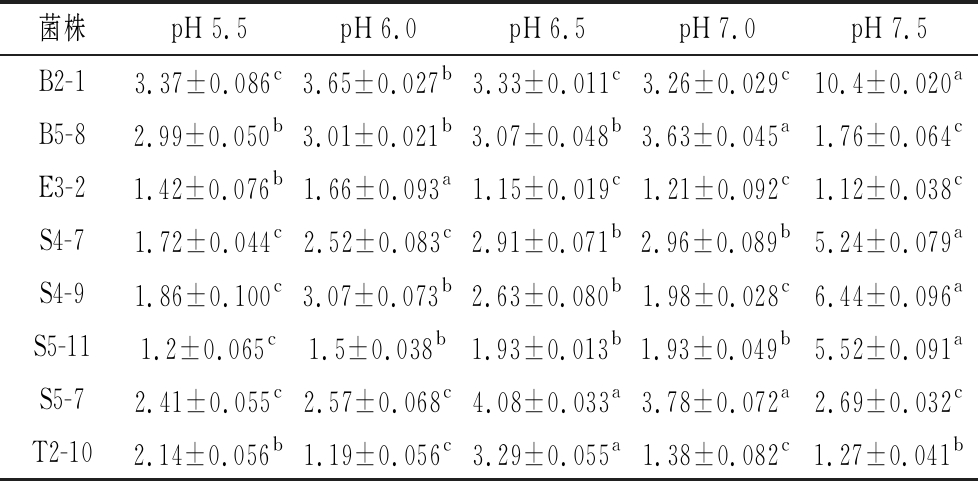
注:不同字母表示同一菌株差异显著(P<0.05)
菌株pH 5.5pH 6.0pH 6.5pH 7.0pH 7.5B2-13.37±0.086c3.65±0.027b3.33±0.011c3.26±0.029c10.4±0.020aB5-82.99±0.050b3.01±0.021b3.07±0.048b3.63±0.045a1.76±0.064cE3-21.42±0.076b1.66±0.093a1.15±0.019c1.21±0.092c1.12±0.038cS4-71.72±0.044c2.52±0.083c2.91±0.071b2.96±0.089b5.24±0.079aS4-91.86±0.100c3.07±0.073b2.63±0.080b1.98±0.028c6.44±0.096aS5-111.2±0.065c1.5±0.038b1.93±0.013b1.93±0.049b5.52±0.091aS5-72.41±0.055c2.57±0.068c4.08±0.033a3.78±0.072a2.69±0.032cT2-102.14±0.056b1.19±0.056c3.29±0.055a1.38±0.082c1.27±0.041b
2.3.2 菌株的最适培养温度
温度对微生物的生长繁殖具有显著影响[19],如图9-a所示,在一定范围内,温度与菌株活菌数呈正相关,在27 ℃时菌株显示较低活性,当温度为37 ℃和42 ℃的生长情况较好(P<0.05)。温度不仅影响微生物的生长发育繁殖,对其代谢产物的品质与产量也有影响[20],适宜的温度培养对菌株生长和功效的发挥具有重大意义。
2.3.3 菌株的最适培养时间
由图9-b可知,8株菌分别在培养18、28、28、24、18、20、24、18 h时达到其最大活菌数(P<0.05),多数菌株在18~24 h时差异不显著,可能是因为在此时菌株处于对数生长末期或稳定前期,而此时的菌株在活力、耐受不良环境能力、代谢能力等的巅峰时期[21],为最佳培养时间。
2.3.4 菌株的最适接种量
如图9-c所示,所有菌株的活菌数都在接种量为2%~3%达到峰值(P<0.05),当接种量为4%~5%时,活菌数逐渐下降,可能是因为接种量越大,越难达到菌株生长的稳定期[22],不利于生长,即在接种量为2%~3%时可以达到最大利用率。

a-培养温度;b-培养时间;c-接种量
图9 菌株培养条件优化
Fig.9 Optimization of culture conditions of strains
综上所述,培养条件优选结果如表3所示。
表3 培养条件优选结果
Table 3 Results of culture conditions preferences
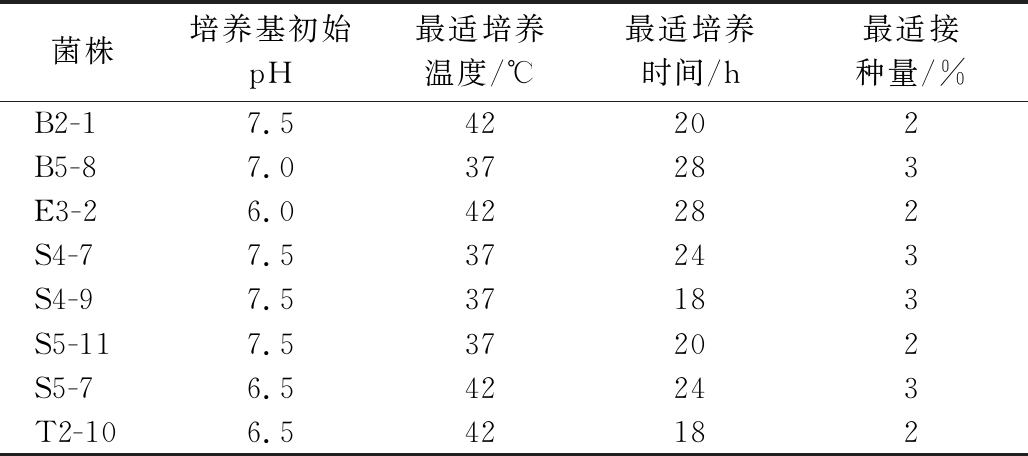
菌株培养基初始pH最适培养温度/℃最适培养时间/h最适接种量/%B2-17.542202B5-87.037283E3-26.042282S4-77.537243S4-97.537183S5-117.537202S5-76.542243T2-106.542182
3 结论
从161株乳酸菌中筛选出了41株能耐受H2O2溶液的菌株,对其进行了多种自由基清除能力的实验,发现菌株与菌株之间抗氧化性有所区别,菌株各个部分的抗氧化性也不相同,表明乳酸菌对于不同自由基的清除部位不同。综合来看菌株各部分抗氧化性由强到弱依次为发酵上清液,菌悬液,细胞破碎液。再通过测试人工胃肠液与胆盐耐受性,最终筛选出8株乳酸菌,16S rDNA鉴定分别是乳酸片球菌7株:S5-7、E3-2、B5-8、S4-7、S4-9、B2-1、T2-10;干酪乳杆菌1株:S5-11。对其培养条件优化,得到最佳条件培养基初始pH为6.5~7.5、培养时间在18 ~28 h、培养温度为37 ℃~42 ℃、接种量为2%~3%。这8株抗氧化乳酸菌可为今后开发具有抗氧化特性的食品奠定基础。
[1] GIRAFFA G, CHANISHVILI N, WIDYASTUTI Y.Importance of Lactobacilli in food and feed biotechnology[J].Research In Microbiology, 2010, 161(6):480-487.
[2] 王刚, 田丰伟, 刘小鸣,等.2 株具有优良体外抗氧化能力乳酸菌的筛选与鉴定[J].食品工业科技, 2013, 34(5):149-153;157.
WANG G, TIAN F W, LIU X M, et al. Screening and identification of two lactic acid bacteria strains with excellent antioxidant activities in vitro[J]. Science and Technology of Food Industry, 2013, 34(15):149-153; 157.
[3] LEE J, HWANG K T, CHUNG M Y, et al.Resistance of Lactobacillus casei KCTC 3260 to reactive oxygen species (ROS):Role for a metal ion chelating effect[J].Journal of Food Science, 2005, 70(8):388-391.
[4] ZHANG Y, DU R T, WANG L F, et al.The antioxidative effects of probiotic Lactobacillus casei Zhang on the hyperlipidemic rats[J].European Food Research and Technology, 2010, 231(1):151-158.
[5] RAMIRO-CORTIJO D, HERRERA T, RODR GUEZ-RODR
GUEZ-RODR GUEZ P, et al.Maternal plasma antioxidant status in the first trimester of pregnancy and development of obstetric complications[J].Placenta, 2016, 47:37-45.
GUEZ P, et al.Maternal plasma antioxidant status in the first trimester of pregnancy and development of obstetric complications[J].Placenta, 2016, 47:37-45.
[6] 林祥娜, 夏永军, 王光强, 等.抗氧化活性乳酸菌的筛选[J].中国食品学报, 2017, 17(6):103-109.
LIN X N, XIA Y J, WANG G Q, et al. Screening of high antioxidative probiotics[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(6):103-109.
[7] 高利娥. 青藏高原传统发酵牦牛乳中乳酸菌的多样性及抗氧化特性研究[D].兰州:兰州大学, 2020.
GAO L E. Biodiversity and antioxidant properties of lactic acid bacteria from spontaneously fermented yak milk in the Qinghai-Tibet Plateau[D]. Lanzhou: Lanzhou University, 2020.
[8] 刘珊春. 传统发酵酸乳中抗氧化乳酸菌的筛选与功能评价[D].重庆:西南大学, 2017.
LIU S C.Screening and functional evaluating of anti-oxidant lactic acid bacteria in traditional fermented milk[D].Chongqing:Southwest University, 2017.
[9] 蒋琰洁. 新疆传统乳制品中抗氧化乳酸菌的筛选及其特性的初步研究[D].石河子:石河子大学, 2015.
JIANG Y J. Screening and study of lactic acid bacteria in Xinjiang traditional dairy products with antioxidative activityl[D]. Shihezi: Shihezi University, 2015.
[10] 云月英, 徐娟, 张小利.4株乳酸菌对模拟胃肠环境的耐受性及生长特性研究[J].中国酿造, 2018, 37(3):53-56.
YUN Y Y, XU J, ZHANG X L. Tolerance to simulated gastrointestinal environment and growth characteristics of four strains of lactic acid bacteria[J]. China Brewing, 2018, 37(3):53-56.
[11] 张悦, 贺银凤, 顾悦, 等.高产生物膜乳酸菌抗逆性及其抗氧化特性[J].农业工程学报, 2021, 37(6):282-288.
ZHANG Y, HE Y F, GU Y, et al. Stress resistance and antioxidant properties of lactic acid bacteria with high biofilm production[J]. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(6):282-288.
[12] 李晓楠, 李宇辉, 卢士玲, 等.新疆传统奶酪中产脂肪酶乳酸菌的优选及酶学特性研究[J].食品与发酵工业, 2021, 47(10):50-57.
LI X N, LI Y H, LU S L, et al. Optimization of lipase-producing lactic acid bacteria in Xinjiang traditional cheese and their enzymatic characteristics[J]. Food and Fermentation Industries, 2021, 47(10):50-57.
[13] 张开屏, 赵艳红, 李权威, 等.乳酸菌抗氧化特性及其katA基因分析[J].中国食品学报, 2021, 21(7):37-43.
ZHANG K P, ZHAO Y H, LI Q W, et al. Antioxidant properties of Lactobacillus and its katA gene analysis[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(7):37-43.
[14] 陈漪汶, 方若楠, 朱剑锋,等.5种乳酸菌及其灭活态体外抗氧化能力的比较研究[J].食品工业科技, 2019, 40(11):85-90;97.
CHEN Y W, FANG R N, ZHU J F, et al. Comparative studies on antioxidant activity in vitro of five species of active and inactived lactic acid bacterial[J]. Science and Technology of Food Industry, 2019, 40(11):85-90; 97.
[15] 黄煜, 蒋家璇, 张凯迪, 等.皖北地区腌制菜中具高抗氧化能力乳酸菌的筛选[J].农产品加工, 2020(03):19-21;28.
HUANG Y, JIANG J X, ZHANG K D, et al. Screening of high antioxidant lactic acid bacteria from preserved vegetables in northern Anhui Province[J]. Farm Products Processing, 2020(3):19-21; 28.
[16] 李丹丹, 蒋婷婷, 张炎, 等.高海拔地区传统牦牛酥油中抗氧化乳酸菌的筛选[J].食品与机械, 2020, 36(6):50-55.
LI D D, JIANG T T, ZHANG Y, et al. Screening of Lactobacillus with antioxidant properties from traditional yak ghee in high altitude area of Tibet[J]. Food & Machinery, 2020, 36(6):50-55.
[17] 夏海燕, 周思多, 张明喆, 等.酢辣椒中益生乳酸菌的筛选及其功能特性[J].食品科学, 2019, 40(6):93-99.
XIA H Y, ZHOU S D, ZHANG M Z, et al. Screening and functional characteristics of probiotics from zuolajiao, a traditional fermented hot pepper product[J]. Food Science, 2019, 40(6):93-99.
[18] 王祎然, 韦明明, 张涵, 等.酸汤中乳酸菌的鉴定及其耐酸、耐胆盐和抗氧化活性[J].食品工业科技, 2020, 41(16):121-126;139.
WANG Y R, WEI M M, ZHANG H, et al. Identification, acid and bile salt tolerance, and antioxidant ability of lactic acid bacteria isolated from sour soup[J]. Science and Technology of Food Industry, 2020, 41(16):121-126;139.
[19] 熊素玉, 姚新奎, 谭小海, 等.不同温度及pH条件对乳酸菌生长影响的研究[J].新疆农业科学, 2006, 43(6):533-538.
XIONG S Y, YAO X K, TAN X H, et al. Effects of different temperatures and pH on the growth of lactic acid bacteria[J]. Xinjiang Agrcultural Sciences, 2006, 43(6):533-538.
[20] 杨同香, 王芳, 李全阳.温度对酸乳中乳酸菌胞外多糖作用机制的研究[J].食品工业科技, 2012, 33(9):58-61.
YANG T X, WANG F, LI Q Y. Effect mechanism of fermentation temperature on the characteristicsof bacteria exopolysaccharides in yogurt[J]. Science and Technology of Food Industry, 2012, 33(9):58-61.
[21] 岳林芳, 王俊国, 萨如拉, 等.培养条件对乳酸菌发酵剂抗冷冻干燥性能影响的研究进展[J].食品科学, 2016, 37(11):270-276.
YUE L F, WANG J G, SA R L, et al. Effects of culture conditions on the survival of freeze-dried lactic acid bacterial starter cultures[J]. Food Science, 2016, 37(11):270-276.
[22] 张秋月, 黎谢飞, 曾小群, 等.产超氧化物歧化酶乳酸菌的筛选及发酵条件优化[J].中国食品学报, 2021, 21(10):143-150.
ZHANG Q Y, LI X F, ZENG X Q, et al. Screening of producing superoxide dismutase lactic acid bacteria and the optimization of fermentation conditions[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(10):143-150.