紫外线是导致皮肤老化的重要外源性因素,其中对人体皮肤造成损害的主要是UVA(320~400 nm)和UVB(290~320 nm)波段[1]。UVA和UVB诱导机体过度产生活性氧(reactive oxygen species,ROS)是导致皮肤损伤的重要原因,ROS积累使得内源性抗氧化系统受损,机体趋于氧化应激状态,进一步刺激基质金属蛋白酶(matrix metalloproteinase,MMPs)上调, MMPs能降解大部分的细胞外基质,如胶原蛋白、弹性蛋白[2]。另一方面,ROS在促炎信号级联反应中充当第二信使,在机体处于氧化应激状态时,可刺激产生促炎细胞因子,加剧炎症反应[3-4]。机体最终表现出泛红、干燥、缺乏弹性、皱纹加深等一系列皮肤损伤,严重影响人们的外表自信。随着审美水平的不断提高,预防和延缓紫外线导致的皮肤老化显得十分必要。
氧化应激能引发皮肤基质的降解和炎症因子的激增,最终导致皮肤老化。核因子红细胞系-2相关因子2/抗氧化反应元件(nuclear factor erythroid-2 related factor 2/ antioxidant response element,Nrf2/ARE) 信号通路是调节氧化还原平衡的重要途径,可控制下游多种抗氧化酶的表达,从而清除ROS,中和过氧化产物,维持氧化还原稳态,在保护皮肤免受紫外线诱导的氧化损伤方面发挥着重要的作用,因而以Nrf2/ARE信号通路为作用靶点的天然抗氧化剂是抗皮肤光老化的潜在原料[5-6]。
多酚、维生素、类胡萝卜素等活性物质具有较好的抗氧化效果,是抗皮肤光老化的常用原料。在护肤产品的开发中,由于受法规的限制,往往不能直接添加活性物质的纯品或允许添加量远低于功效剂量,故常采用富含活性物质的提取物。石榴提取物富含多酚、单宁等,主要为安石榴甙、鞣花酸,研究显示其具有较强的超氧阴离子、羟自由基的清除能力[7]。关于改善皮肤的相关文献表明,特征性物质安石榴甙和鞣花酸体内摄入量约集中在20~250 mg/kg bw[8-9]。雨生红球藻是生产虾青素的最佳原料之一。CHALYK等[10]研究发现虾青素可减少体内脂质过氧化产物的积累,从而延缓衰老。对于雨生红球藻所富集的虾青素,由于其较强的抗氧化性能,文献报道使用剂量多低于4 mg/kg bw[10-11],远少于其他抗氧化剂使用量,并且雨生红球藻摄入量受限于《关于批准雨生红球藻等新资源食品的公告(卫生部第17号公告)》,允许的摄入量为少于0.8 g/d。针叶樱桃可提供多种维生素,如维生素B、C、P以及矿物质元素,其中维生素C含量较高,是公认的“天然维生素C之王”,具有抗氧化和抗炎等生理活性。G![]() GOTEK等[12]以皮肤角质形成细胞和成纤维细胞为研究对象,结果显示维生素C可抑制紫外照射导致的抗氧化酶活力下降。LAUER等[13]研究表明摄入维生素C可加快机体自由基清除速率。在前期研究中,针叶樱桃提取物富含的维生素C在体内的研究剂量约为20~400 mg/kg bw[13-14]。维生素E是脂溶性的抗氧化剂,常与其它抗氧化剂如维生素C进行复配,达到协同增加皮肤抗氧化的作用[15]。在体内研究中,维生素E的剂量多集中为70~125 mg/kg bw[16-17],但摄入量受限于GB 2760—2014《食品安全国家标准 食品添加剂使用标准》,允许的最大使用量为0.2 g/kg,以复配的形式可减少维生素E使用量[18]。在护肤产品的研发选择上,生化、细胞等体外实验难以真实地反映体内抗氧化效果;此外,抗氧化剂的抗氧化效果受作用对象、施用方式等诸多因素的影响,体内不同研究之间的对比不能准确地反映不同抗氧化剂抗皮肤氧化效果及其机制的差异。
GOTEK等[12]以皮肤角质形成细胞和成纤维细胞为研究对象,结果显示维生素C可抑制紫外照射导致的抗氧化酶活力下降。LAUER等[13]研究表明摄入维生素C可加快机体自由基清除速率。在前期研究中,针叶樱桃提取物富含的维生素C在体内的研究剂量约为20~400 mg/kg bw[13-14]。维生素E是脂溶性的抗氧化剂,常与其它抗氧化剂如维生素C进行复配,达到协同增加皮肤抗氧化的作用[15]。在体内研究中,维生素E的剂量多集中为70~125 mg/kg bw[16-17],但摄入量受限于GB 2760—2014《食品安全国家标准 食品添加剂使用标准》,允许的最大使用量为0.2 g/kg,以复配的形式可减少维生素E使用量[18]。在护肤产品的研发选择上,生化、细胞等体外实验难以真实地反映体内抗氧化效果;此外,抗氧化剂的抗氧化效果受作用对象、施用方式等诸多因素的影响,体内不同研究之间的对比不能准确地反映不同抗氧化剂抗皮肤氧化效果及其机制的差异。
因此,本研究以石榴提取物、雨生红球藻提取物、针叶樱桃提取物、维生素E这4种常用的天然抗氧化剂为原料,以UVA+UVB紫外线造模的裸鼠为研究对象,比较不同抗氧化剂灌胃处理对皮肤抗氧化效果的影响,以期为具有皮肤改善效果产品的开发提供依据。
1 材料与方法
1.1 材料与试剂
红石榴浓缩粉(安石榴甙:33.2%,鞣花酸:1.1%),西班牙Euromed公司;雨生红球藻虾青素微囊粉(虾青素:2.4%),大连医诺生物股份有限公司;针叶樱桃浓缩粉(维生素C:18%),浙江天草生物制品有限公司;天然维生素E粉(混合生育酚浓缩物:30.96%),陕西海斯夫生物工程有限公司;BALB/c Nude裸鼠(SPF级、7周龄、雄性),维通利华实验动物有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)试剂盒,南京建成生物研究所;ROS试剂盒,上海贝博生物科技有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、蛋白质羰基(protein carbonyl,PC)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、基质金属蛋白酶-1、9、12(matrix metalloproteinase-1、9、12,MMP-1、9、12)Elisa试剂盒,上海酶联生物科技有限公司;总蛋白试剂盒,美国Thermo Scientific公司;组织总RNA提取、反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)、SYBR qPCR Master Mix试剂盒,南京诺唯赞生物科技有限公司;其他实验试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器与设备
UVA紫外灯管(波长320~400 nm,峰值波长340 nm)、UVB紫外灯管(波长290~320 nm,峰值波长313 nm),荷兰皇家飞利浦公司;UV-313/UV-340双通道紫外辐照计,北京师大光电技术有限公司;皮肤弹性测试仪,德国Courage+Khazaka Electronic GmbH(CK)公司产品;CR-700 d色彩色差计,柯尼卡美能达(中国)投资有限公司;Nanodrop One/OneC型分光光度计、Multiskan Sky型酶标仪,美国Thermo Scientific公司;ETC811型PCR扩增仪,北京东胜生物科技有限公司产品;LightCycler96实时荧光定量PCR仪,瑞士Roche公司。
1.3 实验方法
1.3.1 动物实验分组及处理
1.3.1.1 动物分组
适应性喂养1~2周后, 60只BALB/c Nude裸鼠随机分为6组(n=10):(1)空白组,灌胃等体积生理盐水;(2)模型组,灌胃等体积生理盐水;(3)石榴组,灌胃292 mg/kg bw红石榴浓缩粉(即安石榴甙和鞣花酸为100 mg/kg bw);(4)雨生红球藻组,灌胃103 mg/kg bw雨生红球藻虾青素微囊粉(即虾青素为2.5 mg/kg bw);(5)针叶樱桃组,灌胃556 mg/kg bw针叶樱桃浓缩粉(即维生素C为100 mg/kg bw);(6)针叶樱桃+维生素E组,灌胃556 mg/kg bw针叶樱桃浓缩粉和2.66 mg/kg bw天然维生素E粉(即维生素C为100 mg/kg bw,混合生育酚为0.82 mg/kg bw)。灌胃体积为10 mL/kg,灌胃样品用生理盐水现配现用。除正常组,其余均进行UV暴露处理,在饲养期间记录小鼠体重变化与健康状态。
1.3.1.2 光老化模型建立
根据文献与预实验确定[19]:两支 UVA灯管和一支UVB灯管营造紫外线环境。紫外灯开启稳定30 min后利用紫外辐照计测定紫外线辐照强度。将小鼠放入5 cm×9 cm×4 cm的透明小盒子中,盒子顶部用1 cm×1 cm铁丝网固定小鼠,灯距离小鼠背部距离为30 cm。每周照射3次,连续2周,每次辐照剂量为5 600 mJ/cm2,UVA、UVB辐照强度分别1.44、0.14 mW/cm2。本次动物实验伦理经江南大学动物伦理委员会认可,审核编号为JN.No20210630b0800812[236]。
1.3.1.3 样品采集
实验结束后,禁食不禁水12 h,异氟烷麻醉,摘眼球取血,3 500 r/min,4 ℃离心15 min,取上层血清保存于-80 ℃。取背部皮肤约0.1 g加入0.9 mL预冷的生理盐水,利用快速研磨仪制成10%组织匀浆,3 000 r/min,4 ℃离心15 min,取上清液保存于-80 ℃。
1.3.2 指标测定
1.3.2.1 小鼠脾脏指数测定
取脾脏用滤纸擦干称重,根据公式(1)计算脾脏指数:
脾脏指数![]()
(1)
1.3.2.2 血清、皮肤氧化应激和抗氧化酶指标测定
血清、皮肤组织上清液ROS、MDA、PC、SOD、GHS-Px、CAT根据试剂盒说明书进行测定。
1.3.2.3 皮肤Nrf2/ARE信号通路相关基因RT-PCR测定
根据试剂盒提取皮肤总RNA,测定浓度和纯度,对OD260nm/OD280nm=1.8~2.0的样品调整到相同浓度后逆转录为cDNA,采用RT-PCR扩增测定Nrf2、血红素加氧酶-1 (heme oxygenase-1,HO-1)、还原型烟酰胺腺嘌呤二核苷酸磷酸醌氧化还原酶(nicotinamide adenine dinucleotide phosphatequinone oxidoreductase1,NQO1)的相对表达。引物信息如表1所示。
表1 RT-PCR引物序列
Table 1 Sequences of primers used for RT-PCR
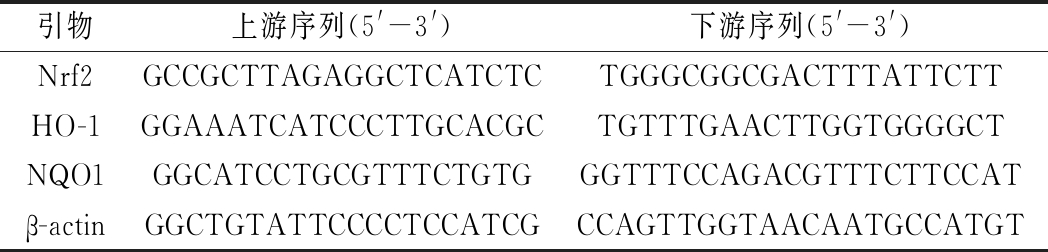
引物上游序列(5'-3')下游序列(5'-3')Nrf2GCCGCTTAGAGGCTCATCTCTGGGCGGCGACTTTATTCTTHO-1GGAAATCATCCCTTGCACGCTGTTTGAACTTGGTGGGGCTNQO1GGCATCCTGCGTTTCTGTGGGTTTCCAGACGTTTCTTCCATβ-actinGGCTGTATTCCCCTCCATCGCCAGTTGGTAACAATGCCATGT
1.3.2.4 皮肤胶原降解指标测定
皮肤组织上清液MMP-1、9、12根据试剂盒说明书进行测定。
1.3.2.5 血清炎症因子测定
血清IL-6、TNF-α根据试剂盒说明书进行测定。
1.3.2.6 皮肤表观指标测定
分别利用色差计和皮肤弹性测试仪测定小鼠同一部位背部皮肤的a*、总弹性、净弹性。取约0.1 g背部皮肤根据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》测定皮肤水分。
1.4 数据处理
利用SPSS 26.0软件,运用LSD和Tukey进行组间方差分析,结果均以“平均值±标准差”来表示,P<0.05表示组间具有显著性差异。
2 结果与分析
2.1 不同抗氧化剂对小鼠生长指数的影响
由图1可知,体重整体呈上升趋势,其中石榴组体重下降,但该组饲养和解剖中也未发现其明显异常,其体重下降原因可能与石榴提取物及其代谢产物具有降脂效果有关[20]。各组脾脏指数无显著性差异(P>0.05)。
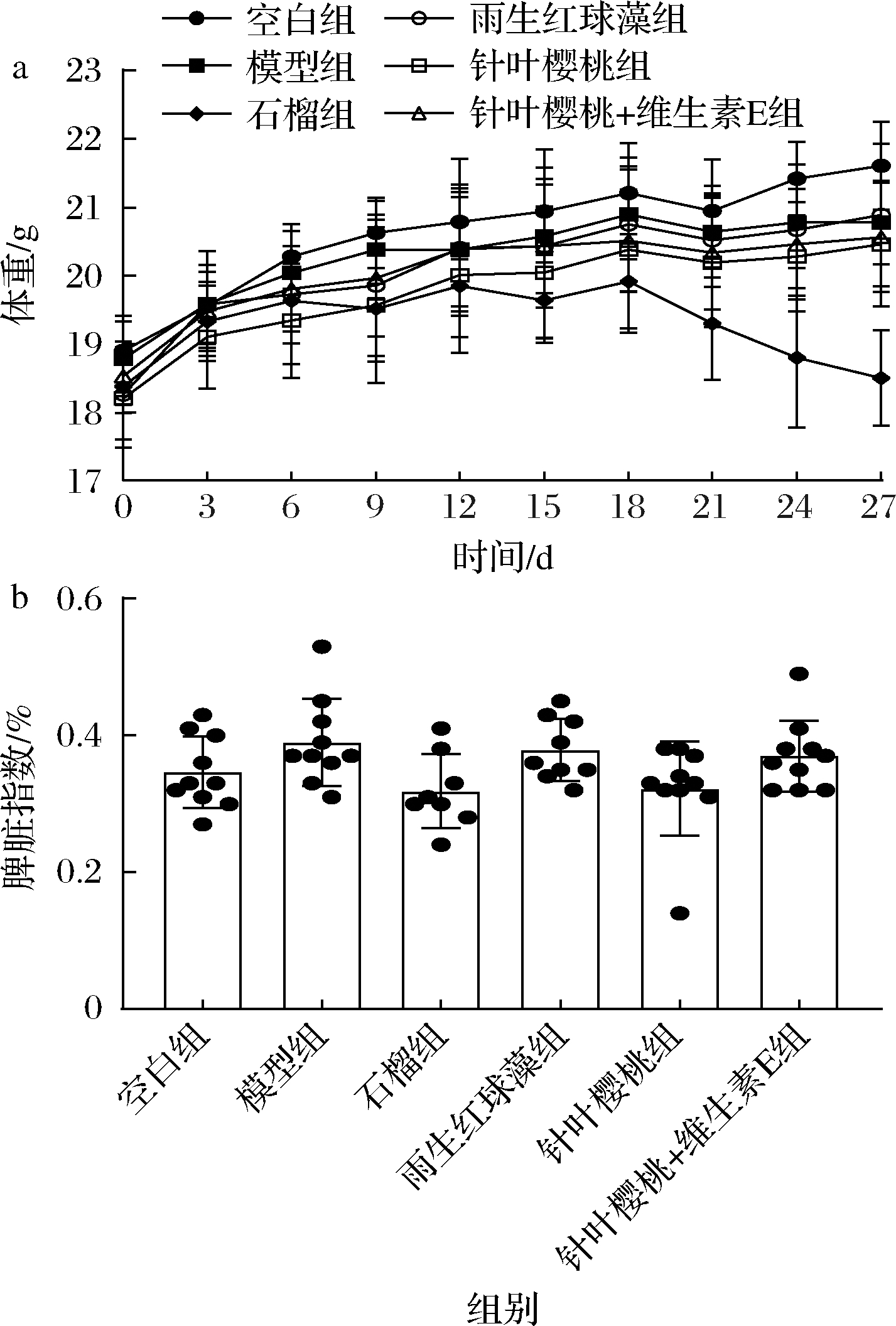
a-体重;b-脾脏指数
图1 不同抗氧化剂对小鼠生长指数的影响
Fig.1 Effects of different antioxidants on growth index in mice
2.2 不同抗氧化剂对小鼠氧化还原稳态的影响
2.2.1 不同抗氧化剂对小鼠氧化应激程度的影响
紫外线照射诱导机体产生过量的ROS攻击细胞膜,生物大分子被破坏,大量的脂质、蛋白质过氧化氧化产物积累,如MDA和蛋白质羰基,由此加快皮肤结构损伤[21]。如图2所示,较空白组,紫外线照射导致模型组ROS、PC含量显著增加,石榴显著减少PC含量,针叶樱桃显著减少MDA含量,雨生红球藻显著减少ROS和PC含量,而针叶樱桃+维生素E能显著减少三者的含量(P<0.05)。说明石榴、雨生红球藻、针叶樱桃、针叶樱桃+维生素E干预能够降低紫外线照射导致的氧化损伤,其中针叶樱桃+维生素E的效果较好,雨生红球藻次之。前人研究已表明,摄入虾青素[10]、维生素C[13]、维生素E[22]可降低体内氧化应激程度,进而保护皮肤免受损伤,但仅对单一抗氧化剂进行研究,未进行多种抗氧化剂之间的体内对比。
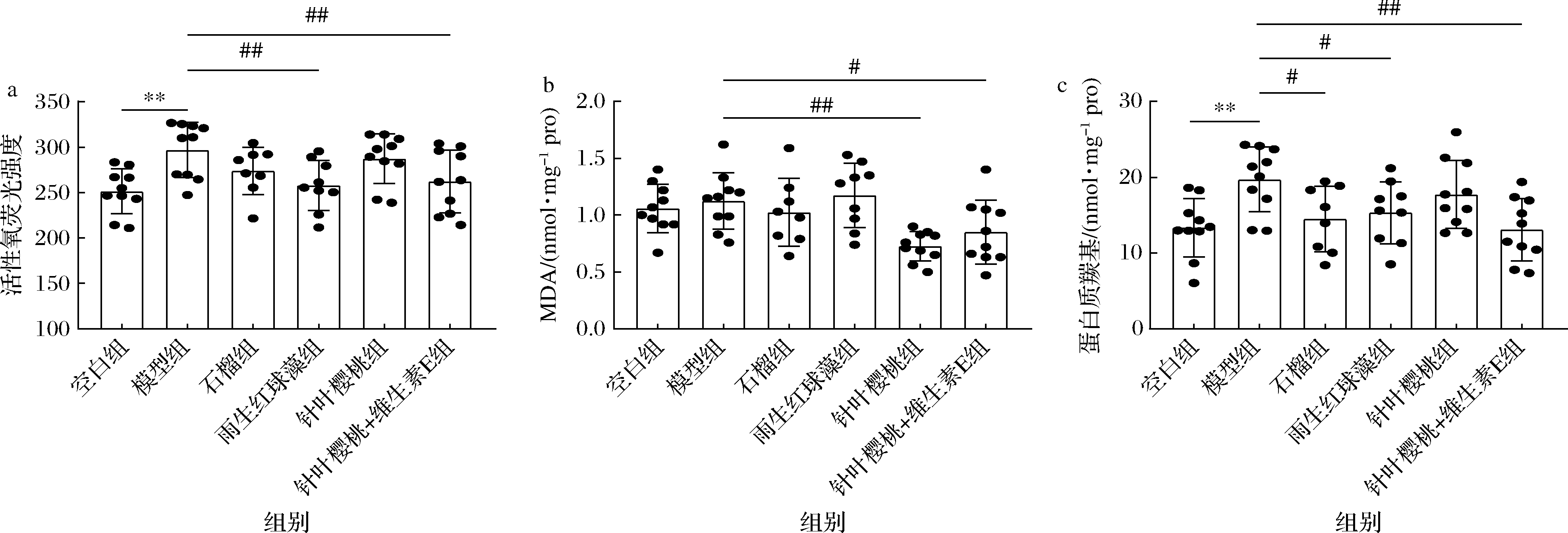
a-血清活性氧荧光强度;b-皮肤MDA含量;c-皮肤蛋白质羰基含量
图2 不同抗氧化剂对小鼠氧化应激程度的影响
Fig.2 Effects of different antioxidants on oxidative stress in mice
注:较空白组,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);较模型组,#表示差异显著(P<0.05),##表示差异极显著(P<0.01)(下同)
2.2.2 不同抗氧化剂对小鼠皮肤抗氧化酶的影响
内源性抗氧化酶(SOD、CAT、GSH-Px)能够抵消机体产生的ROS,维持氧化还原平衡,当紫外线照射产生ROS超出内源性抗氧化防御系统的调节能力时,动态平衡被打破,进而导致皮肤细胞氧化损伤,加剧皮肤光老化[3]。由图3所示,较空白组,模型组GSH-Px、CAT显著下调(P<0.05),说明紫外线照射消耗机体内源性抗氧化酶;较模型组,雨生红球藻显著提高GSH-Px表达量,针叶樱桃+维生素E可显著提高GSH-Px、CAT表达量(P<0.05),这与上述氧化应激的结果相对应。雨生红球藻是天然虾青素的理想来源,虾青素由于其“极性-非极性-极性”的结构特性,使其可以跨膜穿插在脂质双分子层中,兼具亲水区和疏水区捕获自由基的能力,使得少量的虾青素即可达到较高剂量普通抗氧化剂的效果[23]。针叶樱桃提取物富含维生素C,与维生素E在皮肤抗氧化方面是相互依赖的关系,维生素C是水溶性,存在于细胞质,维生素E为脂溶性,存在于细胞膜,紫外线照射产生的自由基攻击细胞膜,诱导过氧化连锁反应的发生,同时维生素E作为抗氧化剂转变为维生素E自由基,后者被维生素C还原为维生素E,二者的协同再生作用可能是其效果优于其他干预组的原因[14]。FUCHS等[15]也证实,维生素C和维生素E协同作用优于单独作用。提示亲水和亲脂互补可增强氧化应激的改善效果。
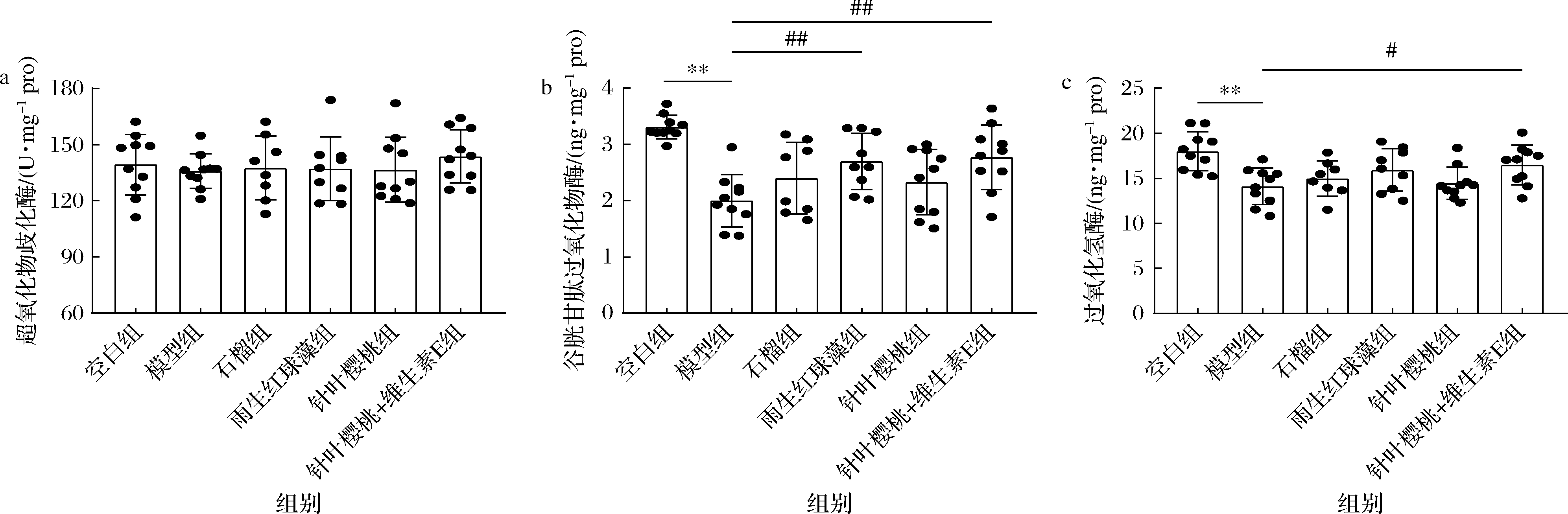
a-皮肤超氧化物歧化酶表达量;b-皮肤谷胱甘肽过氧化物酶表达量;c-皮肤过氧化氢酶表达量
图3 不同抗氧化剂对小鼠皮肤抗氧化酶的影响
Fig.3 Effects of different antioxidants on skin antioxidant enzymes in mice
2.2.3 不同抗氧化剂对小鼠皮肤Nrf2/ARE信号通路的影响
Nrf2/ARE是维持氧化还原平衡的重要调控通路,在外界刺激下, Nrf2移位进入细胞核,并结合抗氧化反应元件ARE,转录激活下游抗氧化酶,如NQO1、HO-1[24]。由图4所示,较空白组,模型组NQO1相对表达量显著下调,较模型组,针叶樱桃+维生素E、石榴分别显著上调Nrf2、HO-1相对表达量(P<0.05)。上述结果说明各抗氧化剂可通过调节氧化还原通路中相关因子表达,来提高皮肤抗氧化效果和抑制氧化损伤,与LOHAKUL等[25]研究结果相似。
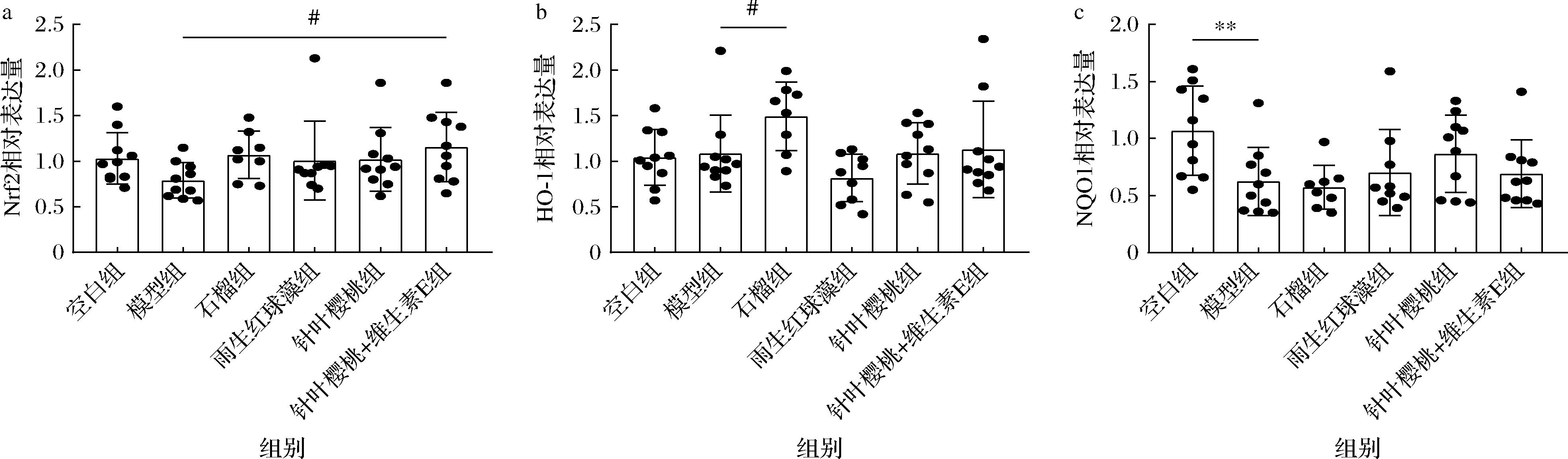
a-皮肤Nrf2的mRNA相对表达量;b-皮肤HO-1的mRNA相对表达量;c-皮肤NQO1的mRNA相对表达量
图4 不同抗氧化剂对小鼠氧化还原相关基因表达的影响
Fig.4 Effects of different antioxidants on mRNA expression levels of redox homeostasis-related genes in mice
2.3 不同抗氧化剂对小鼠皮肤胶原降解代谢的影响
真皮中最为丰富的成分是胶原蛋白,胶原蛋白的类型以Ⅰ和Ⅲ型为主,胶原蛋白交织成胶原纤维平行于皮肤表面,赋予皮肤抗拉强度;微纤维成分包埋在弹性蛋白中形成弹性纤维,维持皮肤弹性[1]。当机体处于氧化应激状态时会激活一系列信号转导途径,如丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,诱导下游MMPs表达,将胶原、弹性蛋白大分子降解为片段化,失去抗拉和弹性结构[2]。其中MMP-1、9是降解Ⅰ和Ⅲ型胶原蛋白的主要活性蛋白[2];MMP-12除了能够降解弹性蛋白,还能够激活其他MMPs家族成员,加速细胞外基质降解的级联反应[1]。如图5所示,较空白组,模型组MMP-1、9、12均显著增加,较模型组,石榴、雨生红球藻、针叶樱桃、针叶樱桃+维生素E可显著减少MMP-1、9或12(P<0.05),说明各抗氧化剂均可抑制MMPs表达,维持胶原蛋白和弹性蛋白稳定性,延缓皮肤老化,其中针叶樱桃+维生素E效果较好,这可能得益于其良好的抗氧化效果。不仅如此维生素C作为脯氨酸羟化酶、赖氨酰羟化酶的辅助因子,还能够促进胶原蛋白合成,这已得到JEONG等[26]的证实。

a-皮肤基质金属蛋白酶-1表达量;b-皮肤基质金属蛋白酶-9表达量;c-皮肤基质金属蛋白酶-12表达量
图5 不同抗氧化剂对小鼠皮肤基质金属蛋白酶表达的影响
Fig.5 Effects of different antioxidants on expression of skin matrix metalloproteinase in mice
2.4 不同抗氧化剂对小鼠机体炎症的影响
ROS积累促使核因子κB(nuclear factor kappa-B,NF-κB)活化,介导下游促炎细胞因子分泌,进而刺激炎症反应,导致皮肤泛红,另外炎症不仅会加剧ROS生成,而且又会促进MMPs表达,加重皮肤损伤[4]。由图6所示,较空白组,模型组IL-6、TNF-α含量显著增加,雨生红球藻显著减少IL-6和TNF-α含量,针叶樱桃+维生素E干预可显著减少IL-6含量(P<0.05),说明雨生红球藻和针叶樱桃+维生素E可抑制促炎因子表达,改善皮肤炎症。该结果与上述雨生红球藻和针叶樱桃+维生素E提高皮肤氧化还原稳态以及抑制胶原降解的结果相一致。MELO等[4]也表明摄入含有酚类抗氧化成分的马鞭草提取物可通过调节抗氧化-炎症-胶原代谢三者关系,改善紫外照射导致的皮肤损伤。
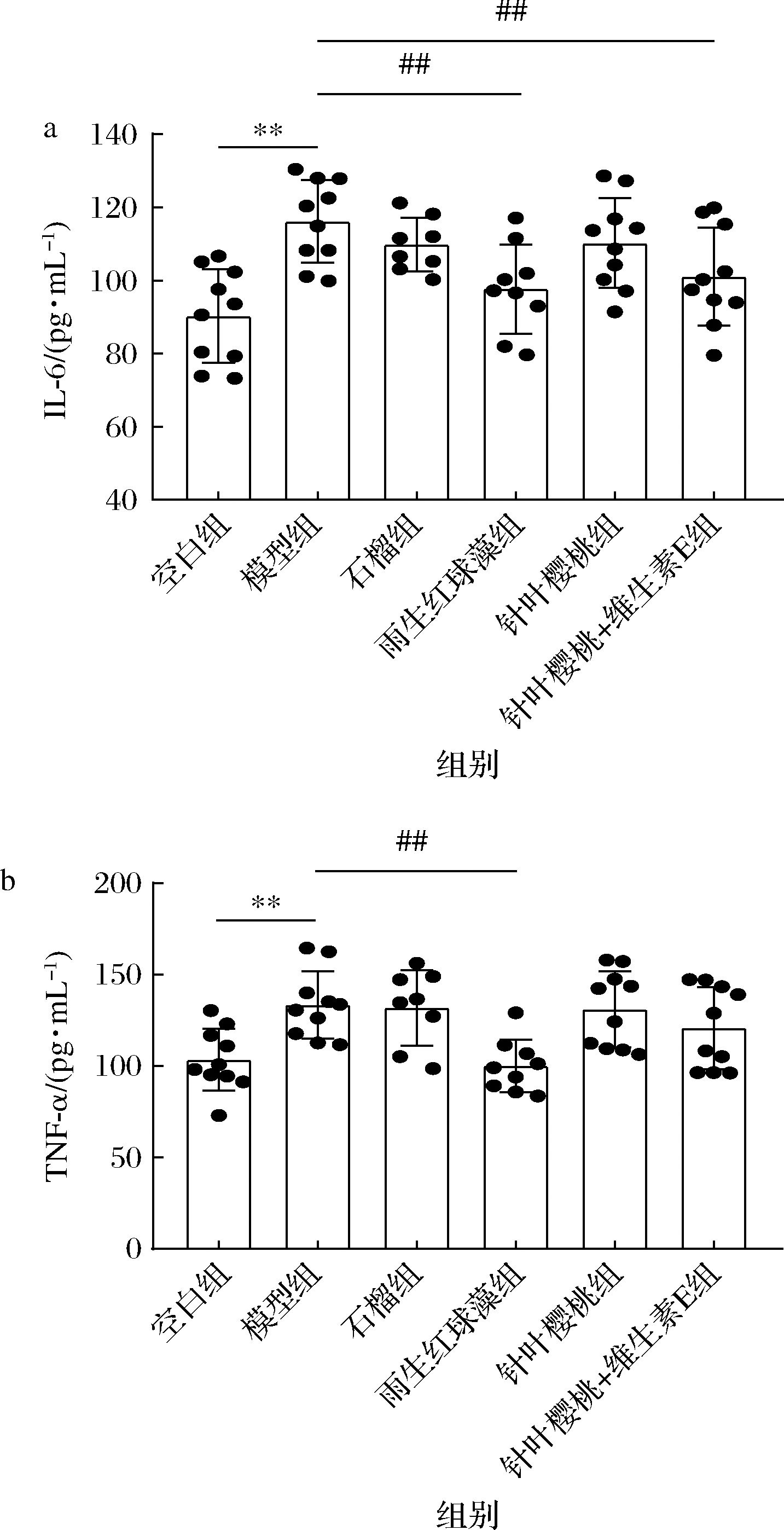
a-IL-6含量;b-TNF-α含量
图6 不同抗氧化剂对小鼠血清炎症因子的影响
Fig.6 Effects of different antioxidants on serum inflammatory factors in mice
2.5 不同抗氧化剂对小鼠皮肤表型的影响
色差a*值代表红绿值(红色>0,绿色<0),用以表征紫外照射导致的皮肤色差变化,过度暴露于紫外会导致皮肤泛红,是皮肤炎症的外在表现。由图7可知,较空白组,模型组a*值显著升高,较模型组,石榴、雨生红球藻、针叶樱桃、针叶樱桃+维生素E显著下调a*值(P<0.05),直观地反映了各抗氧化剂具有一定的皮肤炎症改善效果。这与STAHL等[17]研究结果相似,即摄入抗氧化剂后可改善紫外照射导致的皮肤泛红。除此之外,干燥、松弛也是常见的皮肤光老化问题,表现为水分流失以及弹性下降,石榴干预使得水分显著增加(P<0.05),但皮肤弹性未见显著性改善,可能是由于干预时间过短而未能体现在皮肤表型上。

a-皮肤色差a*值;b-皮肤水分含量;c-皮肤总弹性;d-皮肤净弹性
图7 不同抗氧化剂对小鼠皮肤表观指标的影响
Fig.7 Effects of different antioxidants on skin apparent indices in mice
3 结论
本研究利用UVA+UVB联合紫外照射建立小鼠皮肤光老化模型,准确真实地比较常见抗氧化剂对皮肤的改善效果。结果显示,口服摄入抗氧化剂不仅具有上调抗氧化酶表达,减少氧化产物积累,平衡皮肤氧化还原调节的作用,其中雨生红球藻和针叶樱桃+维生素E效果较好。而且雨生红球藻和针叶樱桃+维生素E在抑制胶原、弹性蛋白降解相关酶和促炎因子的分泌上也表现出最优性,并使皮肤泛红程度下降。上述结果可为今后开发护肤产品提供原料选择,提升产品抗皮肤光老化效果,提高市场竞争力。
本文主要采用了单一天然抗氧化剂及其组合,进行皮肤抗氧化效果的对比研究,在后续的研究中,可考虑复配其他皮肤功效成分,如活性多肽,探究在维持皮肤健康方面是否有协同功效。此外,各抗氧化剂经体内消化吸收后的产物及其护肤作用机理,还可进一步研究。
[1] 刘洋. 弹性蛋白肽的抗皮肤光老化功效及其作用机制研究[D].广州:华南理工大学, 2019.
LIU Y.Study on protective effect of bovine elastin peptides against skin photoaging and its action mechanism[D].Guangzhou:South China University of Technology, 2019.
[2] CHEN T J, HOU H, FAN Y, et al.Protective effect of gelatin peptides from Pacific cod skin against photoaging by inhibiting the expression of MMPs via MAPK signaling pathway[J].Journal of Photochemistry and Photobiology B:Biology, 2016, 165:34-41.
[3] CHEN T J, HOU H.Protective effect of gelatin polypeptides from Pacific cod (Gadus macrocephalus) against UV irradiation-induced damages by inhibiting inflammation and improving transforming growth factor-β/Smad signaling pathway[J].Journal of Photochemistry and Photobiology B:Biology, 2016, 162:633-640.
[4] MELO C P B, SAITO P, VALE D L, et al.Protective effect of oral treatment with Cordia verbenacea extract against UVB irradiation deleterious effects in the skin of hairless mouse[J].Journal of Photochemistry and Photobiology B:Biology, 2021, 216:112151.
[5] DENG H Y, WAN M J, LI H P, et al.Curcumin protection against ultraviolet-induced photo-damage in Hacat cells by regulating nuclear factor erythroid 2-related factor 2[J].Bioengineered, 2021, 12 (2):9 993-10 006.
[6] CUI B N, WANG Y, JIN J H, et al.Resveratrol treats UVB-induced photoaging by anti-MMP expression, through anti-inflammatory, antioxidant, and antiapoptotic properties, and treats photoaging by upregulating VEGF-B expression[J].Oxidative Medicine and Cellular Longevity, 2022, 2022:6037303.
[7] LI Y F, GUO C J, YANG J J, et al.Evaluation of antioxidant properties of pomegranate peel extract in comparison with pomegranate pulp extract[J].Food Chemistry, 2006, 96:254-260.
[8] KASAI K, YOSHIMURA M, KOGA T, et al.Effects of oral administration of ellagic acid-rich pomegranate extract on ultraviolet-induced pigmentation in the human skin[J].Journal of Nutritional Science and Vitaminology, 2006, 52(5):383-388.
[9] YOSHIMURA M, WATANABE Y, KASAI K, et al.Inhibitory effect of an ellagic acid-rich pomegranate extract on tyrosinase activity and ultraviolet-induced pigmentation[J].Bioscience, Biotechnology, and Biochemistry, 2005, 69 (12):2 368-2 373.
[10] CHALYK N E, KLOCHKOV V A, BANDALETOVA T Y, et al.Continuous astaxanthin intake reduces oxidative stress and reverses age-related morphological changes of residual skin surface components in middle-aged volunteers[J].Nutrition Research, 2017, 48:40-48.
[11] KOMATSU T, SASAKI S, MANABE Y, et al.Preventive effect of dietary astaxanthin on UVA-induced skin photoaging in hairless mice[J].PLoS One, 2017, 12(2):e0171178.
[12] G![]() GOTEK A,
GOTEK A, ![]() E, JASTRZA,B A, et al.Rutin and ascorbic acid cooperation in antioxidant and antiapoptotic effect on human skin keratinocytes and fibroblasts exposed to UVA and UVB radiation[J].Archives of Dermatological Research, 2019, 311 (3):203-219.
E, JASTRZA,B A, et al.Rutin and ascorbic acid cooperation in antioxidant and antiapoptotic effect on human skin keratinocytes and fibroblasts exposed to UVA and UVB radiation[J].Archives of Dermatological Research, 2019, 311 (3):203-219.
[13] LAUER A C, GROTH N, HAAG S F, et al.Dose-dependent vitamin C uptake and radical scavenging activity in human skin measured with in vivo electron paramagnetic resonance spectroscopy[J].Skin Pharmacology and Physiology, 2013, 26(3):147-154.
[14] PLACZEK M, GAUBE S, KERKMANN U, et al.Ultraviolet B-induced DNA damage in human epidermis is modified by the antioxidants ascorbic acid and D-α-tocopherol[J].Journal of Investigative Dermatology, 2005, 124 (2):304-307.
[15] FUCHS J, KERN H.Modulation of UV-light-induced skin inflammation by D-alpha-tocopherol and L-ascorbic acid:A clinical study using solar simulated radiation[J].Free Radical Biology & Medicine, 1998, 25 (9):1 006-1 012.
[16] SHIBATA A, NAKAGAWA K, KAWAKAMI Y, et al.Suppression of gamma-tocotrienol on UVB induced inflammation in HaCaT keratinocytes and HR-1 hairless mice via inflammatory mediators multiple signaling[J].Journal of Agricultural and Food Chemistry, 2010, 58(11):7 013-7 020.
[17] STAHL W, HEINRICH U, JUNGMANN H, et al.Carotenoids and carotenoids plus vitamin E protect against ultraviolet light-induced erythema in humans[J].The American Journal of Clinical Nutrition, 2000, 71 (3):795-798.
[18] PUCH F, SAMSON-VILLEGER S, GUYONNET D, et al.Consumption of functional fermented milk containing borage oil, green tea and vitamin E enhances skin barrier function[J].Experimental Dermatology, 2008, 17(8):668-674.
[19] XIAN D H, GAO X, XIONG X Q, et al.Photoprotection against UV-induced damage by skin-derived precursors in hairless mice[J].Journal of Photochemistry and Photobiology B:Biology, 2017, 175:73-82.
[20] KANG B B, KIM C Y, HWANG J, et al.Punicalagin, a pomegranate-derived ellagitannin, suppresses obesity and obesity-induced inflammatory responses via the Nrf2/Keap1 signaling pathway[J].Molecular Nutrition & Food Research, 2019, 63(22):e1900574.
[21] HOU H, LI B F, ZHANG Z H, et al.Moisture absorption and retention properties, and activity in alleviating skin photodamage of collagen polypeptide from marine fish skin[J].Food Chemistry, 2012, 135(3):1 432-1 439.
[22] KUCHIDE M, TOKUDA H, TAKAYASU J, et al.Cancer chemopreventive effects of oral feeding α-tocopherol on ultraviolet light B induced photocarcinogenesis of hairless mouse[J].Cancer Letters, 2003, 196 (2):169-177.
[23] 张舟艺, 曲雪峰, 胡文力,等.虾青素的检测及生物活性研究进展[J].食品安全质量检测学报, 2020, 11 (5):1 431-1 438.
ZHANG Z Y, QU X F, HU W L, et al.Research progress on detection and biological activity of astaxanthin[J].Journal of Food Safety and Quality, 2020, 11 (5):1 431-1 438.
[24] BEYER T A, AUF DEM KELLER U, BRAUN S, et al.Roles and mechanisms of action of the Nrf2 transcription factor in skin morphogenesis, wound repair and skin cancer[J].Cell Death and Differentiation, 2007, 14 (7):1 250-1 254.
[25] LOHAKUL J, CHAIPRASONGSUK A, JEAYENG S, et al.The protective effect of polyherbal formulation, harak formula, on UVA-induced photoaging of human dermal fibroblasts and mouse skin via promoting Nrf2-regulated antioxidant defense[J].Frontiers in Pharmacology, 2021, 12:649820.
[26] JEONG J H, KIM M B, KIM C, et al.Inhibitory effect of vitamin C on intrinsic aging in human dermal fibroblasts and hairless mice[J].Food Science and Biotechnology, 2018, 27 (2):555-564.