银条(Stachys flordana Schuttl.ex Benth.)属唇形科水苏属多年生草本植物,产自河南省偃师市,是我国国家农产品地理标志保护产品[1]。银条富含水苏糖、酚类、蛋白质、氨基酸等多种营养物质,具有软化血管、降血脂、改善血液循环等功效,具有极大的利用价值[2]。银条主食部分为地下根状茎,由于其表面洁白、脆嫩多汁、外皮较薄、无外表皮保护,在常温下贮藏期极短,而且在加工和贮藏中极易发生褐变、失水、硬度下降等现象,这给银条采后贮藏、运输及销售带来了困难。低温是延缓采后果蔬组织衰老、延长货架期的有效措施[3],但不适宜的低温会导致采后果蔬发生低温伤害[4],会大大影响采后果蔬的贮藏品质和货架期,因此确定果蔬采后贮藏的适宜温度至关重要。
银条的采后研究多集中于加工产品,如银条蛋糕、银条面包、银条酱等,对于银条贮藏保鲜方面的研究相对较少,仅有郭香凤等[5]采用低温结合气调包装贮藏银条净菜、易军鹏等[6]采用羧甲基壳聚糖复合涂膜贮藏保鲜银条的报道。然而,目前还鲜有关于不同贮藏温度对采后银条贮藏性影响的报道,尤其是低温对银条褐变及细胞壁降解的影响还未见报道。因此,本研究采用4、10 ℃和常温(20 ℃)贮藏银条,通过测定褐变及细胞壁降解相关指标确定银条最佳贮藏温度,以期为银条的贮藏保鲜提供理论依据和参考。
1 材料与方法
1.1 材料及处理
本实验以“两细一粗”银条为实验材料,2020年11月19日采收于河南省偃师市许庄村,采摘后在1 h内送到实验室。挑选长度为(20±1) cm、无机械损伤、无病虫害、无褐变的银条,用清水轻轻洗净其表面泥土,之后阴凉处(20 ℃)阴干4 h,之后将银条随机分为3组,按每筐0.5 kg分别装入消过毒的聚乙烯塑料筐中,筐外套厚度为0.05 mm聚乙烯薄膜,袋不扎口,将其分别置于相对湿度为85%~90%、温度为4、10 ℃的恒温恒湿箱中贮藏30 d,同时以常温贮藏(20 ℃)作为对照,每处理重复3次。贮藏期内每隔5 d随机取样,取样后立即测定相关指标。
1.2 实验试剂
乙醇、无水碳酸钠(Na2CO3)、乙酸钠、NaCl、咔唑、NaOH、乙酸,国药集团化学试剂有限公司;福林酚、聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、邻苯二酚,北京索莱宝科技有限公司;水杨苷、巯基乙醇、半乳糖醛酸、果胶、多聚半乳糖醛酸、3,5-二硝基水杨酸、p-硝基苯-β-D-吡喃半乳糖苷,上海阿拉丁生化科技股份有限公司;所有试剂均为分析纯。
1.3 仪器与设备
MIR-553 恒温恒湿箱,日本SANYO公司;食品物性分析仪,英国Stable Micro Systemes公司;X-rite Color i5色差仪,美国Gretag Macbeth公司;UV-1800紫外可见分光光度计,日本岛津公司;3-30K 高速冷冻离心机,德国Sigma公司。
1.4 实验方法
1.4.1 褐变指数的评定
褐变指数的评定按银条表面出现褐变的面积大小进行分级,参照何庆等[7]所述的方法,并略有改动。0级,无褐变;1级,褐变面积<1/3;2级,1/3<褐变面积<1/2;3级,1/2<褐变面积<2/3;4级,褐变面面积>2/3。银条褐变指数计算如公式(1)所示:
(1)
式中:R,银条褐变指数;s,银条褐变级别;n,该级别银条根数;N,银条总根数;S,最高级代表数值。
1.4.2 失重率的测定
采用称重法,分别称量银条初始质量和贮藏后质量,失重率计算如公式(2)所示:
(2)
式中:P,银条的失重率,%;m0,初始质量,g;m1,贮藏后质量,g。
1.4.3 硬度的测定
每处理组取10根银条,采用食品物性分析仪测定硬度,选用2 mm柱形探头,设置形变百分量为70%、起始力为10 g、检测速度为10 mm/s,每根银条测定3次,测取平均值。
1.4.4 色差L*值的测定
每处理组取10根银条,采用X-rite Color i5色差仪测定银条表面L*值,每根银条测定3次,测取平均值。
1.4.5 总酚含量的测定
参照黄怡等[8]方法并稍作修改。2 g银条加入5 mL预冷的60%(体积分数)乙醇溶液,冰浴研磨后于4 ℃、12 000×g离心30 min,取0.125 mL上清液,加入0.125 mL福林酚试剂和0.5 mL蒸馏水混匀,静置6 min,再加入1.25 mL 7%(质量分数)Na2CO3溶液和1 mL蒸馏水,室温避光静置2 h,在760 nm处测定吸光度值,总酚含量以μg/g表示。
1.4.6 多酚氧化酶活性的测定
参照刘云芬等[9]方法并稍作修改。5 g银条加入5 mL乙酸-乙酸钠提取液[0.1 mol/L,pH 5.5,含4%(质量分数)PVP],低温研磨后于4 ℃、12 000×g离心15 min,上清液即为酶提取液。3 mL反应液中含有2.8 mL 50 mmol/L邻苯二酚溶液,再加入200 μL酶提取液,在420 nm处测定其吸光度。多酚氧化酶活性用U表示,以每克银条鲜样每分钟在420 nm处吸光度值增加1为1个酶活性单位(U),单位为U/(min·g FW)表示。
1.4.7 原果胶和水溶性果胶含量的测定
参照曹建康等[10]咔唑比色法测定。1 g银条加25 mL 95%(体积分数)乙醇,沸水浴加热30 min后8 000 r/min离心15 min,取沉淀,将沉淀再次洗涤3次后加入20 mL蒸馏水溶解,再次离心后将上清液定容至100 mL,即为可溶性果胶测定液,将沉淀溶解于0.5 mol/L硫酸溶液,沸水浴1 h后离心,将上清液定容至100 mL即为原果胶测定液。分别吸取原果胶和可溶性果胶测定液各1 mL,加入6 mL浓硫酸,沸水浴20 min,之后加入0.2 mL 1.5 g/L咔唑-乙醇溶液,避光放置30 min,测定反应液在530 nm处的吸光度值。原果胶和水溶性果胶含量均以生成的半乳糖醛酸占样品质量的百分数表示,%。
1.4.8 果胶甲酯酶活性的测定
参照魏建梅等[11]方法测定并稍作修改。3 g银条加入15 mL 0.1 mol/L乙酸-乙酸钠缓冲液[含100 mmol/L NaCl、1%(体积分数)巯基乙醇和1.5%(质量分数)PVP,pH值5.2],低温匀浆后4 ℃、12 000×g离心20 min,上清液为酶提取液。以2 mL 0.5%(质量分数)果胶为底物,加入1 mL酶液,37 ℃下恒温1 h,用0.01 mol/L NaOH滴定维持pH值为7.2,记录消耗NaOH毫升数。果胶甲酯酶活性用U表示,其中U定义为每克银条鲜样在每小时内消耗1 μmol NaOH的酶用量,单位为U/(h·g FW)表示。
1.4.9 多聚半乳糖醛酸酶活性的测定
多聚半乳糖醛酸酶参照曹建康等[10]方法测定。10 g银条加入20 mL 95%(体积分数)乙醇,低温匀浆后4 ℃、12 000×g离心20 min,弃上清,将沉淀加入10 mL 80%(体积分数)乙醇,相同操作后离心,将沉淀加入5 mL乙酸-乙酸钠溶液溶解(50 mmol/L、pH 5.5,含1.8 mol/L NaCl),离心后上清液即为酶提取液。取1 mL乙酸-乙酸钠溶液(50 mmol/L,pH 5.5)和0.5 mL 10 g/L多聚半乳糖醛酸溶液,加入0.5 mL酶提取液,37 ℃保温1 h,迅速加入1.5 mL 3,5-二硝基水杨酸溶液,沸水浴煮沸5 min,定容至25 mL,测定540 nm下吸光度值。多聚半乳糖醛酸酶活性用U表示,其中U定义为每小时每克银条鲜样在37 ℃下催化多聚半乳糖醛酸水解生成1 μg半乳糖醛酸所需的酶量,单位为U/(h·g FW)。
1.4.10 β-葡萄糖苷酶活性的测定
参照曹建康等[10]水杨苷水解法测定。酶液提取同1.4.9。取1.5 mL 10 g/L水杨苷溶液加入0.5 mL酶液, 37 ℃保温1 h,之后加入1.5 mL 3,5-二硝基水杨酸溶液终止酶促反应,沸水浴煮沸5 min,定容至25 mL,测定540 nm下吸光度值。β-葡萄糖苷酶活性用U表示,其中U定义为每小时每克银条鲜样中酶在37 ℃催化水杨苷水解形成1 μg葡萄糖所需的酶量,单位为U/(h·g FW)。
1.4.11 β-半乳糖苷酶活性的测定
参照李佩艳等[12]方法测定。2 g银条加入8 mL 50 mmol/L乙酸-乙酸钠缓冲液[含100 mmol/L NaCl、2%(体积分数)巯基乙醇、5%(质量分数)PVP,pH值5.5],低温匀浆后4 ℃、12 000×g离心20 min,上清液即为酶提取液。取1 mL p-硝基苯-β-D-吡喃半乳糖苷(3 mmol/L)加入100 μL酶液,37 ℃保温30 min,取出后立即加入2 mL 1 mol/L Na2CO3终止反应,测定400 nm处反应液的吸光度值。β-半乳糖苷酶活性用U表示,其中U定义为每分钟每克银条鲜样在37 ℃下分解p-硝基苯-β-D-吡喃半乳糖产生1 μmol对硝基苯酚所需的酶量,单位为U/(min·g FW)。
1.5 数据分析
采用SPSS 24.0软件进行数据差异显著性分析,采用Origin 2017软件绘制曲线。
2 结果与分析
2.1 不同贮藏温度对银条褐变指数和L*值的影响
褐变指数和L*值能反映银条贮藏期间褐变程度。3种贮藏温度下银条的褐变指数均呈上升趋势,L*值均呈下降趋势(图1),4 ℃和10 ℃低温贮藏下银条的褐变指数显著低于常温贮藏(P<0.05),L*值显著高于常温贮藏(P<0.05)。常温贮藏5 d时,银条表面已经出现明显的褐变,而2个低温贮藏组银条表面褐变不明显,贮藏15 d时,常温贮藏银条褐变非常严重,2个低温贮藏组银条褐变程度虽略有加重,但银条仍具有良好的外观色泽,两者的褐变指数和L*值差异不显著(P>0.05)。贮藏20~30 d,与4 ℃低温贮藏相比,10 ℃贮藏显著抑制了银条褐变指数的升高和L*值的下降(P<0.05),银条表面褐变程度较轻,具有较好的外观色泽。

A-褐变指数;B-L*值
图1 不同贮藏温度对银条褐变指数和L*值的影响
Fig.1 Effects of different storage temperatures on the browning index and L* value of Stachys flordana Schuttl.ex Benth
2.2 不同贮藏温度对银条总酚和多酚氧化酶的影响
采后果蔬体内的酚类物质在多酚氧化酶作用下被氧化成醌类物质,导致褐变发生[9],因此酚类物质、多酚氧化酶活性影响果蔬酶促褐变的发生[13]。由图2可知,常温贮藏下银条总酚含量和多酚氧化酶活性显著高于4 ℃和10 ℃(P<0.05),这是引起常温贮藏银条褐变严重的主要原因。贮藏前15 d,10 ℃低温贮藏下银条总酚含量和多酚氧化酶活性与4 ℃低温贮藏银条没有显著差异(P>0.05)。贮藏15 d后,2个低温贮藏组银条总酚含量均急剧上升,与4 ℃低温贮藏相比,10 ℃低温贮藏显著抑制了银条总酚含量的上升(P<0.05),而对于多酚氧化酶活性,2个低温贮藏组多酚氧化酶活性变化均不大,但10 ℃低温贮藏银条多酚氧化酶活性在贮藏20~30 d显著低于4 ℃低温贮藏组(P<0.05),说明贮藏后期10 ℃低温贮藏能抑制银条总酚含量的增加,并维持较低多酚氧化酶活性,降低银条褐变的发生。

A-总酚含量;B-多酚氧化酶活性
图2 不同贮藏温度对银条总酚含量和多酚氧化酶活性的影响
Fig.2 Effects of different storage temperatures on the total phenol content and polyphenol oxidase activity of Stachys flordana Schuttl.ex Benth
2.3 不同贮藏温度对银条硬度和失重率的影响
由图3-A可知,3种贮藏温度下银条硬度总体上均呈下降趋势,其中常温贮藏下银条硬度的下降速度显著高于4 ℃和10 ℃(P<0.05),银条常温贮藏5 d,硬度下降32.01%,品质劣变较快,而2个低温贮藏组均能有效抑制银条硬度的下降。贮藏15~30 d,10 ℃低温贮藏银条硬度显著高于4 ℃(P<0.05)。贮藏30 d时,10 ℃低温条件下银条的硬度比4 ℃组高1.5倍,这说明10 ℃低温贮藏能显著抑制贮藏后期银条硬度的下降,保持银条较好的贮藏品质。
由图3-B可知,常温贮藏银条的失重率显著高于2个低温贮藏组(P<0.05),贮藏5 d时常温贮藏组银条失重率已达22.22%,银条表面已经出现萎蔫,而4 ℃和10 ℃贮藏温度下银条的失重率分别为5.03%和4.05%,银条失水较轻,没有出现萎蔫现象,说明常温贮藏下银条失水较低温贮藏快。与4 ℃低温贮藏相比,10 ℃低温贮藏显著抑制了贮藏20~30 d银条失重率的上升(P<0.05),这说明10 ℃低温贮藏能有效抑制银条的失水,减轻银条品质劣变。
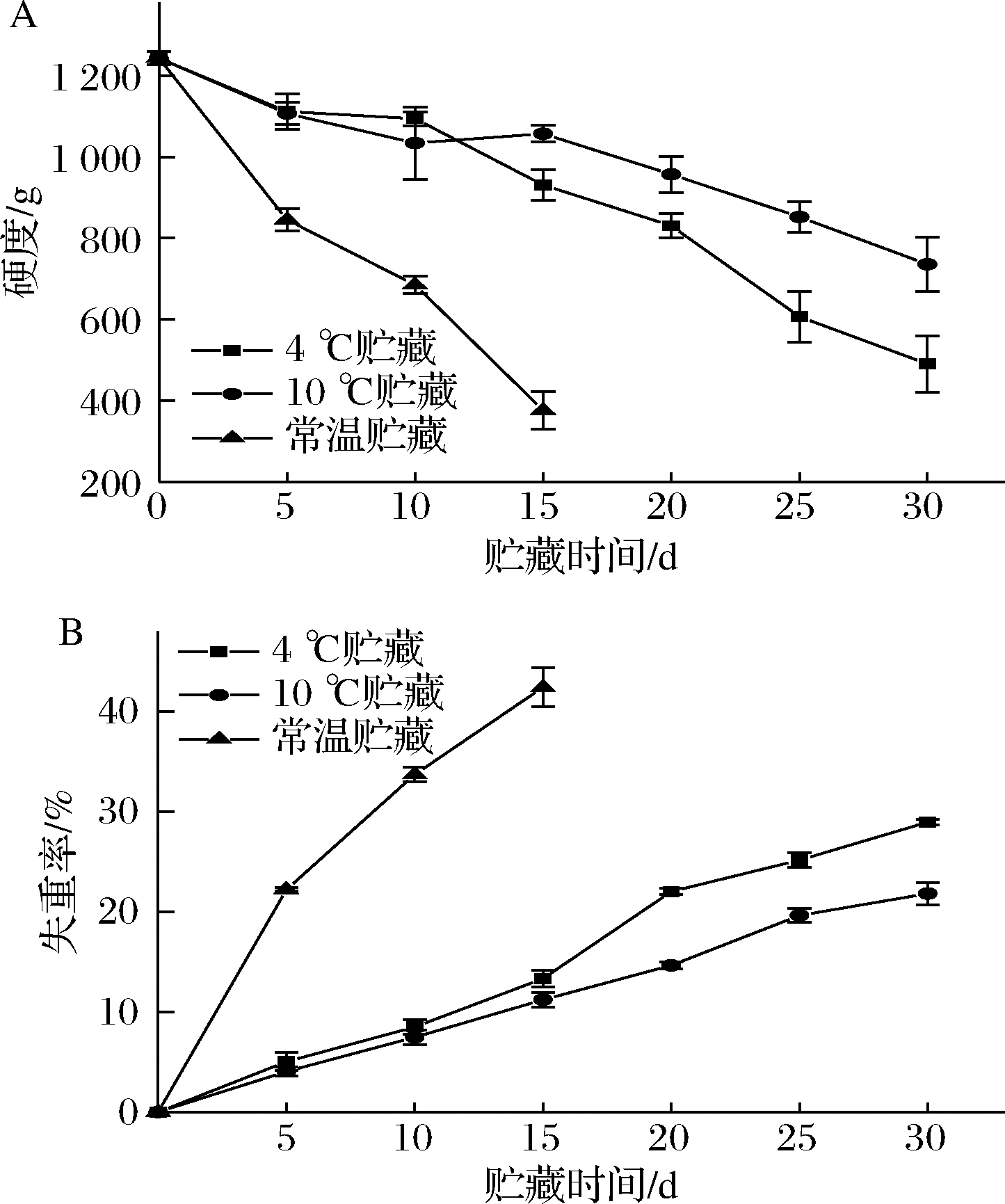
A-硬度;B-失重率
图3 不同贮藏温度对银条硬度和失重率的影响
Fig.3 Effect of different storage temperature on hardness and weight loss rate of Stachys flordana Schuttl.ex Benth
2.4 不同贮藏温度对银条原果胶和水溶性果胶含量的影响
原果胶是构成采后果蔬细胞壁的主要物质,能保持采后果蔬组织坚硬。随着果蔬成熟和衰老,原果胶在细胞壁降解酶的作用下逐渐降解为水溶性果胶,导致果蔬组织软化,硬度下降[14]。由图4-A可知,3个贮藏温度下银条的原果胶含量均呈逐渐下降趋势(除第5天),其中常温贮藏下银条原果胶下降速度最快,贮藏过程中,4和10 ℃低温贮藏显著抑制了银条原果胶的含量的下降(P<0.05)。贮藏5~30 d,10 ℃低温贮藏银条原果胶含量显著高于4 ℃低温贮藏(P<0.05)。由图4-B可知,4 ℃低温贮藏银条水溶性果胶含量呈先升高后下降再升高趋势,10 ℃低温贮藏银条水溶性果胶含量呈现先下降后上升趋势(图3-B),且在整个贮藏期间,10 ℃低温贮藏银条水溶性果胶均显著低于4 ℃(P<0.05)。贮藏30 d时,10 ℃低温贮藏银条水溶性果胶含量较4 ℃ 低18.46%。这说明10 ℃低温贮藏能抑制银条原果胶的降解,显著抑制水溶性果胶的生成,维持细胞壁结构完整,保持银条较高的硬度。

A-原果胶含量;B-水溶性果胶含量
图4 不同贮藏温度对银条原果胶和水溶性果胶的影响
Fig.4 Effects of different storage temperatures on contents of original pectin and water-soluble pectin of Stachys flordana Schuttl.ex Benth
2.5 不同贮藏温度对银条细胞壁降解相关酶活性的影响
果胶甲酯酶能使果胶甲酯化,生成适合多聚半乳糖醛酸酶作用的底物,采后果蔬中果胶在果胶甲酯酶和多聚半乳糖醛酸酶的协同作用下发生降解,使细胞壁结构改变,最终导致果实软化[15]。由图5-A可知,常温贮藏组银条果胶甲酯酶活性一直呈上升趋势,2个低温贮藏组银条果胶甲酯酶活性总体上呈下降-上升-下降的趋势,与常温贮藏相比,2个低温贮藏组均显著抑制了果胶甲酯酶活性升高(P<0.05)。贮藏前10 d,4 ℃和10 ℃低温贮藏银条果胶甲酯酶活性没有显著性差异(P>0.05),贮藏15~30 d,10 ℃低温下贮藏银条果胶甲酯酶活性显著低于4 ℃(P<0.05)。贮藏30 d时,10 ℃低温贮藏银条果胶甲酯酶活性为0.26 U/(h·g FW),比4 ℃低27.92%。这说明10 ℃低温贮藏更能抑制贮藏后期银条果胶甲酯酶活性,降低银条果胶甲酯化的程度,保持银条较好的品质。
多聚半乳糖醛酸酶与果实软化、细胞壁降解有密切关系。多聚半乳糖醛酸酶能参与果胶降解,作用于半乳糖醛酸的非还原末端,生成半乳糖醛酸,使细胞壁结构解体,导致采后果蔬质地软化[16]。由图5-B可知,4 ℃和10 ℃低温贮藏显著抑制了贮藏期间银条多聚半乳糖醛酸酶活性(P<0.05)。10 ℃低温贮藏银条多聚半乳糖醛酸酶活性在贮藏过程呈缓慢增加趋势,4 ℃低温贮藏银条多聚半乳糖醛酸酶活性在贮藏前10 d内变化不大,之后明显升高,且在贮藏15~30 d与10 ℃有显著性差异(P<0.05),结果表明10 ℃能抑制贮藏后期银条多聚半乳糖醛酸酶酶活性,延缓银条软化。
β-葡萄糖苷酶在果实软化过程中起到辅助作用,促进果实软化[17]。图5-C结果表明,3种贮藏温度下银条β-葡萄糖苷酶活性变化均较大,总体上均呈先上升后下降再上升的变化趋势,且常温贮藏下银条β-葡萄糖苷酶活性显著高于2个低温贮藏组(P<0.05)。4 ℃和10 ℃低温贮藏银条β-葡萄糖苷酶活性在贮藏前10 d有所上升,但二者之间没有显著差异(P>0.05),贮藏15~30 d 10 ℃低温贮藏银条β-葡萄糖苷酶活性显著低于4 ℃(P<0.05),这说明10 ℃低温贮藏能抑制贮藏后期银条β-葡萄糖苷酶活性,延缓细胞壁代谢。
β-半乳糖苷酶是降解细胞壁多糖组分的重要糖苷酶之一,主要在果实早期软化过程中起作用,能降解具有支链的多聚醛酸,改变细胞壁组分,从而使果胶降解[17]。图5-D表明,2个低温贮藏组显著抑制了银条β-半乳糖苷酶活性的上升(P<0.05)。随贮藏时间的延长,4和10 ℃低温贮藏银条β-半乳糖苷酶活性均呈现先下降后上升的趋势。贮藏5~15 d 10 ℃低温贮藏银条β-半乳糖苷酶活性显著低于4 ℃(P<0.05),但在贮藏20~30 d两者没有显著性差异(P>0.05)。结果说明,与4 ℃低温贮藏相比,10 ℃低温贮藏能维持银条贮藏前期较低的β-半乳糖苷酶活性,而对贮藏后期β-半乳糖苷酶活性影响不大。
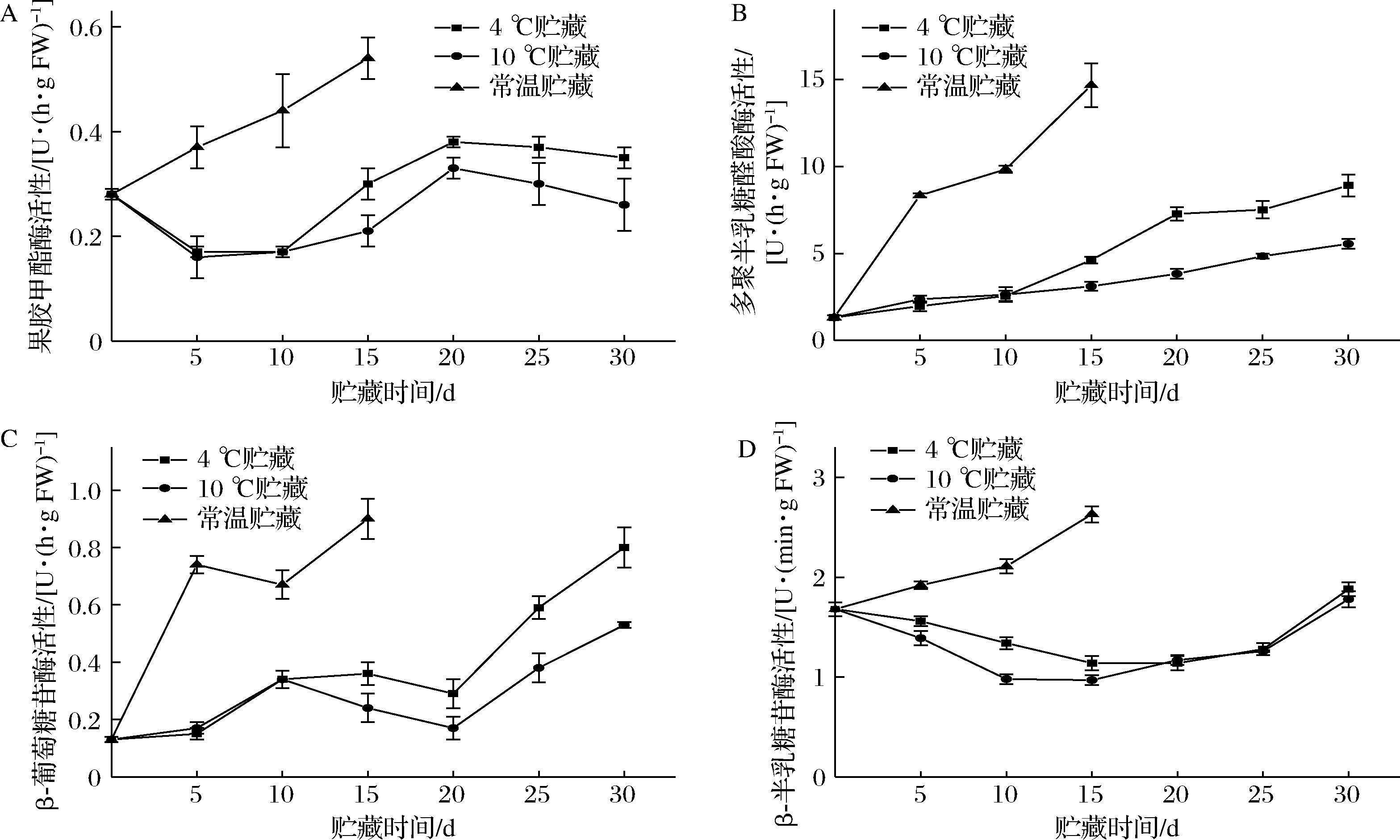
A-果胶甲酯酶活性;B-多聚半乳糖醛酸酶活性;C-β-葡萄糖苷酶活性;D-β-半乳糖苷酶活性
图5 不同贮藏温度对银条贮藏期间果胶甲酯酶、多聚半乳糖醛酸酶、β-葡萄糖苷酶和β-半乳糖苷酶活性的影响
Fig.5 Effects of different storage temperatures on the activities of pectin methylesterase, polygalacturonase, β-glucosidase and β-galactosidase of Stachys flordana Schuttl.ex Benth
3 讨论
银条采收后常温贮藏极易发生褐变,导致其品质劣变[2]。低温贮藏能减轻银条褐变和维持其品质,然而不当的低温贮藏会对果蔬造成低温伤害,造成其品质劣变。本实验结果表明,与4 ℃低温贮藏相比,10 ℃低温贮藏能显著抑制银条褐变指数的上升,维持银条较好的贮藏品质,这说明银条在10 ℃低温下发生的酶促褐变程度较轻。进一步对低温贮藏银条中总酚含量和多酚氧化酶活性分析发现,10 ℃低温贮藏显著降低了银条总酚含量和多酚氧化酶活性(图2-A和图2-B),这是10 ℃低温贮藏银条酶促褐变发生程度较低的主要原因。这与先前陈莲[18]研究发现橄榄果实8 ℃低温贮藏褐变程度显著低于4 ℃的研究结果类似。郑剑英[19]研究表明果蔬受低温伤害严重会导致酚类物质的合成和积累,破坏细胞膜结构和内区域化作用,加重酶促褐变发生。李顺兴[20]研究表明,银条不耐低温,在贮藏温度低于5 ℃时易受到低温伤害而影响其贮藏品质。本实验发现,银条低温贮藏15 d后,2个低温贮藏组银条酚类物质含量均开始出现明显上升,多酚氧化酶活性变化不大,但4 ℃低温贮藏银条酚类物质含量、多酚氧化酶活性均显著高于10 ℃,同时银条褐变指数显著高于10 ℃,这说明银条在4 ℃下酶促褐变更严重,这可能是由于银条在4 ℃低温贮藏下受到的低温伤害更为严重,导致银条酚类物质积累较多,细胞结构破坏严重,加剧了酶促褐变发生,从而使银条贮藏品质下降。先前李惠等[21]在低温贮藏甘薯中也有类似发现。
硬度、失重率是反映银条品质的重要指标。银条由于缺乏外皮保护层,容易发生硬度下降、失水等现象,导致品质劣变。本实验结果表明,常温贮藏下银条失水严重,贮藏5 d时失水率>20%,银条表面已经出现萎蔫。低温贮藏能大大降低银条硬度的下降和失重率的上升,而且贮藏后期(15~30 d)10 ℃低温贮藏银条的硬度较4 ℃低温贮藏高,失重率较4 ℃低温贮藏低,银条的贮藏效果较好,更利于维持银条贮藏品质。梁莉等[22]在低温贮藏南瓜中也有类似发现。
细胞壁组分中果胶物质是影响果实质地的重要因素之一[14]。采后果蔬在贮藏过程中由于原果胶降解成水溶性果胶和果胶酸,导致果蔬硬度下降,品质发生劣变[23]。LIU等[24]认为果胶在采后果蔬质地及软化中起着重要作用,果蔬的硬度与果胶含量表现出高度相关性。王秀[17]认为采后果蔬硬度与不溶性果胶含量呈显著正相关,与可溶性果胶含量呈负相关。本实验中,10 ℃低温贮藏显著降低了银条原果胶的降解和水溶性果胶的生成,维持了银条贮藏过程中较高原果胶含量和较低水溶性果胶含量,这是10 ℃低温贮藏维持银条较高硬度的原因之一。细胞壁物质在果胶甲酯酶、多聚半乳糖醛酸酶、β-葡萄糖苷酶、β-半乳糖苷酶等细胞壁降解酶作用下会发生降解,导致细胞壁结构解体,果实软化[25]。梁洁玉等[26]认为低温能够抑制采后李子细胞壁降解酶活性,降低果胶代谢速率,维持李子较高硬度。何庆等[7]研究表明采前喷施水杨酸能抑制采后葡萄细胞壁降解酶活性上升,降低果胶物质降解程度,抑制葡萄果实采后软化。本研究结果发现,与4 ℃低温贮藏相比,10 ℃低温贮藏显著抑制了银条果胶甲酯酶、多聚半乳糖醛酸酶、β-葡萄糖苷酶、β-半乳糖苷酶等细胞壁代谢酶活性,降低了银条细胞壁降解程度,维持了银条较高的硬度及贮藏品质。这一方面是由于银条在10 ℃低温贮藏失重率较4 ℃贮藏低,能维持银条正常的代谢过程,而银条在4 ℃低温贮藏下失重率较高,细胞失水较严重,导致银条细胞壁降解作用加强,银条贮藏品质劣变,这与陈杰忠等[27]研究表明采后果蔬细胞壁降解酶活性会随着细胞不断失水而增加的研究结果一致。另一方面,果蔬受到低温伤害会导致细胞壁降解酶活力提高而引发细胞壁代谢异常、细胞壁结构解体[28],银条在4 ℃低温贮藏下受低温伤害较10 ℃严重,导致银条果胶质代谢紊乱,提高了细胞壁降解酶活性,加剧了细胞壁结构解体,加速了银条中原果胶向水溶性果胶的转变,导致银条贮藏品质下降,这与CARVAJAL等[29]研究4 ℃低温冷藏西葫芦的结果类似。实验中还发现,10 ℃低温显著抑制了银条贮藏0~15 d β-半乳糖苷酶活性,显著抑制了贮藏15~30 d果胶甲酯酶、多聚半乳糖醛酸酶、β-葡萄糖苷酶活性,这说明β-半乳糖苷酶主要作用于银条贮藏前期的软化,果胶甲酯酶、多聚半乳糖醛酸酶、β-葡萄糖苷酶主要作用于银条贮藏后期的软化。这与魏建梅等[11]研究表明果胶甲酯酶、多聚半乳糖醛酸酶主要作用于采后果蔬贮藏后期软化、CHEN等[30]研究表明β-半乳糖苷酶主要作用于采后果蔬贮藏前期软化的结果类似。
4 结论
本研究结果表明,与常温贮藏相比,低温贮藏能减轻银条贮藏过程中褐变的发生,保持其较好品质。10 ℃低温贮藏能显著降低采后银条总酚含量和多酚氧化酶活性,抑制银条酶促褐变的发生,维持了银条较低褐变指数和较高L*值;显著抑制了原果胶含量下降和水溶性果胶含量上升,显著抑制了贮藏前期β-半乳糖苷酶活性和贮藏后期果胶甲酯酶、多聚半乳糖醛酸酶、β-葡萄糖苷酶活性,降低了银条细胞壁降解过程,保持了银条细胞壁结构的完整,维持了银条较高硬度和较低失重率,提高了银条贮藏品质。总体上,10 ℃低温贮藏效果优于4 ℃。本研究结果为银条的低温贮藏保鲜提供了实验依据和理论参考。今后可进一步研究低温结合气调、生物保鲜剂、涂膜等复合保鲜方法对银条采后贮藏性的影响,以期延长银条贮藏期,提高银条的贮藏品质。
[1] 李惠文. 一根茎蔬成伊尹 偃师银条身价增[J].河南农业, 2011(17):21.
LI H W.Yanshi′s Stachys flordana Schuttl.ex Benth increases in value[J].Agriculture of Henan, 2011(17):21.
[2] 张书芳, 苏永恒, 叶冰, 等.银条营养成分分析[J].河南预防医学杂志, 2014, 25(6):453-454.
ZHANG S F, SU Y H, YE B, et al.Analysis of nutritional components of Stachys flordana Schuttl.ex Benth[J].Henan Journal of Preventive Medicine, 2014, 25(6):453-454.
[3] 顾思彤, 姜爱丽, 李宪民, 等.不同贮藏温度对软枣猕猴桃采后生理品质及抗氧化性的影响[J].食品与发酵工业, 2019, 45(13):178-184.
GU S T, JIANG A L, LI X M, et al.Effects of different storage temperatures on the postharvest physiological quality and antioxidant properties of Actinidia arguta[J].Food and Fermentation Industries, 2019, 45(13):178-184.
[4] 赵昱瑄, 张敏, 姜雪, 等.短时热处理对低温逆境下黄瓜不同部位的冷害及活性氧代谢影响[J].食品与发酵工业, 2020, 46(7):180-187.
ZHAO Y X, ZHANG M, JIANG X, et al.Effects of short time heat treatment on chilling injury and reactive oxygen metabolism in different parts of cucumber under low temperature[J].Food and Fermentation Industries, 2020, 46(7):180-187.
[5] 郭香凤, 史国安.低温和气调小包装处理对银条净菜保鲜品质的影响[J].食品科学, 2008, 29(8):612-616.
GUO X F, SHI G A.Effects of treatment of low-temperature combined with modified atmosphere package on fresh-keeping quality of minimally processed Stachys floridana Schuttl.ex Benth[J].Food Science, 2008, 29(8):612-616.
[6] 易军鹏, 李欣, 周卫利, 等.羧甲基壳聚糖复合涂膜的银条保鲜效果研究[J].食品与药品, 2005, 7(12):51-53.
YI J P, LI X, ZHOU W L, et al.Study on fresh-keeping of Stachys floridana Schuttl.ex Benth with carboxymethyl chitosan coating[J].Food and Drug, 2005, 7(12):51-53.
[7] 何庆, 郑素慧, 秦南南, 等.采前喷施水杨酸对红地球葡萄采后果实软化的影响[J].食品与发酵工业, 2022,48(4):16-23.
HE Q, ZHENG S H, QIN N N, et al.Effect of spraying salicylic acid to pre-harvest fruit on softening of postharvest Vitis vinifera L. cv. red globe[J].Food and Fermentation Industries, 2022,48(4):16-23.
[8] 黄怡, 高春丽, 毕阳, 等.低温贮藏期间梨果皮酚类物质及抗氧化性变化[J].食品与发酵工业, 2019, 45(19):219-226.
HUANG Y, GAO C L, BI Y, et al.Changes in phenolic compounds and antioxidant activity of pear peel during cold storage[J].Food and Fermentation Industries, 2019, 45(19):219-226.
[9] 刘云芬, 田天容, 殷菲胧, 等.赤霉素对鲜切莴苣酶促褐变及活性氧代谢的影响[J].食品与发酵工业, 2021, 47(19):215-220.
LIU Y F, TIAN T R, YIN F L, et al.Effects of gibberellin on enzymatic browning and reactive oxygen metabolism of fresh-cut lettuce[J].Food and Fermentation Industries, 2021, 47(19):215-220.
[10] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Experiment Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[11] 魏建梅, 齐秀东.采收期对京白梨果实细胞壁代谢及货架品质的影响[J].食品研究与开发, 2015,36(11):12-16;53.
WEI J M, QI X D.Effect of harvest date on cell wall metabolism and fruit quality of Jingbaili pear during shelf-life period[J].Food Research and Development, 2015, 36(11):12-16;53.
[12] 李佩艳, 尹飞, 党东阳, 等.草酸处理对桂七芒果冷害及细胞壁代谢的影响[J].核农学报, 2020, 34(12):2 742-2 748.
LI P Y, YIN F, DANG D Y, et al.Effect of oxalic acid treatment on chilling injury and cell wall metabolism of Guiqi mango[J].Journal of Nuclear Agricultural Sciences, 2020, 34(12):2 742-2 748.
[13] WEN X L, GU C Q, ZHU D X, et al.Water stress affects on cell membrane lipid oxidation and calcification of chestnut (Castanea mollissima Bl.)[J].Postharvest Biology and Technology, 2017, 126(1):34-39.
[14] JIN P, DUAN Y F, WANG L, et al.Reducing chilling injury of loquat fruit by combined treatment with hot air and methyl jasmonate[J].Food and Bioprocess Technology, 2014, 7(8):2 259-2 266.
[15] 张群, 周文化, 谭欢, 等.葡萄果肉组织的能量水平和细胞壁代谢对其自溶软化的影响[J].食品科学, 2018, 39(1):264-272.
ZHANG Q, ZHOU W H, TAN H, et al.Effects of energy level and cell wall metabolism on aril breakdown in grape fruits[J].Food Science, 2018, 39(1):264-272.
[16] GWANPUA S G, VAN BUGGENHOUT B, VERLINDEN B E, et al.Pectin modifications and the role of pectin-degrading enzymes during postharvest softening of Jonagold apples[J].Food Chemistry, 2014, 158:283-291.
[17] 王秀. 蓝莓果实采后软化与细胞壁代谢关系研究[D].南京:南京农业大学, 2014.
WANG X.Study on the relationship between postharvest softening and cell wall metabolism of blueberries[D].Nanjing:Nanjing Agricultural University, 2014.
[18] 陈莲. 低温引起橄榄果实冷害褐变的生理生化机制研究[D].福州:福建农林大学, 2006.
CHEN L.Physiological and biochemical mechanism of browning development induced by low temperature in Chinese olive fruit[D].Fuzhou:Fujian Agriculture and Forestry University, 2006.
[19] 郑剑英. 不同处理对低温下甘薯糖代谢、能量代谢和酚类代谢的调控研究[D].杭州:浙江农林大学, 2015.
ZHENG J Y.Physiological and biochemical changes in fresh-cut bamboo shoots (Phyllostachy pubescens) during preservation[D].Hangzhou:Zhejiang Agriculture and Forestry University, 2015.
[20] 李顺兴. 银条[J].河南农林科技, 1983(4):35.
LI S X.Stachys flordana Schuttl.ex Benth[J].Journal of Henan Agricultural Sciences, 1983(4):35.
[21] 李惠, 熊忠飞, 徐梦君, 等.龙薯九号甘薯冷害胁迫与适温贮藏品质调控[J].食品科技, 2018, 43(12):37-42.
LI H, XIONG Z F, XU M J, et al.Study on chilling injury and the optimum storage temperature of Longshu No.9[J].Food Science and Technology, 2018, 43(12):37-42.
[22] 梁莉, 程晨, 张柳茵, 等.温度对南瓜采后贮藏特性的影响[J].北方园艺, 2015(24):131-134.
LIANG L, CHENG C, ZHANG L Y, et al.Effect of different temperatures on the changes of pumpkin storage characteristics[J].Northern Horticulture, 2015(24):131-134.
[23] 吕真真, 刘慧, 张春岭, 等.1-甲基环丙烯和不同贮藏温度对油桃果实硬度与细胞壁果胶的影响[J].食品工业科技, 2021, 42(7):317-323.
LYU Z Z, LIU H, ZHANG C L, et a1.Effects of 1-methylcyclopropene and different ambient temperature on firmness and cell wall pectin in postharvest nectarine[J].Science and Technology of Food Industry, 2021, 42(7):317-323.
[24] LIU H, CHEN F S, LAI S J, et a1.Effects of calcium treatment and low temperature storage on cell wall polysaccharide nanostructures and quality of postharvest apricot (Prunus armeniaca)[J].Food Chemistry, 2017, 225:87-97.
[25] HOLLAND N, DA SILVA NUNES F L, DANTAS DE MEDEIROS I U, et al.High-temperature conditioning induces chilling tolerance in mandarin fruit:A cell wall approach[J].Journal of the Science of Food and Agriculture, 2012, 92(15):3 039-3 045.
[26] 梁洁玉, 朱丹实, 赵丽红, 等.低温贮藏李子细胞壁酶活性变化对果胶降解的影响[J].现代食品科技, 2015, 31(5):212-218.
LIANG J Y, ZHU D S, ZHAO L H, et al.Effect of changes in cell wall enzyme activity on degradation of pectin during low-temperature storage of plum[J].Modern Food Science and Technology, 2015, 31(5):212-218.
[27] 陈杰忠, 叶自行, 周碧燕, 等.柑橘果皮果胶及其酶活性对皱皮果形成的影响[J].园艺学报, 2005, 32(2):202-206.
CHEN J Z, YE Z X, ZHOU B Y, et al.Effects of pectins and pectinesterase activity on creasing fruit formation in orange (Citrus sinensis osbeck)[J].Acta Horticulturae Sinica, 2005, 32(2):202-206.
[28] 孔祥佳, 任思琪, 林河通, 等.不同成熟度橄榄果实冷藏期间细胞壁代谢对采后冷害的响应特性[J].食品科学, 2018, 39(3):229-235.
KONG X J, REN S Q, LIN H T, et al.Characteristics of cell wall metabolism of harvested Chinese olive fruits with different maturities in response to chilling injury during cold storage[J].Food Science, 2018, 39(3):229-235.
[29] CARVAJAL F, PALMA F, JAMILENA M, et al.Cell wall metabolism and chilling injury during postharvest cold storage in zucchini fruit[J].Postharvest Biology and Technology, 2015, 108:68-77.
[30] CHEN Y H, HUNG Y C, CHEN M Y, et al.Effects of acidic electrolyzed oxidizing water on retarding cell wall degradation and delaying softening of blueberries during postharvest storage[J].LWT, 2017, 84:650-657.