高尿酸血症指的是一种体内尿酸水平异常的代谢紊乱性疾病。造成尿酸水平异常的原因一般有2种,一种是嘌呤代谢紊乱造成的尿酸生成过多,另一种是尿酸在肾、肝排泄受到阻碍造成尿酸的沉积。当高尿酸血症发展到一定程度造成尿酸在关节处堆积,进而发展成为痛风,同时引起多种炎症的发生[1]。目前高尿酸与痛风的防治药物主要有三类。一类是抑制尿酸生成类药物,例如别嘌呤醇、非布司他等;一类是促进尿酸排泄类药物,例如苯溴马隆、丙磺舒等;还有一类是缓解痛风的消炎止痛类药物秋水仙碱等。这些药物在发挥作用的同时往往会对肝肾造成损伤,针对本身兼患肝病、肾病的患者更需要严格把控用量。除此之外,高尿酸血症的防治离不开饮食干预,研究开发出能够辅助治疗高尿酸血症与痛风的功能性食品十分必要[2]。
壳寡糖是由β-1-4糖苷键连接组成的碱性氨基低聚糖,一般通过降解壳聚糖获得[3]。壳寡糖具有多种生物活性,例如:降脂、抗氧化、提高免疫力等,近年来被广泛应用于食品、化妆品产业,并已被发现具有降低酵母联合嘌呤致高尿酸血症小鼠的血清尿酸的作用[4-5]。除此之外,在高尿酸血症大鼠模型中,低剂量的樱桃粉可以通过降低腺苷脱氨酶的活性缓解高尿酸血症[6]。研究表明鹅肌肽与人参皂苷联合可以促进高尿酸血症小鼠尿酸排泄[7]。茯苓则被证实可以通过上调ABCG2的基因与蛋白表达调节高尿酸血症[8]。在此基础上,通过一定比例优化制成了由4种主要活性成分组成的壳寡糖复合固体饮料“壳酸平”(ke suan ping,KSP)。
尿酸转运蛋白1(urate transporter 1,URAT1)、葡萄糖转运蛋白9(glucose transporter type 9,GLUT9)是尿酸排泄过程中的关键转运蛋白。ATP结合盒亚家族G成员2(ATP-binding cassette sub-family G member 2,ABCG2)是与尿酸排泄有关的蛋白编码基因。研究表明高尿酸血症患者URAT1、GLUT9表达异常升高,可以通过抑制其表达缓解高尿酸血症[9]。ABCG2表达异常降低,可以通过上调其表达促进尿酸排泄[10],且部分原发性高尿酸血症患者其URAT1、GLUT9、ABCG2等的表达可能存在异常[11]。本文将通过探究壳寡糖复合固体饮料KSP对高尿酸血症的影响,为高尿酸血症及痛风的防治提供新的食源性方案。
1 材料与方法
1.1 材料与试剂
别嘌呤醇,上海麦克林生化科技有限公司;酵母膏,北京索莱宝科技有限公司;壳寡糖复合固体饮料(壳酸平),新优蓝健康科技有限公司;氧嗪酸钾,阿拉丁试剂上海有限公司;尿酸、肌酐、尿素氮、黄嘌呤氧化酶(xanthione oxidase,XOD)活性检测试剂盒,南京建成生物工程研究所;KM小鼠,(20±2) g,SPF级雄性,中国食品药品检定研究院(大兴);多聚甲醛,分析纯,天津市江天化工技术有限公司;Trizol试剂,美国Ambion公司;M-MLV逆转试剂,美国Promega公司;SYBR Green试剂,德国DBI Bioscience公司。
1.2 仪器与设备
85-2型恒温磁力搅拌器,天津市华仪鑫达仪表有限公司;DK-8D型电热恒温水槽,上海一恒科技有限公司;H1650-W台式微量高速离心机,湖南湘仪实验室仪器开发有限公司;Legend Micro 17R Thermo离心机,赛默飞世尔科技公司;UV mini-1240紫外分光光度计,日本SHIMADZU(岛津)公司;SpecturaMax190全波长酶标仪,美国分子仪器公司;TP-24组织匀浆仪,杰灵仪器制造(天津)有限公司;BSA223S电子天平,德国赛多利斯(Sartorius)公司;ND-100C核酸定量仪,杭州米欧(MIULAB)仪器有限公司;BX53 正置荧光显微镜,日本Olympus公司;Stepone Plus实时荧光定量PCR仪,美国ABI公司。
1.3 实验方法
1.3.1 小鼠实验
60只昆明小鼠随机分为6组,每组10只,包括阴性对照组(negative group,NC)、高尿酸模型组(model group,M)、低剂量壳酸平组(low-dose KSP group,LKSP)、中剂量壳酸平组(middle-dose KSP group,MKSP)、高剂量壳酸平组(high-dose KSP group,HKSP)、别嘌呤醇组(allopurinol group,AP)。适应性喂养1周,饲养条件为:(24±2) ℃,12 h光照,12 h黑暗,自由摄食与饮水。正式实验开始后将LKSP、MKSP、HKSP组小鼠饲料更换为含1.6%、2.6%、3.6% KSP的饲料,对应活性成分壳寡糖的含量为150、250、350 mg/(kg·d)。除NC组小鼠,其余小鼠每天腹腔注射300 mg/kg氧嗪酸钾,同时灌胃10 g/kg酵母膏。1 h后AP组小鼠灌胃30 mg/kg别嘌呤醇,M组灌胃对应的磷酸缓冲盐溶液(phosphate buffer saline,PBS)。实验周期为21 d,所有小鼠自由饮水,除KSP组小鼠均正常饮食。最后一天摘眼球取血后,脱臼断颈处死小鼠。解剖取小鼠肝、肾、小肠置于液氮速冻。取部分肝肾组织生理盐水清洗后,置于10%多聚甲醛溶液固定。所有动物实验操作严格遵守实验伦理有关原则和要求。
1.3.2 血清理化指标检测
血液样品室温3 000 r/min离心15 min,吸取上清液置于4 ℃备用,按照尿酸、肌酐、尿素氮、XOD活性检测试剂盒说明书分别进行测定。
1.3.3 HE染色
固定好的肝肾组织经过PBS充分清洗后,使用梯度乙醇浸泡脱水,二甲苯透明。利用石蜡包埋组织,待石蜡冷却后切片,切片厚度4 μm。水浴展片后固定在载玻片上,烤片后进行HE染色。利用正置荧光显微镜放大10倍观察。
1.3.4 q-PCR
剪取适量小鼠组织,预冷研钵,加入1 mL Trizol研磨,收集至1.5 mL EP管内。或者直接置于1.5 mL EP管加入1 mL Trizol利用组织匀浆仪研磨。研磨后加入预冷的200 μL三氯甲烷冰上静置5 min,4 ℃ 12 500 r/min离心12 min。收集上清液加入等体积的异丙醇-20 ℃静置1 h后,再次离心,弃上清液。加入75%(体积分数)乙醇再次离心,待乙醇挥发后加入焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水溶解定量。按照逆转录试剂说明书将RNA逆转为cDNA。逆转体系为25 μL,包括RNA 2 μg、随机引物5 μL、dNTP 5 μL、M-Mlv RT 1 μL、M-Mlv 5×buffer 5 μL、RNA inhibitor 0.625 μL,其余用DEPC水补足。按SYBR Green试剂说明书配制20 μL PCR反应体系,包括DEPC水7.6 μL、SYBR Green Master Mix 10 μL、ROX 0.4 μL、引物1 μL(上下游引物各0.5 μL)、cDNA模板1 μL。q-PCR条件为:保持阶段(95 ℃ 2 min)、循环阶段(95 ℃ 10 s、60 ℃ 30 s)、溶解曲线阶段(95 ℃ 1 min、55 ℃ 1 min、95 ℃ 15 s 阶升0.3 ℃)、循环数40个。内参基因为GAPDH,算法为2-ΔΔCT,特异性引物序列如表1所示。
表1 q-PCR特异性引物序列
Table 1 The specific primer sequence of q-PCR
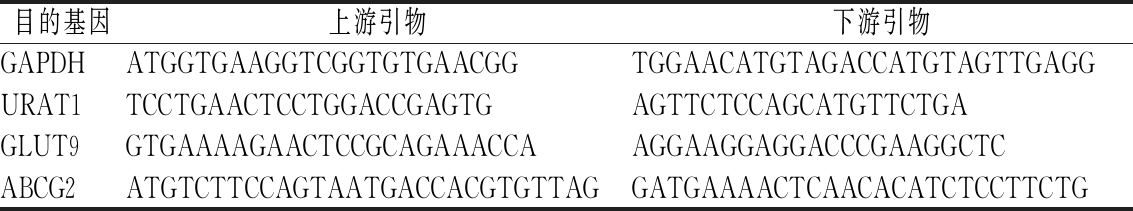
目的基因上游引物下游引物GAPDHATGGTGAAGGTCGGTGTGAACGGTGGAACATGTAGACCATGTAGTTGAGGURAT1TCCTGAACTCCTGGACCGAGTGAGTTCTCCAGCATGTTCTGAGLUT9GTGAAAAGAACTCCGCAGAAACCAAGGAAGGAGGACCCGAAGGCTCABCG2ATGTCTTCCAGTAATGACCACGTGTTAGGATGAAAACTCAACACATCTCCTTCTG
1.4 数据统计
实验数据利用Graph Pad Prism 5.0进行处理。结果表示为Mean±SD,采用One-Way ANOVA进行组间差异分析,当P<0.05时表示为“*”、当P<0.01时表示为“**”、当P<0.001时表示为“***”,且当P<0.05时就认为存在统计学差异。
2 结果与分析
2.1 KSP可降低高尿酸血症小鼠血清中尿酸及XOD活性
如图1-a所示,与NC组相比,M组小鼠血清中尿酸(uric acid,UA)含量显著升高(P<0.001)。与M组相比,HKSP组的UA含量显著降低(P<0.01),AP组也显著降低(P<0.001)。与NC组相比,LKSP组与MKSP组的UA含量均显著升高,但差异逐渐减小,HKSP组的UA与NC组无显著差异。此结果显示KSP可以显著降低UA。
XOD可以催化次黄嘌呤转化为黄嘌呤,同时可以催化黄嘌呤直接产生尿酸,是尿酸生成的关键酶[12]。如图1-b所示,与NC组相比,M组血清XOD酶活显著升高(P<0.001)。与M组相比,HKSP组XOD酶活显著降低(P<0.01),AP组XOD酶活极显著降低(P<0.001)。与NC组相比,HKSP组XOD酶活显著升高(P<0.001)。此结果显示,KSP可以使高尿酸血症小鼠异常升高的XOD酶活得以降低,但不能使其恢复到正常水平。二者结果结合来看,KSP可以通过降低XOD酶活发挥降尿酸作用。
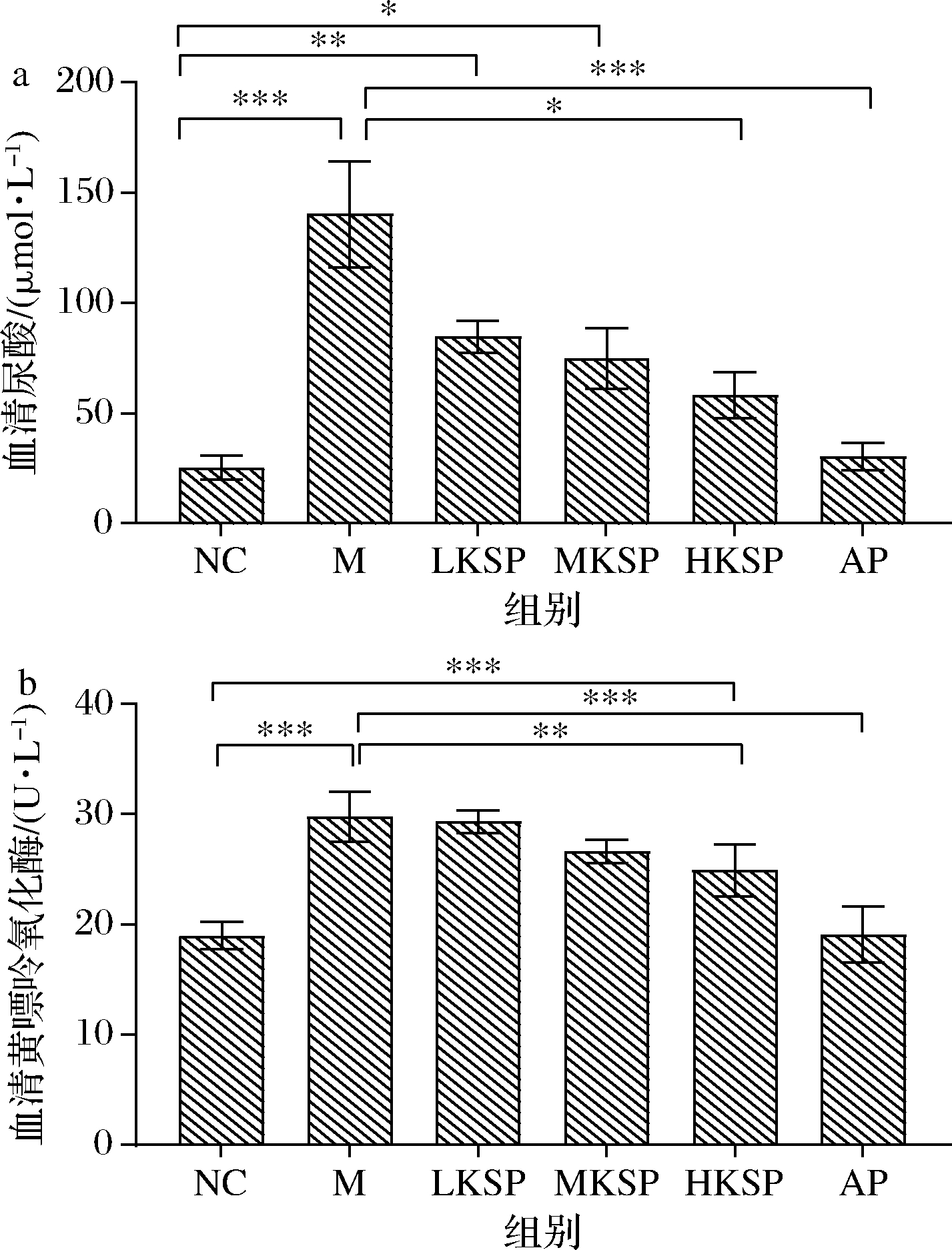
a-血清尿酸;b-血清XOD活性
图1 KSP对高尿酸血症小鼠血清尿酸和XOD活性的影响
Fig.1 Effect of KSP in the serum UA and XOD of hyperuricemia mice
2.2 KSP可缓解高尿酸血症小鼠肝肾损伤
当肾功能不全,肾小球的滤过功能异常时,血清尿素氮(urine urea nitrogen,BUN)会异常上升。如图2-a所示,相比于NC组,M组血清BUN含量显著升高(P<0.001)。相比于M组,LKSP、MKSP组血清BUN含量没有明显变化,HKSP组血清BUN显著升高(P<0.05),AP组血清BUN极显著升高(P<0.001)。除此之外,相比于NC组,LKSP组血清BUN含量仍显著升高(P<0.05)。此结果说明了高剂量的KSP不能改善肾功能异常,低剂量的KSP虽然有一定效果但是也不能完全减低由高尿酸血症引起的血清BUN含量异常。
血清肌酐(creatinine,CR)经肾小球滤过以后完全进入原尿,不会被肾小管重吸收,因此血清CR也是评价肾功能异常的指标。如图2-b所示,相比于NC组,M组血清CR显著升高(P<0.01),HKSP组血清CR极显著降低(P<0.001),且随着KSP的剂量加大血清CR降低。相比于NC组,LKSP组血清CR仍显著升高(P<0.01),AP组血清CR极显著升高(P<0.001),甚至比M组更显著。此结果显示,KSP可以加强肾小管的滤过作用,促进血清CR的排泄。
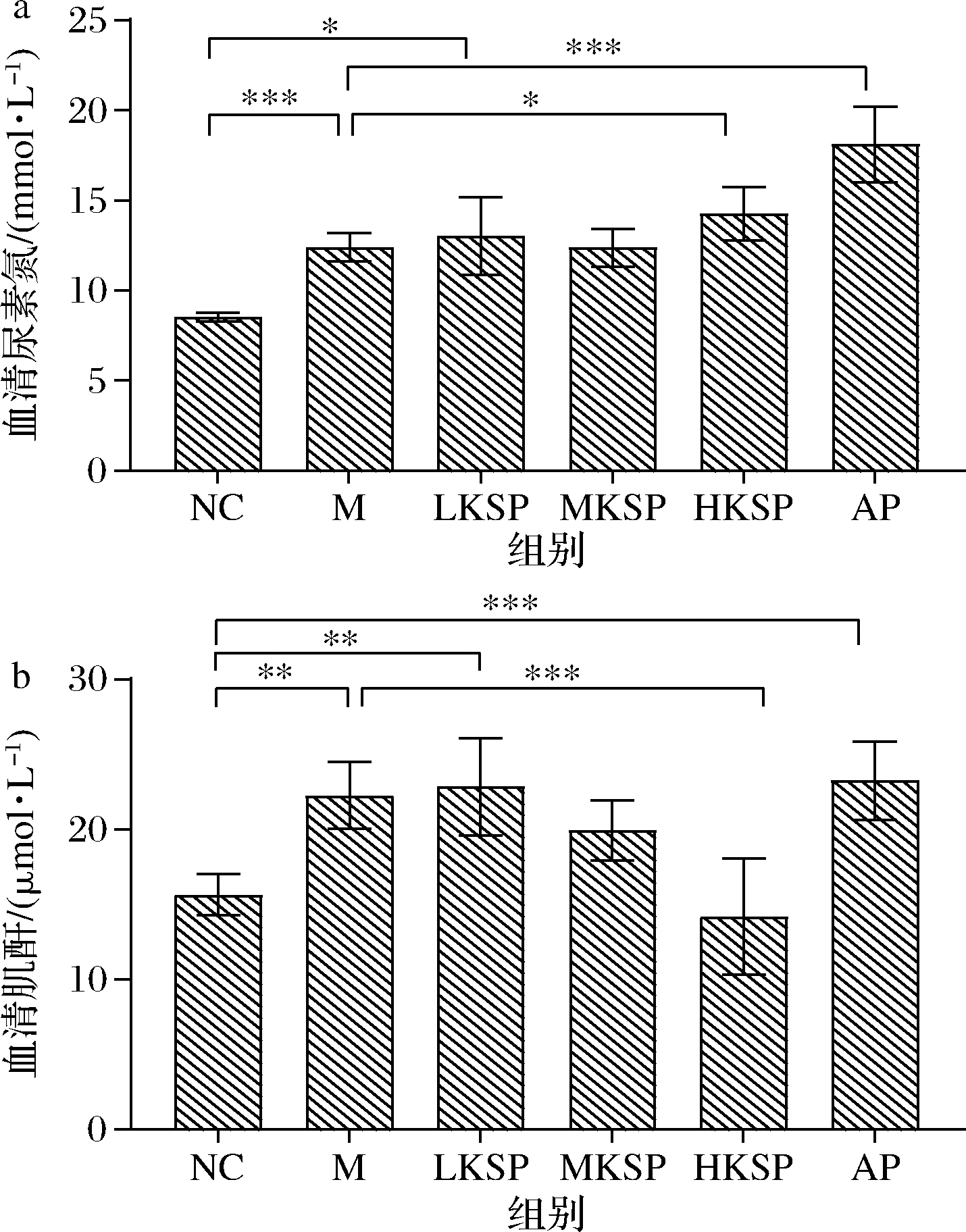
a-血清尿酸氮;b-血清肌酐
图2 KSP对高尿酸血症小鼠血清尿素氮和肌酐的影响
Fig.2 Effect of KSP in the serum BUN and CR of hyperuricemia mice
肝脏HE染色结果如图3所示。由图3可知,NC组小鼠肝板细胞排列紧密,肝小叶结构清晰。相比于NC组,M组肝板细胞体积变小,部分细胞核消失,细胞质溶解,从整体来看肝窦无规律性扩张,肝索结构被破坏。相比于M组,KSP处理组均有一定改善,HKSP组效果较好。AP组肝组织HE染色结果与M组无明显差异,细胞松散排列,肝窦粗且部分区域肝索消失。此结果证明KSP可以缓解高尿酸血症引起的肝脏损伤。
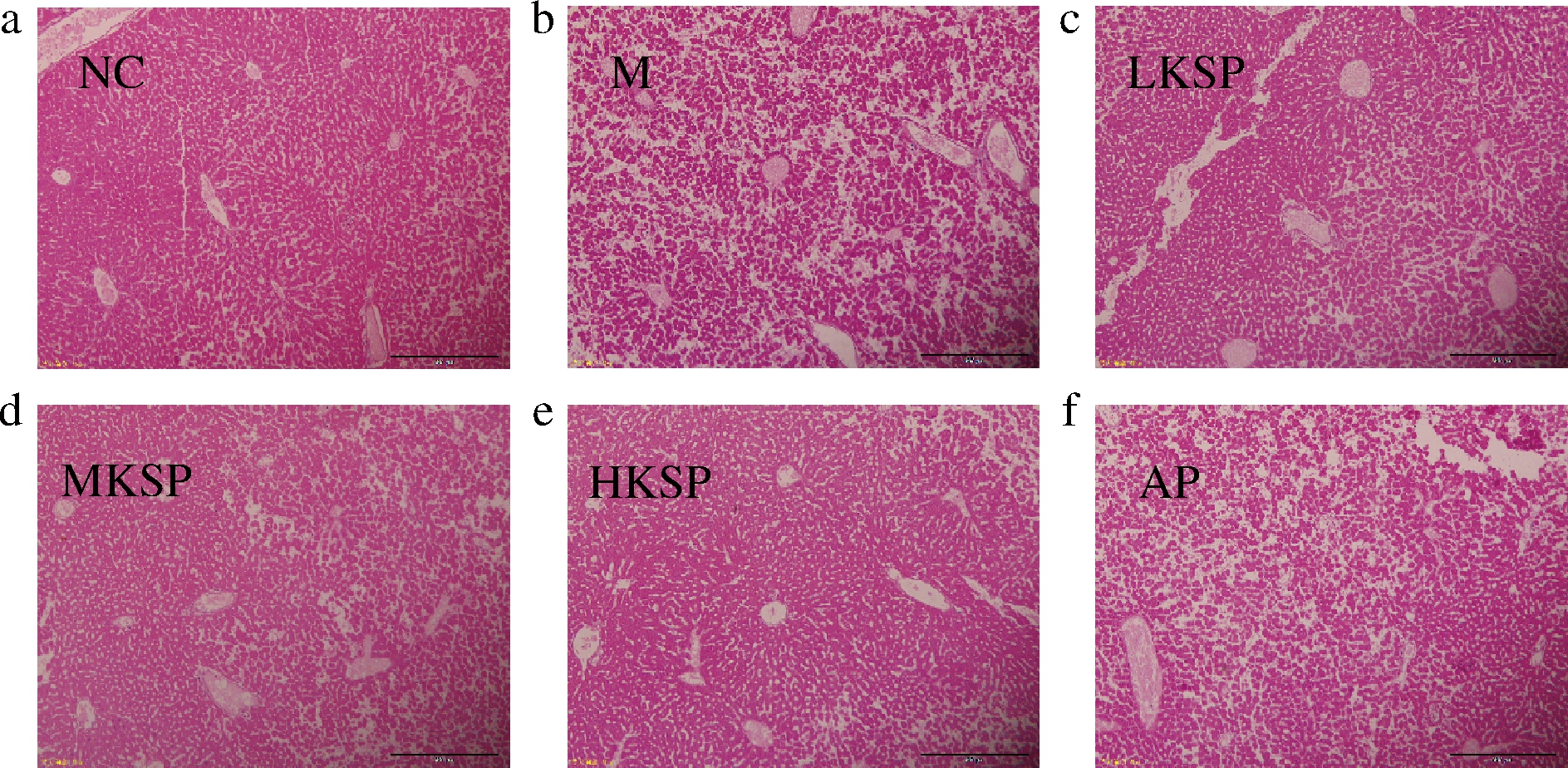
a-阴性对照组;b-模型组;c-低剂量KSP组;d-中剂量KSP组;e-高剂量KSP组;f-别嘌呤醇阳性对照组
图3 高尿酸血症小鼠肝脏组织HE染色结果(10×)
Fig.3 Results of HE staining in the liver tissue of hyperuricemia mice(10×)
肾脏HE染色结果如图4所示。NC组细胞呈圆形,大小均一,排列紧密。相比于NC组,M组肾细胞形态发生巨大变化,部分细胞伸长,部分细胞体积变小,整体排列无规律,且部分细胞细胞膜消失,完全坏死。相比于M组,随着KSP剂量增加,肾细胞形态趋于正常。MKSP与HKSP效果显著。与M组相比,AP组细胞大面积坏死,坏死组织周围存在大量炎细胞。肾脏HE染色结果显示KSP可以缓解高尿酸血症引起的肾脏损伤,AP进一步加剧了这种肾损伤。

a-阴性对照组;b-模型组;c-低剂量KSP组;d-中剂量KSP组;e-高剂量KSP组;f-别嘌呤醇阳性对照组
图4 高尿酸血症小鼠肾脏组织HE染色结果(10×)
Fig.4 Results of HE staining in the kidney tissue of hyperuricemia mice(10×)
2.3 KSP的降尿酸作用与抑制URAT1/GLUT9基因表达有关
URAT1的q-PCR结果如图5-a所示,相比于NC组,M组URAT1的 RNA水平显著升高(P<0.05)。相比于M组,LKSP组URAT1的 RNA水平显著降低(P<0.01),MKSP、HKSP组与LKSP组没有明显差异,均能显著降低URAT1的RNA水平。相比于NC组,MKSP组URAT1的RNA水平与NC组也存在显著性差异(P<0.05)。GLUT9的q-PCR结果如图5-b所示,相比于NC组,M组GLUT9的RNA水平显著升高(P<0.001)。相比于M组,HKSP组的RNA水平显著降低(P<0.001)。LKSP、MKSP组GLUT9的表达水平也有所下降,但差异没有HKSP组明显,并且与NC组相比,仍显著升高,但这种差异随着KSP的剂量增加而减小。ABCG2的q-PCR结果如图5-c所示,相比于NC组,M组ABCG2的表达水平下降,但无显著性差异。与M组相比,KSP处理组ABCG2的表达水平均没有显著变化,MKSP、HKSP组ABCG2的表达水平有上升趋势,但无显著差异。但由图5可知,与NC组相比,MKSP、HKSP的ABCG2的表达水平也没有显著差异。总而言之,由图5可知,KSP可以调节URAT1、GLUT9、ABCG2的RNA水平,使其恢复到正常水平。

a-URAT1 mRNA表达水平;b-GLUT9 mRNA表达水平;c-ABCG2 mRNA表达水平
图5 KSP对高尿酸血症小鼠肾脏URAT1、GLUT9和小肠ABCG2基因表达的影响
Fig.5 Effect of KSP on the expression of URAT1 and GLUT9 in kidney and ABCG2 in small intestine in hyperuricemia mice
3 讨论与结论
研究表明菊粉(9.5 g/kg)可以降低尿酸酶(urate oxidase,UOX)敲除小鼠体内XOD的活性[13];黄芩素(200 mg/kg)可以通过抑制XOD和促进尿酸排泄治疗高尿酸血症[14];咖啡酰奎宁酸可以与XOD产生相互作用从而缓解高尿酸血症[15]。嘌呤代谢紊乱造成UA生成异常,通过抑制XOD可以抑制黄嘌呤转化为UA从而缓解高尿酸血症。在本研究中,KSP同样可以通过抑制XOD活性缓解高尿酸血症,这为KSP发挥降尿酸作用的具体途径研究提供了支持。
肝损伤促进肝功能的衰竭,炎症可诱导急性或者慢性肝功能衰竭[16]。高尿酸血症发展为痛风会伴随着炎症的发生。研究表明芹菜醇通过抑制NLRP3炎症小体的激活可以减轻脂多糖诱导的肝损伤与尿酸钠诱导的痛风性关节炎[17]。这说明肝损伤与炎症具有密切联系[18-19]。在本研究中,高尿酸血症小鼠肝损伤严重,AP组无法对肝脏损伤起到缓解作用。KSP可以缓解由于高尿酸血症造成的肝损伤,这在一定程度上证明了KSP可能会通过缓解肝损伤抑制炎症的发生进一步降低高尿酸血症发展为痛风的可能。除此之外,大约2/3的尿酸排泄依靠肾脏,肾功能损伤会进一步加剧高尿酸血症[20]。KSP可以缓解肾脏损伤并进一步恢复血清BUN、CR至正常水平,这表明KSP可以在降尿酸的同时发挥维护肾功能的作用。
URAT1(SLC22A12)作为评价高尿酸血症的标志性基因,其常见和罕见功能障碍变体显著降低了痛风风险[21]。相比于M组,URAT1受KSP调节其表达水平下降。这表明KSP可以通过促进UA排泄缓解高尿酸血症。然而,值得注意的是KSP处理组的URAT1 mRNA水平比NC组还要低。已有文献表明:URAT1的转录表达主要会受到糖皮质激素受体、雌激素受体等核受体的调控[22-23]。此前已经发现壳寡糖可以抑制SMYD3的表达进而调控糖脂代谢紊乱[24],而SMYD3则是糖皮质激素受体、雌激素受体重要的转录辅助因子[25-27],高尿酸血症与糖脂代谢紊乱也有着紧密的联系[28]。因此,本研究推测KSP很可能是通过对SMYD3的调节从而影响了核受体对URAT1的转录调控。事实上,本研究也已经在实验中检测看到了KSP对SMYD3的转录抑制效应,后续也将对具体分子机制展开进一步的深入研究。
GLUT9以电原性和电压依赖性的方式转运尿酸盐以维持UA的正常水平[29]。本研究中,GLUT9的表达同样受KSP调节,其结果与多数降尿酸物质一致。例如白藜芦醇(40 mg/kg)可以通过抑制GLUT9 mRNA与蛋白的表达降UA[30],岩藻多糖(25 μg/mL)可以降低UA刺激的HK-2细胞中GLUT9、URAT1的表达[31]。相比于URAT1、GLUT9,ABCG2不仅在肾近端小管表达,也在小肠和肝脏的上皮细胞顶端膜表达,可以通过激活ABCG2增强肠道尿酸排泄[32]。KSP可增强ABCG2的表达调节高尿酸血症,但没有显著性差异,其调节效果不如URAT1、GLUT9。
综上所述,KSP可以发挥降尿酸作用,缓解高尿酸血症带来的肝肾损伤以及调节尿酸排泄相关转运蛋白URAT1、GLUT9、ABCG2等的表达。但是KSP的调节作用也具有一定局限性。比如高剂量的KSP虽然降尿酸作用更为明显,但是其对BUN的调节并没有存在剂量依赖,低剂量的KSP就能显著降低URAT1的表达,以及其对ABCG2的调节没有显著性差异,所以KSP的用量范围仍然值得探究。尽管如此,KSP的应用价值不容忽视,其降尿酸作用以及对肝肾的保护作用为其应用于辅助治疗高尿酸血症与痛风提供了可能。
[1] PUNZI L, SCANU A, GALOZZI P, et al.One year in review 2020:Gout[J].Clinical and Experimental Rheumatology, 2020, 38(5):807-821.
[2] 孙珊珊, 曲连悦, 杜荣蓉, 等.高尿酸血症药物治疗研究进展[J].中国临床药理学与治疗学, 2019, 24(5):589-594.
SUN S S, QU L Y, DU R R, et al.Research progress on drug therapy of hyperuricemia[J].Chinese Journal of Clinical Pharmacology and Therapeutics, 2019, 24(5):589-594.
[3] 杨靖亚, 郑雯静, 李诗怡.壳寡糖的制备及生物活性研究进展[J].国际药学研究杂志, 2020, 47(7):502-507.
YANG J Y, ZHENG W J, LI S Y.Preparation and bioactivity of chitosan oligosaccharide:Research advances[J].Journal of International Pharmaceutical Research, 2020, 47(7):502-507.
[4] 孙晨松, 王硕, 王一迪, 等.壳寡糖功能特性研究进展[J].食品工业科技, 2021, 42(16):438-446.
SUN C S, WANG S, WANG Y D, et al.Research progress on the functional characteristics of chitooligosaccharides[J].Science and Technology of Food Industry, 2021, 42(16):438-446.
[5] 刘洋, 韩宝芹, 刘万顺, 等.壳寡糖对酵母联合腺嘌呤致高尿酸血症小鼠的治疗作用[J].中国海洋大学学报(自然科学版), 2009,39(S1):143-146.
LIU Y, HAN B Q, LIU W S, et al.Effects of chitooligosaccharide on the mice hyperuricemia model induced by yeast and adenine[J].Periodical of Ocean University of China, 2009,39(S1):143-146.
[6] LI R R, TAN Y F, LI Y X, et al.Effects of tart cherry powder on serum uric acid in hyperuricemia rat model[J].Evidence-Based Complementary and Alternative Medicine ECAM, 2020, 2020:1454305.
[7] ZHANG Y L, SU H, ZHANG J, et al.The effects of ginsenosides and anserine on the up-regulation of renal aquaporins 1-4 in hyperuricemic mice[J].The American Journal of Chinese Medicine, 2019, 47(5):1 133-1 147.
[8] LIANG D L, YONG T Q, DIAO X, et al.Hypouricaemic and nephroprotective effects of Poria cocos in hyperuricemic mice by up-regulating ATP-binding cassette super-family G member 2[J].Pharmaceutical Biology, 2021, 59(1):275-284.
[9] WANG Z, CUI T, CI X Y, et al.The effect of polymorphism of uric acid transporters on uric acid transport[J].Journal of Nephrology, 2019, 32(2):177-187.
[10] LU Y H, CHANG Y P, LI T, et al.Empagliflozin attenuates hyperuricemia by upregulation of ABCG2 via AMPK/AKT/CREB signaling pathway in type 2 diabetic mice[J].International Journal of Biological Sciences, 2020, 16(3):529-542.
[11] KUBOTA M.Hyperuricemia in children and adolescents:Present knowledge and future directions[J].Journal of Nutrition and Metabolism, 2019, 2019:3480718.
[12] 王爱华, 金玥, 吴越, 等.具有黄嘌呤氧化酶抑制作用的中药及中成药治疗高尿酸血症研究进展[J].天津中医药, 2019, 36(12):1 241-1 245.
WANG A H, JIN Y, WU Y, et al.Research progress on treatment of gout by xanthine oxidase inhibitor in traditional Chinese medicine[J].Tianjin Journal of Traditional Chinese Medicine, 2019, 36(12):1 241-1 245.
[13] GUO Y J, YU Y N, LI H L, et al.Inulin supplementation ameliorates hyperuricemia and modulates gut microbiota in Uox-knockout mice[J].European Journal of Nutrition, 2021, 60(4):2 217-2 230.
[14] CHEN Y Y, ZHAO Z, LI Y M, et al.Baicalein alleviates hyperuricemia by promoting uric acid excretion and inhibiting xanthine oxidase[J].Phytomedicine, 2021, 80:153374.
[15] WAN Y, QIAN J, LI Y Z, et al.Inhibitory mechanism of xanthine oxidase activity by caffeoylquinic acids in vitro[J].International Journal of Biological Macromolecules, 2021, 184:843-856.
[16] ZACCHERINI G, WEISS E, MOREAU R.Acute-on-chronic liver failure:Definitions, pathophysiology and principles of treatment[J].JHEP Reports, 2021, 3(1):100176.
[17] YAN C Y, OUYANG S H, WANG X, et al.Celastrol ameliorates Propionibacterium acnes/LPS-induced liver damage and MSU-induced gouty arthritis via inhibiting K63 deubiquitination of NLRP3[J].Phytomedicine, 2021, 80:153398.
[18] ZHAO M, LIU S Y, WANG C S, et al.Mesenchymal stem cell-derived extracellular vesicles attenuate mitochondrial damage and inflammation by stabilizing mitochondrial DNA[J].ACS Nano, 2021, 15(1):1 519-1 538.
[19] ALJOBAILY N, VIERECKL M J, HYDOCK D S, et al.Creatine alleviates doxorubicin-induced liver damage by inhibiting liver fibrosis, inflammation, oxidative stress, and cellular senescence[J].Nutrients, 2020, 13(1):41.
[20] JOO H J, KIM G R, CHOI D W, et al.Uric acid level and kidney function:A cross-sectional study of the Korean national health and nutrition examination survey (2016—2017)[J].Scientific Reports, 2020, 10:21672.
[21] TOYODA Y, KAWAMURA Y, NAKAYAMA A, et al.Substantial anti-gout effect conferred by common and rare dysfunctional variants of URAT1/SLC22A12[J].Rheumatology, 2021, 60(11):5 224-5 232.
[22] LI G T, HAN L F, MA R C, et al.Glucocorticoids increase renal excretion of urate in mice by downregulating urate transporter 1[J].Drug Metabolism and Disposition:the Biological Fate of Chemicals, 2019, 47(11):1 343-1 351.
[23] MATSUBAYASHI M, SAKAGUCHI Y M, SAHARA Y, et al.27-Hydroxycholesterol regulates human SLC22A12 gene expression through estrogen receptor action[J].The FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2021, 35(1):e21262.
[24] WANG Q T, JIANG Y J, LUO X G, et al.Chitooligosaccharides modulate glucose-lipid metabolism by suppressing SMYD3 pathways and regulating gut microflora[J].Marine Drugs, 2020, 18(1):69.
[25] LUO X G, XI T, GUO S, et al.Effects of SMYD3 overexpression on transformation, serum dependence, and apoptosis sensitivity in NIH3T3 cells[J].IUBMB Life, 2009, 61(6):679-684.
[26] LUO X G, DING Y, ZHOU Q F, et al.SET and MYND domain-containing protein 3 decreases sensitivity to dexamethasone and stimulates cell adhesion and migration in NIH3T3 cells[J].Journal of Bioscience and Bioengineering, 2007, 103(5):444-450.
[27] KIM H, HEO K, KIM J H, et al.Requirement of histone methyltransferase SMYD3 for estrogen receptor-mediated transcription[J].Journal of Biological Chemistry, 2009, 284(30):19 867-19 877.
[28] RAFIULLAH M, SIDDIQUI K, AL-RUBEAAN K.Association between serum uric acid levels and metabolic markers in patients with type 2 diabetes from a community with high diabetes prevalence[J].International Journal of Clinical Practice, 2020, 74(4):e13466.
[29] CHEN Y Y, ZHAO Z, LI Y M, et al.Characterizations of the urate transporter, GLUT9, and its potent inhibitors by patch-clamp technique[J].SLAS Discovery, 2021, 26(3):450-459.
[30] LI L, LI Y M, LUO J, et al.Resveratrol, a novel inhibitor of GLUT9, ameliorates liver and kidney injuries in a D-galactose-induced ageing mouse model via the regulation of uric acid metabolism[J].Food & Function, 2021, 12(18):8 274-8 287.
[31] ZHANG Y, TAN X H, LIN Z, et al.Fucoidan from Laminaria japonica inhibits expression of GLUT9 and URAT1 via PI3K/Aat, JNK and NF-κB pathways in uric acid-exposed HK-2 cells[J].Marine Drugs, 2021, 19(5):238.
[32] 姬志祥, 蓝常贡.尿酸盐转运蛋白在痛风中的多态性和治疗相关性[J].中国组织工程研究, 2021, 25(8):1 290-1 298.
JI Z X, LAN C G.Polymorphism of urate transporter in gout and its correlation with gout treatment[J].Chinese Journal of Tissue Engineering Research, 2021, 25(8):1 290-1 298.