黑色素瘤是一种恶性皮肤肿瘤,它主要是由于皮肤的黑色素细胞发生恶变所导致的,它具有发病率高、致死率高的特点。据统计,在我国,黑色素瘤的发病率在持续增长,年增长率大约为3%~5%,而年新增病例近2万[1]。目前,全球每年死于恶性黑色素瘤[2]的人数高达55 000人,约占皮肤癌总致死数的90%[3]。另外,其恶性程度高、易转移,50%~80%的晚期黑色素瘤会出现肺转移,8%~46%的黑色素瘤病人则会发生脑部转移[4],愈后较差,日益成为威胁人民群众生命健康的重要问题。
目前,肿瘤治疗有多种方法,如外科手术治疗、化疗、靶向治疗、免疫治疗。其中,免疫检查点抑制疗法在肿瘤治疗中取得了很大的进步,已经普遍应用于黑色素瘤、肾细胞癌、非小细胞肺癌等实体瘤的临床治疗。但受到个体免疫情况差异的影响,目前有70%~80%的患者并不能很好地响应免疫检查点疗法[5-6]。因此预测和开发增强免疫检查点阻断疗效的方法具有重要意义。
在黑色素瘤及其他恶性肿瘤的治疗过程中,随着免疫检查点抑制剂的广泛应用,越来越多的科学家致力于探索肠道菌群与免疫检查点抑制剂之间的作用关系[7-10],其中,有学者在小鼠体中发现两者之间的关系[11-13],也有学者研究了在临床上,肠道菌群是如何影响免疫检查点治疗的[14-15]。近期又有一些关于肠道免疫和免疫检查点疗法的研究表明,益生菌可以通过调控肠道菌群影响肿瘤的免疫治疗结果。因此,开发可通过调控肠道菌群而增加免疫检查点阻断疗法治疗效率的益生菌在改善抗肿瘤治疗的策略中有重要意义。
本实验室保藏的假小链双歧杆菌W112在前期研究中表现出抗氧化、调节肠道菌群和调节机体免疫的能力。鉴于多项研究中报道的假小链双歧杆菌在促进免疫检查点疗法中的潜在能力,本研究对假小链双歧杆菌W112在促进PD-1免疫检查点疗法中的效果进行评估。
1 材料与方法
1.1 试剂与设备
PD-1抗体,上海源叶生物科技有限公司;DMEM培养基,美国Gibco生物科技公司;胎牛血清,美国Hyclone生物科技公司;PBS缓冲液、胰蛋白酶-EDTA消化液,鼎国生物技术有限公司;
全自动高压灭菌锅,日本HIRAYAMA公司;细胞超净台,苏州商田洁净公司;-80 ℃超低温冰箱、150i CO2细胞培养箱,美国Thermo公司;冷冻干燥机,德国CHRIST公司;5418R离心机,德国Eppendorf公司;Anaerobox IV厌氧培养箱,美国GeneScience公司。
1.2 实验菌株
保藏于实验室的假小链双歧杆菌W112(Bifidobacterium pseudocatenulatum W112)。
1.3 实验细胞株
购买于北京北纳创联生物技术研究院的鼠源B16-F10黑色素瘤细胞。
1.4 实验动物
SPF级7周龄的C57BL/6雌性小鼠,购自斯贝福(北京)生物技术有限公司。小鼠均在屏障环境动物室单笼饲养,相对湿度(55±5)%,温度(22±2) ℃,12 h昼夜交替光照,试验期间小鼠自由摄水和饮食。本实验由天津科技大学动物保护与使用委员会批准通过(批准号:TUST20210406),所有试验均按照《实验动物管理与使用指南》进行操作。在实验前适应环境1周,所有实验小鼠保证健康状态。
1.5 实验方法
1.5.1 菌株的培养
将活化3代的双歧杆菌W112菌株,以2%的接种量接种于TPY培养基中,在厌氧培养箱中24 h培养至对数末期(此时菌数为1×108 CFU/mL)3代后,以8 000×g的转速离心15 min,弃去培养基后,用PBS缓冲液将菌体重悬成1×108 CFU/mL的菌液。
1.5.2 细胞的培养
首先,将CO2培养箱的温度设置为37 ℃,将B16-F10黑色素瘤细胞放入含有10%胎牛血清的DMEM培养液后,放置在培养箱中进行常规培养。B16-F10黑色素瘤细胞1 d换1次培养液,2 d传1次代,传代比例均为1∶3。传代后利用显微镜直接计数法进行计数,计数时取细胞培养液于16个大方格的血细胞计数板上进行,分别记录左上、左下、右上、右下大方格的细胞数。
1.5.3 黑色素瘤小鼠模型的建立
在造模时,每只小鼠进行背部皮下注射,每只注射5×105个B16-F10黑色素瘤细胞。每天用数字卡尺测量肿瘤的长度(L)和宽度(W),其中长度(L)是2次测量中较长的一个。肿瘤体积按照公式(1)计算,肿瘤体积在100~200 mm3的小鼠,确定黑色素瘤小鼠造模成功。
肿瘤体积=L(长度)×W(宽度)×W(宽度)×0.5
(1)
将造模成功的小鼠随机分成5组,分别进行干预,2 d 1次,共10 d。分组如表1所示。
表1 实验动物分组与处理
Table 1 Grouping and treatment of experimental animals

分组每组小鼠数/只造模方法干预方法肿瘤组(Con)10皮下注射B16-F10细胞每2 d注射1次2 μL PBS溶液PD-1抗体组(PD-1)10皮下注射B16-F10细胞每2 d注射1次100 μL的PD-1抗体(2 μg/μL)假小链双歧杆菌W112组(W112)10皮下注射B16-F10细胞连续灌胃200 μL的W112菌液(1×108 CFU/mL)假小链双歧杆菌W112+PD-1抗体组(W112+PD-1)10皮下注射B16-F10细胞每2 d注射1次100 μL的PD-1抗体(2 μg/μL)并连续灌胃200 μL的W112菌液(1×108 CFU/mL)
1.5.4 小鼠体重的测量
在实验过程中,观察小鼠的生长状态,称量小鼠体重。
1.5.5 小鼠抑瘤率的计算
将小鼠处死后,取出小鼠的肿瘤组织,进行称重,根据公式(2)计算抑瘤率:
抑瘤率![]()
(2)
1.5.6 肿瘤免疫组化染色
按顺序进行烤片、脱蜡、水化、抗原修复脱色素处理。之后的步骤按照免疫组化染色的常规操作流程进行。
1.5.7 肿瘤组织CD8+T细胞免疫组化阳性率的计算
免疫组化阳性率一般是结合阳性强度评分和阳性细胞的百分比这两个方面。A:利用Envision法对视野中的阳性细胞着色强度进行评分:阳性细胞着色按照无、弱(淡黄)、中(棕黄)、强(棕褐)分别计0、1、2、3分。B:参照Axiotis法对阳性细胞百分比进行评分,评分原则:阳性细胞所占总细胞的比例从≤25%、26%~50%、51%~75%、>75%分别计0、1、2、3分。结合A和B两项评分的结果相加从而判断切片染色的阳性等级:0分为阴性(-);1~3分为弱阳性(+);4~5分为阳性(++);6~7分为强阳性(+++)。
1.5.8 宏基因组测序
实验结束后,收集每组小鼠的粪便后,置于冻存管中,放在-80 ℃冰箱内保存。并在一周内进行16S rDNA基因高通量测序,然后对测序结果进行比对分析,测序委托北京百迈客生物科技有限公司进行。
1.6 统计学分析
本实验主要运用PhotoShop、Graphpad Prism 5.0、Image J软件对图像进行处理,运用SPSS 22.0软件分析实验数据;结果均以平均值±标准偏差(Mean±SD)表示,组间分析方法为单因素方差分析(ANOVA)检验,组间两两比较采用LSD方法,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 假小链双歧杆菌W112对PD-1抗体治疗黑色素瘤的效果分析
2.1.1 假小链双歧杆菌W112对小鼠生存率的影响
实验期间,W112治疗组存活率为100%,W112+PD-1抗体联合治疗组存活率为80%,PD-1抗体治疗组为70%,肿瘤组和PD-1抗体组为70%。说明灌胃假小链双歧杆菌W112组、灌胃假小链双歧杆菌W112+PD-1抗体联合治疗组均可以提高小鼠的存活率。
2.1.2 假小链双歧杆菌W112对小鼠体积及抑瘤率的影响
在实验期间,与Con组相比,PD-1组、W112组及W112+PD-1组的肿瘤体积增长更加缓慢,且实验期间的肿瘤体积都小于Con组。10 d的干预结束后比较了各组小鼠的肿瘤体积,结果表明,与Con组[(4 291.17±5.25) mm3]相比,PD-1组和W112组小鼠肿瘤的体积均显著减小至(1 743.52±4.53) mm3和(2 032±3.96) mm3(P<0.05),W112+PD-1组小鼠的肿瘤体积极显著减小至(1 198.67±3.42) mm3(P<0.01)。以上结果表明,假小链双歧杆菌W112对PD-1抗体治疗黑色素瘤的疗效具有一定的促进作用。
随后,为了清晰的描述对不同组别的处理对肿瘤大小的影响,计算了肿瘤抑制率,如表2所示。其中PD-1组、W112组、W112+PD-1组的抑瘤率分别为67.74%、57.51%、72.39%。PD-1组的数据表明,单独使用PD-1抗体可以较为有效的控制黑色素瘤的大小。而W112+PD-1组的数据表明,假小链双歧杆菌W112对PD-1抗体的治疗效果有着显著的促进作用,使得抑瘤率从单独使用PD-1抗体时的67.74%上升至72.39%。结合W112组的数据,结果表明假小链双歧杆菌W112不仅单独使用时可以在一定程度上降低肿瘤体积,还能促进PD-1抗体的治疗效果。
表2 小鼠瘤重和抑瘤率变化表
Table 2 Tumor weight and tumor inhibition rate of mice

组别瘤重/g抑瘤率/%Con组5.05±2.910 9PD-1组1.62±0.750 3∗∗67.74W112+PD-1组1.85±0.713 9∗∗72.39W112组2.14±0.203 6∗57.51
注:*表示与肿瘤组(Con组)相比,P<0.05;**表示与肿瘤组(Con组)相比,P<0.01(下同)
2.2 假小链双歧杆菌W112对小鼠肿瘤组织CD8+T浸润的影响
在许多癌症中,肿瘤浸润性CD8+T细胞可预测患者的存活率和对免疫疗法的应答情况[16-18]。因此我们对肿瘤组织进行了免疫组织化学染色,观测了肿瘤组肿中CD8+T细胞免疫组化阳性率。
各组中新鲜肿瘤组织的免疫组化染色结果如图1所示。利用Envision法对视野中阳性细胞着色进行评分。结果表明,Con组为无色,记0分;PD-1组与W112组呈棕黄色分别记2分;W112+PD-1组呈棕褐色记3分。

图1 小鼠黑色素瘤组织的CD8+ T细胞免疫组化染色
Fig.1 CD8+T Cells immunohistochemical staining of mouse melanoma
注:参考Envision法,对阳性细胞的结果进行判断,若细胞浆 或细胞膜中出现黄色到棕褐色区则视为阳性显色,并结合具体 的染色强度以及阳性细胞百分比来评定阳性表达的具体情况
利用Image J软件,计算阳性细胞数目所占总细胞数目的百分比,结果如图2所示,与Con组[(14.39±1.02)%]相比,其他3组极显著的增加了CD8+ T细胞面积,分别为PD-1组(29.65±0.81)%、假小链双歧杆菌W112与PD-1抗体联合治疗组(38.02±1.40)%、W112组(25.38±0.95)%。

图2 小鼠黑色素瘤组织中的CD8+ T阳性细胞数目 所占总细胞数目的百分比
Fig.2 The percentage of CD8+ T-positive cells in mouse melanoma tissue to the total number of cells
注:*表示与肿瘤组(Con组)相比,P<0.05; **表示与肿瘤组(Con组)相比,P<0.01(下同)
根据图2中阳性细胞所占总细胞的百分比进行计分:Con组≤25%记0分。PD-1抗体组、假小链双歧杆菌W112组、假小链双歧杆菌W112与PD-1抗体联合治疗组在26%~50%记1分。
综合上述两种结果可知各组肿瘤组织中CD8+T细胞的阳性等级分别为Con组0分,PD-1抗体组、W112组记3分,W112+PD-1抗体组在记4分。则Con组为阴性(-),PD-1抗体组、假小链双歧杆菌W112组为弱阳性(+),W112+PD-1抗体组为阳性(++)。
目前,响应抗 PD-1 治疗的非小细胞肺癌患者的CD8+ T 细胞也更高[19],且另一项研究表明,肿瘤中CD8+ T细胞浸润与肠道菌群中粪杆菌属丰度之间具有显著的正相关性[20]。
由以上结果可见3组治疗后CD8+T细胞阳性率显著增加。并且与单独使用PD-1抗体治疗相比,灌胃假小链双歧杆菌W112显著提高了PD-1抗体使用时的CD8+T细胞浸润,进而改善了肿瘤免疫微环境,有利于肿瘤的免疫治疗。
2.3 假小链双歧杆菌W112对小鼠肿瘤组织中γ-干扰素(interferon-γ,IFN-γ)和白细胞介素-12(interleukin-12,IL-12)的影响
细胞因子是由多种细胞分泌的生物应答调节剂,可以反应机体的免疫水平。免疫细胞和肿瘤细胞的功能会受不同的细胞因子之间相互作用而发生变化,进而形成变化的、复杂的肿瘤免疫微环境。不仅IFN-γ被证明可以辅助用于不同类型癌症的免疫治疗,IL-12也表现出了对一系列的恶性肿瘤都具有治疗作用。因此,对小鼠肿瘤组织中的IFN-γ和IL-12含量进行测定,结果如图3所示。
各组小鼠肿瘤组织中的IFN-γ含量如图3-a所示,与Con组相比,PD-1组、W112组以及W112+PD-1组肿瘤中的IFN-γ含量均极显著(P<0.01)的增加,分别增加了约11.74%、16.47%以及20.88%。各组小鼠肿瘤组织中的IL-12含量如图3-b所示,PD-1组、W112组显著增加了肿瘤中的IL-12含量(P<0.05),分别增加了约6.76%、7.49%。而在PD-1抗体治疗基础上给予假小链双歧杆菌W112后,能够极显著的增加肿瘤中的IL-12含量(P<0.01),约增加了9.34%。
因此,假小链双歧杆菌W112和PD-1抗体对黑色素瘤组织中IL-12、IFN-γ的水平有不同程度的升高作用,而两者同时使用会提高单独使用PD-1抗体时的作用,说明假小链双歧杆菌W112有利于促进黑色素瘤小鼠体内的细胞因子生成,通过作用于肿瘤免疫微环境,促进PD-1抗体的作用效果。

a-IFN-γ水平;b-IL-12水平
图3 不同处理组肿瘤组织细胞因子水平
Fig.3 Tumor tissue cytokines levels in different treatment groups
注:#表示与W112+PD-1抗体组相比,P<0.05;ns表示与 W112+PD-1抗体组相比,P>0.05
2.4 假小链双歧杆菌W112对黑色素瘤小鼠肠道菌群的调节作用
目前的研究已经证实了肠道菌群与免疫治疗的相关性[21],基于以上假小链双歧杆菌W112对小鼠肿瘤生长和肿瘤免疫微环境的影响,进一步研究了假小链双歧杆菌W112对小鼠肠道菌群的影响。
2.4.1 灌胃假小链双歧杆菌W112对肠道菌组成的影响
β多样性是个体间微生物组成相似性的一个指标,个体之间物种的有无和不一致性决定了β多样性指数。利用主坐标分析(principal coordinate analysis,PCoA)对不同组别小鼠肠道菌群的相似性进行分析。图4表明,Con组和PD-1组的相对距离相近,而W112+PD-1组和W112组的相对距离相近,表明Con组和PD-1组小鼠的肠道菌群相似,而W112+PD-1组和W112组小鼠肠道菌群相似。上述结果清晰的证实了菌株W112对肠道菌群具有显著的调控作用。假小链双歧杆菌W112单独灌胃或者与PD-1抗体联合使用均可以改变小鼠肠道菌群的组成。
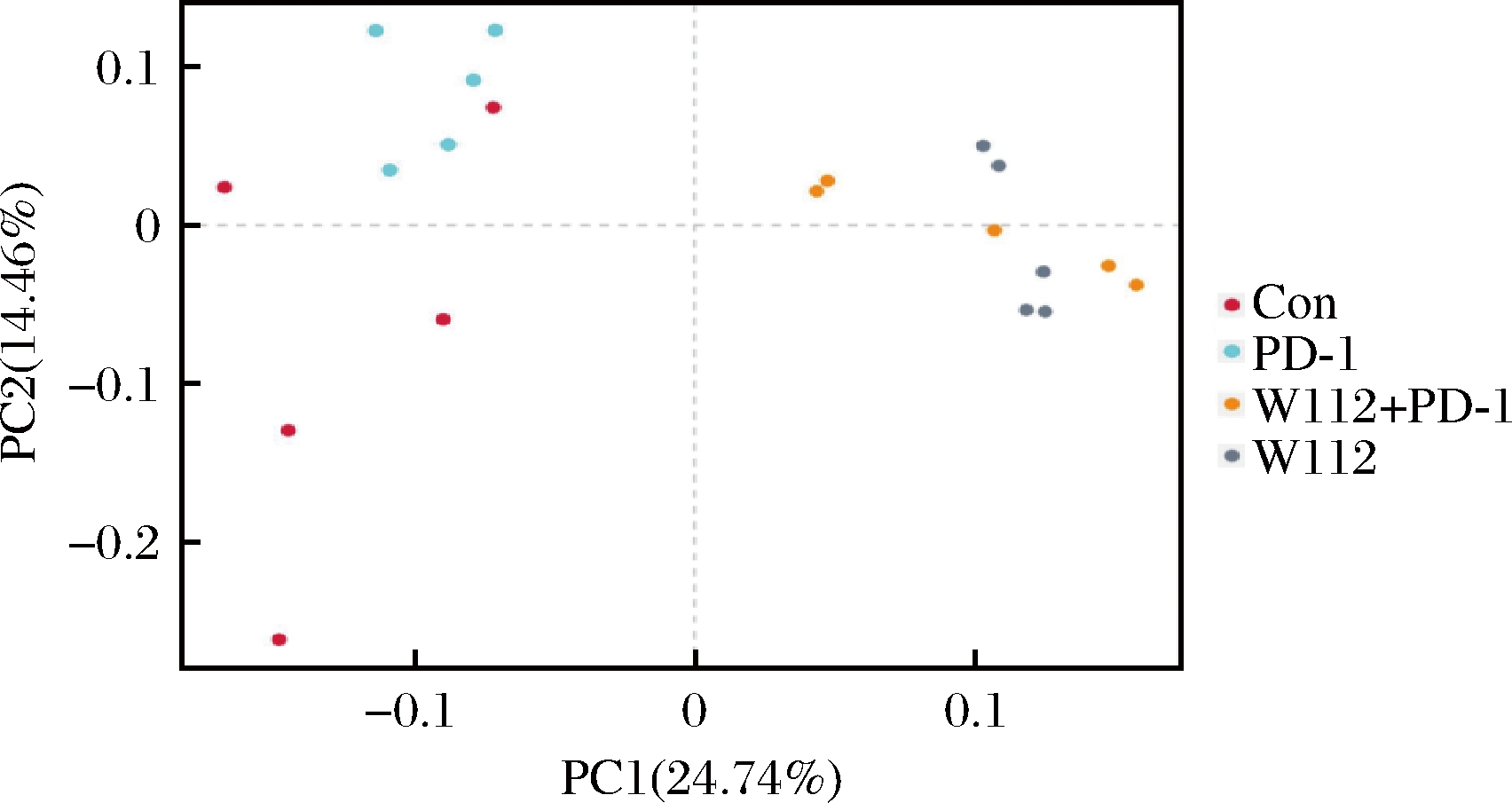
图4 基于Bray-Curtis 距离的PCoA
Fig.4 PCoA by the Bray-Curtis
2.4.2 假小链双歧杆菌W112的干预对小鼠肠道菌群物种α多样性的影响
随后,通过对比不同组别小鼠的α多样性,分析了菌株W112对肠道菌群多样性的调节作用。小鼠肠道菌群的α多样性反映了微生物群落的丰度和多样性,其中ACE指数和Chao1指数反映物种丰富度,Shannon指数和Simpson指数反映物种的多样性。由表3可知,Con组的ACE指数和Chao1指数分别为466.769 8、470.418 1,PD-1组分别为490.345 5 和493.489 6,均显著高于Con组(P<0.05);W112+PD-1组分别为521.784 1和528.525 3,均显著高于Con组(P<0.05);而W112组分别为541.733 3和552.251 2,极显著高于Con组(P<0.01)。
因此,灌胃假小链双歧杆菌W112会提高黑色素瘤小鼠肠道菌群物种总数、丰富度。
表3 α多样性指数
Table 3 α-Diversity indexes
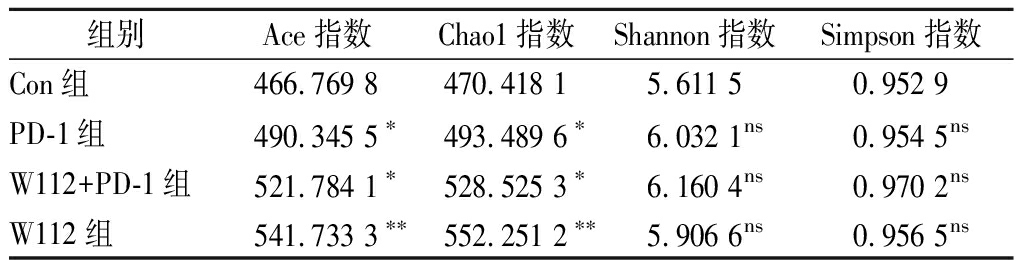
组别Ace指数Chao1指数Shannon指数Simpson指数Con组466.769 8470.418 15.611 50.952 9PD-1组490.345 5∗493.489 6∗6.032 1ns0.954 5nsW112+PD-1组521.784 1∗528.525 3∗6.160 4ns0.970 2nsW112组541.733 3∗∗552.251 2∗∗5.906 6ns0.956 5ns
注:ns表示无显著性差异
2.4.3 假小链双歧杆菌W112对小鼠肠道菌群特定类群的调节作用
为了确定各组小鼠肠道菌群中具体的物种差异,对小鼠肠道菌群特定分类水平的变化进行了分析。图5表示了在门水平的变化,各组小鼠中,拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)占据了门水平丰度的90%以上。与Con组相比,W112组的拟杆菌门相对丰度均降低,同样的,W112+PD-1组的拟杆菌门丰度也低于PD-1组。这表明,菌株W112的干预,可以降低肠道菌群中拟杆菌门的丰度。另外,与Con组相比,PD-1组、W112+PD-1组和W112组的厚壁菌门含量均上升;与PD-1组相比,W112+PD-1组的厚壁菌门也具有较高的丰度。拟杆菌门已被证明与对免疫检查点阻断反应的缺乏有关;而变形菌门的富集与多种疾病相关,如代谢紊乱和炎症性肠病以及哮喘和慢性阻塞性肺病;在癌症的治疗中,厚壁菌门已经被证明与治疗的疗效有关。

图5 各门水平所占比例
Fig.5 The proportion of each phylum level
图6显示了各组小鼠肠道菌群在属水平上的变化,与Con组相比,PD-1组、W112+PD-1组和W112组中乳杆菌属(Lactobacillus)、瘤胃球菌(Ruminococcaceae_UCG-014、uncultured_bacterium_f_Ruminococ caceae)、毛螺菌属(uncultured_bacterium_f_Lachnospiraceae、Lachnospirac-eae_NK4A136_group)、拟杆菌属(Bacteroides)、布劳特氏菌属(Blautia)含量升高,而拟杆菌属(Bacteroides)、Alistipes、普雷沃氏菌科_UCG-001(Prevotellaceae_UCG-001)含量减少。一项研究中对接受了抗PD-1免疫治疗的黑素瘤患者(n=112)的肠道微生物组进行分析发现,患者的α多样性、粪杆菌相对丰度与无进展生存期(progression free survival,PFS)成正比并且发现在无反应者中拟杆菌属相对丰度较高[22]。口服乳酸杆菌属、毛螺菌属和瘤胃球菌已被证明可以抑制结肠癌模型中的肿瘤生长,布劳特氏菌属可以维持肠道稳态活性,防止炎症发生。普雷沃氏菌科_UCG-001,在结肠炎小鼠肠道菌群中富集。拟杆菌属富集的黑色素瘤患者的无进展生存期和总生存期(overall survival,OS)较低[23]。
分析结果发现,无论是单独使用PD-1抗体还是单独灌胃W112组或是两者共同作用都显著改善了小鼠肠道微生态,提高了有益菌的富集,降低了有害菌的含量,改善了小鼠肠道微生态。

图6 各属水平所占比例
Fig.6 The proportion of each genus level
2.4.4 不同组别小鼠的肠道菌群间的差异分析
LEfSe分析通过统计的显著性、生物学的一致性以及效应相关性可以比较2组或者2组以上组别间的差异。菌群在各组中影响力的大小用线性判别分析(linear discriminant analysis,LDA)柱状图来表示。基于之前Con组、PD-1组、W112组和PD-1+W112组4组小鼠的肠道菌群在门水平和属水平存在菌群丰度的差异,所以对各组进行进一步的LEfSe,绘制了LEfSe柱状图及进化分支图,确定各个干预组的特征性类群。
在本课题的实验中LDA设置为4.0,则LDA>4.0表示为具有显著性差异物种。由图7可知,W112+PD-1组小鼠肠道菌群具有显著性差异的类群最多,从门到属水平分别是,javascript:void (0);疣微菌门(Verrucomicrobia)-javascript:void (0);疣微菌纲(Verrucomicrobiae)-javascript:void (0);疣微菌目(Verrucomicrobiales)-阿克曼氏菌科(Akkermansiaceae)以毛螺菌科的未培养的属(g_uncultured_bacterium_f_Lachnospiraceae)。W112组小鼠肠道菌群中显著差异性的类群是厚壁菌门。PD-1抗体组小鼠肠道菌群的显著性差异类群是毛螺菌科(Lachnospiraceae)。而Con组小鼠肠道菌群的差异物种是拟杆菌门-拟杆菌纲(Bacteroidia)-拟杆菌目(Bacteroidales)以及阿洛普雷沃特菌属(Alloprevotella)。
此结果表明,灌胃W112组可以显著改善小鼠肠道微生态,提高与免疫检查点治疗相关的菌种丰度,降低有害菌的丰度,改善小鼠肠道微生态。

图7 LEfSe分析柱状图
Fig.7 The histogram by LEfSe analysis
3 结论
近年来,益生菌一直是国内外研究的热点,在中国的研究不再仅限于益生菌的抗炎抗动脉粥样硬化、抗糖尿病方面的作用。而是把重点逐渐放到了它们在调节肠道菌群、免疫调节和抗肿瘤方面的作用机制。
在本实验中,与肿瘤组小鼠存活率相比,灌胃W112后,存活率为100%。与PD-1抗体治疗组小鼠70%的存活率相比,W112+PD-1抗体联合治疗组存活率达到了80%。在多项研究中也发现益生菌的灌胃能够提高小鼠存活率。如喂食粪肠杆菌和鼠李糖菌后,辐射小鼠的存活率提高了40%~60%,并且实验中证明补充短链脂肪酸中的丙酸可以提高生存率[24];食用阿克曼菌可以延长患有黑色素瘤疾病小鼠的存活率[25]。可见,灌胃假小链双歧杆菌W112可以提高黑色素瘤小鼠的生存率。
W112的灌胃除了提高了小鼠的生存率,还减轻了肿瘤质量、减小了肿瘤体积、提高了抑瘤率,增加了小鼠肿瘤组织中CD8+T细胞阳性率,同时也提高了肿瘤组织中IL-12、IFN-γ的水平,改善了肿瘤的微环境。这与先前多项研究结果相似,如多位学者发现均发现,双歧杆菌或鼠李糖乳杆菌GG的灌胃及富集会缓解肿瘤的发展,且会上调CD8+T细胞,促进IFN-γ和IL-2表达[13,24,26]。综上,灌胃假小链双歧杆菌W112对PD-1抗体治疗黑色素瘤具有一定的促进作用。
前期实验发现假小链双歧杆菌W112可以影响肿瘤的发展。而益生菌可以通过增加有益菌,减少有害菌来调节肠道菌群进而发挥抗肿瘤作用[24,27]。所以接下来利用宏基因组方法分析了灌胃假小链双歧杆菌W112后黑色素瘤小鼠的肠道群菌结构。
结果发现,灌胃假小链双歧杆菌W112后,黑色素瘤小鼠肠道菌群的丰富度得到了提高。且小鼠肠道内厚壁菌门、乳酸杆菌属 (Lactobacillus)、阿克曼菌等这些与肿瘤治疗及预防相关的有益菌群[12-15,19,28]的丰度均升高,而在肿瘤治疗及预防中呈负相关的拟杆菌门、变形菌门、Alistipes[11-14,20]相对丰度降低。因此,灌胃假小链双歧杆菌W112可以通过提高肠道中与免疫检查点阻断有效相关的有益菌群丰度改善肠道菌群,达到促进PD-1抗体治疗黑色素瘤的作用。
综上所述,在本实验中,首先发现灌胃假小链双歧杆菌W112可以在PD-1抗体治疗基础上,提高小鼠的存活率并且减小肿瘤体积。进一步研究发现适当灌胃假小链双歧杆菌W112可能会调节宿主肠道菌群结构,提高小鼠肠道菌群多样性,改善肿瘤小鼠的肠道菌群构成,进而促进了PD-1抗体的治疗效果。本研究的结果可为假小链双歧杆菌W112的综合应用奠定理论基础,同时为假小链双歧杆菌W112应用于临床的促进治疗提供一定的科学依据。
[1] GUO J K, QIN S K, LIANG J, et al.Chinese guidelines on the diagnosis and treatment of melanoma(2015 Edition)[J].Annals of Translational Medicine, 2015, 3(21):322.
[2] SCHADENDORF D, VAN AKKOOI A C J, BERKING C, et al. Melanoma[J].The Lancet, 2018, 392(10151):971-984.
[3] SIEGEL R L, MILLER K D, DVM A J, et al.Cancer statistics, 2017[J].CA:A Cancer Journal for Clinicians, 2017, 67(1):7-30.
[4] CSCO黑色素瘤专家委员会.中国黑色素瘤诊治指南[M].北京:人民卫生出版社, 2013, 17:29-30.
Chinese Society of Clinical Oncology. Chinese Guidelines for Diagnosis and Treatment of Melanoma[M].Beijing: People′s Medical Publishing House, 2013:17,29-30.
[5] MELLMAN I, COUKOS G, DRANOFF G.Cancer immunotherapy comes of age[J].Nature, 2011, 480(7 378):480-489.
[6] KROEMER G, ZITVOGEL L.The breakthrough of the microbiota[J].Nature Reviews Immunology, 2018, 18(2):87-88.
[7] CHEN W G, LIU F L, LING Z X, et al.Human intestinal lumen and mucosa-associated microbiota in patients with colorectal cancer[J].PLoS One, 2012, 7(6):e39743.
[8] WANG T T, CAI G X, QIU Y P, et al.Structural segregation of gut microbiota between colorectal cancer patients and healthy volunteers[J].The ISME Journal, 2012, 6(2):320-329.
[9] WEI H, DONG L, WANG T T, et al.Structural shifts of gut microbiota as surrogate endpoints for monitoring host health changes induced by carcinogen exposure[J].FEMS Microbiology Ecology, 2010, 73(3):577-586.
[10] MARCHESI J R, DUTILH B E, HALL N, et al.Towards the human colorectal cancer microbiome[J].PLoS One, 2011, 6(5):e20447.
[11] VÉTIZOU M, PITT J M, DAILL RE R, et al.Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota[J].Science, 2015, 350(6 264):1 079-1 084.
RE R, et al.Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota[J].Science, 2015, 350(6 264):1 079-1 084.
[12] PITT J M, VEÉTIZOU M, GOMPERTS BONECA I, et al.Enhancing the clinical coverage and anticancer efficacy of immune checkpoint blockade through manipulation of the gut microbiota[J].Oncoimmunology, 2016, 6(1):e1132137.
[13] SIVAN A, CORRALES L, HUBERT N, et al.Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy[J].Science, 2015, 350(6 264):1 084-1 089.
[14] FRANKEL A E, COUGHLIN L A, KIM J, et al.Metagenomic shotgun sequencing and unbiased metabolomic profiling identify specific human gut microbiota and metabolites associated with immune checkpoint ttherapy efficacy in melanoma patients[J].Neoplasia, 2017, 19(10):848-855.
[15] CHAPUT N, LEPAGE P, COUTZAC C, et al.Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab[J].Annals of Oncology: Official Journal of the European Society for Medical Oncology, 2017, 28(6):1 368-1 379.
[16] HERBST R S, SORIA J C, KOWANETZ M, et al.Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients[J].Nature, 2014, 515(7 528):563-567.
[17] TUMEH P C, HARVIEW C L, YEARLEY J H, et al.PD-1 blockade induces responses by inhibiting adaptive immune resistance[J].Nature, 2014, 515(7 528):568-571.
[18] EROGLU Z, ZARETSKY J M, HU-LIESKOVAN S, et al.High response rate to PD-1 blockade in desmoplastic melanomas[J].Nature, 2018, 553(7 688):347-350.
[19] JIN Y P, DONG H, XIA L L, et al.The diversity of gut microbiome is associated with favorable responses to anti-programmed death 1 immunotherapy in Chinese patients with NSCLC[J].Journal of Thoracic Oncology, 2019, 14(8):1 378-1 389.
[20] GOPALAKRISHNAN V, SPENCER C N, NEZI L, et al.Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients[J].Science, 2018, 359(6 371):97-103.
[21] WANG W C, WANG Y, SHI L H, et al.Programmed death 1/programmed death ligand 1 signaling pathway in tumor immunotherapy:An update[J].Academic Journal of Second Military Medical University, 2017, 38(9):1 190-1 195.
[22] DESHPANDE G, RAO S, PATOLE S.Progress in the field of probiotics:Year 2011[J].Current Opinion in Gastroenterology, 2011, 27(1):13-18.
[23] SALGIA N J, BERGEROT P G, MAIA M C, et al.Stool microbiome profiling of patients with metastatic renal cell carcinoma receiving anti-PD-1 immune checkpoint inhibitors[J].European Urology, 2020, 78(4):498-502.
[24] MATSON V, FESSLER J, BAO R Y, et al.The commensal microbiome is associated with anti-PD-1 efficacy in metastatic melanoma patients[J].Science, 2018, 359(6 371):104-108.
[25] SHI L L, SHENG J Y, CHEN G Z, et al.Combining IL-2-based immunotherapy with commensal probiotics produces enhanced antitumor immune response and tumor clearance[J].Journal for ImmunoTherapy of Cancer, 2020, 8(2):e000973.
[26] RAFTER J, BENNETT M, CADERNI G, et al.Dietary synbiotics reduce cancer risk factors in polypectomized and colon cancer patients[J].The American Journal of Clinical Nutrition, 2007, 85(2):488-496.
[27] MCQUADE J L, DANIEL C R, HELMINK B A, et al.Modulating the microbiome to improve therapeutic response in cancer[J].The Lancet Oncology, 2019, 20(2):e77-e91.
[28] ROUTY B, LE CHATELIER E, DEROSA L, et al.Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors[J].Science, 2018, 359(6 371):91-97.