油茶籽经压榨或浸提手段得到山茶毛油,毛油含较多杂质,主要包括磷脂、游离脂肪酸、色素、金属离子等,这些物质会对成品油的口感、气味、外观和贮藏稳定性产生不利影响,不被消费者所接受[1]。对毛油进行精炼加工可以很好的解决这一问题。油脂的精炼方法主要分为化学精炼和物理精炼。物理精炼因不需要碱炼过程,废水排放少且油损失率低[2],得到广泛的重视。其中,脱胶是物理精炼关键步骤之一,且脱胶效果直接影响后续工艺效率和成品油品质,因而对油脂磷含量限制较为严格,一般要求在10 mg/kg以下[3]。水化脱胶和酸法脱胶是油脂工业中应用最广的脱胶方式,然而这两种方法得到的脱胶油磷含量较高且对不同油品的脱胶效果差异较大[4],因此无法满足物理精炼的需求。酶法脱胶是一种新兴的生物脱胶方式,主要原理是利用磷脂酶将毛油中的非水化磷脂水解成可水化形式,再通过离心去除水化磷脂,这种方法得到的脱胶油磷含量可以降至10 mg/kg以内。与传统工艺相比,酶法脱胶具有脱胶彻底、适用范围广和经济环保等明显应用优势[5]。
Lecitase® Ultra,属于磷脂酶A1的一种,能特异性作用于磷脂sn-1位置酰基键生成亲水性良好的溶血磷脂,是酶法脱胶中应用较为广泛的一种酶,有良好的工业应用价值[6]。然而和大多数工业用酶一样,游离Lecitase® Ultra有易失活、难以回收利用和价格昂贵等缺点。据报道,对磷脂酶进行固定化可以有效地提高磷脂酶的稳定性,同时得到的固定化酶的重复使用性良好,降低了生产成本[7],在油脂脱胶方面显示出较好的工业应用前景。
聚多巴胺(polydopamine,PDA)因具有良好的生物相容性且表面含有丰富的活性基团迅速发展为热门的酶固定化载体[8]。目前,已有多数研究表明PDA的表面活性基团(邻苯醌等)能够与酶分子的氨基或巯基共价结合,实现对酶蛋白的固定化。CHAO等[9]对埃洛石纳米管表面包裹PDA后,酶负载量高达168.8 mg/g,几乎是原埃洛石纳米管的7倍;ZHAO等[10]使用PDA修饰的磁性介孔生物炭共价固定脂肪酶,研究发现固定化脂肪酶具有良好的热稳定性和耐碱性,在4 ℃或25 ℃条件下贮藏70 d,酶活性仍保留85%以上。然而目前研究大多集中于将PDA作为酶载体的改性或表面修饰材料,较少有PDA单独作为纳米粒子应用于固定化酶的报道。研究表明,固定化载体的几何形状对固定化酶活性有重要的影响,将酶固定在平面上可能会引起天然蛋白质结构的扭曲以及底物扩散速度较慢等问题,而纳米粒子由于曲率半径较大,酶分子之间活性中心的距离增加,进而保持了酶分子的结构完整性和酶活稳定性[11]。因此,本研究合成了聚多巴胺纳米粒子(polydopamine nanoparticles,PDANPs),并以其为载体固定化Lecitase® Ultra,再将所得固定化酶应用于山茶油脱胶,以期为食用油的固定化酶脱胶的工业化应用提供参考。
1 材料与方法
1.1 材料与试剂
Lecitase®Ultra,诺维信公司;盐酸多巴胺,上海麦克林科技有限公司;大豆卵磷脂,上海蓝季科技发展有限公司;山茶毛油,安徽华银茶油有限公司;氨水、丙酮、乙醇、Triton X-100、氢氧化钠、氢氧化钾(均为分析纯),国药化工试剂有限公司。
1.2 仪器与设备
LaB6透射电子显微镜(transmission electron microscope,TEM),日本电子公司;Nicolet傅里叶红外光谱仪(Fourier transform infrared spectroscopy,FTIR),美国Thermo Nicolet公司;D/MAX2500VL/PC转靶X射线衍射仪,日本理学公司;FA25高剪切分散乳化机,上海弗鲁克流体机械制造有限公司;NSKY-110 WX型水浴摇床,上海苏坤实业有限公司。
1.3 实验方法
1.3.1 PDANPs的制备
参照YE等[12]的方法,并稍作修改,具体如下:首先在180 mL的蒸馏水中加入4 mL氨水溶液和80 mL乙醇,在室温下搅拌20 min。然后,在室温下迅速将20 mL质量浓度为50 mg/mL的盐酸多巴胺溶液加入上述混合物溶液中,剧烈搅拌24 h。最后,向溶液中添加2倍体积的丙酮使纳米粒子絮凝,并于2 000 r/min条件下离心。收集离心产物,用丙酮充分洗涤后,加入适量水分散,放置于真空干燥箱中干燥至无明显丙酮气味,制得PDANPs分散液。
1.3.2 PDANPs@Lecitase®Ultra的制备
参照CAO等[13]的方法,稍作修改,具体如下:将1 mg PDANPs添加到锥形瓶中,然后再加入0.15 mL质量浓度为20 mg/mL的Lecitase® Ultra酶液(pH为5的磷酸缓冲液稀释)。将混合物在摇床中以150 r/min、30 ℃的条件下振荡9 h,随后迅速转入离心机于8 000 r/min条件下离心10 min回收固定化样品,并使用pH为5的磷酸缓冲液连续洗涤,直到上清液中未检测到蛋白质。以酶活力回收率和蛋白固载率为指标,在酶添加量0.15 mL/mg、固定化时间9 h的基础上研究上述2个因素对固定化效果的影响。
1.3.3 固定化酶的蛋白固载率和酶活力回收率测定
1.3.3.1 蛋白固载率的测定
采用Bradford法[14] 测定蛋白含量。具体如下:取适量Lecitase® Ultra或PDANPs@Lecitase®Ultra洗涤液加入5 mL考马斯亮蓝试剂,混匀,反应10 min后于595 nm测定吸光值,以牛血清蛋白作为参考蛋白制作标准曲线,计算酶蛋白含量。蛋白固载率计算如公式(1)所示:
蛋白固载率![]()
(1)
式中:A1表示固定化前酶液中的蛋白含量,mg,A2表示洗涤液和上清液中的蛋白含量,mg。
1.3.3.2 酶活力回收率的测定
参考ZHAN等[15]的方法测定酶活力,稍作修改,具体如下:将适量大豆磷脂、0.02% Triton X-100溶于pH=5的磷酸盐缓冲液中,在10 000 r/min条件下剪切5~10 min使充分乳化,制得质量浓度为40 g/L的底物溶液。于100 mL锥形瓶里先加入底物溶液30 mL, 50 ℃条件下预热10 min,再加入酶样品,160 r/min振荡10 min,最后补加95%乙醇终止反应,用0.1 mol/L NaOH滴定,反应终点为pH 9,计算0.1 mol/L NaOH的平均消耗量。定义1 min水解磷脂产生1 μmol游离脂肪酸所需酶量为一个酶活力单位(U)。酶活力回收率计算如公式(2)所示:
酶活力回收率![]()
(2)
式中:C1表示固定化酶活力,U,C2表示加入的游离酶活力,U。
1.4 PDANPs@Lecitase®Ultra的表征
TEM采用的电子枪为LaB6,加速电压100 kV;FTIR的红外光谱频率为64次/s,扫描范围为4 000~600 cm-1,并采用二阶导数红外去卷积光谱拟合法对FTIR分析得到的谱图的酰胺Ⅰ带(1 600~1 700 cm-1)进行二级结构拟合;X射线光电子能谱仪(X-ray photoelectron spectroscopy,XPS)的射线源测试功率150 W,单色Al靶。
1.5 PDANPs@Lecitase®Ultra的酶学性质研究
1.5.1 最适pH
将适量大豆磷脂、0.02% Triton X-100分别溶于pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0的磷酸盐缓冲液中,制备不同pH的质量浓度为40 g/L的底物溶液,按照1.3.3.2方法测定酶活力。以Lecitase®Ultra和PDANPs@Lecitase® Ultra所测定的最高酶活力值为100%,计算其他pH条件下的相对酶活力。
1.5.2 最适温度
将Lecitase® Ultra和PDANPs@Lecitase® Ultra与质量浓度为40 g/L的底物溶液混合后,设定反应温度分别为40、45、50、55、60、65 ℃,再按照1.3.3.2方法测定酶活力。以游离Lecitase® Ultra和PDANPs@Lecitase® Ultra所测定的最高酶活力值为100%,计算其他温度条件下的相对酶活力。
1.5.3 贮藏稳定性
将游离Lecitase® Ultra和PDANPs@Lecitase® Ultra贮藏在4 ℃冰箱中,每隔7 d分别取样并测定游离Lecitase® Ultra和PDANPs@Lecitase® Ultra的酶活力。将游离Lecitase®Ultra和PDANPs@Lecitase® Ultra贮藏前的酶活力定义为100%,分别计算贮藏了90 d后游离Lecitase®Ultra和PDANPs@Lecitase® Ultra的相对酶活力。
1.6 PDANPs@Lecitase®Ultra酶法脱胶实验
参照JIANG等[4]的方法,稍作修改。取100 g山茶油于三角烧瓶中,水浴加热至55 ℃,加入质量浓度为450 g/L的柠檬酸0.13 mL,10 000 r/min剪切1 min使充分乳化,再于55 ℃水浴下搅拌30 min,待到体系冷却到55 ℃,然后加入一定量质量浓度为40 g/L 的NaOH溶液混合均匀,调节至适当pH,置于55 ℃下搅拌5 min,加入2 mL同温蒸馏水和一定量的PDANPs@Lecitase®Ultra,在适当温度下酶解3 h,随后迅速转入离心机于8 000 r/min条件下离心10 min,取上层油样测定磷含量。磷含量的检测方法参照GB/T 5537—2008《粮油检验 磷脂含量的测定》。以磷含量为指标,在加酶量80 mg/kg、反应pH 6和反应温度55 ℃的基础上研究加酶量、反应pH和反应温度对山茶油脱胶效果的影响。
1.7 PDANPs@Lecitase® Ultra重复使用性
参照YU等[7]的方法,将PDANPs@Lecitase®Ultra在上述得到的最优的脱胶条件下重复操作10次。定义初始酶活力为100%,计算每个循环后的酶活力。
2 结果与分析
2.1 PDANPs@Lecitase® Ultra制备条件的确定
2.1.1 PDANPs@Lecitase®Ultra制备过程中酶添加量的影响
由图1可知, PDANPs@Lecitase®Ultra的蛋白固载率随着酶添加量的增加呈现先升后降趋势,当酶添加量>0.15 mL/mg时,蛋白固载率降低趋势明显,这可能是因为此时载体结合的酶量已接近饱和。当酶添加量为0.15 mL/mg时,酶活力回收率达到最大值71.2%,之后随着酶液的增加,酶活力回收率逐渐降低。这说明酶添加量为0.15 mL/mg后,酶的活性得到部分抑制,原因可能是载体的酶蛋白负载量过大,很容易导致酶分子聚集在载体表面,使得空间阻力增加,底物传质效率减小[16]。因此,较适宜的酶添加量为0.15 mL/mg,此时固定化酶的酶活力较高,蛋白固载率为78.2%。

图1 酶添加量对PDANPs@Lecitase® Ultra酶活力 回收率和蛋白固载率的影响
Fig.1 Effect of enzyme amount on PDANPs@Lecitase® Ultra activity recovery and immobilization efficiency
注:蛋白固载率的显著性差异用A~D表示,酶活力回收率的显著性 差异用a~d表示,不同大小写字母均表示差异显著(P<0.05)(下同)
2.1.2 PDANPs@Lecitase®Ultra制备过程中固定化时间的影响
固定化时间的长短对影响固定化效果有重要影响,固定化时间过短则反应不够充分,而时间过长则容易导致酶失活,为此,分别考察了反应时间为3~18 h对PDANPs@Lecitase®Ultra固定化效果的影响。由图2可知,随着固定化时间的增加,PDANPs@Lecitase®Ultra的蛋白固载率逐渐上升,到9 h后趋于稳定状态;而酶活力回收率则先不断增加,9 h时达到最大值,随后缓慢下降,当固定化时间为15 h后,固定化酶活力急速降低。这可能是因为9 h时,载体结合酶量达到饱和状态,随着反应时间的增加,酶分子逐渐在表面沉积,产生的空间位阻过大,导致底物很难和酶的活性基团发生反应,同时当固定化时间过长时,由于游离酶长时间放置在30 ℃和振荡条件下,引起部分酶发生失活现象。因此,制备PDANPs@Lecitase®Ultra的较优固定化时间为9 h。
2.2 PDANPs和PDANPs@ Lecitase® Ultra的表征
2.2.1 TEM分析
结果如图3所示,由图3-a可以清晰地看出,PDANPs在TEM下呈大小均匀的规则球状颗粒,颗粒粒径约为280~320 nm。由图3-b可知,固定化 Lecitase® Ultra后,PDANPs的表面颜色变浅,这可能是由于Lecitase® Ultra包裹在PDANPs所致,同时固定化前后PDANPs的形状并未发生改变。

图2 固定化时间对PDANPs@Lecitase® Ultra酶活力 回收率和蛋白负载率的影响
Fig.2 Effect of immobilization time on PDANPs@Lecitase® Ultra activity recovery and immobilization efficiency

a-PDANPs;b-PDANPs@ Lecitase® Ultra
图3 PDANPs和PDANPs@ Lecitase® Ultra的TEM图
Fig.3 The TEM images of PDANPs and PDANPs@Lecitase® Ultra
2.2.2 FTIR分析
为明确酶固定化前后的官能团变化,采用FTIR对PDANPs及PDANPs@Lecitase®Ultra进行分析。如图4所示,光谱在3 240 cm-1处的吸收峰可能与PDANPs分子中O—H、N—H的伸缩振动以及水分子的存在相关,1 613 cm-1和1 502 cm-1处的吸收峰与多巴胺自聚合过程中的吲哚和吲哚衍生物的特征峰有关[17],1 286 cm-1处的峰是由酚的C—O伸缩振动引起的,以上都属于聚多巴胺的红外特征峰。相对于PDANPs来说,PDANPs@Lecitase®Ultra的红外谱图在1 631 cm-1和1 514 cm-1处出现面积较大的两个峰,同时,1 229 cm-1处的峰面积也明显增大。1 631 cm-1的峰可能是C![]() O(酰胺I带)或C
O(酰胺I带)或C![]() N伸缩振动引起的。1 514 cm-1处的峰对应于N—H(酰胺Ⅱ带)的弯曲振动,1 229 cm-1处的峰为C—N(酰胺Ⅲ带)的伸缩振动峰,这些都是典型的酶蛋白酰胺带特征吸收峰[18]。这些结果表明Lecitase®Ultra已成功固定于PDANPs上。与本研究相似,ZHAO等[10] 利用聚多巴胺修饰的磁性介孔生物炭共价固定脂肪酶,当使用FTIR对成功获得的固定化酶表征时也发现固定化酶上出现酰胺I带、酰胺Ⅱ带和酰胺Ⅲ带的红外吸收峰。
N伸缩振动引起的。1 514 cm-1处的峰对应于N—H(酰胺Ⅱ带)的弯曲振动,1 229 cm-1处的峰为C—N(酰胺Ⅲ带)的伸缩振动峰,这些都是典型的酶蛋白酰胺带特征吸收峰[18]。这些结果表明Lecitase®Ultra已成功固定于PDANPs上。与本研究相似,ZHAO等[10] 利用聚多巴胺修饰的磁性介孔生物炭共价固定脂肪酶,当使用FTIR对成功获得的固定化酶表征时也发现固定化酶上出现酰胺I带、酰胺Ⅱ带和酰胺Ⅲ带的红外吸收峰。
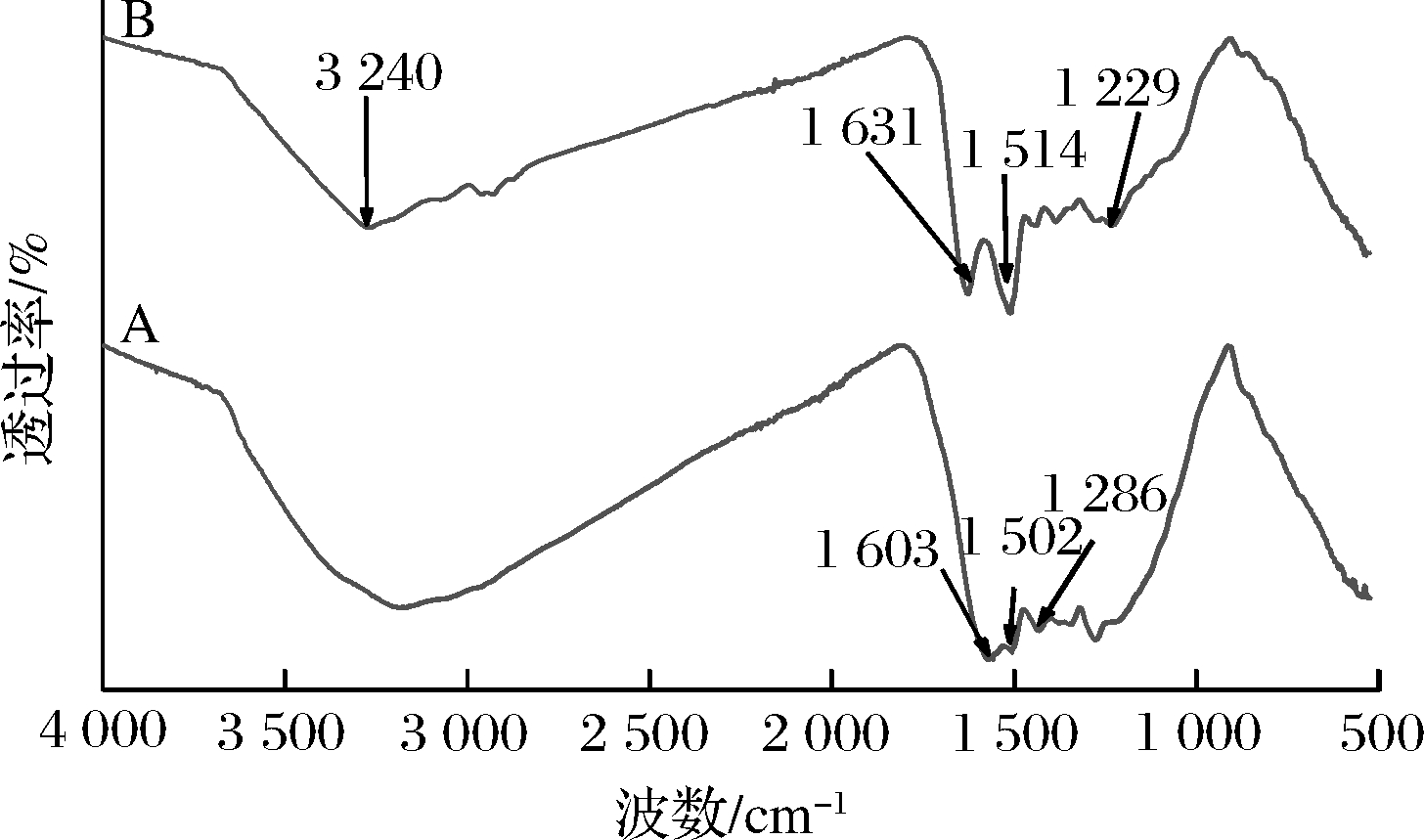
A-PDANPs;B-PDANPs@ Lecitase® Ultra
图4 PDANPs和PDANPs@Lecitase® Ultra 傅里叶红外吸收光谱图
Fig.4 FTIR spectra of PDANPs and PDANPs@Lecitase® Ultra
2.2.3 XPS分析
为了进一步确定Lecitase®Ultra是否结合在PDANPs表面,采用XPS对PDANPs及PDANPs@Lecitase®Ultra的表面元素进行分析。由图5-a可知,PDANPs表面含有3种主要的特征峰,分别是键能为284.8的C 1s峰、531.7 eV的O 1s峰和400.5 eV 的N 1s峰。相对于PDANPs,PDANPs@Lecitase®Ultra表面虽然峰的个数没有增加,但氮峰面积和氧峰面积明显增加,而Lecitase®Ultra是酶蛋白,富含氮元素和氧元素,表明Lecitase®Ultra已成功结合在PDANPs表面。图5-b和图5-c是PDANPs和PDANPs@Lecitase®Ultra的C 1s峰,C 1s峰可以拟合成4个特征峰,分别是键能为284.8 eV的C—C,286.0 eV的C—O(C—N),287.1 eV的C![]() N以及288.2 eV的C
N以及288.2 eV的C![]() O。比较图5-b、图5-c各个特征峰的含量,可得 PDANPs@Lecitase®Ultra表面的C
O。比较图5-b、图5-c各个特征峰的含量,可得 PDANPs@Lecitase®Ultra表面的C![]() N和C
N和C![]() O明显增加,分析其原因,C
O明显增加,分析其原因,C![]() N增加可能是由于酶蛋白的氨基与PDANPs中的醌发生席夫碱反应[19],生成C
N增加可能是由于酶蛋白的氨基与PDANPs中的醌发生席夫碱反应[19],生成C![]() N,而碳氧双键的增加可能是因为酶蛋白中C
N,而碳氧双键的增加可能是因为酶蛋白中C![]() O基团的引入,使峰面积增加,这与红外的结果一致,说明Lecitase®Ultra已固定在PDANPs上。
O基团的引入,使峰面积增加,这与红外的结果一致,说明Lecitase®Ultra已固定在PDANPs上。
2.2.4 二级结构含量分析
酰胺 Ⅰ 带(1 600 ~1 700 cm-1)对酶的二级结构变化很敏感,因此常被用来监测酶的构象变化。如图6所示,在1 600 ~1 700 cm-1,1 622、1 623 cm-1位置为β-折叠;在1 641 cm-1位置为无规卷曲,1 655、1 658 cm-1位置为β-螺旋;在1 675、1 678 cm-1处的谱带为β-转角结构[20]。如表1所示,游离Lecitase®Ultra经过固定化后,PDANPs@Lecitase®Ultra在酰胺 Ⅰ 带的二级结构含量发生了变化。其中,β-螺旋含量增加了2.03%,β-折叠含量增加了2.37%,β-转角含量减少了2.68%,无规则卷曲含量减少了0.72%。据报道,β-螺旋和β-转角的含量增加有助于极端条件下酶分子结构的稳定[11]。因此,可以推断游离Lecitase®Ultra经过固定化后,其稳定性增强。研究表明,酶的二级结构直接影响酶的催化活性[18],由图1和图2可知,固定化酶的蛋白固载率均大于酶活力回收率,这表明游离酶经固定化后酶活力略有下降,其原因可能是酶分子二级结构的变化导致酶表面的部分活性位点发生变化。周颖[21]利用磁性Fe3O4固定化果聚糖聚合酶时也发现游离酶经固定化后,酶活力下降,但下降的并不多,并且固定化酶表现出较高的稳定性。

a-PDANPs(A),PDANPs@Lecitase®Ultra(B)宽谱图;b-PDANPs C 1s谱图;c-PDANPs@Lecitase®Ultra C 1s谱图
图5 PDANPs及PDANPs@Lecitase®Ultra的XPS图谱分析
Fig.5 XPS spectrum of PDANPs and PDANPs@Lecitase® Ultra

a-Lecitase®Ultra;b-PDANPs@Lecitase®Ultra
图6 游离Lecitase®Ultra及PDANPs@Lecitase®Ultra的 二级结构分峰拟合图
Fig.6 The peak fitting of secondary structures of free Lecitase®Ultra and PDANPs@Lecitase® Ultra
2.3 PDANPs@Lecitase®Ultra的酶学性质研究
2.3.1 PDANPs@Lecitase®Ultra的最适pH和最适温度
pH值能影响酶分子的表面电荷和反应界面的稳定性,不适当的pH可能导致酶蛋白沉淀聚集(pH大多在等电点附近)。为此,图7-a考察了pH 为4.0~7.0的PDANPs@Lecitase®Ultra和游离Lecitase®Ultra的酶活力。由图7-a可知,PDANPs@Lecitase®Ultra的最适pH为6.0,游离Lecitase®Ultra的最适pH为5.0,即游离Lecitase®Ultra经固定化后最适pH后移了一个单位,分析原因,可能是载体PDANPs导致的微环境改变致使酶分子表面电荷性质的变化。据报道,固定化酶载体携带负电荷通常会导致酶分子的最适 pH 向碱性一侧移动,而携带正电荷则通常会导致酶分子的最适pH向酸性一侧移动[22]。研究表明,PDANPs在所示pH范围内带负电荷[17],因此Lecitase®Ultra经PDANPs固定化后反应最适pH后移。
表1 游离Lecitase®Ultra和PDANPs@Lecitase® Ultra 二级结构含量分析 单位:%
Table 1 Contents of secondary structures of free Lecitase®Ultra和PDANPs@Lecitase® Ultra
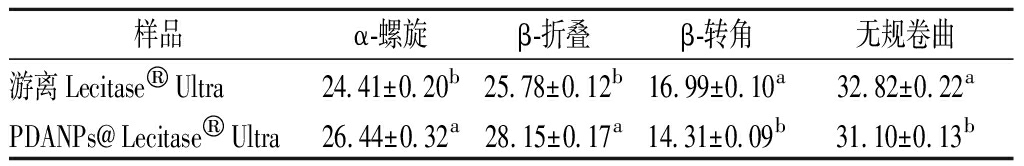
样品α-螺旋β-折叠β-转角无规卷曲游离Lecitase®Ultra24.41±0.20b25.78±0.12b16.99±0.10a32.82±0.22aPDANPs@Lecitase®Ultra26.44±0.32a28.15±0.17a14.31±0.09b31.10±0.13b
注:不同字母表示差异显著(P<0.05)
如图7-b所示,游离Lecitase®Ultra和PDANPs@Lecitase®Ultra的最适作用温度分别为50、55 ℃,即游离Lecitase®Ultra经固定化后最适作用温度增加了5 ℃。这可能是因为载体表面的活性基团通过共价键与酶蛋白相连,而共价键的形成使酶分子的刚性增强,也可能是因为大量酶分子结合在载体表面,使酶分子与底物结合的空间位阻变大,结合的难度也变大,当温度升高时,分子动能增加,底物和酶结合的概率也相应增加。此外,PDANPs@Lecitase®Ultra的最适温度提高可能对酶法脱胶效果产生积极作用,如最适温度提高,导致油脂黏度变小,流动性变好,有利于酶和油脂中磷脂分子的结合,促进了脱胶反应的进行。与本研究类似,YU等[23]在用改性MCM-41固定化脂肪酶也观察到固定化后脂肪酶的最适温度有所提高。

a-pH;b-温度
图7 游离Lecitase® Ultra和PDANPs@Lecitase® Ultra的最适pH和最适温度
Fig.7 Optimal pH and temperature of free Lecitase® Ultra and PDANPs@Lecitase® Ultra
2.3.2 PDANPs@Lecitase®Ultra的贮藏稳定性
固定化酶良好的贮藏稳定性可以有效地降低其在工业应用中的成本。由图8可知,将游离Lecitase®Ultra和PDANPs@Lecitase®Ultra于4 ℃条件下贮藏90 d,游离Lecitase®Ultra酶活力剩余36.7%,而PDANPs@Lecitase®Ultra酶活力剩余68.2%,说明游离Lecitase®Ultra经固定化后,贮藏稳定性增加,酶的使用寿命延长。分析原因,可能是酶经固定化后,载体的活性基团与酶分子形成多点交联,使酶的构象不容易发生变化,从而保持了酶分子催化活性中心构象的稳定[24]。这表明PDANPs@Lecitase®Ultra在长期贮藏中具有的明显优势,可以有效地降低成本。
2.4 PDANPs@Lecitase® Ultra用于茶油酶法脱胶研究
2.4.1 加酶量对PDANPs@Lecitase®Ultra脱胶效果的影响
由图9可知,磷含量随着固定化酶添加量的增加而逐步减少,加酶量为60 mg/kg 时,脱胶油的含磷量降低到10 mg/kg以下,增加酶量至80 mg/kg时,磷含量降低至5 mg/kg以下,再继续增加酶添加量脱胶油磷含量变化相对较小,这表明此时PDANPs@Lecitase®Ultra已将山茶油中非水化磷脂水解完全。磷脂脱除越彻底,对油脂的后续精炼工艺和品质越有利,因此80 mg/kg是固定化酶脱胶的较适加酶量。

图8 游离Lecitase® Ultra和PDANPs@Lecitase® Ultra的贮藏稳定性
Fig.8 Storage stability of Lecitase®Ultra and PDANPs@ Lecitase® Ultra
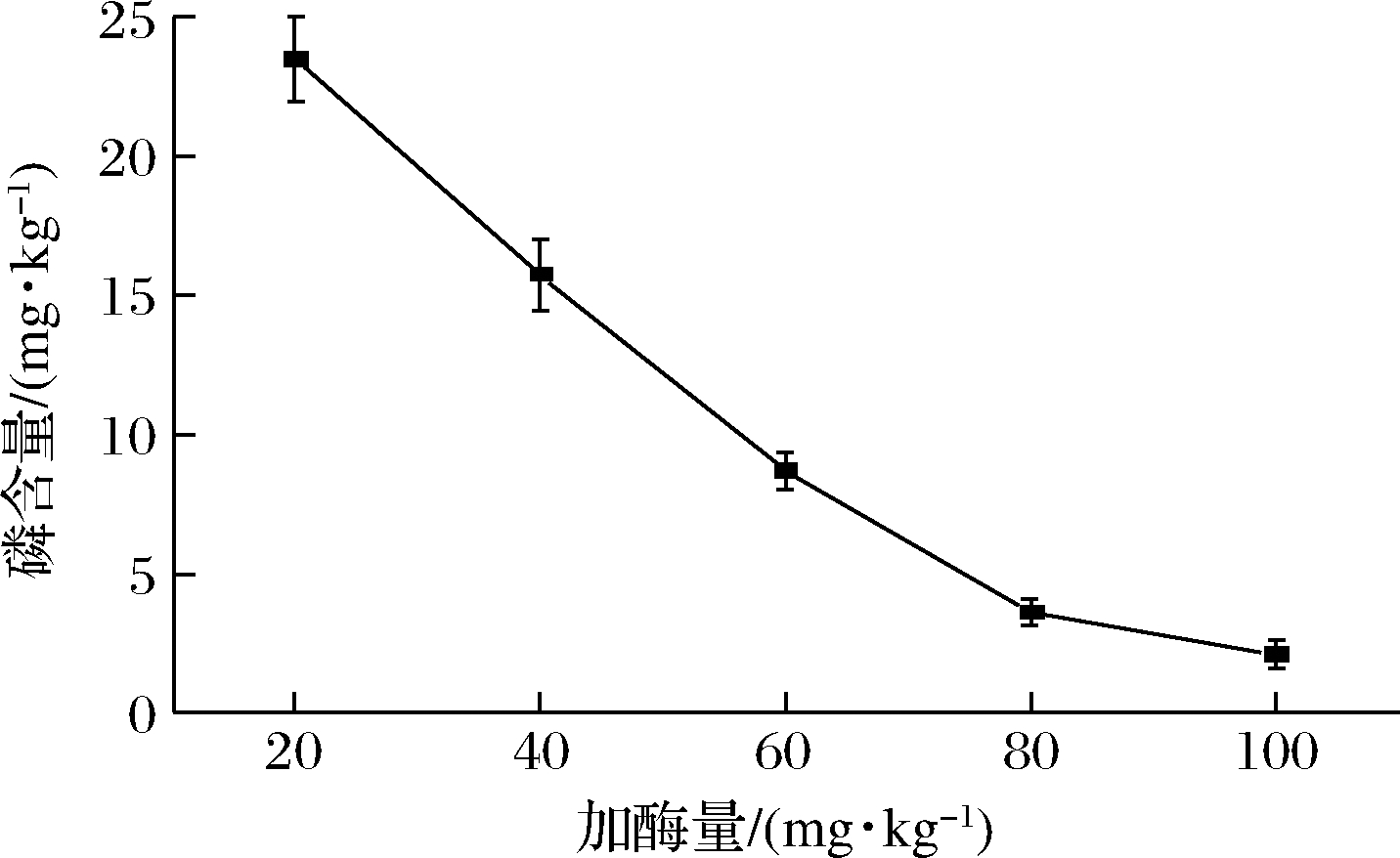
图9 加酶量对PDANPs@Lecitase® Ultra脱胶效果的影响
Fig.9 Effect of phospholipase dosage on degumming efficiency
2.4.2 反应pH对PDANPs@Lecitase®Ultra脱胶效果的影响
pH能够改变底物分子和固定化酶自身的电荷性质,进而影响到酶与底物的结合状态,对酶分子的催化能力有重要影响。此外,适当的pH也有利于油脂中的非水化磷脂转化为水化磷脂,使其移动至水相,缩短酶解时间,有利于PDANPs@Lecitase® Ultra活性的保持。由图10可知,当pH为4.5~6.0时,山茶油的磷含量显著下降,pH为6.0时,磷含量降至5 mg/kg以内,而当pH>6.0后磷含量又逐渐上升。这表明酶的催化效率在pH为6.0时最大,这与酶学性质测定中,PDANPs@Lecitase®Ultra最适pH结果相同。因此,确定PDANPs@Lecitase®Ultra脱胶的较适pH为6.0。
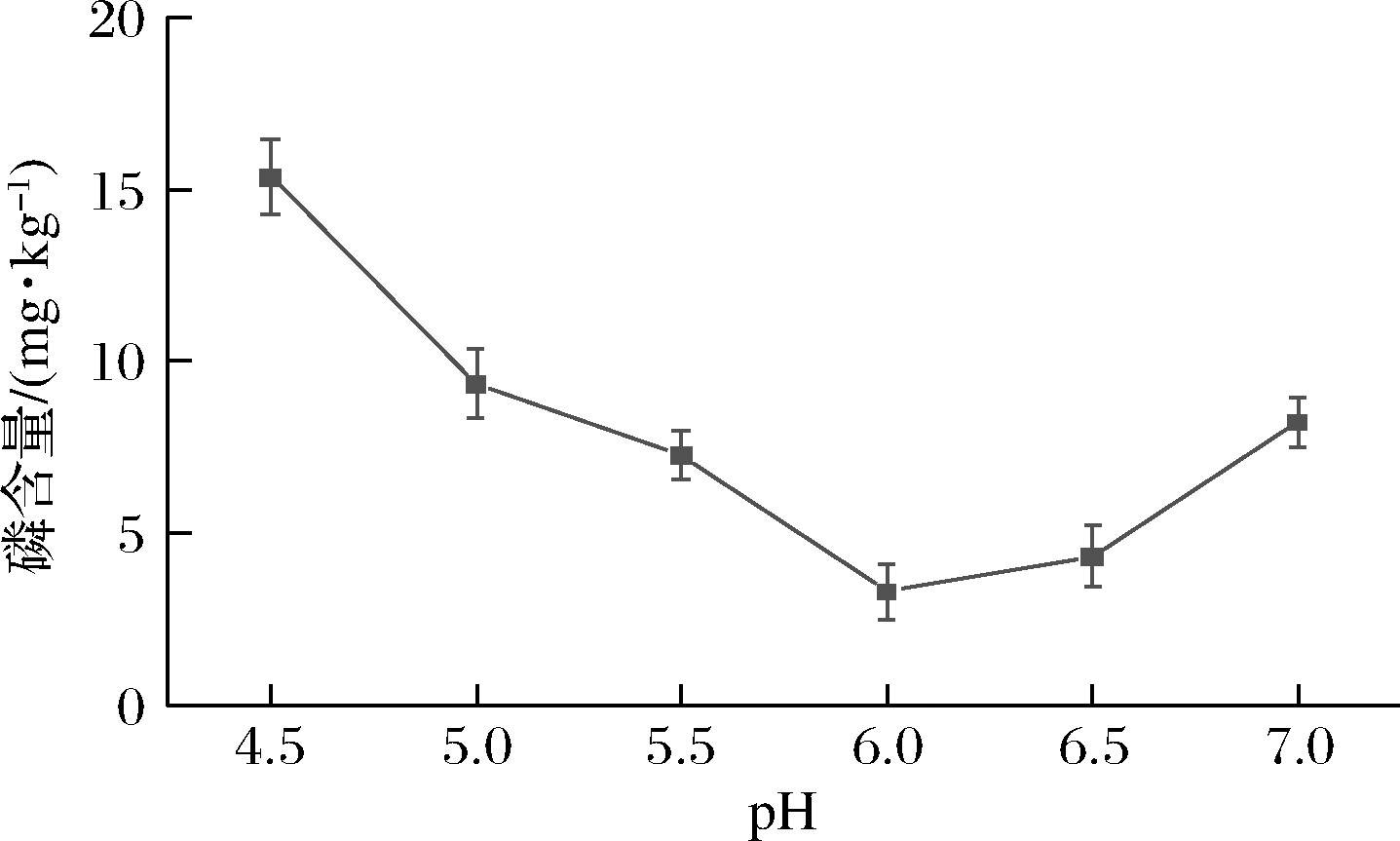
图10 反应pH对PDANPs@Lecitase® Ultra 脱胶效果的影响
Fig.10 Effect of pH on degumming efficiency
2.4.3 反应温度对PDANPs@Lecitase®Ultra脱胶效果的影响
酶促反应的良好效果离不开较适宜的温度。当温度范围较低时,随着温度的升高,酶与底物分子碰撞几率上升,反应速率加快;当温度超过一定范围时,酶的构象发生变化,易产生变性失活现象,导致酶催化速率降低。在图11温度范围内,山茶油的磷含量随着温度的升高呈现先下降后上升趋势。当温度为50~60 ℃时,固定化酶脱胶效果较好,脱胶油的磷含量均能降至10 mg/kg以内,而55 ℃时磷含量最低,为5.12 mg/kg,表明此时酶催化效果最好。因此,将PDANPs@Lecitase®Ultra的温度确定为55 ℃。
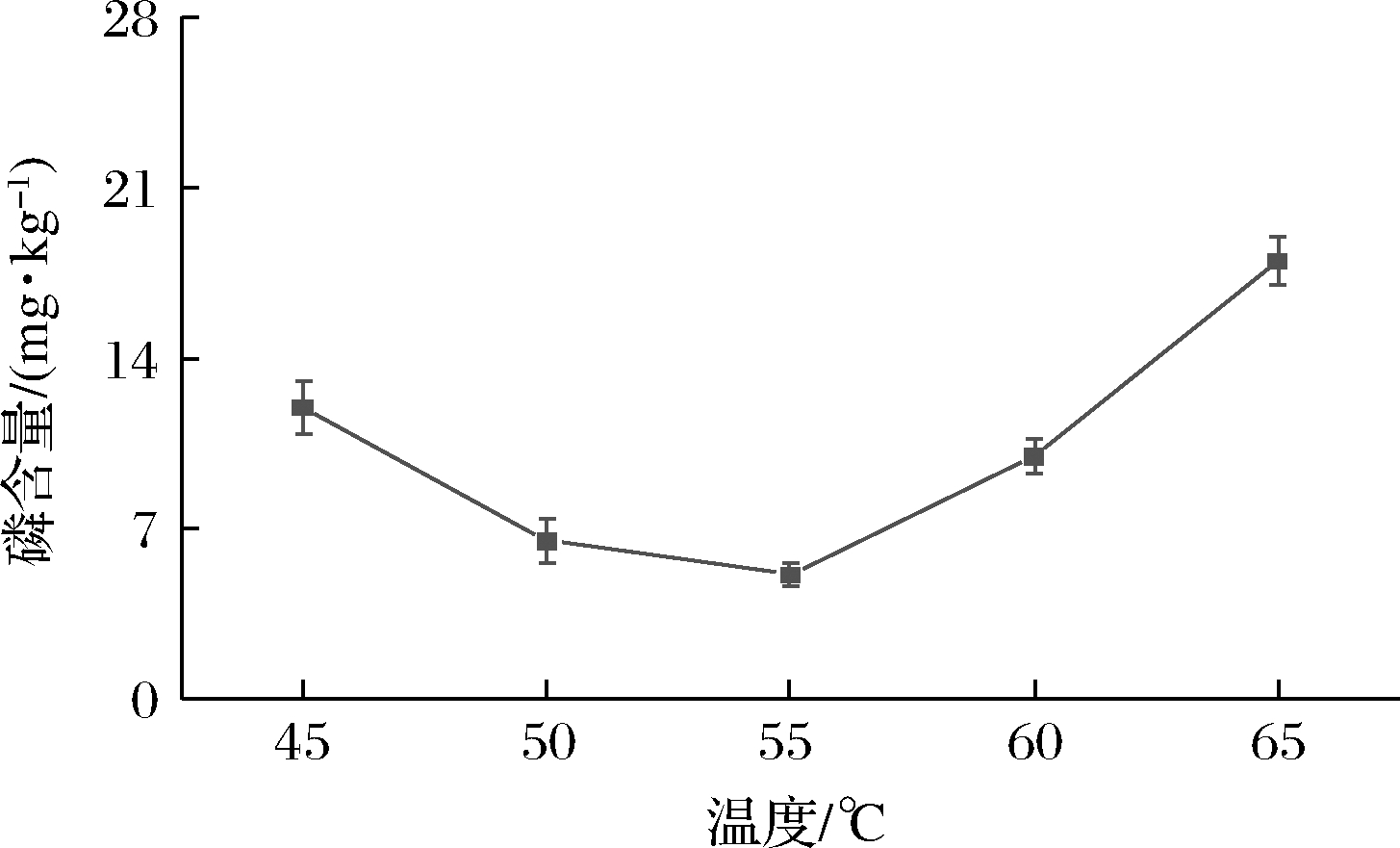
图11 反应温度对PDANPs@Lecitase® Ultra 脱胶效果的影响
Fig.11 Effect of temperature on degumming efficiency
2.4.4 PDANPs@Lecitase®Ultra的重复使用性
结果如图12所示,随着使用次数的增加,PDANPs@Lecitase®Ultra的相对酶活力逐渐降低,其中,在重复使用6次的过程中,PDANPs@Lecitase®Ultra的酶活力下降较快,酶活力仅为初始酶活力的66.1%,一方面是因为固定化酶催化过程中的酶活力损失,另一方面可能是因为固定化酶中的部分酶分子与载体没有充分结合,在重复使用中酶分子脱落,酶活性降低[25];而随着循环次数的增加,酶活力的下降趋势变缓,这部分酶活力损失可能是由搅拌过程中的机械损伤和长时间的催化反应造成的。PDANPs@Lecitase®Ultra重复使用10次后仍能保持57.6%的活性。水龙龙等[26]使用大孔树脂固定化Lecitase®Ultra,重复使用5次后,酶活力仅保留初始活性的47.9%,循环过程中油脂的磷含量一直能保持在4 ~10 mg/kg。这说明PDANPs@Lecitase®Ultra在应用于油脂脱胶时具有良好的重复使用性。

图12 PDANPs@Lecitase® Ultra的重复使用性
Fig.12 Reusability of PDANPs@Lecitase®Ultra
3 结论
本文利用PDANPs为载体对Lecitase®Ultra进行固定化,并将得到的固定化酶(PDANPs@Lecitase®Ultra)成功地应用于山茶油的脱胶。结果表明,PDANPs@Lecitase®Ultra具有优良的热稳定性和贮藏稳定性,应用于山茶油的脱胶时,脱胶油磷含量可降低至极低水平,且重复使用性良好,在油脂脱胶方面有良好的工业应用前景。此外,作为一种新兴的脱胶工艺,固定化酶脱胶对油脂品质的影响仍然需要进一步研究。
[1] LAMAS D L, CONSTENLA D T, RAAB D.Effect of degumming process on physicochemical properties of sunflower oil[J].Biocatalysis and Agricultural Biotechnology, 2016, 6:138-143.
[2] CHEW S C, NYAM K L.Refining of Edible Oils[M]//Lipids and Edible Oils.Amsterdam:Elsevier, 2020:213-241.
[3] 徐赢华, 王国敬, 李春, 等.酶法脱胶在植物油脂精炼中的应用进展[J].农业工程学报, 2015, 31(23):269-276.
XU Y H, WANG G J, LI C, et al.Application of enzymatic degumming on vegetable oils refining[J].Transactions of the Chinese society of Agricultural Engineering, 2015, 31(23):269-276.
[4] JIANG X F, CHANG M, WANG X S, et al.The effect of ultrasound on enzymatic degumming process of rapeseed oil by the use of phospholipase A1 [J].Ultrasonics Sonochemistry, 2014, 21(1):142-148.
[5] GOFFERJÉ G, MOTULEWICZ J, ST BLER A, et al.Enzymatic degumming of crude Jatropha oil:Evaluation of impact factors on the removal of phospholipids[J].Journal of the American Oil Chemists′ Society, 2014, 91(12):2 135-2 141.
BLER A, et al.Enzymatic degumming of crude Jatropha oil:Evaluation of impact factors on the removal of phospholipids[J].Journal of the American Oil Chemists′ Society, 2014, 91(12):2 135-2 141.
[6] VIRGEN-ORT Z J J, DOS SANTOS J C S, ORTIZ C, et al.Lecitase ultra:A phospholipase with great potential in biocatalysis [J].Molecular Catalysis, 2019, 473:110405.
Z J J, DOS SANTOS J C S, ORTIZ C, et al.Lecitase ultra:A phospholipase with great potential in biocatalysis [J].Molecular Catalysis, 2019, 473:110405.
[7] YU D Y, MA Y, XUE S J, et al.Characterization of immobilized phospholipase A1 on magnetic nanoparticles for oil degumming application[J].LWT-Food Science and Technology, 2013, 50(2):519-525.
[8] DENG X, CAO S L, LI N, et al.A magnetic biocatalyst based on mussel-inspired polydopamine and its acylation of dihydromyricetin[J].Chinese Journal of Catalysis, 2016, 37(4):584-595.
[9] CHAO C, LIU J D, WANG J T, et al.Surface modification of halloysite nanotubes with dopamine for enzyme immobilization [J].ACS Applied Materials & Interfaces, 2013, 5(21):10 559-10 564.
[10] ZHAO J X, MA M M, YAN X H, et al.Green synthesis of polydopamine functionalized magnetic mesoporous biochar for lipase immobilization and its application in interesterification for novel structured lipids production[J].Food Chemistry, 2022, 379:132148.
[11] DING S W, CARGILL A A, MEDINTZ I L, et al.Increasing the activity of immobilized enzymes with nanoparticle conjugation [J].Current Opinion in Biotechnology, 2015, 34:242-250.
[12] YE Y W, ZHENG L B, WU T T, et al.Size-dependent modulation of polydopamine nanospheres on smart nanoprobes for detection of pathogenic bacteria at single-cell level and imaging-guided photothermal bactericidal activity[J].Acs Applied Materials & Interfaces, 2020, 12(31):35 626-35 637.
[13] CAO S L, DENG X, XU P, et al.Highly efficient enzymatic acylation of dihydromyricetin by the immobilized lipase with deep eutectic solvents as cosolvent[J].Journal of Agricultural and Food Chemistry, 2017, 65(10):2 084-2 088.
[14] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[15] ZHAN J F, JIANG S T, PAN L J.Immobilization of phospholipase A1 using a polyvinyl alcohol-alginate matrix and evaluation of the effects of immobilization[J].Brazilian Journal of Chemical Engineering, 2013, 30(4):721-728.
[16] CAO D L, CHENG W J, TAO K, et al.Preparation of polydopamine-modified 3D interconnected macroporous silica for laccase immobilization[J].Macromolecular Research, 2018, 26(7):616-622.
[17] HO C C, DING S J.The pH-controlled nanoparticles size of polydopamine for anti-cancer drug delivery[J].Journal of Materials Science:Materials in Medicine, 2013, 24(10):2 381-2 390.
[18] DELFINO I, PORTACCIO M, DELLA VENTURA B D, et al.Enzyme distribution and secondary structure of sol-gel immobilized glucose oxidase by micro-attenuated total reflection FT-IR spectroscopy[J].Materials Science & Engineering C, 2013, 33(1):304-310.
[19] ZHENG G L, ZHANG D, ZHENG C, et al.Facile fabrication of biomimetic superoleophobic composite coating via Schiff base reaction and self-assembly[J].Progress in Organic Coatings, 2020, 142:105568.
[20] LOU W Y, ZONG M H, SMITH T J, et al.Impact of ionic liquids on papain:An investigation of structure-function relationships [J].Green Chemistry, 2006, 8(6):509-512.
[21] 周颖. 异源果聚糖蔗糖酶在B.subtilis中的分泌表达及固定化研究 [D].合肥:合肥工业大学, 2021.
ZHOU Y.Secretotry expression of heterologous levansucrase in B.subtilis and its immobilization [D].Hefei:Hefei University of Technology, 2021.
[22] SPINELLI D, FATARELLA E, DI MICHELE A, et al.Immobilization of fungal (Trametes versicolor) laccase onto amber lite IR-120 H beads:Optimization and characterization[J].Process Biochemistry, 2013, 48(2):218-223.
[23] YU D Y, ZHANG X, WANG T, et al.Immobilized Candida antarctica lipase B (CALB) on functionalized MCM-41:Stability and catalysis of transesterification of soybean oil and phytosterol [J].Food Bioscience, 2021, 40:100906.
[24] SATHISHKUMAR P, CHAE J C, UNNITHAN A R, et al.Laccase-poly (lactic-co-glycolic acid)(PLGA) nanofiber:Highly stable, reusable, and efficacious for the transformation of diclofenac[J].Enzyme and Microbial Technology, 2012, 51(2):113-118.
[25] XU M Q, LI F L, YU W Q, et al.Combined cross-linked enzyme aggregates of glycerol dehydrogenase and NADH oxidase for high efficiency in situ NAD(+) regeneration [J].International Journal of Biological Macromolecules, 2020, 144:1 013-1 021.
[26] 水龙龙, 操丽丽, 庞敏, 等.大孔树脂固定化磷脂酶 A1及其用于菜籽油脱胶工艺的优化[J].食品科学, 2018, 39(4):241-247.
SHUI L L, CAO L L, PANG M, et al.Optimization of process parameters for immobilization of phospholipase A1 onto macroporous resin and its application for degumming rapeseed oil[J].Food Science, 2018, 39(4):241-247.