肉品营养丰富,在加工、贮藏过程中极易遭受微生物污染,发生腐败变质。据统计,全球因微生物污染造成的食品腐败约占总食品损失的三分之一[1-2]。在中国,由微生物引起的肉品腐败损失高达8%[3],给肉类行业造成巨大的经济损失。其中,假单胞菌是一类需氧的革兰氏阴性细菌,是造成肉品腐败变质的重要原因[4],主要包括荧光假单胞菌(Pseudomonas fluorescens)、腐败假单胞菌(Pseudomonas putrefaciens)及嗜麦芽假单胞菌(Pseudomonas maltophila)等。添加防腐剂是抑制食品腐败的常用方式之一,目前使用较为广泛的食品防腐剂多为人工合成防腐剂,如苯甲酸盐、山梨酸盐、亚硝酸盐等。人工合成防腐剂具有成本低廉、作用高效便捷等优点,但其潜在安全问题受到广泛关注。研究证实,苯甲酸钠可导致人体发生过敏反应、哮喘和皮肤皮疹等[5];亚硝酸盐能够在体内转化为强致癌物亚硝胺,制约了其在肉品保鲜中的使用。
近年来,植物精油、溶菌酶、乳酸链球菌素(Nisin)等天然抗菌剂在食品保鲜中的应用受到广泛关注[6]。肉桂精油(cinnamon essential oil,CEO)是从肉桂树皮、树枝或树叶等分离得到的挥发性天然混合物,其主要活性成分包括肉桂醛、反式肉桂醛、α-萜品烯、β-榄香烯等[7]。研究证实CEO能够有效抑制食源性致病菌[8-9]。VAZIRIAN等[10]研究发现CEO能够有效抑制蜡样芽孢杆菌(Bacillus cereus)和鼠伤寒沙门氏菌(Salmonella typhimurium)的生长,并且对两种菌的最小抑菌浓度(minimum inhibitory concentration,MIC)均为0.5 μL/mL,最小杀菌浓度(minimum bactericidal concentration,MBC)均为1 μL/mL。ZHANG等[11]发现,经1.0 mg/mL的CEO处理后,大肠杆菌(Escherichia coli)与金黄色葡萄球菌(Staphylococcus aureus)细胞均发生破损;经测定,CEO对两种细菌的MBC分别为4 mg/mL和2 mg/mL。此外,也有研究发现,CEO能够有效抑制食品中的腐败菌。潘梦诗等[12]发现CEO对黄瓜中醋酸钙不动杆菌(Acinetobacter calcoaceticus)、类产碱假单胞菌(Pseudomonas pseudoalcaligenes)、金黄杆菌(Chryseobacterium sp.)和担子菌酵母(Chryseobacterium sp.) 4种优势腐败菌的MIC为0.125~0.5 ![]() 等[13]发现CEO对分离自酸奶的20种腐败酵母的MIC为0.31~1.25 μL/mL。然而CEO对肉中腐败菌的抗菌活性及作用机制尚不明确。因此,本文以分离自腐败鸡肉的假单胞菌CM2(Pseudomonas deceptionensis CM2)为研究对象,探究CEO对其抑菌活性及作用机制,以期为CEO在肉品保鲜领域的应用提供理论依据。
等[13]发现CEO对分离自酸奶的20种腐败酵母的MIC为0.31~1.25 μL/mL。然而CEO对肉中腐败菌的抗菌活性及作用机制尚不明确。因此,本文以分离自腐败鸡肉的假单胞菌CM2(Pseudomonas deceptionensis CM2)为研究对象,探究CEO对其抑菌活性及作用机制,以期为CEO在肉品保鲜领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
P.deceptionensis CM2菌株分离自腐败鸡肉。
CEO,上海源叶生物科技有限公司;碘化丙啶(propidium iodide,PI)、双(1,3-二丁基巴比妥酸)-三甲基乙氧醇[bis(1,3-dibutylbarbituric acid) trimethine oxonol,DiBAC4(3)]、EDTA、2′,7′-二氯荧光素二乙酸酯(2′,7′-dichlorohydrofluorescein diacetate,DCFH-DA)和N-苯基-1-萘胺(N-phenyl-1-naphthylamine,NPN),上海麦克林生化科技有限公司;胰蛋白胨大豆琼脂培养基(tryptone soy agar,TSA)、胰蛋白胨大豆肉汤培养基(tryptone soy broth,TSB),北京奥博星生物技术有限公司;PBS、BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司。
1.2 仪器与设备
TGL-16M台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司;JSM-700IF场发射扫描电子显微镜(field emission-scanning electron microscope,FE-SEM),日本JEOL公司;Tecan Spark 20M多功能微孔板读数仪,瑞士Tecan公司;Nano Drop 2000超微量分光光度计,美国Thermo公司;Bioscreen C全自动微生物生长曲线系统,芬兰Oy Growth Curves公司。
1.3 实验方法
1.3.1 菌悬液制备
从甘油保存管中挑取1环P.deceptionensis CM2菌液于TSA培养基中进行活化培养,之后挑取单菌落接种到TSB培养基,于25 ℃、150 r/min摇床恒温振荡培养12 h。所得菌液于8 000 r/min、4 ℃离心4 min,弃去上清液后用PBS清洗菌体2次,离心同上。将所得菌体用PBS重悬后并混匀,制成活菌数约为106~107 CFU/mL的菌悬液,备用。
1.3.2 CEO抑菌效果评价
参考DU等[14]的研究方法,采用微量肉汤稀释法测定CEO对P.deceptionensis CM2的MIC。在100孔细胞培养板的前3排各加入100 μL TSB(第一孔加199 μL TSB),之后在第一孔各加入1 μL CEO,用移液器吹打(3次以上)使CEO与TSB充分混匀,然后吸取100 μL混合溶液加入第二孔再次吹打混匀,照此添加至第7孔,从第7孔的混和溶液中吸取100 μL弃去;最后在每一孔中加入制备的菌液100 μL并混匀。此时每孔CEO含量从左到右依次为2.500、1.250、0.625、0.313、0.156、0.078、0.039 μL/mL。每排的第8孔加入100 μL TSB和100 μL菌悬液作为对照组;将培养板置于全自动生长曲线系统并于25 ℃恒温培养14 h,测定OD600值。选择抑制菌株的最低CEO浓度作为MIC,并选择合适浓度绘制生长曲线。在测定MIC的基础上,从MIC试验中每孔吸取100 μL的培养液,然后均匀涂布到TSA平板并于25 ℃培养24 h。最后观察计数,以无菌落的培养基所对应的最低CEO浓度作为MBC。
1.3.3 菌体形态观察
采用FE-SEM观察CEO对P.deceptionensis CM2菌体形态的影响[15]。菌悬液经CEO(1 MIC)25 ℃处理4 h后,于8 000 r/min离心4 min,弃上清液并用PBS洗涤2次,收集菌体,加入预冷的2.5%(体积分数)戊二醛溶液并于4 ℃固定4 h;离心收集菌体,用PBS洗涤样品3次,离心同上;分别用体积分数为10%、30%、50%、70%、90%和100%的乙醇溶液对样品逐级洗脱10 min,其中100%乙醇溶液洗脱2次;最后用乙酸异戊酯置换乙醇2次,每次10 min,离心同上,弃上清液并留取微量液体,混匀后滴到载玻片上,自然晾干,采用HVB-GB型真空蒸镀仪喷金150 s,通过JSM-700IF型FE-SEM观察并采集图像。
1.3.4 菌体细胞膜通透性评价
P.deceptionensis CM2菌悬液经终浓度为1/4 MIC、1/2 MIC和1 MIC的CEO处理4 h后,在8 000 r/min和4 ℃条件下离心4 min,收集上清液,采用NanoDrop 2000型超微量分光光度计测定上清液中的核酸含量;用BCA蛋白试剂盒检测上清液中的蛋白含量。
1.3.5 细胞膜完整性评价
分别用1/4 MIC、1/2 MIC及1 MIC的CEO在25 ℃条件下处理P.deceptionensis CM2菌悬液4 h,之后用PBS洗涤2次并重悬。
采用PI评价P.deceptionensis CM2的细胞质膜完整性[16]。向细菌重悬液中加入PI储备液(终浓度为3.0 μmol/L)并于暗处培养15 min,在8 000 r/min和4 ℃条件下离心4 min,收集菌体,用PBS洗涤2次并重悬。然后采用多功能微孔板读数仪测定荧光强度,激发波长为540 nm,发射光波长为630 nm。PI相对荧光强度计算如公式(1)所示:
相对荧光强度![]()
(1)
式中:F1为CEO处理组P.deceptionensis CM2细胞的荧光强度,F0为对照组细胞的荧光强度。
采用NPN荧光探针检测CEO对P.deceptionensis CM2细胞外膜的影响[11]。向细菌重悬液中加入终浓度为0.5 mmol/L的NPN储备液并置于室温暗处避光10 min。采用多功能微孔板读数仪测定荧光强度,激发波长为350 nm,发射波长为408 nm。NPN相对荧光强度按公式(1)计算。
1.3.6 细胞膜电位测定
参照LEE等[17]的试验方法,菌悬液经不同浓度的CEO(1/4 MIC、1/2 MIC和1 MIC)于25 ℃处理4 h后,离心收集菌体,将所得菌体与500 μL(5 μg/mL)DiBAC4(3)储备液和500 μL EDTA溶液(8 mmol/L)混合均匀,置于25 ℃暗处培养15 min,离心弃上清液。菌体用PBS洗涤2次并重悬。采用多功能微孔板读数仪测定样品荧光强度,激发波长为488 nm,发射光波长为525 nm。以未处理的样品为空白对照,结果表示为相对荧光强度。
1.3.7 菌体胞内活性氧水平测定
参考LIU等[18]的方法,采用DCFH-DA检测细胞内活性氧(reactive oxygen species,ROS)水平。菌悬液经不同浓度的CEO处理后,离心、洗涤并重悬于PBS(方法同1.3.5),之后加入终浓度为50 μmol/L的DCFH-DA溶液并于室温暗处培养20 min;离心弃上清液,用PBS洗涤2次并重悬。采用多功能酶标仪测定荧光强度,激发波长为480 nm,发射波长为525 nm。以未处理的样品为空白对照,结果表示为相对荧光强度。
1.3.8 数据处理
所有试验均重复3次,试验结果表示为平均值±标准差。采用Prism软件(Graphpad 8.0)绘图,IBM SPSS 20.0软件进行数据分析,采用单因素方差分析(ANOVA)中的最小显著差别(least significant difference,LSD)进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 CEO对P.deceptionensis CM2生长的影响
采用微量肉汤稀释法测得CEO对P.deceptionensis CM2的MIC为0.156 μL/mL,MBC为0.313 μL/mL。不同浓度CEO对P.deceptionensis CM2生长的影响见图1。
如图1所示,对照组P.deceptionensis CM2培养14 h后,OD600值由初始的0.228升高至0.617;与对照组相比,当CEO浓度为1/4 MIC和1/2 MIC时,P.deceptionensis CM2的OD600值有所下降,培养14 h后其OD600分别为0.473和0.293。当CEO浓度为1 MIC时,菌液OD600值未出现上升趋势,说明终浓度为1 MIC的CEO能够完全抑制P.deceptionensis CM2的生长。综上所述,CEO对P.deceptionensis CM2具有良好的抑制作用,且抗菌作用随其添加浓度的升高而增强。

图1 肉桂精油对P.deceptionensis CM2的杀菌曲线
Fig.1 Time-kill curves of CEO against P.deceptionensis CM2
2.2 CEO对P.deceptionensis CM2细胞形态的影响
通过FE-SEM研究CEO处理对P.deceptionensis CM2细胞形态的影响,结果见图2。

a-对照组;b-1 MIC CEO处理组
图2 肉桂精油对P.deceptionensis CM2细胞形态的影响
Fig.2 Effect of CEO on the morphology of P.deceptionensis CM2 cells
如图2所示,对照组P.deceptionensis CM2细胞形态正常,细胞结构完整,边界清晰,表面光滑。经终浓度为1 MIC的CEO处理4 h后,P.deceptionensis CM2细胞表面褶皱粗糙并且部分出现孔洞和塌陷现象,菌体变形严重,部分细胞表面有附着物堆积,这可能与胞内物质泄露有关[19]。以上结果与陈雪琴等[8]的研究相同。FE-SEM结果表明,CEO能够破坏P.deceptionensis CM2细胞结构,这可能是其失活P.deceptionensis CM2的重要机制之一。
2.3 CEO对P.deceptionensis CM2细胞膜通透性的影响
正常情况下,细菌的细胞膜具有一定的通透性,从而使细胞内外物质处于平衡状态[20]。通过测定胞外核酸和蛋白释放量评价CEO对P.deceptionensis CM2细胞膜通透性的影响,结果见图3。

a-核酸;b-蛋白
图3 不同浓度肉桂精油处理后P.deceptionensis CM2胞内 核酸与蛋白的泄漏量
Fig.3 Leakage of nucleic acids and proteins from P.deceptionensisCM2 cells treated with CEO at different concentrations
注:不同字母表示差异差异显著(P<0.05)(下同)
如图3所示,对照组P.deceptionensis CM2胞外核酸与蛋白含量分别为6.87 μg/mL和25.65 μg/mL。与对照组相比,P.deceptionensis CM2胞外核酸和蛋白含量随CEO添加浓度的增加而显著升高。经终浓度为1/4 MIC、1/2 MIC和1 MIC的CEO处理4 h后,P.deceptionensis CM2胞外核酸含量分别升高了9.5、10.9和13.5倍(P<0.05);胞外蛋白含量分别升高了2.5、3.4和4.7倍(P<0.05)。研究结果同BOUYAHYA等[21]的研究相一致。因此,CEO能够破坏P.deceptionensis CM2细胞的完整性,导致细胞膜通透性增加,使蛋白质、核酸等胞内物质释放到胞外而造成细菌死亡。
2.4 CEO对P.deceptionensis CM2细胞膜完整性的影响
细胞膜完整性对于维持细胞正常生命代谢活动具有重要意义[22]。P.deceptionensis CM2属于革兰氏阴性菌,由细胞质膜、细胞外膜等组成。PI是一种疏水性核酸染料,只能进入细胞质膜发生损伤的细胞并与核酸结合后产生红色荧光[23];NPN是一种疏水性荧光探针,在水溶液中只能发出微弱的荧光,然而当细胞外膜结构遭到破坏时,NPN可以进入疏水性的外膜内部磷脂层,造成其荧光强度增强[24]。分别采用PI和NPN荧光探针研究CEO对P.deceptionensis CM2细胞内膜和外膜完整性的影响,结果见图4。

a-内膜;b-外膜
图4 不同浓度肉桂精油对P.deceptionensis CM2细胞膜完整性的影响
Fig.4 The membranes integrity of P.deceptionensis CM2 cells treated with CEO at different concentrations
由图4-a可知,CEO处理组P.deceptionensis CM2细胞中PI相对荧光强度随其处理浓度的升高而显著增强。与对照组细胞相比,经终浓度为1/4 MIC、1/2 MIC和1 MIC的CEO处理4 h后,P.deceptionensis CM2细胞中PI相对荧光强度分别升高了8.0%、19.1%和32.6%(P<0.05)。上述结果与ZHAN等[25]的研究相一致。如图4-b所示,P.deceptionensis CM2细胞中NPN相对荧光强度随CEO处理浓度的升高而逐渐增强。经终浓度为1/4 MIC、1/2 MIC 和1 MIC的CEO处理4 h后,P.deceptionensis CM2细胞中NPN相对荧光强度分别升高了11.4%、39.4%和51.9%(P<0.05)。综上所述,CEO破坏了P.deceptionensis CM2细胞质膜和外膜,导致细胞膜渗透性增强并影响细胞正常生长代谢,从而造成细胞死亡。
2.5 CEO对P.deceptionensis CM2膜电位的影响
细胞膜电位是由细胞膜两侧不同浓度的离子产生的电位差,参与细胞增殖、代谢和能量产生等重要生理活动[26]。DiBAC4(3)是一种检测细胞膜电位的亲脂性阴离子荧光染料。当细菌细胞膜发生去极化时,DiBAC4(3)可以进入细胞并与胞浆内的蛋白质结合,从而使其荧光增强[27]。采用DiBAC4(3)研究不同浓度CEO对P.deceptionensis CM2细胞膜电位的影响,结果见图5。
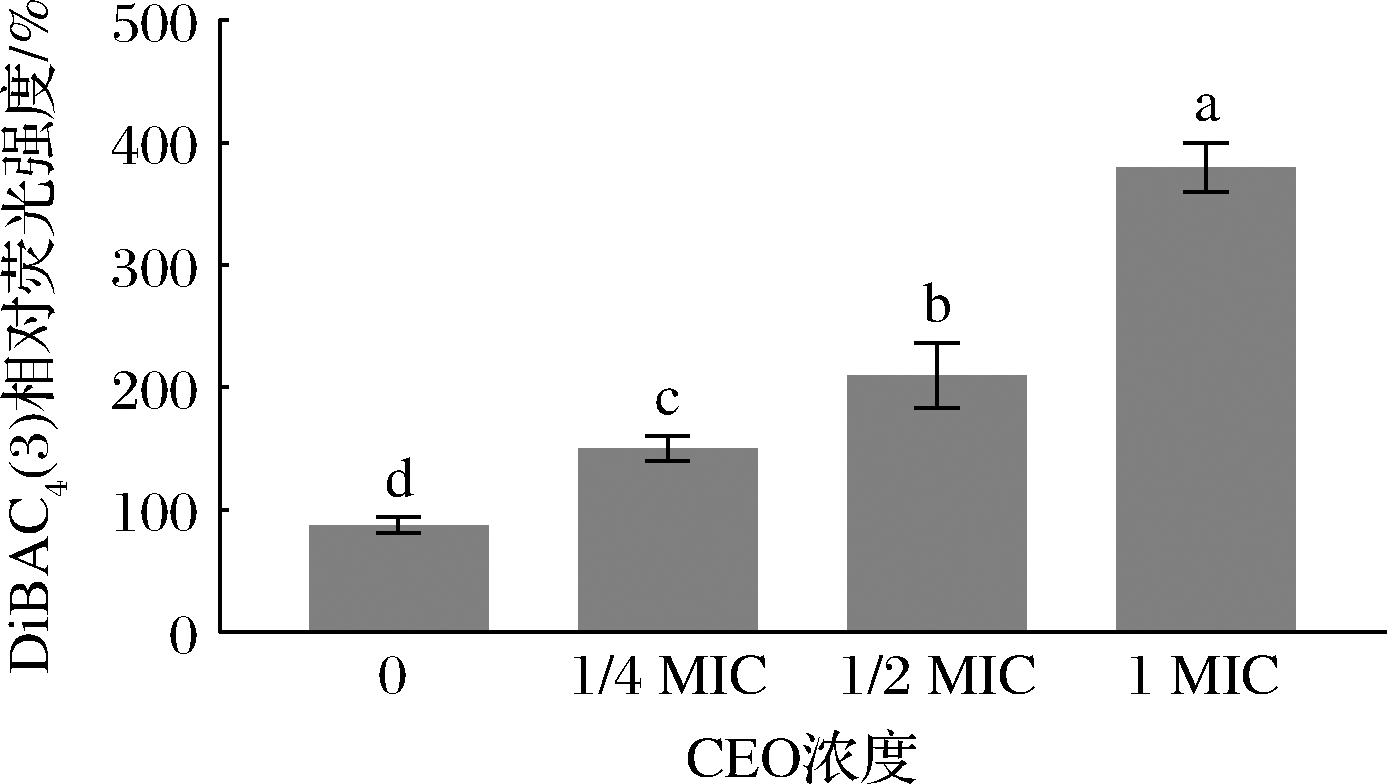
图5 不同浓度肉桂精油处理后P.deceptionensis CM2细胞膜电位的变化
Fig.5 Changes in the membrane potential of P.deceptionensis CM2 cells treated with CEO at different concentrations
如图5所示,与对照组相比,P.deceptionensis CM2细胞中DiBAC4(3)荧光强度随着CEO处理浓度的升高而增强。经终浓度为1/4 MIC、1/2 MIC和1 MIC 的CEO于25 ℃处理4 h后,P.deceptionensis CM2细胞中DiBAC4(3)荧光强度分别升高了0.5、1.1和2.8倍(P<0.05)。以上结果与李欣越等[28]的研究相一致。综上所述,CEO能够造成P.deceptionensis CM2细胞膜电位发生去极化,导致细胞代谢异常,从而影响菌体正常生长。
2.6 CEO对P.deceptionensis CM2细胞活性氧水平的影响
ROS是细胞在正常有氧代谢过程中产生的一类分子氧衍生物,参与细胞信号传导并维持细胞的正常生理活性。然而,ROS过度积累会造成胞内脂类、蛋白质和DNA等生物分子发生氧化损伤,进而影响细胞正常生理代谢活动[29]。DCFH-DA是一种用于检测细胞内ROS的探针。进入细胞后,DCFH-DA能够被胞内酯酶水解生成2′,7′-二氯二氢荧光素(dichlorodihydrofluorescein,DCFH),DCFH能够被胞内ROS氧化并生成强荧光产物2′,7′-二氯荧光素(2′,7′-dichlorofluorescein,DCF)。采用DCFH-DA探针检测CEO对P.deceptionensis CM2胞内ROS水平的影响,结果见图6。

图6 不同浓度肉桂精油处理后P.deceptionensis CM2细胞内ROS水平
Fig.6 The intracellular ROS levels of P.deceptionensis CM2 cells after OEO treatment at different concentrations
如图6所示,P.deceptionensis CM2胞内ROS水平随CEO处理浓度增大而逐渐升高。与对照组相比,经终浓度为1/4 MIC、1/2 MIC和1 MIC的CEO于25 ℃处理4 h后,P.deceptionensis CM2胞内ROS水平分别升高了12.9%、31.5%和45.0%(P<0.05),这与YANG等[30]的研究结果相一致。以上结果表明,CEO可导致P.deceptionensis CM2胞内ROS水平升高,并引发氧化应激反应。但CEO诱导P.deceptionensis CM2胞内ROS升高的分子机制尚不明确,仍有待深入研究。
3 结论
综上所述,CEO对分离自腐败鸡肉的P.deceptionensis CM2具有良好的抑制效果,且抑制效果随其添加浓度的升高而增强。经终浓度为1 MIC的CEO处理4 h后,P.deceptionensis CM2细胞膜通透性增强、细胞质膜和外膜被破坏、细胞膜发生去极化,胞内ROS水平升高,这可能是CEO失活P.deceptionensis CM2的主要机制之一。在今后的研究中,应进一步综合运用代谢组学、转录组学、蛋白质组学等方法系统阐明CEO失活微生物的分子机制;此外还应系统评价其对肉制品、鲜切果蔬等表面微生物的抑制作用及对食品营养和感官品质的影响,以推动CEO在食品保鲜领域的实际应用。
[1] KOUTSOUMANIS K, TSALOUMI S, ASPRIDOU Z, et al.Application of quantitative microbiological risk assessment (QMRA) to food spoilage:principles and methodology[J].Trends in Food Science &Technology, 2021, 114:189-197.
[2] SHAO L T, CHEN S S, WANG H D, et al.Advances in understanding the predominance, phenotypes, and mechanisms of bacteria related to meat spoilage[J].Trends in Food Science & Technology, 2021, 118:822-832.
[3] 陈坚. 中国食品科技:从2020到2035[J].中国食品学报, 2019, 19(12):1-5.
CHEN J.Food science and technology in China:From 2020 to 2035[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(12):1-5.
[4] LIU X, ZHANG M L, MENG X, et al.Inactivation and membrane damage mechanism of slightly acidic electrolyzed water on Pseudomonas deceptionensis CM2[J].Molecules(Basel,Switzerland), 2021, 26(4):1012.
[5] LENNERZ B S, VAFAI S B, DELANEY N F, et al.Effects of sodium benzoate, a widely used food preservative, on glucose homeostasis and metabolic profiles in humans[J].Molecular Genetics and Metabolism, 2015, 114(1):73-79.
[6] 杨焕彬, 曾庆培, 林光明, 等.生物保鲜剂在禽肉保鲜中的应用研究进展[J].轻工学报, 2021, 36(6):38-46.
YANG H B, ZENG Q P, LIN G M, et al.Research progress in the application of biological preservatives in poultry preservation[J].Journal of Light Industry, 2021, 36(6):38-46.
[7] 费莹莹, 张珍, 陈雪琴, 等.肉桂精油抑制肠出血性大肠杆菌O157:H7活性研究[J].食品与发酵工业, 2022,48(14):63-67.
FEI Y Y, ZHANG Z, CHEN X Q, et al.Inhibitory activity of cinnamon essential oil against enterohemorrhagic Escherichia coli O157:H7[J].Food and Fermentation Industries, 2022,48(14):63-67.
[8] 陈雪琴, 赵圆圆, 张珍, 等.肉桂精油的化学成分分析及其对沙门氏菌细胞膜损伤机制的研究[J].食品与发酵工业, 2022,48(14):24-32.
CHEN X Q, ZHAO Y Y, ZHANG Z, et al.Analysis of cinnamon essential oil composition and its mechanism of cell membrane damage in Salmonella enterica[J].Food and Fermentation Industries, 2022,48(14):24-32.
[9] 洪小利, 严媛, 林玲淼, 等.肉桂精油对食源性肠炎沙门氏菌和单增李斯特菌的抑菌作用[J].食品与发酵工业, 2021, 47(17):54-60.
HONG X L, YAN Y, LIN L M, et al.Antibacterial activity of cinnamon essential oil against foodborne Salmonella enteritidis and Listeria monocytogenes[J].Food and Fermentation Industries, 2021, 47(17):54-60.
[10] VAZIRIAN M, ALEHABIB S, JAMALIFAR H, et al.Antimicrobial effect of cinnamon (Cinnamomum verum J.Presl) bark essential oil in cream-filled cakes and pastries[J].Research Journal of Pharmacognosy, 2015, 2(4):11-16.
[11] ZHANG Y B, LIU X Y, WANG Y F, et al.Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J].Food Control, 2016, 59:282-289.
[12] 潘梦诗, 李博.黄瓜优势腐败菌的分离与鉴定及抑菌实验研究[J].食品科技, 2018, 43(11):12-18.
PAN M S, LI B.Isolation and identification of dominant spoilage bacteria of cucumbers and its antimicrobial experiments[J].Food Science and Technology, 2018, 43(11):12-18.
[13] ![]() V, SABBATINI R, GAROFALO C, et al.Evaluation of the inhibitory activity of essential oils against spoilage yeasts and their potential application in yogurt[J].International Journal of Food Microbiology, 2021, 341:109048.
V, SABBATINI R, GAROFALO C, et al.Evaluation of the inhibitory activity of essential oils against spoilage yeasts and their potential application in yogurt[J].International Journal of Food Microbiology, 2021, 341:109048.
[14] DU J, HU Z Y, YU Z Y, et al.Antibacterial activity of a novel Forsythia suspensa fruit mediated green silver nanoparticles against food-borne pathogens and mechanisms investigation[J].Materials Science & Engineering. C, Materials for Biological Applications, 2019, 102:247-253.
[15] XIANG Q S, KANG C D, NIU L Y, et al.Antibacterial activity and a membrane damage mechanism of plasma-activated water against Pseudomonas deceptionensis CM2[J].LWT-Food Science and Technology, 2018, 96:395-401.
[16] XIANG Q S, WANG W J, ZHAO D B, et al.Synergistic inactivation of Escherichia coli O157:H7 by plasma-activated water and mild heat[J].Food Control, 2019, 106:106741.
[17] LEE B, LEE D G.Synergistic antibacterial activity of gold nanoparticles caused by apoptosis-like death[J].Journal of Applied Microbiology, 2019, 127(3):701-712.
[18] LIU X, LI Y F, WANG S D, et al.Synergistic antimicrobial activity of plasma-activated water and propylparaben:Mechanism and applications for fresh produce sanitation[J].LWT-Food Science and Technology, 2021, 146:111447.
[19] LIU G R, SONG Z Q, YANG X L, et al.Antibacterial mechanism of bifidocin A, a novel broad-spectrum bacteriocin produced by Bifidobacterium animalis BB04[J].Food Control, 2016, 62:309-316.
[20] 张莲娇. 超声与百里香油纳米乳液协同杀菌机制及其初步应用研究[D].杭州:浙江大学, 2021.
ZHANG L J.Synergistic antibacterial mechanism of ultrasonication with thyme essential oil nanoemulsion and their application[D].Hangzhou:Zhejiang University, 2021.
[21] BOUYAHYA A, ABRINI J, DAKKA N, et al.Essential oils of Origanum compactum increase membrane permeability, disturb cell membrane integrity, and suppress quorum-sensing phenotype in bacteria[J].Journal of Pharmaceutical Analysis, 2019, 9(5):301-311.
[22] 萨仁高娃, 胡文忠, 冯可, 等.植物精油及其成分对病原微生物抗菌机理的研究进展[J].食品科学, 2020, 41(11):285-294.
SARENGAOWA, HU W Z, FENG K, et al.Antimicrobial mechanisms of essential oils and their components on pathogenic bacteria:A review[J].Food Science, 2020, 41(11):285-294.
[23] NESCERECKA A, HAMMES F, JUHNA T.A pipeline for developing and testing staining protocols for flow cytometry, demonstrated with SYBR Green I and propidium iodide viability staining[J].Journal of Microbiological Methods, 2016, 131:172-180.
[24] MUHEIM C, GÖTZKE H, ERIKSSON A U, et al.Increasing the permeability of Escherichia coli using MAC13243[J].Scientific Reports, 2017, 7(1):1-11.
[25] ZHAN J F, HE F, CAI H M, et al.Composition and antifungal mechanism of essential oil from Chrysanthemum morifolium cv.Fubaiju[J].Journal of Functional Foods, 2021, 87:104746.
[26] STRATFORD J P, EDWARDS C L A, GHANSHYAM M J, et al. Electrically induced bacterial membrane-potential dynamics correspond to cellular proliferation capacity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116 (19): 9 552-9 557.
[27] XU X H, JIANG Z L, FENG F Q. et al. Mechanisms of Nα-lauroylarginate ethyl ester against Penicillium digitatum and Pectobacterium carotovorum subsp. Carotovorum[J]. Journal of Food Science and Technology, 2018, 55(9): 3 675-3 682.
[28] 李欣越, 苟玉虹, 申瀚君, 等.山苍子精油抑制沙门菌作用机制研究[J].四川农业大学学报, 2021, 39(3):385-390.
LI X Y, GOU Y H, SHEN H J, et al.Antibacterial mechanism of Litsea cubeba essential oil on Salmonella[J].Journal of Sichuan Agricultural University, 2021, 39(3):385-390.
[29] EZRATY B, GENNARIS A, BARRAS F, et al.Oxidative stress, protein damage and repair in bacteria[J].Nature Reviews Microbiology, 2017, 15(7):385-396.
[30] YANG S K, YUSOFF K, THOMAS W, et al.Lavender essential oil induces oxidative stress which modifies the bacterial membrane permeability of carbapenemase producing Klebsiella pneumoniae[J].Scientific Reports, 2020, 10(1):1-14.