金花菌[1],学名“冠突散囊菌”,真菌类,散囊菌目、曲霉属,在云南的普洱熟茶中也有存在,是黑茶发酵形成重要风味和生物活性功能的重要菌株,能在低温、低湿、低水分的环境中生长[2-4]。冠突散囊菌能产生大量的茶黑素[[5],生成独特的芳香类物质及小分子糖类,能产生纤维素酶[6]和多酚氧化酶[7]转化生成多种具有芬芳味道的化合物[8-9],能有效消除茶叶枝梗的粗老气味,降低茶梗的涩味,增强抗氧化性,使茶汤呈红棕色,提升茶汤香气与甜味,滋味更加醇厚,能较好的改善茶香气、汤色及口感,降低苦涩味[10-11]。云南普洱大叶晒青毛茶,含有大量的茶多酚、茶多糖、氨基酸、蛋白质、生物碱、有机酸、维生素、果胶质等物质,营养丰富,但茶叶中的果胶质导致茶水浑浊,影响汤色[12]。果胶酶是一种水解酶[13-14],适量的果胶酶能将茶叶中的果胶质分解为D-半乳糖醛酸产物,降低茶叶中果胶质的浓度,使茶汤澄清透澈,口感柔和,有利于提升茶饮品质[15]。随着食品安全与加工的大力发展,高效的果胶酶系、良好的果胶酶品种及制备果胶酶的工艺研究成为当前应用开发的一大热点问题。因此,实验拟通过利用冠突散囊菌对普洱大叶毛茶在固态发酵模式条件下探索产果胶酶能力及果胶酶的酶学性质分析,力图开发来自茶叶基的高原特色食品果胶酶,避免外来培养基物质的影响,降低产品的不良气味,从而提升果胶酶产品质量。
1 材料与方法
1.1 实验材料
1.1.1 菌种与原料
冠突散囊菌SP-5,由云南师范大学微生物实验室分离保藏;普洱大叶毛茶,由云南普洱茶厂提供。
1.1.2 主要试剂
果胶,东京化成工业株式会社;X4252木聚糖,SIGMA公司;羟甲基纤维素钠,天津市光复精细化工研究所;D-半乳糖醛酸标准品,Sigma公司;木糖标准品和葡萄糖标准品,中国医药(集团)上海化学试剂公司,用于标准曲线的制备。
DNS试剂:称取182 g酒石酸钾钠,加入到500 mL蒸馏水中,置于45 ℃水浴搅拌,加入40 g NaOH,搅拌溶解完,依次加入5.5 g苯酚,5.2 g无水亚硫酸钠和6.3 g 3,5-二硝基水杨酸,同时不断搅拌,直到溶液完全溶解,冷却至室温,用蒸馏水定容至1 000 mL,保存于棕色瓶中避光保存7 d后使用。
1.1.3 培养基
(1)土豆固体培养基:20%(质量分数)的土豆浸出汁、2%(质量分数)琼脂,pH=7,在121 ℃,0.1 MPa条件下,灭菌25 min;
(2)果胶液体发酵培养基:1%果胶、0.5%氯化钠、1%硫酸铵(均为质量分数),pH=7,在121 ℃,0.1 Mpa条件下,灭菌25 min;
(3)木聚糖液体发酵培养基:1%木聚糖、0.5%氯化钠、1%硫酸铵(均为质量分数),pH=7,在121 ℃,0.1 MPa条件下,灭菌25 min;
(4)纤维素液体发酵培养基:1%羟甲基纤维素钠、0.5%氯化钠、1%硫酸铵(均为质量分数),pH=7,在121 ℃,0.1 MPa条件下,灭菌25 min。
(5)BIOLOG专用FF培养液:0.03%吐温40,结冷胶0.25%(均为质量分数),121 ℃,0.1 MPa条件下,灭菌30 min。
1.1.4 设备与仪器
LDZX-50KB立式高压蒸汽灭菌锅,上海申安医疗器械厂;UV-5100 紫外分光光度计,上海元析仪器有限公司;WH240-HT磁力搅拌器,德国WIGGENS公司;ME104E电子天平,德国梅特勒公司;FE20 pH计,德国梅特勒公司;NSKY 恒温培养振荡器,上海苏坤实业有限公司;SW-CJ-1F 超净工作台,苏净集团苏州安泰空气技术有限公司;HR/T 16W高速冷冻离心机,湖南赫西仪器教备有限公司;BWS-20 恒温水浴锅,上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 D-半乳糖醛酸标椎曲线的制作
D-半乳糖醛酸标准溶液的配制:准确称取25 mg D-半乳糖醛酸标准品,加入少量纯净水搅拌振荡,待标准品完全溶解后,定容至25 mL,终质量浓度为1.0 mg/mL。
绘制标准曲线:取7支25 mL具塞试管,分别加入0、0.2、0.4、0.6、0.8、1.0、1.2 mL的1.0 mg/mL的D-半乳糖醛酸标准溶液,在依次向试管中加入蒸馏水2.0、1.8、1.6、1.4、1.2、1.0、0.8、0.6、0.4、0.2、0.0 mL,摇匀;在每支试管中加入3.0 mL DNS试剂,混匀,沸水浴保温5.0 min,取出流水冷却,每支试管中补加蒸馏水10.0 mL,混合摇匀,以无D-半乳糖醛酸的试管为空白,在540 nm下比色。以D-半乳糖醛酸含量为纵坐标,吸光度值为横坐标,绘制标准曲线,求出系数k,得出D-半乳糖醛酸标准曲线线性回归方程为y=0.973x+0.063,k=0.973, R2=0.999 8>0.99,式中x表示测定的吸光度(OD)值,y表示D-半乳糖醛酸含量(mg)。
1.2.2 酶活力测定
1.2.2.1 果胶酶活力测定
酶液制备:用天平准确称量1.00 g发酵茶叶干粉,加入10 mL蒸馏水,在磁力搅拌器上混合5.0 min;于5 000 r/min条件下离心5 min,取离心上清液过0.22 μm的过滤器,形成的过滤液供酶活力测定使用。
酶活力定义:1 U指在一定反应温度和pH条件下,每克酶粉每分钟降解1%果胶底物产生1 μmoL D-半乳糖醛酸所需要的酶量为1个单位,计算如公式(1)所示:
果胶酶活力![]()
(1)
式中:0.894为曲线斜率;0.023为曲线截距;n为稀释倍数;1 000为mg变为μg的转换系数;194.14为半乳糖醛酸分子质量,Da;0.2为酶液体积,mL;10为反应时间,min。
1.2.2.2 木聚糖酶活和纤维素酶活力测定
测定方法采用GB/T 23874—2009 《饲料添加剂木聚糖酶活力的测定 分光光度法》和GB/T 23881—2009 《饲用纤维素酶活性的测定 滤纸法》。
1.2.3 冠突散囊菌SP-5的活化
用无菌接种针挑破冠突散囊菌落表面,释放黑色液体,使用接种环蘸取黑色液体,涂抹土豆固体培养基表面,于28 ℃恒温培养箱中培养8 d,肉眼观察获得生长的菌落,放置于4 ℃冰箱保藏。
1.2.4 冠突散囊菌SP-5的碳源代谢谱图分析
使用无菌的棉签刮取生长SP-5菌株上的孢子,放入FF培养液,混合均匀,光透过率为95%,倒入V型槽,使用移液器吸取菌悬液到96孔培养板中,每个单孔加入100 μL菌悬液。将鉴定板正置于28 ℃培养箱中培养72 h,用BIOLOG仪器读数。根据图谱分析碳源利用情况,获得冠突散囊菌能利用的单糖,以单糖推导多聚物底物,从而设计相关结构类似物作为SP-5的诱导底物,设计产酶路线及代谢通路,测定酶活力。
1.2.5 冠突散囊菌SP-5对碳源底物利用分析
使用无菌接种针挑取冠突散囊菌孢子,分别在果胶、木聚糖、纤维素CMC液体培养基中,每类培养基做3个平行,于28 ℃恒温培养箱中培养5 d,测定酶活力。
1.2.6 培养基含水量对冠突散囊菌SP-5生长的影响
用果胶培养基纯化冠突散囊菌SP-5菌株,并将其转移到果胶液体培养基中,于28 ℃恒温培养振荡器中培养发酵5 d,取冠突散囊菌SP-5菌液接种于不同含水量(20%、30%、40%、50%、60%、70%)的茶叶中,接种量为5 mL/100g茶叶,包扎瓶口,摇晃振荡培养基后,放入28 ℃恒温箱中培养5 d,通过肉眼观察菌种在茶叶中的生长,发酵样品烘干进行果胶酶活力测定。
1.2.7 果胶酶最适反应pH、温度测定
取10 g发酵茶叶粉碎,称2.00 g粉碎样品于100 mL烧杯中,加入40 mL 50 ℃蒸馏水,于磁力搅拌器上搅拌10 min,倒入离心管中,在15 000 r/min离心5 min,取上清液作为待测酶液。
配制pH不同的0.2 mol/L磷酸-柠檬酸缓冲液,pH分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0的果胶底物溶液各10 mL,做标记。再取9组试管,每组3支,每组试管标记好为空白管和A、B管,每组试管各加入对应pH果胶底物溶液1.8 mL,于50 ℃水浴中保温5 min,A、B管加入0.2 mL待测酶液,于50 ℃水浴中保温10 min,加入3 mL DNS试剂终止反应,然后混合均匀,空白管中补加0.2 mL酶液,并将所有试管放于沸水浴中保温5 min,取出流水冷却,再加入0.5 mL 20%(质量分数)NaOH,补加9.5 mL蒸馏水,振荡摇匀于540 nm下比色,进而确定果胶酶最适反应pH。
利用磷酸-柠檬酸缓冲液配制果胶底物pH 3.5的溶液100 mL,取9组试管,每组3支,标记好空白管和实验A、B管,每支试验中加入果胶底物溶液1.8 mL,每3支试管放置在一个温度梯度中,温度梯度设置为30、35、40、45、50、55、60、70、80 ℃;试管在水浴中保温5 min,各梯度的A、B管中各加入0.2 mL待测酶液,保温10 min,各试管都加入3 mL DNS试剂终止反应,空白试管中补加0.2 mL酶液;试管混合均匀,放置在沸水浴中保温5 min,取出流水冷却,每支试管中再加入0.5 mL 20%(质量分数)的NaOH,补加9.5 mL蒸馏水,振荡摇匀于540 nm下比色,依据颜色深浅确定果胶酶最适反应温度。
1.2.8 果胶酶稳定性分析
取10 mL待测酶液置于80 ℃水浴中保温并计时,每隔10 min取酶液测定酶活力,分析果胶酶的热稳定性,反应时间为60 min;
取pH 2.0的缓冲液9 mL,加入1 mL果胶酶离心上清液,混合均匀,置于50 ℃水浴中保温并计时,每隔10 min取酶液测定酶活力,确定果胶酶的耐酸稳定性,反应时间为60 min。
1.2.9 冠突散囊菌果胶酶的动力学分析
利用磷酸-柠檬酸缓冲液配制果胶底物pH 3.5的溶液100 mL,分别配制质量浓度为0、0.312 5、0.625、1.25、2.5、5、10 g/L的溶液各10 mL,取7组试管,标记为0~6,每组试管各加入不同浓度的果胶底物溶液1.9 mL,于50 ℃水浴中保温5 min,取待测酶液0.1 mL,于50 ℃水浴中保温反应5 min,加入3 mL DNS试剂终止反应,然后混合均匀,所有试管放于沸水浴中保温5 min,取出流水冷却,再加入0.5 mL 20% NaOH,补加9.5 mL蒸馏水,振荡摇匀于540 nm下比色,计算反应速度,绘制果胶酶动力学曲线图。
1.2.10 金属离子对果胶酶活力的影响
分别配制1 mg/mL的Mg2+、Cu2+、Fe3+、Ca2+、K+、Ag+溶液 10 mL。取18支具塞试管,每组3支并做好标记,标记好空白管和实验A、B管,每支试验中加入pH 3.5的1%果胶底物1.7 mL,每3支试管对应一个金属离子,均加入对应的金属离子0.1 mL,50 ℃水浴中保温5 min,A、B管加入0.2 mL待测酶液,于50 ℃保温10 min,加入3 mL DNS试剂终止反应,混合均匀,空白管中补加0.2 mL酶液,混匀,所有试管于沸水浴中保温5 min,取出流水冷却,每支管中加入0.5 mL 20% NaOH,补加9.5 mL蒸馏水,振荡摇匀于540 nm下比色,依据颜色深浅分析金属离子对果胶酶活力的影响。
1.2.11 实验统计分析
实验结果采用Excel软件进行数据处理和分析,数学公式采用Mathtype软件处理,Origin 2022软件用于作图曲线拟合和统计分析,统计分析采用正态性检验Shapiro-Wilk检验和单因素方差分析Tukey检验。
2 结果与分析
2.1 冠突散囊菌SP-5菌落形态观察
金花菌SP-5是一类能产生特殊香气的曲霉属,表面菌落致密,能形成金黄色孢子。图1-a为SP-5在果胶培养基上的生长状态,第3天为白色菌丝,每天同向性延伸,到第8天,菌丝已经形成一个直径2 cm的菌落。图1-b为土豆培养基上培养的冠突散囊菌SP-5,表面形成的菌落犹如一朵朵金花。
2.2 SP-5菌株的碳源代谢谱图分析
利用SP-5菌株对霉菌鉴定板中特有的75种碳源的利用情况,发现SP-5菌能利用D-核糖、D-木糖、D-阿拉伯糖、L-阿拉伯糖、D-葡萄醛酸、D-半乳糖醛酸,尤其对D-核糖、D-木糖的利用最好。由于核糖和木糖是五碳糖,在代谢通路上和其他六碳糖有差异,表明SP-5菌的代谢肯定有其特殊性,在对多聚木糖进行降解过程中必然要产生木聚糖酶降解多聚木糖形成木糖,用于提供碳源物质。同理,SP-5利用半乳糖醛酸构成的多聚半乳糖醛酸进行生长,必然伴随着果胶酶产生。而在有机材料中,半乳糖醛酸存在于果胶中,木糖存在于半纤维素的特点,大叶毛茶中含有大量的纤维素、半纤维素和果胶物质物质。通过对发酵产物测定果胶酶活力、木糖酶活力和纤维素酶活力,由图2可知,SP-5菌能产生果胶酶、木聚糖酶和纤维素酶,表明在有多聚糖底物存下能诱导产酶。

a-果胶平板;b-土豆平板
图1 冠突散囊菌SP-5的生长状态
Fig.1 Growth status of E.cristatum SP-5
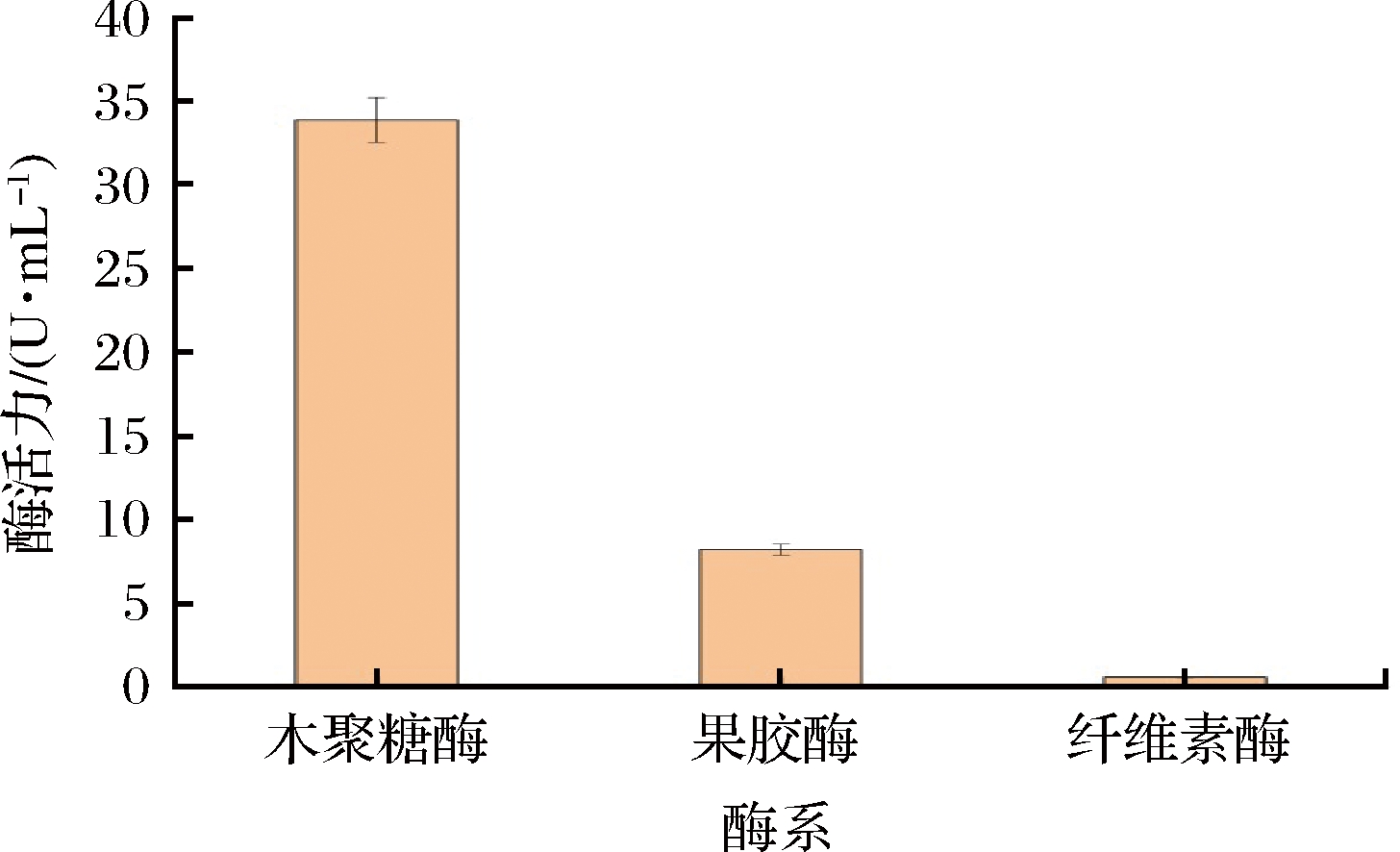
图2 冠突散囊菌SP-5的酶系
Fig.2 Enzyme system of E.cristatum SP-5
2.3 培养基含水量对冠突散囊菌SP-5生长及产果胶酶的影响
冠突散囊菌SP-5是从茶饼中分离,为分析SP-5生长受水分的影响。实验选取了含水量为20%~60%比例的茶叶培养基进行SP-5菌的培养。由图3可知,菌丝在培养基中含水量高,湿度大的条件下容易导致SP-5长菌丝,并伴随着无性繁殖,大量的黑色孢子产生,具有黑曲霉特征,而在含水量低,湿度低的条件下易通过子囊果产生大量的黄色孢子,表明该冠突散囊菌具有独特的耐旱功能,即使在20%含水量茶叶中都能生长,远远超越了其他真菌的抗旱能力。实验表明通过对茶叶的固态发酵,利用水分的控制,能有效调节冠突散囊菌SP-5的生长繁殖方式,如要导致大量的子囊果产生金黄色孢子,培养基的含水量则要偏低。我们接种SP-5到茶叶的液体培养基中进行发酵,菌丝进行有性繁殖,没有产生孢子,伴随大量的黑色素释放,导致发酵液呈墨黑色。由图4可知,在对不同水分培养SP-5的代谢产物中,检测到的果胶酶活力能达到12.52 U/g干曲,随着培养基含水量的增加,SP-5产果胶酶能力是降低的。

a-21%;b-30%;c-40%;d-50%;e-60%
图3 不同含水量对冠突散囊菌SP-5生长的影响
Fig.3 Effects of different water content on growth of E.cristatum SP-5
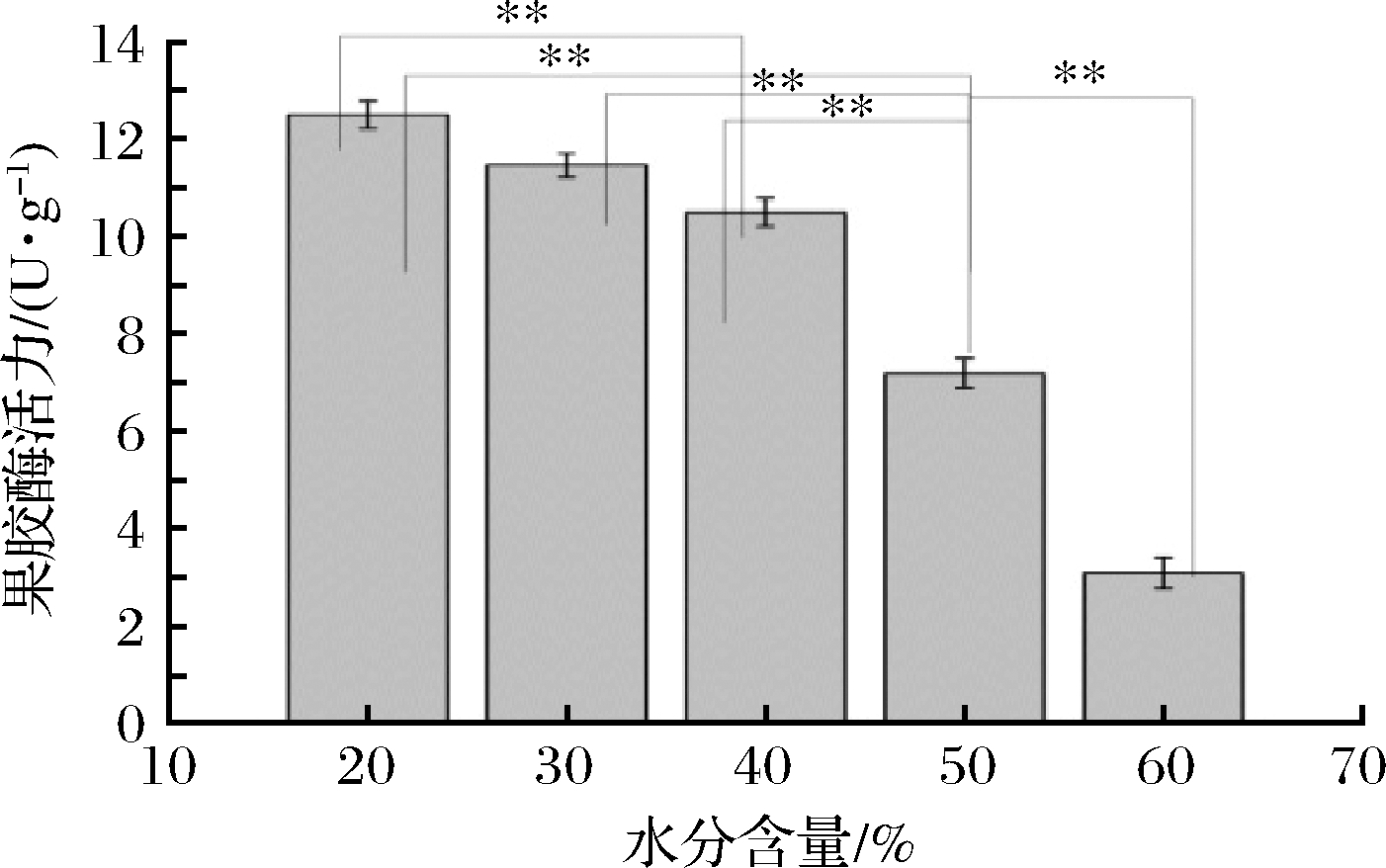
图4 茶基质含水量对冠突散囊菌SP-5产果胶酶的影响
Fig.4 Effect of water content of tea substance on pectinase production of E.cristatum SP-5
注:**表示差异显著(P<0.01)
冠突散囊菌在干旱的条件下体现了强大的生长能力,尤其在含水量为20%的条件下都能生长,这种耐旱的生长特性也说明古代通过马驮,人挑运输茶饼过程中,含有冠突散囊菌的茶叶在含有一定水分的情况下,依然能够生长,引发茶叶后熟增香增色的现象。果胶酶是改善茶叶品质的重要酶系,在含水量不同条件下不同微生物分泌产生的果胶酶活力差异也大。表1显示了固态发酵产果胶酶的菌株主要有黑曲霉、青霉属、毛霉、细菌为主,培养基的含水量要控制在40%~70%,低于40%以下的培养基不利于微生物生长,而冠突散囊菌具有极高的耐旱性,可利用该菌株进行培养基优化,提升产果胶酶、木聚糖酶、纤维素酶的研究开发,有利于环境废弃物的处理、发酵饲料的开发,大幅降低环境的污染和干燥能耗。
表1 产果胶酶菌株固态发酵比较一览表
Table 1 Comparison of pectinase-producing strains in solid-state fermentation
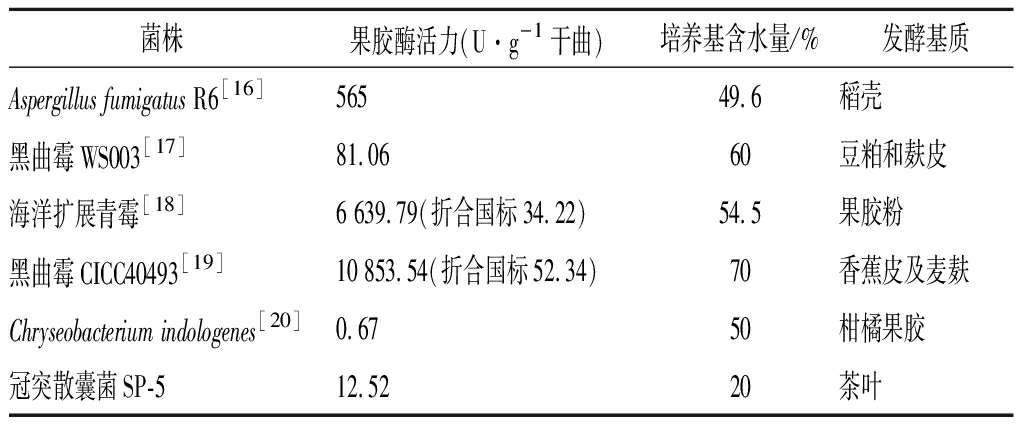
菌株果胶酶活力(U·g-1干曲)培养基含水量/%发酵基质Aspergillus fumigatus R6[16]56549.6稻壳黑曲霉WS003[17]81.0660豆粕和麸皮海洋扩展青霉[18]6 639.79(折合国标34.22)54.5果胶粉黑曲霉CICC40493[19]10 853.54(折合国标52.34)70香蕉皮及麦麸Chryseobacterium indologenes[20]0.6750柑橘果胶冠突散囊菌SP-512.5220茶叶
2.4 冠突散囊菌SP-5发酵中代谢产物果胶酶酶学性质的研究
2.4.1 果胶酶最适反应pH、温度测定
为了分析冠突散囊菌SP-5代谢形成的果胶酶的性质差异,实验对果胶的最适反应温度和pH进行了分析,通过滤膜处理测定相对酶活力。由图5-a可知,果胶酶最适反应温度为50.0 ℃,当反应温度达到90.0 ℃时,果胶酶蛋白受温度影响变性,催化活性基本丧失,残余酶活力只有5.0%,该果胶酶的反应温度趋势与罗雯等[21]利用黑曲霉CM3制备的果胶酶酶学性质相一致,表明冠突散囊菌SP-5形成的果胶酶特性和黑曲霉产生的果胶酶特性相接近。图5-b为果胶酶的作用pH的分布,其最适pH为3.50;当pH>3.50时,果胶酶催化活性随pH的升高而不断降低。
2.4.2 果胶酶稳定性分析
为分析果胶酶在耐热条件下的稳定性,我们对果胶酶的耐热性进行了分析。将果胶酶液置于80 ℃恒温水浴锅中保温,每10 min取样测定果胶酶活力。由图6-a可知,随时间的推移果胶酶活力不断降低,维持到60 min时相对酶活力为15%,通过logistic模型进行曲线拟合,拟合公式为![]() 半衰期为30.28 min;考虑果胶酶进入人体胃肠道,而胃液的pH为2.0~3.5,对果胶酶的耐酸性展开试验,本文通过缓冲液调节果胶酶液pH为2.0,放置于50 ℃恒温水浴锅中保温,每10 min取样测定果胶酶活力。由图6-b可知,在pH 2.0 条件下,果胶酶耐受能力随时间的延长而不断降低,到76.31 min后酶活力已基本为0。通过ExpAssoc模型进行拟合,得曲线y=-4.12+104.12×e-x/23.525,半衰期为15.39 min。表明该类果胶酶在人体胃中的强酸环境下依然能保持一定时间催化活力。
半衰期为30.28 min;考虑果胶酶进入人体胃肠道,而胃液的pH为2.0~3.5,对果胶酶的耐酸性展开试验,本文通过缓冲液调节果胶酶液pH为2.0,放置于50 ℃恒温水浴锅中保温,每10 min取样测定果胶酶活力。由图6-b可知,在pH 2.0 条件下,果胶酶耐受能力随时间的延长而不断降低,到76.31 min后酶活力已基本为0。通过ExpAssoc模型进行拟合,得曲线y=-4.12+104.12×e-x/23.525,半衰期为15.39 min。表明该类果胶酶在人体胃中的强酸环境下依然能保持一定时间催化活力。

a-温度对果胶酶活力的影响;b-pH对果胶酶活力的影响
图5 温度和pH对冠突散囊菌SP-5果胶酶活力的影响
Fig.5 Effects of temperatures and pH on E.cristatum SP-5 Pectinase activity

a-果胶酶耐热性测定(80 ℃、pH 3.5);b-果胶酶耐酸性测定 (pH 2.0、50 ℃)
图6 冠突散囊菌SP-5果胶酶稳定性分析
Fig.6 The stability analysis of the pectinase from E.cristatum SP-5
2.4.3 果胶酶的动力学分析
图7为SP-5果胶酶催化速率和底物关系,曲线方程为v=-6×e-x/1.17+5.775。以果胶浓度的倒数1/S为横坐标,酶促反应速度的倒数1/v为纵坐标,制作Lineweaver-Rurk双倒数曲线。由图8可知,SP-5菌所产果胶酶的水解作用方程为y=0.197x+0.162 5(相关系数R2=0.99),表明曲线拟合良好。由回归方程计算得到果胶酶的米氏常数Km为1.21 mg/mL,最大反应速率vmax为6.15 μmoL/(U·min),与一些商品酶相比,SP-5果胶酶具有更好的底物亲和力。

图7 果胶酶催化速度与底物的关系
Fig.7 Relationship between pectinase catalysis rate and substrate
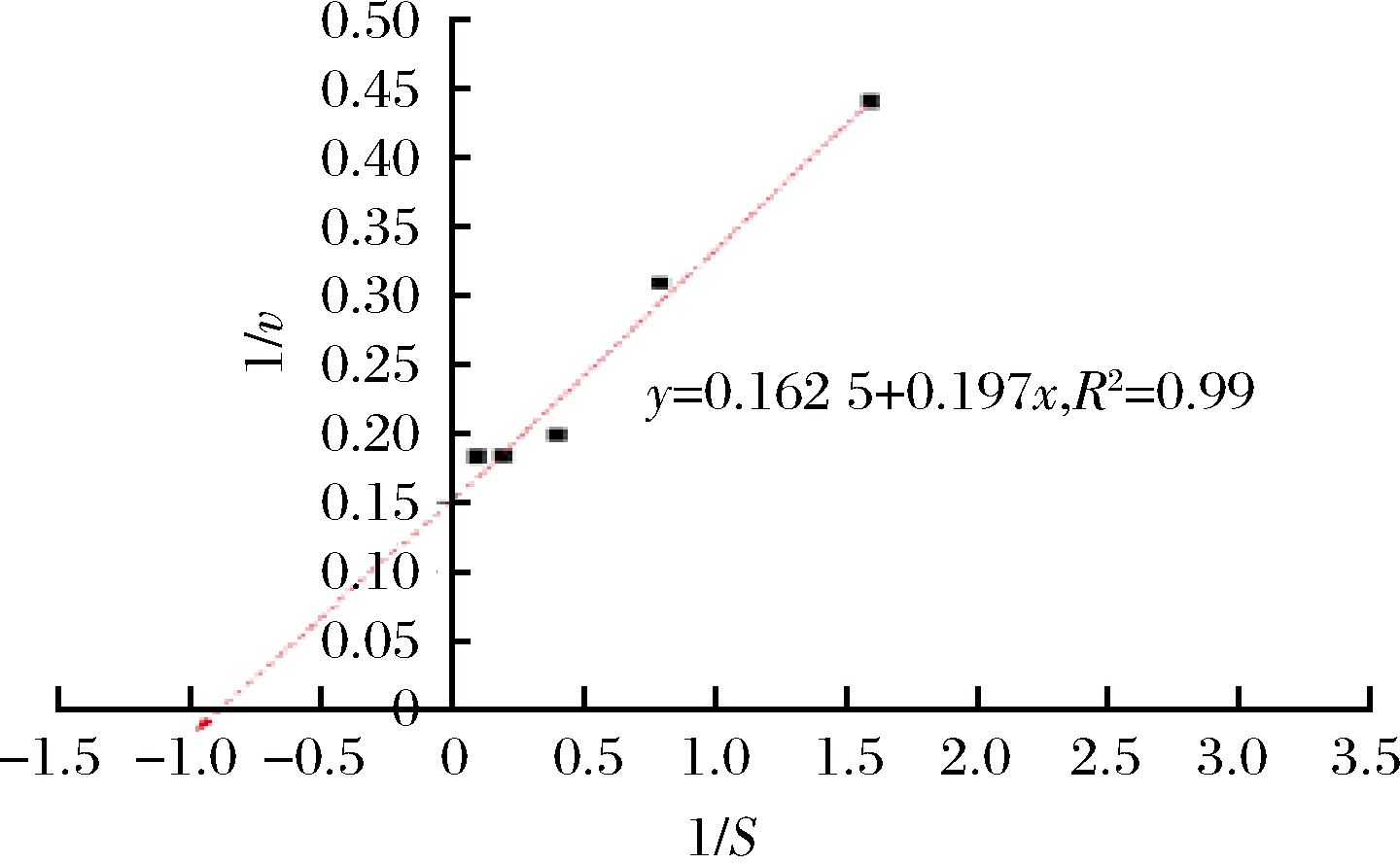
图8 Lineweaver-Rurk双倒数曲线
Fig.8 Lineweaver-Rurk double reciprocal curve
2.5 金属离子对果胶酶活力的影响
本研究利用冠突散囊在我们的日常的饮食中,金属离子K+、Mg2+、Fe2+、Ca2+、Ag+等大量存在,对果胶酶的酶促反应具有促进和抑制效[22-23]。由图9可知,在金属离子质量浓度为1.0 g/L的条件下,金属离子K+、Mg2+、Fe2+、Ca2+、Ag+均抑制冠突散囊菌果胶酶的活力,高浓度K+也导致酶活力只有空白对照的45%,其中Ag+的抑制作用最强,酶活力接近为0,表明在一些高浓度的无机离子溶液中,果胶酶活力会受到抑制。

图9 金属离子对果胶酶活力的影响
Fig.9 The Effects of metal ions on the pectinase activity
3 结论
本文利用冠突散囊菌SP-5直接进行茶叶发酵,分析了代谢副产物果胶酶的活力及酶学性质,了解茶叶水分与果胶酶分泌量的关联,对普洱熟茶和黑茶固态发酵过程进行了解析。研究中我们发现当培养基中的含水量为20%,冠突散囊菌发酵形成的代谢产物果胶酶活力最高,能达到12.52 U/g干基;含水量越高的培养基中,形成的酶活力较低。果胶酶作为冠突散囊菌SP-5直接利用茶叶分泌的代谢产物,能调整茶叶中的果胶质含量,改善发酵茶的口感,变得柔和甘甜,这在传统黑茶发酵和渥堆发酵中是一种常用的改良手段。
在传统的普洱茶渥堆发酵过程中,茶叶中水分含量对发酵影响较大。当茶叶中的含水量过高,会导致黑曲霉的菌丝大量繁殖,形成的孢子较少;而一旦在在含水量低,湿度低的条件下,黑曲霉繁殖过程中就会产生大量黑孢子。渥堆发酵能改善茶叶中的果胶质含量及香气物质的产生;而在黑茶发酵过程中,过高水分不利于冠突散囊菌的生长,胞囊果中的孢子浓度低,形成的金花较少,影响黑茶的品质。实验研究发现冠突散囊菌SP-5产的果胶酶最适反应温度为50.00 ℃,最适反应pH为3.50。酶的热稳定性方面,在温度80 ℃、pH 3.5 条件下,果胶酶在60 min后仍然具有酶活力,相对酶活力为15%;在酸稳定性方面,果胶酶在温度为50 ℃、pH=2.0 条件下维持60 min后相对酶活力为4.13%,表明该果胶酶为酸性果胶酶,在水解酶家族中有较好的耐酸性和耐热性,在食品行业中具有一定的应用价值。在探索金属离子对果胶酶的影响过程中发现,1.0 g/L的Mg2+、Cu2+、Fe2+、Ca2+、K+、Ag+均会抑制冠突散囊菌果胶酶活力,其中Ag+的抑制作用最强,导致酶活力为0,K+的抑制作用最弱。可见,冠突散囊菌果胶酶活力受过高浓度金属离子影响较大,在高于10 mmol/L浓度的反应体系中酶活性受到严重抑制。
[1] 张月, 崔旋旋, 刘英学, 等.茯砖茶中冠突散囊菌的分离鉴定及其发酵工艺和生物活性研究[J].食品与发酵工业, 2020, 46 (22):202-207.
ZHANG Y, CUI X X, LIU Y X, et al.Isolation, identification, fermentation technology and bioactivity of Eurotium cristatum in Fuzhuan brick tea [J].Food and Fermentation Industries, 2020,46(22):202-207.
[2] JIANG C K, ZENG Z, HUANG Y H, et al.Chemical compositions of Pu′er tea fermented by Eurotium cristatum and their lipid-lowering activity [J].LWT, 2018, 98:204-211.
[3] 黄彦, 石瑞, 苏二正.冠突散囊菌的研究与应用进展[J].生物加工过程, 2017, 15 (1):49-56.
HUANG Y, SHI R, SU E Z.Progress in the research and application of the Eurotium cristatum[J].China Journal of Bioprocess Engineering,2017,15(1):49-56.
[4] 吴凯为, 杨立娜, 朱力杰, 等..冠突散囊菌在发酵茶中应用的研究进展[J].食品研究与开发, 2018, 39 (1):189-193.
WU K W, YANG L N, ZHU L J, et al.Advances on the Application of Eurotium cristatum in fermented tea[J].Food Research and Development, 2018, 39(1):189-193.
[5] 杨妮, 刘素纯, 王继刚, 等.冠突散囊菌产胞外黑色素发酵条件优化及稳定性研究[J].食品与发酵工业, 2020, 46 (16):37-42.
YANG N, LIU S C, WANG J G, et al.Optimization of fermentation conditions and the stability of Eurotium cristatum extracellular melanin[J].Food and Fermentation Industries, 2020,46(16):37-42.
[6] 蔡正安, 刘素纯, 刘仲华, 等.茯砖茶中冠突散囊菌纤维素酶的酶学性质研究[J].茶叶科学, 2010, 30 (1):57-62.
CAI Z A, LIU S C, LIU Z H, et al.Cellulase enzymatic property of Eurotium Cristatum from brick tea[J].Journal of Tea Science, 2010, 30(1):57-62.
[7] 黄俊. 冠突散囊菌发酵甜荞主要功能性成分变化和功效研究[D].长沙:湖南农业大学, 2019.
HUANG J.Study on the main functional components and effects of sweet buckwheat fermented by Eurotium cristatum[D].Changsha:Hunan Agricultural University, 2019.
[8] 李玉婷, 吕嘉枥, 李良凤, 等.冠突散囊菌固态发酵产消化酶活力的研究[J].中 国 酿 造, 2012, 31 (10):93-95.
LI Y T, LYU J L, LI L F, et al.The activity of digestive enzymes produced by Eurotium cristatum with solid-state fermentation [J].China Brewing.2012, 31(10):93-95.
[9] 李适, 龚雪, 刘仲华, 等.冠突散囊菌对茶叶品质成分的影响研究[J].菌物学报, 2014, 33 (3):713-718.
LI S, GONG X, LIU Z H, et al.The qualitative component conversion in dark tea after colonization of Eurotium cristatum strains [J].Mycosystema, 2014, 33(3):713-718.
[10] 陈琳琳, 邱树毅, 罗小叶, 等.夏秋茶发花工艺及发花过程中主要物质成分变化[J].食品工业, 2017, 38 (9):71-75.
CHEN L L, QIU S Y, LUO X Y, et al.The fungus grow processing of summer-autumn tea and the changes of main components during the fungus growing[J].Food Industry, 2017, 38(9):71-75.
[11] 王家琛, 刘素纯, 刘善鑫.冠突散囊菌发酵燕麦对多酚含量影响的研究[J].中国酿造,2017, 36 (8):104-108.
WANG J C, LIU S C, LIU S X.Effect of Eurotium cristatum fermentation on polyphenol content in oats[J].China Brewing, 2017, 36(8):104-108.
[12] 冯超浩. 不同渥堆工艺条件对普洱茶品质的影响[D].广州:华南理工大学, 2013.
FENG C H.Effect of different pile-fermentation process conditions on the quality of Pu-erh tea[D].Guangzhou:South China University of Technology, 2013.
[13] AMIN F, BHATTI H N, BILAL M.Recent advances in the production strategies of microbial pectinases—A review[J].International Journal of Biological Macromolecules, 2019, 122:1 017-1 026.
[14] SHRESTHA S, RAHMAN M S, QIN W S.New insights in pectinase production development and industrial applications[J].Applied Microbiology and Biotechnology, 2021, 105(24):9 069-9 087.
[15] 崔凯宇, 李迎秋.果胶酶生产和应用的研究进展[J].江苏调味副食品, 2016, 33(1):11-13.
CUI K Y, LI Y Q.Research progress of production and application of pectinase[J].Jiangsu Condiment and Subsidiary Food, 2016, 33(1):11-13.
[16] WONG L Y, SAAD W Z, MOHAMAD R, et al.Optimization of cultural conditions for polygalacturonase production by a newly isolated Aspergillus fumigatus R6 capable of retting kenaf[J].Industrial Crops and Products, 2017, 97:175-183.
[17] 张忠平, 杨旭.黑曲霉WS003固态发酵制备果胶酶条件的优化[J]."中国调味品, 2017, 42(9):58-60.
ZHANG Z P, YANG X.Optimization of Aspergillus niger WS003 producing pectinase conditions by solid-state fermentation method[J].China Condiment, 2017,42(9):58-60.
[18] 吴爽, 张敏, 潘仁瑞,等.海洋扩展青霉(Penicillium expansun)产耐盐型果胶酶的固态发酵优化[J].食品工业科技, 2015, 36 (14):235-238;248.
WU S, ZHANG M, PAN R R, et al.Optimization of solid fermentation conditions of marine Penicillium expansum for producing salt-tolerant pectinase[J].Science and Technology of Food Industry, 2015, 36(14):235-238;248.
[19] 韦璐, 唐婷, 宁恩创.黑曲霉固态发酵香蕉皮产果胶酶的培养基条件研究[J].广 西 农 学 报, 2015, 30 (6):25-29.
WEI L, TANG T, NING E C.Study on the culture medium conditions of solid-state fermentation of pectinase by Aspergillus niger from banana peel[J].Journal of Guangxi Agriculture, 2019, 30(6):25-29.
[20] ROY K, DEY S, UDDIN M K, et al.Extracellular pectinase from a novel bacterium Chryseobacterium indologenes strain SD and its application in fruit juice clarification[J].Enzyme Research, 2018,2018:3859752.
[21] 罗雯, 徐珂盼, 王怡, 等.果胶酶生产菌株的筛选、发酵优化及其酶学性质研究[J].食品科技, 2022, 47 (4):6-13.
LUO W, XU K P, WANG Y, et al.Screening, fermentation optimization and enzymatic properties of pectinase-producing strains[J].Food Science and Technology,2022,47(4):6-13.
[22] MAHTO R B,YADAV M,MUTHURAJ M,et al.Biochemical properties and application of a novel pectinase from a mutant strain of Bacillus subtilis[J].Biomass Conversion and Biorefinery, 2022:1-12
[23] MEHMOOD T, SAMAN T, IRFAN M, et al.Pectinase production from Schizophyllum commune through central composite design using Citrus waste and its immobilization for industrial exploitation[J].Waste and Biomass Valorization, 2019, 10 (9):2 527-2 536.