西藏位于中国西南部,地处青藏高原,平均海拔在3 000 m以上。西藏气温较低、昼夜温差大、氧气含量少、具有中国最独特的地理环境,牦牛是当地特色家畜,具有耐高寒、生存能力强等特性。牦牛乳营养丰富,蛋白质、脂肪含量高于普通牛乳,通常被用来制作酥油茶、牦牛酸乳、牦牛奶酪等藏族人日常生活中必不可少的食品。西藏牦牛奶酪又名曲拉,藏语意为奶渣,曲拉是将牦牛乳经煮沸脱脂后自然发酵、风干,不加凝乳酶、不经成熟直接食用的酸凝型硬质奶酪。曲拉制作工艺简单、可贮藏时间长、营养价值高、风味独特,深受藏族人民喜爱。
自然发酵的乳制品具有丰富的微生物多样性,乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)为乳制品中最常见的优势细菌菌属,奶酪中的其他菌属还有明串珠菌属(Leuconostoc)、链球菌属(Streptococcus)、肠球菌属(Enterococcus)等[1]。常见的真菌菌属有青霉属(Penicillium)、毕赤酵母属(Pichia)、克鲁维酵母属(Kluyreromyces)、假丝酵母属(Candida)等[2]。乳制品中的微生物影响着发酵、成熟、腐败等一系列过程,对成品的品质有着极大的影响。产自不同地理位置的奶酪中微生物群落结构有很大差异:比利时埃尔维奶酪(Herve cheese)的优势菌属为乳球菌属、棒杆菌属(corynebacterium)[3]荷兰干酪(Dutch-type cheese)的优势菌属为乳球菌属和明串珠菌属[4]。意大利奶酪(Plaisentif cheese)的优势菌属为醋杆菌属(Acetobacter)、链球菌属[5]。土耳其奶酪(mouldy civil cheese)是一种自然霉变的奶酪,其优势菌属为德巴里酵母属(Debaryomyces)、毕赤酵母属、假丝酵母属[6]。
奶酪中微生物多样性影响其产品风味。以霉菌为发酵剂的蓝纹奶酪常具有霉腐味、青香味,其主要风味物质为2-庚酮、苯乙醇[7]。内蒙古奶豆腐具有强烈的奶油香,2,3-丁二酮则是其中的典型风味物质[8],成熟的切达奶酪(Cheddar)中杏仁味较浓,其典型风味物质为苯甲醛、3-甲基丁醛[9],卡门贝尔奶酪(Camembert)具有花香,乙酸苯乙酯、苯乙醇则是其中的主要风味成分[10]。西班牙羊奶奶酪(Ibores cheese)的主要风味物质为丁酸、己酸、辛酸[11]。新疆哈萨克奶酪的各种酸类物质含量也较高[12]。由此可见,世界各地奶酪的微生物群落结构与风味物质成分差异很大,因此探究西藏牦牛奶酪的微生物群落结构,并分析其风味成分与微生物的关系对提高西藏牦牛奶酪品质有重要意义。
1 材料与方法
1.1 材料与试剂
采自西藏6个不同地区的牦牛奶酪样品,分别为林芝(LZ)、拉萨(LS)、山南(SN)、那曲(NQ)、阿里(AL)、日喀则(RKZ),每个地区采集3个样品,共计18个样品;E.Z.N.A.®Soil DNA Kit,美国OMEGA公司;AxyPrep DNA 凝胶回收试剂盒,美国AXYGEN公司;琼脂糖,西班牙Biowest公司;PCR所用试剂,大连TaKaRa公司;E-WAX ETR色谱柱(30 m×0.25 mm,0.50 μm),美国PerkinElmer公司;50/30 μm DVB/CAR/PDMS萃取头,美国Supelco公司;风味物质标准品(色谱纯),比利时Acros公司。
1.2 仪器与设备
MiSeq PE300高通量测序仪,美国Illumina公司;2-16N型台式微量离心机,湖南恒诺仪器厂;C1000 Touch型PCR仪,美国Bio-Rad公司;BG-SubMIDI电泳仪,北京百晶生物公司;Tanon 1600型凝胶成像系统,上海天能公司;Clarus 680-600T GC-MS仪,美国PerkinElmer公司;1384型超净工作台,美国Thermo公司。
1.3 实验方法
1.3.1 样品采集与分组
采集西藏不同地区牧民家中自产的牦牛奶酪,置于无菌采样袋中,保存于有生物冰袋的保温箱中,运送回实验室,4 ℃保藏。将同一地区的样品分为一组,便于后续分析。样品分组与采样地点如表1所示。
表1 样品信息表
Table 1 sample information table
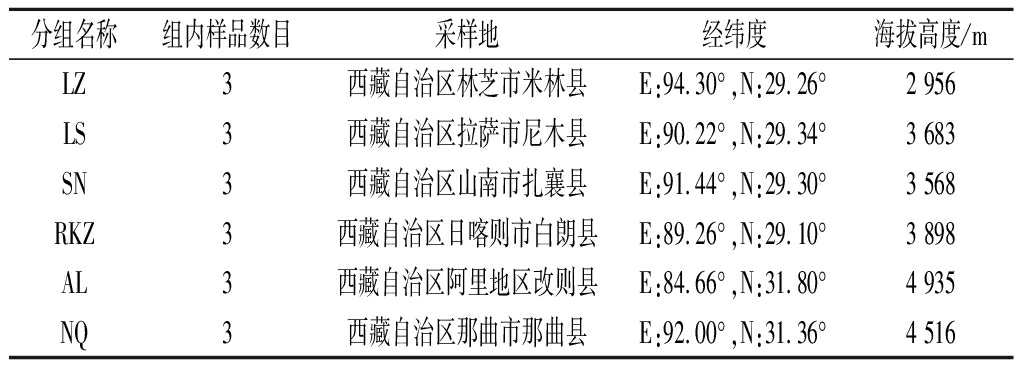
分组名称组内样品数目采样地经纬度海拔高度/mLZ3西藏自治区林芝市米林县E:94.30°,N:29.26°2 956LS3西藏自治区拉萨市尼木县E:90.22°,N:29.34°3 683SN3西藏自治区山南市扎襄县E:91.44°,N:29.30°3 568RKZ3西藏自治区日喀则市白朗县E:89.26°,N:29.10°3 898AL3西藏自治区阿里地区改则县E:84.66°,N:31.80°4 935NQ3西藏自治区那曲市那曲县E:92.00°,N:31.36°4 516
1.3.2 高通量测序
将整块的牦牛奶酪粉碎后,取中心位置的样品,按照E.Z.N.A.® soil DNA Kit的说明进行牦牛奶酪的总DNA提取,后进行PCR扩增。PCR反应体系为10×PCR buffer(Mg2+plus)2.5 μL,dNTP Mixture 2.0 μL,上游引物1.0 μL,下游引物1.0 μL,DNA模板1.0 μL,rTaq DNA聚合酶(5 U/μL)0.3 μL,ddH2O补足至25 μL。细菌扩增区域为16S rDNA V3~V4区域,引物为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)、806R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,扩增30 个循环;72 ℃再延伸10 min,4 ℃保存。真菌扩增区域为ITS 1区,引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′),ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)。PCR扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,扩增35 个循环;72 ℃再延伸10 min,4 ℃保存。PCR产物用2.0%琼脂糖凝胶电泳检测、将合格的PCR产物切胶回收后进行纯化,经文库构建后利用Illumina Miseq PE300测序平台进行高通量测序[13]。
1.3.3 挥发性成分测定
固相微萃取(solid-phase microextraction,SPME):取3.0 g粉碎后的牦牛奶酪样品于20 mL顶空瓶中,置于70 ℃GC顶空加热炉内,加热平衡30 min,将老化好的萃取头插入顶空瓶中,吸附45 min。
GC:载气为高纯氦气,流速:1.0 mL/min,不分流进样。E-WAX ETR 色谱柱(30 m×0.25 mm,0.50 μm),升温程序:起始柱温35 ℃,保持2 min,以4 ℃/min升至120 ℃,以6 ℃/min升至180 ℃,最后以10 ℃/min升至230 ℃,保持10 min。
MS:电子电离源,电子能量70 eV,离子源温度240 ℃,传输线温度230 ℃,四极杆温度150 ℃,扫描方式为全扫描。
1.4 数据处理
1.4.1 高通量测序
对原始序列进行质控优化后,按照97%的一致性将序列聚类为操作分类单元(operational taxonomic unit,OTU),利用生成的OTU表格进行Alpha多样性分析及微生物群落结构分析,结果以各组的平均值表示。
1.4.2 挥发性成分
挥发性物质的定性:由仪器自带软件检索NIST数据库进行比对分析,仅选择匹配度>800以上的物质。
挥发性物质的定量:利用外标法,将香气物质标准品配制成不同浓度,并绘制标准曲线根据标准曲线定量,结果以各组的平均值表示。
2 结果与分析
2.1 微生物多样性与群落结构分析
6组牦牛奶酪的Alpha多样性指数如表2所示,结果表明,各组样品的微生物多样指数有较大差异。在细菌多样性中,LS组样品的Shannon指数和Ace指数均为最高,表明该组样品的细菌多样性较其他组样品高;NQ组样品的Shannon指数及Ace指数均为最低,表明该组样品的细菌多样性较其他组样品低。在真菌多样性中,LZ组样品的Shannon指数最低,真菌多样性较低,SN组样品的Ace指数最低,真菌丰富度较低。造成此现象的原因可能是各地的海拔高度、气温、氧气含量等环境因素不同,最终导致了成品牦牛奶酪的微生物组成有所区别。总体而言,西藏不同地区的牦牛奶酪微生物多样性存在显著差异,且细菌多样性要高于真菌。
表2 西藏牦牛奶酪的Alpha多样性分析
Table 2 Alpha diversity analysis of Tibetan yak cheese
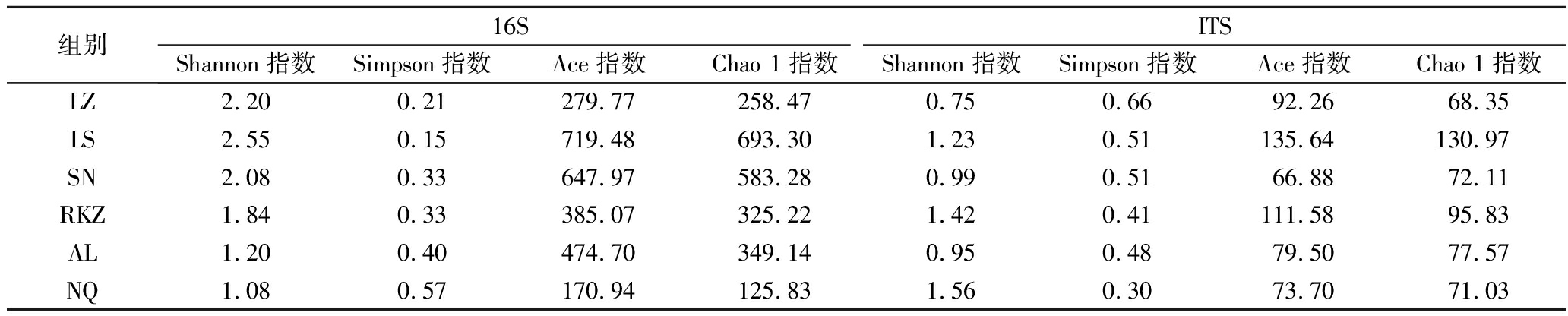
组别16SITSShannon指数Simpson指数Ace指数Chao 1指数Shannon指数Simpson指数Ace指数Chao 1指数LZ2.200.21279.77258.470.750.6692.2668.35LS2.550.15719.48693.301.230.51135.64130.97SN2.080.33647.97583.280.990.5166.8872.11RKZ1.840.33385.07325.221.420.41111.5895.83AL1.200.40474.70349.140.950.4879.5077.57NQ1.080.57170.94125.831.560.3073.7071.03
各组样品的细菌群落结构如图1所示,结果表明,相对丰度>1%的属共有16 个,其中优势菌属为乳球菌属、乳杆菌属、醋杆菌属、明串珠菌属、链球菌属、肠球菌属等。乳球菌属在各组样品中的相对丰度为19.20%~82.41%、乳杆菌属为6.25%~66.35%、醋杆菌属为10.81%~18.68%、明串珠菌属为1.74%~10.12%、肠球菌属为4.74%~6.16%。不同组样品的优势菌属有所差异,各组样品中乳球菌属和乳杆菌属占比优势较大,为第一优势菌和第二优势菌。但AL组样品未检出乳球菌属,LS组样品中乳杆菌属的相对丰度也<1%。其他优势菌的分布情况也存在差异,如醋杆菌属在RKZ组样品中相对丰度<1%、在NQ组样品中未检出。明串珠菌属在AL组样品中未检出,链球菌属是AL组中的特有菌属,且相对丰富较高。肠球菌属在SN组样品及RKZ组样品中有较高的相对丰度。
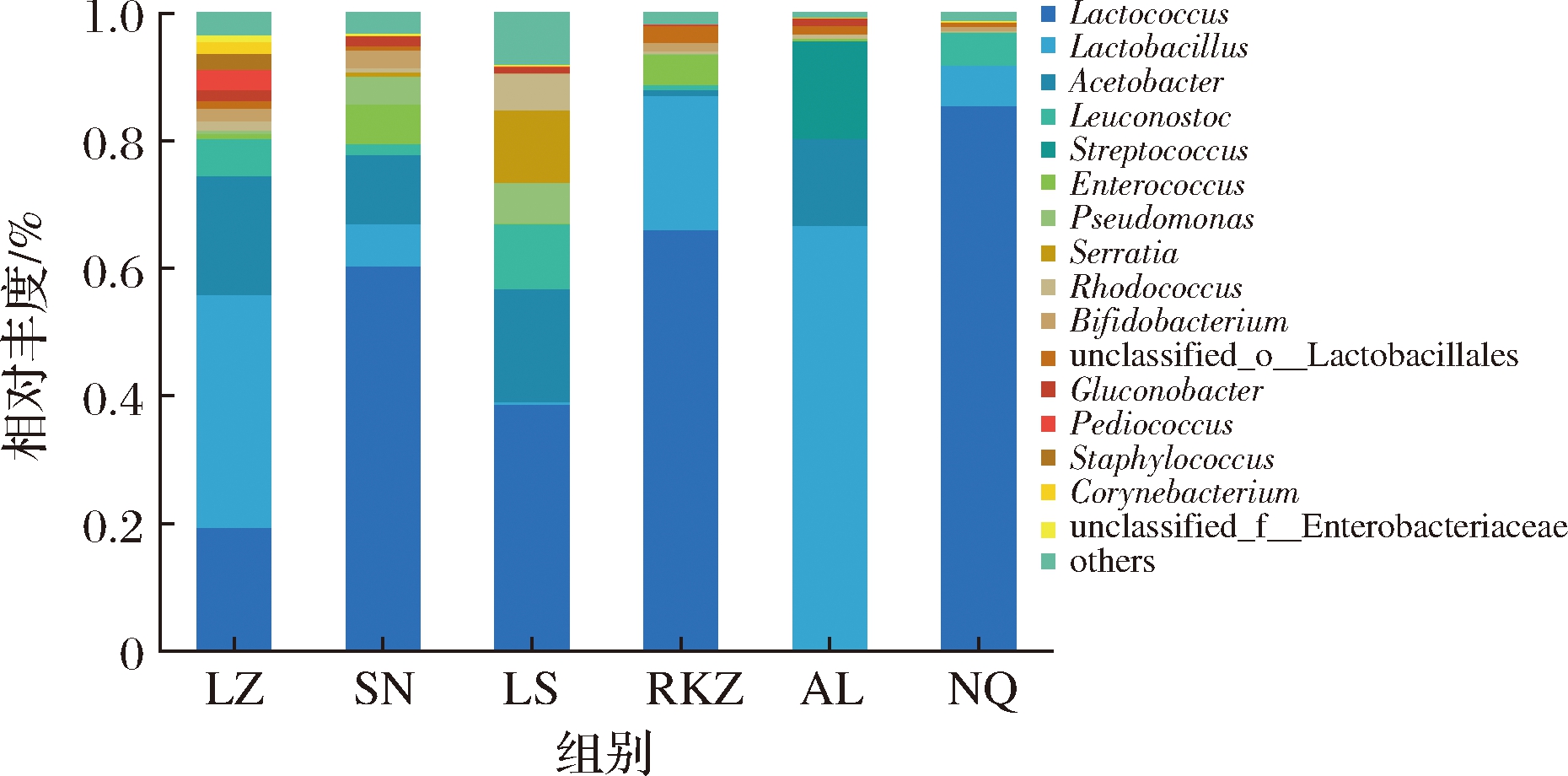
图1 属水平细菌群落结构
Fig.1 Bacterial community structure at genus level
各组样品的真菌群落结构如图2所示,结果表明,相对丰度>1%的属共有18个。牦牛奶酪中相对丰度含量较高的优势菌属包括地霉属(39.46%~60.71%);unclassified-f-Dipodascaceae(2.29%~24.90%);Tausonia(1.17%~40.41%);毕赤酵母属(1.97%~21.11%);假丝酵母属(1.60%~23.22%)。优势菌属在不同组样品间存在差异,地霉属和unclassified-f-Dipodascaceae为6个样品共有的优势菌属,且相对丰度较高。LZ组的优势菌属为青霉属、曲霉属(Aspergillus);SN组的优势菌属为Tausonia、隐球酵母属(Naganishia);LS组的优势菌属为假丝酵母属、双足囊菌属(Dipodascus);RKZ组的优势菌属为克鲁维酵母属;AL组的优势菌属为毕赤酵母属、有孢圆酵母属(Torulaspora);NQ组的优势菌属为双足囊菌属、有孢圆酵母属、曲霉属。与细菌相比,各组样品中真菌的群落结构差异更大,每组样品的优势菌属各不相同,表明不同地区的牦牛奶酪真菌多样性丰富,且群落结构差异较为明显。
2.2 西藏牦牛奶酪的风味分析
2.2.1 风味物质成分分析
采自西藏不同地区的6组牦牛奶酪样品共检出挥发性风味物质43种,其中包括醇类15种、醛类9种、酯类8种、酮类7种、酸类3种、内酯类1种。各组样品检出的风味物质及浓度详情见附表1(https://kns.cnki.net/kcms/detail/11.1802.TS.20220713.1816.020.html)。

图2 属水平真菌群落结构
Fig.2 Fungal community structure at genus level
各组样品中分别检测出风味物质数量为LZ组样品33种、LS组样品33种、SN组样品31种、RKZ组样品37种、AL组样品30种、NQ组样品37种。NQ组样品和RKZ组样品的风味物质种类最多,AL组样品最少。图3显示了各组样品所含风味物质的种类数,结果表明牦牛奶酪中风味物质种类从多到少依次为醇类、醛类、酯类、酮类、酸类、内酯类。

图3 西藏牦牛奶酪风味物质类型
Fig.3 Types of flavor substances in Tibetan yak cheese
2.2.2 醛类化合物
醛类是组成奶酪风味的重要成分,一般由脂肪酸代谢、氨基酸降解及Strecker降解产生[14]。醛类物质一般阈值较低,通常表现出青香、果香、油脂香等,对奶酪整体风味有重要贡献。奶酪中常见的醛类物质一般以己醛、庚醛、壬醛等为主,西藏不同地区牦牛奶酪共有的醛类为反-2-庚烯醛、反-2-壬烯醛、反-2-癸烯醛、辛醛、壬醛、癸醛、苯甲醛,且LZ组样品中壬醛含量明显高于其他组样品。
2.2.3 酮类化合物
酮类物质因其阈值较低、风味独特,通常是奶酪中风味物质的重要组成部分。脂肪酸的β氧化过程中会产生甲基酮,甲基酮类被广泛认为是霉菌奶酪中的特征香气成分[15]。2,3-丁二酮(双乙酰)、3-羟基-2丁酮(乙偶姻)是发酵乳制品中典型的风味物质,但在本次实验中未检出。西藏不同地区牦牛奶酪中共有的酮类为2-庚酮、2-壬酮;2-庚酮具有典型的蓝纹奶酪香气,2-壬酮具有青香与油脂香气,且LZ组样品中2-壬酮含量明显高于其他组样品。
2.2.4 酸类化合物
奶酪中的酸类物质一般为中短链的脂肪酸,因为其既是风味物质,也会进一步代谢产生甲基酮、酯类等风味物质,因此在奶酪中具有重要作用[16]。丁酸、己酸、辛酸、癸酸通常在各种奶酪制品中都有检出。丁酸被认为一般来源于原料乳,具有酸臭味、己酸具有油脂香、辛酸具有刺激味、癸酸具有腐臭味,酸类物质共同构成了奶酪的特殊奶酸味。西藏牦牛奶酪中检出的酸类物质有己酸、辛酸、癸酸,LZ组样品的酸类物质含量明显高于其他组样品。
2.2.5 醇类化合物
奶酪中的醇类物质一般由乳糖代谢、氨基酸代谢、甲基酮还原等途径产生,醇类物质一般具有花香、果香、青香、油脂香,但其一般阈值较高,对奶酪的风味贡献比较有限,主要是起修饰作用[17]。奶酪中最常见的醇类为1-辛烯-3-醇,具有典型的蘑菇香。不同组牦牛奶酪中共有的醇类物质有正戊醇、正己醇、1-庚醇、1-辛醇、1-壬醇、苯乙醇;2,3-丁二醇在各种样品中的浓度均较高,但在LZ组与样品AL组样品中未检出,异辛醇是LZ组中特有的醇类物质。
2.2.6 酯类化合物
奶酪中酯类物质由乳脂肪降解产生的脂肪酸与发酵过程中乳糖代谢产生的醇类发生酯化反应产生[18]。酯类具有花香、果香、且阈值较低,可中和酸类浓度过高而引起的刺激性气味,使奶酪的风味更加柔和,以促进奶酪整体风味的平衡,是奶酪中的重要风味成分。西藏牦牛奶酪中检出的酯类有己酸乙酯、辛酸乙酯、癸酸乙酯、乙酸苯乙酯、十一酸乙酯、异丁酸丁酯、异丁酸庚酯、硬脂酸乙酯。其中十一酸乙酯仅在RKZ组样品中检出。
2.2.7 内酯类化合物
奶酪中常见的内酯类物质有γ-辛内酯、γ-癸内酯、δ-癸内酯等,常具有椰子香、水果香,内酯类物质在奶酪中的含量虽然不高,但因其阈值较低,所以对多种奶酪的风味也有所贡献,通常在切达奶酪、马苏里拉奶酪、法国羊奶奶酪中都有检出[19]。在西藏牦牛奶酪中检出的内酯类为γ-壬内酯,仅在NQ组样品中检出、且浓度较低,表明内酯类物质并非西藏牦牛奶酪的关键性风味成分。
2.2.8 关键风味物质分析
为找出影响西藏牦牛奶酪质量的关键风味物质,研究采用气味活度值(odor activity value,OAV)分析所有风味物质,表3列出了OAV≥1的关键风味物质。结果表明样品中关键风味物质主要有醛类8种、醇类7种、酯类3种、酮类3种、酸类1种、共22种。其中LZ组样品17种,LS组样品15种、SN组样品14种、RKZ组样品17种、AL组样品13种、NQ组样品16种,LZ组样品及RKZ组样品中OAV≥1的关键性风味物质最多,AL组样品最少。各组样品共有的关键风味物质共12种,包括己醛、辛醛、反-2-庚烯醛、壬醛、癸醛、反-2-壬烯醛、反-2-癸烯醛、2-壬酮、1-庚醇、己酸乙酯、辛酸乙酯、异丁酸庚酯。关键风味物质的种类以醛类为主,香气类型主要为青香、奶酪香、脂肪香、水果香四类。
表3 西藏牦牛奶酪关键风味物质的OAV
Table 3 OAV of key flavor compounds in Tibetan yak cheese

风味物质LZLSSNRKZALNQ己醛6.00±0.4921.13±0.9040.27±0.9316.33±0.6845.20±0.8223.20±0.65庚醛192.78±2.08115.33±1.70102.00±1.660±0112.22±1.66159.33±2.72辛醛240.95±2.94401.43±4.21430.48±6.42473.33±4.10405.24±5.26385.71±3.50反-2-庚烯醛3.10±0.194.08±0.235.13±0.411.54±0.173.21±0.254.38±0.35壬醛1 373.33±3.86700.67±4.11779.33±5.73282.33±2.49585.33±8.58518.67±3.68癸醛105.17±1.25112.50±2.2796.50±1.2266.67±1.2570.83±1.8479.83±1.03反-2-壬烯醛1 191.67±25.692 008.33±25.692 141.67±41.25820.83±11.791 541.67±21.251 658.33±38.64反-2-癸烯醛442.22±5.67310.00±12.47100.00±8.16635.56±8.75200.00±5.44224.44±6.852-庚酮0±00.61±0.030±02.86±0.020±00±02-壬酮181.07±1.2358.47±0.7442.07±0.98121.93±0.9073.47±0.9860.13±1.972-十一酮21.48±0.4120.19±0.340±019.90±0.700±00±0癸酸3.10±0.052.15±0.030±01.98±0.010±00±0异戊醇0.46±0.020±00±01.46±0.020±00±01-辛烯-3-醇0±00±00±00±00±032.00±0.821-庚醇22.11±1.7730.11±0.6830.11±0.8350.22±1.1093.22±1.7730.78±0.68异辛醇1.30±0.020±00±00±00±00±01-辛醇2.12±0.030.91±0.021.56±0.031.02±0.031.54±0.042.15±0.05(R,R)-2,3-丁二醇0±00.43±0.010.70±0.010.68±0.010±01.20±0.011-壬醇0.49±0.080.24±0.030.31±0.020.54±0.070.65±0.091.33±0.11己酸乙酯50.33±2.4930.33±1.2527.67±4.1181.00±3.2731.67±4.1930.67±2.87辛酸乙酯4.56±0.142.07±0.053.42±0.227.82±0.222.89±0.142.60±0.20异丁酸丁酯2.46±0.032.35±0.051.20±0.071.00±0.030.85±0.040.54±0.09
2.2.9 西藏牦牛奶酪风味物质主成分分析与聚类分析
以各样品所含风味物质为研究对象,进行主成分分析,结果如图4所示。LZ组样品及RKZ组样品在PC1正半轴、LS、SN、AL、RKZ组样品在PC1负半轴,根据不同样品在PCA图中的位置,可将LZ组样品分为一类、RKZ组样品分为一类、NQ组样品分为一类,SN组、LS组、AL组样品归为一类。风味物质距离样品越近,表示风味物质在该组样品内的含量越高。RKZ组样品的乙酸苯乙酯、癸酸乙酯、十一酸乙酯、己酸乙酯含量较高,这些风味物质通常表现出水果香气,RKZ组样品的水果香气较为浓郁。这些物质是导致RKZ组样品与其他样品有所差异的主要风味物质。LZ组样品的己酸、辛酸、癸酸、异丁酸丁酯、异丁酸庚酯含量较高,LZ组样品可能更具酸臭味与油脂味。NQ组样品的月桂醇、硬脂酸乙酯、1-壬醇、1-辛烯-3-醇等含量较高,可能NQ组样品的花香较多,LS、SN、AL组样品的反-2-庚烯醛、反-2-壬烯醛、庚醛、壬醛、癸醛等醛类物质含量较多,这3组样品的青香可能更浓一些。
图5为各组样品风味物质的聚类热图,左侧聚类树为各风味物质聚类,上侧聚类树为各组样品聚类。结果显示,样品可分为两大类,NQ组、AL组、SN组、LS组样品为一类,LZ组、RKZ组样品为一类。所有风味物质可分为两大类,第一类以醇类和醛类为主,第二类以酯类和酸类为主。NQ组、AL组、SN组、LS组样品的第一类风味物质含量较高,LZ组、RKZ组样品的第二类风味物质含量较高,此结论与主成分分析结论相一致。
2.2.10 西藏牦牛奶酪中微生物与风味物质的相关性分析
为探究西藏牦牛奶酪中微生物与风味物质的关系,找出对风味物质有所影响的关键微生物,计算样品中相对丰度前13的细菌菌属、前11的真菌菌属与43种风味物质间的Sperman相关性系数ρ,选取|ρ|≥0.8且P<0.05、具有显著性关联的微生物与风味物质,使用Cytoscape 3.8.0对微生物与风味物质相关性进行可视化。
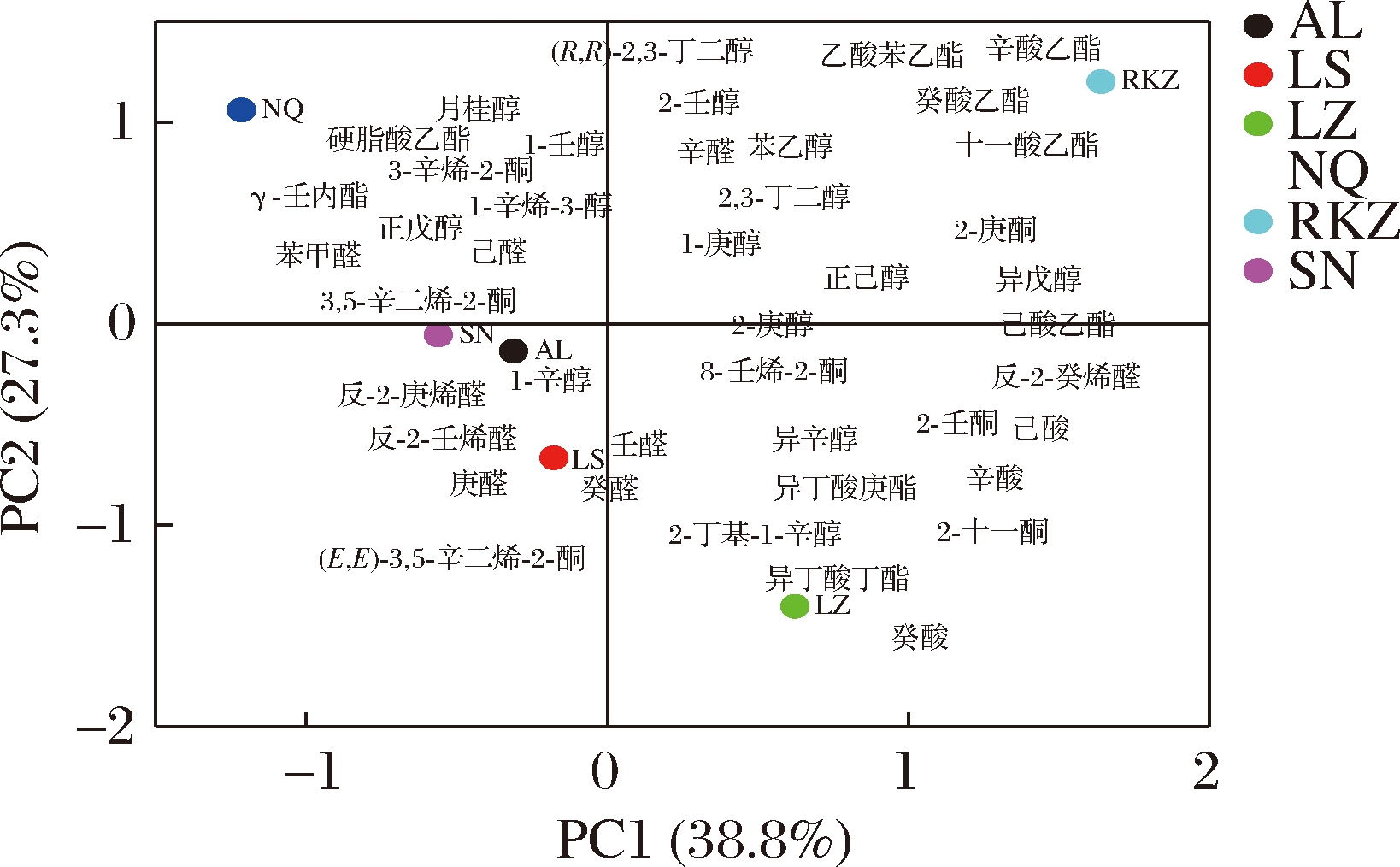
图4 西藏牦牛奶酪风味物质主成分分析
Fig.4 Principal component analysis of flavor compounds in Tibetan yak cheese

图5 西藏牦牛奶酪风味物质热图
Fig.5 Heat map of flavor compounds in Tibetan yak cheese
图6为微生物与风味物质间的相关性网络图,蓝点为细菌菌属、绿点为真菌菌属,粉点为不同类型的风味物质;微生物与风味物质间的实线表示二者存在正相关性,虚线表示二者存在负相关性。由图6可知,西藏牦牛奶酪中微生物与风味物质共有40种相关性,有6种细菌菌属、6种真菌菌属与8种醇类、5种醛类、4种酯类、3种酸类、2种酮类,共计22种风味物质存在较强相关性。
乳杆菌属、乳球菌属、明串珠菌属是连接数较多的细菌菌属,与己酸、辛酸、癸酸、2,3-丁二醇、壬醛、癸醛等风味物质存在显著的正相关性,克鲁维酵母属、地霉属、毕赤酵母属、有孢圆酵母属为连接数较多的真菌菌属,与苯乙醇、癸酸乙酯、2,3-丁二醇、乙酸苯乙酯、异戊醇、辛醛、1-庚醇、1-壬醇、2-十一酮等风味物质存在显著的正相关性。微生物与风味物质相关性分析结果表明,这些连接数较多的微生物可能对西藏牦牛奶酪的挥发性风味物质产生重要影响,最终影响产品的品质。

图6 微生物与风味物质的相关性网络图
Fig.6 Correlation network diagram of microorganisms and flavor substances
3 结论
本研究以产自西藏不同地区的牦牛奶酪为研究对象,通过高通量测序技术、SPME-GC-MS对奶酪样品进行测定分析,结果显示,西藏牦牛奶酪中的优势细菌菌属为乳球菌属、乳杆菌属、醋杆菌属、明串珠菌属、肠球菌属、链球菌属等;优势真菌菌属为地霉属、unclassified-f-Dipodascaceae、Tausonia、毕赤酵母属、假丝酵母属、双足囊菌属、青霉属、有孢圆酵母属、克鲁维酵母属等,不同地区的牦牛奶酪微生物多样性与优势菌属均有所差异。西藏牦牛奶酪中共检出43种风味物质,包括醇类15种、醛类9种、酯类8种、酮类7种、酸类3种、内酯类1种;根据风味物质在各组样品中的OAV确定关键风味物质,共有22种OAV≥1的关键风味物质,其中12种在所有样品中的OAV均>1,分别为己醛、辛醛、反-2-庚烯醛、壬醛、癸醛、反-2-壬烯醛、反-2-癸烯醛、2-壬酮、1-庚醇、己酸乙酯、辛酸乙酯、异丁酸庚酯。西藏不同地区的牦牛奶酪样品中主要风味物质有所差异;通过计算微生物与风味物质间的Sperman相关性系数可得,乳杆菌属、乳球菌属是与风味物质相关性较高的细菌菌属,克鲁维酵母属、地霉属、毕赤酵母属与是与风味物质相关性较高的真菌菌属,可能对西藏牦牛奶酪风味的形成有重要贡献。该研究分析了西藏牦牛奶酪的微生物群落结构、风味物质成分,并利用Sperman算法找出了可能对西藏牦牛奶酪风味有所影响的关键微生物菌属,对改善西藏牦牛奶酪整体风味提供了理论依据。
[1] SETTANNI L, MOSCHETTI G.Non-starter lactic acid bacteria used to improve cheese quality and provide health benefits[J].Food Microbiology, 2010, 27(6):691-697.
[2] PANGALLO D, ![]() J, et al.Microbial diversity and dynamics during the production of May bryndza cheese[J].International Journal of Food Microbiology, 2014, 170:38-43.
J, et al.Microbial diversity and dynamics during the production of May bryndza cheese[J].International Journal of Food Microbiology, 2014, 170:38-43.
[3] DELCENSERIE V, TAMINIAU B, DELHALLE L, et al.Microbiota characterization of a Belgian protected designation of origin cheese, Herve cheese, using metagenomic analysis[J].Journal of Dairy Science, 2014, 97(10):6 046-6 056.
[4] PORCELLATO D, SKEIE S B.Bacterial dynamics and functional analysis of microbial metagenomes during ripening of Dutch-type cheese[J].International Dairy Journal, 2016, 61:182-188.
[5] DALMASSO A, DE LOS DOLORES SOTO DEL RIO M, CIVERA T, et al.Characterization of microbiota in Plaisentif cheese by high-throughput sequencing[J].LWT - Food Science and Technology, 2016, 69:490-496.
[6] YILDIZ M, TURGUT T, CETIN B, et al.Microbiological characteristics and identification of yeast microbiota of traditional mouldy civil cheese[J].International Dairy Journal, 2021, 116:104955.
[7] HIGH R, EYRES G T, BREMER P, et al.Characterization of blue cheese volatiles using fingerprinting, self-organizing maps, and entropy-based feature selection[J].Food Chemistry, 2021, 347:128955.
[8] 宫俐莉, 王蓓, 王绒雪, 等.奶豆腐发酵期间挥发性风味组分变化及其感官品质分析[J].食品科学, 2017, 38(24):81-86.
GONG L L, WANG B, WANG R X, et al.Changes in volatile flavor compounds during the fermentation of laboratory-made hurood and its sensory evaluation[J].Food Science, 2017, 38(24):81-86.
[9] CHEN C, ZHOU W Y, YU H Y, et al.Characterization of major odor-active compounds responsible for nutty flavor in Cheddar cheese according to Chinese taste[J].Flavour and Fragrance Jouranl, 2020, 36(2):171-181.
[10] ![]() J, GROSCH W.Evaluation of potent odorants of Camembert cheese by dilution and concentration techniques[J].International Dairy Journal, 1997, 7(1):65-70.
J, GROSCH W.Evaluation of potent odorants of Camembert cheese by dilution and concentration techniques[J].International Dairy Journal, 1997, 7(1):65-70.
[11] DELGADO F J, GONZ LEZ-CRESPO J, CAVA R, et al.Formation of the aroma of a raw goat milk cheese during maturation analysed by SPME-GC-MS[J].Food Chemistry, 2011, 129(3):1 156-1 163.
LEZ-CRESPO J, CAVA R, et al.Formation of the aroma of a raw goat milk cheese during maturation analysed by SPME-GC-MS[J].Food Chemistry, 2011, 129(3):1 156-1 163.
[12] XU Z L, CHEN J L, SHI X W, et al.Characteristic physicochemical indexes and flavor compounds in Xinjiang Kazak cheese during ripening[J].Food Bioscience, 2020, 35:100586.
[13] 薛蓓, 卢灏泽, 杨帆, 等.高通量测序技术分析西藏不同海拔地区曲拉微生物多样性[J].食品科学, 2022,43(14):176-182.
XUE B, LU H Z, YANG F, et al.High-throughput sequencing technology to analyze microbial diversity in Qula at different altitudes in Tibet[J].Food Science, 2022,43(14):176-182.
[14] NIRO S, SUCCI M, TREMONTE P, et al.Evolution of free amino acids during ripening of Caciocavallo cheeses made with different milks[J].Journal of Dairy Science, 2017, 100(12):9 521-9 531.
[15] 陈臣, 周文雅, 袁佳杰, 等.3-甲基丁醛对奶酪坚果风味的贡献及其生物合成的研究进展[J].食品科学, 2020, 41(7):228-233.
CHEN C, ZHOU W Y, YUAN J J, et al.Recent progress in biosynthesis of 3-methylbutanal and its contribution to nutty flavor in cheese[J].Food Science, 2020, 41(7):228-233.
[16] 李露, 王蓓, 王绒雪, 等.奶疙瘩特征风味组分研究[J].中国食品学报, 2018, 18(9):297-302.
LI L, WANG B, WANG R X, et al.Study on characteristic aroma components of kurut[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(9):297-302.
[17] 李志国, 宗学醒, 闫清泉, 等.奶酪风味形成的研究进展[J].乳业科学与技术, 2019, 42(1):51-54.
LI Z G, ZONG X X, YAN Q Q, et al.Recent progress in understanding flavor formation in cheese[J].Journal of Dairy Science and Technology, 2019,42(1):51-54.
[18] HONG Q, LIU X M, HANG F,et al.Screening of adjunct cultures and their application in ester formation in Camembert-type cheese[J].Food Microbiology, 2018, 70(4):33-41.
[19] 陈臣, 刘政, 于海燕, 等.奶酪中内酯类物质风味贡献及其生物合成调控进展[J].现代食品科技, 2020, 36(11):305-312.
CHEN C, LIU Z, YU H Y, et al.Flavor contribution of lactones in cheese and its biosynthetic regulation:A review[J].Modern Food Science and Technology, 2020, 36(11):305-312.
[20] PINO, J A, MESA J.Contribution of volatile compounds to mango (Mangifera indica L.) aroma[J].Flavour and Fragrance Journal, 2006, 21(2):207-213.
[21] GIRI A, OSAKO K, OHSHIMA T.Identification and characterisation of headspace volatiles of fish miso, a Japanese fish meat based fermented paste, with special emphasis on effect of fish species and meat washing[J].Food Chemistry, 2010, 120(2):621-631.
[22] CZERNY M, CHRISTLBAUER M, CHRISTLBAUER M, et al.Re-investigation on odour thresholds of key food aroma compounds and development of an aroma language based on odour qualities of defined aqueous odorant solutions[J].European Food Research and Technology, 2008, 228(2):265-273.
