益生菌是食用一定数量后对宿主健康有益的一类微生物,主要包括乳杆菌属和双歧杆菌属,具有改善肠道菌群紊乱,提高免疫力等功能[1]。随着越来越多消费者对肠道健康的关注,市面上出现了许多与益生菌相关的产品,常见的产品类型为粉剂(38%)、胶囊剂(26%)、颗粒剂(11%)和乳制品(10%)等[2]。其中,由于发酵乳本身具有良好的风味,在此基础上将具有发酵性能的功能性益生菌与发酵乳结合,逐渐成为益生菌类产品开发的热点。
传统发酵乳的发酵剂主要为保加利亚乳杆菌(Lactobacillus delbrueckii subsp.bulgaricus)及嗜热链球菌(Streptococcus thermophilus),随着益生菌类产品的兴起,部分功能性益生菌逐渐被应用于发酵乳制品。与传统发酵剂不同的是,罗伊氏乳杆菌(Lactobacillus reuteri)、植物乳杆菌(Lactobacillus plantarum)等益生菌虽具有一定生理功能性,但由于无法利用乳糖或缺乏水解酪蛋白的能力,在牛乳中生长不良,无法凝乳[3]。而部分副干酪乳杆菌(Lactobacillus paracasei)、嗜酸乳杆菌(Lactobacillus acidophilus)由于产酸能力一般,导致发酵速率低,出现乳清析出及风味不佳等现象[4]。目前生产功能性酸奶的方法普遍为使用传统发酵剂对牛乳进行初发酵,然后加入功能性益生菌完成后续发酵[5]。但这种方法成本高,污染风险大,益生菌的活菌数也较低。
针对上述问题,已有部分学者采用协同发酵的方式,利用微生物群体之间的互利共生、偏利共生等关系,增加菌株在牛乳中的增殖或达到更好的发酵效果。如瑞士乳杆菌(Lactobacillus helveticus)在牛乳中初步水解的产物可被植物乳杆菌有效利用并促进其在牛乳中的生长,实现偏利共生[3]。CHAMPAGNE等[6]指出,乳酸乳球菌(Lactococcus lactis)与嗜热链球菌在切达奶酪的生产过程中存在着偏利共生的关系,乳酸乳球菌和嗜热链球菌的协同发酵可以显著增加乳酸乳球菌的活菌数。
综上,协同发酵法有利于功能性益生菌在发酵乳中的应用,但目前与之相关的研究较少,且特定益生菌的协同发酵工艺也有所不同。通过前期研究,我们从中国本土人群的粪便中筛选得到2株具有缓解辣椒素致胃肠损伤的益生菌,它们分别为罗伊氏乳杆菌CCFM1175及副干酪乳杆菌CCFM1176[7-8]。为进一步促进上述2株益生菌在发酵乳中的应用,本研究将筛选与之协同发酵的发酵菌株,以提高益生菌在发酵乳中的活菌数;并从感官及贮藏角度探讨协同发酵对发酵乳品质的影响,为开发具有高活菌数、高品质的益生菌发酵乳提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 实验菌株
实验所用的所有菌株均来自于江南大学食品生物技术中心,具体菌株信息如表1所示:
表1 实验菌株信息表
Table 1 Experiment strains information

菌株种属拉丁文名称菌株编号菌株简称菌株来源罗伊氏乳杆菌Lactobacillus reuteriCCFM1175罗伊氏乳杆菌CCFM1175人群粪便副干酪乳杆菌Lactobacillus paracaseiCCFM1176副干酪乳杆菌CCFM1176乳制品德氏乳杆菌保加利亚亚种Lactobacillus delbrueckii subsp. bulgaricusDQHXNS5L6保加利亚乳杆菌5L6乳制品德氏乳杆菌保加利亚亚种Lactobacillus delbrueckii subsp. bulgaricusDQHXNS11M10保加利亚乳杆菌M10乳制品乳酸乳球菌乳酸亚种Lactococcus lactis subsp. lactisDQHXNM17M6乳酸乳球菌M6乳制品
1.1.2 实验材料
脱脂奶粉,新西兰恒天然公司;白砂糖,南京甘汁园糖业有限公司;市售发酵乳(简爱原味裸酸奶,成分:生牛乳≥90%、白砂糖≥7%、保加利亚乳杆菌、嗜热链球菌),朴诚乳业(集团)有限公司;LM17培养基(添加0.5%乳糖)、LBS培养基,青岛海博生物技术有限公司;用于配制MRS培养基的酵母粉,英国Oxoid公司;其余试剂,国药集团化学试剂有限公司。
1.1.3 仪器与设备
ZHJH-C1115B型超净工作台,上海智诚分析仪器制造有限公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;隔水式恒温培养箱,上海森信实验仪器有限公司;5424R台式高速离心机,德国Eppendorf;G20自动电位滴定仪、FE20型pH计,梅特勒-托利多仪器(上海)有限公司;TA.XT plus物性测试仪,英国Stable Micro Systems公司。
1.2 实验方法
1.2.1 培养基的配制
MRS培养基:参照GB 4789.35—2016中的MRS培养基成分进行配制。
1.2.2 菌株的活化与培养
取出菌株冻藏管,在MRS固体培养基中接种,“Z”字形来回密集划线,37 ℃培养36~48 h,取单菌落接入液体培养基中,振荡使菌体充分分散;37 ℃培养12~18 h,以2%(体积分数)的接种量传代,37 ℃培养,活化2代后用于实验。
1.2.3 益生菌的乳糖、半乳糖利用能力测定
分别替换MRS培养基中的葡萄糖为等量的乳糖及D-半乳糖,并加入1.5%(体积分数)质量浓度为5 g/L的溴甲酚紫溶液,灭菌备用。测定2株益生菌在以乳糖及半乳糖为碳源的MRS培养基中的生长状况,具体方法参考文献[9]进行。
1.2.4 益生菌的蛋白水解活性测定
采用脱脂乳平板法测定益生菌的蛋白水解活性,参考CAVANAGH等[10]的研究并稍作修改:将菌株活化3代后8 000×g,5 min离心,菌泥用无菌生理盐水洗涤2次后重悬于等体积的无菌生理盐水中。取5 μL上述活菌重悬液点样于脱脂乳平板(100 g/L复原脱脂乳,15 g/L琼脂),置于37 ℃培养48 h,以水解圈表明菌株的蛋白水解活性。
1.2.5 发酵乳的制备
按脱脂乳粉110 g/L,蔗糖60 g/L的比例配制复原乳,灭菌条件为105 ℃,10 min,冷却至室温后接种菌种进行发酵。单一发酵及协同发酵接种量均为2%,协同发酵时不同菌株的比例为1∶1。具体接种操作如下:取活化2代后的发酵液,按上述接种量取相应菌液10 000×g、4 ℃离心5 min,除去上清液,菌泥用无菌生理盐水洗涤2~3次,将菌泥重悬于脱脂乳,并添加至复原脱脂乳体系中,混匀后置于37 ℃培养箱中恒温发酵。待发酵乳pH值降至4.6时,取出置于4 ℃冷藏,用于酸乳品质的测定。
1.2.6 发酵乳pH和滴定酸度的测定
在不同的时间点取适量样品,用pH计测定其pH值,并参考GB 5009.239—2016中酸度的测定方法用自动电位滴定仪进行酸度测定。
1.2.7 发酵乳活菌数的测定
已通过前期实验证明,本实验所用保加利亚乳杆菌5L6、保加利亚乳杆菌M10在LM17培养基中不能生长,而罗伊氏乳杆菌CCFM1175和副干酪乳杆菌CCFM1176在LM17培养基中能生长;乳酸乳球菌M6在LBS培养基中不能生长,罗伊氏乳杆菌CCFM1175和副干酪乳杆菌CCFM1176在LBS培养基中能生长;上述所有菌株均能在MRS培养基中生长。故单菌发酵时采用MRS培养基进行活菌数测定,协同发酵时采用表2中的选择性培养基对发酵乳中2株特定益生菌的活菌数进行测定,并用MRS培养基进行菌落总数测定,具体参考GB 4789.35—2016中乳酸菌的检验方法。
表2 协同发酵乳中各菌株活菌数测定所用培养基
Table 2 Culture medium for the determination of viable counts of each strain in co-fermented milk

菌株组合计数培养基菌株1菌株2菌株1菌株2罗伊氏乳杆菌CCFM1175保加利亚乳杆菌5L6LM17MRS总数-菌株1副干酪乳杆菌CCFM1176保加利亚乳杆菌5L6LM17MRS总数-菌株1罗伊氏乳杆菌CCFM1175保加利亚乳杆菌M10LM17MRS总数-菌株1副干酪乳杆菌CCFM1176保加利亚乳杆菌M10LM17MRS总数-菌株1罗伊氏乳杆菌CCFM1175乳酸乳球菌M6LBSMRS总数-菌株1副干酪乳杆菌CCFM1176乳酸乳球菌M6LBSMRS总数-菌株1
1.2.8 发酵乳持水力的测定
取10 g发酵乳样品,4 ℃,3 000×g离心30 min,去除上清液后称重。每个样品平行测定3次,按公式(1)计算持水力:
持水力![]()
(1)
1.2.9 发酵乳的感官评价
由15名接受过专业感官分析培训的食品从业人员分别对样品的口感、风味、质地、酸甜比、黏度和稠度进行感官评价[11],评价标准见表3。
表3 发酵乳感官评价标准
Table 3 Standards for sensory evaluation of yogurt quality
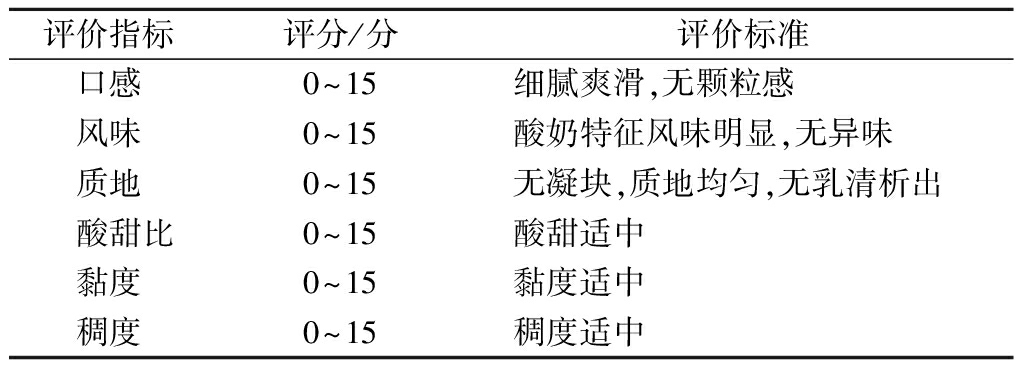
评价指标评分/分评价标准口感0~15细腻爽滑,无颗粒感风味0~15酸奶特征风味明显,无异味质地0~15无凝块,质地均匀,无乳清析出 酸甜比0~15酸甜适中黏度0~15黏度适中稠度0~15稠度适中
1.2.10 数据处理及分析方法
所有数据均表示为平均值±标准差,使用Origin 2018软件进行可视化绘图,使用SPSS 22对获得的数据进行统计分析。单因素方差分析采用Tukey多重检验,P<0.05表明数据具有显著性差异。
2 结果与分析
2.1 两株益生菌在牛乳中的发酵特性初探
脱脂乳中益生菌可利用的碳源和氮源分别为乳糖及蛋白质类物质,本研究通过测定罗伊氏乳杆菌CCFM1175及副干酪乳杆菌CCFM1176对乳糖、半乳糖及牛乳蛋白的利用能力,与3株发酵菌株比较,对两株益生菌的发酵特性进行初探,结果如表4所示。
表4 两株益生菌的乳糖、半乳糖利用能力及蛋白 水解活性测定
Table 4 Utilization of lactose and galactose by different strains

菌株糖利用能力乳糖半乳糖蛋白水解活性罗伊氏乳杆菌CCFM1175(+)(+)(-)副干酪乳杆菌CCFM1176(+)(+)(+)保加利亚乳杆菌5L6(+)(-)(++)保加利亚乳杆菌M10(+)(-)(++)乳酸乳球菌M6(+)(+)(++)
注:(+)表示阳性,(++)表示强阳性,(-)表示阴性
所有测试菌株均具有利用乳糖的能力,但仅罗伊氏乳杆菌CCFM1175、副干酪乳杆菌CCFM1176及乳酸乳球菌M6具有利用半乳糖的能力。研究表明,传统发酵菌株,如保加利亚乳杆菌,采用透膜酶系统将乳糖运至胞内,分解代谢后产生的半乳糖由于不被利用而转化为胶糖。蓄积的半乳糖既影响了发酵乳的品质,也将对部分人群的身体健康造成负担,尤其是半乳糖血症患者。本研究的实验结果表明,罗伊氏乳杆菌CCFM1175、副干酪乳杆菌CCFM1176均能利用乳糖及半乳糖,这是由于两株益生菌代谢乳糖的机制与传统发酵菌株(嗜热链球菌,保加利亚乳杆菌)不同。在细胞膜磷酸转移酶的作用下,乳糖被磷酸β-半乳糖苷酶代谢为葡萄糖及6-磷酸半乳糖,后者经6-磷酸塔格糖途径分解,避免了半乳糖在胞外的蓄积[12]。目前已有研究发现,将酸奶发酵剂与具有半乳糖利用能力的植物乳杆菌共培养后,酸奶终产品中的总糖含量降低,有效提高了发酵乳的发酵速率及品质[13]。上述结果提示我们可以将2株具有半乳糖利用能力的益生菌与发酵菌株协同发酵,从乳糖及半乳糖代谢角度改善发酵乳品质。
除了碳源之外,由于大多数益生菌是氨基酸的营养缺陷株,无法自身合成所需的氨基酸,因此需要获取外源性氮以满足生长所需。牛乳中的氮源为酪蛋白和乳清蛋白,通过脱脂乳平板法测定2株益生菌的蛋白水解活性,并与3株发酵菌株比较。结果表明,罗伊氏乳杆菌CCFM1175缺乏蛋白水解活性,而副干酪乳杆菌CCFM176具有蛋白水解活性,但水解圈较小。研究表明,罗伊氏乳杆菌利用大分子蛋白的能力有限,这可能是由于其缺失细胞壁蛋白水解酶,并且胞内的肽转运系统具有较大的底物特异性[14]。
综上,通过对2株益生菌的发酵特性进行初探,结果显示,副干酪乳杆菌CCFM1176具有乳糖、半乳糖利用能力和一定的蛋白水解活性,能够实现在牛乳中的增殖,但其蛋白水解活性有限,可能限制其发酵速率;罗伊氏乳杆菌CCFM1175具有良好的乳糖、半乳糖利用能力,但不具备蛋白水解活性,可能限制其在牛乳中的生长。
2.2 不同菌株与两株益生菌协同发酵过程中的pH及酸度变化
通过对罗伊氏乳杆菌CCFM1175及副干酪乳杆菌CCFM1176的发酵特性初探,发现蛋白水解活性的缺乏和不足可能会影响上述两株益生菌在发酵乳中的应用。为促进功能性益生菌发酵乳的开发,需要找到适宜与两株益生菌协同发酵的发酵菌株,以提高各益生菌在发酵乳中的活菌数、发酵速率及发酵品质。本研究选用在37 ℃发酵温度下具有优良产酸、产香、产黏能力的3株发酵菌株——保加利亚乳杆菌5L6,保加利亚乳杆菌M10及乳酸乳球菌M6,与2株益生菌分别协同发酵,观察牛乳在发酵过程中的pH及酸度变化,结果如图1所示。
罗伊氏乳杆菌CCFM1175在牛乳中单独发酵时产酸能力差,24 h的pH值为6.32±0.01,酸度为(14.80±0.35) °T,无法达到凝乳条件。通过与其他发酵菌株协同发酵,罗伊氏乳杆菌CCM1175发酵乳的pH值显著降低,但不同菌株组合的产酸水平存在较大差距。观察发酵过程中pH值及滴定酸度的变化曲线可知,发酵12 h时,保加利亚乳杆菌5L6与罗伊氏乳杆菌CCFM175的协同发酵组合表现出较高的产酸速率,pH值下降至4.55±0.01,滴定酸度达(68.17±0.42) °T;而其余两株保加利亚乳杆菌M10和乳酸乳球菌M6的菌株组合pH值仅为5.70±0.02、5.90±0.01,对应的酸度为(38.70±0.20) °T,(35.12±0.42) °T。发酵24 h时,5L6+CCFM1175协同发酵乳的pH值与酸度分别为3.84±0.07、(136.18±1.05) °T,显著低于M10+CCFM1175[4.57±0.01、(64.44±0.63) °T]与M6+CCFM1175[4.2±0.01、(82.01±1.05) °T]。上述结果表明,与益生菌CCFM1175单独发酵相比,保加利亚乳杆菌5L6与罗伊氏乳杆菌CCFM1175的协同发酵组合在牛乳中具有较强的产酸能力,显著提高了发酵乳的发酵速率。
副干酪乳杆菌CCFM1176在牛乳中单独发酵时具有一定的产酸能力,但产酸速率较低,发酵24 h后的pH值为5.02±0.02,酸度仅为(41.88±1.02) °T。因此,虽然副干酪乳杆菌CCFM1176单菌发酵能够实现凝乳,但由于发酵速度慢,导致大量乳清析出,发酵乳品质不佳。由图1发酵过程pH值及滴定酸度的变化曲线可知,3株发酵菌株与副干酪乳杆菌CCFM1176的协同发酵提高了其在牛乳中的发酵速率,最显著的菌株组合为5L6+CCFM1176,发酵至12 h时,发酵乳的pH值下降至4.59±0.01,滴定酸度达(62.51±0.84) °T;发酵至24 h时,发酵乳的pH值为3.89±0.03,滴定酸度达(110.88±1.05) °T,此时凝乳状态良好,表明该复合菌株具有强产酸能力。

a-pH值;b-滴定酸度
图1 不同菌株发酵牛乳过程中的pH值及酸度变化
Fig.1 Changes of pH and titratable acidity of samples during milk fermentation by different strains
2.3 不同菌株与两株益生菌协同发酵过程中的活菌数变化
由2.2结果可知,2株益生菌在发酵乳中的产酸能力有限,特别是罗伊氏乳杆菌CCFM1175;益生菌与发酵菌株协同后,部分组合的产酸速率显著提高。为探究产酸速率的改变是否与菌种复合过程中的共生或竞争机制有关,采用选择性培养基对不同组合中的益生菌及发酵菌株进行计数,以明确发酵过程中的活菌数变化,找到最佳的协同发酵组合,保证益生菌在发酵过程中的高活菌数。结果如表5所示。
表5 益生菌与不同菌株协同发酵过程中的活菌数变化 单位:lg CFU/mL
Table 5 Viable counts of starters and probiotics in different co-fermented groups

类别发酵时间/hCCFM1175CCFM1175+5L6CCFM1175+M10CCFM1175+M6CCFM1176CCFM1176+5L6CCFM1176+M10CCFM1176+M607.40±0.03dA7.22±0.12cB7.24±0.08aAB7.21±0.02cB7.02±0.03dC6.80±0.04dD6.82±0.07cD6.78±0.02dD益生菌67.46±0.05cdB7.79±0.08bA7.37±0.04aB7.37±0.05abB7.34±0.04cBC7.41±0.01cB7.22±0.07bCD7.19±0.02cD127.52±0.05bcCD8.24±0.05aB7.41±0.13aD7.43±0.03abD7.68±0.03bC8.61±0.08bA8.43±0.08aAB8.44±0.03bA167.60±0.02bD8.29±0.02aC7.41±0.05aE7.33±0.03bcE7.61±0.05bD8.79±0.02aA8.52±0.05aB8.55±0.01aB247.72±0.03aDE8.32±0.03aBC7.61±0.30aE7.47±0.08aE8.00±0.03aCD8.68±0.04abA8.57±0.09aAB8.59±0.05aAB0ND6.82±0.03dA6.91±0.15cA6.97±0.07dAND6.79±0.23dA6.73±0.07dA6.82±0.12dA6ND7.76±0.03cA7.20±0.06cC7.19±0.08cCND7.60±0.03cB7.27±0.07cC7.47±0.04cB发酵菌株12ND8.62± 0.01bA8.20±0.13bB7.19± 0.07cCND8.67±0.11bA8.37±0.02bB8.36±0.04bB16ND8.77±0.05aC8.74±0.06aC8.71±0.01bCND9.36±0.01aA9.09±0.09aB8.48±0.01abD24ND8.79±0.02aBC8.87±0.14aBC8.98±0.12aBND9.39±0.12aA9.09±0.09aAB8.64±0.14aC
注:不同小写字母表示同一菌株不同时间点的差异显著(P<0.05),不同大写字母表示同一时间点不同菌株的差异显著(P<0.05);其中,CCFM1175及CCFM1176为益生菌,5L6、M10及M6为发酵菌株,ND表示未检测(下同)
罗伊氏乳杆菌CCFM1175在牛乳中单独发酵 24 h,活菌数仅增长0.49 lg CFU/mL,由2.1结果可知,这是由于其缺乏蛋白水解活性,因此在牛乳中的生长和增殖受限。与不同发酵菌株协同发酵后,保加利亚乳杆菌M10和乳酸乳球菌M6都无法使罗伊氏乳杆菌CCFM1175在牛乳中大量增殖,其终活菌数与单发酵相比无显著变化,这可能是由于上述2株菌的蛋白水解能力中等,水解产生的游离氨基酸及多肽无法满足罗伊氏乳杆菌CCFM1175的生长需求。同时,乳酸乳球菌在发酵过程中经由核糖体生成一类多肽,其作为一种抑菌物质,可能抑制了罗伊氏乳杆菌的生长[15]。保加利亚乳杆菌M10及乳酸乳球菌M6自身在牛乳中的生长并未受到限制,24 h时的活菌数均能达到(8.87±0.14)lg CFU/mL、(8.98±0.12)lg CFU/mL。
与上述结果不同的是,保加利亚乳杆菌5L6能够显著促进罗伊氏乳杆菌CCFM1175在牛乳中的生长速率,24 h时CCFM1175的活菌数可达(8.32±0.03)lg CFU/mL,同时5L6的活菌数达到(8.79±0.02)lg CFU/mL。这可能是由于保加利亚乳杆菌5L6的蛋白水解能力较强,能够产生大量游离氨基酸及多肽[11],为罗伊氏乳杆菌CCFM1175提供有效氮源,实现偏利共生[4]。
副干酪乳杆菌CCFM1176具有一定乳糖、半乳糖利用能力,能够利用牛乳中的蛋白质,但由于其水解蛋白能力低于传统发酵菌株,因此在牛乳中的生长增殖速率较慢,从而导致发酵速率和品质受限[16]。通过与不同发酵菌株的协同发酵,12 h及24 h各菌株的活菌数表明,与单菌发酵相比,协同发酵显著提高了副干酪乳杆菌CCFM1176在牛乳中的活菌数,且3株发酵菌株对副干酪乳杆菌CCFM1176的协同增殖效益无显著差异。但3株发酵菌株本身在协同发酵乳中的增殖数量存在差异,相较于罗伊氏乳杆菌CCFM1175,与副干酪乳杆菌CCFM1176协同发酵24 h后,保加利亚乳杆菌5L6的活菌数显著增加至(9.39±0.12)lg CFU/mL。
研究表明,副干酪乳杆菌是一种兼性厌氧菌,在氧气不足的条件下能够激活丙酮酸甲酸裂解酶的活性,能够在乳糖代谢过程中催化丙酮酸生成甲酸和乙酰磷酸,后者又催化生成乙酸[17-18]。由于保加利亚乳杆菌不含有上述酶,进而导致在生长过程中缺乏甲酸及嘌呤[19]。推测副干酪乳杆菌CCFM1176可能在发酵后期,氧气不足时通过产生甲酸、乙酸等代谢产物,有效促进了保加利亚乳杆菌5L6在牛乳中的增殖。同时,副干酪乳杆菌CCFM1176自身在牛乳中的增殖速度也显著增加,与单独发酵相比,协同发酵12 h后活菌数可达(8.61±0.08)lg CFU/mL,这可能与保加利亚乳杆菌5L6在发酵过程中产生的氨基酸及有机酸类代谢产物有关[20-21]。推测保加利亚乳杆菌5L6与副干酪乳杆菌CCM1176在协同发酵过程中存在互利共生关系,能够显著提高发酵乳中2株菌的活菌数,实现协同增殖。
综上,通过比较协同发酵过程中各菌株活菌数的变化情况可知,罗伊氏乳杆菌CCFM1175能够与保加利亚乳杆菌5L6实现有效的协同发酵,显著增加罗伊氏乳杆菌CCFM1175在牛乳中的活菌数;副干酪乳杆菌CCFM1176与3株发酵菌株的协同发酵均能提高其在牛乳中的活菌数。考虑到后期发酵乳制备的经济效益和发酵品质,保加利亚乳杆菌5L6与益生菌协同发酵组合的产酸速率最快,12 h牛乳的pH值即可降至4.60左右,有效实现凝乳,并且品质良好,无大量乳清析出。因此,后续研究选用保加利亚乳杆菌5L6分别与罗伊氏乳杆菌CCFM1175、副干酪乳杆菌CCFM1176协同发酵,制备具有高活菌数的益生菌发酵乳,并探讨协同发酵对发酵乳品质的影响。
2.4 益生菌协同发酵乳的贮藏特性
2.4.1 益生菌协同发酵乳在贮藏期间的pH值及酸度变化
发酵乳在贮藏期间的pH及酸度变化直接影响发酵乳的口感及品质,为比较协同发酵法对发酵乳贮藏特性的影响,分别制备保加利亚乳杆菌5L6单菌发酵乳、罗伊氏乳杆菌CCFM1175与保加利亚乳杆菌5L6的协同发酵乳、副干酪乳杆菌CCFM1176与保加利亚乳杆菌5L6的协同发酵乳,将上述3组发酵乳置于4 ℃冷藏,测定第0、1、7、14、21天的pH及酸度变化,结果如图2所示。
贮藏期间各发酵乳的pH持续下降,滴定酸度持续升高。这是由于发酵乳的后酸化,即在贮藏过程中,由于菌株的生长繁殖,分解发酵乳中残存的乳糖、半乳糖、葡萄糖,从而产生乳酸[22]。保加利亚乳杆菌5L6单菌发酵乳的pH值在贮藏的第7~21天显著低于2株益生菌发酵乳,同时滴定酸度也显著高于2株益生菌协同发酵乳。研究表明,由于保加利亚乳杆菌细胞内乳糖酶所处胞质的pH值与胞外不同,因此外界环境的pH值对保加利亚乳杆菌的乳糖酶活性影响较小。在贮藏过程中,虽然发酵乳的pH值较低,但保加利亚乳杆菌仍能持续分解乳糖产酸,是导致发酵乳后酸化的主要菌株[23]。目前常见的后酸化防止措施有:添加产酸抑制剂或防腐剂,通过基因手段选用低温不产酸的特定菌株,通过调节复合菌株的比例抑制保加利亚乳杆菌的代谢等[24]。任然[15]发现,添加双歧杆菌或植物乳杆菌,能有效缓解传统发酵剂的后酸化现象。推测由于罗伊氏乳杆菌CCFM1175及副干酪乳杆菌CCFM1176的加入,协同发酵乳中保加利亚乳杆菌5L6的活菌数相较与单菌发酵时低,因此改善了发酵乳的后酸化现象。

a-pH值;b-滴定酸度
图2 益生菌协同发酵乳在贮藏期间的pH及酸度变化
Fig.2 Changes of pH and titratable acidity of different co-fermented milk during storage.
2.4.2 益生菌协同发酵乳在贮藏期间的活菌数变化
发酵乳中活菌数的变化会对产品的品质及生理功能造成一定影响,为探究益生菌在协同发酵乳中能否保持稳定的活性,对上述3组发酵乳在不同贮藏时期的活菌数进行测定,结果如表6所示。
在贮藏期间,益生菌协同发酵乳各菌株的活菌数发生了一定变化。在罗伊氏乳杆菌CCFM1175协同发酵乳中,从第7天开始,罗伊氏乳杆菌CCFM1175的活菌数显著下降,第21天时,活菌数降至(7.25±0.02)lg CFU/mL。而副干酪乳杆菌CCFM1176协同发酵乳在贮藏期间保持了较高的活菌数,虽然副干酪乳杆菌CCFM1176在第14天时的活菌数出现显著下降,但在第21天时仍能保持(8.12±0.02)lg CFU/mL的高活菌数。推测可能是由于贮藏过程中,保加利亚乳杆菌水解蛋白活性逐渐下降,仅能保证自身生长,无法为益生菌提供有效氮源,导致缺乏蛋白水解活性的罗伊氏乳杆菌CCFM1175活力显著下降,而具有一定蛋白水解活性的副干酪乳杆菌CCFM1176保持稳定的活性。
同时,从保加利亚乳杆菌5L6自身的活菌数来看,由于起始接菌量的差异,单发酵组的保加利亚乳杆菌5L6活菌数始终高于两组协同发酵乳,并在第14天出现活菌数的显著下降。与益生菌协同后,罗伊氏乳杆菌CCFM1175部分降低了保加利乳杆菌5L6的活菌数,可能是由于罗伊氏乳杆菌在贮藏过程中逐渐死亡,其死亡的菌体及代谢产物可能对保加利亚乳杆菌5L6的生存造成了一定影响。副干酪乳杆菌CCFM1176显著降低了保加利亚乳杆菌5L6从第14天开始的活菌数,可能是由于副干酪乳杆菌CCFM1176在贮藏过程中仍具有一定活性,与保加利亚乳杆菌争夺发酵乳中剩余的碳源及氮源,导致贮藏后期保加利亚乳杆菌5L6活菌数下降。
表6 益生菌协同发酵乳在贮藏期间的活菌数变化 单位:lg CFU/mL
Table 6 Changes of viable counts of probiotics and starters in the co-fermented milk during storage
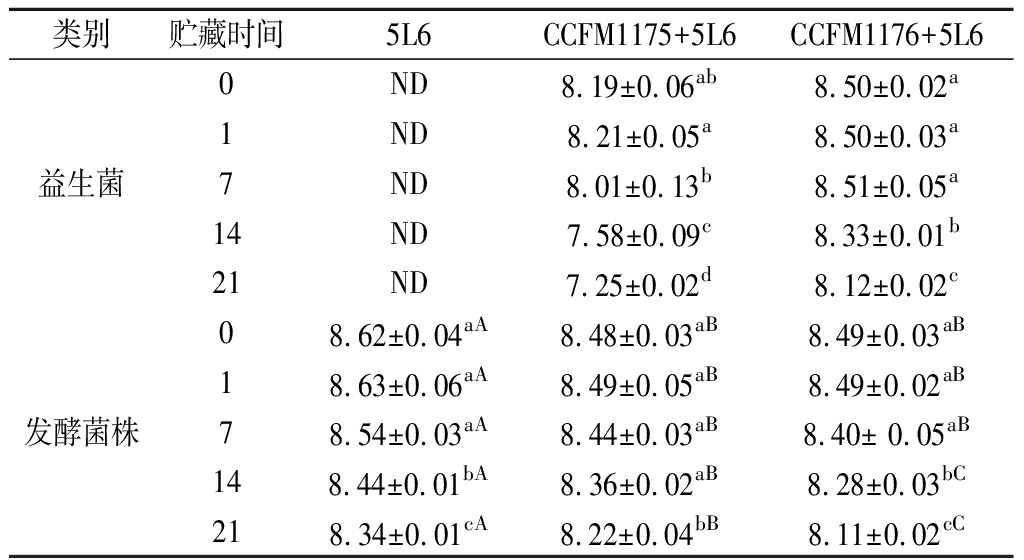
类别贮藏时间5L6CCFM1175+5L6CCFM1176+5L60ND8.19±0.06ab8.50±0.02a1ND8.21±0.05a8.50±0.03a益生菌7ND8.01±0.13b8.51±0.05a14ND7.58±0.09c8.33±0.01b21ND7.25±0.02d8.12±0.02c08.62±0.04aA8.48±0.03aB8.49±0.03aB18.63±0.06aA8.49±0.05aB8.49±0.02aB发酵菌株78.54±0.03aA8.44±0.03aB8.40± 0.05aB148.44±0.01bA8.36±0.02aB8.28±0.03bC218.34±0.01cA8.22±0.04bB8.11±0.02cC
2.4.3 益生菌协同发酵乳在贮藏期间的持水力变化
持水力可用于衡量发酵乳的组织状态,为探究协同发酵对发酵乳贮藏品质的影响,对益生菌协同发酵乳在贮藏期间的持水力进行测定,并与单菌发酵乳进行比较,结果如图3所示。发酵乳的持水力在冷藏1 d后显著增加,后随着贮藏时间的增加而逐渐下降。通过与罗伊氏乳杆菌CCFM1175及副干酪乳杆菌CCFM1176协同发酵,发酵乳的持水力增强,具体表现为发酵后第1~14天,协同发酵组(CCFM1175+5L6,CCFM1176+5L6)发酵乳的持水力显著高于发酵菌株单发酵组(5L6),这可能是由于罗伊氏乳杆菌CCFM1175及副干酪乳杆菌CCFM1176在发酵过程中产生的活性物质与酪蛋白充分作用,促进了发酵乳中酪蛋白的相互聚集,进而提高了酸乳的总持水力[25-26];同时,在发酵过程中,益生菌产生的胞外多糖促进发酵乳形成孔状结构,防止乳清析出[27],因此益生菌协同发酵有助于提高发酵乳在贮藏期间的持水力,进而改善产品品质。
2.5 益生菌协同发酵乳的感官评价
感官作为评价发酵乳品质的重要指标之一,能够反映出消费者度产品的喜好度。各组发酵乳冷藏1 d后的感官评价如图4所示。与单菌发酵乳及市售发酵乳相比,罗伊氏乳杆菌CCFM1175及副干酪乳杆菌CCFM1176协同发酵乳显著增加了发酵乳在稠度、黏度和质地方面的评价,可能是由于益生菌协同发酵乳具有高胶黏性和高硬度。研究表明,益生菌在发酵过程中产生的胞外多糖能够为发酵乳添加特殊的风味和更加细腻的口感,同时,协同发酵相对于单菌发酵能够增加发酵乳的发酵速率,使其更快形成凝胶结构,改善酸乳质地[15]。但与市售发酵乳相比,罗伊氏乳杆菌CCFM1175在风味方面的得分较低,推测是由于其异型发酵生成乙醇等风味不佳的代谢产物。综上,与保加利亚乳杆菌5L6单菌发酵相比,益生菌的加入能够赋予发酵乳更高的稠度、黏度,并改善发酵乳的质地,但与市售发酵乳相比,益生菌协同发酵乳在口感及风味上还需进一步的改进。
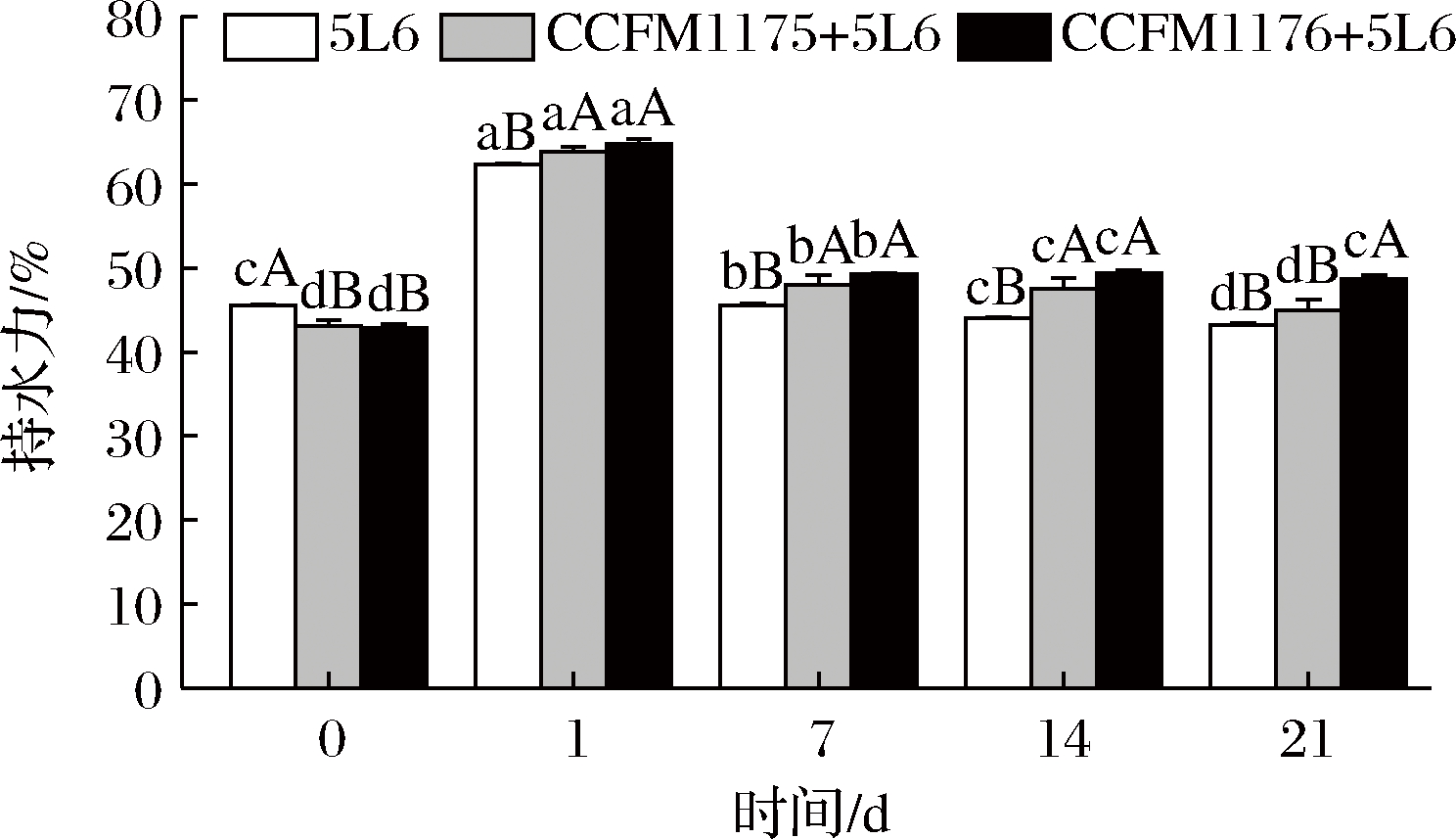
图3 益生菌协同发酵乳在贮藏期间的持水力变化
Fig.3 Changes of water retention of different co-fermented milk during storage
注:不同小写字母表示同一菌株不同时间点的差异(P<0.05), 不同大写字母表示同一时间点不同菌株的差异(P<0.05)

图4 益生菌协同发酵乳的感官评价
Fig.4 Sensory evaluation of different co-fermented milk
3 结论
本研究基于协同发酵法分别制备了罗伊氏乳杆菌CCFM1175和副干酪乳杆菌CCFM1176协同发酵乳,以发酵过程中牛乳的pH值、酸度及活菌数变化为参考,筛选得到1株适宜与2株益生菌协同发酵的保加利亚乳杆菌5L6,能够将发酵乳中罗伊氏乳杆菌CCFM1175和副干酪乳杆菌CCFM1176的活菌数增加至8.24lg CFU/mL、8.61lg CFU/mL。协同发酵法制备得到的益生菌发酵乳具有良好的贮藏特性及感官评价,有效改善发酵乳的后酸化现象并提高持水力,表明协同发酵法能够显著提高益生菌发酵乳的活菌数及品质。此研究解决了2株益生菌在发酵乳中难以凝乳、生长不良或发酵速率较慢的问题,有利于功能性益生菌在发酵乳中的广泛应用。
[1] KIMOTO H, NOMURA M, KOBAYASHI M, et al.Identification and probiotic characteristics of Lactococcus strains from plant materials[J].JARQ-Japan Agricultural Research Quarterly, 2004, 38(2):111-117.
[2] 段昊, 吕燕妮, 闫文杰.益生菌在我国保健食品中的应用进展[J].食品工业科技, 2022, 43(3):384-394.
DUAN H, LV Y N, YAN W J.Application progress of probiotics in functional food in China[J].Science and Technology of Food Industry, 2022, 43(3):384-394.
[3] 石阳阳, 江远智, 李瑞, 等.协同发酵生产植物乳杆菌发酵乳及其特性研究[J].食品与发酵工业, 2021, 47(11):8-13.
SHI Y Y,JIANG Y Z,LI R,et al. Lactobacillus plantarum fermented milk manufactured by co-fermentation and its properties[J]. Food and Fermentation Industries, 2021, 47(11):8-13.
[4] 侯团伟, 段剑平, 吴晓红.发酵剂在乳品中应用的影响因素及协同发酵的研究进展[J].食品工业科技, 2021, 42(1):378-386.
HOU T W,DUAN J P,WU X H.Recent progress of influence factors and synergistic fermentation of starters in dairy products[J].Science and Technology of Food Industry, 2021, 42(1):378-386.
[5] 袁秀丽, 吕嘉枥, 韩迪, 等.益生菌制品的研究进展[J].中国乳品工业, 2010, 38(4):46-49.
YUAN X L, LV J L, HAN D, et al.Research progress of probiotic products[J].China Dairy Industry, 2010, 38(4):46-49.
[6] CHAMPAGNE C P, GAGNON D, ST-GELAIS D, et al.Interactions between Lactococcus lactis and Streptococcus thermophilus strains in Cheddar cheese processing conditions[J].International Dairy Journal, 2009, 19(11):669-674.
[7] 崔树茂, 毛丙永, 项群然, 等.缓解辣椒素致胃肠损伤的罗伊氏乳杆菌及其应用:中国, CN113046274B[P].2022-09-27.
CUI S M, MAO B Y, XIANG Q R, et al.Lactobacillus reuteri for relieving capsaicin-induced gastrointestinal injury and its application:China, CN113046274B[P].2022-09-27.
[8] 毛丙永, 项群然, 崔树茂, 等.一株能够缓解辣椒素致胃肠损伤的副干酪乳杆菌及其用途:中国, CN113122478B[P].2022-09-06.
MAO B Y, XIANG Q R, CUI S M, et al.A strain of Lactobacillus paracasei for relieving capsaicin-induced gastrointestinal injury and its use:China, CN113122478A[P].2022-09-06.
[9] 李晓姝. 不同来源的副干酪乳杆菌的基因组及生理特性差异研究[D].无锡:江南大学, 2019.
LI X S.Differences in genomics and physiological characteristics of Lactobacillus paracasei from different sources[D].Wuxi:Jiangnan University, 2019.
[10] CAVANAGH D, KILCAWLEY K N, O'SULLIVAN M G, et al.Assessment of wild non-dairy lactococcal strains for flavour diversification in a mini-Gouda type cheese model[J].Food Research International, 2014, 62:432-440.
[11] ESCOBAR D, CLARK S, GANESAN V, et al.High-pressure homogenization of raw and pasteurized milk modifies the yield, composition, and texture of queso fresco cheese[J].Journal of Dairy Science, 2011, 94(3):1 201-1 210.
[12] 梁龙. 酵母菌对发酵乳乳糖代谢影响的研究[D].大连:大连工业大学, 2013.
LIANG L.Study on effect of yeast on lactose metabolism in fermented milk[D].Dalian:Dalian Polytechnic University, 2013.
[13] 张夙夙. 乳酸菌的乳糖/半乳糖代谢及其应用[D].济南:山东大学, 2020.
ZHANG S S.The metabolism of lactose and galactose in lactic acid bacteria and its potential application[D].Jinan:Shandong University, 2020.
[14] 朱丹凤, 王园园, 崔树茂, 等.罗伊氏乳杆菌氮源利用的选择性与特征分析[J].食品与发酵工业, 2018, 44(11):35-41.
ZHU D F, WANG Y Y, CUI S M, et al. Selectivity and characteristic analysis of nitrogen source utilized by Lactobacillus reuteri[J]. Food and Fermentation Industries, 2018, 44(11):35-41.
[15] 任然. 四株益生菌对发酵酸奶保质期品质和风味影响的研究[D].成都:西南民族大学, 2021.
REN R.Effect of four strains of probiotics on quality and flavor of fermented yogurt during the storage[D].Chengdu:Southwest Minzu University, 2021.
[16] BURITI F C A, DA ROCHA J S, ASSIS E G, et al.Probiotic potential of Minas fresh cheese prepared with the addition of Lactobacillus paracasei[J].LWT-Food Science and Technology, 2005, 38(2):173-180.
[17] MELCHIORSEN C R, JOKUMSEN K V, VILLADSEN J, et al.Synthesis and posttranslational regulation of pyruvate formate-lyase in Lactococcus lactis[J].Journal of Bacteriology, 2000, 182(17):4 783-4 788.
[18] LEIBIG M, LIEBEKE M, MADER D, et al.Pyruvate formate lyase acts as a formate supplier for metabolic processes during anaerobiosis in Staphylococcus aureus[J].Journal of Bacteriology, 2011, 193(4):952-962.
[19] LIU E N, ZHENG H J, SHI T, et al.Relationship between Lactobacillus bulgaricus and Streptococcus thermophilus under whey conditions:Focus on amino acid formation[J].International Dairy Journal, 2016, 56:141-150.
[20] SERRAZANETTI D I, GUERZONI M E, CORSETTI A, et al.Metabolic impact and potential exploitation of the stress reactions in Lactobacilli[J].Food Microbiology, 2009, 26(7):700-711.
[21] 吴荣荣, 马静, 裴家伟, 等.保加利亚乳杆菌和嗜热链球菌相互作用的研究[J].中国乳品工业, 2003, 31(4):9-13.
WU R R, MA J, PEI J W, et al.Interactions between Streptococcus thermophilus and Lactobacillus delbrueckii subsp bulgaricus used as starter cultures for the production of yogurt[J].China Dairy Industry, 2003, 31(4):9-13.
[22] SIEUWERTS S, DE BOK F A M, HUGENHOLTZ J, et al.Unraveling microbial interactions in food fermentations:From classical to genomics approaches[J].Applied and Environmental Microbiology, 2008, 74(16):4 997-5 007.
[23] 豆剑伟. 复合乳酸菌酸奶发酵特性研究[D].成都:西华大学, 2016.
DOU J W.Study on the fermenting characteristics of Lactobacillus in processing yogurt[D].Chengdu:Xihua University, 2016.
[24] 郭清泉. 酸奶制品在贮存过程发生后酸化的机理及控制措施的研究[D].哈尔滨:东北农业大学, 2001.
GUO Q Q.Study on the mechanism of postacidification of the plain yogurt during storage and the methods to control it[D].Harbin:Northeast Agricultural University, 2001.
[25] BARKALLAH M, DAMMAK M, LOUATI I, et al.Effect of Spirulina platensis fortification on physicochemical, textural, antioxidant and sensory properties of yogurt during fermentation and storage[J].LWT, 2017, 84:323-330.
[26] CASAROTTI S N, MONTEIRO D A, MORETTI M M, et al.Influence of the combination of probiotic cultures during fermentation and storage of fermented milk[J].Food Research International, 2014, 59:67-75.
[27] PRASANNA P, GRANDISON A, CHARALAMPOPOULOS D.Microbiological, chemical and rheological properties of low fat set yoghurt produced with exopolysaccharide (EPS) producing Bifidobacterium strains[J].Food Research International, 2013, 51(1):15-22.