砷是一种类金属,已被国际癌症研究机构(International Agency for Research on Cancer,IARC)归类为I类致癌物,广泛存在于水产品中。水产品中的砷可分为有机砷和无机砷,无机砷主要有亚砷酸盐(iAsⅢ)和砷酸盐(iAsⅤ),有机砷主要有一甲基砷(MMA)、二甲基砷(DMA)、三甲基砷(TMA)、砷甜菜碱(AsB)、砷胆碱(AsC)、砷糖(AsS)、砷脂(AsL)等。研究表明,砷的毒性不仅与其总量有关,更与其存在的化学形态密切相关[1]。此外,无机砷因其具有极强的毒性,已成为膳食风险评估的关键要素之一[2]。若食用无机砷含量超标的水产品会危机健康,有可能诱发皮肤癌、肺癌、膀胱癌和肾癌等癌症[3-4],或者其他非癌症疾病,如心血管疾病、糖尿病、生殖和发育障碍以及神经和认知功能障碍[5-6]。因此,通过分析水产品中的无机砷含量,对科学、客观地评估水产品中砷的健康风险具有重要意义。
近年来,随着沿海港口石化、核电、航运、旅游等产业的大规模发展,环境质量的恶化,特别是重金属的快速积累,广东水产品中的重金属污染越来越受到关注。同时,市售水产品大多为近海养殖,生长地点较为固定,更易受到环境污染物的影响。因此,人类食用水产品后由砷引起的潜在健康风险不可忽视。为了全面了解广东沿海常见水产品中砷的污染情况和及其对人体健康风险,本研究采用电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry,ICP-MS)和高效液相色谱-原子荧光光谱法(high performance liquid chromatography-atomic fluorescence spectrometry,HPLC-AFS)对广东沿海常见水产品的总砷及无机砷含量进行测定,采用单因子污染指数法(single factor pollution index,Pi)[7]、估算每周摄入量(estimated weekly intake,EWI)占暂定每周可耐受摄入量(provisional tolerable weekly intake,PTWI)的百分比[8]、目标危害系数法(target hazard quotients,THQ)[9]和致癌风险(carcinogenic risk,CR)[8,10]评价广东沿海常见水产品中砷污染程度及其健康风险,并根据当地居民的饮食习惯,提出每日最大允许食用量CRlim[11]和每月最大允许餐数CRmm[12],以期为广东沿海常见水产品的膳食摄入选择和预防砷污染提供科学依据。
1 材料与方法
1.1 材料与试剂
2021年4月于广东湛江硇洲岛、广东珠海万山群岛采集2种藻类,2021年5月于广东湛江近海养殖场以及该区域的自然海域采集8种鱼类、7种贝类和6种甲壳类,每种1~3 kg。采集后冷藏,带回实验室,测量记录鱼类体长、体重含水率等基本信息如表1所示。
表1 样品基本信息
Table 1 Basic information of samples

类别品种拉丁学名数量体长/cm体重/g含水率/%来源鱼类真鲷Pagrus major1(10)12.1(11.7~12.5)81.1(79.3~82.9)76.49野生捕捞金线鱼Nemipterus virgatus1(3)22.5(22.1~22.9)(11.7-12.5)265.8(265.0~266.6)80.67野生捕捞沙丁鱼Sardine1(13)15.3(14.9~15.7)37.6(37.1~38.1)79.88野生捕捞黑鲷Acanthopagrus schlegelii1(4)19.2(18.9~15.7)229.6(229.0~230.2)70.76近海养殖金鲳Trachinotus ovatus1(2)23.8(23.7~23.8)519.0(518.7~519.0)68.93近海养殖银鲳Pampus argenteus1(11)13.0(12.6~13.4)87.3(86.8~87.8)80.97近海养殖石斑鱼Epinephelusspp133.0877.271.99近海养殖金钱鱼Scatophagus argus1(4)15.2(14.8~15.6)220.6(219.8~221.0)78.59近海养殖甲壳类锈斑蟳Charybdis feriatus1(4)—254.1(252.8~255.4)81.28野生捕捞黄道蟹Cancer pagurus1(10)—106.4(104.7~108.1)80.97野生捕捞远海梭子蟹Portunus pelagicus1(6)—134.8(132.5~137.1)84.77野生捕捞梭子蟹Portunus trituberculatus1(3)—217.5(214.3~220.7)75.90野生捕捞虾蛄Oratosquilla oratoria1(33)17.3(16.7~17.9)31.5(30.2~32.8)83.41野生捕捞斑节对虾Penaeus monodon1(34)11.2(10.7~11.7)16.1(14.9~17.3)76.98野生捕捞贝类菲律宾帘蛤Ruditapes philippinarum1(147)—6.6(5.2~8.0)88.78近海养殖方斑东风螺Babylonia areolata1(99)—11.4(10.6~12.2)85.11近海养殖方形马珂蛤Mactra veneriformis1(95)—10.4(9.3~11.5)89.27近海养殖贻贝Mytilus edulis1(21)—48.2(46.5~49.9)86.91近海养殖缢蛏Sinonovacula constricta1(76)—11.3(10.6~12.0)85.68近海养殖海湾扇贝Argopecten irradians1(29)—32.8(30.7~34.9)86.32近海养殖牡蛎ostrea gigas tnunberg1(14)—74.4(71.6~77.2)86.75近海养殖藻类马尾藻Sargassum hemiphllum Turn1—56090.00野生采摘S1马尾藻Sargassum hemiphllum Turn1—51090.00野生采摘S2羊栖菜Hizikia fusifarme1—50090.00野生采摘S1
注:数量以合并后样品数(合并前)表示;S1表示珠海市万山群岛;S2表示湛江市硇洲岛;“—”表示未检测
砷单元素溶液(As, GBW08611)、亚砷酸根标准溶液(iAsⅢ,GBW08666)、砷酸根标准溶液(iAsⅤ, GBW08667),中国计量科学研究院;扇贝成分分析标准物质(GBW10024),中国地质科学院地球物理地球化学勘查研究所;硝酸(GR)、30%双氧水(GR),国药集团化学试剂有限公司。
1.2 仪器与设备
7500cx ICP-MS电感耦合等离子体质谱仪,安捷伦Agilent;Multiwave PRO 41HVT56微波消解仪,安东帕Anton Paar;BAF-3000 HPLC-AFS宝德仪器;FD551冷冻干燥机,EYELA。
1.3 实验方法
1.3.1 样品制备
样品清洗、剥肉取可食部位、剪碎,记录其湿重的质量,在冷冻干燥机下干燥,然后研磨成粉末状。
1.3.2 水产品中总砷及无机砷的测定
参照GB 5009.11—2014《食品安全国家标准 食品中总砷及无机砷的测定》中ICP-MS法和LC-AFS法。总砷取样量0.1 g,无机砷取样量1.0 g,总砷和无机砷的检出限分别为0.01 mg/kg及 0.03 mg/kg。在实验过程中,设计平行样、加标回收率及精密度试验以确保检测数据的准确性。
1.4 健康风险评估方法
1.4.1 单因子污染指数法
单因子污染指数通常用于评估水产品中单一污染物的水平,其值不受样品中其他非目标污染物或污染物降解的影响。当Pi<0.2时,为无污染水平;当0.2≤Pi<0.6时,为轻度污染水平;当0.6≤Pi<1.0时,为中度污染水平;当Pi>1.0时,超出限量标准。计算如公式(1)所示:
(1)
式中:Pi为无机砷的污染指数;Ci为实测无机砷含量,mg/kg;Si为无极砷含量标准值。根据GB 2762—2017《食品安全国家标准 食品中污染物限量》要求,水产动物及其制品无机砷限量为0.5 mg/kg,鱼类及其制品无机砷限量为0.1 mg/kg,要求藻类无机砷限量为0.5 mg/kg。
1.4.2 暴露量评估
为评估通过食用水产品摄入无机砷对人体健康产生的潜在风险,以PTWI(iAs:15 μg /kg BW)为参考值,根据公式(2)算出EWI[8],并与PTWI进行比较。其中,水产品占总膳食贡献率约为10%[13],因此,EWI/PTWI<10%,表明没有明显的食用风险;EWI/PTWI≥10%时,表明具有一定的食用风险。
(2)
式中:FIR为食物摄入率,查阅文献得知广东省水产品消费量中位数为28.6 g/d[14];得知海水鱼类的平均消费量(30.4 g/d)、虾类(3.7 g/d)、软体动物类(1.6 g/d)、蟹类(1.6 g/d)。中国居民藻类平均消费量5.2 g/d[15];Ci为实测无机砷含量,mg/kg;BW为人群的平均体重(kg),中国成年男性平均体重约为69.6 kg,成年女性约为59 kg[16],儿童按32.5 kg计[17]。
1.4.3 非致癌风险与致癌风险
THQ评估污染物的非致癌风险,THQ<1表示无明显健康风险,THQ≥1表明极大可能存在健康风险;THQ值越大,表明该污染物对人体健康的风险越大。CR表示一个人一生中因接触潜在致癌物而患上癌症的增量概率,CR<1×10-6,可忽略不计;CR为10-6~10-4,可接受水平;CR>10-4,不可接受水平。计算如公式(3)、公式(4)所示:
(3)
(4)
式中:EF为暴露频率(365 d/年);ED为暴露年限(为人平均寿命),鉴于我国人均期望寿命为76.34年;RfD为口服参考剂量,依据USEPA的标准无机砷为0.3 μg/(kg·d);Ci为实测无机砷含量,mg/kg;CSF是特定污染物的致癌斜率因子[μg/(g·d)];无机砷的CSF为1.5 [μg/(g·d)];TA为非致癌风险平均暴露时间。
1.4.4 消费建议
根据CR值,提出每日最大允许消费量CRlim(kg/d)和每月最大允许餐数CRmm,目的通过控制日食用量和月食用餐数以有效降低无机砷积累造成的致癌风险。计算如公式(5)、公式(6)所示:
(5)
(6)
式中:ARL为最高可接受终身致癌风险(10-4);Ci为实测无机砷含量,mg/kg;Tap为每月平均天数(365/12 d);查阅文献得知,每餐食物摄入量MS取成人0.174 kg,儿童0.170 kg[18]。
1.5 数据统计与分析
实验数据采用JMP Pro 16 和GraphPad Prism 9软件对数据进行分析和作图。
2 结果与分析
2.1 水产品中总砷和无机砷含量
本研究所检测的广东沿海常见水产品可食部位总砷的含量范围为0.22 mg/kg(金钱鱼)~34.84 mg/kg(马尾藻),总砷含量依次为:藻类[(21.40±12.96) mg/kg]>甲壳类[(8.35±4.87) mg/kg]>鱼类[(3.37±5.36) mg/kg]>贝类[(1.49±0.33) mg/kg],无机砷含量最高的也是藻类,占其总砷含量的59.01%~92.73%,其余均低于10%,见表2。与国内外其他地区相比(表3),本次检测广东沿海常见水产品总砷含量大多低于来自地中海、欧洲大西洋和北波斯湾。在中国,贝类总砷的含量呈现由北向南递减的趋势。
表2 水产品中总砷和无机砷含量水平 单位:mg/kg(以湿重计)
Table 2 Total arsenic and inorganic arsenic in aquatic products

种类样品iAsⅢiAsⅤiAs总砷iAs占总砷鱼类 真鲷(Pagrus major)0.02ND0.0217.06±0.960.12%金线鱼(Nemipterus virgatus)NDND—4.70±0.25—沙丁鱼(Sardine)NDND—2.33±0.15—黑鲷(Acanthopagrus schlegelii)NDND—1.13±0.06—金鲳(Trachinotus ovatus)NDND—0.95±0.08—银鲳(Pampus argenteus)NDND—0.34±0.03—石斑鱼(Epinephelusspp)NDND—0.25±0.02—金钱鱼(Scatophagus argus)0.02ND0.020.22±0.019.09%甲壳类锈斑蟳(Charybdis feriatus)NDND—16.40±1.35—黄道蟹(Cancer pagurus)0.06ND0.0611.61±0.290.52%远海梭子蟹(Portunus pelagicus)0.01ND0.019.87±0.570.10%梭子蟹(Portunus trituberculatus)0.02ND0.022.60±0.090.59%虾蛄(Oratosquilla oratoria)0.01ND0.016.64±0.080.14%斑节对虾(Penaeus monodon)0.02ND0.022.98±0.060.63%贝类 菲律宾帘蛤(Ruditapes philippinarum)0.02ND0.022.02±0.090.83%方斑东风螺(Babylonia areolata)NDND—1.97±0.11—方形马珂蛤(Mactra veneriformis)0.02ND0.021.19±0.081.62%贻贝(Mytilus edulis)0.02ND0.021.41±0.041.21%缢蛏(Sinonovacula constricta)0.03ND0.031.38±0.121.97%海湾扇贝(Argopecten irradians)NDND—1.30±0.08—牡蛎(ostrea gigas tnunberg)NDND—1.17±0.05—藻类 马尾藻(万山群岛)(Sargassum hemiphllum Turn)0.6621.1021.7634.84±3.0562.46%马尾藻(硇洲岛)(Sargassum hemiphllum Turn)0.3314.7015.0325.47±2.0859.01%羊栖菜(万山群岛)(Hizikia fusifarme)0.263.343.603.88±0.3392.73%
注:iAs表示 iAsⅢ和 iAsⅤ的含量之和;ND表示低于检出限,未检出;“-”表示未检出
分析不同水产品中砷含量差异的原因可能与环境相关。此外,它可以被水自由溶解和运输,并很容易被水生生物吸收。水生生物的生活习惯、摄食方式、新陈代谢活动和栖息环境等因素是导致砷在水生生物中的积累的原因。
表3 不同海域海产品中总砷含量 单位:mg/kg(以湿重计)
Table 3 Total arsenic content in seafood from different sea areas
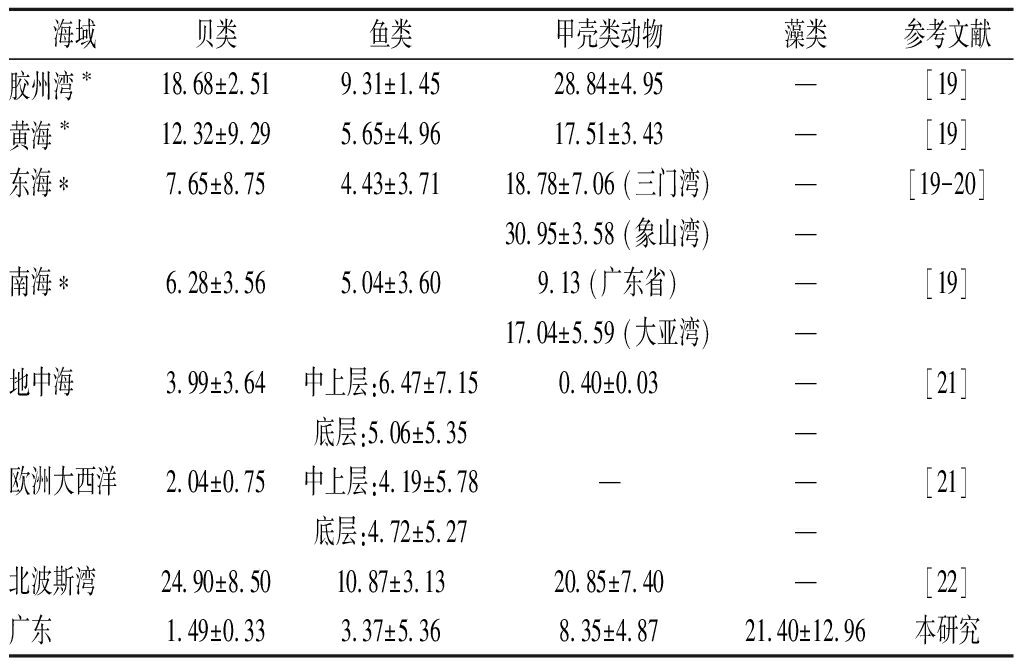
海域贝类鱼类甲壳类动物藻类参考文献胶州湾∗18.68±2.519.31±1.4528.84±4.95—[19]黄海∗12.32±9.295.65±4.9617.51±3.43—[19]东海∗7.65±8.754.43±3.7118.78±7.06 (三门湾)—[19-20]30.95±3.58 (象山湾)—南海∗6.28±3.565.04±3.609.13 (广东省)—[19]17.04±5.59 (大亚湾)—地中海3.99±3.64中上层:6.47±7.150.40±0.03—[21]底层:5.06±5.35—欧洲大西洋2.04±0.75中上层:4.19±5.78——[21]底层:4.72±5.27—北波斯湾24.90±8.5010.87±3.1320.85±7.40—[22]广东1.49±0.333.37±5.368.35±4.8721.40±12.96本研究
注:*按湿重计;“—”表示未检出
藻类是重金属污染的良好生物监测仪,已被纳入欧洲沿海监测项目[23]。因其细胞壁由各种多糖和蛋白质组成,部分含有硫酸盐、阴离子羧基和磷酸盐等金属螯合能力强的基团,具有较高的金属保留能力[24]。本研究中,数据显示藻类植物中总砷浓度比水生动物高,与TAYLOR等[25]的结果一致。此外,大量研究表明:藻类中的砷浓度会因海水、生物群和沉积物中的浓度而改变[24]。
甲壳类动物是居住在沉积物上方或中间的底栖生物,其足部常被埋在表层沉积物中,并经常搅动沉积物,这可导致其从沉积物中吸收更多的金属[26]。同时,甲壳类是杂食性或食腐性动物,在食物链中,更容易摄入含砷的污染物,并且通过肝脏积累更多的砷[26]。
鱼类主要通过摄取悬浮颗粒物质和呼吸时通过亲脂膜进行离子交换来吸收水体中的金属,同时也通过食物链吸收金属[26]。本研究中,根据鱼类的栖息环境划分时,其总砷含量排序:底层鱼类>中层鱼类。
贝类是滤食性动物,会主动摄取与有机和无机颗粒物质结合的重金属,并从沉积物中积累多种金属[26]。一般来说,贝类比鱼类更易于蓄积重金属,但本研究结果中,贝类的总砷含量比鱼类低。查阅文献发现[19]:南方海域海温较高,贝类生长速度较快,使得蓄积重金属的时间减少,从而含量相对较低。
2.2 水产品无机砷污染状况
本研究所检测的广东沿海常见水产品砷的单因子污染指数评价结果如表4所示,大多数鱼类、甲壳类和贝类的Pi在正常水平,个别如真鲷、金钱鱼处于轻度污染水平。但是,藻类的Pi值均大于1,其中来自湛江硇洲岛和珠海万山群岛的马尾藻Pi值均大于30,提示的所采集区域的藻类中无机砷已超出限量标准。
表4 水产品中无机砷的污染状况
Table 4 Pollution status of inorganic arsenic in seafood

种类样品数限量标准Pi污染评价鱼类6≤0.10无污染(真鲷、金钱鱼)2≤0.10.20轻度污染甲壳类6≤0.50~0.12无污染贝类7≤0.50~0.05无污染马尾藻(万山群岛)1≤0.543.52超标马尾藻(硇洲岛)1≤0.530.06超标羊栖菜(万山群岛)1≤0.57.19超标
2.3 健康风险评估
为了进一步评估通过食用水产品摄入无机砷所带来的健康风险,本研究利用EWI值与粮农组织/世卫组织食品添加剂联合专家委员会提出的PTWI进行了比较。同时,运用THQ评估其非致癌风险,当THQ<1时,无明显非致癌风险,THQ≥1时,极大可能存在非致癌风险且值越大风险越大。如表5本研究结果显示:所检测的鱼类、甲壳类和贝类THQ均小于1,表明食用该种类水产品处于安全范围内,对人体健康的潜在风险较低。鱼类、甲壳类和贝类中无机砷对成年男性、成年女性和儿童的EWI/PTWI范围在0~0.87%。藻类的EWI/PTWI值均超过10% 的安全阈值,特别是儿童摄入马尾藻后,高达162.47%,表明存在过量摄入iAs的风险,尽量不食用或者通过加工除砷至安全范围才食用。藻类THQ在0.90~11.61,其中,马尾藻的THQ值均大于3,儿童的THQ大约是成年人的两倍,这表明可能会对人体的健康产生不利影响。
表5 水产品的健康风险评估相关指数
Table 5 Evaluation of the food safety of inorganic arsenic in aquatic products
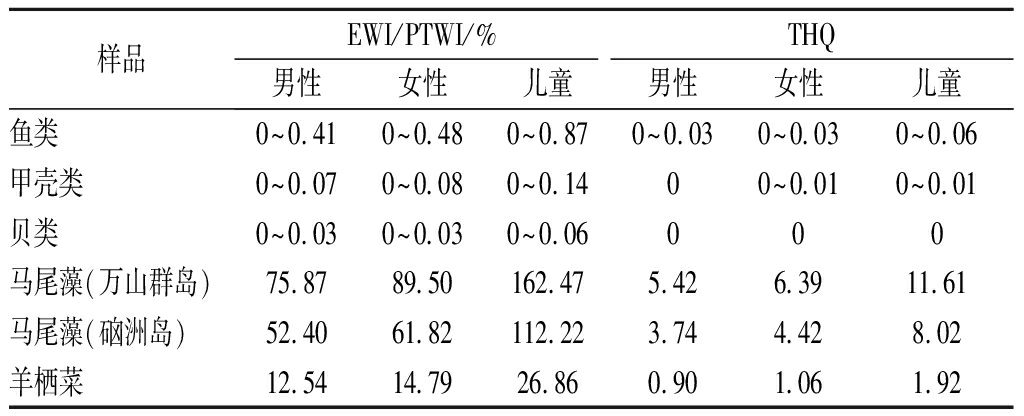
样品EWI/PTWI/%THQ男性女性儿童男性女性儿童鱼类0~0.410~0.480~0.870~0.030~0.030~0.06甲壳类0~0.070~0.080~0.1400~0.010~0.01贝类0~0.030~0.030~0.06000马尾藻(万山群岛)75.8789.50162.475.426.3911.61马尾藻(硇洲岛)52.4061.82112.223.744.428.02羊栖菜12.5414.7926.860.901.061.92
CR表示暴露于污染物的致癌风险,可接受最大值为10-4。由图1可知,食用所采集的水产品摄入无机砷的致癌风险。大部分鱼类、甲壳类和贝类样品的CR≤10-6,致癌风险可忽略,其中,真鲷、金钱鱼、黄道蟹和斑节对虾的致癌风险为可接受水平。藻类样品CR≤10-4,表明居民若常食用藻类将持续暴露于iAs污染,潜在癌症风险较高。研究所检测的广东沿海常见水产品的THQ和CR均表明,在广东沿海食用被砷污染的藻类可能会导致iAs过度暴露,并对健康造成非致癌性和致癌性风险。因此,减少摄入广东沿海藻类的量是必要的。

图1 摄入水产品中无机砷的致癌风险(×10-5)
Fig.1 Carcinogenic risk of inorganic arsenic in aquatic products(×10-5)
2.4 消费建议
表6给出了成年男性、女性和儿童水产品的每日最大允许消费量和每月最大允许餐数。消费建议中,除了藻类的CRlim应减少至0.1~1.3 g/d外,其余均在可接受水平。成年男性、女性和儿童食用锈斑蟳的CRmm低于USEPA估算的安全阈值(每月最大允许餐数16)[11],此外,儿童食用缢蛏的CRmm低于USEPA估算的安全阈值。因此,建议广东沿海当地居民参考表5适当调整对这几种水产品的日食用量和月食用餐数。
2.5 不确定性分析
健康风险评估的不确定性分析也是风险评估的一个重要过程。以下是本研究的不确定性说明:(1)采用终身暴露评估模式,假设暴露频率为每年365 d,可能高估暴露时间从而高估暴露量。(2)因缺乏研究区域的人群具体暴露参数,引用广东省甚至全国的平均参数,可能会存在一定偏差。(3)仅对单一污染物(As)进行评价,缺乏其他金属含量和其他食物中的暴露剂量,可能低估了居民膳食重金属暴露水平。(4)本文未考虑食材的运输、加工与烹饪过程中都有可能引起食入重金属含量的变化,并默认人体对As的吸收率为100%,因此,评估结果存在不确定性。
表6 广东沿海常见水产品的CRlim和CRmm值
Table 6 CRlim and CRmm of aquatic products in the South China Sea
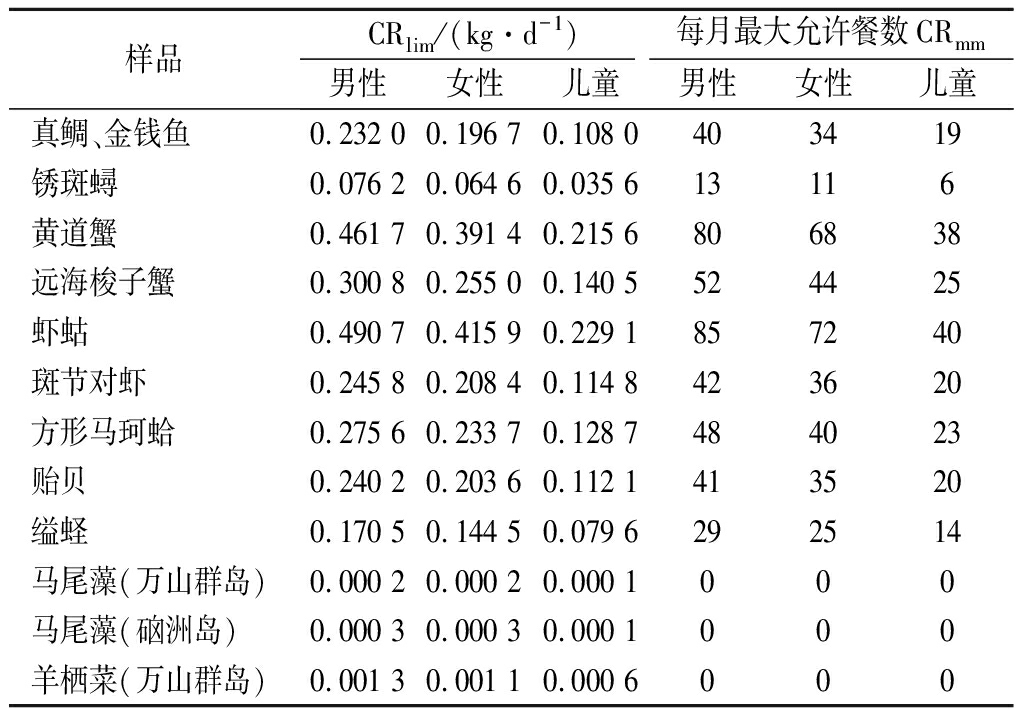
样品CRlim/(kg·d-1)每月最大允许餐数CRmm男性女性儿童男性女性儿童真鲷、金钱鱼0.232 00.196 70.108 0403419锈斑蟳0.076 20.064 60.035 613116黄道蟹0.461 70.391 40.215 6806838远海梭子蟹0.300 80.255 00.140 5524425虾蛄0.490 70.415 90.229 1857240斑节对虾0.245 80.208 40.114 8423620方形马珂蛤0.275 60.233 70.128 7484023贻贝0.240 20.203 60.112 1413520缢蛏0.170 50.144 50.079 6292514马尾藻(万山群岛)0.000 20.000 20.000 1000马尾藻(硇洲岛)0.000 30.000 30.000 1000羊栖菜(万山群岛)0.001 30.001 10.000 6000
注:每月餐数采用去余取整统计法
3 结论
(1)广东沿海常见水产品中总砷含量高低为:藻类>甲壳类>鱼类>贝类;其中藻类无机砷占总砷的59.01%~92.73%,其余均低于10%。
(2)广东沿海常见水产品中鱼类、甲壳类和贝类的无机砷污染状况总体处于无污染水平,但个别品种如真鲷和金钱鱼处于轻度污染水平。同时,藻类的无机砷含量已超出限量标准,因此需要特别关注,并加强实地监测以提高对广东沿海水生生物中As防治。
(3)健康风险评估结果显示,长期食用广东沿海常见水产品动物的THQ和CR值均处于可接受水平,但藻类的THQ和CR值大于可接受水平,最大值分别为11.61和5.22×10-3,存在一定健康风险,建议消费者适当控制日食用量和月食用餐数。
[1] SILVA C A D, DE OLIVEIRA SANTOS S, GARCIA C A B, et al.Metals and arsenic in marine fish commercialized in the NE Brazil:Risk to human health[J].Human and Ecological Risk Assessment:an International Journal, 2020, 26(3):695-712.
[2] CUBADDA F, JACKSON B P, COTTINGHAM K L, et al.Human exposure to dietary inorganic arsenic and other arsenic species:State of knowledge, gaps and uncertainties[J].The Science of the Total Environment, 2017, 579:1 228-1 239.
[3] MONTEIRO DE OLIVEIRA E C, CAIXETA E S, SANTOS V S V,et al.Arsenic exposure from groundwater:Environmental contamination, human health effects, and sustainable solutions[J].Journal of Toxicology and Environmental Health. Part B, Critical Reviews, 2021, 24(3):119-135.
[4] SHAO K, ZHOU Z, XUN P C, et al.Bayesian benchmark dose analysis for inorganic arsenic in drinking water associated with bladder and lung cancer using epidemiological data[J].Toxicology, 2021, 455:152752.
[5] REHMAN K, FATIMA F, AKASH M S H.Biochemical investigation of association of arsenic exposure with risk factors of diabetes mellitus in Pakistani population and its validation in animal model[J].Environmental Monitoring and Assessment, 2019, 191(8):511.1-511.15.
[6] LUO L R, LI Y Y, GAO Y H, et al.Association between arsenic metabolism gene polymorphisms and arsenic-induced skin lesions in individuals exposed to high-dose inorganic arsenic in northwest China[J].Scientific Reports, 2018, 8(1):1-12.
[7] WANG X F, WANG L F, JIA X P, et al.Long-term spatiotemporal trends and health risk assessment of oyster arsenic levels in coastal waters of northern South China Sea[J].Environmental Science and Pollution Research International, 2017, 24(25):20 673-20 684.
[8] GONG Y, CHAI M W, DING H, et al.Bioaccumulation and human health risk of shellfish contamination to heavy metals and As in most rapid urbanized Shenzhen, China[J].Environmental Science and Pollution Research International, 2020, 27(2):2 096-2 106.
[9] LIU S, LIU Y L, YANG D F, et al.Trace elements in shellfish from Shenzhen, China:Implication of coastal water pollution and human exposure[J].Environmental Pollution, 2020, 263(B):114582.
[10] LI P, PAN Y S,FENG Y, et al.Concentrations and health risks of inorganic arsenic and methylmercury in shellfish from typical coastal cities in China:A simultaneous analytical method study[J].Food Chemistry, 2019, 278:587-592.
[11] CHAI M W, LI R L, GONG Y, et al.Bioaccessibility-corrected health risk of heavy metal exposure via shellfish consumption in coastal region of China[J].Environmental Pollution(Barking, Essex: 1987), 2021, 273:116529.
[12] VAROL M, KAYA G K, ALP A.Heavy metal and arsenic concentrations in rainbow trout (Oncorhynchus mykiss) farmed in a dam reservoir on the Firat (Euphrates) River:Risk-based consumption advisories[J].The Science of the Total Environment, 2017, 599-600:1 288-1 296.
[13] 袁丽娟, 熊艳, 廖且根, 等.江西省市售草鱼重金属含量分析及食用安全性评价[J].环境化学, 2020, 39(6):1 555-1 567.
YUAN L J, XIONG Y, LIAO Q G,et al.Determination and health risk assessment of heavy metals in commercial Ctenopharyngodon idellus from Jiangxi Province[J].Environmental Chemistry, 2020, 39(6):1 555-1 567.
[14] 黄芮, 陈子慧, 王萍, 等.2015年广东省成年居民水产品类食物摄入状况分析[J].华南预防医学, 2019, 45(3):283-286.
HUANG R, CHEN Z H,WANG P,et al.Analysis of aquatic products consumption in adults in Guangdong province, 2015[J]. South China Journal of Preventive Medicine, 2019, 45(3):283-286.
[15] CHEN Q, PAN X D, HUANG B F, et al.Distribution of metals and metalloids in dried seaweeds and health risk to population in southeastern China[J].Scientific Reports, 2018, 8(1):1-7.
[16] 中国居民营养与慢性病状况报告(2020年)[J].营养学报, 2020, 42(6):521.
Report on nutrition and chronic diseases of residents in China (2020)[J].Acta Nutrimenta Sinica, 2020, 42(6):521.
[17] 覃焱, 韦燕燕, 顾明华.中国市售大米重金属含量及健康风险评估[J].食品工业, 2020, 41(11):332-335.
QIN Y, WEI Y Y, GU M H.The heavy metal content monitoring and dietary risk assessment of commercial rice in China[J].The Food Industry, 2020, 41(11):332-335.
[18] 李昇昇, 李敏, 朱晓辉, 等.大亚湾海产中重金属的健康风险与海产消费建议[J].环境化学, 2020, 39(2):352-361.
LI S S, LI M, ZHU X H, et al.Heavy metals in selected marine organisms from Daya Bay:Human health risk assessment and advice for seafood consumption[J].Environmental Chemistry, 2020, 39(2):352-361.
[19] WANG Z X, GU X, OUYANG W, et al.Trophodynamics of arsenic for different species in coastal regions of the Northwest Pacific Ocean:in situ evidence and a meta-analysis[J].Water Research, 2020, 184:116186.
[20] PALASH M A U, ISLAM M S, BAYERO A S, et al.Evaluation of trace metals concentration and human health implication by indigenous edible fish species consumption from Meghna River in Bangladesh[J].Environmental Toxicology and Pharmacology, 2020, 80:103440.
[21] FERRANTE M, NAPOLI S, GRASSO A, et al.Systematic review of arsenic in fresh seafood from the Mediterranean Sea and European Atlantic coasts:A health risk assessment[J].Food and Chemical Toxicology: an International Journal Published for the British Industrial Biological Research Association, 2019, 126:322-331.
[22] SOLTANI N, MAREGO M,KESHANARZI B, et al.Occurrence of trace elements (TEs) in seafood from the North Persian Gulf:Implications for human health[J].Journal of Food Composition and Analysis, 2021, 97:103754.
[23] PAN Y R, WERNBERG T, DE BETTIGNIES T D, et al.Screening of seaweeds in the East China Sea as potential bio-monitors of heavy metals[J].Environmental Science and Pollution Research International, 2018, 25(17):16 640-16 651.
[24] KHANDAKER M U, CHIJIOKE N O, HEFFNY N A B, et al.Elevated concentrations of metal(loids) in seaweed and the concomitant exposure to humans[J].Foods(Basel, Switzerland), 2021, 10(2):381.
[25] TAYLOR V, GOODALE B, RAAB A, et al.Human exposure to organic arsenic species from seafood[J].The Science of the Total Environment, 2017, 580:266-282.
[26] LIU Q, LIAO Y B, SHOU L.Concentration and potential health risk of heavy metals in seafoods collected from Sanmen Bay and its adjacent areas, China[J].Marine Pollution Bulletin, 2018, 131(Pt A):356-364.