山楂为传统药食两用中药,《中国药典》规定药用山楂为蔷薇科植物山里红Crataegus pinnatifida Bge.var.major N.E.Br.或山楂Crataegus pinnatifida Bge.的干燥成熟果实[1],习称“北山楂”;具有消食健胃,行气散瘀,化浊降脂的功效,现代药理研究表明,山楂具有保护心脑血管系统、降糖、降压、降血脂改善代谢综合征等作用[2-9]。野山楂为蔷薇科植物野山楂Crataegus cuneata Sieb.& Zucc.的干燥成熟果实,习称“南山楂”。南北山楂均含有机酸、黄酮类、黄烷类、三萜类、挥发性成分、氨基酸类以及微量元素等多种成分[10-14]。
山楂中的有机酸类成分具有促进胃肠运动的作用[15],被认为是山楂健胃消食、改善血液循环、降低高血压和高脂血症的关键生物活性化合物之一[16],同时也是山楂风味的重要组成。由于山楂中的强极性有机酸类(如枸橼酸、苹果酸)等在常规C18反相色谱柱分离较困难,目前针对山楂中有机酸类成分主要采用电位滴定法[17-18]、近红外漫反射光谱法[19]、电化学微反应器技术[20]进行总量的测定。相关研究表明,山楂中的总有机酸含量高于野山楂[21],但具体成分含量差异尚不明确。然而,在开展多成分含量测定时,每个成分均需要对照品,分析成本较高。一测多评法通过研究在一定的色谱条件下,待测化学成分间响应值的内在函数或者比例关系,可实现采用一个对照品(简单易得的成分)对多个成分进行含量测定,适用于多指标质量控制与评价[22-23]。本研究针对山楂中的有机酸类成分,采用适合于酸性纯水分析的ZORBAX SB-Aq柱,建立了山楂和野山楂强极性有机酸的HPLC指纹图谱及同时多成分含量测定的一测多评分析方法,对山楂及野山楂样品进行研究,以期为山楂质量控制及应用提供参考。
1 材料与方法
1.1 材料与试剂
山楂样品(Crataegi Fructus,CF)为从产地采收蔷薇科植物山楂Crataegus pinnatifida Bge.的成熟果实(CPF)14批、山里红Crataegus pinnatifida Bge. var. major N. E. Br.的成熟果实(CPMF)10批,以及从市场收集山楂饮片(CFYP)9批;野山楂样品(Crataegi Cuneata Fructus,CCF)为从产地采收野山楂Crataegus cuneata Sieb. & Zucc.的成熟果实10批。自行采收的果实经低温干燥后,贮存备用;市场收集的山楂饮片均为切片。样品具体信息见表1。
对照品:枸橼酸(批号:100396-201603,纯度HPLC≥98%),L-苹果酸(批号:190014-201302,纯度HPLC≥98%),购自中国食品药品检定研究院;D-奎宁酸(批号:PS0713-0120MG,纯度HPLC≥98%),购自成都普思生物科技股份有限公司;水为超纯水,其余试剂为分析纯。
1.2 仪器与设备
Agilent 1260 Infinity高效液相色谱仪,美国Agilent公司;KH 500DB超声波提取器,昆山禾创超声仪器有限公司(中国);Sartorius QUINTIX 224-1CN万分之一、35-1CN十万分之一电子天平,北京赛多利斯科学仪器有限公司。
1.3 实验方法
1.3.1 色谱条件
色谱分离采用Agilent ZORBAX SB-Aq(4.6 mm×250 mm,5 μm)色谱柱;以0.1%磷酸溶液为流动相,等度洗脱20 min,流速0.8 mL/min,柱温30 ℃,进样量10 μL。对D-奎宁酸、L-苹果酸和枸橼酸对照品溶液进行全波长扫描,其最大吸收波长均在210 nm左右(图1),因此选择检测波长为210 nm。
表1 三十三批山楂样品及10批野山楂样品信息
Table 1 Origin information of 33 batches of Crataegi Fructus and 10 batches of Crataegi Cuneata Fructus

编号产地收集日期或批号编号产地收集日期或批号CPF-1山东阳谷2018.12CPMF-9河北承德2018.11CPF-2山东聊城2018.12CPMF-10山东聊城2018.11CPF-3河北承德2018.12CFYP-1山东潍坊 18100501CPF-4山东聊城2018.11CFYP-2山东 181002 CPF-5安徽亳州2018.12CFYP-3山东潍坊 18081006CPF-6山西长治2018.12CFYP-4山东临沂180801 CPF-7河北承德2018.11CFYP-5山东 181001 CPF-8河北承德2018.12CFYP-6河北 180917014CPF-9河北遵化2018.12CFYP-7江苏 181101 CPF-10河北承德2018.12CFYP-8山东临沂190105 CPF-11河北承德2018.11CFYP-9山东平邑 20181201CPF-12山西长治2018.12CCF-1山东阳谷2018.11CPF-13山东聊城2018.11CCF-2山东聊城2018.11CPF-14山西长治2018.11CCF-3河北承德2018.11CPMF-1河北遵化2018.11CCF-4山东聊城2018.11CPMF-2辽宁庄河2018.11CCF-5安徽亳州2018.11CPMF-3河北遵化2018.11CCF-6山西长治2018.11CPMF-4河北承德2018.11CCF-7河北承德2018.11CPMF-5河北承德2018.11CCF-8河北承德2018.11CPMF-6河北承德2018.11CCF-9河北遵化2018.11CPMF-7河北承德2018.11CCF-10河北承德2018.11CPMF-8辽宁庄河2018.11 ///
注“/”表示无样品(下同)

A-D-奎宁酸;B-L-苹果酸;C-枸橼酸
图1 D-奎宁酸,L-苹果酸和枸橼酸的紫外吸收光谱图
Fig.1 UV spectrums of D-quinic acid, L-malic acid, and citric acid hydrate
1.3.2 供试品溶液制备
对照品溶液的制备取D-奎宁酸、L-苹果酸、枸橼酸对照品适量,精密称定,加纯水制成质量浓度分别为3.83、5.40、19.75 mg/mL的混合对照品储备液。
供试样品溶液的制备取山楂样品粉末(过四号筛)0.5 g,精密称定,置具塞锥形瓶中,精密加入纯水15 mL,摇匀,超声30 min,放冷,补足失重,用0.22 μm滤膜滤过,取续滤液,即得。
2 结果与分析
2.1 方法学考察结果
2.1.1 线性范围考察
将对照品储备液分别稀释得到不同梯度质量浓度的混合对照品溶液,在上述的色谱条件下进样分析,各个梯度平行进样3次,测定峰面积,以质量浓度(mg/mL)为横坐标(x),峰面积(mAU)为纵坐标(y),绘制标准曲线。将对照品溶液进一步稀释后进样分析,以信噪比(S/N)分别为3和10时的浓度记为该化合物的检测限和定量限。取该线性范围考察的7个浓度的对照品溶液每份分析3次,记录峰面积,按公式(1)计算相对校正因子,以D-奎宁酸为内标物分别计算L-苹果酸、枸橼酸的相对校正因子(relative correction factor, RF),结果见表2。
RF=(As/Cs)/(Ai/Ci)
(1)
式中:As为内标峰面积;Cs为内标浓度;Ai为待测物峰面积;Ci为待测物浓度。
表2 各成分线性范围、检测限、定量限、相对校正因子考察结果
Table 2 Results of linearity, limit of detection, limit of quantitation, and relative correction factor for each component

待测物线性回归方程R2线性范围/(μg·mL-1)检测限/(μg·mL-1)定量限/(μg·mL-1)RFD-奎宁酸y=325.93x+3.252 11.00058.4~2 920.04.62413.2141.00L-苹果酸y=526.88x+3.724 40.999 940.3~2 013.31.6675.0000.62枸橼酸y=748.35x+22.6160.999 958.0~8 068.03.2179.6510.43
2.1.2 精密度考察
取对照品溶液,在上述色谱条件下,于同一日内连续进样6次,记录D-奎宁酸、L-苹果酸、枸橼酸峰面积,各成分峰面积相对标准偏差(relative standard deviation, RSD)分别为0.07%、0.08%、0.05%,表明仪器日内精密度良好;连续3日,每日进样分析3次,记录各成分峰面积,各成分峰面积RSD分别为1.55%、0.90%、0.81%,表明仪器日间精密度良好。同时按照供试品溶液制备方法以山楂样品(CPF-5)制备供试品溶液,同样在上述建立好的色谱条件下于同一日内连续进样6次,用相似度评价软件计算,测得的各色谱与其所得共有模式图的相似度均为1.000,结果表明仪器精密度良好。
2.1.3 重复性考察
平行称量6份山楂样品(CPF-5),按照供试品制备方法制备样品,在同样的色谱条件下进样分析,各成分峰面积RSD分别为1.91%、0.47%、1.84%;用相似度评价软件计算,各色谱图与其所得共有模式的相似度分别均为1.000,结果表明该方法重复性良好。
2.1.4 稳定性考察
取山楂样品(CPF-5)制备的供试品溶液,在已经建立好的色谱条件分别在0、2、4、6、8、10、12、24 h进样分析,各成分峰面积RSD分别为0.93%、0.77%、1.63%;相似度计算结果显示,2~24 h测得的色谱图与0 h色谱图相似度分别为0.995、0.993、1.000、1.000、1.000、1.000、1.000,结果表明样品在24 h内稳定性良好。
2.1.5 准确度考察
准确性采用加样回收率试验来考察。精密称取已知含量的山楂样品(CFYP-5)0.25 g,平行6份,分别精密加入待测化合物的对照品适量,按上述的供试品溶液制备方法制备供试品溶液,在已经建立好的色谱条件下进样分析,测定峰面积,各成分的平均回收率分别为105%、98%、94%,RSD分别为1.94%、2.06%、2.59%,结果表明该方法可靠。
2.1.6 相对校正因子的耐用性考察
采用不同厂家、型号的液相色谱仪和不同品牌的色谱柱(规格均为4.6 mm×250 mm, 5 μm)进行校正因子耐用性考察,见表3。结果表明,校正因子RSD<3%,表明各成分的相对校正因子耐用性良好。
表3 不同色谱仪及色谱柱对校正因子的影响
Table 3 Relative correction factor of different instruments and columns
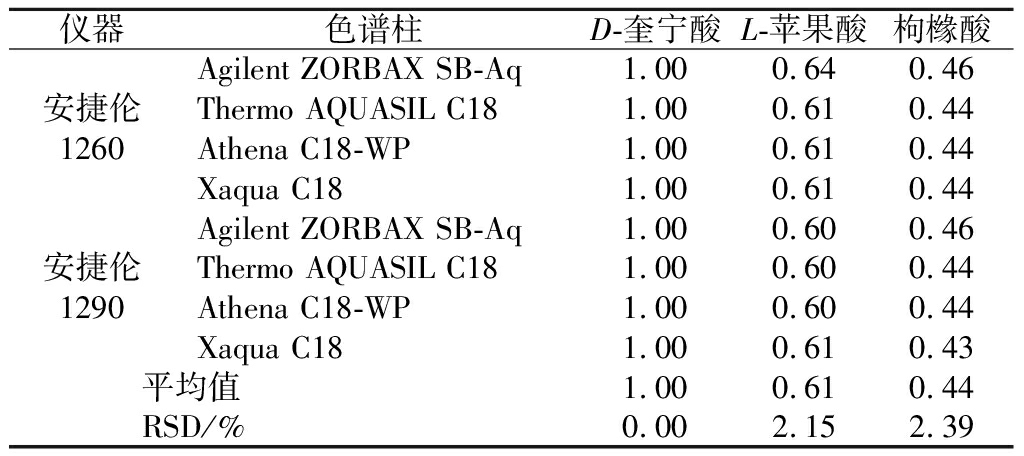
仪器色谱柱D-奎宁酸L-苹果酸枸橼酸Agilent ZORBAX SB-Aq1.000.640.46安捷伦Thermo AQUASIL C181.000.610.441260Athena C18-WP1.000.610.44Xaqua C181.000.610.44Agilent ZORBAX SB-Aq1.000.600.46安捷伦Thermo AQUASIL C181.000.600.441290Athena C18-WP1.000.600.44Xaqua C181.000.610.43平均值1.000.610.44RSD/%0.002.152.39
2.2 山楂与野山楂指纹图谱的建立
将33批山楂样品以及10批野山楂样品所得的色谱数据以CDF格式导入国家药典委员会颁布的《中药色谱指纹图谱相似度评价系统(2012版)》。以CPMF-1为参照图谱,时间窗宽度设置为0.1 min,中位数法生成对照谱,经全谱峰匹配后生成的33批山楂及10批野山楂样品的叠加图谱和对照指纹图谱(R),共标定3个共有峰,通过与对照品比对,1号峰为D-奎宁酸,2号峰为L-苹果酸,4号峰为枸橼酸,见图2~3。

图2 三十三批山楂及10批野山楂HPLC指纹图谱
Fig.2 HPLC fingerprints of 33 batches of Crataegi Fructus and 10 batches of Crataegi Cuneata Fructus

1-D-奎宁酸;2-L-苹果酸;3-未知峰;4-枸橼酸 A-野山楂样品;B-混合对照品;C-山楂样品
图3 HPLC图
Fig.3 HPLC chromatograms
2.3 含量测定结果
采用一测多评法(quantitative analysis of multi-components by single marker, QAMS)和标准曲线法(standard curve method, SCM)对33批山楂样品以及10批野山楂样品中的3个有机酸类成分进行含量测定,结果见表4。按照公式(2)对3个有机酸类总含量进行准确度评价。计算得到有机酸类成分准确度为98.78%~105.67%,且RSD<1.34%,说明建立的一测多评法用于山楂及野山楂样品的多成分含量测定与标准曲线法测定结果较为一致。
准确度![]()
(2)
式中:Cq为一测多评法测定结果,Cs为标准曲线法测定结果。
表4 一测多评法和标准曲线法含量结果(干燥品,n=2) 单位:%(质量分数)
Table 4 The content determination results of QAMS and SCM

编号D-奎宁酸L-苹果酸枸橼酸准确度/%CqCsCqCsCqCs编号D-奎宁酸L-苹果酸枸橼酸准确度/%CqCsCqCsCqCsCPF-13.503.551.601.618.027.93100.23CPMF-13.293.333.273.3613.6913.8198.78CPF-23.873.931.581.588.858.76100.21CPMF-22.312.311.041.0111.5111.5599.93CPF-32.702.711.351.338.618.52100.80CPMF-32.282.281.111.0810.2810.26100.37CPF-43.243.291.751.767.707.59100.40CPMF-43.433.482.702.7710.5910.6199.17CPF-53.263.301.611.609.018.92100.43CPMF-52.462.471.861.8710.8210.8599.67CPF-62.952.982.012.039.919.8799.93CPMF-61.931.921.241.229.859.83100.39CPF-73.503.551.361.368.037.95100.23CPMF-72.522.531.591.599.989.96100.07CPF-82.872.901.161.138.628.54100.64CPMF-82.402.401.041.0111.2211.25100.00CPF-92.742.760.920.897.627.52100.98CPMF-92.372.371.781.7911.5811.6299.68CPF-102.942.971.401.398.968.90100.30CPMF-102.412.421.031.009.559.51100.46CPF-113.293.331.421.419.929.88100.07CCF-15.175.140.990.970.610.51102.27CPF-123.023.051.561.5610.8810.8899.81CCF-25.485.460.800.780.600.49102.23CPF-134.264.332.002.0211.0511.0599.48CCF-36.886.85NDND0.390.29101.82CPF-142.432.431.281.268.047.88101.56CCF-47.397.37NDND0.250.15101.60CFYP-12.492.500.740.697.747.61101.57CCF-54.784.750.470.450.450.34102.89CFYP-21.561.530.480.414.854.58105.67CCF-66.156.130.730.700.570.47102.05CFYP-32.842.860.850.819.349.29100.54CCF-75.715.690.780.760.490.39102.05CFYP-42.172.170.810.776.766.58102.31CCF-87.267.24NDND0.410.30101.72CFYP-52.142.130.660.616.516.33102.65CCF-97.267.23NDND0.260.16101.76CFYP-73.043.071.030.997.207.04101.53/CFYP-82.142.130.620.566.266.05103.20/CFYP-91.531.510.640.595.635.41103.86/
注:ND表示检测不到该成分
2.4 山楂与野山楂比较分析
2.4.1 相似度分析
以CPMF-1为参照,时间窗宽度设置为0.1 min,中位数法生成对照谱,采用《中药色谱指纹图谱相似度评价系统(2012版)》对各批次样品图谱进行相似度评价,见表5。结果表明,33批山楂样品与参照图谱CPMF-1的相似度在0.983~1.000,10批野山楂样品与参照图谱CPMF-1相似度在0.289~0.432,说明山楂与野山楂样品之间化学信息差异较大。
表5 三十三批山楂及10批野山楂的相似度结果
Table 5 Similarities of 33 batches of Crataegi Fructus and and 10 batches of Crataegi Cuneata Fructus

样品相似度样品相似度样品相似度样品相似度CPMF-11.000CPF-20.993CPF-130.990CCF-10.432CPMF-20.986CPF-30.996CPF-140.984CCF-20.406CPMF-30.989CPF-40.992CFYP-10.990CCF-30.311CPMF-40.999CPF-50.990CFYP-20.985CCF-40.289CPMF-50.989CPF-60.994CFYP-30.990CCF-50.412CPMF-60.987CPF-70.990CFYP-40.990CCF-60.379CPMF-70.990CPF-80.989CFYP-50.986CCF-70.381CPMF-80.986CPF-90.988CFYP-60.983CCF-80.316CPMF-90.988CPF-100.986CFYP-70.983CCF-90.293CPMF-100.986CPF-110.987CFYP-80.983CCF-100.307CPF-10.995CPF-120.987CFYP-90.987 //
2.4.2 聚类分析
采用IBM SPSS Statistics 23.0(SPSS Inc., Chicago, IL)软件,以山楂与野山楂样品中共有的3个有机酸含量为变量,采用瓦尔德法对33批山楂及10批野山楂样品进行聚类分析,结果见图4,由结果可知,当判别条件距离为5时,33批山楂及10批野山楂样品被明显分开,这与指纹图谱相似度评价的结果一致,说明山楂与野山楂样品的质量有明显的差异。

图4 系统聚类树状图
Fig.4 Systematic clustering tree
2.4.3 主成分分析(principal component analysis,PCA)及偏最小二乘法-判别分析(partial least squares method-discriminant analysis,PLS-DA)
以山楂与野山楂样品中共有的3个有机酸含量为变量导入SIMCA 14.1(Sartorius Stedim., Sweden)软件进行PCA和PLS-DA分析,结果见图5,山楂样品与野山楂样品各自聚为两簇,结果与指纹图谱以及聚类分析的结果一致,表明通过3个有机酸的含量可以对山楂和野山楂进行区分。3个有机酸在PLS-DA模型中的VIP值从大到小依次为枸橼酸、D-奎宁酸、L-苹果酸,其中的枸橼酸和D-奎宁酸的VIP > 1.0。结合定量和化学计量学分析结果可知,山楂和野山楂所含的酚酸类成分有明显区别;山楂中的CPF和CPMF有机酸成分也比较接近,但切制成饮片(CFYP)后,其有机酸含量则会有一定程度的降低。
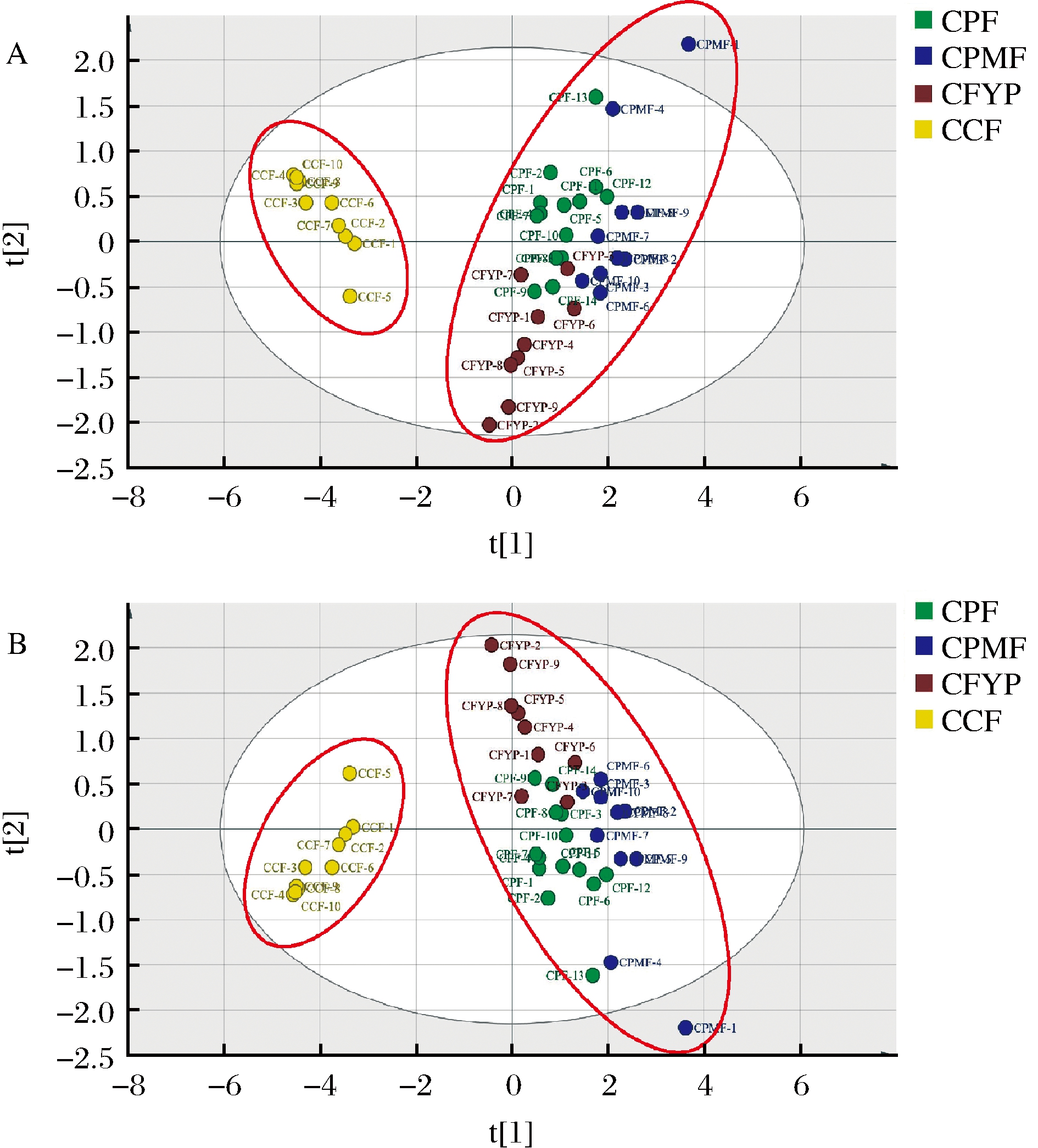
A-PCA;B-PLS-DA
图5 PCA和PLS-DA得分图
Fig.5 Scores plot of PCA and PLS-DA
3 结论
本实验以33批山楂和10批野山楂样品建立了山楂与野山楂强极性的有机酸的指纹图谱,发现山楂与野山楂所含有的有机酸类成分存在较大差异;进一步以D-奎宁酸为内参物,建立L-苹果酸与枸橼酸的相对校正因子,可同时对山楂与野山楂中D-奎宁酸、L-苹果酸与枸橼酸进行含量测定。对33批山楂和10批野山楂的测定结果显示,山楂中枸橼酸、L-苹果酸的含量远高于野山楂,而野山楂中以D-奎宁酸含量则远高于山楂。以3个有机酸类成分含量为变量进行聚类分析、主成分分析、偏最小二乘法-判别分析,山楂与野山楂样品各自聚为一簇,说明可以通过含量差异鉴别山楂与野山楂,其中枸橼酸和D-奎宁酸为山楂和野山楂中含量差别最大的成分。本文采用HPLC指纹图谱进行定性分析结合一测多评法对3个有机酸类成分进行定量分析,为山楂的质量评价及应用提供参考。
[1] 国家药典委员会. 中华人民共和国药典-一部:2020年版[M].北京:中国医药科技出版社, 2020:33.
Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia:Volume Ⅰ[M].2020. Beijing:China Medical Science Press, 2020:33.
[2] RIGELSKY J M, SWEET B V.Hawthorn:Pharmacology and therapeutic uses[J].American Journal of Health-System Pharmacy, 2002, 59(5):417-422.
[3] PITTLER M H, GUO R, ERNST E.Hawthorn extract for treating chronic heart failure[J].The Cochrane Database of Systematic Reviews, 2008, (1):CD005312.
[4] CHANG W T, DAO J, SHAO Z H.Hawthorn:Potential roles in cardiovascular disease[J].The American Journal of Chinese Medicine, 2005, 33(1):1-10.
[5] DEHGHANI S, MEHRI S, HOSSEINZADEH H.The effects of Crataegus pinnatifida (Chinese hawthorn) on metabolic syndrome:A review[J].Iranian Journal of Basic Medical Sciences, 2019, 22(5):460-468.
[6] ZENG L, LUO L, XUE Q, et al.LC-MS based plasma metabolomics study of the intervention effect of different polar parts of Hawthorn on hyperlipidemia rats[J].Journal of Separation Science, 2021, 44(5):963-972.
[7] ZHANG Y Y, ZHANG L, GENG Y, et al.Hawthorn fruit attenuates atherosclerosis by improving the hypolipidemic and antioxidant activities in apolipoprotein e-deficient mice[J].Journal of Atherosclerosis and Thrombosis, 2014, 21(2):119-128.
[8] WU M, LIU L T, XING Y W, et al.Roles and mechanisms of hawthorn and its extracts on atherosclerosis:A review[J].Frontiers in Pharmacology, 2020, 11:118.
[9] AIERKEN A, BUCHHOLZ T, CHEN C, et al.Hypoglycemic effect of hawthorn in type II diabetes mellitus rat model[J].Journal of the Science of Food and Agriculture, 2017, 97(13):4 557-4 561.
[10] 张祺嘉钰, 赵佩媛, 孙静, 等.山楂的化学成分及药理作用研究进展[J].西北药学杂志, 2021, 36(3):521-523.
ZHANG Q J Y, ZHAO P Y, SUN J, et al.Research progress on chemical constituents and pharmacological action of hawthorn[J].Northwest Pharmaceutical Journal, 2021, 36(3):521-523.
[11] 董嘉琪, 陈金鹏, 龚苏晓, 等.山楂的化学成分、药理作用及质量标志物(Q-Marker)预测[J].中草药, 2021, 52(9):2 801-2 818.
DONG J Q, CHEN J P, GONG S X, et al.Research progress on chemical constituents and pharmacological effects of Crataegi Fructus and predictive analysis on Q-Marker[J].Chinese Traditional and Herbal Drugs, 2021, 52(9):2 801-2 818.
[12] 靳庆霞. 浅析山楂的化学成分及药理作用[J].内蒙古中医药, 2014, 33(36):62.
JIN Q X.Analysis on chemical constituents and pharmacological effects of hawthorn[J].Nei Mongol Journal of Traditional Chinese Medicine, 2014, 33(36):62.
[13] 楼陆军, 罗洁霞, 高云.山楂的化学成分和药理作用研究概述[J].中国药业, 2014, 23(3):92-94.
LOU L J, LUO J X, GAO Y.Overview of chemical compostions and pharmacological action of Grataegus pinnatifida bunge[J].China Pharmaceuticals, 2014, 23(3):92-94.
[14] 吴士杰, 李秋津, 肖学凤, 等.山楂化学成分及药理作用的研究[J].药物评价研究, 2010, 33(4):316-319.
WU S J, LI Q J, XIAO X F, et al.Study on chemical constituents and pharmacological effects of hawthorn[J].Drug Evaluation Research, 2010, 33(4):316-319.
[15] 吴建华, 孙净云.山楂有机酸部位对胃肠运动的影响[J].陕西中医, 2009, 30(10):1 402-1 403.
WU J H, SUN J Y.Effect of organic acid fraction of hawthorn on gastrointestinal motility[J].Shaanxi Journal of Traditional Chinese Medicine, 2009, 30(10):1 402-1 403.
[16] LIU P Z, KALLIO H, LYU D G, et al.Acids, sugars, and sugar alcohols in Chinese hawthorn (Crataegus spp.) fruits[J].Journal of Agricultural and Food Chemistry, 2010, 58(2):1 012-1 019.
[17] 张慧, 夏厚林, 杨孟妮, 等.电位滴定法测定山楂及其炮制品总有机酸的含量[J].中药与临床, 2016, 7(3):27-28;32.
ZHANG H, XIA H L, YANG M N, et al.Determination of total organic acids content in Shanzha and processed products by potentiometric titration method[J].Pharmacy and Clinics of Chinese Materia Medica, 2016, 7(3):27-28;32.
[18] 雷成康, 郭玲.山楂中有机酸含量测定方法的改进[J].中药材, 2010, 33(5):745-747.
LEI C K, GUO L.Improvement of determination method of organic acid content in hawthorn[J].Journal of Chinese Medicinal Materials, 2010, 33(5):745-747.
[19] 杨海龙, 臧恒昌, 胡甜, 等.近红外漫反射光谱法对不同产地山楂的定性鉴别和定量分析[J].药物分析杂志, 2014, 34(3):396-401.
YANG H L, ZANG H C, HU T, et al.Classification and quantification analysis of hawthorn from different origins with near-infrared diffuse reflection spectroscopy[J].Chinese Journal of Pharmaceutical Analysis, 2014, 34(3):396-401.
[20] YANG J, DONG X, ZHEN X T, et al.Rapid analysis and identification of flavonoid and organic acid metabolites in Hawthorn using an on-line flow injection assisted electrochemical microreactor combined with quadrupole time-of-flight tandem mass spectrometry[J].Journal of Food Composition and Analysis, 2021, 96:103700.
[21] 邵峰, 谷丽菲, 陈慧娟, 等.不同产地山里红野山楂中总黄酮总有机酸含量比较[J].时珍国医国药, 2015, 26(1):11-13.
SHAO F, GU L F, CHEN H J, et al.The comparison of total flavonoids and total organic acid in Crataegus pinnatifida bge.var.major.N.E.Br.and Crataegus cuneata sieb.et zucc.in different habitats[J].Lishizhen Medicine and Materia Medica Research, 2015, 26(1):11-13.
[22] 王智民, 高慧敏, 付雪涛, 等.“一测多评”法中药质量评价模式方法学研究[J].中国中药杂志, 2006, 31(23):1 925-1 928.
WANG Z M, GAO H M, FU X T, et al.Multi-components quantitation by one marker new method for quality evaluation of Chinese herbal medicine[J].China Journal of Chinese Materia Medica, 2006, 31(23):1 925-1 928.
[23] 陆兔林, 石上梅, 蔡宝昌, 等.基于一测多评的中药多成分定量研究进展[J].中草药, 2012, 43(12):2 525-2 529.
LU T L, SHI S M, CAI B C, et al.Advances in studies on multi-component determination of Chinese materia medica by QAMS[J].Chinese Traditional and Herbal Drugs, 2012, 43(12):2 525-2 529.