食品安全监测是预防控制食源性疾病的重要手段。鉴于食品危害物种类繁多,食品链错综复杂且任何环节均易受到污染,以及食品基质复杂多样等原因,准确高效的食品安全监测仍是亟待解决的难题。免疫层析技术(immunochromatographic assay, ICA)因操作简单、检测速度快和信号可肉眼判读,是现场快速筛查的首选方法,在基层食品安全监测中发挥着举足轻重的作用。近年来,为了提高ICA的性能以满足实际应用需要,大量新型纳米材料如磁性颗粒、荧光微球、表面增强拉曼光谱(surface enhanced Raman spectra, SERS)纳米颗粒等在ICA应用研究领域备受关注[1]。其中,基于功能集成化策略的双(或多)功能探针,包括具备双信号输出能力的纳米探针[2]、可实现前处理-检测一体化的磁性光学纳米探针[3]、可通过催化信号放大实现多级比色信号输出的纳米探针[4]等因能显著提升ICA在实际应用中的灵活性、适应性和分析性能,被广泛用于各种食品危害物的快速检测(图1)。本文详细阐述了基于上述三类双功能探针的ICA技术的检测原理、发展现状及其在检测真菌毒素[4]、农兽药残留[5]、违禁添加物[6]和致病菌[7]等食品危害物方面的应用情况,并探讨了该领域的发展趋势和主要挑战。
1 基于双信号探针的ICA
相比传统单信号ICA,双信号ICA整合了不同检测信号的优点,有显著的优势[8]:(1)应用更灵活。比如,比色SERS、比色荧光或比色光热等双信号ICA既可用于现场裸眼定性筛查,又能用于高灵敏定量检测;(2)检测线性范围更宽,其是两个基于不同信号线性检测范围的并集;(3)检测结果更准确。基于不同信号的检测结果之间可以相互验证,方法的可靠性更高;同时,双信号系统能优势互补,降低各种干扰因素(如背景色、背景荧光、外部环境温度等)对某一信号的负面影响。因此,近年来基于双信号探针的ICA备受关注,且已用于致病菌、真菌毒素、农兽药残留和违禁添加物等食品危害物的快速检测(近5年代表性研究见表1)。
1.1 比色荧光双信号ICA
比色荧光ICA构建策略分为两种:其一,以比色荧光材料为双信号探针[10];其二,检测(T)、质控(C)线喷涂荧光材料输出背景荧光,以消光材料作为双信号探针在输出比色信号的同时,通过荧光内滤效应(即吸光物质吸收激发光或发射光,导致荧光减弱的现象)调控荧光信号[20]。
比色荧光双功能材料可分为两类:其一为荧光材料(如荧光聚合物、量子点[QDs]等),比色信号来源于荧光材料本身的消光能力[9, 21];其二为荧光材料与消光材料的复合材料[10-11]。BU等[9,21]在金黄色葡萄球菌内原位合成大量的QDs或聚合物点,赋予细菌很强的比色荧光信号输出能力,且细菌表面A蛋白能特异性结合抗体Fc段从而实现抗体的定向偶联。基于这种比色荧光细菌探针构建双信号ICA检测玉米赤霉烯酮(zearalenone,ZEN),比色、荧光信号的分析灵敏度相当,比传统AuNPs-ICA提高15~30倍。WANG等[10]在SiO2纳米颗粒表面通过静电层层自组装法分别依次修饰一层3 nm AuNPs和一层QDs,制得比色荧光SiO2@Au@QDs,并在其表面修饰万古霉素作为双信号探针构建ICA检测蔬菜汁和牛奶中的金黄色葡萄球菌,裸眼判读比色信号和荧光信号的检出限(limit of detection,LOD)分别为104 cells/mL和102 cells/mL。HE等[11]以封装了亚甲基蓝的锆基金属有机框架(UIO@MB)为探针构建ICA检测大肠杆菌O157∶H7。通过T线蓝色深浅及Al3+诱导的探针蓝色荧光强度对饮用水和卷心菜中目标致病菌进行检测,LOD均在103CFU/mL(较AuNPs-ICA提高100倍)。另外,受样本基质影响,比色信号检测卷心菜中目标致病菌的LOD增大到104CFU/mL。

图1 基于三类双功能纳米探针的免疫层析技术 及其食品安全应用
Fig.1 Immunochromatographic assays based on three types of bifunctional nanoprobes for food safety applications
表1 基于双信号探针的免疫层析试纸条在食品安全检测中的应用
Table 1 Dual-signal nanoprobe based ICA for food safety monitoring

探针类型探针材料目标物样本检出限LOD检测范围参考文献内部原位合成聚合物点金黄色葡萄球菌ZEN小米、玉米比色:0.09 ng/mL(裸眼), 0.036 ng/mL;荧光:0.043 ng/mL比色:0.045~12 ng/mL荧光:0.045~1.5 ng/mL[9]比色荧光SiO2@Au@QDs金黄色葡萄球菌蔬菜汁、牛奶比色:104 cells/mL(裸眼);荧光:102 cells/mL比色:未给出荧光:未给出[10]UIO@MB(封装亚甲基蓝的MOF材料)大肠杆菌O157∶H7饮用水、卷心菜比色荧光均为:103 CFU/mL比色:103~ 107 CFU/mL荧光:103~ 108 CFU/mL[11]聚多巴胺粒子(淬灭AIE微球荧光)磺胺甲嘧啶鸡肉比色:10 ng/mL(裸眼), 49 pg/mL;荧光:0.5 ng/mL(裸眼), 43 pg/mL比色:0.05~5 ng/mL荧光:0.05~10 ng/mL[12]比色光热还原氧化石墨烯大肠杆菌O157∶H7牛奶比色:5×106 CFU/mL(裸眼);光热:5×105 CFU/mL光热:5×105~ 5×107 CFU/mL[13]MnO2-AuNPs脱氧雪腐镰刀菌烯醇玉米、小米、青豆比色:0.19 ng/mL(裸眼);光热:0.013 ng/mL比色:0.19~25 ng/mL;光热:0.19~12 ng/mL[14]星型AuNPs(表面修饰拉曼分子)克伦特罗猪肉、鸡肉、香肠比色:5 ng/mL(裸眼);SERS:0.05 ng/mL比色:未给出SERS:0 ~1 ng/mL[2]比色SERS星型AuNPs(表面修饰拉曼分子)双酚A-比色:15 ng/mL(裸眼),1.47 ng/mL;SERS:0.073 ng/mL比色:1~30 ng/mLSERS:0.05~60 ng/mL[15]GO@Au薄膜(Au表面修饰拉曼分子)伏马毒素B1,黄曲霉毒素B1,ZEN花生、玉米、河水比色:1.1、0.012、0.36 ng/mL(裸眼)SERS:0.529、0.745、5.90 pg/mL-[16]AuNR@Pt(AuNR表面修饰拉曼分子)空肠弯曲菌牛奶比色:75 CFU/mL;SERS:50 CFU/mL比色:102~106 CFU/mLSERS:102~5×106 CFU/mL[17]比色化学发光鲁米诺还原的AuNPs氰戊菊酯黄芪、党参比色:0.2 ng/mL(裸眼);化学发光:0.067 ng/mL比色:未给出化学发光:0.2~200 ng/mL,[18]比色气压树枝状铂纳米粒子黄曲霉毒素B1莲子、薏苡仁比色:未给出;气压:0.03 ng/mL比色:未给出气压:0.05~10 ng/mL,[19]
注:“-”表示文献中没有相关数据或特征描述(下同)
相比基于信号“turn off”模式的传统竞争荧光ICA,基于内滤效应的荧光淬灭型竞争ICA为“turn-on”模式,可明显提升小分子物质的灵敏度[20]。影响荧光淬灭型ICA性能的关键是荧光淬灭探针对背景荧光的淬灭效率,其取决于探针的消光能力、探针的吸收光谱与荧光材料的激发或发射光谱的重叠程度。因此常选取发光亮度高的材料(如QDs、荧光微球等)构筑背景荧光,高摩尔消光系数的材料[如贵金属、聚多巴胺(polydopamine,PDA)]作为淬灭探针。赵赟等[22]基于Au@PDA纳米颗粒淬灭绿色荧光QDs构建ICA检测黄瓜中的戊唑醇。CHEN等[23]基于红光QDs为背景荧光材料,25 nm金纳米花为探针,构建ICA检测玉米中的ZEN。WANG等[12]以黑色PDA纳米粒子为消光探针构建ICA检测鸡肉中的磺胺甲嘧啶。由于PDA纳米粒子在紫外-可见光谱全区域均有较强吸收,其对荧光供体的选择性较低,能高效淬灭不同发光波长的聚集诱导发光(aggregation-induced emission, AIE) 微球(505 nm)、QDs微球(615 nm)和有机染料微球(530 nm)。其中基于AIE微球为背景荧光材料的ICA性能最佳,其“turn-on”荧光信号裸眼LOD较“turn-off”比色信号高20倍。
1.2 比色光热双信号ICA
试纸条采集的比色信号局限于T线表层,而基于材料光热效应的温度信号是T线上全部探针在一段时间内的热效应累积,因此光热ICA具有更高的灵敏度[24]。另外,温度信号不受背景色的干扰,而比色信号不受外部环境温度的干扰,因此比色光热ICA可根据应用场景灵活运用不同信号。
比色信号和光热信号均是基于材料对光的吸收,因此具有强光吸收和高光热转换效率的材料,如石墨烯[13]和AuNPs[14, 24]等是常用的比色光热双功能探针。其中,AuNPs是ICA中研究最多的光热探针,其光热信号较比色信号灵敏度高约1个数量级[24]。ZHAN等[24]证明基于粒径分别为30、60、100 nm AuNPs的ICA比色光热信号的灵敏度依次升高,表明大粒径AuNPs吸光能力更强,利于提高灵敏度。大量装载小粒径AuNPs是提高探针比色光热信号输出的另一常用策略。如ZHANG等[14]以三维花状MnO2颗粒为载体大量装载AuNPs制备MnO2-AuNPs比色光热探针,构建ICA用于脱氧雪腐镰刀菌烯醇的检测。结果表明光热信号灵敏度较其比色信号、传统AuNPs-ICA分别提高15倍和58倍。类似的结果见于SU等[5]基于MnO2-AuNPs的比色光热双信号ICA,用于检测呋喃唑酮的代谢产物(3-氨基-2-恶唑烷酮)的研究报道。
1.3 比色SERS双信号ICA
比色SERS探针一般是基于贵金属纳米材料基底的SERS探针,其中核壳结构贵金属纳米颗粒、表面粗糙的AuNPs、AuNPs聚集体等是富含“热点”的常用基底材料。SU等[2]以富含“热点”的星型AuNPs为基底,表面修饰拉曼染料二硫硝基苯制备SERS探针,并构建ICA检测克伦特罗(瘦肉精)。该方法可通过裸眼判读颜色信号LOD为5 ng/mL的瘦肉精,基于SERS信号LOD为0.05 ng/mL,灵敏度较AuNPs-ICA提高200倍。ZHENG等[16]在氧化石墨烯片(graphite oxide,GO)上大量负载30 nm AuNPs构建GO@Au薄膜,并在AuNPs上修饰二硫硝基苯制备SERS探针,从而构建三元ICA同时检测伏马毒素B1(fumonisins B1,FB1),黄曲霉毒素B1(aflatoxin B1, AFB1)和ZEN。3种毒素的裸眼比色LOD分别为1.1、 0.012、0.36 ng/mL,而基于SERS信号的LOD为0.529、 0.745、5.90 pg/mL。相比于基于30 nm AuNPs的SERS探针构建的ICA,该试纸条比色和SERS信号灵敏度分别提高10倍和500倍。HE等[17]在金纳米棒(gold nanorods,AuNRs)表面生长铂纳米粒子,制备具备高过氧化物酶活性和拉曼增强能力的AuNR@Pt,基于此构建比色SERS双信号ICA检测牛奶中的空肠弯曲菌。基于AuNR@Pt催化TMB显色和SERS信号,LOD分别为75、50 CFU/mL。
1.4 其他双信号ICA
WANG等[18]以化学发光底物鲁米诺为还原剂制备AuNPs,并以其为探针构建比色化学发光双信号ICA,用来检测中药中残留的痕量农药氰戊菊酯。当目标物残留质量浓度高于0.2 ng/mL时,可通过裸眼观测T线显色定性判读,而对于低浓度的目标物残留,可进一步激发探针的化学发光进行检测,LOD为0.067 ng/mL。
JIANG等[19]以树枝状铂纳米粒子为探针构建AFB1免疫层析试纸条,探针的比色信号作为定性快速筛查信号,而基于手持式气压计测量探针催化分解H2O2产生的氧气压力LOD为0.03 ng/mL。
2 基于磁光双功能探针的ICA
在检测复杂食品基质样本时,基质物质或提取试剂会严重干扰ICA试纸条的准确性。然而,为降低基质干扰进行的样本稀释又会导致ICA检测实际食品样本的灵敏度明显下降。磁分离前处理技术可特异性地捕获和浓缩待测样本中目标物,并极大限度地降低基质干扰,从而提高检测的灵敏度和准确性。科研人员普遍认为,将磁性材料和信号输出材料集成化为双功能探针,不仅可以简化流程,实现前处理-检测一体化,还能通过浓缩待测物提高检测灵敏度[25]。磁性颗粒本身是既能磁分离富集目标物,又可输出高灵敏磁信号的双功能探针[26]。磁信号读取依赖于特定设备,相比而言,种类丰富的光学信号更加直观和方便读取,受到更多研究人员的关注。近年来,磁性荧光、磁性比色、磁性光热等各种双功能探针被用于构建ICA实现致病菌、真菌毒素、农兽药残留、非法添加物的快速检测(近5年代表性研究见表2)。
表2 基于磁性光学探针的免疫层析试纸条在食品安全检测中的应用
Table 2 Magnetic-optical nanoprobe based ICA for food safety monitoring

探针类型探针材料目标物样本灵敏度(LOD)AuNPs-ICA对比检测范围参考文献Fe3O4聚集体呋喃唑酮代谢物牛奶0.044 ng/mL10-fold-[27]Fe3O4@Au沙门氏菌牛奶5×105 CFU/mL10-fold-[28]磁性比色Fe3O4-AuNPs微球OTA葡萄汁0.094 ng/mL7-fold0.098~12.5 ng/mL[29]Fe3O4@PDA@Pd/Pt大肠杆菌O157∶H7牛奶9×101 CFU/mL100-fold102~105 CFU/mL[30]修饰HRP酶的磁珠微囊藻毒素海鲜2 pg/mL-3.7~33.7 pg/mL[31]Fe3O4@SiO2@QDs克仑特罗猪尿0.22 ng/mL4-fold0.25~5 ng/mL[6]磁性荧光Fe3O4@DQDs(DQDs:双层QDs)AFB1,OTA,FB1谷物、坚果、饮料0.42、11.48、4.21 pg/mL1 000-fold-[32]Fe3O4-QDs微球AFB1浓香型酱油51 pg/mL-5~150 pg/mL[3]磁性比色光热Fe3O4@CuS大肠杆菌O157∶H7牛肉、鸡肉、牛奶和蜂蜜比色:103 CFU/mL;光热:102 CFU/mL-比色:103~108 CFU/mL;光热:102~108 CFU/mL[7]Fe3O4@AuOTA玉米比色:100 pg/mL(裸眼);光热:0.12 pg/mL-比色:未给出;光热:1 pg/mL~ 1 μg/mL[33]磁性比色SERSFe3O4@Au(表面修饰拉曼分子)克伦特罗、莱克多巴胺猪肉、羊肉、牛肉比色:1、0.1 ng/mL(裸眼);SERS:7.8、3.5 pg/mL--[34]磁性比色荧光纳米磁珠(通过内滤效应淬灭FITC微球荧光)磺胺甲嘧啶牛奶比色:0.71 ng/mL;荧光:0.026 ng/mL3-fold, 77-fold比色:1~100 ng/mL;荧光:0.033~33 ng/mL[35]
注:OTA为赭曲霉毒素A(ochratoxin A)
2.1 磁性比色双功能探针
磁性比色探针的构建方式根据比色信号来源可以分为三类:(1)磁性颗粒,比色信号来源于其本身的光吸收[27, 36];(2)磁性颗粒与消光材料复合[28-29],比色信号来源于复合材料的光吸收;(3)磁性颗粒与催化材料复合[30-31],比色信号来源于酶催化产物。
小粒径磁性颗粒的消光能力有限,磁性微球或磁性颗粒组装体可输出更高强度的比色信号,进而提高ICA分析灵敏度。如LIU等[36]以磁性颗粒聚集体为探针构建ICA检测农残甲基对氧磷,灵敏度比小粒径Fe3O4颗粒作为探针的ICA提高40倍。YAN等[27]以抗体介导的磁性颗粒多聚体为ICA免疫探针,检测牛奶中呋喃唑酮的代谢物,LOD比AuNPs-ICA低10倍。AuNPs消光能力更强,与磁性颗粒复合制备金磁颗粒是比色信号更强的探针材料。XIA等[28]基于Fe3O4@Au(通过在Fe3O4颗粒表面原位生长Au壳层获得)为探针构建ICA试纸条检测牛奶中的沙门氏菌,灵敏度比AuNPs-ICA提高10倍。为了避免因强烈的磁阻效应(即外层材料对磁力线的屏蔽作用)使磁性能严重下降,Fe3O4@Au的Au壳层不宜过厚,使得其比色信号强度严重受限。HAO等[29]基于相分离原理,通过超声乳化法将油酸修饰的Fe3O4和油胺修饰的AuNPs封装进双亲性的聚马来酸酐-十八烯共聚物中制备Fe3O4-AuNPs微球。所得微球中Fe3O4分布于外部聚合物层,磁性能得到了很好的保护,从而利于封装大量AuNPs以使比色信号大大增强。基于Fe3O4-AuNPs微球构建ICA,检测葡萄汁中OTA的LOD低至94 pg/mL。通过引入酶催化信号放大技术,ICA的灵敏度可得到极大提升。LAI等[30]以PDA包裹的Fe3O4为核心,在其表面原位还原生长Pd/Pt合金纳米颗粒,制备高催化活性的Fe3O4@PDA@Pd/Pt复合纳米颗粒。以Fe3O4@PDA@Pd/Pt〗为双功能探针,构建ICA检测大肠杆菌O157∶H7,根据探针催化氧化二氨基联苯胺在T线处的沉积产物颜色深浅,发现LOD达9×101CFU/mL。HENDRICKSON等[31]以表面修饰HRP酶的磁珠为探针构建针对海鲜中微囊藻毒素的ICA,基于磁富集和酶催化信号放大,裸眼判读“cut-off”值低至50 pg/mL,LOD为2 pg/mL。
2.2 磁性荧光双功能探针
目前报道的磁性荧光探针主要是将磁性颗粒与高发光亮度的QDs复合(为减弱荧光内滤作用,主要以红光QDs为主)。磁性量子点微球的制备方法主要有两种,第一种方法是以磁性颗粒为核心,通过静电作用和共价偶联等方式将QDs包裹在磁性颗粒表面,形成核壳结构磁性荧光微球。HUANG等[6]在Fe3O4@SiO2表面通过酰胺键共价偶联方式包裹红光QDs制备Fe3O4@SiO2@QDs磁性荧光微球,并构建ICA试纸条检测猪尿中的克伦特罗。由于QDs载量有限,微球的发光强度较低,该方法灵敏度仅比AuNP-ICA提高4倍。ZHENG等[32]通过静电层层自组装法在磁性颗粒表面包裹双层QDs获得发光强度更高的Fe3O4@DQDs微球,并构建三元ICA试纸条同时检测AFB1、OTA和FB1,检测灵敏度比AuNPs-ICA高1000倍。第二种方法为将磁性颗粒与荧光染料同时封装进聚合物中制备磁性荧光微球。GUO等[3]利用相分离原理通过超声乳化法制备了Fe3O4-QDs微球,其中磁性颗粒分布在外层聚马来酸酐-十八烯共聚物层中,而红光QDs分布在中心。由于磁性能得到很好的保留,所需磁含量较低,微球可包裹更多的QDs,从而使发光强度更高。基于该核壳型Fe3O4-QDs微球构建的ICA检测酱油提取液和浓香型酱油原液中的AFB1的LOD分别为3、51 pg/mL,灵敏度超过基于量子点微球的ICA。
2.3 其他磁性光学探针
通过将磁性材料和双光学信号材料复合可以构建兼具前处理和双信号输出能力的多功能探针。ZHANG等[7]在Fe3O4表面原位生长CuS纳米片制备Fe3O4@CuS探针,对食品中的大肠杆菌O157∶H7进行分离富集和ICA检测。基于手持式红外相机测试光照后的温度变化检测目标菌的LOD为102CFU/mL,灵敏度相比于探针比色信号提高1个数量级。加标回收试验表明该试纸条能准确检出牛肉、鸡肉、牛奶和蜂蜜中少量的目标细菌。ZHANG等[33]以核壳型Fe3O4@Au纳米颗粒为磁性比色光热探针构建ICA试纸条检测玉米中的OTA。808 nm激光照射一定时间后,红外相机检测试纸条T线的温度变化,LOD低至0.12 pg/mL,相比于肉眼判读T线显色灵敏度提高近3个数量级。WU等[34]则在Fe3O4@Au面修饰二硫硝基苯制得磁性比色SERS探针,并构建ICA检测克仑特罗和莱克多巴胺。该方法基于磁富集效应,比色SERS信号检测目标物的灵敏度均提高约1个数量级,基于SERS信号检测克仑特罗和莱克多巴胺的LOD分别低至7.8、3.5 pg/mL,较基于T线显色强度灵敏度提高2个数量级。
FANG等[35]则以纳米磁珠为荧光淬灭剂,以FITC绿色荧光微球为背景荧光构建荧光淬灭型ICA检测牛奶中的磺胺甲嘧啶。该方法中磁珠兼具磁分离富集、比色信号输出、荧光淬灭3种功能,比色信号和荧光信号LOD分别为0.71、0.026 ng/mL。
3 基于探针催化信号放大的多级比色ICA
相比于发展各种新型信号探针,引入信号放大机制构建多级比色信号输出ICA具有如下明显优点:(1)可裸眼直接判读信号,不依赖于激发光源和读取设备;(2)对夹心模式ICA能提升分析灵敏度2~3个数量级以上,比新型信号ICA提升更显著;(3)检测浓度范围宽。夹心模式ICA在目标物低浓度区域或者竞争模式ICA在目标物浓度高区域,探针在T线过少而不显色,通过催化使其显色增强,其检测范围较催化前明显变宽。常引入的信号放大机制包括金、银染信号增强技术,探针自组装堆积和催化信号放大等3种。前两种方式可控性均较差,导致出现检测结果重现性低和稳定性差的缺陷;而酶催化可极大提高试纸条的检测灵敏度,并具备较强的稳定性和重现性,因此备受关注[37]。
近年来,基于比色催化探针构建的多级比色ICA被用于致病菌、真菌毒素、农兽药残留、非法添加物的快速检测(近5年代表性研究见表3)。构建基于催化信号放大的多级比色ICA的关键在于制备消光能力强且催化活性高的探针。比色催化探针主要可分为两种:(1)将天然酶(如HRP,β-内酰胺酶)装载在消光材料上[38-40];(2)模拟酶或模拟酶与消光材料的复合纳米颗粒(如普鲁士蓝纳米颗粒[PBNPs],MnO2,Fe络合物,Pd@Pt,Au@Pt等)[4, 40-45]。
从表3代表性研究中可看出,检测小分子的竞争ICA中,由于信号随目标物浓度升高为“turn off”模式,因此多数情况下催化显色对灵敏度无提升作用,有时甚至反而会降低灵敏度。然而,催化显色能明显从高浓度区域拓宽ICA的检测范围。CAI等[4]以MnO2为双功能探针构建ICA检测玉米中的AFB1,经催化显色后LOD降低7.2倍,检测范围拓宽60倍。比色催化探针用于检测致病菌[44-45]、大分子蛋白等的夹心ICA中,催化放大其“turn on”模式比色信号,可以明显提升检测灵敏度,同时拓宽其检测范围。如CHENG等[44]基于高活性纳米酶Pd@Pt构建的针对两种致病菌的ICA中,催化显色将检测灵敏度提升4~5个数量级,两种细菌的检测范围均从106~107 CFU/mL拓展至10~107 CFU/mL。
表3 基于探针催化信号放大的多级比色免疫层析试纸条在食品安全检测中的应用
Table 3 Nanoprobe catalyzed signal amplification based multi-scale colorimetric ICA for food safety monitoring
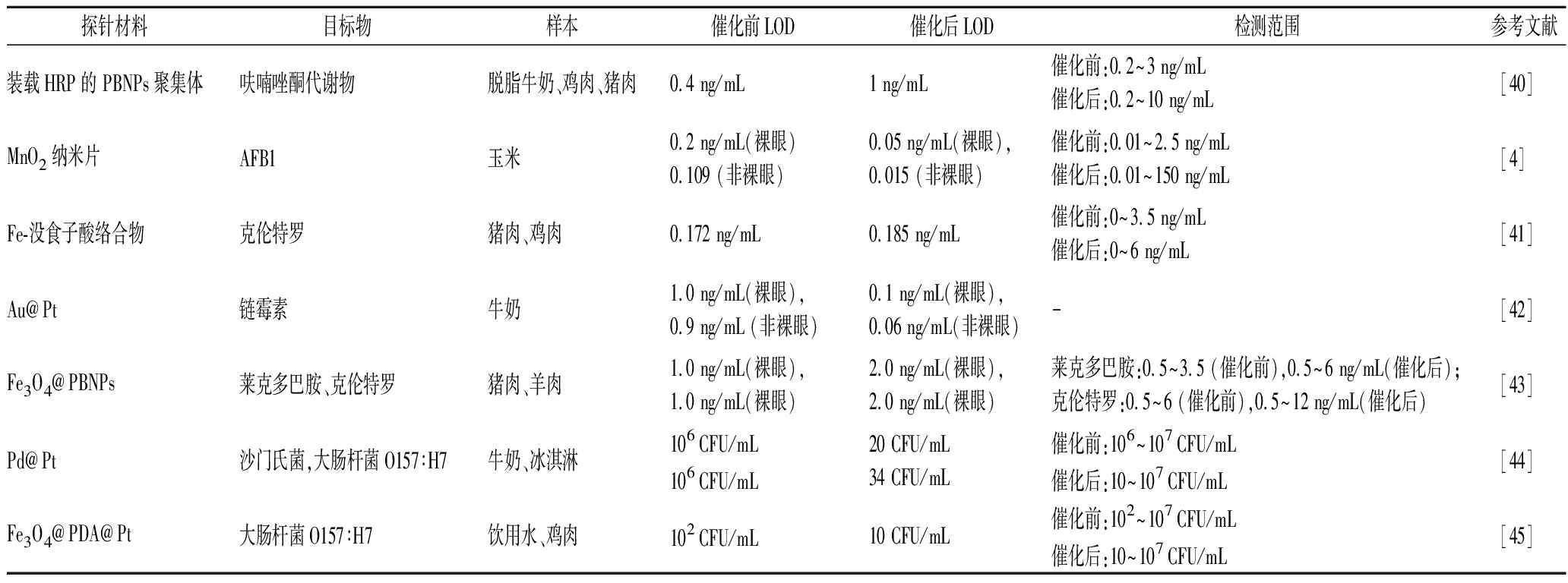
探针材料目标物样本催化前LOD催化后LOD检测范围参考文献装载HRP的 PBNPs聚集体呋喃唑酮代谢物脱脂牛奶、鸡肉、猪肉0.4 ng/mL1 ng/mL催化前:0.2~3 ng/mL催化后:0.2~10 ng/mL[40]MnO2纳米片AFB1玉米0.2 ng/mL(裸眼)0.109 (非裸眼)0.05 ng/mL(裸眼),0.015 (非裸眼)催化前:0.01~2.5 ng/mL催化后:0.01~150 ng/mL[4]Fe-没食子酸络合物克伦特罗猪肉、鸡肉0.172 ng/mL0.185 ng/mL催化前:0~3.5 ng/mL催化后:0~6 ng/mL[41]Au@Pt链霉素牛奶1.0 ng/mL(裸眼),0.9 ng/mL (非裸眼)0.1 ng/mL(裸眼),0.06 ng/mL(非裸眼)-[42]Fe3O4@PBNPs莱克多巴胺、克伦特罗猪肉、羊肉1.0 ng/mL(裸眼),1.0 ng/mL(裸眼)2.0 ng/mL(裸眼),2.0 ng/mL(裸眼)莱克多巴胺:0.5~3.5 (催化前),0.5~6 ng/mL(催化后);克伦特罗:0.5~6 (催化前),0.5~12 ng/mL(催化后)[43]Pd@Pt沙门氏菌,大肠杆菌O157∶H7牛奶、冰淇淋106 CFU/mL106 CFU/mL20 CFU/mL34 CFU/mL催化前:106~107 CFU/mL催化后:10~107 CFU/mL[44]Fe3O4@PDA@Pt大肠杆菌O157∶H7饮用水、鸡肉102 CFU/mL10 CFU/mL催化前:102~107 CFU/mL催化后:10~107 CFU/mL[45]
4 总结与展望
近年来,由于材料化学和纳米科技的快速发展,基于双(或多)功能探针的ICA取得了巨大的进展。功能集成化的探针能显著提升ICA的分析性能和应用灵活性,对拓展ICA的应用范围和实际应用效果具有重要的现实意义。新材料和新技术的不断涌现,为基于双(或多)功能探针的ICA(尤其是本文阐述的3种类型)的开发及应用研究提供更多的可能性。作者认为,以下4个方面的研究和发展对于进一步提升此类ICA技术的性能和应用价值非常重要。
第一,通过引入新材料优化探针的性能。将两(多)种功能组分集成于一定尺寸的纳米空间内,由于载量有限、两种组分相互影响等原因,使得构建两种功能均性能优异的材料非常困难。比如,受限于其他组分对磁性材料的磁阻效应及磁性材料对荧光的淬灭等原因,如何获得磁响应性好、发光强度高的磁性荧光微球,仍是亟待解决的瓶颈问题。而新型材料为此提供了更多的可能性:AIE染料等被证明能制备发光强度更高背景噪声更低的荧光微球[46];近红外染料可尽可能降低内滤效应对荧光性能的负面影响[47];在磁性颗粒表面采用Fe基MOF材料作为壳层在大量装载其他功能材料的同时,可大大降低磁阻效应[48]。
第二,双功能材料的可控稳定合成。功能集成化的纳米材料相比于单一功能材料合成过程更加复杂,可能导致材料性能的批间差异较大。因此,发展新技术实现多组分材料的可控合成、组装及表面修饰,使材料性能可高度稳定地重现,是未来制备双(或多)功能探针的重要挑战。
第三,发展高性能特异性识别元件。目前的识别元件主要为传统的免疫抗体。然而其受限于以下几个方面的缺陷:(1)免疫抗体的制备和筛选过程繁复且成本高昂;(2)很多小分子或重金属离子难以获得性能优异的特异性抗体;(3)抗体的稳定性较差,易受环境因素影响,导致方法学的鲁棒性(即外界干扰下,性能保持稳定的能力)较差。因此,除制备高性能免疫抗体外,发展其他高性能识别单元(如基因重组抗体、纳米抗体、核酸适配体、模拟表位肽和核酸酶等),对于提高ICA技术的性能和适用范围非常重要。
第四,一体化简易检测设备的开发。针对各种新型信号ICA,目前市场上均开发了专用的信号读取设备,缺乏功能集成化的读取设备。而目前基于智能手机构建简易的ICA信号读取设备[49]得到研究人员的广泛关注。另一方面,ICA检测食品样品前仍需要进行复杂的前处理,基于信号催化放大的ICA等需要进行多步操作,导致ICA技术的应用便利性不足。因此,研究人员考虑通过与工程技术(如微流控技术)[50]等结合,构建一次加样操作即可获得结果的ICA芯片。
[1] 田亚晨,王淑娟,马兰,等.纳米颗粒在侧流免疫层析技术中的应用研究进展[J].食品科学,2019,40(17):348-356.
TIAN Y C, WANG S J, MA L, et al.Recent progress on nanoparticles in lateral flow immunochromatographic strip[J].Food science, 2019, 40 (17):348-356.
[2] SU L H, HU H L, TIAN Y L, et al.Highly sensitive colorimetric/surface-enhanced Raman spectroscopy immunoassay relying on a metallic core-shell Au/Au nanostar with clenbuterol as a target analyte[J].Analytical Chemistry, 2021, 93(23):8 362-8 369.
[3] GUO L, SHAO Y N, DUAN H, et al.Magnetic quantum dot nanobead-based fluorescent immunochromatographic assay for the highly sensitive detection of aflatoxin B1 in dark soy sauce[J].Analytical chemistry, 2019, 91(7):4 727-4 734.
[4] CAI X F, LIANG M J, MA F, et al.Nanozyme-strip based on MnO2 nanosheets as a catalytic label for multi-scale detection of aflatoxin B1 with an ultrabroad working range[J].Food Chemistry, 2022, 377:131965.
[5] SU L H, CHEN Y Q, WANG L L, et al.Dual-signal based immunoassay for colorimetric and photothermal detection of furazolidone[J].Sensors and Actuators B:Chemical, 2021, 331:129431.
[6] HUANG Z, XIONG Z J, CHEN Y, et al.Sensitive and matrix-tolerant lateral flow immunoassay based on fluorescent magnetic nanobeads for the detection of clenbuterol in swine urine[J].Journal of agricultural and food chemistry, 2019, 67(10):3 028-3 036.
[7] ZHANG M, BU T, TIAN Y, et al.Fe3O4@ CuS-based immunochromatographic test strips and their application to label-free and dual-readout detection of Escherichia coli O157:H7 in food[J].Food Chemistry, 2020, 332:127398.
[8] ZHOU Y F, HUANG X L, HU X Y, et al.Recent advances in colorimetry/fluorimetry-based dual-modal sensing technologies[J].Biosensors and Bioelectronics, 2021, 190:113386.
[9] BU T, BAI F E, ZHAO S, et al.Dual-modal immunochromatographic test for sensitive detection of zearalenone in food samples based on biosynthetic Staphylococcus aureus-mediated polymer dot nanocomposites[J].Analytical Chemistry, 2022, 94 (14):5 546-5 554.
[10] WANG S, SHEN W Z, ZHENG S, et al.Dual-signal lateral flow assay using vancomycin-modified nanotags for rapid and sensitive detection of Staphylococcus aureus[J].RSC Advances, 2021, 11(22):13 297-13 303.
[11] HE K Y, BU T, ZHENG X H, et al.“Lighting-up” methylene blue-embedded zirconium based organic framework triggered by Al3+ for advancing the sensitivity of E.coli O157∶H7 analysis in dual-signal lateral flow immunochromatographic assay[J].Journal of Hazardous Materials, 2022, 425:128034.
[12] WANG Z X, XING K Y, DING N S, et al.Lateral flow immunoassay based on dual spectral-overlapped fluorescence quenching of polydopamine nanospheres for sensitive detection of sulfamethazine[J].Journal of Hazardous Materials, 2022, 423:127204.
[13] SHIRSHAHI V, TABATABAEI S N, HATAMIE S, et al.Photothermal enhancement in sensitivity of lateral flow assays for detection of E.coli O157:H7[J].Colloids and Surfaces B:Biointerfaces, 2020, 186:110721.
[14] ZHANG M, BU T, BAI F E, et al.Gold nanoparticles-functionalized three-dimensional flower-like manganese dioxide:A high-sensitivity thermal analysis immunochromatographic sensor[J].Food Chemistry, 2021, 341:128231.
[15] LIN L K, STANCIU L A.Bisphenol A detection using gold nanostars in a SERS improved lateral flow immunochromatographic assay[J].Sensors and Actuators B:Chemical, 2018, 276:222-229.
[16] ZHENG S, WANG C G, LI J X, et al.Graphene oxide-based three-dimensional Au nanofilm with high-density and controllable hotspots:A powerful film-type SERS tag for immunochromatographic analysis of multiple mycotoxins in complex samples[J].Chemical Engineering Journal, 2022, 448:137760.
[17] HE D Y, WU Z E, CUI B, et al.Establishment of a dual mode immunochromatographic assay for Campylobacter jejuni detection[J].Food Chemistry, 2019, 289:708-713.
[18] WANG W W, OUYANG H.Luminol-reduced Au nanoparticles-based dual-signal immunochromatographic test strip for pesticide residues[J].Microchemical Journal, 2019, 149:104055.
[19] JIANG S, ZHANG L X, LI J Z, et al.Pressure/colorimetric dual-readout immunochromatographic test strip for point-of-care testing of aflatoxin B1[J].Talanta, 2021, 227:122203.
[20] ZHANG X Y, DING M Y, MAO Y X, et al.A comparative study of “turn-off” mode and “turn-on” mode lateral flow immunoassay for T-2 toxin detection[J].Sensors and Actuators B:Chemical, 2022, 359:131545.
[21] BU T, BAI F E, ZHAO S, et al.Multifunctional bacteria-derived tags for advancing immunoassay analytical performance with dual-channel switching and antibodies bioactivity sustaining[J].Biosensors and Bioelectronics, 2021, 192:113538.
[22] 赵赟,蔡伊娜,张存政,等.基于比色和荧光双信号检测戊唑醇的免疫层析试纸条的构建[J].食品与生物技术学报,2022,41(1):36-43.
ZHAO Y, CAI Y N, ZHANG C Z, et al.Fabrication of immunochromatography strip for tebuconazole based on colorimetric and fluorescent dual-signal detection[J].Journal of Food Science and Biotechnology, 2022, 41(1):36-43.
[23] CHEN Y, FU Q Q, XIE J, et al.Development of a high sensitivity quantum dot-based fluorescent quenching lateral flow assay for the detection of Zearalenone[J].Analytical and Bioanalytical Chemistry, 2019, 411(10):2 169-2 175.
[24] ZHAN L, GUO S Z, SONG F Y, et al.The role of nanoparticle design in determining analytical performance of lateral flow immunoassays[J].Nano Letters, 2017, 17(12):7 207-7 212.
[25] MOYANO A, SERRANO-PERTIERRA E, SALVADOR M, et al.Magnetic lateral flow immunoassays[J].Diagnostics, 2020, 10(5):288.
[26] ORLOV A V, MALKEROV J A, NOVICHIKHIN D O, et al.Express high-sensitive detection of ochratoxin A in food by a lateral flow immunoassay based on magnetic biolabels[J].Food Chemistry, 2022, 383:132427.
[27] YAN L Z, DOU L N, BU T, et al.Highly sensitive furazolidone monitoring in milk by a signal amplified lateral flow assay based on magnetite nanoparticles labeled dual-probe[J].Food Chemistry, 2018, 261:131-138.
[28] XIA S Q, YU Z B, LIU D F, et al.Developing a novel immunochromatographic test strip with gold magnetic bifunctional nanobeads (GMBN) for efficient detection of Salmonella choleraesuis in milk[J].Food Control, 2016, 59:507-512.
[29] HAO L W, CHEN J, CHEN X R, et al.A novel magneto-gold nanohybrid-enhanced lateral flow immunoassay for ultrasensitive and rapid detection of ochratoxin A in grape juice[J].Food Chemistry, 2021, 336:127710.
[30] LAI X C, ZHANG G G, ZENG L F, et al.Synthesis of PDA-mediated magnetic bimetallic nanozyme and its application in immunochromatographic assay[J].ACS Applied Materials & Interfaces, 2021, 13(1):1 413-1 423.
[31] HENDRICKSON O D, ZVEREVA E A, ZHERDEV A V, et al.Ultrasensitive lateral flow immunoassay of phycotoxin microcystin-LR in seafood based on magnetic particles and peroxidase signal amplification[J].Food Control, 2022, 133:108655.
[32] ZHENG S, WU T, LI J X, et al.Difunctional immunochromatographic assay based on magnetic quantum dot for ultrasensitive and simultaneous detection of multiple mycotoxins in foods[J].Sensors and Actuators B:Chemical, 2022, 359:131528.
[33] ZHANG T, LEI L L, TIAN M L, et al.Multifunctional Fe3O4@ Au supraparticle as a promising thermal contrast for an ultrasensitive lateral flow immunoassay[J].Talanta, 2021, 222:121478.
[34] WU T, LI J X, ZHENG S, et al.Magnetic nanotag-based colorimetric/SERS dual-readout immunochromatography for ultrasensitive detection of clenbuterol hydrochloride and ractopamine in food samples[J].Biosensors, 2022, 12(9):709.
[35] FANG B, HU S, WANG C, et al.Lateral flow immunoassays combining enrichment and colorimetry-fluorescence quantitative detection of sulfamethazine in milk based on trifunctional magnetic nanobeads[J].Food Control, 2019, 98:268-273.
[36] LIU C Y, JIA Q J, YANG C H, et al.Lateral flow immunochromatographic assay for sensitive pesticide detection by using Fe3O4 nanoparticle aggregates as color reagents[J].Analytical Chemistry, 2011, 83(17):6 778-6 784.
[37] CALABRIA D, CALABRETTA M M, ZANGHERI M, et al.Recent advancements in enzyme-based lateral flow immunoassays[J].Sensors, 2021, 21(10):3358.
[38] WU Z Z, HE D Y, XU E B, et al.Rapid detection of β-conglutin with a novel lateral flow aptasensor assisted by immunomagnetic enrichment and enzyme signal amplification[J].Food Chemistry, 2018, 269:375-379.
[39] 山珊,黄艳梅,赵雪龙,等.级联信号转导系统结合免疫层析法检测大肠埃希氏菌O157:H7[J].食品科学,2021,42(18):314-320.
SHAN S, HUANG Y M, ZHAO X L, et al.Detection of Escherichia coli O157:H7 by cascade signal transduction system combined with immunochromatography[J].Food Science, 2021, 42(18):314-320.
[40] REN J, SU L H, HU H L, et al.Expanded detection range of lateral flow immunoassay endowed with a third-stage amplifier indirect probe[J].Food Chemistry, 2022, 377:131920.
[41] LI Y C, LIU S J, YIN X C, et al.Nature-inspired nanozymes as signal markers for in-situ signal amplification strategy:A portable dual-colorimetric immunochromatographic analysis based on smartphone[J].Biosensors and Bioelectronics, 2022,210:114289.
[42] WEI D L, ZHANG X Y, CHEN B, et al.Using bimetallic Au@ Pt nanozymes as a visual tag and as an enzyme mimic in enhanced sensitive lateral-flow immunoassays:Application for the detection of streptomycin[J].Analytica Chimica Acta, 2020, 1 126:106-113.
[43] LIU S J, DOU L N, YAO X L, et al.Nanozyme amplification mediated on-demand multiplex lateral flow immunoassay with dual-readout and broadened detection range[J].Biosensors and Bioelectronics, 2020, 169:112610.
[44] CHENG N, SONG Y, ZEINHOM M M A, et al.Nanozyme-mediated dual immunoassay integrated with smartphone for use in simultaneous detection of pathogens[J].ACS Applied Materials & Interfaces, 2017, 9(46):40 671-40 680.
[45] DOU L N, BAI Y C, LIU M G, et al.‘Three-To-One’multi-functional nanocomposite-based lateral flow immunoassay for label-free and dual-readout detection of pathogenic bacteria[J].Biosensors and Bioelectronics, 2022, 204:114093.
[46] MEI J, LEUNG N L C, KWOK R T K, et al.Aggregation-induced emission:Together we shine, united we soar![J].Chemical Reviews, 2015, 115(21):11 718-11 940.
[47] LENG Y, WU W, LI L, et al.Magnetic/fluorescent barcodes based on cadmium-free near-infrared-emitting quantum dots for multiplexed detection[J].Advanced Functional Materials, 2016, 26(42):7744.
[48] CHEN R, CHEN X R, ZHOU Y F, et al.“Three-in-One” multifunctional nanohybrids with colorimetric magnetic catalytic activities to enhance immunochromatographic diagnosis[J].ACS nano, 2022, 16(2):3 351-3 361.
[49] 李辉,盈盈,曹振,等.基于智能手机拍照判读的侧流免疫层析快速检测技术研究进展[J].分析化学,2022,50(1):1-11.
LI H, YING Y, CAO Z, et al.Research progress on rapid detection technology based on smartphone and lateral flow immunoassay[J].Chinese Journal of Analytical Chemistry, 2022, 50(1):1-11.
[50] 单万水. 从层析荧光到微流控生物芯片:现场快速检验 (POCT) 技术基础概述[J].中国医疗器械信息, 2017, 23(7):45-52.
SHAN W S.From lateral flow immunoassay to microfluidic biochip:An overview of key POCT technologies[J].China Medical Device Information, 2017, 23(7):45-52.