红曲色素(Monascus pigments, MPs)是红曲霉发酵制备红曲过程中产生的、具有生物活性的一种物质,它作为传统的食品添加剂,已广泛应用于肉类发色、酒类酿造以及工业燃料染色中[1]。在中国和日本等东亚国家,红曲色素已经有千年的应用历史,《本草备要》对红曲如此评价:“入营而破血,燥胃消食,活血和血”、“治跌打损伤”,其中起药食两用功效的主要是红曲色素和Monacolin K,但因Monacolin K有毒性作用[2],科研工作者更关注于红曲色素的生物活性。
红曲色素生物活性主要体现在降血脂、降血压[3]、降血糖、抗氧化[4]等方面,同时鉴于天然、无毒的优点,红曲色素不仅可作为药物用来治疗糖尿病、动脉粥样硬化和癌症等疾病,还可用于研制具有功能特性的面制品[5]、肉制品[6]、酒类[7]和调味制品[8]等,为“三高”人群提供了更多、更健康的膳食选择。因此,红曲色素的营养价值、功能特性和作用机制备受关注。但是,此前研究大多侧重于红曲色素的应用、提高稳定性和生物活性的表征等方面,深入综述红曲色素作用机制的研究较少。
本文拟介绍红曲色素组成、生物合成途径、结构特性,以治疗代谢综合征角度来讲述降血脂、抗氧化、降血糖和抗阿尔兹海默症等生物活性,并揭示其作用机制,以期为红曲广泛应用,开发绿色、安全的活性物质提供理论依据。
1 红曲色素
1.1 红曲色素的组成
红曲色素是红曲霉利用糯米中蛋白质、糖类在不同发酵阶段产的生物活性物质,目前发现的代表物有110多种[9],按其溶解性可分为醇溶性和水溶性,其中醇溶性色素(胞内色素)占70%~80%、水溶性色素(保外色素)占20%~30%。
典型的醇溶性色素有6种,按颜色可分三大类[10]:呈红色的红斑红曲胺(Rubropunctamine)和红曲玉红胺(Monascorubramine)、呈橙色的红斑红曲素(Rubropunctatin)和红曲玉红素(Monascorubin)以及呈黄色的红曲黄素(Monascin)和安卡红曲黄素(Ankaflavin),其化学结构式、颜色、溶解性如图1所示。而醇溶性橙色素与胺类或糖类物质作用生成水溶性色素,其中典型的为以谷氨酸盐为氮源发酵产生的N-谷氨酰红斑胺素(N-glutarylrubropunctamine)和N-谷氨酰红曲红安素(N-glutarylmonascorubramine)以及以葡萄糖为碳源发酵产生的N-葡萄糖基红斑胺素(N-glucosylrubropunctamine)和N-葡萄糖基红曲红胺素(N-glucosylmonascorubramine)(图1)。

图1 典型红曲色素的颜色、结构与性质
Fig.1 The color, structure and properties of typical Monascus pigments
1.2 红曲色素的生物合成途径
红曲色素生物合成过程大致可分为原料、前体物质和色素合成3个过程,具体生物合成途径如图2所示。原料的合成:红曲霉(M.pilosus、M.ruber和M.purpureus)利用米中的糖类物质通过糖酵解过程生成丙酮酸,继而在丙酮酸脱氢酶复合酶的作用下生成乙酰辅酶A,乙酰辅酶A在其羧化酶作用下生成丙二酰辅酶A[11]。前体物质的合成:乙酰辅酶A和丙二酰辅酶A是红曲色素的合成单位,它们以1∶3的比例在短链脂肪酸合成酶的作用下生成己酸或辛酸,经转酰基作用生成β酮酸(β-keto acid);另一方面,以1∶5的比例在聚酮合成酶(polyketide synthases)的作用下生成六酮体,经聚酮化合物合成途径生成发色团(polyketide chromophore),再通过酯化反应与β酮酸结合生成红曲色素的前体物质[12]。色素的合成过程:红曲橙色素优先被合成出来,继而通过发生氧化还原反应生成黄色素,与含氮化合物(氨基酸、多肽、蛋白质等)反应生成红色素[13]。
近些年学者们研究发现红曲黄色素不仅由橙色素转化,还可直接通过色素前体物质发生还原反应生成。BALAKRISHNAN等[14]敲除基因mppG(生成橙色素所需酶)的菌株所产的代谢产物中橙色素的含量显著降低,而黄色素产量并未发生明显变化,由此可知,黄色素的合成是相对独立的,不依赖于橙色素。但也有研究表明,在缺乏合成黄色素的还原酶(烯酰基还原酶)的前提下,也有少量黄色素合成,说明黄色素有另外的分支合成途径(可能是橙色素转化成黄色素)[15]。

图2 红曲色素的生物合成途径
Fig.2 Biosynthesis pathway of Monascus pigments
1.3 结构特性及其与生物活性的关系
红曲色素是由羰基、醚键等官能团和环己烯、γ-内酯环等结构组成的聚酮类化合物,还含有共轭双键结构![]() 为单位的特殊的共轭结构。这些特殊的官能团和共轭结构使红曲色素发挥出降血脂、抗氧化、抗炎等生物活性。
为单位的特殊的共轭结构。这些特殊的官能团和共轭结构使红曲色素发挥出降血脂、抗氧化、抗炎等生物活性。
洛伐他汀为降血脂药物,因与胆固醇生物合成过程中的限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase, HMGCR)结构相似,竞争性抑制胆固醇合成,从而起到降血脂作用[2]。而红曲色素与洛伐他汀具有相同的官能团(如羰基、醚键、羟基等)和相同的环己烯结构,这可能是红曲色素具有良好降血脂活性的原因。除此之外,红曲色素的抗炎活性和抗氧化活性也与它的羟基、侧链R基和γ-内酯环等化学结构密切相关。对红曲橙色素而言[16],C8连羟基的红曲橙色素(Monaphilol A,Monaphilol B,Monaphilol C,Monaphilol D)的抗炎活性优于C8连羰基的红斑红曲素和红曲玉红素。而对于红曲黄色素而言[17],安卡红曲黄素和Monaphilone A(R![]() C7H15)的抗氧化活性比红曲黄素和Monaphilone B(R
C7H15)的抗氧化活性比红曲黄素和Monaphilone B(R![]() C5H11)高;无γ-内酯环结构的Monaphilone A的抗氧化和抗炎活性优于含γ-内酯环结构的红曲黄素。
C5H11)高;无γ-内酯环结构的Monaphilone A的抗氧化和抗炎活性优于含γ-内酯环结构的红曲黄素。
2 红曲色素的生物活性
红曲色素具有特殊的官能团和共轭结构,发挥降血脂、抗氧化、降血糖、抗阿尔兹海默症等生物活性,能够调节机体脂代谢和糖代谢紊乱,抑制氧化应激反应和炎症反应的发生,起到治疗代谢综合征的作用。
2.1 降血脂活性
红曲色素的降血脂活性是最重要的生物活性,它主要通过降低血液中脂类物质含量、降低低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)水平、增加高密度脂蛋白胆固醇水平(high-density lipoprotein cholesterol, HDL-C)和改善肠道菌群组成等途径来起到降血脂的作用,从而起到治疗以动脉粥样硬化为代表的心血管疾病的功效。
2.1.1 作用效果
高血脂症可以通过血清中LDL-C、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)和HDL-C含量来表现,也可通过测定体重、肝脏重量、肝脏中TC、TG含量以及排泄物中胆汁酸含量等间接体现。LEE等[2]用红曲黄色素(红曲黄素、安卡红曲黄素)和Monacolin K灌胃HFD-叙利亚仓鼠发现红曲黄色素具有较好的降血脂功效,其中AK灌胃的仓鼠血清中LDL-C、TC、TG含量分别降低了47.9%、21.9%和19.4%,HDL-C含量增加了0.12%;肝脏中TC和TG含量分别降低了33.8%和20.2%;排泄物中胆汁酸含量增加了49.2%。ZHOU等[18]、LEE等[19]、LEE等[20]、BUNNOY等[21]也进行了相关研究,证实了红曲色素的降血脂功效,如表1所示。
表1 红曲色素的降血脂活性
Table 1 Hypolipidemic activity of Monascus pigments

关键物质作用效果实验对象参考文献红曲黄素,安卡红曲黄素,Monacolin K体重↓;血清中TC、TG、LDL-C、MDA↓,HDL-C↑;动脉粥样硬化斑块↓;叙利亚仓鼠[2]红曲红、橙、黄色素体重↓;肝脏重量↓;血清中HDL-C↑、TC、TG, LDL-C↓;肝脏中脂肪酶、脂肪酸、脂积累、TC、TG↓;粪便中脂肪酶↓;排泄物中胆汁酸、TG、TC↑HFD-Wistar大鼠[18]红曲黄素,安卡红曲黄素肝脏TC、TG↓;血清TG、TC、LDL-C↓;排泄物中TC、胆汁酸↑HFD+HCD- SD大鼠[19]红曲黄素,安卡红曲黄素肝脏T C和TG ↓;血清TC、TG、LDL-C、LDL-C/HDL-C↓;HDL-C↑动脉粥样硬化斑块↓;HCD-叙利亚仓鼠[20]红曲体重↓血清TC,LDL-C↓,HDL-C↑HFD+HCD-SD大鼠[21]
注:HFD=high fat diet;HCD=high cholesterol diet
2.1.2 作用机制
红曲色素主要通过降低脂类物质含量、降低LDL-C含量、增加HDL-C含量和改善肠道菌群紊乱来起到降血脂的作用,作用机制如图3所示。
2.1.2.1 降低脂类物质的含量
脂类物质(胆固醇、脂肪酸)合成的主要场所为肝脏,底物为乙酰辅酶A,催化剂为3-羟基-3甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase, HMGCR)、乙酰辅酶A羧化酶(acetyl-CoA carboxylases, ACC)和脂肪酸合酶(fatty acid synthase, FAS)等酶类。HMGCR作为胆固醇合成过程中的限速酶,是红曲色素的主要靶向位点;ACC和FAS均为乙酰辅酶A生成游离脂肪酸的催化剂,也可与红曲色素相互作用。即红曲色素不仅可以通过抑制HMGCR的表达来降低胆固醇的合成,而且可以通过降低ACC和FAS的催化作用来减少游离脂肪酸的含量,从而降低脂类物质的合成[18, 22]。
除了降低脂类物质的合成,红曲色素还促进肝脏内游离胆固醇代谢。安卡红曲黄素促进肝脏中胆固醇发生代谢产生胆汁酸过程中的限速酶CYP7A1(cholesterol 7 alpha hydroxylase)的表达,从而促进胆固醇发生代谢,降低其在肝脏中的含量[23]。另外,产生的胆汁酸在肝脏内长时间贮存会产生活性氧自由基,损坏肝细胞;而红曲黄素和安卡红曲黄素促进法尼酯X受体(farnesoid X receptor, FXR)的表达,加快胆汁酸进入小肠的速率,从而保护肝脏[24]。

图3 红曲色素的降血脂机制
Fig.3 The underlying regulatory mechanisms of Monascus pigments on hyperlipidemia
2.1.2.2 降低LDL-C含量
红曲色素可以通过抑制LDL-C的合成以及促进其代谢来发挥降血脂的作用。LDL-C是动脉粥样硬化产生的主要因素,减少其含量可有效降低心血管疾病的发生。红曲色素降低LDL-C形成过程中的乙酰辅酶A乙酰转移酶(acetyl-coenzyme A acetyltransferase, ACAT)、微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein, MTP)和载脂蛋白B100(apolipoprotein B100, Apo B100)等关键物质活性,从而抑制LDL-C的含量,达到降血脂的作用[19]。另外,红曲色素上调肝脏组织的低密度脂蛋白胆固醇受体(low-density lipoprotein receptor, LDLR)活性,从而促进血液中的LDL-C进入肝脏发生代谢,降低血液中LDL-C含量[25]。
2.1.2.3 增加HDL-C含量
红曲色素不仅有降低LDL-C的作用,还具有增加血液中HDL-C含量的作用。高密度脂蛋白含量越高血管越清洁,脂肪含量越少。红曲色素降血脂的作用是通过增加血液中形成HDL-C的关键物质-载脂蛋白A1(apolipoprotein A1, Apo A1)活性来实现的[25]。Apo A1可有效地加速血液中的游离胆固醇与高密度脂蛋白结合形成HDL-C,从而使其进入肝脏发生代谢,达到降血脂效果。
2.1.2.4 改善肠道菌群组成
肠道微生物能够参与机体代谢,与糖尿病、肥胖、动脉粥样硬化、血脂异常等疾病密切相关。肠道菌群产生的短链脂肪酸抑制脂质物质的合成,提高氧摄取率,对机体健康有重要的作用;而其产生的脂多糖、炎症因子和氧化三甲胺(trimethylamine N-oxide, TMAO)促进脂质积累,引起动脉粥样硬化[26]。
红曲色素通过调节肠道菌群组成来降低脂多糖、炎症因子的含量,增加短链脂肪酸含量从而起到降血脂的作用。从门类水平分析,红曲色素能够下调厚壁菌门(Firmicutes)和上调拟杆菌门(Bacteroidetes)的丰度,而脂多糖、炎症因子、TMAO等与Firmicutes具有正相关性、与Bacteroidetes具有负相关性。从科类水平分析,红曲色素上调拟杆菌属(Bacteroides)、瘤胃球菌(Ruminococcus)、梭状芽孢杆菌属(Clostridium)等菌属,下调肠球菌属(Enterococcus)、Alistipes等菌属丰度,排泄物中胆固醇和甘油三酯含量与前者正相关、与后者负相关,说明红曲色素促进脂类物质排泄[8, 27]。总的来讲,红曲色素能够改善肠道菌群失调和肠道屏障功能,从而调节脂代谢,起到治疗心血管疾病的作用。
2.2 红曲色素的抗氧化活性
红曲色素具有较强的抗氧化活性,当体内存在的活性氧自由基(reactive oxygen species, ROS)含量增加时,红曲色素主要通过上调体内抗氧化酶的活性,来抑制脂质过氧化反应的发生,从而起到抗氧化的作用。
2.2.1 作用效果
红曲色素等红曲酶发酵产品具有较强的抗氧化效果,在肉制品加工方面除了表现出良好的发色作用外,还起到了抗氧化作用。彭荣等[28]、金二庆[6]以红曲霉作为发酵剂研究其对兔肉香肠和腊肠抗氧化性的影响,发现红曲霉发酵组(28 ℃,30 d)的DPPH自由基、羟自由基(·OH)和超氧阴离子自由基![]() 清除率均高于自然发酵组约37.5%、66.9%和25.0%,而过氧化值(第42天)低于自然发酵组约48.2%。
清除率均高于自然发酵组约37.5%、66.9%和25.0%,而过氧化值(第42天)低于自然发酵组约48.2%。
不同红曲色素抗氧化效果不同,其中红曲黄色素的抗氧化活性最好。ZHANG等[29]通过泛函理论和含时泛函理论分析测定6种色素的最高占有分子轨道能量、最低空分子轨道能量和能隙,发现红曲色素具有抗氧化活性,并且抗氧化活性大小依次为红曲黄素>安卡红曲黄素>红斑红曲素>红曲玉红素>红曲玉红胺>红斑红曲胺。
红曲色素的抗氧化效果通过体内和体外实验得以证实:WU等[17]从功能性红曲和发色性红曲中分离提取七种红曲黄色素,并测定它们体外抗氧化活性和细胞内抗氧化活性,其中Monaphilone A(0.6 mg/mL)的DPPH自由基和![]() 清除率分别为75%和80%、细胞内抗氧化活性为40%。
清除率分别为75%和80%、细胞内抗氧化活性为40%。
2.2.2 红曲色素的抗氧化作用机制
红曲色素抗氧化活性通过直接清除·OH、![]() 等自由基和增加抗氧化酶活性来降低ROS含量,从而抑制脂质过氧化程度,减少丙二醛(malondialdehyde,MDA)形成来完成(图4)。
等自由基和增加抗氧化酶活性来降低ROS含量,从而抑制脂质过氧化程度,减少丙二醛(malondialdehyde,MDA)形成来完成(图4)。
降低ROS含量:从氢原子转移和单电子转移理论分析,红曲黄素(基态)与·OH和![]() 发生反应后,接受电子使其碳碳双键变长、碳碳单键变短形成了激发态[30];同时,·OH和
发生反应后,接受电子使其碳碳双键变长、碳碳单键变短形成了激发态[30];同时,·OH和![]() 失去电子变成了无毒、无害的H2O和O2。另外,红曲色素上调过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)等抗氧化酶活性,促进了
失去电子变成了无毒、无害的H2O和O2。另外,红曲色素上调过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)等抗氧化酶活性,促进了![]() 等发生反应,生成无毒的H2O和O2,最终减少ROS[31]。
等发生反应,生成无毒的H2O和O2,最终减少ROS[31]。
抑制脂质过氧化:ROS引发多不饱和脂肪酸(LH)发生一系列反应,产生烷基自由基(L·)过氧基自由基(LOO·)、脂质氢过氧化物(LOOH)等中间产物,此反应过程也称为一级引发作用。LOOH均裂生成LO·和LOO·,这些烷基自由基能引发脂质过氧化反应,称为二级引发作用。多不饱和脂肪酸通过自由基引发的链式反应最终氧化成MDA[31]。而红曲色素降低ROS含量,抑制自由基链式反应的发生,从而降低MDA含量。

图4 红曲色素抗氧化活性机制
Fig.4 Antioxidant mechanisms of Monascus pigments
注:L·为烷基自由基,LH为脂肪酸,LO·为烷基过氧基, LOO·为过氧自由基,LOOH为脂质氢过氧化物
2.3 血糖活性
红曲色素降血糖活性通过2个方面来完成:一方面保护胰岛β细胞,促进胰岛素分泌;另一方面,通过改善胰岛素抵抗,增加靶细胞对胰岛素的敏感性,从而增加靶细胞对葡萄糖的摄取,达到降血糖效果。
2.3.1 降血糖效果
糖尿病(diabetes mellitus, DM),以高血糖为特征,是由机体内分泌紊乱而引发的疾病。随着人们对含高糖、高脂肪食物摄入的不断增加糖尿病患病率也随之升高,据2021年国际糖尿病联合会报道,如今全球已有5.37亿人患有糖尿病,并预测2045年将达惊人的7.84亿[34]。因此,利用天然物质控制血糖含量倍受关注。HSU等[35]证实了红曲色素在一定程度上预防和治疗糖尿病的效果,且学者们还发现红曲霉其他发酵产品也具有降血糖活性。SHI等[36]以不同红曲霉发酵产品(大米、薯蓣、薏仁)灌胃链脲佐菌素(streptozotocin, STZ)诱导的糖尿病大鼠8周,发现与对照组相比血糖含量分别降低了18.5%、24.1%、22.9%。
2.3.2 红曲色素的降血糖作用机制
红曲色素降血糖活性在不同组织器官通过不同途径协同完成的:在胰腺组织起到保护胰岛细胞和促进胰岛素分泌的作用;在肝脏中抑制糖异生;在胰岛素靶组织(肝脏、骨骼肌、脂肪组织)起到改善胰岛素抵抗的作用,从而发挥降血糖的作用。
2.3.2.1 保护胰岛β细胞
胰岛β细胞是胰岛素合成与分泌的场所,其完整性是机体维持正常血糖水平的先决条件。当体内ROS含量升高时,极易使β细胞受损,胰岛素分泌减少,导致血糖水平升高,甚至引发糖尿病。红曲色素不仅上调GPx, SOD, CAT 等抗氧化酶活性,而且核因子E2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)和转录因子叉头蛋白O1(forkhead box protein O1, FoxO1)的表达,继而抑制与胰岛素合成有关的蛋白激酶C(protein kinase C, PKC)的磷酸化[37],降低ROS含量,起到保护胰岛β细胞的作用(图5中的A)。
2.3.2.2 促进胰岛素分泌
过量的葡萄糖通过葡萄糖转运体蛋白4(glucose transporter4, GLUT4)进入胰岛β细胞内,并在葡萄糖激酶(glucokinase, GCK)的作用下转化成6-磷酸葡萄糖,继而刺激β细胞分泌胰岛素。而红曲黄素作为PPARγ激动剂,上调GCK和GLUT4的表达,从而促进胰岛素分泌[38](图5中的B)。
2.3.2.3 抑制糖异生
糖异生是将非糖类物质(氨基酸、乳酸、甘油和丙酮酸等)转化成葡萄糖的过程(图5)。红曲抑制糖异生过程中的限速酶磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)表达来减少异生的葡萄糖含量,从而起到降血糖的作用[39](图5中的C)。
2.3.2.4 改善胰岛素抵抗
当胰岛素靶组织对胰岛素的敏感性降低时,对葡萄糖的摄取率也随之下降,促使β细胞代偿性分泌胰岛素来试图增加葡萄糖的摄取,但血液中葡萄糖含量不降反增,导致胰岛素与葡萄糖含量长期处于不平衡状态,此过程也称为胰岛素抵抗。研究表明,肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-1β(interleukin-1β, IL-1β)等炎症因子和ROS激活c-Jun 氨基末端激酶(c-Jun N-terminal kinase, JNK)的磷酸化,继而抑制胰岛素受体(insulin receptor, IR)和胰岛素受体底物1(insulin receptor subsutrate 1, IRS-1)磷酸化,降低GLUT4的转位,从而减少靶细胞对葡萄糖的摄取,引起胰岛素抵抗[40]。
红曲色素具有较好的缓解胰岛素抵抗的效果,主要通过以下途径:(1)安卡红曲黄素和红曲黄素通过增强PPAR-γ mRNA的表达或作为PPAR-γ激动剂,抑制JNK磷酸化,改善靶细胞胰岛素敏感性,提高其葡萄糖摄取率[41-42]。(2)红曲色素上调SOD、CAT等抗氧化酶活性来抑制体内ROS产生,减少靶细胞和靶组织损伤,从而改善其胰岛素敏感性。(3)红曲黄色素和红曲橙色素通过下调诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的表达来降低TNF-α、IL-6和NO等炎症因子含量,继而抑制JNK的激活,促进GLUT4转位,最终提高葡萄糖摄取率[43](图5中的D)。
2.4 抗阿尔兹海默症
除了降血脂、抗氧化和降血糖活性,红曲色素还能提高机体记忆力和学习能力,即表现出抗阿尔兹海默症(Alzheimer′s disease, AD)活性,主要通过抑制Tau蛋白磷酸化和淀粉样β肽(amyloid-beta peptide, Aβ)的蓄积来发挥作用。
2.4.1 抗阿尔兹海默症效果
AD是一种神经衰退性疾病,亦是导致老年痴呆的主要因素,据国际阿尔茨海默病协会(Alzheimer′s Disease International, ADI)发布的21年世界阿尔兹海默症报告,目前全球有5500多万人患有老年痴呆,其中61%来自中低收入国家,已经成为社会不得不关注的健康安全问题。而红曲色素能够抑制Aβ在脑中蓄积,具有治疗AD的功效。ZHENG等[44]研究了红曲橙色素衍生物FZU-H抑制Aβ对神经细胞毒性作用的效果,当FZU-H添加量为100 μmol/L时神经细胞凋亡率降低至6.0%,显著低于Aβ处理组(19.2%),说明红曲色素具有较强的抗AD活性。在铝诱导大鼠致AD模型中,红曲霉发酵产品(含7.5 mg/g红曲黄素和3.5 mg/g安卡红曲黄素)灌胃铝诱导大鼠后,其海马区中Aβ1-42和Tau蛋白磷酸化含量分别降低了20.3%和17.6%[45]。
2.4.2 抗阿尔兹海默症作用机制
2.4.2.1 AD的发病机制
引起AD的因素很多,其中起关键作用的是Tau蛋白磷酸化和Aβ的蓄积。Tau蛋白是一种具有多种细胞功能的蛋白质,与微管蛋白结合形成微管,其中Tau维持微管稳定性。它本身具有2~3个磷酸基,但是当发生过度磷酸化时,微管结构被破坏,Tau游离出来并发生蓄积,导致神经元纤维缠结,最终引起AD[46](图6)。另外,Tau蛋白的过度磷酸化使线粒体功能发生紊乱,引起DNA片段化,激活Caspase-3蛋白,继而促进神经细胞凋亡[47]。

图5 红曲色素的降血糖机制
Fig.5 The underlying regulatory mechanisms of Monascus pigments on hyperglycemia
而Aβ是引起AD的另一个主要危害因素,它是通过β淀粉样前体蛋白剪切酶(beta-site amyloid precursor protein-cleaving enzyme, BACE)和γ-分泌酶(γ-secretase)切割淀粉样前体蛋白(amyloid precursor protein, APP)所产生的多肽[48],在神经细胞内大量蓄积,引起AD(图6)。同时,Aβ还引起炎症反应和氧化应激反应,损伤大脑皮层和海马神经元,导致机体记忆力和学习能力下降。除上述两大危害因素外,高脂、高胆固醇饮食通过上调载脂蛋白E(apolipoprotein E, Apo E)和BACE的活性来促进Aβ的积累,最终引起AD。
2.4.2.2 红曲色素抑制Tau过度磷酸化和Aβ的蓄积
红曲色素具有抗氧化、抗炎、降血脂活性,通过抑制神经细胞凋亡、氧化应激反应和炎症反应发生等3个途径来降低Tau磷酸化和Aβ蓄积,起到保护神经元的作用(图6)。抑制神经细胞凋亡:红曲橙色素的衍生物FZU-H抑制Caspase-3蛋白活性和Tau蛋白磷酸化,保护线粒体,从而抑制神经细胞的凋亡[44]。抑制氧化应激反应:红曲霉发酵产品通过上调SOD、CAT等抗氧化酶类活性来抑制ROS引起的氧化应激反应,从而抑制Tau蛋白磷酸化和Aβ的积累[45]。抑制炎症反应:红曲色素具有较强的抗炎活性和降血脂活性,降低TNF-α、IL-6等炎症因子和胆固醇、甘油三酯等脂类物质的生成,从而下调Apo E和BACE活性,增加可溶性淀粉样前体蛋白α(soluble APP α-fragment, sAPPα)生成,继而抑制Aβ的蓄积,缓解AD症状[49]。
3 展望
在推进健康中国建设、营造绿色安全的健康环境下,红曲色素作为肉类食品中常用的天然、绿色的着色剂,同时具有降血脂、降血糖、抗氧化、抗阿尔兹海默症等生物活性,使其在功能性食品、制药等方面有更广阔的应用前景。目前,对红曲色素着色效果,功能特性(降低胆固醇、控制血糖、抗衰老等)的表征研究较多。红曲色素家族成分多、各成分结构相似,但功能性差异明显,因此,对各组分的分离、鉴定、纯化,以及典型功能性富集将是新的研究热点。为了更好发挥红曲色素对人类健康安全的作用,未来将从以下2个方面进行相关研究:
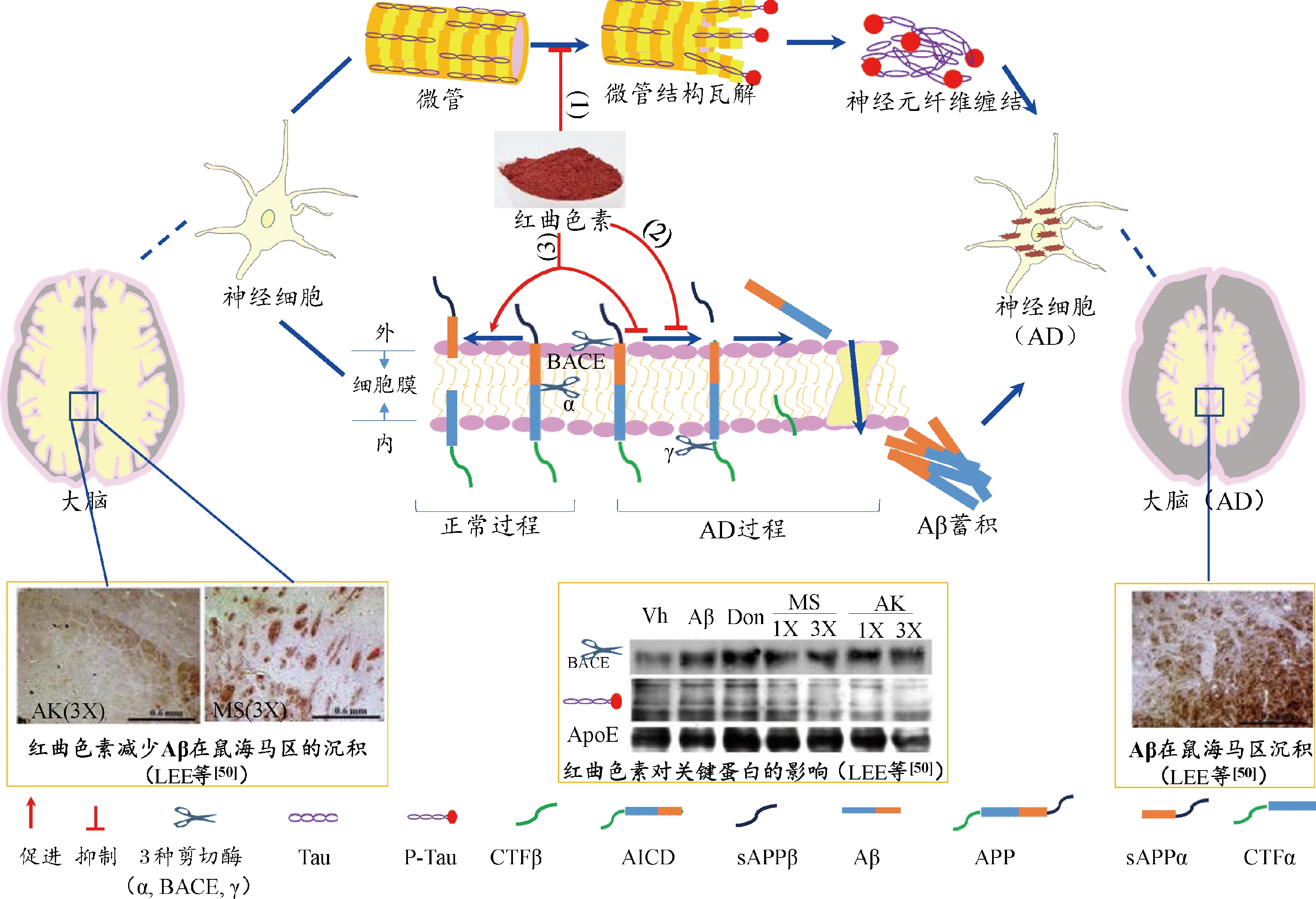
图6 红曲色素抗阿尔兹海默症机制
Fig.6 The anti-Alzheimer′s disease mechanism of Monascus pigments
(1)利用基因敲除和基因过表达技术,分析和加强靶基因的生物学功能,获得色素产量高的菌株,从而获得高功能特性的产品。
(2)利用超微、纳米等技术对红曲色素各组分进行分离、纯化,明确红曲色素各组分生物功能特性,为红曲色素综合利用和功能性食品开发提供技术支持。
[1] AGBOYIBOR C, KONG W B, CHEN D, et al.Monascus pigments production, composition, bioactivity and its application:A review[J].Biocatalysis and Agricultural Biotechnology, 2018, 16:433-447.
[2] LEE C L, HUNG Y P, HSU Y W, et al.Monascin and ankaflavin have more anti-atherosclerosis effect and less side effect involving increasing creatinine phosphokinase activity than monacolin K under the same dosages [J].Journal of Agricultural and Food Chemistry, 2013, 61(1):143-150.
[3] WU H C, CHENG M J, WU M D, et al.Secondary metabolites from the fermented rice of the fungus Monascus purpureus and their bioactivities[J].Natural Product Research, 2019, 33(24):3 541-3 550.
[4] KOLI S H, SURYAWANSHI R K, MOHITE B V, et al.Prospective of Monascus pigments as an additive to commercial sunscreens[J].Natural Product Communications, 2019, 14(12):1-7.
[5] 付丽芳, 林家莲.新型功能食品:红曲面包的研制[J].粮油加工与食品机械, 2002(1):45-46.
FU L F, LIN J L.Development of a new functional food-Red rice bread[J]. Machinery for Cereals, Oil and Food Processing, 2002(1):45-46.
[6] 金二庆. 红曲菌发酵对广式腊肠感官、风味及保藏特性的影响[D].广州:暨南大学, 2017.
JIN E Q.The quality of sensory and flavor and preservation of cantonese sausage fermented by Monascus[D].Guangzhou:Jinan University, 2017.
[7] 吴玉峰. 高产洛伐他汀红曲菌的选育及其在黄酒中的应用研究[D].无锡:江南大学:2021.
WU Y F.Breeding of high lovastatin-producing Monascus and its application in Huangjiu[D].Wuxi:Jiangnan University, 2021.
[8] SONG J, ZHANG J J, SU Y, et al.Monascus vinegar-mediated alternation of gut microbiota and its correlation with lipid metabolism and inflammation in hyperlipidemic rats[J].Journal of Functional Foods, 2020, 74:104 152-104 161.
[9] CHEN W P, FENG Y L, MOLN R I, et al.Nature and nurture:Confluence of pathway determinism with metabolic and chemical serendipity diversifies Monascus azaphilone pigments[J].Natural Product Reports, 2019, 36(4):561-572.
R I, et al.Nature and nurture:Confluence of pathway determinism with metabolic and chemical serendipity diversifies Monascus azaphilone pigments[J].Natural Product Reports, 2019, 36(4):561-572.
[10] LIU L J, WU S, WANG W, et al.Sulfonation of Monascus pigments to produce water-soluble yellow pigments[J].Dyes and Pigments, 2020, 173:107965.
[11] CHAUDHARY V, KATYAL P, POONIA A K, et al.Natural pigment from Monascus:The production and therapeutic significance[J].Journal of Applied Microbiology, 2022,133(1):18-38.
[12] HE J T, JIA M X, LI W, et al.Toward improvements for enhancement the productivity and color value of Monascus pigments:A critical review with recent updates[J].Critical Reviews in Food Science and Nutrition, 2022,62(26):7 139-7 153.
[13] LIU L J, ZHAO J X, HUANG Y L, et al.Diversifying of chemical structure of native Monascus pigments[J].Frontiers in Microbiology, 2018, 9:3 143-3 155.
[14] BALAKRISHNAN B, PARK S H, KWON H J.Inactivation of the oxidase gene mppG results in the selective loss of orange azaphilone pigments in Monascus purpureus[J].Applied Biological Chemistry, 2017, 60(4):437-446.
[15] BALAKRISHNAN B, PARK S H, KWON H J, et al.A reductase gene mppE controls yellow component production in azaphilone polyketide pathway of Monascus[J].Biotechnology Letters, 2017, 39(1):163-169.
[16] HSU L C, LIANG Y H, HSU Y W, et al.Anti-inflammatory properties of yellow and orange pigments from Monascus purpureus NTU 568[J].Journal of Agricultural and Food Chemistry, 2013, 61(11):2 796-2 802.
[17] WU L, ZHOU K X, CHEN F, et al.Comparative study on the antioxidant activity of Monascus yellow pigments from two different types of Hongqu-functional Qu and coloring Qu[J].Frontiers in Microbiology, 2021, 12:715295.
[18] ZHOU W B, GUO R L, GUO W L, et al.Monascus yellow, red and orange pigments from red yeast rice ameliorate lipid metabolic disorders and gut microbiota dysbiosis in Wistar rats fed on a high-fat diet[J].Food and Function, 2019, 10(2):1 073-1 084.
[19] LEE C L, WEN J Y, HSU Y W, et al.The blood lipid regulation of Monascus-produced monascin and ankaflavin via the suppression of low-density lipoprotein cholesterol assembly and stimulation of apolipoprotein A1 expression in the liver[J].Journal of Microbiology, Immunology, and Infection.2018, 51(1):27-37.
[20] LEE C L, KUNG Y H, WU C L, et al.Monascin and ankaflavin act as novel hypolipidemic and high-density lipoprotein cholesterol-raising agents in red mold dioscorea[J].Journal of Agricultural and Food Chemistry, 2010, 58(16):9 013-9 019.
[21] BUNNOY A, SAENPHET K, LUMYONG S, et al.Monascus purpureus-fermented Thai glutinous rice reduces blood and hepatic cholesterol and hepatic steatosis concentrations in diet-induced hypercholesterolemic rats[J].BMC Complementary and Alternative Medicine, 2015, 15:88.
[22] WEI R R, HE M H, SANG Z P, et al.Structurally diverse Monascus pigments with hypolipidemic and hepatoprotective activities from highland barley Monascus[J].Fitoterapia, 2022, 156:105090.
[23] HSU W H, HUANG Y C, LEE B H, et al.The improvements of ankaflavin isolated from Monascus-fermented products on dyslipidemia in high-fat diet-induced hasmster[J].Journal of Functional Foods, 2013, 5(1):434-443.
[24] HSU W H, CHEN T H, LEE B H, et al.Monascin and ankaflavin act as natural AMPK activators with PPARα agonist activity to down-regulate nonalcoholic steatohepatitis in high-fat diet-fed C57BL/6 mice[J].Food and Chemical Toxicology: an International Journal Published for the British Industrial Biological Research Association, 2014, 64:94-103.
[25] GUARDAMAGNA O, ABELLO F, BARACCO V, et al.The treatment of hypercholesterolemic children:Efficacy and safety of a combination of red yeast rice extract and policosanols[J].Nutrition, Metabolism, and Cardiovascular Diseases: NMCD, 2011, 21(6):424-429.
[26] LIU Q X, LI Y C, SONG X, et al.Both gut microbiota and cytokines act to atherosclerosis in ApoE-/- mice[J].Microbial Pathogenesis, 2020, 138:103 827-103 833.
[27] HUANG Z R, CHEN M, GUO W L, et al.Monascus purpureus-fermented common buckwheat protects against dyslipidemia and non-alcoholic fatty liver disease through the regulation of liver metabolome and intestinal microbiome[J].Food Research International, 2020, 136:109 511-109 524.
[28] 彭荣, 蔡琼, 贺稚非, 等.红曲霉对发酵兔肉香肠抗氧化活性及生物胺含量的影响[J].食品与发酵工业, 2020, 46 (19):48-56.
PENG R, CAI Q, HE Z F, et al.Effects of Monascus sp.f on antioxidant activity and biogenic amine content of fermented rabbit sausages[J].Food and Fermentation Industries, 2020, 46(19):48-56.
[29] ZHANG X W, LIU C H, TIAN W H, et al.Theoretical and experimental investigation of the antioxidative activity of monascin[J].Food and Function, 2020, 11(7):5 915-5 923.
[30] HUANG Q, ZHANG H, XUE D, et al.Enhancement of antioxidant activity of Radix Puerariae and red yeast rice by mixed fermentation with Monascus purpureus[J].Food Chemistry, 2017, 226:89-94.
[31] YIN Y, HAN W, CAO Y.Association between activities of SOD, MDA and Na+-K+-ATPase in peripheral blood of patients with acute myocardial infarction and the complication of varying degrees of arrhythmia[J].Hellenic Journal of Cardiology, 2019, 60(6):366-371.
[32] URSINI F, MAIORINO M.Lipid peroxidation and ferroptosis:The role of GSH and GPx4[J].Free Radical Biology and Medicine, 2020, 152:175-185.
[33] RAJASEKARAN A, KALAIVANI M. Protective effect of Monascus fermented rice against STZ-induced diabetic oxidative stress in kidney of rats[J].Journal of Food Science and Technology, 2015, 52(3):1 434-1 433.
[34] International Diabetes Federation.IDF diabetes atlas 9th edition[EB/OL].(2021-11-8) [2021-12-4].https://diabetesatlas.org/.
[35] HSU W H, PAN T M.A novel PPARgamma agonist monascin′s potential application in diabetes prevention[J].Food and Function, 2014, 5(7):1 334-1 340.
[36] SHI Y C, PAN T M.Antioxidant and pancreas-protective effect of red mold fermented products on streptozotocin-induced diabetic rats[J].Journal of the Science of Food and Agriculture, 2010, 90(14):2 519-2 525.
[37] LEE B H, HSU W H, HUANG T, et al.Monascin improves diabetes and dyslipidemia by regulating PPARγ and inhibiting lipogenesis in fructose-rich diet-induced C57BL/6 mice[J].Food and Function,2013, 4(6):950-959.
[38] CHANG J C, WU M C, LIU I M, et al.Plasma glucose-lowering action of Hon-Chi in streptozotocin-induced diabetic rats[J].Hormone and Metabolic Research, 2006, 38(2):76-81.
[39] HSU W H, LEE B H, LI C H, et al.Monascin and AITC attenuate methylglyoxal-Induced PPARγ phosphorylation and degradation through inhibition of the oxidative stress/PKC pathway depending on Nrf2 activation[J].Journal of Agricultural and Food Chemistry 2013, 61(25):5 996-6 006.
[40] LI B, YE J J, LIU R X, et al.Programmed cell death 5 improves skeletal muscle insulin resistance by inhibiting IRS-1 ubiquitination through stabilization of MDM2[J].Life Sciences, 2021, 285:119 918.
[41] HSU W H, LIAO T H, LEE B H, et al.Ankaflavin regulates adipocyte function and attenuates hyperglycemia caused by high-fat diet via PPAR-γ activation[J].Journal of Functional Foods, 2013, 5(1):124-132.
[42] LEE B H, HSU W H, LIAO T H, et al.The Monascus metabolite monascin against TNF-α induced insulin resistance via suppressing PPAR-γ phosphorylation in C2C12 myotubes[J].Food and Chemical Toxicology: an International Journal Published for the British Industrial Biological Research Association, 2011, 49(10):2 609-2 617.
[43] HSU L C, LIANG Y H, HSU Y W, et al.Anti-inflammatory properties of yellow and orange pigments from Monascus purpureus NTU 568[J].Journal of Agricultural and Food Chemistry, 2013, 61(11):2 796-2 802.
[44] ZHENG Y Q, PAN Q S, MO L D, et al.Monascus pigment rubropunctatin derivative FZU-H reduces Aβ (1-42)-induced neurotoxicity in Neuro-2A cells[J].RSC Advances, 2018, 8(31): 17 389-17 398.
[45] CHEN C L, CHANG K Y, PAN T M.Monascus purpureus NTU 568 fermented product improves memory and learning ability in rats with aluminium-induced Alzheimer′s disease[J].Journal of Functional Foods, 2016, 21:167-177.
[46] TAKEDA S.Progression of Alzheimer′s disease, tau propagation, and its modifiable risk factors[J].Neuroscience Research, 2019, 141:36-42.
[47] SANDHU P, NAEEM M M, LU C Y, et al.Ser422 phosphorylation blocks human Tau cleavage by caspase-3:Biochemical implications to Alzheimer′s disease[J].Bioorganic and Medicinal Chemistry Letters, 2017, 27(3):642-652.
[48] CHEIGNON C, TOMAS M, BONNEFONT-ROUSSELOT D, et al.Oxidative stress and the amyloid beta peptide in Alzheimer′s disease[J].Redox Biology, 2018, 14:450-464.
[49] LEE C L, PAN T M.The prevention of Alzheimer′s disease and Parkinson′s disease by Monascus purpureus NTU 568-fermented compounds[J].Journal of Alzheimer′s Disease and Parkinsonism, 2017, 7(4):1-8.
[50] LEE C L, LIN P Y, HSU Y W, et al.Monascus-fermented monascin and ankaflavin improve the memory and learning ability in amyloid β-protein intracerebroventricular-infused rat via the suppression of Alzheimer′s disease risk factors[J].Journal of Functional Foods, 2015, 18:387-399.