经济社会发展使得禽肉加工业快速扩张,2015年全球禽肉产量为1.006亿t,预计2030年将达到1.433亿t,这伴随了大量羽毛废弃物的产生[1]。研究表明,占羽毛干重85%以上的物质为角蛋白,这使其成为一种优秀的可再生蛋白质资源[2]。角蛋白是一种中间丝蛋白,主要存在于表皮附属物中,如羽毛、羊毛、头发、指甲、喙和角等[3]。羽毛水解液中含有丰富的营养物质,可作为动物饲料的添加剂、生物肥料和培养基成分[4]。然而,角蛋白中富含半胱氨酸并形成了大量的二硫键,导致其结构顽固,难以被降解[5]。因此,打开二硫键是羽毛高效降解的一个关键步骤[6]。目前,羽毛废弃物的常用降解方法是高温、高压和酸碱水解,但存在一些不可避免的问题,如高能耗、产品营养低和环境污染等[7]。角蛋白酶能够特异性地水解角蛋白产生可溶性蛋白质、氨基酸和生物活性多肽等物质,是一种可持续的角蛋白废弃物转化方法,具有良好的应用前景[8]。然而,受到角蛋白酶低二硫键还原活性的限制,其水解角蛋白的效率并不高[9]。同时,角蛋白酶还原功能的分子机制并不清晰,难以通过分子修饰来提高其还原活性。因此,寻找合适的还原力来协同角蛋白酶降解羽毛是提升羽毛废弃物酶促降解的关键。
二硫苏糖醇(dithiothreitol, DTT)、β-巯基乙醇和亚硫酸盐等化学还原剂已被证明可以在不同程度上加速角蛋白酶催化降解角蛋白的过程[10-11]。然而,还原剂的毒性使得角蛋白废弃物的降解产物无法应用。相比之下,二硫键还原酶是一种专门用于还原二硫键的绿色生物催化剂,这在以往产角蛋白酶菌株降解羽毛的研究中也被发现。齐志国等[12]在筛选到的羽毛降解菌株CP-16、CP-7和10号菌(Stenotrophomonas maltophilia SHMP-2)同时检测到角蛋白酶和二硫键还原酶活性,并且胞外酶液显著促进了羊毛和羽毛角蛋白的水解。王德山[13]在羽毛降解菌Bacillus licheniformis CP-16中分离到具有二硫键还原活性的酶,并成功在Escherichia coli BL21中异源表达,胞内二硫键还原酶活力3.1 U/mg。邹林源等[14]将B.1icheniformis CP-16和S.maltophilia 10号菌来源的二硫键还原酶在E.coli BL21中表达,成功纯化出P-Glu、P-Alk、P-Trx,并且体外水解羽毛试验表明这3种酶均对角蛋白酶水解羽毛具有不同程度促进作用。廖朝勇[15]将来源于B.licheniformis CP-16中的二硫键还原酶基因Trx和角蛋白酶基因ker在B.subtilis WB600中异源表达,并尝试通过搭载不同信号肽提升二硫键还原酶和角蛋白酶活性。但是,天然的或大多数异源表达的二硫键还原酶一般是胞内酶,这限制了其在实际应用中的可行性[16]。因此,实现二硫键还原酶的胞外表达将有助于实现协同角蛋白酶降解羽毛的实际应用。
本研究中,我们在B.subtilis WB600中实现了4种二硫键还原酶的胞外表达。其中,肽甲硫氨酸亚砜还原酶(MsrA)比酶活力为16.7 U/mg,复配体系MsrA+KerZ1水解羽毛的产物中可溶性蛋白含量是KerZ1单独降解的3倍。此外,通过枯草芽孢杆菌内源信号肽的筛选,进一步提高了MsrA的胞外表达量。优化后的MsrA+KerZ1降解100 g/L的羽毛,得到了含有大量氨基酸的水解液,并且水解液能显著促进植物的生长。这项研究表明,二硫键还原酶和角蛋白酶的协同作用可以显著提高羽毛的降解效率,是一种有效的羽毛废弃物回收方法。
1 材料与方法
1.1 材料与试剂
1.1.1 基因、菌株与质粒
E.coli JM109、B.subtilis WB600菌株,质粒p43 NMK,二硫键还原酶和信号肽基因来源菌株B.subtilis 168均为实验室保藏。角蛋白酶KerZ1为实验室前期在B.subtilis WB600中重组表达了B.licheniformis BBE11-1基因ker(NCBI数据库登录号:JX504681)的重组酶[17]。
1.1.2 引物
本研究中使用的引物见表1。
1.1.3 试剂
SanPrep柱式质粒DNA小量抽提试剂盒、大肠杆菌感受态制备试剂盒、Bradford蛋白测定试剂盒、抗生素,生工(上海)生物工程有限公司,2×PrimeSTAR Max DNA Polymerase、Taq DNA Polymerase、DNA Maker,大连TaKaRa生物公司,Novex NuPAGE SDS-PAGE、NuPAGE LDS-Sample Buffer(4×)、标准蛋白marker、GeneJET柱纯化回收试剂盒,Thermo Fisher Scientific;可溶性角蛋白,梯希爱(上海)化成工业发展有限公司;其他试剂购自国药集团。
表1 本研究中使用的引物
Table 1 Primers used in this study

引物名称序列(5′-3′)pP43 NMK-FTGATGAAAGCTTGGCGTAATCATGGTCpP43 NMK-RCGTGTACATTCCTCCTTCTCCTATAATGGahpC-FCCATTATAGGAGAAGGAGGAATGTACACGATGTCTTTAATCGGTAAAGAAGTACTTCCATTCGAahpC-RGACCATGATTACGCCAAGCTTTCATCATTAGATTTTACCTACTAGATCAAGGCTAGGTGTAAGAcysH-FCCATTATAGGAGAAGGAGGAATGTACACGATGTTAACGTATGATAATTGGGAAGAACCAACGcysH-RGACCATGATTACGCCAAGCTTTCATCATTATTCATGCAGTCCGCATTCTGTTTTCGlpdV-FCCATTATAGGAGAAGGAGGAATGTACACGATGGCAACTGAGTATGACGTAGTCATTClpdV-RGACCATGATTACGCCAAGCTTTCATCATTAAAAATGAATGGCTTTGCCATCTGCGmsrA-FCCATTATAGGAGAAGGAGGAATGTACACGATGTCTGAAAAAAAAGAAATCGCCACATTTGCmsrA-RGACCATGATTACGCCAAGCTTTCATCATTATTTAGCCCCCCAATGCTCGCTrxB-FCCATTATAGGAGAAGGAGGAATGTACACGGTGTCAGAAGAAAAAATTTATGACGTGATTrxB-RGACCATGATTACGCCAAGCTTTCATCATTATTTTAAGGTTTTCAGCGTTTCTTGGAGsacB-FATTATAGGAGAAGGAGGAATGTACACGATGAACATCAAAAAGTTTGCAAAACAAGCAACsacB-RGTGGCGATTTCTTTTTTTTCAGACATCGCAAACGCTTGAGTTGCGvpr-FACCATTATAGGAGAAGGAGGAATGTACACGTTGAAAAAGGGGATCATTCGCTTTCTGCvpr-RAAATGTGGCGATTTCTTTTTTTTCAGACATTGCCTGAACGCCCGTAATnprE-FATTATAGGAGAAGGAGGAATGTACACGGTGGGTTTAGGTAAGAAATTGTCTGTTGCTGnprE-RAAATGTGGCGATTTCTTTTTTTTCAGACATAGCCTGAACACCTGGCAnprB-FACCATTATAGGAGAAGGAGGAATGTACACGTTGCGCAACTTGACCAAGACATCTnprB-RAAATGTGGCGATTTCTTTTTTTTCAGACATAGCTGAGGCATGTGTTACAAAAACCAggt-FCATTATAGGAGAAGGAGGAATGTACACGATGAAAAGAACGTGGAACGTCTGTTTAACAggt-RAAATGTGGCGATTTCTTTTTTTTCAGACATAGCTTCCGCGTGAAAAGGGApelC-FAGAAGGAGGAATGTACACGTTGAAAAAAATCGTGTCTATCCTATTTATGTTCGGTTTGGpelC-RAAATGTGGCGATTTCTTTTTTTTCAGACATTGCAAAAACGGTTGATGGCTGAAACmpr-FAGGAGAAGGAGGAATGTACACGATGAAATTAGTTCCAAGATTCAGAAAACAATGGTTCGmpr-RAAATGTGGCGATTTCTTTTTTTTCAGACATCGCTTTTGCCGGTACGCCAAAAyncM-FACCATTATAGGAGAAGGAGGAATGTACACGATGGCGAAACCACTATCAAAAGGGGyncM-RAAATGTGGCGATTTCTTTTTTTTCAGACATTGCTTTTGCGACTTGAGCGTCTker-FCCATTATAGGAGAAGGAGGAATGTACACGGTGATGAGGAAAAAGAGTTTTTGGCTTGGGker-RAAATGTGGCGATTTCTTTTTTTTCAGACATAGCAGACGCGGAATCGCTGAAywbN-FACCATTATAGGAGAAGGAGGAATGTACACGATGAGCGATGAACAGAAAAAGCCAGAywbN-RAAATGTGGCGATTTCTTTTTTTTCAGACATCGCAACGGCTGCCCCCGCCATphoD-FACCATTATAGGAGAAGGAGGAATGTACACGATGGCATACGACAGTCGTTTTGATGAphoD-RAAATGTGGCGATTTCTTTTTTTTCAGACATAGCATTTACTTCAAAGGCCCCAACCyxkH-FTAGGAGAAGGAGGAATGTACACGATGAAACGATTGTTTTTAAGCATCTTTCTTTTGGGCyxkH-RAAATGTGGCGATTTCTTTTTTTTCAGACATAGCCGCAAGAGCCAAACAGPLS-FATGTCTGAAAAAAAAGAAATCGCCACATTTGCPLS-RCGTGTACATTCCTCCTTCTCCTATAATGGT
注:下划线部分为用于同源重组的序列
1.1.4 培养基与培养条件
LB液体培养基(g/L):酵母粉5.0,蛋白胨10.0,氯化钠10.0,琼脂20.0(固体培养基),pH 7.0,121 ℃灭菌15 min。
发酵培养基(g/L):蔗糖20.0,酵母粉10.0,蛋白胨20.0,Na2HPO4·12H2O 6.0,KH2PO4 3.0,MgSO4·7H2O 0.3,pH 7.0,121 ℃灭菌15 min。
LB培养基用于菌株种子液以及E.coli JM109的培养,培养条件为37 ℃、220 r/min培养12或24 h;发酵培养基用于B.subtilis WB600的培养,培养条件为37 ℃、220 r/min培养24 h。
1.2 实验方法
1.2.1 二硫键还原酶的表达与纯化
使用表1中ahpC-F/ahpC-R、cysH-F/cysH-R、lpdV-F/lpdV-R、msrA-F/msrA-R、TrxB-F/TrxB-R引物分别扩增来源于B.subtilis 168菌株的ahpC、CysH、lpdV、msrA、TrxB基因片段。随后,利用Gibson组装插入线性化的质粒p43 NMK中,将重组质粒转化至E.coli JM109感受态细胞中,挑取转化子进行菌落PCR验证。提取验证正确转化子质粒,转化至B.subtilis WB600感受态细胞中,涂布至相应抗性平板,长出的单菌落即为重组菌株。
4种含组氨酸标签的二硫键还原酶均使用镍离子亲和层析法进行纯化。将粗酶液于12 000 r/min离心10 min,再通过0.22 μm的水系过滤器。基于AKTA avant蛋白纯化系统,设置不同浓度的咪唑进行梯度洗脱,收集280 nm处的洗脱液。分别使用SDS-PAGE和Bradford方法对纯化蛋白的纯度和浓度进行检测。
1.2.2 酶活力的测定
角蛋白酶活力测定使用福林酚方法[18]:将50 μL角蛋白酶酶液、100 μL 2.5%(质量分数)的可溶性角蛋白底物和150 μL的Gly-NaOH缓冲液(50 mmol/L,pH 9.0)于60 ℃下反应20 min,加入200 μL 4%(质量分数)的TCA溶液终止反应,将混合物室温8 000 r/min离心3 min后,取200 μL上清液,加1 mL 4%(质量分数)的Na2CO3和200 μL的福林酚试剂混匀,50 ℃显色10 min,测定其在660 nm处吸光值,对照组角蛋白酶酶液先与TCA溶液混合再加可溶性角蛋白,其余操作与实验组相同。
角蛋白酶活力定义:上述条件下,OD660值每分钟增加0.001为1个酶活力单位(U)。
二硫键还原酶活力测定方法在何周凤[19]的基础上改进,将50 μL酶液、200 μL 1%(质量分数)可溶性角蛋白和250 μL缓冲液在40 ℃下反应30 min,加入200 μL 5%(质量分数)TCA终止反应,将反应混合物以10 000 r/min离心3 min,取200 μL上清液与5 μL 10 mmol/L 5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]溶液混合,静置10 min后,测定412 nm处吸光值,对照组为先加入200 μL 5% TCA,其余操作与实验组相同。
二硫键还原酶活力定义:上述反应条件下,在412 nm处吸光值每增加0.01为1个酶活力单位(U)。
1.2.3 二硫键还原酶的酶学性质分析
使用纯化后的二硫键还原酶,分别测定其在30、40、50、60、70、80 ℃下的二硫键还原酶活力,确定最适反应温度;测定其在40、60、80 ℃下放置0、30、60、90 min后的二硫键还原酶活力,确定其热稳定性;配制50 mmol/L的NaAc-HAc(pH 4.0~6.0),Tris-HCl(pH 7.0~8.0),Gly-NaOH(pH 9.0~12.0)缓冲液,分别测定二硫键还原酶在pH 4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0下的二硫键还原酶活力,确定最适反应pH;测定其在pH 4.0、6.0、8.0、10.0缓冲液中放置0、30、60、90 min后的酶活力,确定其pH稳定性。
1.2.4 二硫键还原酶与角蛋白酶组合降解羽毛效果分析
分别将重组酶烷基过氧化物还原酶AhpC(alkyl hydroperoxide reductase)、二氢硫辛酸脱氢酶DLD(dilipoamide dehydrogenase)、肽甲硫氨酸亚砜还原酶MsrA(peptide methionine sulfoxide reductase)、硫氧还蛋白还原酶TrxR(thioredoxin reductase)与角蛋白酶KerZ1等体积混合,设置添加等量缓冲液的对照组,测定不同组合酶体系下的二硫键还原酶活力和角蛋白酶活力。同时,选取长度、大小相同的羽毛,分别添加等量二硫键还原酶AhpC、DLD、MsrA、TrxR与角蛋白酶KerZ1组合体系酶液、单独的二硫键还原酶酶液和角蛋白酶KerZ1酶液。在40 ℃下水解48 h,观察羽毛的形态变化,设置不添加羽毛的对照组,分别测定实验组和对照组中可溶性蛋白含量,进一步量化二硫键还原酶与角蛋白酶复配降解羽毛的效果。
1.2.5 信号肽筛选
通过SingalP 5.0[20]预测MsrA信号肽分泌途径,发现MsrA蛋白序列不含有信号肽。将B.subtilis内源信号肽加在MsrA蛋白序列的N端并通过PSORT 4.0[21]预测亚细胞定位,预测结果显示30种信号肽定位至细胞外,选取其中的12种进行筛选,分别是SacB、Vpr、NprE、Ggt、PelC、Mpr、YncM、角蛋白酶KerZ1自身信号肽SPker(Sec途径),YwbN、PhoD(Tat途径),NprB(other途径),YxkH(Lipo途径)信号肽[22-23]。以B.subtilis 168菌株基因组为模板,分别使用表1中引物对相应的信号肽基因片段进行PCR扩增,采用Gibson组装方法将信号肽片段连接至MsrA序列的上游,构建重组菌株,并进行发酵验证。
1.2.6 羽毛水解液中成分测定及其应用
水解液中可溶性蛋白含量使用Bradford方法进行检测。氨基酸含量使用氨基酸分析仪进行测定,羽毛水解产物经过滤获得水解液,水解液于8 000 r/min离心10 min,保留上清液,等体积加入100 g/L磺基水杨酸溶液,混合均匀,4 ℃静置4 h,12 000 r/min离心10 min,取上清液,加入0.02 mol/L HCl(GR)稀释至0.1 mmol/L,通过0.22 μm的水系过滤器过滤至样品瓶,等待上机检测。
将玉米种子置于铺有湿润滤纸片的培养皿中,30 ℃催芽24 h,随机挑选发芽种子种植于含200 g有机土壤的花盆中,每盆种植6株,在28 ℃恒温条件下种植,实验组每3 d浇灌10%(体积分数)羽毛水解液,对照组浇灌等量的水,3周后测量各组玉米植株的高度和鲜重。
2 结果与分析
2.1 二硫键还原酶的异源表达
将来源于B.subtilis 168菌株的AhpC、CysH、DLD、MsrA、TrxR在B.subtilis WB600中过表达,其中AhpC、DLD、MsrA、TrxR成功表达,理论分子质量分别是20.6、50.4、20.2、34.5 kDa,经SDS-PAGE检测与预测分子质量一致(图1)。AhpC、DLD、TrxR胞内和胞外表达量无明显差别,MsrA主要是胞内酶,考虑到实际应用时的便捷性,后续选取AhpC、DLD、MsrA、TrxR的胞外酶部分为研究对象。

1-AhpC胞外上清液;2-DLD胞外上清液;3-MsrA 胞外上清液;4-TrxR胞外上清液;5-对照组上清液;M-Marker; 6-AhpC破碎液上清液;7-DLD破碎液上清液;8-MsrA 破碎液上清液;9-TrxR破碎液上清液;10-对照组破碎液上清液
图1 二硫键还原酶表达的SDS-PAGE验证
Fig.1 Detection of disulfide reductase expression by SDS-PAGE
2.2 二硫键还原酶的酶学性质表征
AhpC、DLD、MsrA和TrxR经镍离子亲和层析纯化后(图2-a),测定并计算其比酶活力分别为(0.53±0.07)、(1.69±0.3)、(16.7±0.53)、(2.06±0.08) U/mg。4种二硫键还原酶的最佳温度和pH都是40 ℃和 8.0(图2-b和图2-c)。AhpC在40、60、80 ℃孵育30 min后,残余酶活力分别为60%、20%和10%;在pH 8.0条件下处理30 min后,残余酶活力低于40%(图2-d和图2-h)。DLD在40 ℃孵育30 min后,残余酶活力为30%;在pH 8.0下孵育30 min后,残余酶活力低于20%(图2-e和图2-i)。MsrA在40、60 ℃孵育30 min后,保留了60%和40%的活性(图2-f);在pH 8.0下孵育30 min后,残余酶活力为40%,显示出良好的稳定性(图2-j)。TrxR在40 ℃孵育30 min后,残余酶活力约为30%(图2-g);在pH 8.0条件下处理30 min后,二硫键还原酶残余酶活力约为25%(图2-k)。
2.3 二硫键还原酶与角蛋白酶复配体系的活性变化
如图3所示,MsrA+KerZ1、TrxR+KerZ1组合体系的角蛋白酶和二硫键还原酶活力较单一酶均显著提高,其中,MsrA+KerZ1组合角蛋白酶活力高达93.98 kU/mL,比KerZ1单一酶体系提高了29.4%,其二硫键还原酶活力4.75 U/mL,是MsrA单一酶体系的6.3倍。二硫键还原酶与角蛋白酶组合体系酶活力变化表明二硫键还原酶可以破坏角蛋白中的二硫键,能够促进角蛋白酶对角蛋白的降解。但是羽毛等天然底物中的成分、结构比可溶性的角蛋白更复杂,为了更接近实际应用,我们将进一步在真实的羽毛降解中探究二硫键还原酶与角蛋白酶的联合水解效果。
2.4 二硫键还原酶与角蛋白酶复配降解羽毛效果
由图4可知,无论是二硫键还原酶的胞外上清液还是胞内破碎液上清液,与角蛋白酶KerZ1复配时均能使羽毛形态发生明显的降解变化,而二硫键还原酶单独作用时不具有水解羽毛能力,KerZ1单独作用时羽毛被轻微水解。
如图5所示,复配体系的可溶性蛋白含量均明显高于对照组,而单独的二硫键还原酶水解时可溶性蛋白含量无明显变化。MsrA+KerZ1、AhpC+KerZ1、DLD+KerZ1和TrxR+KerZ1体系的可溶性蛋白含量变化分别是84、65、62、41 mg/L,均高于角蛋白酶KerZ1单独水解的可溶性蛋白含量变化(28 mg/L)。可溶性蛋白含量变化与组合体系中酶活力的变化是一致的,这充分说明二硫键还原酶具有促进角蛋白酶降解羽毛的能力。尽管MsrA+KerZ1组合具有相对较优的水解效果,但是由于MsrA的胞外表达量较低,无法大规模降解羽毛,因此,进一步提高MsrA的胞外表达量十分必要。

a-纯化的二硫键还原酶SDS-PAGE验证;b-最适温度;c-最适pH;d~g-AhpC、DLD、MsrA、TrxR的热稳定性;h~k-AhpC、DLD、MsrA、TrxR 的pH稳定性
图2 二硫键还原酶的纯化及酶学性质
Fig.2 Purification and enzymatic characterization of disulfide reductase

图3 二硫键还原酶与KerZ1复配体系的酶活力变化
Fig.3 Changes in the enzymatic activity of complex system of disulfide reductase and KerZ1
2.5 MsrA的信号肽优化
由图6-a可知,当MsrA分别携带PelC、NprE、PhoD、SPker、YwbN、YxkH信号肽时,其胞外二硫键还原酶活力分别提高了1.4、1.8、2.0、2.2、2.6、4.2倍。虽然Tat途径信号肽在数量上远不及Sec途径信号肽,但是似乎更有利于提高MsrA的胞外表达量。并且,当MsrA携带YxkH信号肽时,MsrA的胞外表达量显著提高(图6-b)。
2.6 羽毛水解液的氨基酸分析和应用
2.6.1 水解液中的氨基酸含量
由表2可知,水解液中检测到常见氨基酸15种。

1-胞外上清液+KerZ1;2-胞内破碎液上清液+KerZ1;3-胞外上清液;4-胞内破碎液上清液;5-KerZ1
图4 二硫键还原酶与KerZ1复配降解羽毛形态变化
Fig.4 Morphological changes of feathers by degradation of disulfide reductase and KerZ1

图5 二硫键还原酶与KerZ1降解羽毛水解液中 可溶性蛋白含量
Fig.5 The content of soluble protein in feather hydrolyzate degraded by disulfide reductase and KerZ1

a-MsrA携带不同信号肽时胞外二硫键还原酶活力; b-携带信号肽YxkH时MsrA的胞外蛋白量变化
图6 信号肽对MsrA表达的影响
Fig.6 The effect of signal peptide on the expression of MsrA
鸭毛水解液中氨基酸总量为7 472.33 mg/L,其中Ser、Gly、Ala、Val、Ile、Leu、Phe含量较高;鸡毛水解液氨基酸总量达5 589.67 mg/L,其中含量较高的有Val、Tyr、Leu、Phe、Lys。并且Leu、Phe、Lys和Glu具有促进植物光合作用的效果而被广泛应用于生物肥料中[24],在改善土壤理化性质和促进植物生长中发挥重要作用。
表2 羽毛水解液中各氨基酸含量 单位:mg/L
Table 2 The contents of amino acid in feather hydrolyzate
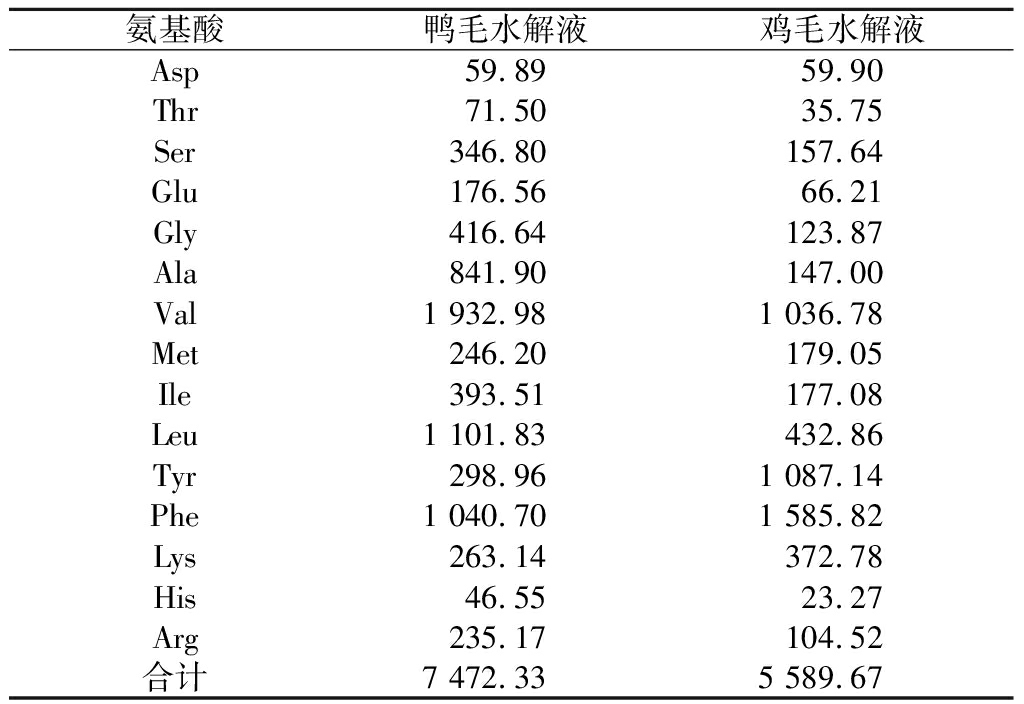
氨基酸鸭毛水解液鸡毛水解液Asp59.8959.90Thr71.5035.75Ser346.80157.64Glu176.5666.21Gly416.64123.87Ala841.90147.00Val1 932.981 036.78Met246.20179.05Ile393.51177.08Leu1 101.83432.86Tyr298.961 087.14Phe1 040.701 585.82Lys263.14372.78His46.5523.27Arg235.17104.52合计7 472.335 589.67
2.6.2 羽毛水解液在植物生长中的应用
玉米种苗经10%(体积分数)羽毛水解液浇灌3周后,浇灌羽毛水解液玉米植株的根系更发达,茎较对照组更粗壮,对照组、鸭毛水解液和鸡毛水解液浇灌的植株高度分别是12.64、14.76、16.86 cm,羽毛水解液具有明显的促进生长效果(图7-a);10%鸭毛水解液浇灌的玉米植株鲜重达(4.92±0.12) g,是对照组[(2.91±0.1) g]的1.7倍,10%鸡毛水解液浇灌的植株鲜重是(4.15±0.44) g,较对照组提高了1.4倍(图7-b)。可见,羽毛水解液作为一种生物肥料,具有良好的应用前景。

a-植物形态的变化;b-植物鲜重的变化
图7 水解液对植物生长的影响
Fig.7 The effect of hydrolysate on plant growth
3 结论
本研究使用高表达的二硫键还原酶和角蛋白酶协同作用来提高羽毛废弃物的降解效率。在B.subtilis WB600中成功胞外表达4种二硫键还原酶AhpC、DLD、MsrA和TrxR,比酶活力分别是0.53、1.69、16.7、2.06 U/mg;对其酶学性质进行表征,4种二硫键还原酶最佳温度和pH都是40 ℃和8.0,其中MsrA在40 ℃ 和pH 8.0孵育30 min,分别保留了60%和40%的活性。MsrA与KerZ1协同降解羽毛时水解液中可溶性蛋白含量较KerZ1降解时提高3倍。此外,对MsrA进行信号肽优化,使其胞外二硫键还原酶活力提高了4.2倍。优化后的MsrA和KerZ1降解100 g/L鸭毛和鸡毛可分别获得7 472.31、5 589.66 mg/L氨基酸的水解液,且水解液可以促进玉米植株的生长。本研究表明二硫键还原酶能显著促进角蛋白酶对羽毛废弃物的降解,在羽毛降解中发挥重要作用,同时也为角蛋白废弃资源的绿色回收提供了一定的理论依据和应用参考。
[1] LI Q X.Progress in microbial degradation of feather waste[J].Frontiers in Microbiology, 2019, 10:2717.
[2] WANG J, HAO S L, LUO T T, et al.Development of feather keratin nanoparticles and investigation of their hemostatic efficacy[J].Materials Science and Engineering:C, 2016, 68:768-773.
[3] WANG B, YANG W, MCKITTRICK J, et al.Keratin:Structure, mechanical properties, occurrence in biological organisms, and efforts at bioinspiration[J].Progress in Materials Science, 2016, 76:229-318.
[4] PENG Z, MAO X Z, ZHANG J, et al.Effective biodegradation of chicken feather waste by co-cultivation of keratinase producing strains[J].Microbial Cell Factories, 2019, 18(1):84.
[5] CALVARESI M, ECKHART L, ALIBARDI L.The molecular organization of the beta-sheet region in corneous beta-proteins (beta-keratins) of sauropsids explains its stability and polymerization into filaments[J].Journal of Structural Biology, 2016, 194(3):282-291.
[6] PENG Z, ZHANG J, DU G C, et al.Keratin waste recycling based on microbial degradation:Mechanisms and prospects[J].ACS Sustainable Chemistry & Engineering, 2019, 7(11):9 727-9 736.
[7] CALLEGARO K, BRANDELLI A, DAROIT D J.Beyond plucking:Feathers bioprocessing into valuable protein hydrolysates[J].Waste Management, 2019, 95:399-415.
[8] QIU J W, WILKENS C, BARRETT K, et al.Microbial enzymes catalyzing keratin degradation:Classification, structure, function[J].Biotechnology Advances, 2020, 44:107607.
[9] PENG Z, XU P, SONG Y, et al.Cysteine-mediated cyclic metabolism drives the microbial degradation of keratin[J].ACS Sustainable Chemistry & Engineering, 2021, 9(29):9 861-9 870.
[10] LIN H H, YIN L J, JIANG S T.Cloning, expression, and purification of Pseudomonas aeruginosa keratinase in Escherichia coli AD494(DE3) pLysS expression system[J].Journal of Agricultural and Food Chemistry, 2009, 57(9):3 506-3 511.
[11] JAOUADI N Z, REKIK H, BADIS A, et al.Biochemical and molecular characterization of a serine keratinase from Brevibacillus brevis US575 with promising keratin-biodegradation and hide-dehairing activities[J].PLoS One, 2013, 8(10):e76722.
[12] 齐志国, 张铁鹰, 董杰丽, 等.角蛋白降解菌分离、鉴定及其降解机制研究[J].饲料工业, 2012, 33(17):19-24.
QI Z G, ZHANG T Y, DONG J L, et al.Research on isolation and identification of keratin-degrading bacterias and its degradation mechanism[J].Feed Industry, 2012, 33(17):19-24.
[13] 王德山. 地衣芽孢杆菌CP-16降解羽毛角蛋白相关蛋白酶的分离、表达和相互关系[D].北京:中国农业科学院, 2014.
WANG D S.Purification, expression and relationship of some proteases related to feather keratin degradation from B.licheniformis CP-16[D].Beijing:Chinese Academy of Agricultural Sciences, 2014.
[14] 邹林源, 张铁鹰, 齐志国, 等.嗜麦芽窄食单胞菌胞内具二硫键还原活性酶蛋白的研究[J].饲料工业, 2015, 36(13):30-34.
ZOU L Y, ZHANG T Y, QI Z G, et al.Research on enzyme with disulfide reductase in Stenotrophomonas maltophilia[J].Feed Industry, 2015, 36(13):30-34.
[15] 廖朝勇. 地衣芽孢杆菌CP-16降解羽毛关键酶高效表达研究[D].北京:中国农业科学院, 2019.
LIAO C Y.High-efficiency expression of key hydrolysis enzymes of feathers from Bacillus licheniformis CP-16[D].Beijing:Chinese Academy of Agricultural Sciences, 2019.
[16] PRAKASH D, WALTERS K A, MARTINIE R J, et al.Toward a mechanistic and physiological understanding of a ferredoxin:Disulfide reductase from the domains archaea and bacteria[J].The Journal of Biological Chemistry, 2018, 293(24):9 198-9 209.
[17] PENG Z, MAO X Z, ZHANG J, et al.Biotransformation of keratin waste to amino acids and active peptides based on cell-free catalysis[J].Biotechnology for Biofuels, 2020, 13:61.
[18] 冒鑫哲. Bacillus licheniformis BBE11-1角蛋白酶底物特异性改造及发酵优化[D].无锡:江南大学, 2020.
MAO X Z.Substrate specificity and fermentation optimization of Bacillus licheniformis BBE11-1 keratinase[D].Wuxi:Jiangnan University, 2020.
[19] 何周凤. 枯草芽孢杆菌BS8对羽毛角蛋白的降解机制初探[D].雅安:四川农业大学, 2017.
HE Z F.Exploration of the degradation mechanism of feather keratin by Bacillus subtilis 8[D].Ya′an:Sichuan Agricultural University, 2017.
[20] ARMENTEROS A J J, TSIRIGOS K D, SØNDERBY C K, et al.SignalP 5.0 improves signal peptide predictions using deep neural networks[J].Nature Biotechnology, 2019, 37(4):420-423.
[21] LAU W, HOAD G R, JIN V, et al.PSORTdb 4.0:Expanded and redesigned bacterial and archaeal protein subcellular localization database incorporating new secondary localizations[J].Nucleic Acids Research, 2021, 49(D1):D803-D808.
[22] TSIRIGOTAKI A, GEYTER J D, ![]() N, et al.Protein export through the bacterial Sec pathway[J].Nature Reviews Microbiology, 2017, 15(1):21-36.
N, et al.Protein export through the bacterial Sec pathway[J].Nature Reviews Microbiology, 2017, 15(1):21-36.
[23] MÜLLER M, KLÖSGEN R B.The Tat pathway in bacteria and chloroplasts[J].Molecular Membrane Biology, 2005, 22(1-2):113-121.
[24] 张健, 李燕婷, 袁亮, 等.氨基酸发酵尾液可促进樱桃番茄对水溶肥料氮素的吸收利用[J].植物营养与肥料学报, 2018, 24(1):114-121.
ZHANG J, LI Y T, YUAN L, et al.Tail liquid from amino acid fermentation could improve the uptake and utilization of water soluble fertilizer nitrogen by cherry tomato[J].Journal of Plant Nutrition and Fertilizers, 2018, 24(1):114-121.