裂褶菌(Schizophyllum commune Fr.)又称白参菌,是一种珍稀的食药用菌,近年来在云南、湖北等地逐步实现了人工栽培[1]。裂褶菌中含有多种生物活性成分,如多糖、多酚、萜类等,其中多糖是裂褶菌中最主要的生物活性成分,具有抑制肿瘤、抗菌消炎、提高机体免疫力等作用[2-3]。目前,国内外对裂褶菌多糖的研究主要集中在结构与功能开发方面,如刘淑敏等[4]发现裂褶菌多糖具有良好的抑制果汁褐变效果,YELITHAO等[5]分离纯化得到一种裂褶菌多糖组分具有较强的免疫活性和细胞增殖活性。但裂褶菌多糖在体外消化及其对益生菌的增殖效果方面尚未研究。本课题组前期利用60Co γ辐照处理技术制备了辐照裂褶菌多糖(irradiated schizophyllum polysaccharide,ISPG),该多糖具有纯度高、溶解性好等优点[6],因此,本研究以ISPG为原料分析了ISPG基本组成、理化性质和抗氧化活性,并以低聚果糖(fructo-oligosaccharide,FOS)为阳性对照,探究了ISPG体外消化特性及其对鼠李糖乳杆菌(Lactobacillus rhamnosus)和植物乳杆菌(Lactobacillus plantarum)的增殖效果,研究结果将为ISPG的功能挖掘及其产品开发提供理论依据。
1 材料与方法
1.1 材料与试剂
裂褶菌子实体,武汉普天乐农业科技有限公司;单糖标准品、葡聚糖标准品(HPLC≥98%)、1-苯基-3-甲基-5-吡唑啉酮(phenyl-3-methyl-5-pyrazolone,PMP),Sigma公司;FOS、纤维素酶(400 U/mg)、果胶酶(500 U/mg)、木瓜蛋白酶(800 U/mg),上海源叶生物科技有限公司;植物乳杆菌JYLP-002、鼠李糖乳杆菌JYLR-005,山东中科嘉亿生物工程有限公司;其他试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
Nexus 470傅立叶变换红外光谱仪,美国Metso公司;Waters e2695高相液相色谱仪,美国waters公司;Agilent 1100高效液相色谱仪,美国Agilent公司;SPARK多功能酶标仪、UV-1800紫外可见分光光度计,日本岛津有限公司;MCO-15AC CO2恒温培养箱,日本SANYO公司;SW-CJ-1FD洁净工作台,苏净安泰集团。
1.3 实验方法
1.3.1 ISPG的制备
洗净烘干的裂褶菌子实体经粉碎过80目筛后,采用60Co γ辐照处理过夜,干燥器中贮存备用。
ISPG的制备方法参考CHEN等[7]方法。采用超声辅助酶法提取裂褶菌粗多糖,粗多糖经sevag法脱蛋白并过8 000 Da透析袋。完成后,加入4倍体积无水乙醇,4 ℃静置过夜,离心收集沉淀并低温烘干获得ISPG。
1.3.2 ISPG基本组成测定
采用苯酚硫酸法测定ISPG中总糖的含量[8](y=8.383 3x+0.004 9,R2=0.999 2);采用DNS法测定ISPG中还原糖的含量[9](y=1.855x-0.035,R2=0.995 5);采用考马斯亮蓝法[10]测定ISPG中蛋白质的含量(y=5.446 2x+0.017 4,R2=0.995 5);采用硫酸-间羟联苯法测定ISPG中糖醛酸含量[11](y=29.823x-0.010 2,R2=0.998 6);采用氯化钡-明胶比浊法测定ISPG中硫酸基含量[12](y=1.190 8x-0.105,R2=0.980 9)。
1.3.3 紫外光谱分析
配制ISPG(0.25 g/L)水溶液,利用UV-1800紫外可见分光光度计在200~400 nm进行扫描。
1.3.4 红外光谱分析
将预先干燥的ISPG样品(1.00 mg)和KBr(100.00 mg)在研钵中研磨成细粉,并压制成片[13],利用Nexus 470傅立叶变换红外光谱仪在4 000~400 cm-1进行扫描。
1.3.5 分子质量测定
分子质量测定所用HPLC仪器为安捷伦1100系列,该仪器装备了RID检测器以及TSK gel G4000PWxL色谱柱(10 μm,300 mm×7.8 mm)。流动相:0.05 mol/L硝酸钠水溶液;流速1.0 mL/min;柱温35 ℃;进样量20 μL。以葡聚糖标准品(PJT-180、PJT-3K、PJT-7K、PJT-10K、JT-40K、PJT-70K、PJT-500K和PJT-2000K)获得的校准曲线计算ISPG平均分子质量。
1.3.6 单糖组成测定
ISPG单糖组成测定参照YUAN等[14]的方法。将ISPG溶液(100 g/L)和三氟乙酸溶液(trifluoroacetic acid,TFA,0.4 mol/L)等量混合,110 ℃下水解6 h。干燥后,残渣用甲醇清洗数次,随后溶解在蒸馏水中获得多糖水解液。将200.0 μL多糖水解液、400.0 μL NaOH溶液(0.3 mol/L)和200.0 μL PMP溶液(0.5 mol/L)混合,70 ℃下衍生2 h。反应完成后添加400.0 μL HCl溶液(0.3 mol/L)终止反应,过0.22 μm微孔滤膜后使用Waters e2695 HPLC仪器(2998 PDA检测器)进行分析。色谱柱:岛津InertSustain AQ-C18柱(5 μm,4.6 mm×250 mm);流动相:乙腈-磷酸盐缓冲液(17%∶83%;0.05 mol/mL;pH=6.8);柱温30 ℃;检测波长245 nm;流速1.0 mL/min;进样量10 uL。
1.3.7 刚果红实验
将0.5 mL ISPG溶液(2.0 g/L)和1.5 mL刚果红溶液(2.0 mmol/L)混合,加入一定量NaOH溶液使反应体系NaOH终浓度分别为0.0、0.05、0.1、0.15、0.2、0.3、0.4、0.5 mol/L,混匀后室温下静置10 min,并使用UV-1800紫外可见分光光度计在400~600 nm内测量最大吸收波长(λ)[15]。
1.3.8 ISPG的抗氧化活性分析
以维生素C作为阳性对照,按照CHEN等[7]的方法测定DPPH自由基清除活性、还原力以及羟自由基清除活性,按照SHANG等[16]的方法测定ABTS阳离子自由基清除活性。
1.3.9 口腔、胃肠道模拟消化实验
将ISPG与FOS(阳性对照)分别配制成10 g/L的溶液,备用。
口腔模拟消化实验:人工口腔液参照杨明琛等[17]的方法配制。将5 mL口腔电解质分别加入至5 mL ISPG溶液与5 mL FOS溶液中,37 ℃消化2 min后,取消化液1 mL沸水浴2 min后测定还原糖、总糖含量,剩下的口腔消化液进一步开展胃模拟消化,水解度的计算如公式(1)所示:
水解度![]()
(1)
式中:总糖含量、初始还原糖含量为水解前测得,还原糖释放量=某时间点的还原糖含量-初始还原糖含量。
胃模拟消化实验:人工胃液参照叶子晨等[18]的方法配制,并分别调节pH值至1、2、3。然后将5 mL不同pH的人工胃液分别添加至5 mL经人工口腔液消化后的ISPG溶液和FOS溶液中,37 ℃下恒温振荡6 h(速率=130 r/min),分别在第1、2、4、6 h收集胃部消化液1 mL,沸水浴2 min后测定还原糖、总糖含量,水解度按公式(1)计算。剩下的胃部消化液进一步开展肠道模拟消化。
肠道模拟消化实验:人工肠液参照杨明琛等[17]的方法配制。将5 mL人工肠液分别添加至5 mL经人工胃液消化后的ISPG溶液和FOS溶液(pH=2)中,37 ℃下恒温振荡6 h(速率=50 r/min),分别在第1、2、4、6 h收集消化液1 mL,沸水浴2 min后测定还原糖、总糖,水解度按公式(1)计算。
1.3.10 益生菌发酵实验
MRS液体以及固体培养基的配制参照谢曈等[19]的方法。将植物乳杆菌和鼠李糖乳杆菌分别接种于MRS固体培养基上,37 ℃恒温培养活化。挑取活化单菌落至含有ISPG或FOS(10 g/L)的液体培养基,37 ℃下恒温发酵48 h,分别在0、8、16、24、32、40、48 h时测定体系的OD600值和pH值。
1.3.11 数据分析
所有实验均重复3次,且所有实验数据显示为平均值±标准偏差(SD),采用Origin 2021软件进进行绘图与方程拟合。
2 结果与分析
2.1 ISPG的基本组成
ISPG中多糖、还原糖、糖醛酸、蛋白质和硫酸根的含量如表1所示。其中多糖含量为81.84%(质量分数),显著高于超声辅助提取法[20]提取的多糖(69.56%)。表1显示ISPG中仍含有1.58%(质量分数)蛋白质,可能是由于这部分蛋白和多糖结合较为紧密[21],没有被完全脱除。
表1 ISPG的化学组成
Table 1 Chemical compositions of ISPG

多糖/%还原糖/%蛋白质/%糖醛酸/%硫酸基/%单糖组成及其摩尔比甘露糖核糖鼠李糖葡萄糖醛酸半乳糖醛酸半乳糖葡萄糖木糖阿拉伯糖岩藻糖81.84±0.350.43±0.011.58±0.061.46±0.044.25±0.0110.020.0390.110.0570.00110.34-0.340.027
注:%代表质量分数
2.2 ISPG的紫外光谱分析
ISPG紫外光谱如图1所示,ISPG在260、280 nm处均未显示明显的强吸收峰,说明ISPG中蛋白质和核酸含量较少。

图1 ISPG 紫外光谱图
Fig.1 UV-Vis spectra of ISPG
2.3 ISPG的红外光谱分析
ISPG的红外光谱如图2所示。3 388、2 931 cm-1分别对应O—H、C—H伸缩振动峰,这是多糖的两个特征峰。1 653 cm-1波长处的吸收峰是由C![]() O的伸缩振动引起的,1 417 cm-1波长处的吸收峰是由C—H的弯曲振动引起的,1 255、1 041 cm-1波长处的强吸收峰由2种C—O伸缩振动所产生,一种属于C—O—H,另外一种是C—O—C糖苷键,883 cm-1波长处吸收峰是吡喃糖β型C—H弯曲振动的特征吸收峰。因此红外光谱可进一步表明ISPG是一种β型葡聚糖。
O的伸缩振动引起的,1 417 cm-1波长处的吸收峰是由C—H的弯曲振动引起的,1 255、1 041 cm-1波长处的强吸收峰由2种C—O伸缩振动所产生,一种属于C—O—H,另外一种是C—O—C糖苷键,883 cm-1波长处吸收峰是吡喃糖β型C—H弯曲振动的特征吸收峰。因此红外光谱可进一步表明ISPG是一种β型葡聚糖。
2.4 ISPG的分子质量分析
ISPG的分子质量分布如图3所示,图中有多个峰,表明ISPG含有多种组分。不同组分的分子质量特征如表2所示。组分1分子质量为17.68 kDa,峰面积为49.57%;组分2分子质量为3.42 kDa,峰面积为50.42%,相较未脱蛋白、未透析之前(大分子峰面积为13.382%,小分子峰面积为27.547%)[7],其多糖纯度有了很大提升。

图2 ISPG红外光谱图
Fig.2 FT-IR spectra of ISPG

图3 ISPG的分子质量分布
Fig.3 Molecular weight distribution of ISPG
表2 ISPG的分子质量特征
Table 2 Molecular weight characteristics of ISPG
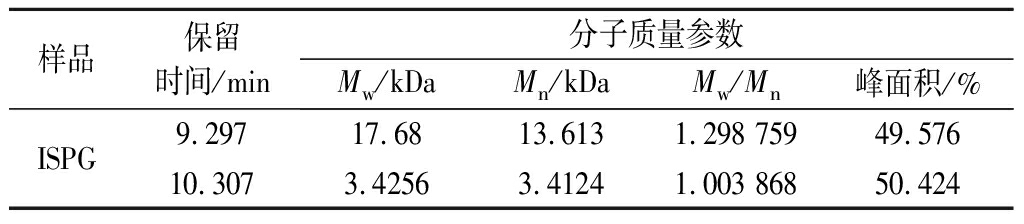
样品保留时间/min分子质量参数Mw/kDaMn/kDaMw/Mn峰面积/%ISPG9.29717.6813.6131.298 75949.57610.3073.42563.41241.003 86850.424
注:Mw表示重均分子量,Mn表示数均分子量,Mw/Mn表示多分散指数
2.5 单糖组成分析
ISPG单糖组成测定结果如图4所示,其不同单糖摩尔比如表1所示。结果表明,ISPG主要由甘露糖、葡萄糖醛酸、葡萄糖、阿拉伯糖组成,其中葡萄糖含量最高,这与上述红外图谱中ISPG主要成分为β-葡聚糖结论相符。

1-甘露糖;2-核糖;3-鼠李糖;4-葡萄糖醛酸;5-半乳糖醛酸; 6-半乳糖;7-葡萄糖;8-木糖;9-阿拉伯糖;10-岩藻糖 a-标准单糖HPLC图谱;b-ISPG HPLC图谱
图4 标准单糖和ISPG HPLC图谱
Fig.4 HPLC spectra of standard monosaccharide and ISPG
2.6 刚果红实验
在碱性溶液中,刚果红可以与具有三股螺旋结构的多糖大分子形成较稳定的络合物,该络合物在较低浓度的碱性溶液中最大吸收波长在可见光范围内会向波长较长方向进行移动,即发生红移现象[22]。刚果红实验结果如图5所示,ISPG在NaOH浓度逐渐增大的情况下λmax先升高再降低,这表明ISPG可能具有三螺旋结构。

图5 刚果红与ISPG络合物的最大吸收
Fig.5 Maximum absorption of the Congo red-ISPG complex
2.7 抗氧化活性
研究表明,食用菌多糖具有一定抗氧化活性,可以保护机体器官、延缓细胞衰老[23]。如图6-a~图6-d所示,在1~5 g/L,ISPG的DPPH自由基清除率、羟自由基清除率、ABTS阳离子自由基清除率以及还原力均随着质量浓度的增加而增大,且有一定的剂量依赖效应,但都低于对照组维生素C。

a-DPPH自由基清除率;b-羟自由基清除率;c-ABTS阳离子自由基清除率;d-还原能力
图6 ISPG和维生素C的抗氧化活性
Fig.6 Antioxidant activities of ISPG and vitamin C
2.8 口腔、胃肠道模拟消化实验
食物经口腔至胃肠道大约需要2 min,ISPG在人工在口腔消化液中FOS和ISPG的水解度分别为7.83% 和6.28%,这可能是因为ISPG主要成分为β-葡聚糖,而作为口腔消化中的关键酶α淀粉酶只能水解α-糖苷键的缘故[24]。ISPG在人工胃液中的水解度如图7-a~图7-c所示,ISPG与FOS的水解度随着pH的升高而降低,可能是由于在较低pH环境中糖苷键更容易发生断裂,从而导致多糖水解度增加[25]。在同一pH条件下,随着孵育时间的延长,ISPG 与FOS的水解程度也逐渐增大,但都低于同一时间点的阳性对照,说明ISPG比FOS更能抵抗胃酸的水解,这可能与二者单糖组成、糖苷键类型不同相关[17]。当ISPG在pH 1~3的人工胃液水解6 h后,ISPG的水解度分别为4.04%、2.29%、0.98%,表明至少能有95.96%的ISPG可耐受胃液的水解到达肠道。图7-d为ISPG 与FOS在人工肠液中的水解情况,ISPG与FOS的水解度随着消化时间的延长而升高,水解6 h后,ISPG的水解度仅为0.61%,这表明ISPG在人工肠液中几乎不水解。

a-人工胃液(pH 1);b-人工胃液(pH 2);c-人工胃液(pH 3);d-人工肠液
图7 FOS、ISPG在人工胃肠液中的水解情况
Fig.7 Hydrolysis of FOS and ISPG in artificial human gastrointestinal fluid
2.9 益生菌发酵实验
研究发现,一些天然多糖可以促进益生菌增殖,一方面是因为这些多糖可被益生菌分解为单糖,为益生菌生长提供能量,另一方面,益生菌在分解多糖过程中会产生有机酸,提供酸性环境促进益生菌的增殖[22]。益生菌发酵实验结果如图8所示。

a-鼠李糖乳杆菌OD600值随时间的变化;b-植物乳杆菌OD600值随时间的变化;c-鼠李糖乳杆菌pH值随时间的变化;d-植物乳杆菌pH值随时间的变化
图8 鼠李糖乳杆菌与植物乳杆菌pH值、OD600值随时间的变化
Fig.8 Changes of pH and OD600 of Lactobacillus rhamnosus and Lactobacillus plantarum with time
图8-a、图8-b分别为鼠李糖乳杆菌和植物乳杆菌在ISPG液体培养基和FOS液体培养基中OD600值随时间的变化情况,在0~48 h,鼠李糖乳杆菌在2种培养基中OD600值先上升后趋于一致,培养至8 h时,鼠李糖乳杆菌在ISPG液体培养基中OD600值高于FOS液体培养基中OD600值;而植物乳杆菌在ISPG液体培养基中OD600值先上升后趋于平稳,但远低于FOS液体培养基中的OD600值。培养液中OD600值越大,表明菌体数量越多,说明鼠李糖乳杆菌和植物乳杆菌在2种培养基中的菌体数量都有所增加。图8-c、图8-d表示鼠李糖乳杆菌、植物乳杆菌在含ISPG液体培养基和含FOS液体培养基中pH随时间的变化情况,随着培养时间的延长,鼠李糖乳杆菌和植物乳杆菌在2种培养基中pH均先下降后趋于稳定,这表明鼠李糖乳杆菌和植物乳杆菌生长代谢过程中产生酸性物质,导致pH下降,而随着培养时间的延长,培养基中的多糖基本被分解,所以益生菌的生长变缓,发酵液中pH便趋于稳定[26]。以上结果说明ISPG对2种菌都具有一定的促增殖作用。
3 结论
本实验以辐照裂褶菌子实体为原材料,采用超声辅助酶法提取辐照裂褶菌子实体多糖ISPG,并对其化学组成和理化性质,在人工胃肠液中的水解度、以及对植物乳杆菌和鼠李糖乳杆菌增殖的影响进行了较为系统的研究。结果显示,ISPG中总糖含量为81.84%(质量分数),另外含有少量的还原糖、蛋白质、糖醛酸以及硫酸基;ISPG分子质量为17.68 kDa,单糖组成中葡萄糖含量最多;体外抗氧化实验表明ISPG具有一定的抗氧化性;体外模拟消化实验表明ISPG在人工口腔、胃肠液中几乎不被水解;益生菌发酵实验表明ISPG对鼠李糖乳杆菌和植物乳杆菌生长均有一定的促增殖作用。以上结果表明ISPG可作为一种潜在的益生元为ISPG的开发利用指明一个新的方向。
[1] 姜涛. 裂褶菌中化学成分的研究和异戊烯基断裂酶的鉴定[D].重庆:西南大学, 2020.
JIANG T.The study of chemical composition and the identification of prenyl-cleaving enzymes on Schizophyllum commune[D].Chongqing:Southwest University, 2020.
[2] 吴继宏, 余菁菁, 周林, 等.双水相体系萃取分离发酵液中的裂褶菌多糖[J].食品科技, 2019, 44(3):188-193.
WU J H, YU J J, ZHOU L, et al.Extraction and separation of Schizophyllum polysaccharide in fermentation broth by double aqueous phase system[J].Food Science and Technology, 2019, 44(3):188-193.
[3] 贺凤, 黄龙花, 刘远超, 等.裂褶菌多糖的研究进展[J].食用菌学报, 2016, 23(2):88-93.
HE F, HUANG L H, LIU Y C, et al.Progress in Schizophyllan research[J].Acta Edulis Fungi, 2016, 23(2):88-93.
[4] 刘淑敏, 张兴龙, 邵兴锋, 等.裂褶菌多糖抑制枇杷果汁褐变的工艺优化[J].食品科学, 2016, 37(6):58-63.
LIU S M, ZHANG X L, SHAO X F, et al.Optimization of browning inhibition of loquat juice by schizophyllan[J].Food Science, 2016, 37(6):58-63.
[5] YELITHAO K, SURAYOT U, LEE C S, et al.Studies on structural properties and immune-enhancing activities of glycomannans from Schizophyllum commune[J].Carbohydrate polymers, 2019, 218:37-45.
[6] 湖北省农业科学院农产品加工与核农技术研究所. 一种高纯度、高溶解性、高活性的食用菌多糖制备方法:中国, ZL201910003450.9[P].2021-03-16.
Institute of Agro-Products Processing and Nuclear-Agricultural Technology.A preparation method of edible fungus polysaccharide with high purity, high solubility and high activity:China, ZL201910003450.9[P].2021-03-16.
[7] CHEN Z Y, YIN C M, FAN X Z, et al.Characterization of physicochemical and biological properties of Schizophyllum commune polysaccharide extracted with different methods[J].International Journal of Biological Macromolecules, 2020, 156:1 425-1 434.
[8] 陈春. 桑葚多糖的结构鉴定、活性评价及其体外消化酵解[D].广州:华南理工大学, 2018.
CHEN C.Structural identification, biological activities evaluation, digestion and fermentation in vitro of polysaccharides from Fructus mori[D].Guangzhou:South China University of Technology, 2018.
[9] HUSSAIN H, NGAINI Z, CHONG N.Modified bicinchoninic acid assay for accurate determination of variable length reducing sugars in carbohydrates[J].International Food Research Journal, 2018, 25(6):2 614-2 619.
[10] 卢琪, 薛淑静, 杨德, 等.3种提取方法对大球盖菇粗多糖抗氧化性能的影响[J].食品科技, 2021, 46(11):171-178.
LU Q, XUE S J, YANG D, et al.Effects of three extraction methods on antioxidant properties of crude polysaccharides from Stropharia Rugoso[J].Food Science and Technology, 2021, 46(11):171-178.
[11] 郝金斌, 孟国良, 杨军, 等.奶油栓孔菌子实体多糖的理化性质、抗氧化活性与保肝作用[J].菌物学报, 2020, 39(12):2 355-2 368.
HAO J B, MENG G L, YANG J, et al.Physicochemical properties, antioxidant activities and liver protective effects of polysaccharides from fruiting bodies of Trametes lactinea[J].Mycosystema, 2020, 39(12):2 355-2 368.
[12] 杨大俏, 王锦旭, 李来好, 等.近江牡蛎多糖的结构鉴定及免疫调节能力分析[J].食品科学, 2020, 41(10):38-46.
YANG D Q, WANG J X, LI L H, et al.Structural analysis and immunoregulatory activity of polysaccharides from Crassostrea rivularis[J].Food Science, 2020, 41(10):38-46.
[13] 宋梦歌. 手性聚苯胺纳米纤维与氨基酸分子印迹聚苯胺的合成[D].昆明:昆明医科大学, 2021.
SONG M G.Synthesis of chiral polyaniline nanofibers and amino acid molecularly imprinted Polyaniline[D].Kunming:Kunming Medical University, 2021.
[14] YUAN Q, LIN S, FU Y, et al.Effects of extraction methods on the physicochemical characteristics and biological activities of polysaccharides from okra (Abelmoschus esculentus)[J].International Journal of Biological Macromolecules, 2019, 127:178-186.
[15] 曹桦强, 刘琛仪, 李赛芬, 等.刚果红法定量检测酵母β-葡聚糖的方法研究[J].食品与发酵工业, 2022, 48(9):261-266.
CAO H Q, LIU C Y, LI S F, et al.Study on quantitative determination of yeast β-glucan by Congo red[J].Food and Fermentation Industries, 2022, 48(9):261-266.
[16] SHANG H M, WANG M H, LI R, et al.Extraction condition optimization and effects of drying methods on physicochemical properties and antioxidant activities of polysaccharides from Astragalus cicer L.[J].Scientific Reports, 2018, 8(1):1-12.
[17] 杨明琛, 袁梦欣, 陆维, 等.黄精多糖体外消化特性及对Ⅱ型糖尿病小鼠肠道菌群的调节作用[J].现代食品科技, 2021, 37(8):14-21.
YANG M C, YUAN M X, LU W, et al.In vitro digestion properties of Polygonatum sibiricum polysaccharide and its regulatory action on the gut microbiota in T2DM mice[J].Modern Food Science and Technology, 2021, 37(8):14-21.
[18] 叶子晨, 王腾, 杨云, 等.黄参粗多糖对植物乳杆菌CGMCC-15801和鼠李糖乳杆菌CGMCC-16103增殖的影响[J].食品与发酵工业, 2022, 48(4):207-212.
YE Z C, WANG T, YANG Y, et al.Effects of crude Sphallerocarpus gracilis polysaccharides on proliferation of Lactobacillus plantarum CGMCC-15801 and Lactobacillus rhamnosus CGMCC-16103[J].Food and Fermentation Industries, 2022, 48(4):207-212.
[19] 谢曈, 吕虹雨, 朱佳佳, 等.几株益生菌的性能比较研究[J].动物医学进展, 2021, 42(12):26-30.
XIE T, LYU H Y, ZHU J J, et al, Comparative study on the performance of several strains of probiotics[J].Progress in Veterinary Medicine, 2021, 42(12):26-30.
[20] 杨娜, 王鸿飞, 宋佳敏, 等.超声波辅助提取裂褶菌多糖及分离纯化的研究[J].核农学报, 2014, 28(11):2 015-2 024.
YANG N, WANG H F, SONG J M, et al.Uitrasonic assisted extraction and purification and determination of Schizophyllian polysaccharose[J].Journal of Nuclear Agricultural Sciences, 2014, 28(11):2 015-2 024.
[21] 赵书凡, 朱科学, 朱红英, 等.苦丁茶冬青多糖乙醇分级纯化及其理化性质研究[J].热带农业科学, 2017, 37(4):80-86.
ZHAO S F, ZHU K X, ZHU H Y, et al.Ethanol fractionation and physico-chemical properties of soluble polysaccharides from Ilex kudingcha C.J.Tseng[J].Chinese Journal of Tropical Agriculture, 2017, 37(4):80-86.
[22] WANG X, HUANG M Y, YANG F, et al.Rapeseed polysaccharides as prebiotics on growth and acidifying activity of probiotics in vitro[J].Carbohydrate Polymers, 2015, 125:232-240.
[23] 李顺峰, 许方方, 崔国梅, 等.香菇柄多糖乙酰化修饰及其抗氧化活性[J].食品与发酵工业, 2022, 48(3):130-134.
LI S F, XU F F, CUI G M, et al.Acetylation modification of Lentinus edodes stipe polysaccharide and its antioxidant activity[J].Food and Fermentation Industries, 2022, 48(3):130-134.
[24] SIU K C, XU L J, CHEN X, et al.Molecular properties and antioxidant activities of polysaccharides isolated from alkaline extract of wild Armillaria ostoyae mushrooms[J].Carbohydrate Polymers, 2016, 137:739-746.
[25] CHEN C, ZHANG B, FU X, et al.The digestibility of mulberry fruit polysaccharides and its impact on lipolysis under simulated saliva, gastric and intestinal conditions[J].Food Hydrocolloids, 2016, 58:171-178.
[26] 王丽波, 高婧宇, 李腾飞, 等.硒化蒲公英多糖的制备、结构表征及益生菌促增殖活性[J].食品科学, 2021, 42(7):169-175.
WANG L B, GAO J Y, LI T F, et al.Preparation, structural characterization and probiotics proliferation-promoting activity of selenized dandelion polysaccharide[J].Food Science, 2021, 42(7):169-175.