在我国,牡蛎资源十分丰富,且在水产养殖产业中,牡蛎养殖产业十分发达。牡蛎在我国广泛分布于南海、东海、黄海及渤海等海域。牡蛎中的基本营养素包括蛋白质、脂肪、糖原(碳水化合物)、水和灰分。鲜牡蛎软体部中水分的质量分数为70.91%~88.24%,与其他水产品相近,蛋白质为6.14%~11.29%,为牛奶的2~3倍[1-3]。人体必需的氨基酸、亚麻酸和亚油酸等多不饱和脂肪酸在牡蛎中含量丰富,钙、铁、锌、硒的含量高于禽畜肉类[3]。
多糖是由超过10个单糖(同种或者不同种)以糖苷键衔接而成的链状结构的生物活性分子。多糖的分布广泛,近年来,多糖因具有抗氧化、抑菌、免疫调节、抗炎、降血糖、抗病毒等独特的生物学功能而备受人们关注[4-6]。随着工业的发展,在食药、化工等领域多糖都已被广泛应用。因此,对多糖结构的研究有助于进一步认识和提高多糖在各领域的应用。
牡蛎多糖具有免疫调节、抗肿瘤以及护肝等生物活性[7],其通过T淋巴细胞介导免疫应答,从而参与机体的免疫反应[8],还有研究指出牡蛎多糖可以减轻5-氟尿嘧啶引起的肠炎症和营养不良,从而改善肿瘤患者的肠道环境[9]。然而,目前对牡蛎多糖的结构特征和理化特性研究较少。牡蛎国内国际市场巨大,是食品和医药行业应用的重要原料。因此,本研究以近江牡蛎为原料提取多糖,采用高效凝胶渗透色谱、高效液相色谱、红外光谱对2种多糖进行结构表征,并对获得的牡蛎多糖进行热稳定性和流变特性研究。最后,对牡蛎多糖的体外抗氧化能力进行了研究,为牡蛎多糖的进一步开发利用提供了依据,具有重要的意义。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
近江牡蛎,产自福建省漳州市漳浦县。丙酮、四氯化碳、正丁醇、甲醇、溴化钾,广州化学试剂厂;菠萝蛋白酶、碱性蛋白酶、牛血清白蛋白、考马斯亮蓝G-250、DPPH、ABTS,北京博奥拓达科技有限公司;苯酚、磷酸、过硫酸钾、硫酸亚铁、水杨酸、氯化亚铁、菲啰嗪,福晨(天津)化学试剂有限公司;1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)、单糖,上海源叶生物科技有限公司。
1.1.2 仪器与设备
LC-20高效液相凝胶渗透色谱、LC-20AD高效液相色谱,日本Shimadzu(岛津)公司;S-3400N钨丝灯扫描电子显微镜,日本日立公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;Nicolet is50傅里叶变换红外光谱仪、旋转流变仪,赛默飞世尔科技(中国)有限公司;SDT 650热重与差热同步热分析仪,美国TA仪器有限公司。
1.2 牡蛎多糖的制备
取新鲜牡蛎肉50 g,经粉碎后形成匀浆,加入去离子水,并将pH调节至10,在55 ℃下水浴3 h进行提取,过滤后进行离心。弃去离心产生的沉淀后,将上层清液通过减压进行浓缩,加入4倍体积无水乙醇,醇沉24 h。3 500 r/min离心20 min,取沉淀,用95%(体积分数)乙醇、无水乙醇、丙酮(过夜)分别进行2次洗涤。在提取液中加入10倍体积水溶解,调pH至5.5,加入0.2%菠萝蛋白酶,50 ℃酶解3 h,再调pH至8.5,加入1%碱性蛋白酶,55 ℃酶解4 h。将水溶液90 ℃水浴10 min,灭活菠萝蛋白酶和碱性蛋白酶。在酶解液中加入体积比为4∶1的四氯化碳、正丁醇(Sevage液),振荡15 min,离心弃去沉淀,重复多次至不再产生白色絮状沉。于37 ℃烘箱烘干,即得牡蛎多糖(oyster polysaccharide,OPS)。采用苯酚-硫酸法[10]对总糖含量进行测定。采用考马斯亮蓝法[10]对蛋白质含量进行测定。
1.3 多糖的分子质量测定
通过高效液相凝胶渗透色谱(high performance liquid gel permeation chromatography,HAGPC)对牡蛎多糖的分子质量进行分析[11]。色谱条件:色谱柱:TSKgel GMPWXL 水相凝胶色谱柱;流动相:0.1 mol/L NaNO3和0.06% NaN3溶液(流速0.6 mL/min;柱温35 ℃)。采用窄分布聚乙二醇(polyethylene glycol,PEG)(分子质量:903 000、580 000、146 000、44 200、1 000、600 Da)进样得到色谱图,以PEG为标样绘制标准曲线。将多糖样品进样后测得保留时间,根据曲线方程计算牡蛎多糖样品的相对分子质量。
1.4 多糖的单糖组成测定
对PMP衍生化多糖水解物法进行些许修改[12]。向5.0 mg样品中加入3.0 mL 2 mmol/L三氟乙酸(trifluoroacetic acid,TFA)混匀,并在120 ℃环境下酸解1 min。取多糖样品酸水解产物250 μL,依次加入250 μL 0.6 mol/L NaOH、500 μL 0.4 mol/L PMP-甲醇溶液。采用高效液相色谱法对衍生物进行测定,测试条件为:岛津LC-20AD;色谱柱(Xtimate C18 4.6 mm×200 mm,5 μm);柱温(30 ℃);流速(1.0 mL/min);检测波长(250 nm);进样量(20 μL);流动相[0.05 mol/mL磷酸二氢钾溶液(用氢氧化钠溶液调pH为6.70)∶乙腈=83∶17(体积比)]。依据各单糖标准品对应衍生物色谱图的峰面积和各单糖标准品的摩尔浓度,依据多糖水解样品衍生物在色谱中的出峰时间判断其单糖组成,依据多糖水解样品衍生物在色谱中的峰面积和计算得出的各单糖含量百分比。
1.5 多糖的紫外可见光谱和红外光谱分析
在5.0 mL去离子水中充分溶解5.0 mg牡蛎多糖样品,配制成1.0 mg/mL多糖水溶液,使用去离子水进行调零后,在紫外可见分光光度计上于200~600 nm波长进行紫外波长扫描。
称取2 mg牡蛎多糖样品与200 mg KBr(光谱级)充分研磨成细腻粉末,多糖-KBr粉末混合均匀后,将混合粉末使用压片机压制成质密透明薄片,通过傅里叶变换红外光谱仪在波数400~4 000 cm-1进行红外光谱扫描。
1.6 多糖的三股螺旋结构分析
根据PAN等[13]的方法稍作修改,取1.0 mL 1.0 mg/mL牡蛎多糖样品溶液,依次加入等体积0.2 mmol/L刚果红溶液和2.0 mL NaOH溶液(0~0.5 mol/L)。将混合液混合均匀后静置10 min,进行紫外全波长扫描,波长400~600 nm。分别采集并记录在不同浓度NaOH溶液中的最大吸收波长。
1.7 多糖的扫描电镜分析
使用双面胶将少量牡蛎多糖样品粉末固定在样品台上后进行喷金处理,使用钨丝灯扫描电子显微镜,在加速电压为5.00 kV放大1 000倍和5 000倍进行牡蛎多糖表面图像采集。
1.8 多糖的热重分析
取10 mg牡蛎多糖,以N2气体作为样品的保护气体,以10 ℃/min的升温速率进行升温,通过热重与差热同步热分析仪采集从室温到800 ℃的热失重数据和差示扫描量热法数据(differential scanning calorimetry,DSC)。
1.9 多糖的流变特性分析
用去离子水将牡蛎多糖样品配制成OPS溶液(0.5%、1.0%、2.0%,质量分数)加入到旋转流变仪(探头直径40 mm;间隙为0.5 mm)对样品的稳态剪切黏度进行测试,温度为25 ℃,剪切速率为0.1~100 s-1。
1.10 多糖的抗氧化活性测定
1.10.1 DPPH自由基清除活性测定
DPPH自由基清除能力测定参照MA等[14]的方法进行稍微修改。将牡蛎多糖溶液(0~0.5 mg/mL)与0.2 mmol/L DPPH-无水乙醇溶液等体积混合并摇晃均匀,放置于暗室中反应30 min。用紫外分光光度计测其517 nm处波长,以无水乙醇作为空白对照,每个处理重复3次实验。DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A1为样品溶液的吸光度;A2为无水乙醇替代DPPH-无水乙醇溶液的吸光度;A0为去离子水替代样品溶液的吸光度。
1.10.2 ABTS阳离子自由基清除活性测定
ABTS阳离子自由基清除能力测定是由LIAO等[15]的方法进行稍微修改。以2.45 mmol/L K2S2O4溶液为溶剂,配制7 mmol/L ABTS溶液,于暗室静置12~16 h。用去离子水将混合液的734 nm处吸光度值调至0.700± 0.020。将牡蛎多糖溶液(0~5.0 mg/mL)与稀释后的ABTS溶液按照1∶4(体积比)混合,于734 nm处测其吸光度值,每个处理重复3次实验。ABTS阳离子自由基清除率计算如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
式中:A1为样品溶液的吸光度值;A2为去离子水替代ABTS溶液的吸光度值;A0为去离子水替代样品溶液的吸光度值。
1.10.3 自由基清除活性测定
羟自由基清除能力测定是由XU等[16]的方法稍加修改。将牡蛎多糖溶液(0~5.0 mg/mL)中加入等体积FeSO4溶液(6 mmol/L),水杨酸-乙醇溶液(6 mmol/L),过氧化氢溶液(6 mmol/L),摇晃均匀后于37 ℃反应30 min。在510 nm处测其吸光度值,每个处理重复3次实验。羟自由基清除率计算如公式(3)所示:
羟自由基清除率![]()
(3)
式中:A1为样品溶液的吸光度值;A2为去离子水替代H2O2溶液的吸光度值;A0为去离子水替代样品的吸光度值。
1.10.4 亚铁离子螯合能力测定
亚铁离子螯合能力测定是由MENG等[17]的方法进行稍微修改。2.0 mL牡蛎多糖溶液(0~5.0 mg/mL)中依次加入0.1 mL 2 mmol/L FeCl2溶液、3.7 mL去离子水、0.2 mL 5 mmol/L菲咯嗪溶液,混匀后于室温静置10 min,测其于562 nm处吸光度值,每个处理重复3次实验。亚铁离子螯合能力计算如公式(4)所示:
亚铁离子螯合能力![]()
(4)
式中:A1为样品溶液的吸光度值;A2为去离子水替代氯化亚铁溶液的吸光度值;A0为去离子水替代多糖样品的吸光度值。
1.11 统计分析
使用SPSS 22.0软件对数据进行统计学分析,并用Origin 2019软件绘图。
2 结果与分析
2.1 多糖的化学组成、分子质量、单糖组成及表面结构
由表1可知OPS的总糖含量为(69.21±0.97)%,蛋白质含量为(0.15±0.04)%,OPS的总糖含量大于50%,表明OPS为较纯的多糖。OPS的平均分子质量为623.24 kDa。杨大俏等[15]制备出的牡蛎多糖分子质量为8.3~124.5 kDa,这可能是由于在对多糖提取时使用了滤膜进行分离,导致分子质量低于本研究中OPS的分子质量。在OPS中葡萄糖含量为95.35%,而其他单糖的含量均不足1%,其中甘露糖∶核糖∶半乳糖∶木糖∶阿拉伯糖∶岩藻糖=0.309∶0.496∶0.299∶0.256∶0.542∶0.391。因此,OPS主要是以葡萄糖构成的。李世杰[7]研究也同样发现牡蛎多糖主要由葡萄糖组成,与本文中OPS的单糖组成相似。
2.2 多糖的紫外可见光谱和红外光谱分析
由图1可知,在紫外光谱波长为260、280、420 nm时,OPS不具有紫外吸收峰。这说明OPS中不含有核酸、蛋白质以及多肽,这一结果与蛋白质含量结果相符合。
由图2可知,OPS在400~4 000 cm-1也具有典型的多糖特征吸收。3 389 cm-1的吸收峰主要是由于O—H的拉伸振动,2 931 cm-1以及1 416 cm-1的强吸收峰分别代表多糖亚甲基的C—H拉伸振动和糖环上携带的C—H振动。1 647 cm-1强吸收峰为C![]() O振动。1 000~1 200 cm-1为C—O—C和吡喃糖环结构的吸收峰。1 022 cm-1处有强吸收峰,这个吸收峰对应为葡萄糖,此结果与单糖组成结果相一致。931 cm-1显示OPS具有β-构型。由此可以看出OPS主要是以β-糖苷键链接而成的D-葡聚糖。
O振动。1 000~1 200 cm-1为C—O—C和吡喃糖环结构的吸收峰。1 022 cm-1处有强吸收峰,这个吸收峰对应为葡萄糖,此结果与单糖组成结果相一致。931 cm-1显示OPS具有β-构型。由此可以看出OPS主要是以β-糖苷键链接而成的D-葡聚糖。
表1 OPS的化学组成、分子质量及单糖组成
Table 1 Chemical composition, molecular weight, and monosaccharide composition of OPS
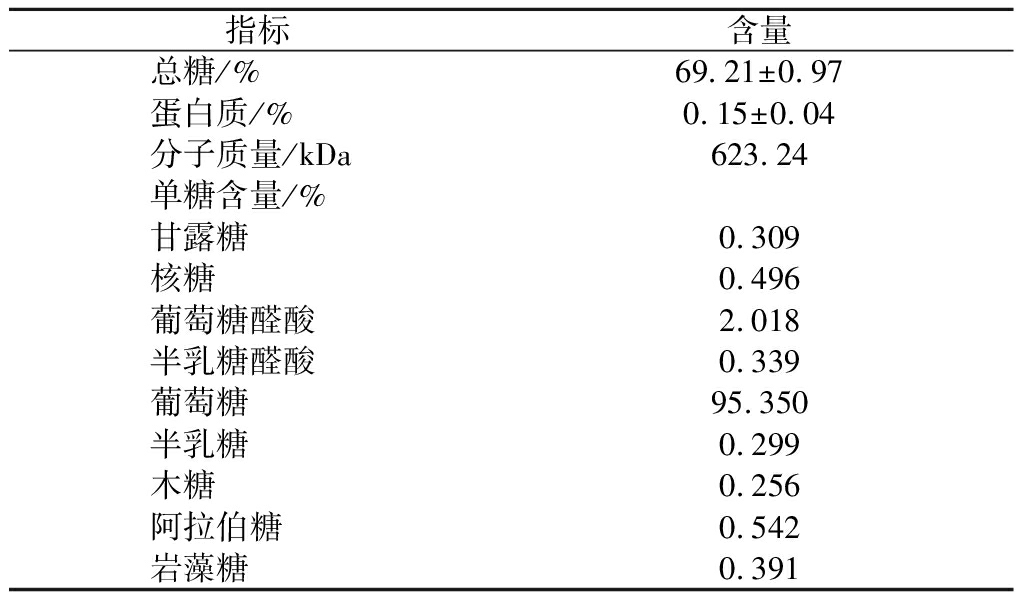
指标含量总糖/%69.21±0.97蛋白质/%0.15±0.04分子质量/kDa623.24 单糖含量/%甘露糖0.309核糖0.496葡萄糖醛酸2.018半乳糖醛酸0.339葡萄糖95.350半乳糖0.299木糖0.256阿拉伯糖0.542岩藻糖0.391
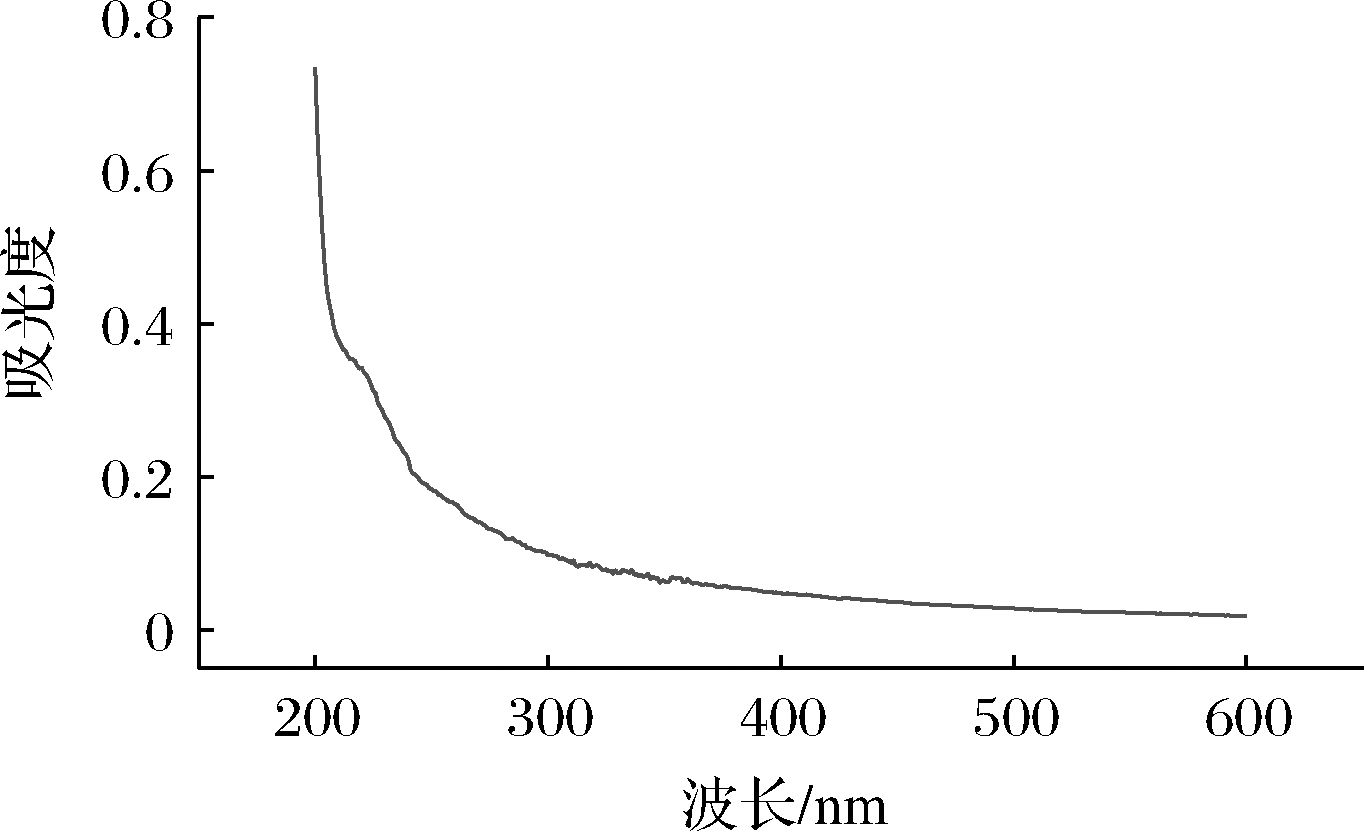
图1 OPS的紫外可见光谱
Fig.1 UV-Vis spectrum of OPS
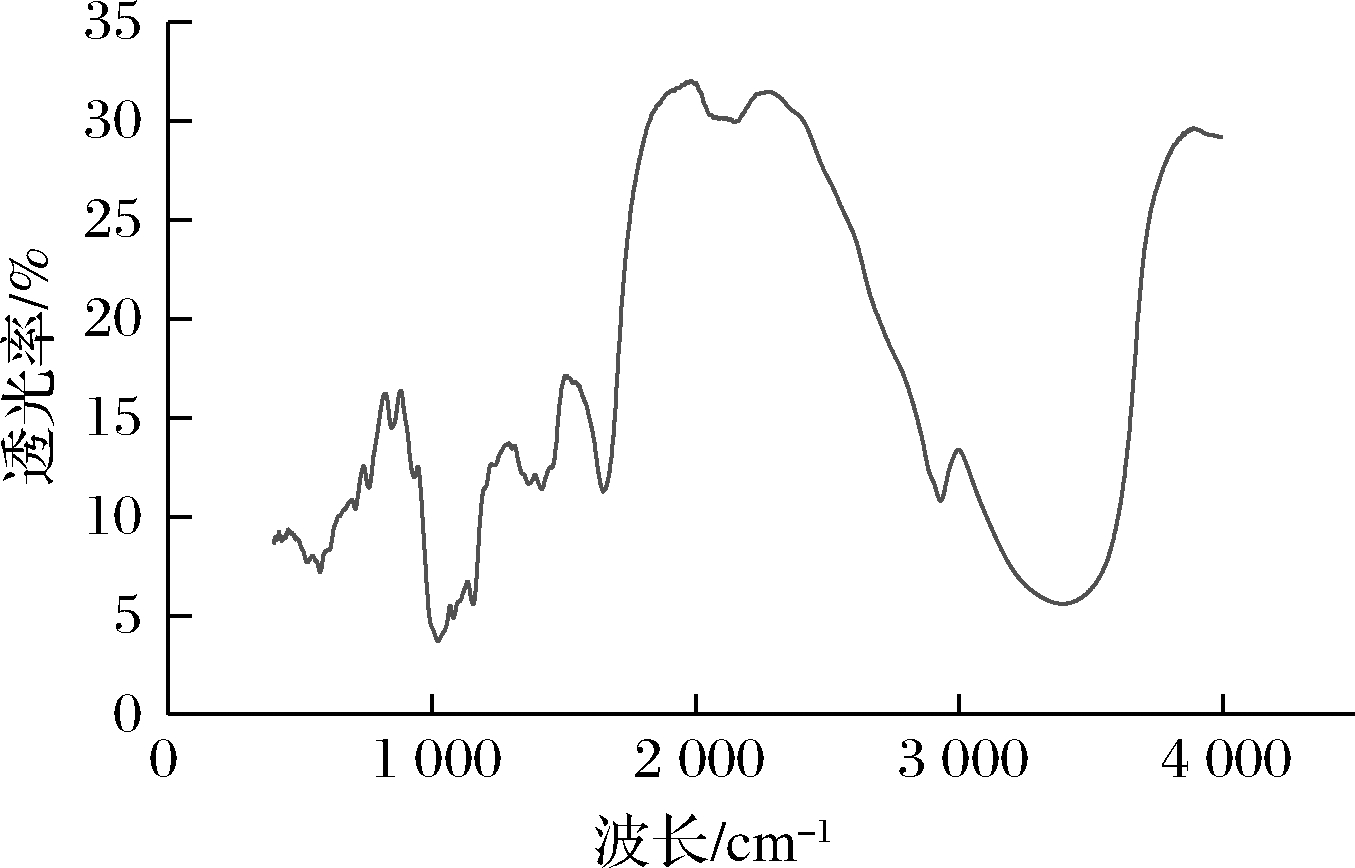
图2 OPS的红外光谱
Fig.2 Infrared spectrum of OPS
2.3 多糖的三股螺旋结构分析
由图3可知,在NaOH溶液浓度小于0.4 mol/L时,OPS与刚果红混合液的紫外吸收波长会随着NaOH溶液的浓度升高而增大,在该NaOH溶液浓度范围内,随着溶液的碱性增强,多糖的3股螺旋结构变为有序的状态,且OPS的3股螺旋结构会与刚果红络合,λmax会升高,OPS与刚果红混合液会产生红移现象。因此,可以证实OPS具有3股螺旋结构[19]。

图3 OPS的三股螺旋结构分析
Fig.3 Analysis of three strand spiral structure of OPS
2.4 多糖的扫描电子显微镜分析
由图4可知,在1 000倍镜下,OPS的表面粗糙,带有碎屑物。在经过5 000倍放大后可以观察到OPS的表面比较疏松,呈珊瑚状结构,这种结构可以极大地增加牡蛎多糖颗粒的表面积。

图4 OPS的不同放大倍数扫描电子显微镜图
Fig.4 Scanning electron microscope graph of OPS at different magnification
2.5 多糖的热重分析
由图5可知,OPS主要有3个热损失阶段。第一个损失阶段温度在25~200 ℃,质量损失大约达10%左右,此处有一个明显的失热重峰,大约在80 ℃左右,这可能是由于OPS水分的散失造成质量损失[20]。第二个损失阶段温度在200~450 ℃,质量损失达55%,此降解阶段的损失是由于OPS的化学结构降解,包括糖环脱水、解聚以及水和二氧化碳的形成[21]。第三个阶段在450~800 ℃,质量损失大约达7%左右,此阶段的损失可能是由于OPS样品碳化导致的[22]。OPS在整个过程中共损失72%,而在周蓉等[23]报道的黄枝瑚菌多糖在25~800 ℃质量损失93%,因此,OPS具有更好的热稳定性。
2.6 多糖的流变特性分析
由图6可知,OPS表现出典型的非牛顿流体特征,剪切速率在0.1~1 s-1内,随着剪切速率的增加,剪切应力增加,OPS的黏度显著降低,表现出剪切稀化行为。这是多糖分散体的常见行为,由于在剪切速率增大时,多糖溶液中无序的多糖沿着流动方向排列和/或多糖的分子间的连接遭到破坏,从而降低了溶液分散体系内的黏度。在溶液质量分数为0.5%时,溶液的黏度要大于质量分数为1.0%和2.0%的多糖溶液的黏度。在剪切速率为0.1 s-1时,0.5%(质量分数)OPS溶液的表观黏度为280 mPa·s。

图5 OPS的热重分析
Fig.5 Thermogravimetric analysis of OPS

图6 OPS溶液的表观黏度
Fig.6 Apparent viscosity of OPS solution
2.7 多糖的体外抗氧化活性
2.7.1 DPPH自由基清除能力
DPPH是一种稳定的以氮为中心的自由基,这种自由基具有不成对电子。由图7可知,OPS具有很强的DPPH自由基清除能力。在0~0.5 mg/mL,DPPH自由基的清除能力会随着OPS和维生素C浓度的升高而增强,但OPS的DPPH自由基清除率始终小于维生素C。当溶液的质量浓度为0.5 mg/mL时,OPS的DPPH自由基的清除能力最高为(63.10±0.18)%。OPS对DPPH自由基的半抑制浓度(IC50)为0.36 mg/mL,小于鱿鱼(3.93 mg/mL和2.05 mg/mL)[24]和鲍鱼(2.05 mg/mL)[25]对DPPH自由基的IC50值。
2.7.2 ABTS阳离子自由基清除能力
由图8可知,在OPS溶液质量浓度为0~5.0 mg/mL,ABTS阳离子自由基清除率会随溶液质量浓度升高而增加。当溶液的质量浓度为5 mg/mL时,OPS的ABTS阳离子自由基的清除能力最高,但小于维生素C的ABTS阳离子自由基的清除能力,其ABTS阳离子自由基的清除能力[(61.60±0.29)%]高于竹笋多糖(59.63%)[12]。OPS清除ABTS阳离子自由基的IC50为2.71 mg/mL,而GETACHEW等[26]研究中牡蛎多糖的DPPH自由基清除能力和ABTS阳离子自由基清除能力的IC50分别为9.60 mg/mL 和13.52 mg/mL,这可能是由于OPS具有更高的分子质量,表现出更强的生物活性[27]。

图7 OPS的DPPH自由基清除能力
Fig.7 DPPH radical scavenging capacity of OPS
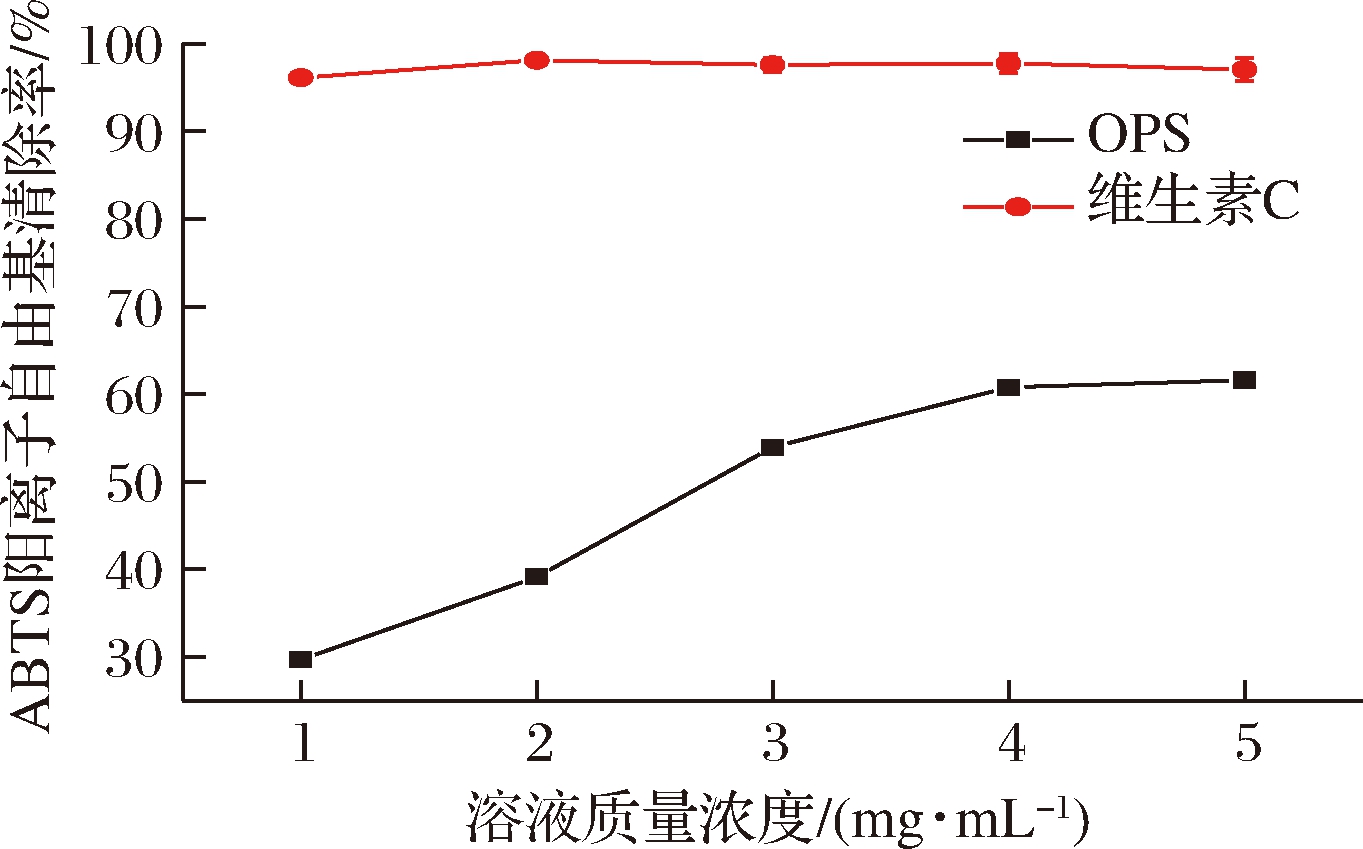
图8 OPS的ABTS阳离子自由基清除能力
Fig.8 ABTS cationic radical scavenging capacity of OPS
2.7.3 亚铁离子螯合能力
亚铁离子抗氧化的机制不是对自由基进行直接的清除,而是通过螯合离子间接抑制自由基的产生。由图9可知,在OPS质量浓度在0~5.0 mg/mL,亚铁离子的螯合能力会随着溶液质量浓度的升高而增强,但始终小于维生素C。在溶液质量浓度为5.0 mg/mL时,亚铁离子螯合能力最高,为(60.52±0.77)%。OPS亚铁离子螯合能力的IC50为4.15 mg/mL,而桑葚多糖的亚铁离子螯合能力的IC50为9.54 mg/mL[28],OPS的亚铁离子螯合能力强于桑葚多糖。
2.7.4 羟自由基清除能力
由于高活性的羟自由基可以与一些生物分子快速发生反应,这些反应可能会导致邻近的组织或器官造成严重的损害。由图10可知,当溶液的质量浓度为5 mg/mL时,OPS表现出最强的羟自由基的清除能力,其羟自由基的清除能力最高为(64.37±1.45)%,小于维生素C。OPS对于羟自由基清除能力的IC50为1.21 mg/mL,小于鱿鱼(3.38 mg/mL和3.05 mg/mL)[22]和鲍鱼(9.32 mg/mL)[25]对羟自由基的IC50值。

图9 OPS的亚铁离子螯合能力
Fig.9 Ferrous ion chelating capacity of OPS

图10 OPS的羟自由基清除率
Fig.10 Hydroxyl radical scavenging rate of OPS
3 结论
牡蛎多糖(OPS)是一种杂多糖,由葡萄糖、甘露糖、核糖、半乳糖、木糖、阿拉伯糖和岩藻糖组成,主要是葡萄糖,其含量为95.35%,而其他单糖的含量均不足1%。扫描电子显微镜下,OPS的表面比较疏松,呈珊瑚状结构。OPS存在糖类特征基团,具有吡喃环和三股螺旋结构。经热重分析得出OPS具有较好的热稳定性;样品溶液具有典型的剪切稀化行为,为非牛顿流体中的假塑性流体;且OPS溶液的黏度较大,可应用至食品增稠剂方面。OPS对DPPH自由基、ABTS阳离子自由基、亚铁离子螯合能力和羟自由基的半数抑制浓度(IC50值)分别为0.36、2.71、4.15、1.21 mg/mL,具有较好的抗氧化能力,可作为天然抗氧化剂。本研究可为OPS的热加工领域、增稠剂以及抗氧化剂等方面的运用提供依据。
[1] 姜画画, 王宁丽, 裴栋, 等.牡蛎肉营养成分分析及安全性评价[J].食品工业, 2018, 39(11):298-299.
JIANG H H, WANG N L, PEI D, et al.Nutrient analysis and safety evaluation of oyster meat[J].The Food Industry, 2018, 39(11):298-299.
[2] 朱怡静, 李琪, 张景晓, 等.5种壳色长牡蛎不同组织常规营养成分分析与评价[J].中国水产科学, 2018, 25(2):354-360.
ZHU Y J, LI Q, ZHANG J X, et al.Analysis and evaluation of nutrient composition in different tissues of Pacific oyster (Crassostrea gigas) with five shell colors[J].Journal of Fishery Sciences of China, 2018, 25(2):354-360.
[3] 方玲, 马海霞, 李来好, 等.华南地区近江牡蛎营养成分分析及评价[J].食品工业科技, 2018, 39(2):301-307;313.
FANG L, MA H X, LI L H, et al.Analysis and evaluation of nutrient composition in Ostrea rivularis from South China Sea coast[J].Science and Technology of Food Industry, 2018, 39(2):301-307;313.
[4] WANG L C, DI L Q, LI J S, et al.Elaboration in type, primary structure, and bioactivity of polysaccharides derived from mollusks[J].Critical Reviews in Food Science and Nutrition, 2019, 59(7):1 091-1 114.
[5] XIONG Q P, SONG Z Y, HU W H, et al.Methods of extraction, separation, purification, structural characterization for polysaccharides from aquatic animals and their major pharmacological activities[J].Critical Reviews in Food and Science and Nutrition, 2020, 60(1):48-63.
[6] CAO H.Polysaccharides from Chinese tea:Recent advance on bioactivity and function[J].International Journal of Biological Macromolecules, 2013, 62:76-79.
[7] 李世杰. 近江牡蛎多糖的纯化、结构鉴定、硒化及其生物活性研究[D].广州:广州中医药大学, 2017.
LI S J.The study of purification, structure identification, selenium modification and biological activity of polysaccharides from Ostrea rivularis Gould[D].Guangzhou:Guangzhou University of traditional Chinese Medicine, 2017
[8] 位迎雪, 宋春, 刘兴祖, 等.牡蛎多糖的提取与纯化[J].科学养鱼, 2020 (7):68-69.
WEI Y X, SONG C, LIU X Z, et al.Extraction, purification of oyster polysaccharides and its function[J].Scientific Fish Farming, 2020 (7):68-69.
[9] CAI B N, WAN P, CHEN H, et al.Composition characterization of oyster polysaccharides from Crassostrea hongkongensis and their protective effect against H2O2-induced oxidative damage in IEC-6 cells[J].International Journal of Biological Macromolecules, 2019, 124:246-254.
[10] HADIDI M, AMOLI P I, JELYANI A Z, et al.Polysaccharides from pineapple core as a canning by-product:Extraction optimization, chemical structure, antioxidant and functional properties[J].International Journal of Biological Macromolecules, 2020, 163:2 357-2 364.
[11] CHEN H Y, ZENG J S, WANG B, et al.Structural characterization and antioxidant activities of Bletilla striata polysaccharide extracted by different methods[J].Carbohydrate Polymers, 2021, 266:118149.
[12] CHEN G J, BU F, CHEN X H, et al.Ultrasonic extraction, structural characterization, physicochemical properties and antioxidant activities of polysaccharides from bamboo shoots (Chimonobambusa quadrangularis) processing by-products[J].International Journal of Biological Macromolecules, 2018, 112:656-666.
[13] PAN F, SU T J, LIU Y, et al.Extraction, purification and antioxidation of a polysaccharide from Fritillaria unibracteata var.wabuensis[J].International Journal of Biological Macromolecules, 2018, 112:1 073-1 083.
[14] MA Y L, SUN P, FENG J, et al.Solvent effect on phenolics and antioxidant activity of Huangshan Gongju (Dendranthema morifolium (Ramat) Tzvel.cv.Gongju) extract[J].Food and Chemical Toxicology, 2021, 147:111875.
[15] LIAO B Y, ZHU D Y, THAKUR K, et al.Thermal and antioxidant properties of polysaccharides sequentially extracted from mulberry leaves (Morus alba L.)[J].Molecules(Basel,Switerland), 2017, 22(12):2 271.
[16] XU S Q, ZHANG Y J, JIANG K.Antioxidant activity in vitro and in vivo of the polysaccharides from different varieties of Auricularia auricula[J].Food & Function, 2016, 7(9):3 868-3 879.
[17] MENG Q R, LI Y H, XIAO T C, et al.Antioxidant and antibacterial activities of polysaccharides isolated and purified from Diaphragma juglandis fructus[J].International Journal of Biological Macromolecules, 2017, 105:431-437.
[18] 杨大俏, 王锦旭, 李来好, 等.近江牡蛎多糖的结构鉴定及免疫调节能力分析[J].食品科学,2020, 41(10):38-46.
YANG D Q, WANG J X, LI L H, et al.Structural analysis and immunoregulatory activity of polysaccharides from Crassostrea rivularis[J].Food Science,2020, 41(10):38-46.
[19] GAO X, QI J Y, HO C T, et al. Purification, physicochemical properties, and antioxidant activities of two low-molecular-weight polysaccharides from Ganoderma leucocontextum fruiting bodies[J].Antioxidants(Basel,Switerland), 2021, 10(7):1 145.
[20] YU W S, CHEN H, XIANG Z H, et al.Preparation of polysaccharides from Ramulus mori, and their antioxidant, anti-inflammatory and antibacterial activities[J].Molecules(Basel,Switerland), 2019, 24(5):856.
[21] Y LMAZ T, TAVMAN
LMAZ T, TAVMAN  .Ultrasound assisted extraction of polysaccharides from hazelnut skin[J].Food Science and Technology International Ciencia y Tecnologia De Los Alimentos Internacional, 2016, 22(2):112-121.
.Ultrasound assisted extraction of polysaccharides from hazelnut skin[J].Food Science and Technology International Ciencia y Tecnologia De Los Alimentos Internacional, 2016, 22(2):112-121.
[22] AKHTAR H M S, RIAZ A, HAMED Y S, et al.Production and characterization of CMC-based antioxidant and antimicrobial films enriched with chickpea hull polysaccharides[J].International Journal of Biological Macromolecules, 2018, 118:469-477.
[23] 周蓉, 祝佳惠, 李玉芹, 等.黄枝瑚菌多糖提取工艺优化及其体外抗氧化活性研究[J].湘潭大学学报(自然科学版),2021, 43(4):35-44.
ZHOU R, ZHU J H, LI Y Q, et al. Extraction optimization of polysaccharides from Ramaria flava and its antioxidant activity[J].Journal of Xiangtan University (Natural Science Edition),2021, 43(4):35-44.
[24] 杨嘉梁, 陈小娥, 方旭波, 等.鱿鱼内脏多糖的分离纯化、理化性质及抗氧化活性研究[J].中国食品学报,2019, 19(4):116-124.
YANG J L, CHEN X E, FANG X B, et al.Studies on isolation, purification, characterization and antioxidant activity of polysaccharides extracted from squid viscera[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(4):116-124.
[25] 陈胜军, 刘先进, 杨贤庆, 等.鲍鱼内脏多糖分离纯化与抗氧化活性评价[J].南方农业学报,2019, 50(2):372-377.
CHEN S J, LIU X J, YANG X Q, et al.Isolation and purification of visceral polysaccharides from abalone and its antioxidant activity[J].Journal of Southern Agriculture,2019, 50(2):372-377.
[26] GÉTACHEW A T, LEE H J, CHO Y J, et al.Optimization of polysaccharides extraction from Pacific oyster (Crassostrea gigas) using subcritical water:Structural characterization and biological activities[J].International Journal of Biologiocal Macromolecules, 2019, 121(2):852-861.
[27] XU Z, LI X, FENG S L, et al.Characteristics and bioactivities of different molecular weight polysaccharides from camellia seed cake[J].Internatinal Journal of Biological Macromolecules, 2016, 91:1 025-1 032.
[28] 胡晓波, 汪小明, 完颜红影, 等.桑葚多糖的磷酸化修饰及其抗氧化活性研究[J].食品科技, 2022, 47(2):215-220.
HU X B, WANG X M, WANYAN H Y, et al.Phosphorylation modification and antioxidation activity of polysaccharides from mulberry[J].Food Science and Technology, 2022, 47(2):215-220.