‘蜂糖李’(Prunus salicina ‘Fengtang’)属于蔷薇科(Rosaceae)李属(Prunus)多年生落叶果树,是在贵州安顺镇宁发现并选育出来的中熟李新品种,属贵州特色水果,其果实皮薄多汁、清脆爽口、果大味甜、且风味酷似蜂蜜,因而深受消费者喜爱[1]。‘蜂糖李’是呼吸跃变型果实,其采收期通常集中在6~7月高温季节,常温贮藏极易软化和腐烂,严重影响果实的食用价值和商品价值。
果实软化是评价果实商品价值的重要指标之一,易受病原菌侵染,降低果实品质,缩短贮藏期及货架期[2]。果实软化是一个极其复杂的生理过程,主要是在多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲酯酶(pectin methylesterase,PME)、纤维素酶(cellulase,Cx)和β-半乳糖苷酶(β-galactosidase,β-Gal)等的作用下,构成细胞壁的果胶物质、纤维素、半纤维素和糖蛋白等物质被水解引起细胞壁结构的破坏和细胞间连接减少,导致细胞发生分离[3-4]。PG、PME、Cx、β-Gal、木葡聚糖内糖基转移酶(xyloglucan endotransglucosylase,XET)和α-L-阿拉伯呋喃糖苷酶(α-L-arabinofuranosidase,α-L-Af)是致使果实成熟软化的主要细胞壁降解酶[5-6]。细胞壁降解酶使得原果胶降解为可溶性果胶和果胶酸,纤维素溶解,从而降低果实硬度,加速果实软化[7]。因此,如何减缓果实软化是广大科研工作者一直关注的问题。
草酸(oxalic acid,OA)是一种由植物自身产生的小分子有机酸,广泛存在于植物各种组织器官中,对植物的多种代谢活动起着重要的调控作用[8]。研究表明,草酸处理可通过降低木瓜抗氧化酶活性、膜脂通透性和果皮的黄化速率,从而延缓木瓜的成熟衰老进程[9]。ZHENG等[10]采用5 mmol/L草酸溶液对采后芒果果实进行浸泡处理,发现草酸显著抑制果实硬度的下降、延缓可溶性固形物含量上升及可滴定酸含量的下降。李佩艳等[11]研究发现草酸处理能减轻桂七芒果的冷害,并维持较高的果实细胞壁降解酶活性和可溶性果胶含量。课题组前期研究发现,草酸处理能在一定程度上延缓‘蜂糖李’果实采后衰老和品质下降[12]。然而,草酸处理对采后李果实软化及细胞壁降解的影响尚不清楚。因此,本试验以‘蜂糖李’果实为试材,探究草酸处理对其常温贮藏过程中果实软化和细胞壁代谢的影响,以期为采后‘蜂糖李’果实贮藏保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
‘蜂糖李’果实于2019年6月17日采摘自贵州省镇宁县六马蜂糖李种植农民专业合作社果园(105.52 E,25.37 N),约8成熟,采后4 h内运回至贵州大学园艺实验室。
草酸、咔唑、半乳糖醛酸、蒽酮、葡萄糖、多聚半乳糖醛酸、氯化钠、乙二胺四乙酸为分析纯,贵州省格瑞恩科技有限公司;交联聚乙烯吡咯烷酮、果胶、溴麝香草酚蓝、巯基乙醇、乙酸、乙酸钠、对硝基-β-D-半乳糖苷、碳酸钠、羧甲基纤维素钠、3,5-二硝基水杨酸、乙醇等均为分析纯,贵州省赛兰博科技有限公司。植物木葡聚糖内转糖苷酶ELISA试剂盒,上海科顺生物科技有限公司。
1.2 仪器与设备
GY-4型硬度计,浙江托普云农科技股份有限公司;FA-2104型分析天平,上海良平仪器仪表有限公司;DK-98-II双列八孔电热恒温水浴锅,天津泰斯特仪器有限公司;2-JR冷冻离心机,美国TOMOS公司;UV752紫外分光光度计,上海佑科仪器有限公司;DW-HL678型超低温冰箱,成都川弘科生物技术有限公司。
1.3 实验方法
1.3.1 试验处理
挑选大小、色泽及成熟度一致、无病虫害和机械损伤的果实进行处理。将果实分为2组,每组180个果,重复3次。进行如下处理:一组在5 mmol/L(课题组前期筛选出的最佳浓度)的草酸溶液中浸泡10 min,另一组则浸泡蒸馏水10 min为对照(CK)。待果实自然晾干后于常温(25±1) ℃下贮藏20 d,贮藏期间分别于0、4、8、12、16、20 d取样,果肉用液氮速冻后,置于-80 ℃保存备用。
1.3.2 硬度的测定
每组随机选取10个果实,在果实赤道部位均匀选取3个点,去皮(约1 mm),用硬度计 (探头直径3.5 mm,测定深度10 mm) 进行测定,取平均值,结果以kg/cm2表示。
1.3.3 纤维素含量的测定
纤维素含量参考曹建康等[13]的方法,采用蒽酮比色法测定。测定620 nm的处吸光度,结果以mg/g表示。
1.3.4 原果胶和水溶性果胶含量的测定
原果胶含量参考曹建康等[13]的方法,采用咔唑比色法测定。以半乳糖醛酸质量为横坐标,吸光度值为纵坐标,制作标准曲线。测定530 nm处的吸光度值,结果以mg/g表示。
可溶性果胶含量参考曹建康等[13]的方法,采用咔唑比色法进行测定,沸水浴1 h以水解原果胶。测定530 nm处吸光度值,结果以mg/g表示。
1.3.5 细胞壁降解酶活性的测定
PG活性的测定参考曹建康等[13]的方法,稍作修改。以葡萄糖质量为横坐标,吸光度值为纵坐标,绘制标准曲线。向反应体系中加入1.5 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)终止反应,煮沸5 min,冷却至室温后,定容到25 mL,测定540 nm处吸光度值。结果以mg/(h·g)表示。
PME活性的测定参考曹建康等[12]的方法,稍作修改。反应液包括0.1 mL的酶液、2 mL 0.5%果胶溶液、0.15 mL 0.01%溴麝香酚兰,反应2 min后测定620 nm处吸光度值,表示为mg/(h·g)。
Cx活性的测定参考曹建康等[13]的方法。标准曲线的制作方法同PG,Cx活性以羧甲基纤维素为底物利用比色法进行测定,结果表示为mg/(h·g)。
β-Gal活性的测定参考曹建康等[13]的方法,采用二硝基水杨酸法进行测定,以每小时每克鲜样水解释放对硝基苯-β-D-半乳糖苷产生1 μmol对硝基酚量表示,结果表示为μmol/(h·g)。
α-L-Af活性的测定参考曹建康等[13]的方法,采用对硝基半乳糖苷水解法进行测定,以每小时每克鲜样水解生成1 nmol对硝基酚量表示,结果表示为nmol/(h·g)。
XET活性的测定,按照植物木葡聚糖内转糖苷酶ELISA试剂盒的方法步骤进行测定。
1.4 数据统计与分析
采用Microsoft Excel 2010软件对数据进行统计整理,利用SPSS 20.0软件进行显著性分析 (P<0.05表示差异显著),并利用Origin 2021软件作图。
2 结果与分析
2.1 外源草酸处理对‘蜂糖李’果实硬度的影响
硬度是评价果实软化最直观的指标。如图1所示,在整个贮藏期间,‘蜂糖李’果实的硬度总体呈下降趋势,对照和草酸处理组果实硬度变化幅度不同,草酸处理组果实的硬度高于对照组 (P<0.05)。贮藏20 d时,草酸处理组硬度为对照组的1.53倍。说明草酸处理有效减缓了果实硬度的下降速度,一定程度上延缓了‘蜂糖李’果实的软化进程。
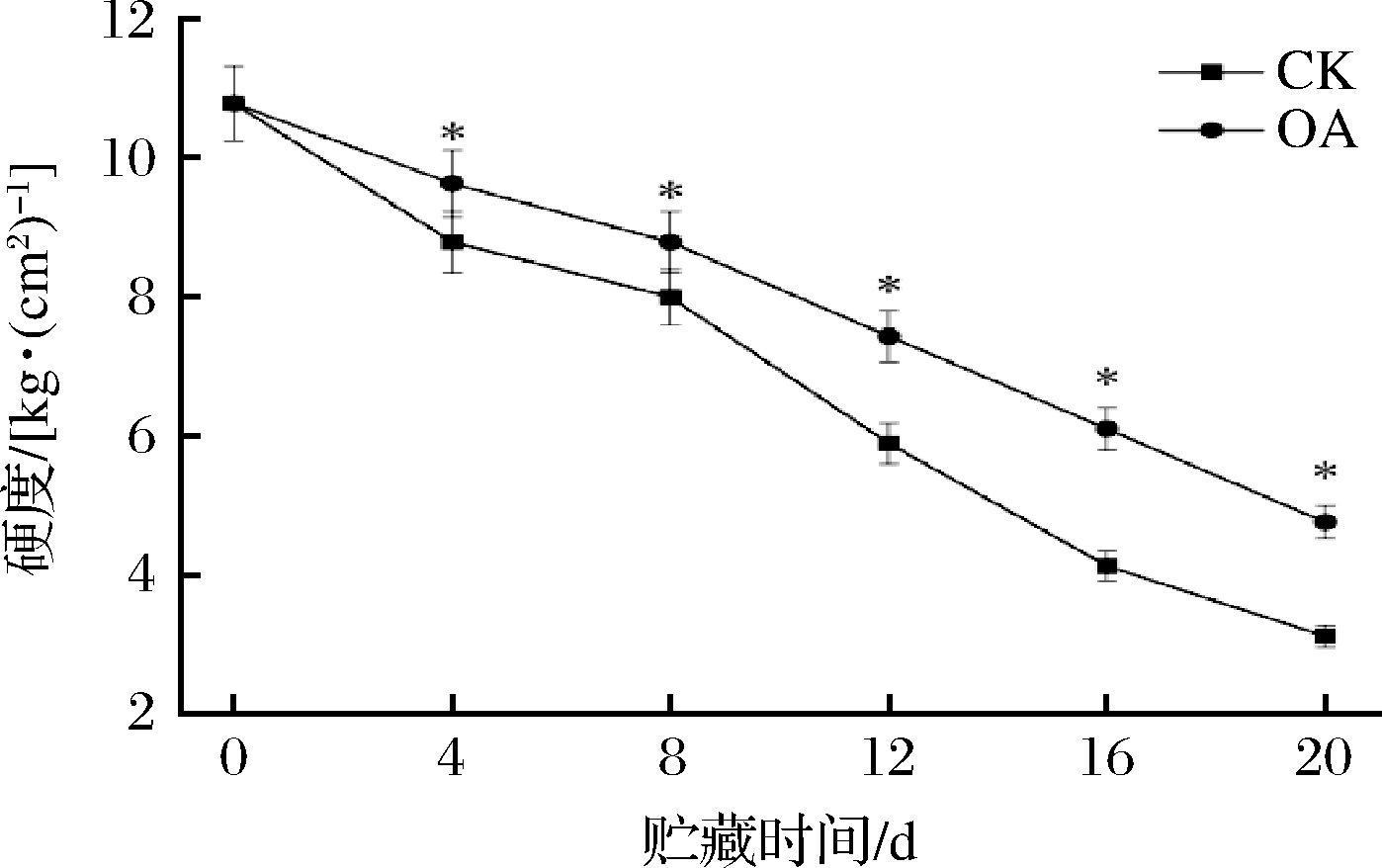
图1 外源草酸对‘蜂糖李’果实硬度的影响
Fig.1 Effects of exogenous oxalic acid treatment on firmness of ‘Fengtang’ plum fruit
注:*表示P<0.05水平显著性差异(下同)
2.2 外源草酸处理对‘蜂糖李’果实细胞壁组分的影响
2.2.1 外源草酸处理对‘蜂糖李’果实原果胶含量的影响
果胶参与细胞壁分子间的相互作用,其主要存在于初生细胞壁和中胶层,在果实后熟软化过程中,原果胶会被相关酶水解成可溶性果胶,导致细胞壁结构被破坏[14]。如图2-A所示,对照和草酸处理组果实原果胶含量变化明显,均呈逐渐下降的变化趋势。贮藏前4 d,对照组果实原果胶含量迅速下降,而处理组果实原果胶含量则缓慢下降。贮藏第20天时草酸处理组的原果胶含量是对照组的1.94倍,草酸处理组果实原果胶含量高于对照组 (P<0.05)。在整个贮藏过程中,草酸处理组果实原果胶含量始终低于对照组,说明草酸处理可以有效延缓‘蜂糖李’果实中原果胶的降解。
2.2.2 外源草酸处理对‘蜂糖李’果实可溶性果胶含量的影响
如图2-B所示,对照组和草酸处理组果实的可溶性果胶含量均呈先上升后下降的趋势,贮藏12 d达到峰值,对照组可溶性果胶含量是草酸处理组的1.30倍,贮藏后期缓慢下降。贮藏20 d时,对照组可溶性果胶含量是草酸处理组的1.15倍。在整个贮藏期间,草酸处理组可溶性果胶含量始终低于对照组 (P<0.05),说明草酸处理可以延缓可溶性果胶含量的上升。

A-原果胶含量;B-可溶性果胶含量
图2 外源草酸对‘蜂糖李’果实原果胶和可溶性果胶含量的影响
Fig.2 Effects of exogenous oxalic acid treatment on content of protopectin and water soluble pectin in‘Fengtang’ plum fruit
2.2.3 外源草酸处理对‘蜂糖李’果实纤维素含量的影响
纤维素是构成果实细胞壁的重要组分之一,纤维素的分解会加快果实变软。如图3所示,2组果实纤维素含量随着贮藏时间的延长而下降。草酸处理组果实的纤维素含量高于对照组(P<0.05)。贮藏20 d时,草酸处理组纤维素含量是对照组的1.44倍。说明草酸处理可有效延缓‘蜂糖李’果实中纤维素降解。
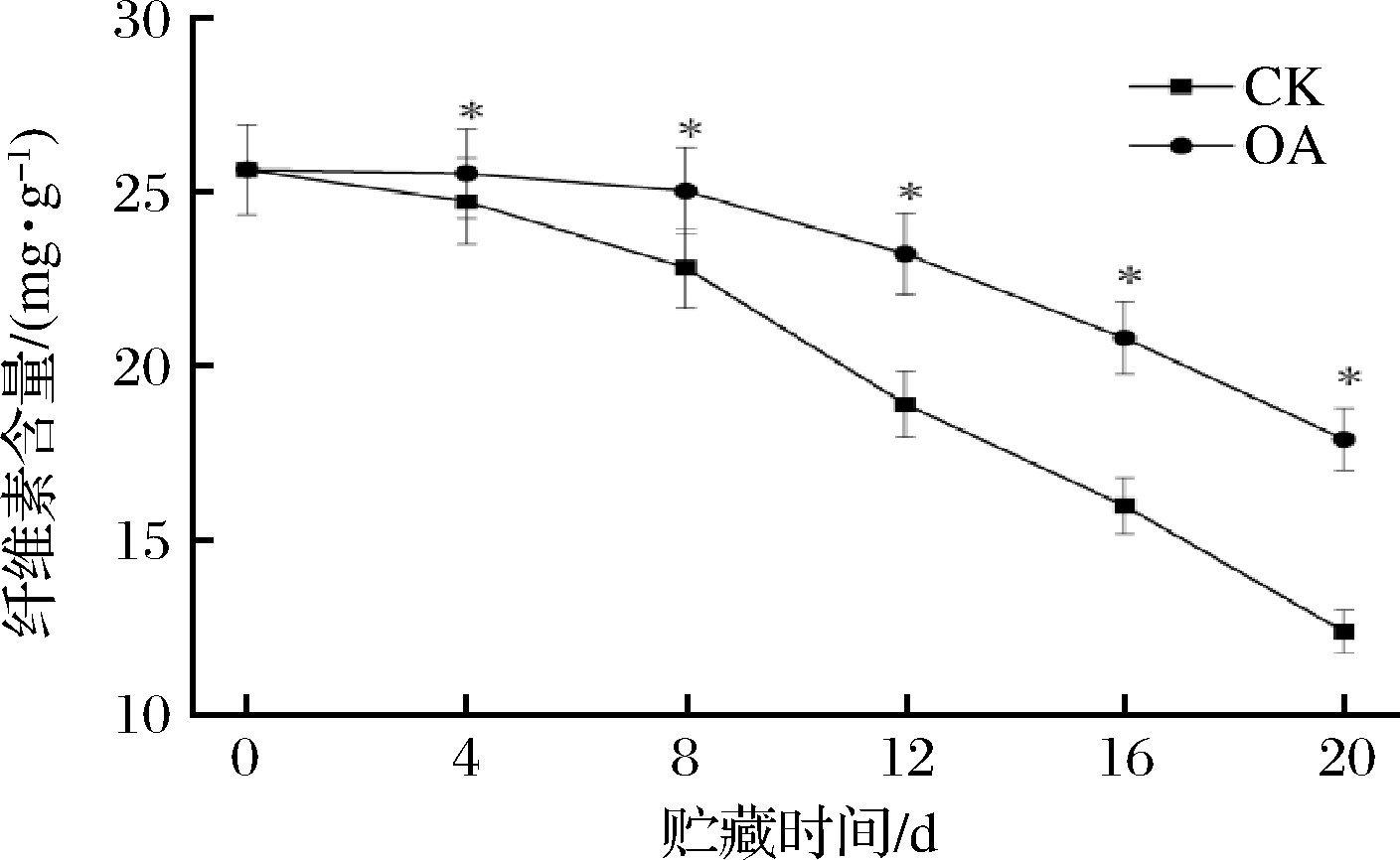
图3 外源草酸对‘蜂糖李’果实纤维素含量的影响
Fig.3 Effects of exogenous oxalic acid treatment on cellulose content of ‘Fengtang’ plum fruit
2.3 外源草酸处理对‘蜂糖李’果实细胞壁降解酶活性的影响
2.3.1 外源草酸处理对‘蜂糖李’果实中PG、PME、Cx和β-Gal活性的影响
如图4-A所示,‘蜂糖李’果实PG活性与可溶性果胶含量变化趋势相似,呈先上升后下降的趋势,在整个贮藏期间,草酸处理组的PG活性低于对照组 (P<0.05)。贮藏0~12 d,2组果实的PG活性都快速上升,并在12 d达到峰值,对照组PG活性是草酸处理组的1.12倍,随后PG活性缓慢下降。贮藏20 d时,对照组PG活性是草酸处理组的1.11倍。说明草酸处理可以延缓PG活性的上升。结合图2-A、图2-B可知,草酸处理的果实可溶性果胶含量显著低于对照组,其原因可能是通过提高PG活性加速对细胞壁中果胶物质的降解,使得可溶性果胶含量不断提高,原果胶含量降低,进而破坏细胞壁的组成成分,加快果实的软化。
如图4-B所示,‘蜂糖李’果实中PME活性呈先上升后下降的趋势,草酸处理组果实PME活性低于对照组 (P<0.05)。贮藏12 d时出现峰值,对照组PME活性是草酸处理组的1.20倍,随后PME活性缓慢下降,贮藏20 d时,对照组PME活性是草酸处理组的1.38倍。说明草酸处理能够有效抑制‘蜂糖李’果实中PME活性。
如图4-C所示,草酸处理组与对照组果实中Cx活性变化明显,均呈上升趋势。在贮藏0~8 d,草酸处理组与对照组Cx活性缓慢上升。贮藏12~20 d对照组果实Cx活性迅速上升,而草酸处理组仍缓慢上升。贮藏20 d时对照组Cx活性是草酸处理组的1.92倍。说明草酸能抑制‘蜂糖李’果实中Cx活性,减少对细胞壁结构的破坏,从而延缓果实软化。
如图4-D所示,‘蜂糖李’果实的β-Gal活性与Cx活性变化趋势相似。随着贮藏时间的延长,果实中β-Gal活性逐渐上升,在贮藏0~4 d草酸处理组和对照组β-Gal活性变化不明显,贮藏20 d时对照组β-Gal活性是草酸处理组的1.44倍,对照组果实β-Gal活性高于草酸处理组 (P<0.05)。说明草酸处理显著抑制了‘蜂糖李’果实β-Gal活性。

A-PG活性;B-PME活性;C-Cx活性;D-β-Gal活性
图4 外源草酸对‘蜂糖李’果实PG、PME、Cx和β-Gal活性的影响
Fig.4 Effects of exogenous oxalic acid treatment on the activities of PG, PME, Cx, and β-Gal in ‘Fengtang’ plum fruit
2.3.2 外源草酸处理对‘蜂糖李’果实中 XET和 α-L-Af活性的影响
如图5-A所示,对照和草酸处理‘蜂糖李’果实XET活性在整个贮藏期内均逐渐升高,但草酸处理组果实XET活性在贮藏4~20 d低于对照果实 (P<0.05)。贮藏20 d时,对照组XET活性是草酸处理组的1.32倍。说明草酸处理可有效延缓XET活性上升,维持 ‘蜂糖李’果实细胞壁的完整性。
如图5-B所示,随着贮藏时间的延长,草酸处理组和对照组‘蜂糖李’果实中α-L-Af活性均逐渐上升。对照组果实α-L-Af活性全程上升速度快于草酸处理组 (P<0.05)。在贮藏20 d后,对照组α-L-Af活性是草酸处理组的1.51倍。说明草酸处理有效抑制‘蜂糖李’果实中α-L-Af活性。
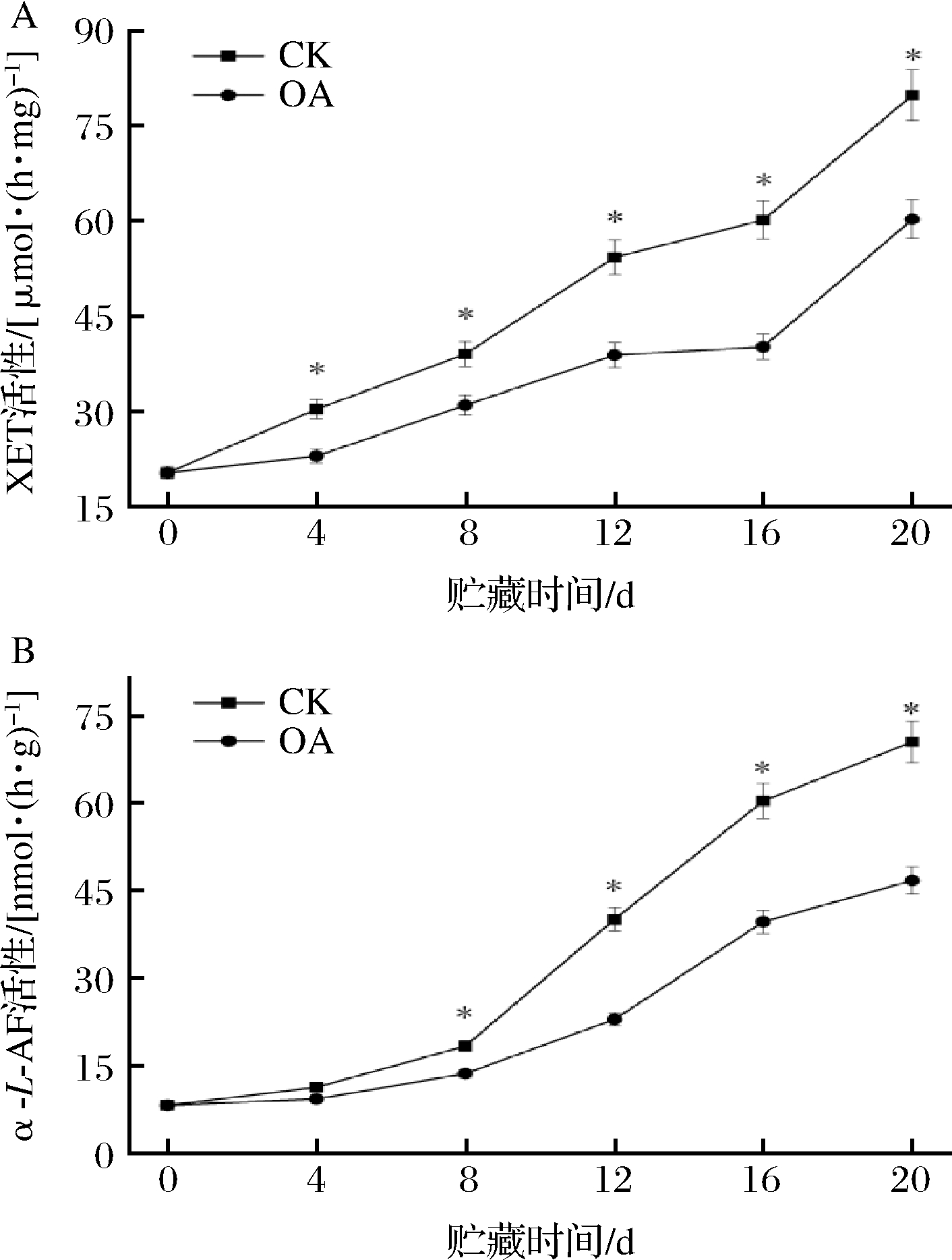
A-XET活性;B-α-L-Af活性
图5 外源草酸对‘蜂糖李’果实XET和α-L-Af活性的影响
Fig.5 Effects of exogenous oxalic acid treatment on the activities of XET and α-L-Af in ‘Fengtang’ plum fruit
2.4 ‘蜂糖李’果实硬度、细胞壁组分含量和细胞壁降解酶活性的相关性分析
由表1可知,在贮藏过程中,‘蜂糖李’果实硬度与细胞壁组分含量及其细胞壁降解酶活性之间有密切相关性。果实硬度与原果胶含量呈极显著正相关,与纤维素含量也呈极显著正相关,而与可溶性果胶含量呈极显著负相关;果实硬度与Cx、β-Gal、XET和α-L-Af活性则呈极显著负相关,与PME活性无相关性 (P>0.05)。说明原果胶和纤维素含量对于维持果实的硬度具有重要作用,PME对‘蜂糖李’果实软化的贡献不大,Cx、β-Gal、XET和α-L-Af共同作用于细胞壁,破坏细胞壁结构,导致果实硬度下降。
在整个贮藏过程中,‘蜂糖李’果实细胞壁组分含量与细胞壁降解酶活性密切相关。原果胶含量与Cx、β-Gal、XET和α-L-Af活性均呈极显著负相关;可溶性果胶含量与PG、PME 活性呈极显著正相关。纤维素含量与Cx、β-Gal、XET和α-L-Af活性均呈极显著负相关。由此表明,‘蜂糖李’果实中果胶物质的降解与细胞壁降解酶活性的变化密切相关。
3 讨论与结论
果实硬度主要取决于果实细胞壁结构的完整性和构成细胞紧凑的程度,其中构成细胞壁的果胶和纤维素的含量及其存在形态起着关键作用[15]。在果实
表1 ‘蜂糖李’果实硬度、细胞壁组分及细胞壁降解酶活性之间的相关性
Table 1 Correlation analysis of fruit firmness, cell wall components, and cell wall degrading enzyme activities of ‘Fengtang’ plum
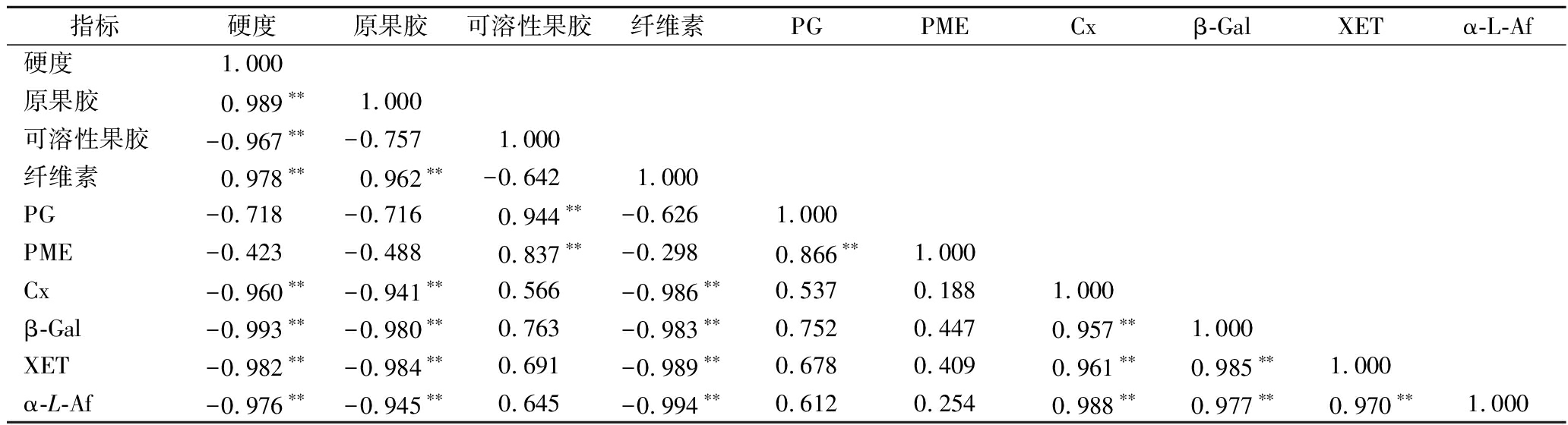
指标硬度原果胶可溶性果胶纤维素PGPMECxβ-GalXETα-L-Af硬度1.000原果胶0.989∗∗1.000可溶性果胶-0.967∗∗-0.7571.000纤维素0.978∗∗0.962∗∗-0.6421.000PG-0.718-0.7160.944∗∗-0.6261.000PME-0.423-0.4880.837∗∗-0.2980.866∗∗1.000Cx-0.960∗∗-0.941∗∗0.566-0.986∗∗0.5370.1881.000β-Gal-0.993∗∗-0.980∗∗0.763-0.983∗∗0.7520.4470.957∗∗1.000XET-0.982∗∗-0.984∗∗0.691-0.989∗∗0.6780.4090.961∗∗0.985∗∗1.000α-L-Af-0.976∗∗-0.945∗∗0.645-0.994∗∗0.6120.2540.988∗∗0.977∗∗0.970∗∗1.000
注:**表示极显著相关 (P<0.01)
贮藏过程中,果胶和纤维素的含量会发生一定的变化,原果胶转变为可溶性果胶,中胶层解聚,导致细胞壁结构被破坏,纤维素、半纤维素骨架结构松散,进而使得细胞间的黏附力下降,细胞间隙增大,果实硬度下降,导致果实软化[16]。本研究发现,贮藏初期‘蜂糖李’果实硬度较高,这时存在的果胶物质主要为原果胶,而随着贮藏时间的延长,果实细胞壁中胶层明显解聚,原果胶含量下降,可溶性果胶含量上升,导致果实硬度下降,而草酸处理有效保持了果实的硬度和延缓原果胶含量的下降,可溶性果胶含量的上升,这与宁密密等[17]在葡萄、ELLA MISSANG等[18]在杏、李佩艳等[11]在芒果中的研究结果相似。‘蜂糖李’果实纤维素的含量随着贮藏时间的延长呈下降趋势,这与WANG等[19]在库尔勒香梨中变化相似。相关性分析结果表明,‘蜂糖李’果实细胞壁物质中原果胶、纤维素含量与硬度呈极显著正相关,可溶性果胶含量与硬度呈极显著负相关,表明细胞壁组分与硬度密切相关,细胞壁结构的完整性直接决定果实的硬度。
果实质地软化主要是由多种细胞壁降解酶共同作用,通过水解细胞壁的成分,减少细胞间的连接,导致细胞松散,使得果实逐渐软化[20]。PG作为主要的细胞壁降解酶之一,作用于酯化的高半乳糖醛酸,使得细胞壁结构被破坏,导致果实软化[21]。PME则使果胶去甲酯化,催化生成高半乳糖醛酸,可为PG提供反应底物[22]。Cx通过水解纤维素为葡萄糖分子来破坏细胞壁结构,使得果实硬度下降。本研究发现,‘蜂糖李’果实中PG、PME活性先升高后降低,可溶性果胶含量明显增加,这与曾照旭等[23]在猕猴桃中研究结果类似。贮藏过程中‘蜂糖李’果实中Cx和β-Gal活性均呈逐渐上升趋势,且草酸处理组低于对照组 (P<0.05)。XET是一种细胞壁修饰酶,具有强化细胞壁和维持果实细胞壁完整性的作用,从而维持果实的硬度,延缓其软化进程[24]。在本研究中,草酸处理的‘蜂糖李’果实XET活性显著低于对照组,表明草酸处理通过抑制果实内XET活性,对于延缓果实软化进程具有重要作用。α-L-Af作用于细胞壁支链中的阿拉伯糖苷残基,使得阿拉伯半乳聚糖等含量下降,进而促进果胶物质的降解,破坏细胞壁结构[25]。草酸处理的‘蜂糖李’果实α-L-Af活性显著低于对照,其原果胶和纤维素的含量显著高于对照组。说明采后‘蜂糖李’果实使用草酸处理能有效抑制细胞壁降解酶活性,从而延缓果实的软化腐烂进程。相关性分析表明,‘蜂糖李’果实中原果胶和纤维素含量与Cx、β-Gal、XET和α-L-Af活性均呈极显著负相关;可溶性果胶含量与PG、PME活性呈极显著正相关。
综上所述,外源草酸处理在一定程度上保持了‘蜂糖李’果实较高的硬度,有效延缓果实原果胶和纤维素含量的下降以及可溶性果胶含量的上升,同时延缓果实中PG、PME、Cx和β-Gal活性上升,抑制XET和α-L-Af活性。研究表明草酸处理可以影响细胞壁代谢,抑制细胞壁降解关键酶活性,延缓‘蜂糖李’果实细胞壁物质的降解,保持较完整的细胞壁结构,维持‘蜂糖李’果实硬度,从而延缓果实软化进程。
[1] 张毅, 李用奇, 肖祎, 等.李新品种“蜂糖李”的选育及栽培技术[J].中国南方果树, 2018, 47(6):146-148.
ZHANG Y, LI Y Q, XIAO Y.et al.Breeding and cultivation techniques of a new plum variety “bee sugar plum”[J].South China Fruits, 2018, 47(6):146-148.
[2] 何庆, 郑素慧, 秦南南, 等.采前喷施水杨酸对红地球葡萄采后果实软化的影响[J].食品与发酵工业, 2022, 48(4):16-23.
HE Q, ZHENG S H, QIN N N, et al.Effect of spraying salicylic acid to pre-harvest fruit on softening of postharvest Vitis vinifera L.cv.red globe[J].Food and Fermentation Industries, 2022, 48(4):16-23.
[3] CARVAJAL F, PALMA F, JAMILENA M, et al.Cell wall metabolism and chilling injury during postharvest cold storage in zucchini fruit[J].Postharvest Biology and Technology, 2015, 108:68-77.
[4] 郭丹, 韩英群, 魏鑫,等.1-MCP处理对“岳帅”苹果冷藏软化及相关生理指标的影响[J].食品科学, 2017, 38(17):266-272.
GUO D, HAN Y Q, WEI X, et al.Effect of 1-MCP treatment on softening and related physiological indices in “Yueshuai” apples during cold storage[J].Food Science, 2017, 38(17):266-272.
[5] 王培, 张丽芬, 陈复生, 等.贮藏技术对采后水果细胞壁酶影响的研究进展[J].食品研究与开发, 2017, 38(19):199-204.
WANG P, ZHANG L F, CHEN F S, et al.Research progress on the effects of storage technology on cell wall enzymes of post-harvest fruits[J].Food Research and Development, 2017, 38(19):199-204.
[6] CHIABRANDO V, GIACALONE G, ROLLE L.Mechanical behavior and quality traits of highbush blueberry during postharvest storage[J].Journal of the Science of Food and Agriculture, 2009, 89(6):989-992.
[7] HOSSEINIFARAHI M, JAMSHIDI E, AMIRI S, et al.Quality, phenolic content, antioxidant activity, and the degradation kinetic of some quality parameters in strawberry fruit coated with salicylic acid and Aloe vera gel[J].Journal of Food Processing and Preservation, 2020, 44(9):e14647.
[8] ZHENG J, LI S G, XU Y H, et al.Effect of oxalic acid on edible quality of bamboo shoots (Phyllostachys prominens) without sheaths during cold storage [J].LWT, 2019, 109:194-200.
[9] 周道志. 草酸处理对采后木瓜成熟及其品质的影响[J].现代食品, 2016(5):106-110.
ZHOU D Z.The influence of oxalic acid treatment in ripening and quality of papaya fruit during storage[J].Modern Food, 2016(5):106-110.
[10] ZHENG X L, TIAN S P, GIDLEY M J, et al.Effects of exogenous oxalic acid on ripening and decay incidence in mango fruit during storage at room temperature[J].Postharvest Biology and Technology, 2007, 45(2):281-284.
[11] 李佩艳, 尹飞, 党东阳, 等.草酸处理对桂七芒果冷害及细胞壁代谢的影响[J].核农学报, 2020, 34(12):2 742-2 748.
LI P Y, YIN F, DANG D Y, et al.Effect of oxalic acid treatment on chilling injury and cell wall metabolism of Guiqi mango[J].Journal of Nuclear Agricultural Sciences, 2020, 34(12):2 742-2 748.
[12] 董晓庆, 石其宇, 卢梅, 等.草酸处理对采后蜂糖李果实贮藏品质的影响[J].食品科技, 2020, 45(10):53-59.
DONG X Q, SHI Q Y, LU M, et al.Effects of oxalic acid treatment on storage quality of harvested Fengtang plum fruit[J].Food Science and Technology, 2020, 45(10):53-59.
[13] 曹建康, 姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007:34-37;57-59;60-62.
CAO J K, JIANG W B, ZHAO Y M.Experiment Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007:34-37;57-59;60-62.
[14] SUN X K, YANG Q, GUO W D, et al.Modification of cell wall polysaccharide during ripening of Chinese bayberry fruit[J].Scientia Horticulturae, 2013, 160:155-162.
[15] TRAINOTTI L, SPINELLO R, PIOVAN A, et al.β-Galactosidases with a lectin-like domain are expressed in strawberry[J].Journal of Experimental Botany, 2001, 52(361):1 635-1 645.
[16] 沈颖, 李芳东, 王玉霞, 等.甜樱桃果实发育过程中细胞壁组分及其降解酶活性的变化[J].果树学报, 2020, 37(5):677-686.
SHEN Y, LI F D, WANG Y X, et al.A study on the variation of cell wall components and activities of their degradation enzymes in sweet cherry during fruit development[J].Journal of Fruit Science, 2020, 37(5):677-686.
[17] 宁密密, 张群, 舒楠, 等.不同形式SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间果实硬度和细胞壁代谢的影响[J].食品与发酵工业, 2022,48(19):169-177.
NING M M, ZHANG Q, SHU N, et al.Effects of different forms of SO2 preservative on fruit firmness and cell wall metabolism of ‘Shine Muscat’ grape during storage[J].Food and Fermentation Industries, 2022,48(19):169-177.
[18] ELLA MISSANG C, MAINGONNAT J F, RENARD C M G C, et al.Apricot cell wall composition:Relation with the intra-fruit texture heterogeneity and impact of cooking[J].Food Chemistry, 2012, 133(1):45-54.
[19] WANG Y, MAO H J, LYU Y H, et al.Comparative analysis of total wax content, chemical composition and crystal morphology of cuticular wax in Korla pear under different relative humidity of storage [J].Food Chemistry, 2021, 339:128097.
[20] SUN Q Q, ZHANG N, WANG J F, et al.Melatonin promotes ripening and improves quality of tomato fruit during postharvest life[J].Journal of Experimental Botany, 2015, 66(3):657-668.
[21] ZHANG C H, XIONG Z H, YANG H Y, et al.Changes in pericarp morphology, physiology and cell wall composition account for flesh firmness during the ripening of blackberry (Rubus spp.) fruit[J].Scientia Horticulturae, 2019, 250:59-68.
[22] SÉNÉCHAL F, WATTIER C, RUSTÉRUCCI C, et al.Homogalacturonan-modifying enzymes:Structure, expression, and roles in plants[J].Journal of Experimental Botany, 2014, 65(18):5 125-5 160.
[23] 曾照旭, 朴一龙, 金东淳, 等.1-甲基环丙烯处理对软枣猕猴桃果实软化的影响[J].北方园艺, 2014, 304(1):123-126.
ZENG Z X, PIAO Y L, JIN D C, et al.Effects of 1-MCP treatment on softening of Actinidia arguta fruit[J].Northern Horticulture, 2014(1):123-126.
[24] ZHANG Z Y, WANG N, JIANG S H, et al.Analysis of the xyloglucan endotransglucosylase/hydrolase gene family during apple fruit ripening and softening[J].Journal of Agricultural and Food Chemistry, 2017, 65(2):429-434.
[25] MART NEZ G A, CIVELLO P M.Effect of heat treatments on gene expression and enzyme activities associated to cell wall degradation in strawberry fruit[J].Postharvest Biology and Technology, 2008, 49(1):38-45.
NEZ G A, CIVELLO P M.Effect of heat treatments on gene expression and enzyme activities associated to cell wall degradation in strawberry fruit[J].Postharvest Biology and Technology, 2008, 49(1):38-45.