胶原是动物体主要的结构蛋白,具有特殊的三螺旋结构,约占总蛋白含量的30%[1]。胶原具有很好的可降解性、生物相容性和低免疫原性等生物学特性,大量地应用于食品、医药材料、日用化工用品等行业中。由于种族宗教信仰的不同及人畜共患疾病在世界范围内的广泛传播,使得哺乳动物来源的胶原应用逐渐受到限制[2],寻求替代哺乳动物来源的胶原显得日益紧迫,同时也使得胶原新资源的开发逐渐成为研究的热点。
鱼皮胶原是目前研究的热点。科研工作者在鱼皮胶原研发方面,取得了丰硕的成果。如ARUMUGAM等[3]研发比目鱼鱼皮胶原,分析比目鱼皮胶原的制备工艺,并进行表征研究;CHEN等[4]研发赤魟鱼皮胶原,对其理化性质和功能特性进行研究;LIU等[5]从澳洲肺鱼皮提取胶原,研究自组装产物对伤口愈合作用。但这些鱼皮资源量太少,鱼皮胶原无法实现规模产业化。目前,鱼皮资源量大的有罗非鱼(164万t/年)、草鱼(554万t/年)[4],这些鱼皮胶原亦成为市场上胶原的主流产品。随着人们生活水平的提高,市场上,现有的胶原无法满足消费者的需求,故急需开发一种资源量大的鱼皮胶原。三文鱼(Salmo salar)又名鲑鱼,属硬骨鱼纲、鲑形目、鲑属,主要分布在大西洋与太平洋、北冰洋交界的水域,是常见的食用鱼种,三文鱼占全球海产品供应的 4.4%,每年总供应量超过了254万t,市场份额较大,2018年我国三文鱼产量为41 052 t,2019年41 328 t[6],产量呈快速增长的趋势[7]。三文鱼鱼肉具有较高的营养价值,被大规模地生产为生鱼片等食品,其鱼皮未被充分开发利用而丢弃,造成了大量的资源浪费。三文鱼鱼皮胶原的研究很少,目前,仅见张雄等[8]通过超滤膜分离技术,对三文鱼皮胶原的提纯研究、TYLINGO等[7]制备三文鱼鱼皮胶原对其进行表征研究。关于三文鱼胶原的功能性和流变学研究未见报道,而这些性质是决定三文鱼胶原是否具有产业化生产价值的最关键因素。故本研究以三文鱼鱼皮为原料,利用酸法提取技术制备三文鱼鱼皮胶原、利用SDS-PAGE和光谱鉴定其结构;并探究其理化性质、流变特性、功能特性以及细胞相容性,为进一步提高三文鱼加工副产化的高值化开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
三文鱼鱼皮,购于漳州市水产加工厂。
26634Marker,美国赛默飞公司;浓缩胶缓冲液、分离胶缓冲液,北京索莱宝公司;醋酸、过硫酸铵、碳酸氢钠、乙二胺四乙酸二钠等试剂均为分析纯,西陇科学股份有限公司;考马斯亮蓝,国药集团化学试剂有限公司。
1.2 仪器与设备
MCR302流变仪,奥地利Anto-Paar公司;PowerPac basic电泳装置,美国Bio-Rad公司;ZEN-3600电位测定仪,英国马尔文公司;VERTEX70红外光谱仪,德国Bruker公司;PANalytical Pro X射线衍射仪,荷兰博纳科公司;Seven Go便携式pH计,上海梅特勒-托利多仪器有限公司;J-26XP高速冷冻离心机,美国BECKMAN公司;3000-API4000QTRAP高效液相色谱,德国赛默费世尔科学公司。
1.3 实验方法
1.3.1 三文鱼鱼皮胶原的制备
参考TYLINGO等[7]的方法,使用手术刀去除湿三文鱼鱼皮上脂肪和鱼肉杂质,用蒸馏水洗净剪碎待用,以料液比1∶30(g∶mL)溶解于0.5 mol/L的冰醋酸中,搅拌24 h。溶解后的溶液在4 ℃的条件下离心30 min,转速9 000 r/min,取上清液去除沉淀,量取上清液体积,加入以上清液体积为标准的2.5 mol/L的NaCl溶液盐析2 h。将盐析液在4 ℃条件下离心30 min,转速9 000 r/min,取沉淀称量。将所得的胶原粗产品以料液比1∶15(g∶mL)溶解于0.5 mol/L的冰醋酸中,搅拌12 h后透析。0.1 mol/L冰醋酸中透析1 d,纯水透析2 d,每6 h换1次透析液,再进行真空冷冻干燥备用。得率计算如公式(1)所示:
得率![]()
(1)
式中:M0为鱼皮的湿重,g;M为冻干的胶原质量,g。
1.3.2 SDS-PAGE
参考TYLINGO等[7]的方法,并做修改。配制1 mg/mL的三文鱼鱼皮胶原样液,胶原以4∶1(g∶mL)与缓冲液混合,加热3 min,冷却后加入样板,于110 V,50 mA下电泳60 min,进行固定、染色、脱色后再使用凝胶成像系统进行分析。
1.3.3 光谱分析
1.3.3.1 傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
参考SUN等[9]的方法,称取1 mg胶原样品与100 mg溴化钾,研磨混匀后压片。以溴化钾为空白对照,分辨率为4 cm-1,扫描范围为400~4 000 cm-1。
1.3.3.2 紫外光谱(ultraviolet,UV)分析
参考李剑瑛[10]的方法。以0.5 mol/L醋酸做溶剂配制1 mg/mL的样品溶液。醋酸做空白对照,设置波长为190~600 nm,对样品进行紫外吸收值测量。
1.3.3.3 X射线衍射光谱(X-ray diffraction sepectrum,XRD)分析
参考SUN等[9]的方法,取适量的胶原样品,制备压片,进行X射线衍射并记下数据。测量条件:线源Cu,扫描角度范围5°~90°,管电压40 V,管电流40 mA,λ=0.154 nm,扫描速度0.06/s。
1.3.4 理化特性
1.3.4.1 热变性温度(Td)
参考ZHAO等[1]的方法,配制50 mg/mL的胶原溶液,置于流变仪中,设置温度区间为15~50 ℃,通过公式计算得到Td,黏度分数为0.5时所对应的温度为Td值。Td计算如公式(2)所示:
(2)
式中:A为样品黏度,Pa·s;B为10 ℃下样品黏度,Pa·s。
1.3.4.2 Zeta电位
参考FAN等[2]的实验方法并修改,以0.5 mol/L醋酸为溶剂胶原溶液。取20 mL的样品转移至自动滴定仪中,将pH调节为2、3、4、5、6、7、8、9、10,测定其每个pH的电位,取3次平均值。
1.3.4.3 氨基酸分析
胶原与等量浓盐酸结合,110 ℃氮气条件下水解21 h。将过滤后的100 μL溶液冷却过滤后真空干燥,然后与1 mL蒸馏水混合。然后将20 μL样品溶液衍生,采用高效液相色谱分析氨基酸含量。
1.3.5 功能性质
1.3.5.1 乳化性及乳化稳定性
参考MAROUA等[11]的方法,配制5 g/L的胶原样品,溶液取6 mL胶原溶液,调节pH(2、4、6、8、10),22 000 r/min均质60 s,取50 μL管底液。以0.1% SDS稀释100倍,分别测量0 min和10 min下500 nm处的吸光度。
样品溶液乳化性及乳化稳定性如公式(3)、公式(4)所示:
乳化性![]()
(3)
乳化稳定性![]()
(4)
式中:A0为0 min时吸光度;φ为油体积分数,25%;A10为均质10 min的吸光度;Δt,10 min;ΔA,A0-A10。
1.3.5.2 起泡性及泡沫稳定性
参考SUN等[9]的方法,以0.5 mol/L的醋酸溶液制备5 g/L的胶原溶液,初始体积为50 mL,分别调节pH为2、4、6、8、10。16 000 r/min均质2 min,将发泡溶液转移到量筒中,记录体积V1,静置60 min,记录体积V2。
样品溶液起泡性及泡沫稳定性如公式(5)、公式(6)所示:
起泡性![]()
(5)
泡沫稳定性![]()
(6)
式中:V0为胶原溶液的初始体积,mL;V1为均质后的体积;V2为均质后静置60 min的体积,mL。
1.3.5.3 流变性能测试
参考LAI等[12]的方法,将三文鱼鱼皮胶原溶解在0.5 mol/L的醋酸中,制备成质量浓度为50、55、60、65 mg/mL的胶原溶液。流变仪频率为0.01~10 Hz,15 ℃条件下检测胶原溶液的弹性模量(G′)、黏性模量(G″)、复数黏度(η*)、正切损耗角tanδ随频率的变化。
1.3.6 细胞增殖
参考SONG等[13]的方法修改。使用CCK-8测定法评估胶原蛋白对MC3T3-E1细胞的细胞毒性,配制胶原为0.05、0.1、0.2、0.4 mg/mL的质量浓度梯度组。96孔板的底部涂上不同浓度的胶原溶液,并在层流罩下干燥,然后进行紫外线消毒。取96孔板,每孔加入浓度为1×105个/mL的细胞悬液,接种MC3T3-E1细胞(培养基为DMEM培养基),在5% CO2培养箱中于37 ℃孵育24 h后,每孔加入10 μL CCK-8溶液,在倒置显微镜下观察1、3、5 d各组的形态,测量其450 nm处吸光度值(OD),评估细胞毒性,细胞增殖率计算如公式(7)所示:
相对增殖率![]()
(7)
式中:A为样品组吸光度;A0为对照组吸光度。
1.3.7 数据统计与分析
采用Origin 8.5和SPSS对数据进行处理分析,每组数据设定3个平行,采用平均值±标准偏差表示。
2 结果与分析
2.1 三文鱼鱼皮胶原得率
三文鱼鱼皮胶原得率为22.6%(湿基重),鱼皮胶原得率高于竹鲨鱼皮胶原(9.38%,湿基重)[14]、罗非鱼鱼皮胶原(19.8%,湿基重)[15]、马面鲀鱼皮胶原(14.8%,湿基重)[16],说明三文鱼鱼皮胶原得率较高,具有巨大的市场开发前景。
2.2 SDS-PAGE
如图1所示,三文鱼鱼皮胶原和 Ⅰ 型鼠尾胶原都具有β条带、α1条带、α2条带、γ条带,使用ImaginJ软件对灰度比的计算,得到鼠尾α1、α2灰度面积比为近似2∶1,三文鱼鱼皮胶原样品也是近似2∶1的结果,与 Ⅰ 型鼠尾胶原一致,说明所制备的胶原样品为 Ⅰ 型胶原[3]。鼠尾胶原的α1、α2的分子质量为134、120 kDa,三文鱼鱼皮胶原样品的α1、α2的分子质量为120、115 kDa,与陆源胶原鼠尾胶原相比可以看出陆源动物与水生动物胶原结构间存在差异。三文鱼胶原α1、α2的分子质量与比目鱼鱼皮胶原(118、116 kDa)[3]、罗非鱼鱼皮胶原(125、114 kDa)[9]相似,进一步说明胶原为Ⅰ型胶原。两种胶原α条带下未发现杂带,未发生分解,基本结构保持完整。

marker26634-标准条带;A-鼠尾胶原条带;B-三文鱼鱼皮胶原条带
图1 胶原SDS-PAGE图谱
Fig.1 SDS-PAGE pattern of collagen
2.3 光谱分析
2.3.1 FTIR分析
如图2所示,三文鱼鱼皮胶原具有5个典型的特征吸收峰,分别为酰胺A带、酰胺B带、酰胺 Ⅰ 带、酰胺 Ⅱ 带、酰胺 Ⅲ 带。鱼皮胶原与猪皮胶原[17]、罗非鱼鱼皮胶原[9]、大西洋三文鱼皮胶原[7]的吸收峰相似,说明三文鱼鱼皮胶原为 Ⅰ 型胶原。酰胺 Ⅲ 带与胶原的结构完整性相关,鱼皮胶原酰胺 Ⅲ 带的特征峰在1 238.71 cm-1。酰胺Ⅲ带与1 450 cm-1比为0.9,吸收比约为1,则表明胶原的三螺旋结构完整未被破坏[3]。

图2 三文鱼鱼皮胶原的红外光谱图
Fig.2 FTIR spectrum of salmon skin collagen
2.3.2 UV分析
如图3所示,三文鱼鱼皮胶原在233 nm处有最大吸收峰,而在280 nm处区域没有发现有明显的吸收峰。光谱鉴定结果与猪皮胶原[17]、赤魟鱼鱼胶原[10]等Ⅰ型胶原图谱一致,由此说明所提取的三文鱼鱼皮胶原为Ⅰ型胶原。
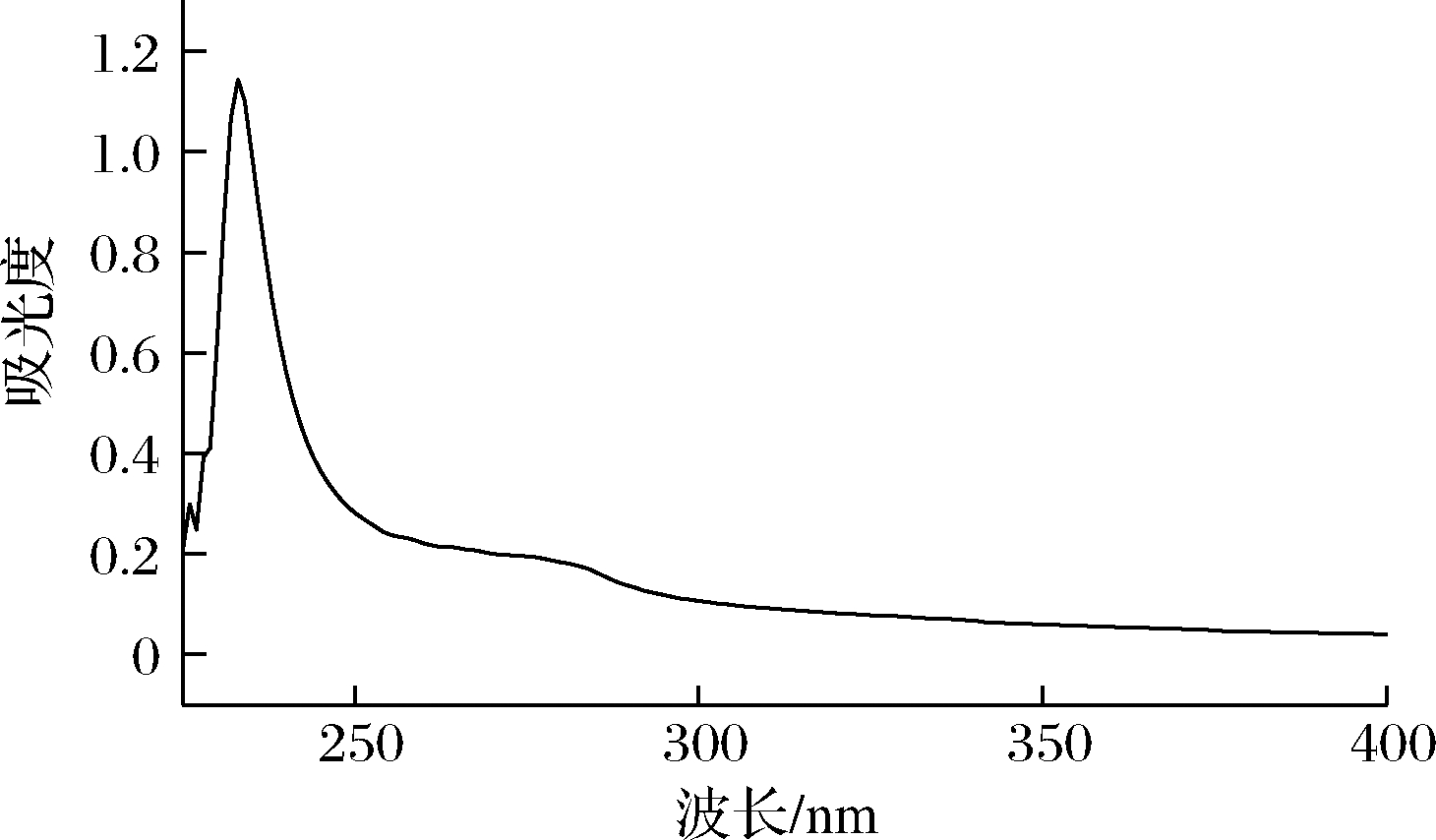
图3 三文鱼鱼皮胶原紫外吸收光谱
Fig.3 UV absorption spectrum of salmon skin collagen
2.3.3 XRD分析
如图4所示,三文鱼鱼皮胶原有2个明显的吸收峰,在8.0° 时出现一个尖锐的吸收峰Peak1,在20.6°有一个较宽的吸收峰Peak2,这与李剑瑛[10]所测XRD的结果(7.84°和21.12°)相似。第一个峰表示胶原内部有较为完整的衍射,反映的是胶原分子链间的距离,与胶原的三螺旋结构有关;第二个特征峰是胶原骨架间的距离[9]。根据布拉格方程d=λ/(2 sinθ)(λ是X射线波长,θ时布拉格衍射角,描述X射线衍射的结果)。经计算得胶原分子链间的距离为1.08 nm,胶原骨架间的距离为0.42 nm。这与所参考的罗非鱼鱼皮胶原结果(1.5、0.6 nm)较为相近[9],d值相差不大,故三文鱼鱼皮胶原样品具有完整的三螺旋结构未发生变性。
2.4 理化特性
2.4.1 Td和氨基酸含量分析
胶原热变性温度指胶原在介质中受热三螺旋解旋为50%单链时,此时相对应的温度为热变性温度[16]。如图5所示,三文鱼鱼皮胶原的热变性温度为22.3 ℃,高于鳕鱼皮胶原(15.2 ℃)[7]、大西洋三文鱼皮胶原(20.6 ℃)[7]低于小牛皮胶原(34.7 ℃)[18]。亚氨基酸(脯氨酸+羟基脯氨酸)含量的差异与胶原的热变性温度相关[1],如表1所示,三文鱼鱼皮胶原的亚氨基酸含量(164/1 000个残基)高于鳕鱼皮胶原(154/1 000个残基)[7]、大西洋三文鱼皮胶原(161/1 000个残基)[7],低于小牛皮胶原(215/1 000个残基)[18],进一步说明亚氨基含量是决定胶原热变性温度的重要因素。
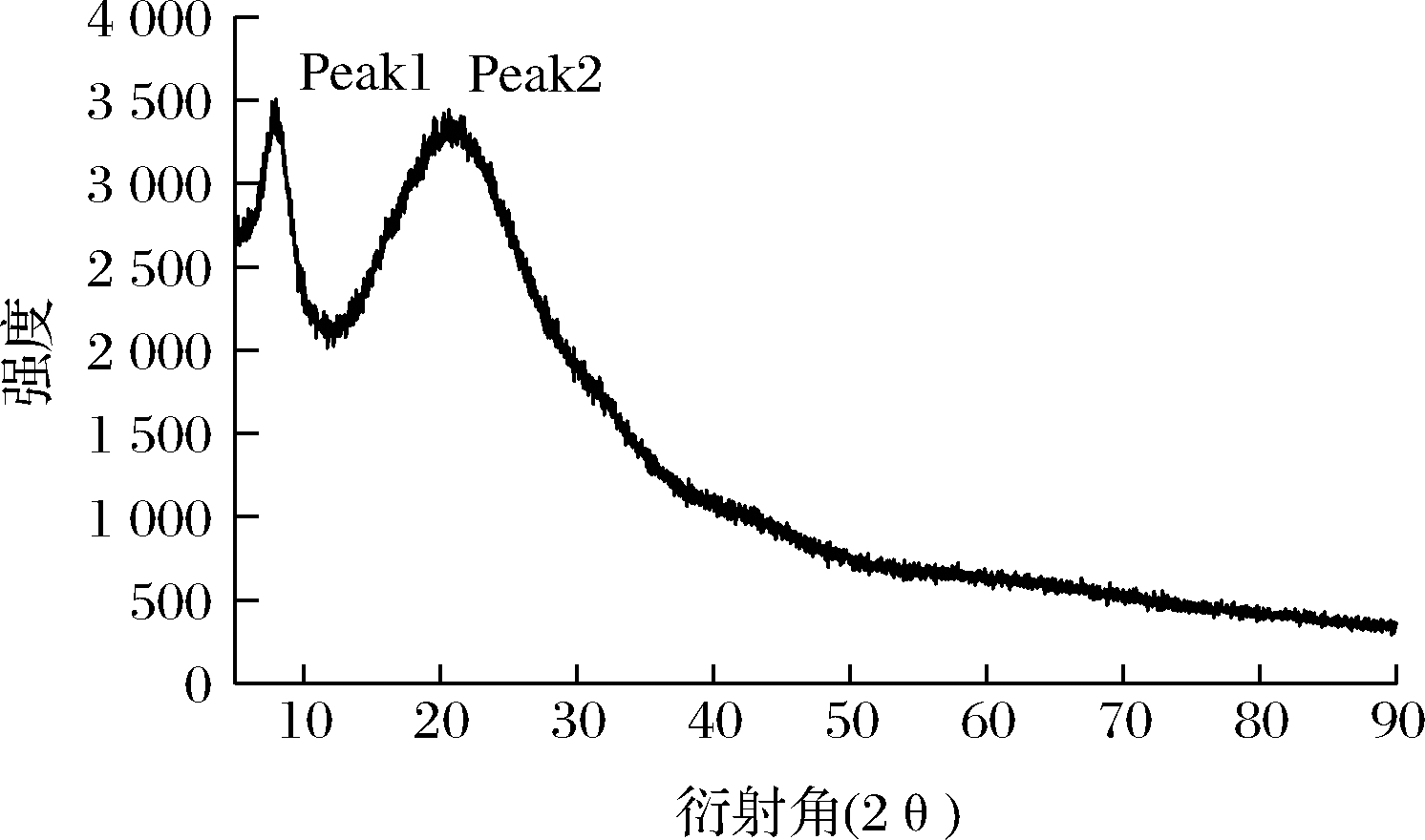
图4 三文鱼鱼皮胶原XRD
Fig.4 XRD of salmon skin collagen
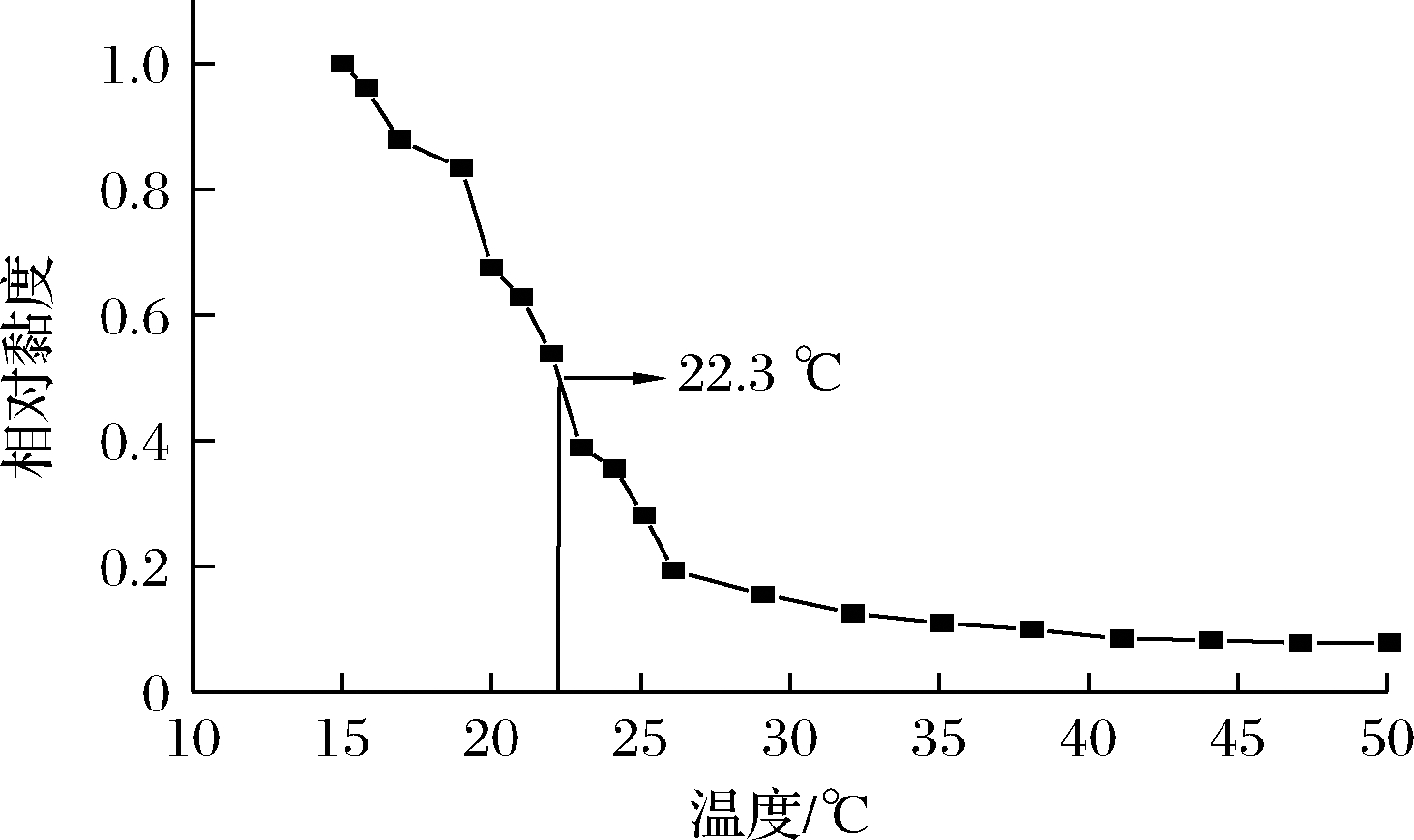
图5 三文鱼鱼皮胶原热变性曲线
Fig.5 Thermal denaturation curve of salmon skin collagen
谷氨酸、天门冬酰胺、酪氨酸、甘氨酸、天门冬氨酸等与鲜味肽有关,能够呈现鲜味同时使得食品的味感更加柔和、浓厚,具有重要的感官特性[19],鱼皮胶原与鲜味肽氨基酸相关的含量高(434/1 000个残基),因此可作为一种食品添加剂原料进行开发。
2.4.2 Zeta电位
如图6所示鱼皮胶原在pH 2~6.39时,电荷为正值,pH 6.39~10时电荷为负值,故鱼皮胶原的等电点为6.39。在等电点时,胶原相同电荷斥力减小,分子借静电引力结合成较大的聚集体,黏度、膨胀性以及导电性能均减小[2],可通过调节胶原的pH值,开发不同物化特性的系列胶原产品。
表1 三文鱼鱼皮胶原氨基酸组成
Table 1 Amino acid composition of salmon skin collagen
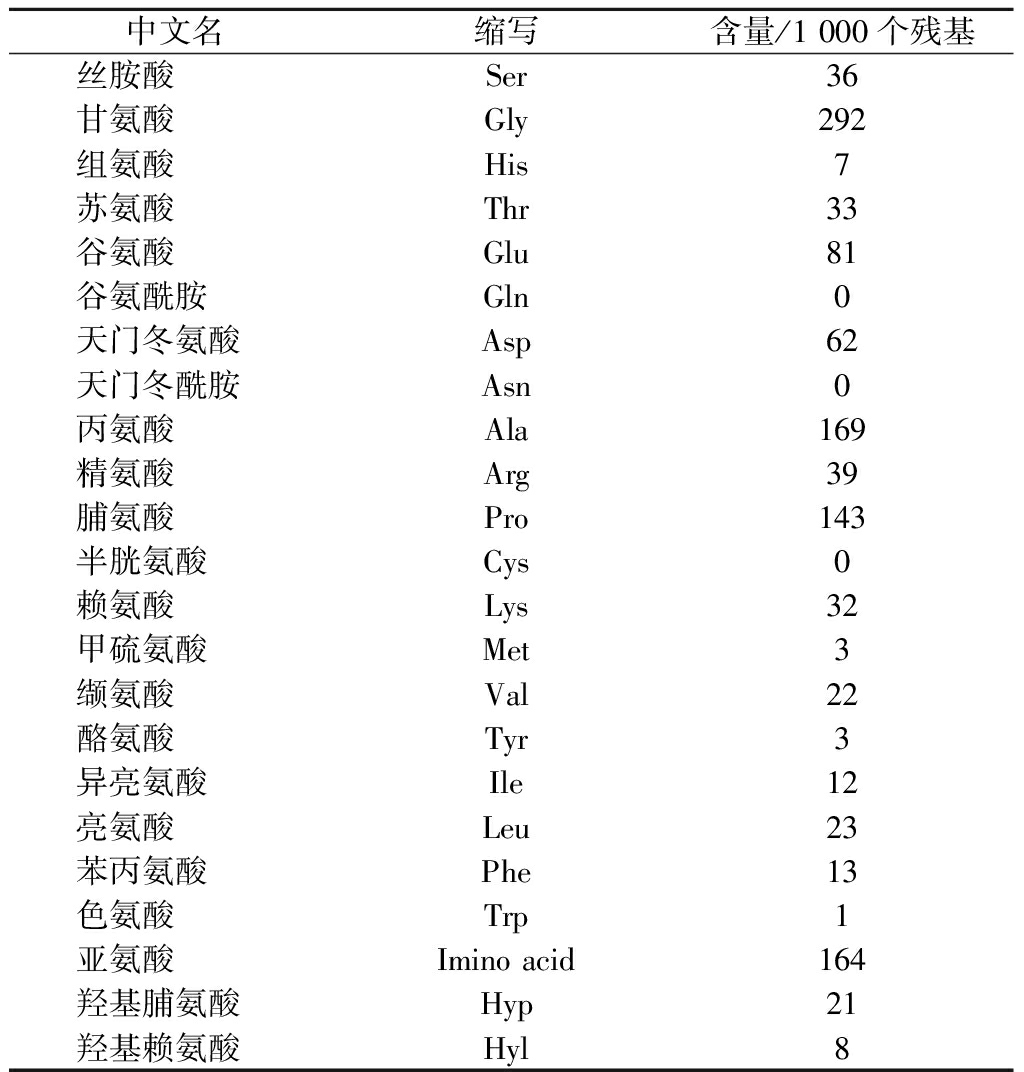
中文名缩写含量/1 000个残基丝胺酸Ser36 甘氨酸Gly292 组氨酸His7 苏氨酸Thr33 谷氨酸Glu81 谷氨酰胺Gln0 天门冬氨酸Asp62 天门冬酰胺Asn0 丙氨酸Ala169 精氨酸Arg39 脯氨酸Pro143 半胱氨酸Cys0 赖氨酸Lys32 甲硫氨酸Met3 缬氨酸Val22 酪氨酸Tyr3 异亮氨酸Ile12 亮氨酸Leu23 苯丙氨酸Phe13 色氨酸Trp1亚氨酸Imino acid164羟基脯氨酸Hyp21 羟基赖氨酸Hyl8
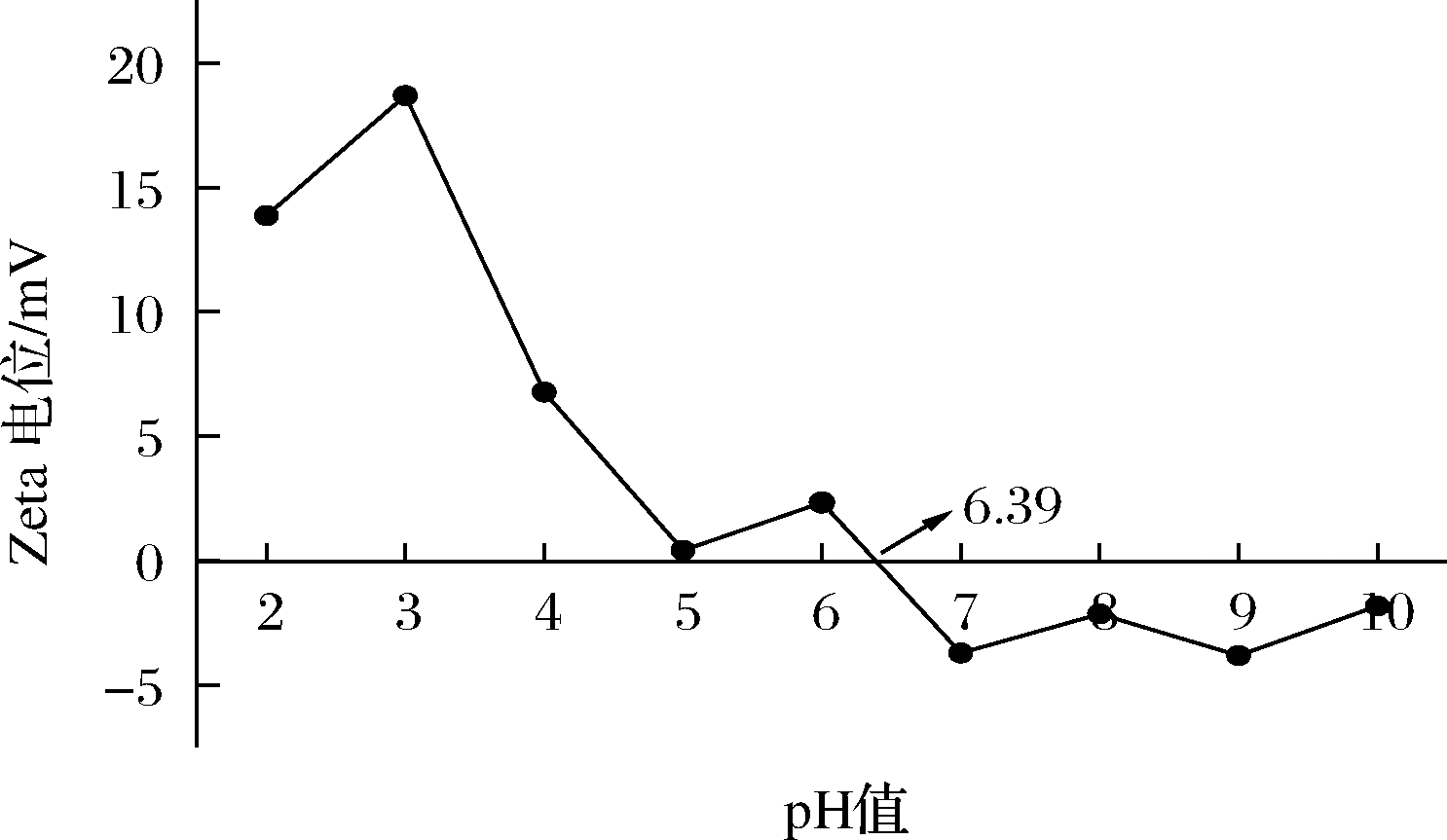
图6 三文鱼鱼皮胶原不同pH值下的Zeta电位
Fig.6 Zeta potential of salmon skin collagen at different pH values
2.5 功能性质
2.5.1 乳化性及乳化稳定性
如图7所示,三文鱼鱼皮胶原的乳化性(65.91~755.97 m2/g)高于牛皮胶原(28.4~56.2 m2/g)[20]、大鲵肌浆蛋白(0.6~3.38 m2/g)[21]。三文鱼鱼皮胶原的乳化稳定性高于蒙古牛骨胶原(0.8 min)[22]、军曹鱼鱼皮胶原(0.2 min)[23]。如图7-a所示,pH值为2~6时,随着pH值不断的升高,鱼皮胶原的乳化性下降,当pH值为6.39时,乳化性到达最低点(65.91 m2/g),这是由于胶原接近等电点时,胶原链之间的斥力减小,胶原溶解度降低,导致乳化性减小。当pH值继续增大,乳化性开始增大,但当pH值到10时,胶原乳化性(520.40 m2/g)明显小于pH值为2的乳化性(755.97 m2/g)。因为在高pH值下胶原表现出空间位阻,降低了流动性,因此低于酸性条件下乳化性。如图7-b所示,随着pH的升高,胶原的乳化稳定性呈现先升高后降低趋势。在接近等电点时乳化稳定性急剧降低,溶液pH为等电点时,乳化稳定性最低(3.50 min),此时胶原不带电荷或带电荷少,静电斥力减小分子聚集,溶解度降低,无法在分散相表面形成稳定的界面膜,乳状液的稳定性较差[11]。综上,三文鱼鱼皮胶原可作为乳化剂用于面包生产,改善面包组织,延长保鲜期。

a-三文鱼鱼皮胶原乳化性;b-三文鱼鱼皮胶原乳化稳定性
图7 三文鱼鱼皮胶原乳化性和乳化稳定性
Fig.7 Emulsification and stability of salmon skin collagen
注:不同字母表示样本间差异显著(下同)
2.5.2 起泡性及泡沫稳定性
如图8所示,三文鱼鱼皮胶原起泡性(16.56%~77.79%)高于酪蛋白(3.95%~10.15%)、米糠浓缩蛋白(5.2%~10.03%)[24],说明三文鱼鱼皮胶原的起泡性较好。鱼皮胶原的泡沫稳定性(13%)大于大鲵肌浆蛋白泡沫稳定性(5%)[21]、牛胶原泡沫稳定性(10%)[20]。如图8-a所示,鱼皮胶原随着pH值的增加,起泡性先减小,后增加,在等电点时达到最低(16.56%)。这是因为在等电点时溶解度的降低,干扰了泡沫形成所需要的相互作用,导致泡沫形成和稳定性降低。当溶液的pH偏离等电点时,胶原溶液电荷数增加,溶解性增加,胶原的起泡性增加[25]。如图8-b所示,在等电点时鱼皮胶原的泡沫稳定性最低(13.14%),泡沫稳定性的降低可能是由于其接近等电点时,电荷减少,溶解度下降,泡沫表面吸附性降低,泡沫稳定性下降[26]。综上,三文鱼鱼皮胶原起泡性和泡沫稳定性较好,可应用于啤酒、乳制品食品加工中。

a-三文鱼鱼皮胶原起泡性;b-三文鱼鱼皮胶原泡沫稳定性
图8 三文鱼鱼皮胶原起泡性和泡沫稳定性
Fig.8 Foamability and foam stability of salmon skin collagen
2.5.3 流变特性
如图9所示,三文鱼鱼胶原溶液的G′和G″随着剪切频率的增加而升高,而鱼皮胶原η*随着剪切速率的增加而减小,与牛皮胶原[12]、马面鲀鱼皮胶原[16]、长鳍鲶鱼皮胶原[27]的结果相似。这种随剪切速率的增加而η*降低的现象称为剪切稀释。剪切速率的增加,被剪切破坏的物理缠结点来不及被重建,这种具有剪切稀释现象的流体被称为假塑性流体[28]。可适当增加剪切速率使黏度下降,有利于原料注射成型[29]。G′和G″的比值定义为损失切线(tanδ)[27],随着剪切速率的增大,tanδ数值减小,鱼皮胶原质量浓度为55~65 mg/mL的胶原浓度组中tanδ<1,表现出弹性流体;50 mg/mL浓度组tanδ>1,表现为黏性流体,弹性流体可作为食品包装材料进行研究[30]。

a-三文鱼鱼皮胶原弹性模量(G′);b-三文鱼鱼皮胶原黏性模量(G″);c-三文鱼鱼皮胶原复数黏度(η*);d-三文鱼鱼皮胶原损失切线(tanδ)
图9 三文鱼鱼皮胶原的流变学曲线
Fig.9 Rheological curves of salmon skin collagen
2.6 细胞增殖
MC3T3-E1细胞是成骨样细胞前体细胞,具有在体外分化成成骨细胞、骨细胞,形成骨结节的能力。选择此细胞进行毒性和细胞增殖实验,验证胶原的细胞相容性。如图10所示,随着细胞培养时间的增加,0.4 mg/mL实验组相对增殖率上升。在体外培养第1天时其增殖率为110.9%,第3天时,细胞增殖率为111.3%,第5天时,细胞增殖率为111.6%,其他3组的相对增殖率较0.4 mg/mL实验组小,说明胶原浓度越大细胞增殖率越高[31]。结果表明三文鱼鱼皮胶原能促进ME3T3-E1细胞增殖且无毒,可提供一个适宜ME3T3-E1细胞生长和增殖的环境。三文鱼鱼皮胶原的相对细胞增殖率优于罗非鱼胶原(105.09%)[13],因此三文鱼鱼皮胶原在生物医学材料方面具有很大的应用潜力。
如图11所示,对照组和实验组均出现了纺锤行的细胞图形,这与ME3T3-E1细胞的形态一致。说明细胞在此条件下生长的良好[31]。在不同浓度的三文鱼鱼皮胶原溶液培养的细胞形态图中发现,随着时间的增加,实验组中的细胞数量增加,结合细胞形态,表明鱼皮胶原促进细胞生长无毒,与细胞相对增殖率结果相似。

图10 ME3T3-E1小鼠成纤维细胞在三文鱼鱼皮胶 原接种1、3、5 d后的增殖率柱状图
Fig.10 Histogram of proliferation rate of ME3T3-E1 mouse fibroblasts inoculated with salmon skin collagen for 1, 3, and 5 days

a-空白组;b-0.05 mg/mL组;c-0.1 mg/mL;d-0.2 mg/mL组; e-0.4 mg/mL组
图11 ME3T3-E1小鼠成纤维细胞在三文鱼鱼皮胶 原接种1、3、5 d后细胞形态图(×40)
Fig.11 Cell morphology of ME3T3-E1 mouse fibroblasts inoculated with salmon skin collagen for 1, 3, and 5 days(×40)
3 结论与讨论
本研究以三文鱼鱼皮为原料,制备鱼皮胶原,得率为22.3%(湿基重),SDS-PAGE实验结果显示,制备的胶原为典型Ⅰ型胶原;光谱鉴定结果表明所制备的胶原保留了完整的三螺旋结构未发生变性。三文鱼鱼皮胶原Td值为22.3 ℃,高于大西洋三文鱼皮胶原、鳕鱼皮胶原,结合分析胶原亚氨酸含量,说明亚氨酸是决定胶原热变性温度最重要因素。三文鱼鱼皮胶原与鲜味肽相关氨基酸含量较高,适用于食品添加剂或作为风味食品进行开发利用。三文鱼鱼皮胶原的功能性实验结果表明,鱼皮胶原乳化性高于牛皮胶原、大鲵肌浆蛋白;乳化稳定性优于蒙古牛骨胶原、军曹鱼鱼皮胶原,可作为乳化剂用于面包。起泡性优于酪蛋白、米糠浓缩蛋白;起泡稳定性优于大鲵肌浆蛋白、牛皮胶原,可用于啤酒、乳制品食品生产加工。胶原流变特性符合假塑性流体,可应用于食品加工原料塑形,在50 mg/mL的鱼皮胶原表现为黏性行为,在高于50 mg/mL的质量浓度时中表现为弹性行为,应用于食品包装材料。细胞增殖实验显示胶原对ME3T3-E1细胞相对增值率好无毒性,优于罗非鱼鱼皮胶原,可作为生物医学原料。综上所述,三文鱼鱼皮胶原具有成为替代市场上胶原产品的潜在原料。
[1] ZHAO W H, CHI C F, ZHAO Y Q, et al.Preparation, physicochemical and antioxidant properties of acid- and pepsin-soluble collagens from the swim bladders of miiuy croaker (Miichthys miiuy)[J].Marine Drugs, 2018, 16(5):161.
[2] FAN H Y, DUMONT M J, SIMPSON B K.Preparation and physicochemical characterization of films prepared with salmon skin gelatin extracted by a trypsin aided process[J].Current Research in Food Science, 2020, 3:146-157.
[3] ARUMUGAM G K S, SHARMA D, BALAKRISHNAN R M, et al.Extraction, optimization and characterization of collagen from sole fish skin[J].Sustainable Chemistry & Pharmacy, 2018, 9:19-26.
[4] CHEN J D, LI J Y, LI Z B, et al.Physicochemical and functional properties of type I collagens in red stingray (Dasyatis akajei) skin[J].Marine Drugs, 2019, 17(10):558.
[5] LIU S Q, WEN F, MUTHUKUMARAN P, et al.Self-assembled nanofibrous marine collagen matrix accelerates healing of full-thickness wounds[J].ACS Applied Bio Materials, 2021, 4(9):7 044-7 058.
[6] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会.中国渔业统计年鉴2020[M].北京:中国农业出版社, 2020.
Fishery Bureau of Ministry of Agriculture and Rural Affairs of China.National Fisheries Technology Extension Center, China Society of Fisheries.China Fishery Statistical Book 2020[M].Beijing:China Agriculture Press, 2020.
[7] TYLINGO R, MANIA S, PANEK A, et al.Isolation and characterization of acid soluble collagen from the skin of African catfish (Clariasg ariepinus), salmon (Salmo salar) and Baltic cod (Gadus morhua)[J].Journal of Biotechnology & Biomaterials, 2016, 6(2):1-6.
[8] 张雄, 李云雁, 张凯, 等.酸溶性三文鱼皮胶原蛋白超滤脱盐的研究[J].食品工业科技, 2014, 35(21):69-72;76.
ZHANG X, LI Y Y, ZHANG K, et al.Application of ultrafiltration in the desalination process of acid-soluble collagen from salmon skin[J].Science and Technology of Food Industry, 2014, 35(21):69-72;76.
[9] SUN L L, HOU H, LI B F, et al.Characterization of acid- and pepsin-soluble collagen extracted from the skin of Nile tilapia (Oreochromis niloticus)[J].International Journal of Biological Macromolecules, 2017, 99:8-14.
[10] 李剑瑛. 赤魟鱼鱼皮胶原及其衍生物的制备、理化性质及功能特性研究[D].厦门:集美大学, 2019.
LI J Y.Study on the preparation, physicochemical properties and functional properties of collagen and its derivatives from skin of Dasyatisakajei[D].Xiamen:Jimei University, 2019.
[11] ELLOUZE M, LAJNAF R, ZOUARI A, et al.Camel α-lactalbumin at the oil-water interface:Effect of protein concentration and pH change on surface characteristics and emulsifying properties[J].Colloids and Surfaces B:Biointerfaces, 2020, 189:110654.
[12] LAI G L, LI Y, LI G Y.Effect of concentration and temperature on the rheological behavior of collagen solution[J].International Journal of Biological Macromolecules, 2008, 42(3):285-291.
[13] SONG X, LI Z X, LI Y Y, et al.Typical structure, biocompatibility, and cell proliferation bioactivity of collagen from Tilapia and Pacific cod[J].Colloids and Surfaces B:Biointerfaces, 2022, 210:112238.
[14] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al.Isolation and characterisation of collagen from the skin of brownbanded bamboo shark (Chiloscyllium punctatum)[J].Food Chemistry, 2010, 119(4):1 519-1 526.
[15] LI J, WANG M C, QIAO Y Y, et al.Extraction and characterization of type I collagen from skin of tilapia (Oreochromis niloticus) and its potential application in biomedical scaffold material for tissue engineering[J].Process Biochemistry, 2018, 74:156-163.
[16] 吴坤远. 马面鲀鱼皮胶原结构、功能及流变性能的研究[D].福州:福建农林大学, 2020.
WU K Y.Study on skin collagen structure, function and rheological properties of Navodon septentrionalis[D].Fuzhou:Fujian Agriculture and Forestry University, 2020.
[17] 纪倩, 宿丹丹, 应慧妍, 等.猪皮中胶原蛋白的提取与结构鉴定[J].食品研究与开发, 2017, 38(13):44-49.
JI Q, SU D D, YING H Y, et al.Extraction of pigskin collagen and its structural identification[J].Food Research and Development, 2017, 38(13):44-49.
[18] 孟雪萍. 牛皮胶原的提取及分子量分布研究[D].郑州:郑州大学, 2017.
MENG X P.Study on extraction and molecular weight distribution of collagen from Bovine hides[D].Zhengzhou:Zhengzhou University, 2017.
[19] 耿瑞蝶, 王金水.呈味氨基酸和肽对发酵食品中风味的作用[J].中国调味品, 2019, 44(7):176-178;183.
GENG R D, WANG J S.Effect of flavored amino acids and peptides on the flavor of fermented foods[J].China Condiment, 2019, 44(7):176-178;183.
[20] 张鑫. 牛胶原蛋白的功能特性及多肽的抗氧化活性研究[D].济南:齐鲁工业大学, 2021.
ZHANG X.Study on functional properties of Bovine collagen and antioxidant activity of polypeptide [D].Jinan:Qilu University of Technology, 2021.
[21] 杨慧. 大鲵肌肉蛋白组分及特性研究[D].汉中:陕西理工大学, 2020.
YANG H.Study on the composition and characteristics of Giant salamander muscle protein[D].Hanzhong:Shaanxi University of Technology, 2020.
[22] 乌日古莫乐. 吉尔利阁蒙古牛骨胶原蛋白的提取及理化特性研究[D].呼和浩特:内蒙古农业大学, 2015.
WUR I G.Study on extraction of collagen from Gi er li go Mongolia bovine bone and its physical and chemical properties[D].Hohhot:Inner Mongolia Agricultural University, 2015.
[23] 杨树奇. 军曹鱼鱼皮胶原蛋白的提取及其功能特性的研究[D].湛江:广东海洋大学, 2010.
YANG S Q.Study on isolation and functional properties of collagens from the skin of cobia (Rachycentron canadum)[D].Zhanjiang:Guangdong Ocean University, 2010.
[24] CHANDI G K, SOGI D S.Functional properties of rice bran protein concentrates[J].Journal of Food Engineering, 2007, 79(2):592-597.
[25] HAN J R, TANG Y, LI Y, et al.Physiochemical properties and functional characteristics of protein isolates from the scallop (Patinopecten yessoensis) gonad[J].Journal of Food Science, 2019, 84(5):1 023-1 034.
[26] CANO-MEDINA A, JIMÉNEZ-ISLAS H, DENDOOVEN L, et al.Emulsifying and foaming capacity and emulsion and foam stability of sesame protein concentrates[J].Food Research International, 2011, 44(3):684-692.
[27] ZHANG M, LI J H, DING C C, et al.The rheological and structural properties of fish collagen cross-linked by N-hydroxy succinimide activated adipic acid[J].Food Hydrocolloids, 2013, 30(2):504-511.
[28] ZHU S C, YU X Y, XIONG S B, et al.Insights into the rheological behaviors evolution of alginate dialdehyde crosslinked collagen solutions evaluated by numerical models[J].Materials Science & Engineering C, 2017, 78:727-737.
[29] 唐颂超. 高分子材料成型加工[M].第三版.北京:中国轻工业出版社, 2013.
TANG S C.Polymer Materials Processing [M].The third edition.Beijing:China Light Industry Press, 2013.
[30] 尹明华. 热塑性弹性体产品在食品行业的应用[J].上海包装, 2011(12):30-31.
YIN M H.Applications of thermoplastic elastomer products in food industry [J].Shanghai Packaging, 2011(12):30-31.
[31] WANG C, XIE X D, HUANG X, et al.A quantitative study of MC3T3-E1 cell adhesion, morphology and biomechanics on chitosan-collagen blend films at single cell level[J].Colloids and Surfaces B:Biointerfaces, 2015, 132:1-9.