水芹(Oenanthe javanica)属于伞形科(Apiaceae)水芹属(Oenanthe),分布广泛[1]。水芹作为中国传统蔬菜食品,富含多种蛋白质、维生素和矿物质等营养成分[2]。此外,水芹还是一味传统中药材,性辛、凉,主治黄疸、脉溢、驱风、消渴,常用于黄疸、肝炎、高血压和流行性腮腺炎等疾病的治疗[3]。
研究发现水芹中含有多种生理活性成分,展现出良好的免疫调节、抗氧化、护肝和神经保护等活性[4]。郭晓青等[5]研究发现水芹醇提物可有效降低由链尿菌素诱导的糖尿病小鼠血糖水平;水芹黄酮类化合物可明显提高免疫低下模型小鼠的碳粒廓清指数[6];水芹总酚酸提取物可通过提高血清溶血素和白细胞介素水平,改善正常小鼠免疫功能[7]。
然而,多糖作为水芹的重要生物活性成分,其分离和活性研究尚未见报道。因此,本文采用单因素试验明确了水芹多糖(Oenanthe javanica polysaccharide,OJP)的超声提取条件,采用响应面法对其提取工艺进行优化,成功得到OJP。利用高效凝胶渗透色谱(high performance gel permeation chromatography,HPSEC)和高效阴离子色谱法探究OJP的分子质量分布和单糖组成,基于细胞实验考察OJP对巨噬细胞RAW264.7的免疫调节作用,为水芹进一步开发利用提供依据。
1 材料与方法
1.1 材料与试剂
水芹,中国江苏省盐城市,洗净烘干后粉碎,过60目筛,密封备用;RAW264.7细胞株,中科院细胞库(上海);单糖标准品、噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT]、脂多糖(lipopolysaccharides,LPS),Sigma公司(美国);一氧化氮(NO)试剂盒、中性红染色液,碧云天生物公司(上海);其他试剂,国药化学试剂公司。
1.2 仪器与设备
RE3000-D旋转蒸发仪,亚荣生化(上海);超声波清洗机,新芝科技(中国宁波);Waters2695高效液相色谱仪,Waters(美国);ICS-2500离子色谱仪,Dionex(美国);Synergy HT酶标仪,Bio-Tek(美国)。
1.3 实验方法
1.3.1 OJP的提取
称取干燥水芹粉末,加入适量去离子水超声辅助提取,离心取上清液,旋蒸浓缩后加入乙醇沉淀,离心(8 000 r/min,4 ℃,10 min)取沉淀,去离子水复溶,加入一定浓度三氯乙酸,离心除蛋白沉淀,上清液浓缩透析后冷冻干燥,即得OJP。OJP提取率参照公式(1)计算:
(1)
式中:W为多糖提取率,m1为OJP的质量,m2为水芹粉末的质量。
1.3.2 单因素试验
分别称取水芹粉末适量,设置料液比1∶30 (g∶mL),超声温度80 ℃,超声提取50 min。分别测定超声温度(50、60、70、80、90 ℃),超声时间(20、30、40、50、60 min)和料液比(1∶20、1∶25、1∶30、1∶35、1∶40,g∶mL)对多糖得率的影响。
1.3.3 响应面优化(response surface optimization,RSM)实验
根据单因素试验结果,以多糖提取率为响应值,设计响应面实验(表1),考察各实验条件对多糖提取率的影响,Design-Expert 8.0.6软件分析确定OJP最佳提取条件[8]。
表1 响应面试验设计的因素及水平
Table 1 Factors and levels of response surface experiment design
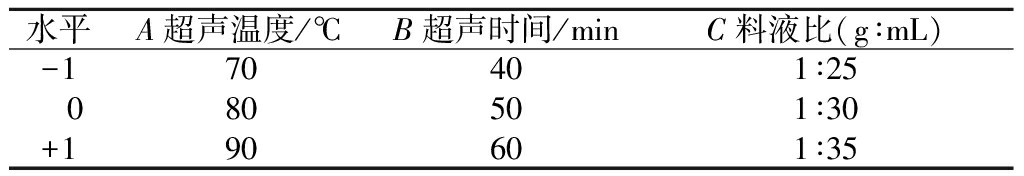
水平A超声温度/℃B超声时间/minC料液比(g∶mL)-170401∶25 080501∶30+190601∶35
1.3.4 多糖分子质量测定
采用HPSEC法检测OJP的分子质量分布[9]。取干燥多糖样品5 mg,超纯水溶解后离心,0.22 μm滤膜过滤,上样分析。测定参数如下:G4 000PWXL和G2 500PWXL色谱柱(7.8 mm×300 mm)、流动相为0.15 mol/L NaNO3、0.05 mol/L NaH2PO4,流速0.5 mL/min,柱温30 ℃,使用Astra(version 6.1.1)软件进行数据分析。
1.3.5 单糖组成测定
参考文献[10]的方法测定OJP单糖组成。取适量干燥多糖样品,三氟乙酸(2 mol/L)溶解后110 ℃水解4 h,冷却后氮气吹干,加入少许甲醇反复吹干,产物用超纯水冲洗,定容至25 mL容量瓶,过0.22 μm滤膜后上样分析。测定参数如下:ICS2500离子色谱仪,流动相480 mmol/L NaOH,流速0.45 mL/min,柱温30 ℃。
1.3.6 OJP对巨噬细胞RAW264.7的激活作用研究
1.3.6.1 巨噬细胞的增殖率测定
细胞接种在96孔板中(1×105个细胞/孔)培养12 h,不同剂量的OJP(25、50、100、200、400 μg/mL)处理细胞。培养24 h,加入20 μL MTT溶液,避光培养4 h,吸去上清液,加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),孵育30 min测定490 nm吸光度[11]。按公式(2)计算巨噬细胞相对存活率:
细胞相对存活率![]()
(2)
1.3.6.2 巨噬细胞的NO分泌量测定
按照1.3.6.1培养和处理细胞,培养24 h,Griess法测定NO产生量[12]。将50 μL上清液与50 μL Griess I和Griess Ⅱ 混合,37 ℃孵育10 min,酶标仪测定540 nm吸光度。LPS(1 μg/mL)处理为阳性对照。
1.3.6.3 巨噬细胞的吞噬能力测定
按照1.3.6.1培养和处理细胞,培养24 h,吸去上清液,按照文献[13]方法测定OJP对巨噬细胞吞噬能力的影响。LPS(1 μg/mL)处理为阳性对照,培养基处理为空白对照。
1.3.7 统计学分析
所有实验均设置6次平行,实验结果取平均值。使用SPSS 16.0,Design Expert 8.0.6和Origin 9.0软件进行数据统计和处理。
2 结果与分析
2.1 单因素试验结果
如图1-a所示,随着超声温度升高,多糖提取率逐渐增加,80 ℃时达到最大值12.96%,温度进一步升高,提取率降低,表明温度升高可以加速多糖溶出,但温度过高可能会破坏多糖的结构稳定性,导致提取率下降[14]。如图1-b所示,多糖提取率随超声时间的延长有明显提高。50 min时达到最大值12.84%,随着时间继续延长,提取率呈下降趋势,表明较短的超声时间不足以让多糖完全溶出,而超声时间过长可能会使多糖部分降解,导致提取率下降[15]。如图1-c所示,多糖提取率随着溶剂量的增加逐渐提高,液料比为1∶30 (g∶mL)时,提取率达到最大值13.17%,这表明高溶剂量增加了多糖在水边界层的浓度差,使多糖加速溶出[16]。溶剂量继续加大提取率开始降低,可能是因为过多的溶剂量降低了多糖浓度,超声能量被过多消耗,导致多糖提取率下降[17]。
2.2 响应面优化OJP提取条件
2.2.1 响应面实验设计及结果
由单因素结果进行RSM试验,设置3次平行试验,取多糖得率的平均值,结果如表2所示。
2.2.2 模型的建立及显著性检验
RSM分析结果结合Design-Expert 8.0.6软件对试验结果进行拟合分析,回归模型方程如下:R1=13.65+0.79A+0.57B-0.42C-0.84AB+0.66AC+0.33BC-0.93A2-1.21B2-1.20C2。

a-超声温度;b-超声时间;c-料液比
图1 不同因素对多糖提取率的影响
Fig.1 Effects of different factors on the extraction rate of polysaccharide
表2 响应面实验设计及结果
Table 2 Response surface experimental design and results
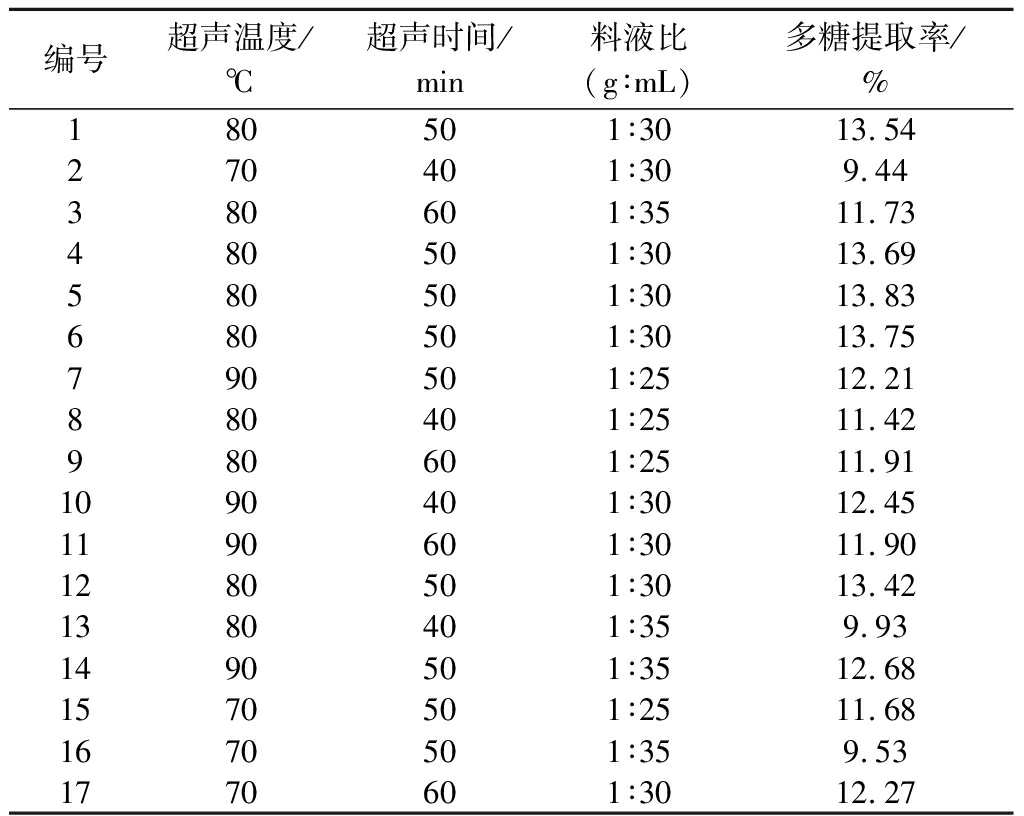
编号超声温度/℃超声时间/min料液比(g∶mL)多糖提取率/%180501∶3013.54270401∶309.44380601∶3511.73480501∶3013.69580501∶3013.83680501∶3013.75790501∶2512.21880401∶2511.42980601∶2511.911090401∶3012.451190601∶3011.901280501∶3013.421380401∶359.931490501∶3512.681570501∶2511.681670501∶359.531770601∶3012.27
回归模型方差分析结果见表3,各自变量对因变量的影响均显著。P<0.001,说明模型极显著;R2=0.992 2说明模型拟合程度良好;模型失拟项F=1.60,P=0.322 5>0.05,表明失拟项不显著,模型可用;校正系数![]() 表明响应面效果与实验有较高拟合度,回归方程可用于实验结果的分析预测[18]。表3中数据表明各因素对多糖提取率的影响为超声温度(A)>超声时间(B)>料液比(C)。
表明响应面效果与实验有较高拟合度,回归方程可用于实验结果的分析预测[18]。表3中数据表明各因素对多糖提取率的影响为超声温度(A)>超声时间(B)>料液比(C)。
2.2.3 响应曲面及等高线分析
运用Design-expert软件对各因素的交互作用进行响应面分析,考察两因素间的交互对提取率的影响(图2)。响应面的3D立体图的走势和等高线可反映因素之间交互程度的强弱。3D图的曲线形势越陡峭,表明因素间影响越显著,反之则表明影响越小。变量间的显著交互程度可由等高线直观反应,等高线越趋于椭圆,表明两因素之间的影响越显著,等高线越趋于圆,则两因素间的影响越不显著。由图2结果可知,超声温度(A)和超声时间(B)的交互作用较为显著,超声温度(A)和料液比(C)、超声时间(B)和料液比(C)交互作用不显著。
表3 回归模型的方差分析
Table 3 Analysis of variance in regression model

来源平方和自由度均方FP显著性模型31.5893.5199.08<0.000 1∗∗A4.9914.99140.98<0.000 1∗∗B2.6112.6173.71<0.000 1∗∗C1.4011.4039.610.000 4∗∗AB2.8612.8680.65<0.000 1∗∗AC1.7211.7248.460.000 2∗∗BC0.4310.4312.110.010 3∗A23.6213.62102.33<0.000 1∗∗B26.1216.12172.70<0.000 1∗∗C26.0216.02169.85<0.000 1∗∗残差0.2570.035失拟项0.1430.0451.600.322 5误差0.1140.028总和31.8316
注:*表示差异显著(P <0.05),**表示差异极显著(P <0.001)
2.2.4 验证试验
利用统计优化工具对OJP提取条件进行优化的最适条件为温度83.57 ℃,时间51.04 min,料液比1∶29.68(g∶mL),此条件下多糖得率为13.83%。模型预测的条件下,通过实验验证了响应面模型结果。优化的试验条件结合实际操作,调整最佳条件为超声温度83.6 ℃,超声时间51 min,料液比1∶29.7(g∶mL),此时测定OJP提取率为13.81%,与预测值接近,证实了响应模型的有效性,优化得到的最佳工艺具有可行性。
2.3 OJP的分子质量和单糖组成
OJP的HPSEC图谱如图3-a所示,色谱峰均一性较差,说明OJP为杂多糖,其重均分子质量为3.264×104 Da。如图3-b所示,OJP中含有阿拉伯糖(29.94%)、半乳糖(52.48%)、葡萄糖(11.32%)以及少量的木糖(2.22%)、半乳糖醛酸(3.5%)和葡萄糖醛酸(0.53%)。

图2 各因素交互作用对多糖提取率的影响
Fig.2 Interactive effects of various factors on extraction rate of polysaccharide

a-HPSEC图谱;b-高效阴离子色谱图
图3 OJP的HPSEC图谱和高效阴离子色谱图
Fig.3 HPSEC spectrum and high performance anion chromatography of OJP
2.4 OJP对巨噬细胞RAW264.7的激活作用
2.4.1 OJP对巨噬细胞RAW264.7的增殖作用
巨噬细胞是免疫系统的重要组成部分,也是评价活性成分免疫调节能力的重要载体[19]。图4描述了不同质量浓度(25~400 μg/mL)的OJP对巨噬细胞RAW264.7存活率的影响,实验浓度范围内,OJP对巨噬细胞无细胞毒性。实验组巨噬细胞存活率均高于空白组,且OJP对巨噬细胞的增殖作用显现出剂量依赖关系。
2.4.2 OJP对巨噬细胞RAW264.7的NO分泌量影响
NO可刺激各种细胞因子的产生,参与各种生理和病理反应,是免疫细胞被激活的重要指标[20]。由图5可知,细胞在不同质量浓度(25~400 μg/mL)OJP中培养24 h后,与空白组相比,NO分泌量均呈现增加趋势,且表现出一定的剂量依赖关系,表明OJP可激活RAW264.7细胞,促进RAW264.7巨噬细胞中NO的产生。

图4 OJP对RAW264.7巨噬细胞活性的影响
Fig.4 Effects of OJP on cell viability of RAW264.7 macrophages

图5 OJP对RAW264.7巨噬细胞NO分泌的影响
Fig.5 Effects of OJP on NO secretion in RAW264.7 macrophages
2.4.3 OJP对巨噬细胞RAW264.7吞噬能力的影响
吞噬作用是巨噬细胞最基本防御机制之一,对保护人类免受有害病菌的侵害有重要作用[21]。通过中性红摄取试验探究了不同质量浓度(25~400 μg/mL)的OJP对RAW264.7细胞吞噬能力的影响。如图6所示,与空白组相比,经OJP处理组细胞的吞噬能力均有一定提升,且具有一定的剂量依赖性。当OJP质量浓度达到400 μg/mL时,巨噬细胞的吞噬能力增加率为17.58%。

图6 OJP对RAW264.7巨噬细胞吞噬能力的影响
Fig.6 Effects of OJP on phagocytic capacity of RAW264.7 macrophages
3 结论与讨论
水提法是多糖提取的传统方法,具有工艺简单、无污染等优点。在传统水提法基础上,使用超声辅助提取可大量减少提取时间,提高效率,同时也可降低多糖长时间高温提取中的损失,本研究采用响应面法实验优化得到超声辅助提取OJP的最佳提取条件,多糖提取率为13.81%。单糖组成和分子质量是多糖最基本的结构特征,经HPSEC和离子色谱分析,OJP分子质量为3.264×104 Da,由阿拉伯糖(29.94%)、半乳糖(52.48%)、葡萄糖(11.32%)以及微量的木糖(2.22%)、半乳糖醛酸(3.5%)和葡萄糖醛酸(0.53%)等单糖组成,这为其进一步的研究奠定了基础。
巨噬细胞在免疫应答中发挥重要功能,一般情况下,机体中的巨噬细胞处于相对静止的状态,仅具有一定的非特异性吞噬和趋化能力[22]。研究发现多糖或其他免疫调节剂的刺激可有效激活巨噬细胞,使其分化成M1型巨噬细胞。M1型巨噬细胞的典型特征是吞噬能力增强、NO和促炎因子的分泌量大幅提升,主要参与病原清除和免疫启动[23]。NO是一种重要的信使分子,参与调节各种生理和病理反应,同时可以刺激TNF-α、IL-6和IL-1β等细胞因子的分泌,是免疫细胞激活的重要指标[24]。丁航等[25]研究发现香菇多糖能刺激小鼠腹腔巨噬细胞活化,NO产生量大幅增加;LI等[26]研究了脆江蓠多糖对巨噬细胞的活化作用,发现脆江蓠多糖可显著促进巨噬细胞的增殖和NO分泌;DU等[27]研究发现无花果多糖可以增强巨噬细胞吞噬能力,促进NO和细胞因子的分泌。这与本研究得出的OJP能有效促进巨噬细胞RAW264.7增殖,提升NO的分泌量以及增强其吞噬能力的结果相一致,说明OJP可激活巨噬细胞RAW264.7,并刺激其向M1型巨噬细胞分化。因此,OJP具有潜在的免疫调节作用,其免疫调节的机制有待后续深入探究。本研究为OJP的深入研究提供了参考,为水芹在医药和功能性食品领域的应用提供了理论依据。
[1] 李瑞, 王燕, 李良俊.水芹品质研究现状[J].长江蔬菜, 2017(22):27-31.
LI R, WANG Y, LI L J.Quality research status of water celery[J].Journal of Changjiang Vegetables, 2017(22):27-31.
[2] 唐明明. 水芹的漂烫、超微粉碎及具有降血糖活性的固体饮料的工艺研究[D].合肥:合肥工业大学, 2019.
TANG M M.Study on blanching, superfine grinding of water dropwort and processing technology of solid beverage with hypoglycemic activity[D].Hefei:Hefei University of Technology, 2019.
[3] 黄正明, 杨新波, 曹文斌.水芹的本草考证[J].中草药, 2001,32(1):59-62.
HUANG Z M, YANG X B, CAO W B.Textual study on Oenanthe javanica documented in ancient Chinese medicinal literatures[J].Chinese Traditional and Herbal Drugs, 2001,32(1):59-62.
[4] PARK J H, CHO J H, KIM I H, et al.Oenanthe javanica extract protects against experimentally induced ischemic neuronal damage via its antioxidant effects[J].Chinese Medical Journal, 2015, 128(21):2 932-2 937.
[5] 郭晓青, 韦隆华, 代甜甜, 等.水芹化学成分检测及降血糖作用[J].食品与机械, 2017, 33(1):155-157;173.
GUO X Q, WEI L H, DAI T T, et al.The detection of the chemical components in Oenanthe javanica and its hypoglycemic activity[J].Food and Machinery, 2017, 33(1):155-157;173.
[6] 刘哲慧, 张琳.水芹总黄酮对免疫抑制小鼠免疫功能的影响[J].中国中医药科技, 2016, 23(4):423-425.
LIU Z H, ZHANG L.Effects of total flavone extract from SHuiqin (Oenanthe javanica) on immune function of immunosuppression mice[J].Chinese Journal of Traditional Medical Science and Technology, 2016, 23(4):423-425.
[7] 张伟, 黄正明, 陈晓农.水芹总酚酸对正常小鼠免疫功能的影响[J].解放军药学学报, 2013,29(1):17-19.
ZHANG W, HUANG Z M, CHEN X N.Effect of total phenolics acid extracted from Oenanthe javanica on immune function in normal mice[J].Pharmaceutical Journal of Chinese PLA, 2013,29(1):17-19.
[8] 崔明晓, 王晓晨, 王玉, 等.超声辅助提取大石花菜多糖及其抗氧化研究[J].上海海洋大学学报, 2018, 27(5):797-804.
CUI M X, WANG X C, WANG Y, et al.Ultrasonic-assisted extraction and anti-oxidation of polysaccharides from Gelidium pacifium Okam[J].Journal of Shanghai Ocean University, 2018, 27(5):797-804.
[9] 刘艳芳, 薛令坤, 唐庆九, 等.刺芹侧耳下脚料水溶性细胞壁多糖碱提工艺优化及活性分析[J].食用菌学报, 2019, 26(4):116-122.
LIU Y F, XUE L K, TANG Q J, et al.Alkaline extraction condition optimization for water soluble polysaccharide in cell wall of waste Pleurotus eryngii and its immunological activity in vitro[J].Acta Edulis Fungi, 2019, 26(4):116-122.
[10] 何连军, 干雅平, 吕伟德, 等.高效阴离子交换色谱-脉冲安培检测法测定多花黄精多糖的单糖组成[J].中草药, 2017, 48(8):1 671-1 676.
HE L J, GAN Y P, LV W D, et al.Monosaccharide composition analysis on polysaccharides in Polygonatum cyrtonema by high performance anion-exchange chromatography with pulsed amperometric detection[J].Chinese Traditional and Herbal Drugs, 2017, 48(8):1 671-1 676.
[11] NAI J J, ZHANG C, SHAO H L, et al.Extraction, structure, pharmacological activities and drug carrier applications of Angelica sinensis polysaccharide[J].International Journal of Biological Macromolecules, 2021, 183:2 337-2 353.
[12] YOU S Y, LIU X W, XU G T, et al.Identification of bioactive polysaccharide from Pseudostellaria heterophylla with its anti-inflammatory effects[J].Journal of Functional Foods, 2021, 78:104353.
[13] YANG D D, LIN F D, HUANG Y Y, et al.Separation, purification, structural analysis and immune-enhancing activity of sulfated polysaccharide isolated from sea cucumber viscera[J].International Journal of Biological Macromolecules, 2020, 155:1 003-1 018.
[14] 李德龙, 陈冰婷, 谭惠文, 等.响应面优化药桑椹多糖超声提取工艺及其抗氧化活性研究[J].中国食品添加剂, 2021, 32(7):14-22.
LI D L, CHEN B T, TAN H W, et al.Optimization of ultrasonic extraction of polysaccharides from medicinal mulberry by response surface methodology and its antioxidant activity[J].China Food Additives, 2021, 32(7):14-22..
[15] 张亚楠, 董旭然.秋葵多糖提取及抗氧化性的研究进展[J].现代农村科技, 2019(10):66-67.
ZHANG Y N, DONG X R.Research progress on extraction and antioxidant activity of okra polysaccharides[J].Modern Rural Science and Technology, 2019(10):66-67.
[16] 闫亚茹, 孙飞龙, 张冬梅.响应面法优化菠菜多酚的提取工艺研究[J].应用化工, 2017, 46(7):1 306-1 308.
YAN Y R, SUN F L, ZHANG D M.Optimization of ultrasonic extraction process of polyphenols from spinach by response surface methodology[J].Applied Chemical Industry, 2017, 46(7):1 306-1 308.
[17] 王炜清, 庄虎, 王康平, 等.石榴皮渣果胶电解水提取工艺及其结构特性[J].食品科学, 2020, 41(12):243-249.
WANG W Q, ZHUANG H, WANG K P, et al.Electrolyzed water extraction and structural characteristics of pectin from pomegranate pomace[J].Food Science, 2020, 41(12):243-249.
[18] 吴云, 陈薇, 田文慧, 等.树莓果肉多糖超声提取工艺优化及其抗疲劳作用[J].天然产物研究与开发, 2020, 32(12):2 081-2 093.
WU Y, CHEN W, TIAN W H, et al.Ultrasonic extraction optimization of raspberry(Rubus idaeus L.) pulp polysaccharides and its anti-fatigue activity[J].Natural Product Research and Development, 2020, 32(12):2 081-2 093.
[19] SHI Z Y, AN L J, ZHANG S J, et al.A heteropolysaccharide purified from leaves of Ilex latifolia displaying immunomodulatory activity in vitro and in vivo[J].Carbohydrate Polymers, 2020, 245:116469.
[20] GU J Y, ZHANG H H, ZHANG J X, et al.Preparation, characterization and bioactivity of polysaccharide fractions from Sagittaria sagittifolia L[J].Carbohydrate Polymers, 2020, 229:115355.
[21] ZHAO P, ZHOU H F, ZHAO C C, et al.Purification, characterization and immunomodulatory activity of fructans from Polygonatum odoratum and P.cyrtonema[J].Carbohydrate Polymers, 2019, 214:44-52.
[22] 林玲辉. 银杏叶多糖的抗炎活性及其抗炎信号转导机制[D]. 长春: 吉林大学, 2012.
LIN L H. Anti-inlfammatory activity and anti-inflammatiory signal transduction mechanism of polysacchairdes from Ginkgo biloba leaf[D]. Changchun: Jilin University, 2012.
[23] LEE S, KI C S.Inflammatory responses of macrophage-like RAW264.7 cells in a 3D hydrogel matrix to ultrasonicated schizophyllan[J].Carbohydrate Polymers, 2020, 229:115555.
[24] ZHANG T T, YE J F, XUE C H, et al.Structural characteristics and bioactive properties of a novel polysaccharide from Flammulina velutipes[J].Carbohydrate Polymers, 2018, 197:147-156.
[25] 丁航, 侯敢, 周克元,等.香菇多糖对巨噬细胞一氧化氮和一氧化氮合酶活性的影响[J].广东药学, 2003,13(4):32-33.
DING H, HOU G, ZHOU K Y, et al.Effects of lentinan on the nitric oxide production and the inducible nitric oxide synthase in mounse peritoneal macrophages[J]. Guangdong Pharmaceutical Journal, 2003,13(4):32-33.
[26] LI F F, LIU K H, LIU K W.Chemical characterization of a new sulfated polysaccharide from Gracilaria chouae and its activation effects on RAW264.7 macrophages[J].Journal of Zhejiang University-SCIENCE B, 2022, 23(1):84-88.
[27] DU J, LI J J, ZHU J H, et al.Structural characterization and immunomodulatory activity of a novel polysaccharide from Ficus carica[J].Food & Function, 2018, 9(7):3 930-3 943.