血红素(heme)是一种重要的金属卟啉化合物,亚铁离子处于卟啉环的中心位置[1];血红素具有多种重要的生理功能,如参与生物体内的多种代谢活动,作为各种血红蛋白的辅基为其提供蛋白活性[2],参与活性氧分解、电子传递、信号转导等生物过程[3],也可以作为一种重要的生物补铁剂,对于维持生物内铁的转换和平衡有着非常重要的生理意义[4];因此血红素被医药、食品等行业广泛应用[5-6]。
铁摄取调节子(ferric uptake regulator,Fur)是一种全局性转录调控因子,不仅参与铁代谢的转录调节,还参与了能量代谢、氧化应激、信号传导等生物过程的调节[7];在大肠杆菌中,铁摄取调节子主要以转录阻遏抑制的模式参与到铁转运和铁贮存的转录调节[8]。染料脱色过氧化物酶(dye-decolorizing peroxidase,EfeB)是一种以血红素为辅基的过氧化物酶,具有广泛的底物特异性,能够催化降解多种有机物和难降解的染料[9],研究表明在大肠杆菌中EfeB对菌体的生长和氧化应激的调控具有重要的调控作用[10];efeB属于EfeUOB转运系统,具有特异性的铁转运功能,efeUOB操纵子的共转录受到fur调节子的调控,而efeB还额外受到一个σ因子的调控[11]。亚铁鳌合酶由henH编码,是血红素C5合成途径中最后一步的作用酶,负责催化原卟啉Ⅸ与亚铁结合从而形成血红素,是血红素合成的限速步骤之一[12]。
生物体中的多种蛋白如肌红蛋白、血红蛋白和细胞色素b等都结合有含亚铁的卟啉,即血红素,然而它们也可以与不含亚铁的卟啉即原卟啉Ⅸ结合,这会导致其蛋白的活性降低甚至失活;因此,对于这类蛋白的催化活性来说,是否结合有完整的血红素是非常关键的因素[13]。
本研究以血红素C5合成途径的最后一步为对象,通过对大肠杆菌中fur、efeB、hemH 3个基因的表达进行调控,研究了不同条件下对于血红素合成的影响,为血红素C5合成途径下游的研究提供了一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本研究中所用到的质粒和菌株相关信息见表1。
1.1.2 试剂与仪器
限制性内切酶EcoR I、HindⅢ、Xho I,质粒提取,RNA提取、反转录、实时荧光定量PCR试剂盒,TaKaRa公司;ClonExpress® MultiS One Step Cloning Kit,南京诺唯赞有限公司;血红素标准品、二水合草酸、冰乙酸,国药沪试;IPTG、硫酸卡那霉素(kanamycin monosulfate,Kan),上海生工生物。
表1 本研究中使用的质粒和菌株
Table 1 Strains and plasmids used in this study

菌株/质粒描述来源质粒pEH[14]pET28a连接hemH实验室保存pEE[10]pEHEpET28a连接efeBpET28a连接hemH和efeB实验室保存本研究 菌株E.coli BL21(DE3)EcoΔfur[15]Eco/pEHEco/pEEEcoΔfur/pEHEcoΔfur/pEEEco/pEHE野生型E.coli BL21(DE3)敲除furE.coli BL21(DE3)导入pEHE.coli BL21(DE3)导入pEEEcoΔfur导入pEHEcoΔfur导入pEEE.coli BL21(DE3)导入pEHE实验室保存实验室保存实验室保存实验室保存本研究 本研究 本研究
核酸电泳仪、凝胶成像仪及电转仪,Bio-Rad公司;紫外可见光分光光度计,尤尼柯(上海)仪器有限公司;Enspire多标记检测系统(酶标仪),珀金埃尔默有限公司;实时荧光定量PCR仪,美国应用生物系统有限公司。
1.1.3 培养基
LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10。pH调至7.0;固体培养基加入2%的琼脂粉,1×105 Pa灭菌20 min。
1.2 实验方法
1.2.1 转化方法
提前将制备好的感受态细胞于冰上解冻,加入2 μL质粒于100 μL感受态细胞中,用枪头轻轻吸吹混匀,先冰浴30 min,然后42 ℃热激90 s,再冰浴3~5 min,加入1 mL新鲜的LB培养基,37 ℃、200 r/min复苏60 min;然后12 000 r/min离心2 min,去上清液,剩余菌液浓缩混匀后涂布到Kan抗性的LB固体平板上,37 ℃过夜培养获得阳性克隆。
1.2.2 共表达质粒的构建
引物使用SnapGene软件设计,交由生工生物(上海)股份有限公司合成。引物序列如表2所示。
表2 所用引物
Table 2 Sequences of primers used

引物名称引物序列(5′-3′)efeB-FggtggtgctcgagTTAAACCCGCAATAAefeB-RgctaaaagcttTTTGTTTAACTTTAAGAAGGAGAATGCAGTATAAAGATGAAAACGGCG
注:小写字母代表同源臂序列,斜体代表RBS序列,下划线代表酶切位点序列
以实验室保存的质粒pEE为模板,使用引物efeB-F和efeB-R按照PCR程序进行扩增;为了保证重组后efeB和hemH都能正常转录表达,在其中一个同源臂引物上加入一段质粒pET28a自身的RBS序列,最终得到含有RBS的efeB的扩增产物。将质粒pEH用HindⅢ进行单酶切使其线性化,将以上PCR产物和酶切产物纯化后进行连接。
连接产物经转化后挑取阳性克隆,接种至含Kan抗性的LB液体培养基中,摇床培养后提取质粒后进行双酶切验证,条带大小正确的质粒送样至生工生物(上海)股份有限公司进行测序,再把测序结果正确的质粒转化至E.coli BL21(DE3)感受态细胞中,重组菌命名为Eco/pEHE,-80 ℃冰箱保存。重组质粒的结构如图1所示。

图1 pEHE质粒示意图
Fig.1 Scheme of pEHE
1.2.3 培养方法
菌株的构建和发酵:均为250 mL摇瓶装液量50 mL,37 ℃、200 r/min摇床培养8 h;含有质粒的菌株添加终质量浓度为50 mg/L的Kan抗生素,在培养至OD600值约为0.8时,加入终浓度0.2 mmol/L的IPTG继续培养诱导。
1.2.4 蛋白的诱导表达
将重组菌在37 ℃,200 r/min过夜活化后,按2%接种量转接至含50 μg/mL Kan抗生素的新鲜LB液体培养基中,相同条件培养至OD600值约为0.8时,加入终浓度为0.2 mmol/L的IPTG,37 ℃条件诱导6 h。于4 ℃,8 000 r/min离心10 min收集菌体,弃上清液,剩余菌体用磷酸缓冲液(20 mmol/L,pH=7.4)悬浮,超声破碎细胞20 min,所得到的蛋白样品用12%的SDS-PAGE进行分析。
1.2.5 荧光定量PCR基因转录水平检测
将菌株活化转接培养至对数生长期后,12 000 r/min、4 ℃、5 min离心收集菌体,用50 mg/mL的溶菌酶在37 ℃金属浴中破壁30 min。之后按照Takara试剂盒说明书进行总RNA提取,使用核酸定量仪测RNA浓度及纯度,之后将RNA直接反转录成cDNA保存用于荧光定量实验。以上述cDNA为模板,荧光定量PCR引物如表3所示,选择编码3-磷酸甘油醛脱氢酶的基因gapA作为内参基因,采用SYBR® Green I嵌合荧光法,反应体系和步骤参照Takara试剂盒说明书操作。
表3 荧光定量 PCR 引物
Table 3 Primers for fluorescent quantitative PCR

引物引物序列(5′-3′)长度/bpgapAFGCTACTACCGCTACTCAG18gapARTCAGGTCAACTACAGATACG20furFCCTCGACTGCGGCAAGGTTATC22furRACTGTGGTTAGTCAGGCGAATGC23efeUFGCTGGTGATGATGGTCTT18efeURCAAGATTGAGGCGAATACC19efeOFGTGATGGTGGTGGAAGAG18efeORCCGCAGGTCATATCGTATT19efeBFCGTAGTAAAGGCAAAGAG18efeBRCTTATCATTCTGGCTATCG19
1.2.6 血红素浓度检测
参考陈丹园等[16]的血红素检测方法,利用荧光法检测大肠杆菌胞内的血红素浓度。
2 结果与分析
2.1 fur缺失菌中过表达hemH
hemH编码的亚铁螯合酶负责将Fe2+与卟啉环结合形成血红素,研究表明过表达hemH的菌株只有在限铁培养的条件下才会显示出血红素合成的优势,而铁摄取调节子基因fur的缺失会使胞内的总铁含量大幅下降[15];因此在fur缺失菌中过表达hemH,研究在这种基因表达情况下大肠杆菌的血红素合成的水平。
将菌株Eco/pEH中的质粒pEH提取后,使用热转化的方式将其导入预先制备好的EcoΔfur的感受态细胞中,对阳性克隆进行培养后,分别进行质粒的酶切验证和SDS-PAGE蛋白表达验证。hemH的基因片段大小为963 bp,其所编码的亚铁鳌合酶蛋白的大小约为35 kDa,其验证结果如图2所示。
质粒的酶切结果和蛋白表达结果表明质粒转入成功,并且可以正常转录表达,将重组菌命名为EcoΔfur/pEH并保藏。
重组菌的血红素含量检测结果如图3所示,大肠杆菌缺失fur基因会使血红素的含量大幅减少,同样也低于过表达hemH基因的Eco/pEH菌株的血红素含量,而重组菌EcoΔfur/pEH的血红素含量则前者更低,仅有0.32 μmol/L,说明hemH的过表达会对fur缺失菌的血红素合成途径产生抑制作用,使血红素的含量进一步减少。李蒙蒙[15]的研究表明,过表达hemH的菌株在限铁培养的条件下血红素含量相对较高,然而重组菌EcoΔfur/pEH的血红素含量却降到更低,说明改变基因表达水平的手段不同于改变培养条件的方法,其对细胞内部的影响更大,fur基因和hemH基因相互之间可能存在更复杂的关系。

a-双酶切验证(M-marker;1~4-pEH双酶切);b-SDS-PAGE验证 (M-marker;1-Eco/pEH全细胞;2-Eco/pEH上清液; 3-Eco/pEH包涵体;4-EcoΔfur全细胞;5-EcoΔfur 破碎上清液;6-EcoΔfur破碎沉淀)
图2 pEH质粒双酶切和SDS-PAGE验证
Fig.2 pEH double enzyme digestion and SDS-PAGE verification

图3 各菌株的血红素浓度
Fig.3 Concentration of heme in each strains
注:*数量不同代表具有显著性差异(P<0.05)(下同)
2.2 fur缺失菌中过表达efeB
efeB基因所在的efeUOB操纵子具有特异性的铁转运功能,fur对该操纵子有着调控作用,而efeB则还受到额外的细胞膜应激σ因子调控[11],因此在fur缺失菌中过表达efeB以调控该操纵子的表达,研究其对血红素合成的影响。
将菌株Eco/pEE中的质粒pEE提取后,导入预先制备好的EcoΔfur的感受态细胞中,对阳性克隆进行培养后,分别进行质粒的酶切验证和SDS-PAGE蛋白表达验证。efeB的基因片段大小为1 272 bp,其所编码的蛋白的大小约为46 kDa,其验证结果如图4所示。

a-双酶切验证(M-marker;1~4-pEE双酶切);b-SDS-PAGE 验证(M-marker;1-BL21全细胞;2-EcoΔfur/pEE全细胞; 3-EcoΔfur全细胞)
图4 pEE质粒双酶切和SDS-PAGE验证
Fig.4 pEE double enzyme digestion and SDS-PAGE verification
质粒的酶切结果和蛋白表达结果表明质粒转入成功,并且可以正常转录表达,将重组菌命名为EcoΔfur/pEE并保藏。
使用实时荧光定量PCR的方法对基因表达情况进行检测,结果如图5所示。
由图5可知,在重组菌EcoΔfur/pEE中,fur基因表达显著下调,efeB基因表达显著上调,而与efeB基因属于同一操纵子的efeU和efeO的表达则分别出现小幅的上调和下调。之前的研究表明,在大肠杆菌Nissle 1917中efeU基因和efeOB基因的表达率有所不同,不确定它们之间是否还存在有其他转录起点[17]。efeU基因和efeO基因表达水平的变化不一致且幅度微小,结合efeB基因在低pH下表达的特性,推测efeUO基因在该条件下也没有完全表达,或者铁摄取调节子对efeUO基因表达的调控在该条件下不明显。

图5 菌株EcoΔfur/pEE基因相对转录水平
Fig.5 Relative transcription level of genes in EcoΔfur/pEE
由图6可知,fur基因的缺失会使大肠杆菌的血红素含量大幅减少,而在过表达efeB基因后会有所回升,fur和efeB都涉及细胞的铁转运,而铁含量以及铁转运速率对于血红素合成途径的最后一步至关重要,重组菌血红素含量检测的结果表明efeB基因的过表达缓解了fur基因缺失给血红素合成途径带来的负面影响。

图6 各菌株的血红素浓度
Fig.6 Concentration of heme in each strains
2.3 efeB和hemH共表达
efeB的过表达对fur缺失菌的血红素合成有提升作用,而EfeUOB铁转运系统对亚铁更具亲和力,因此将efeB与编码亚铁鳌合酶的基因hemH共表达,研究它们对血红素合成的影响。
以质粒pEE为PCR模板,引物为efeB-F和efeB-R,按照PCR反应体系和程序进行扩增,扩增产物如图7所示,efeB基因的片段大小为1 272 bp,扩增产物的电泳位置在理论值附近,说明目的基因片段扩增成功。
将扩增产物与线性化的质粒pEH进行连接后,挑选阳性克隆后对其质粒提取后进行双酶切验证,目的基因片段的大小为2 258 bp,条带验证正确,共表达菌株命名为Eco/pEHE,并进行SDS-PAGE蛋白表达验证,结果如图8所示。

M-marker;1~4-efeB
图7 目的基因efeB的扩增
Fig.7 Amplification of the target efeB gene

a-双酶切验证(M-marker;1~4-pEHE双酶切);b-SDS-PAGE 验证(M-marker;1-BL21全细胞;2-Eco/pEE全细胞; 3-Eco/pEHE全细胞;4-Eco/pEHE破碎上清液; 5-Eco/pEHE破碎沉淀)
图8 pEHE质粒双酶切和SDS-PAGE验证
Fig.8 pEHE double enzyme digestion and SDS-PAGE verification
由SDS-PAGE验证图可知,重组菌Eco/pEHE中hemH编码的亚铁鳌合酶成功表达,而efeB基因所编码的蛋白并没有明显增加,这种现象可能是由于利用单一转录单元共表达时,第二个基因转录不完全造成的[18]。
重组菌Eco/pEHE的血红素浓度如图9所示,可以看出其含量达到了4.68 μmol/L,相对于出发菌株BL21的提高了约1.72倍,效果比较明显,说明efeB基因和hemH基因的共表达可以有效促进血红素代谢途径,提高血红素产量。EfeB是一种血红素结合蛋白,与亚铁鳌合酶的共表达可以提高菌株的血红素产量。有研究表明,血红素结合蛋白(如一氧化氮合酶)与亚铁鳌合酶共表达并结合外源添加时,可以使该蛋白中完全掺入血红素[13],与本研究的结果一致。
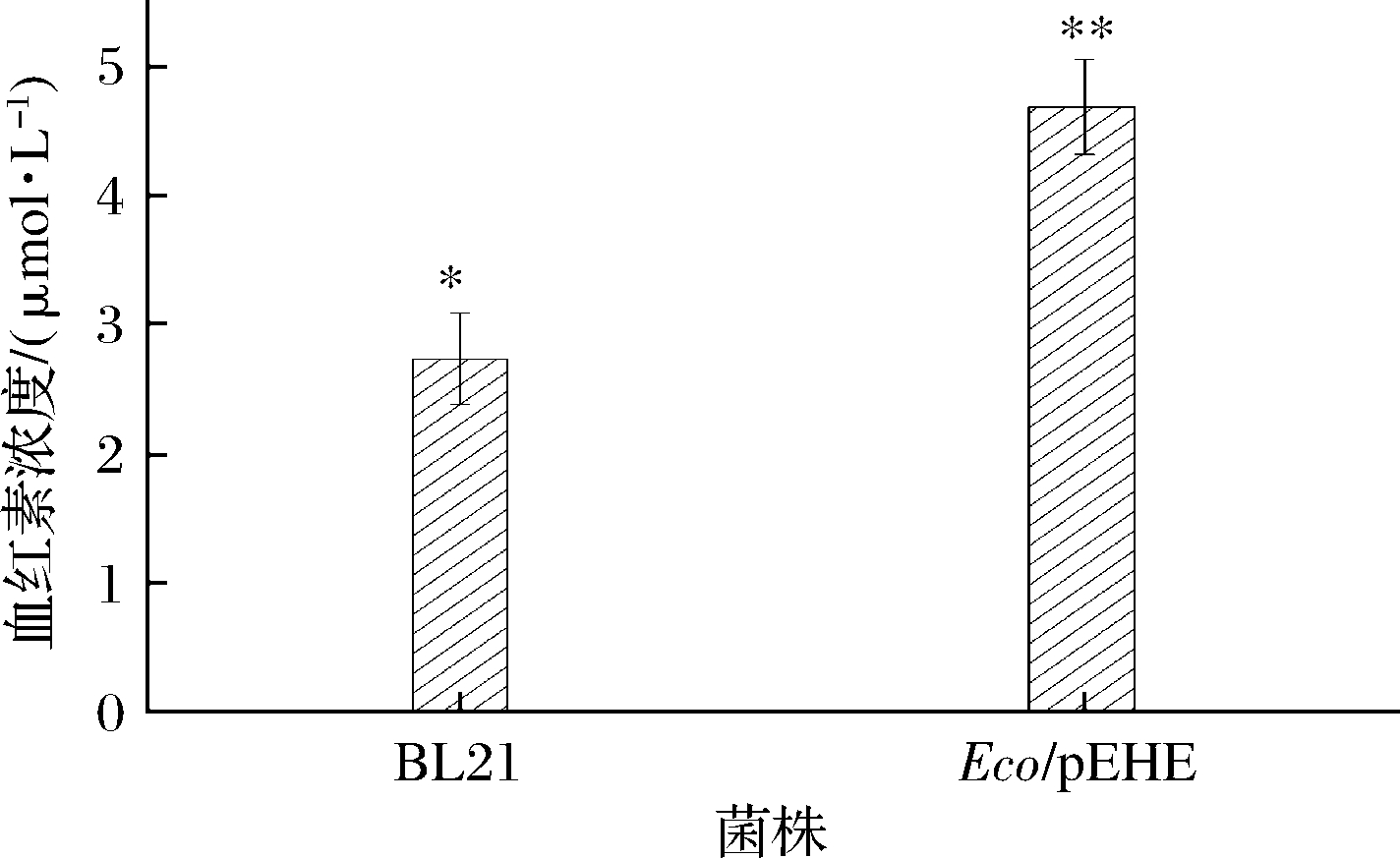
图9 重组菌株的血红素浓度
Fig.9 Concentration of heme in recombinant strain
3 讨论
血红素具有很多重要的生物学功能,参与生物体众多的生物过程,同时也是生物体中铁元素的重要来源。以血红素为辅基的各种蛋白酶对各种生物学过程至关重要,也在实际生产中有广泛应用,而其中的血红素结合不足是导致酶活性难以提高的重要原因[19]。目前的研究大多集中在上游关于前体物质5-氨基乙酰丙酸(5-aminolevulinicacid,ALA)的部分[20-22],ALA含量的增加可以有效提高血红素的合成水平,而过高的ALA水平会对细胞产生毒害,同时外源添加ALA的成本相对过高[23-24]。
本研究主要关注了血红素合成途径的最后一步,以3个与血红素中心离子Fe2+相关的基因fur、hemH、efeB为研究对象,分别进行了不同的表达调控,表明fur基因的缺失而造成的缺铁并不能使hemH过表达菌的血红素含量提高,反而会进一步抑制其合成;而efeB基因的过表达则可以缓解由于fur缺失造成的血红素合成的抑制;efeB与hemH的共表达则可以显著提升大肠杆菌的血红素合成水平,相比于出发菌株提高了约1.72倍。综上,为大肠杆菌的血红素含量的提高提供了一定的策略。
[1] FRANKENBERG N, MOSER J, JAHN D.Bacterial heme biosynthesis and its biotechnological application[J].Applied Microbiology and Biotechnology, 2003, 63(2):115-127.
[2] SHIMIZU T, HUANG D Y, YAN F, et al.Gaseous O-2, NO, and CO in signal transduction:Structure and function relationships of heme-based gas sensors and heme-redox sensors[J].Chemical Reviews, 2015, 115(13):6 491-6 533.
[3] FIEGE K, QUEREBILLO C J, HILDEBRANDT P, et al.Improved method for the incorporation of heme cofactors into recombinant proteins using Escherichia coli nissle 1917[J].Biochemistry, 2018, 57(19):2 747-2 755.
[4] STOJILJKOVIC I, PERKINS-BALDING D.Processing of heme and heme-containing proteins by bacteria[J].DNA and Cell Biology, 2002, 21(4):281-295.
[5] RYTER S W.Significance of heme and heme degradation in the pathogenesis of acute lung and inflammatory disorders[J].International Journal of Molecular Sciences, 2021, 22(11):5509.
[6] QUINTERO-GUTIÉRREZ A G, GONZ LEZ-ROSENDO G, S
LEZ-ROSENDO G, S NCHEZ-MU
NCHEZ-MU OZ J, et al.Bioavailability of heme iron in biscuit filling using piglets as an animal model for humans[J].International Journal of Biological Sciences, 2008, 4(1):58-62.
OZ J, et al.Bioavailability of heme iron in biscuit filling using piglets as an animal model for humans[J].International Journal of Biological Sciences, 2008, 4(1):58-62.
[7] FILLAT M.F.The FUR (ferric uptake regulator) superfamily:Diversity and versatility of key transcriptional regulators[J].Archives of Biochemistry and Biophysics, 2014, 546:41-52.
[8] SEO S W, KIM D, LATIF H, et al.Deciphering Fur transcriptional regulatory network highlights its complex role beyond iron metabolism in Escherichia coli[J].Nature Communications, 2014, 5:4910.
[9] STURM A,SCHIERHORN A,LINDENSTRAUSS U, et al.YcdB from Escherichia coli reveals a novel class of Tat-dependently translocated hemoproteins[J].Journal of Biological Chemistry, 2006, 281(20):13 972-13 978.
[10] 丁亮亮,刘进生,顾鹏帅, 等.大肠杆菌过氧化物酶EfeB在细胞氧化应激中的作用[J].食品与发酵工业, 2020, 46(17):33-39.
DING L L, LIU J S, GU P S, et al.The role of peroxidase EfeB in Escherichia coli under cell oxidative stress[J] Food and Fermentation Industries, 2020, 46 (17):33-39.
[11] MIETHKE M, MONTEFERRANTE C G, MARAHIEL M A, et al.The Bacillus subtilis EfeUOB transporter is essential for high-affinity acquisition of ferrous and ferric iron[J].Biochimica et Biophysica Acta.Molecular Cell Research, 2013, 1 833(10):2 267-2 278.
[12] PRANAWIDJAJA S, CHOI S I, LAY B W, et al.Analysis of heme biosynthetic pathways in a recombinant Escherichia coli[J].Journal of Microbiology and Biotechnology, 2015, 25(6):880-886.
[13] SUDHAMSU J, KABIR M, AIROLA M V, et al.Co-expression of ferrochelatase allows for complete heme incorporation into recombinant proteins produced in E.coli[J].Protein Expression and Purification, 2010, 73(1):78-82.
[14] 陈丹园. 大肠杆菌血红素合成途径关键酶基因的表达与调控[D].无锡:江南大学,2018.
CHEN D Y.Expression and regulation of genes coding for the key enzyme in heme synthstic pathway in E.coli [D].Wuxi:Jiangnan University, 2018.
[15] 李蒙蒙. 铁摄取调节子与亚铁鳌合酶基因表达对大肠杆菌血红素合成的调控[D].无锡:江南大学,2019.
LI M M.Regulation of iron uptake regulator and ferrochelatase gene expression on heme synthesis of Escherichia coli [D].Wuxi:Jiangnan University, 2019.
[16] 陈丹园,沈云杰,杨燕, 等.关键酶基因的过表达与环境因素对大肠杆菌血红素合成的调控[J].食品与发酵工业, 2018, 44(11):7-14.
CHEN D Y, SHEN Y J, YANG Y, et al.Regulation of heme synthesis in Escherichia coli by overexpression of genes for the key enzymes and environmental factors[J]. Food and Fermentation Industries, 2018, 44 (11):7-14.
[17] GROSSE C, SCHERER J, KOCH D, et al.A new ferrous iron-uptake transporter, EfeU (YcdN), from Escherichia coli[J].Molecular Microbiology, 2006, 62(1):120-131.
[18] 马蓉,徐昊,丁锐, 等.大肠杆菌多基因共表达策略[J].中国生物工程杂志, 2012, 32(4):117-122.
MA R,XU H,DING R, et al.The strategy of gene coexpression in Escherichia coli[J].China Biotechnology, 2012, 32 (4):117-122.
[19] GRAVES P E, HENDERSON D P, HORSTMAN M J, et al.Enhancing stability and expression of recombinant human hemoglobin in E.coli:Progress in the development of a recombinant HBOC source[J].Biochimica Et Biophysica Acta-Proteins and Proteomics, 2008, 1 784(10):1 471-1 479.
[20] FENG C Q, PAN M, TANG L.5-Aminolevulinic acid level and dye-decolorizing peroxidase expression regulate heme synthesis in Escherichia coli[J].Biotechnology Letters, 2022, 44(2):271-277.
[21] DE ARMAS-RICARD M, LEVIC N G, KATZ A, et al.Cellular levels of heme affect the activity of dimeric glutamyl-tRNA reductase[J].Biochemical and Biophysical Research Communications, 2011, 405(1):134-139.
N G, KATZ A, et al.Cellular levels of heme affect the activity of dimeric glutamyl-tRNA reductase[J].Biochemical and Biophysical Research Communications, 2011, 405(1):134-139.
[22] YU T H, TAN S I, YI Y C, et al.New insight into the codon usage and medium optimization toward stable and high-level 5-aminolevulinic acid production in Escherichia coli[J].Biochemical Engineering Journal, 2022, 177:108259.
[23] ZHANG J L, WENG H J, ZHOU Z X, et al.Engineering of multiple modular pathways for high-yield production of 5-aminolevulinic acid in Escherichia coli[J].Bioresource Technology, 2019, 274:353-360.
[24] 张良程. 大肠杆菌中5-氨基乙酰丙酸转运蛋白的研究[D].天津:天津科技大学,2016.
ZHANG L C.Study on 5-aminolevulinic acid transporters in Escherichia coli [D].Tianjin:Tianjin University of Science and Technology, 2016.