生物胺(biogenic amines,BAs)是一种含氮低分子质量的有机化合物,由氨基酸的脱羧或活细胞代谢过程中醛和酮的胺化和转氨作用产生[1],在发酵食品中广泛存在。郫县豆瓣是我国传统发酵调味品的代表,品牌价值超过600亿元人民币。甜瓣子是郫县豆瓣的主要原料之一,它是由鲜豆瓣制曲得到霉豆瓣,再加入适量的盐水发酵制成[2],富含蛋白质,其发酵过程产生的氨基酸是郫县豆瓣中BAs的主要前体物质。有学者对市场上21种郫县豆瓣中的BAs抽查检测,发现部分豆瓣样品中的酪胺(tyramine,Tyr)、组胺(histamine,His)及2-苯乙胺(2-phenylethylamine,2-Phe)的含量超过了欧盟标准,对人体健康有潜在风险[3-4]。食用富含BAs的食物会刺激血管或神经系统,并导致患者产生食物中毒症状,如恶心、呼吸窘迫、潮热、头痛、出汗、口腔灼烧、心悸、高血压或低血压等[5-9]。已有文献报道了多种可抑制食品中BAs形成的方法,其一是抑制形成BAs的微生物的生长,其二是抑制形成BAs的酶活性[10-11]。有研究表明,可通过在发酵过程中控制pH值、发酵时间和温度等微生物的发酵条件实现抑制生物胺的含量[12-15]。MAH等[16]通过加入食品添加剂来控制BAs,大蒜等天然提取物可以抑制BAs的产生并延缓发酵过程中微生物的生长。BAs的生物合成过程中有多巴脱羧酶的参与,BERTOLDI等[17]研究表明,表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-gallate,EGCG]与酶相互作用并结合,抑制多巴脱羧酶,从而证明EGCG能够使多巴脱羧酶失活。但是,不同的食品基质及发酵条件会对BAs的形成产生显著影响。然而,上述研究仅以发酵过程中的微生物为目标,并没有考虑对食品风味的影响。在食品系统中有效地抑制BAs的方法也必须考虑食物感官方面的变化。
目前对甜瓣子中生物胺的形成规律还不清楚。因此,研究郫县豆瓣中BAs的形成规律,以及进一步开发抑制BAs形成的有效方法对食品安全具有重要意义。超高效液相色谱串联飞行时间质谱(ultra-high performance liquid chromatography with quadrupole time-of-flight mass spectrometry,UHPLC-QTOF/MS)因同时具备色谱的超强分离能力和质谱的卓越定性、定量分析能力,广泛应用于食品复杂体系中未知物的筛查研究[18]。它既可以利用二级碎片的高精度质量数、同位素离子丰度等对未知化合物进行筛查,也可以采用多反应监测模式(multiple reaction monitoring,MRM)对目标离子对进行定量分析。本研究的主要目的是:(1)采用UHPLC-QTOF/MS技术创建甜瓣子发酵过程中的7种BAs的定性定量检测方法,用于准确监控甜瓣子发酵过程中BAs种类与数量的变化;(2)进一步在甜瓣子发酵过程中添加茶多酚(tea polyphenol,TP)和EGCG,探讨它们对甜瓣子中BAs形成的影响。研究结果将为郫县豆瓣中BAs的调控,研究优质新产品提供技术支撑。
1 材料与方法
1.1 材料和仪器
1.1.1 材料与试剂
材料:新鲜蚕豆瓣(样品取自某豆瓣公司)、天然食品添加剂TP和EGCG、面粉、食盐、曲精(米曲霉)。
试剂:甲醇(色谱级)、乙腈(色谱级)、NaCl(分析纯)、His、Tyr、Phe、精胺(spermine,Spm)、亚精胺(spermidine,Spd)、色胺(tryptamine,Try)和尸胺(cadaverine,Cad)标准品(各标准的纯度均高于98%),美国Sigma公司。
1.1.2 仪器与设备
HNY-2102C制冷恒温摇床,天津市欧诺仪器仪表有限公司;SpectraMax i3x多功能酶标仪,奥地利Molecular Devices公司;超高效液相色谱系统,日本SHIAMDZU公司;TD-5M离心机,四川蜀科仪器有限公司;Milli-Q超纯水仪,美国Millipore公司;IKA Vortex 2涡旋混匀器,德国IKA公司万能高速粉碎机,深圳尼嘉商贸有限公司;AB SCIEX X500R飞行时间质谱仪,美国AB SCIEX公司;KQ-100DZ数控超声波清洗机,昆山市超声仪器有限公司;Heto-HSC500真空冷冻干燥机,上海佰蕾真生物科技有限公司。
1.2 实验方法
1.2.1 样品制备
取新鲜蚕豆瓣用沸水漂烫3 min,再将其冷却至室温,然后用质量分数0.3%米曲霉接种,加入质量分数20%面粉混匀,同时再加入TP或EGCG(浓度梯度设置为0.01%、0.05%、0.1%,质量分数),30 ℃下制曲培养72 h,再加入水和食盐,使得水分质量分数为55%、盐分质量分数为13.5%,最后在37 ℃环境下培养60 d。同时使用未加入添加剂的发酵豆瓣酱作为空白对照,3次平行实验。发酵60 d的时间,每5 d取1次样,并用密封袋分装,将其储存于-78 ℃冰箱中。将部分冻干后保存以用于分析BAs含量。
1.2.2 感官评价
选取12名感官评价员对甜瓣子来进行感官评价。主要从色泽、香气、滋味、质地等指标进行评价,产品指标的评分选择最后的平均分。感官评价标准如表1所示。
表1 前发酵过程甜瓣子感官评价
Table 1 Sensory evaluation of Tianbanzi during pre-fermentation
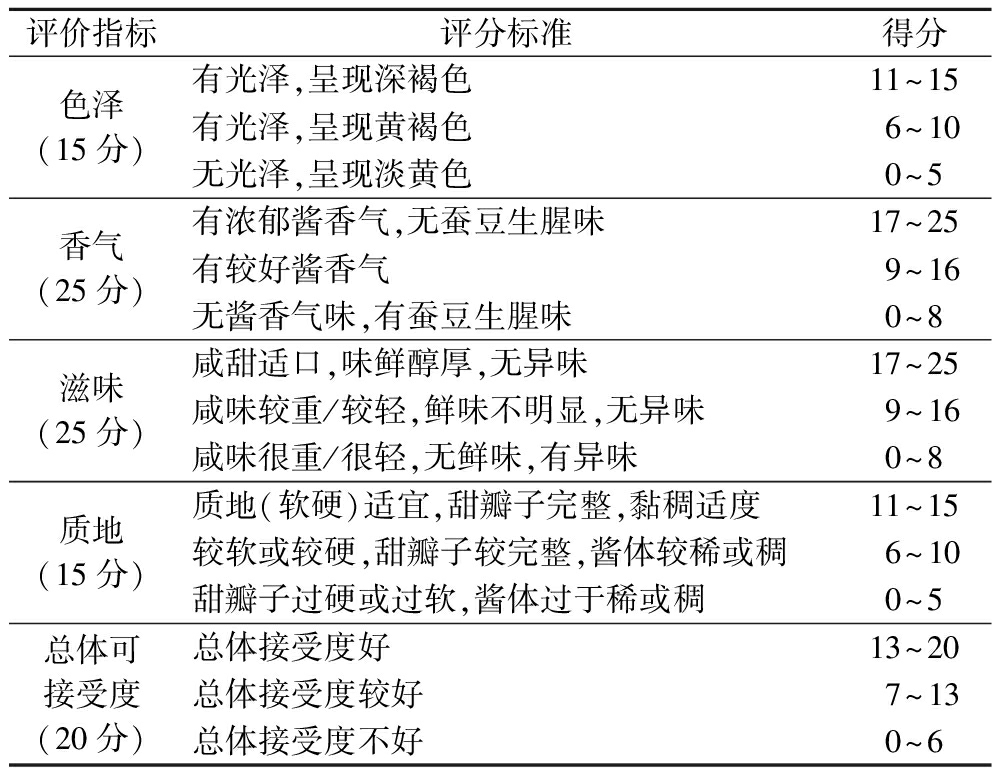
评价指标评分标准得分色泽(15分)有光泽,呈现深褐色11~15有光泽,呈现黄褐色6~10无光泽,呈现淡黄色0~5香气(25分)有浓郁酱香气,无蚕豆生腥味17~25有较好酱香气9~16无酱香气味,有蚕豆生腥味0~8滋味(25分)咸甜适口,味鲜醇厚,无异味17~25咸味较重/较轻,鲜味不明显,无异味9~16咸味很重/很轻,无鲜味,有异味0~8质地(15分)质地(软硬)适宜,甜瓣子完整,黏稠适度11~15较软或较硬,甜瓣子较完整,酱体较稀或稠6~10甜瓣子过硬或过软,酱体过于稀或稠0~5总体可接受度(20分)总体接受度好13~20总体接受度较好7~13总体接受度不好0~6
1.2.3 BAs含量的测定
1.2.3.1 标准溶液的配制
分别称取7种BAs标准品适量(精确到0.1 mg)溶解于50%甲醇水(体积分数),得到1 g/L的单体标准原液,将各标准溶液稀释到0.1 g/L,混合各相同体积的标准原液从而制得混合标准溶液(0.01 g/L)。将所有单标溶液、混标溶液和内部标液均储存在4 ℃冰箱内。测定前用50%甲醇水(体积分数)将混标溶液进一步稀释,获得一系列混合标准工作液(0.000 01、0.000 05、0.000 1、0.000 25、0.000 5、0.001、0.005、0.01 g/L)。
1.2.3.2 样品制备
50 mL聚乙烯离心管中称取冻干粉末(0.50 g),再加入10 mL萃取溶剂。使用涡旋混匀器涡旋1 min,然后再超声处理30 min(15 ℃),并在常温下以4 000 r/min的速度离心12 min。取其上清液在4 ℃下高速离心10 min(12 000 r/min),取上清液。再经0.22 μm有机滤膜过滤,将过滤后的样液置于1.5 mL液相小瓶中。储存于-18 ℃冰箱中备用。
1.2.3.3 UHPLC-MS/MS 分析条件
色谱柱岛津C18柱(100 mm×2.1 mm,1.8 μm),流动相A为0.1%甲酸(体积分数)水,流动相B为0.1%甲酸(体积分数)甲醇。流速:0.3 mL/min;采用以下线性梯度洗脱程序:0~2 min,2% B;2~13 min,2%~90% B;13~16 min,99% B;16~16.1 min,99%~2% B;16.1~20 min,2% B。进样室温度4 ℃,柱温40 ℃,进样量3 μL。
质谱条件:离子源为电喷雾电离源(electrospray spray ionization,ESI);检测模式为正离子。喷雾器气体(gas1)为55 psi;加热器气体(gas2)为55 psi;窗帘气体35 psi;离子喷雾电压ESI+5.5 kV;TOF MS扫描m/z范围:50~500 Da;产物离子扫描m/z范围为50~500 Da;TOF MS扫描累积时间为每个频谱0.15 s;产物离子扫描累积时间每个光谱0.08 s。在纯标准液注入过程中,针对每种分析物优化了裂解器电压和碰撞能量,并选择最丰富的碎片离子使用多反应监测模式定量。
1.2.4 数据处理
使用软件SCIEX OS进行豆瓣样品中BAs的定量分析。平均值使用Microsoft Excel 2013计算,使用SPSS 19.0分析标准差和相对标准偏差(relative standard deviation,RSD)。数据的统计显著性和Pearson相关分析。数据经过单向方差分析(ANOVA),并根据Duncan检验进行了多次比较分析。
2 结果与分析
2.1 BAs定性定量检测方法优化
首先在正离子和负离子模式下对7种BAs的标准品溶液进行质谱全扫描,研究其质谱裂解规律,以选择可靠的定性、定量离子对(图1)。
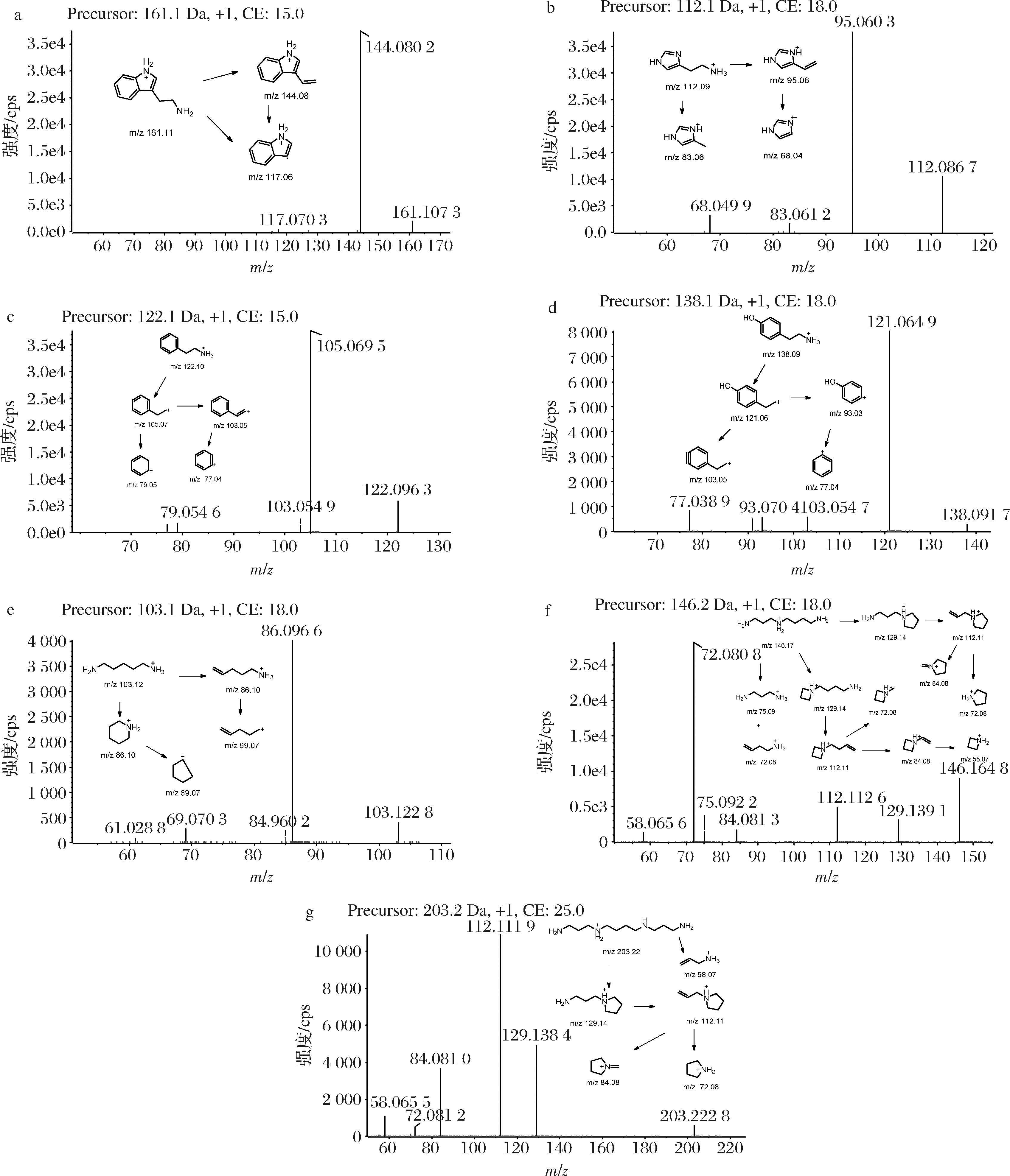
a-色胺;b-组胺;c-2-苯乙胺;d-酪胺;e-尸胺;f-亚精胺;g-精胺
图1 七种BAs标准品二级质谱图(0.005 g/L)
Fig.1 HPLC-MS/MS spectrograms of 7 BAs standards (0.005 g/L)
结果显示,所有BAs在正离子模式下均可生成前体离子[M+H]+。由于负离子模式的离子响应强度更低,因此本研究采用正离子模式进行检测。选择母离子进行二级质谱扫描,BAs的二级质谱图如图1所示。Cad、His、2-Phe、Tyr和Trp的二级图谱较为简单,根据碎片离子中性丢失原则可以看出,在母离子存在的情况下,主要产生了[M+H-NH3]+片段,这是由于其丢失1个氨分子,其他碎片离子响应强度相对较低。相比之下,Spd和Spe是直链多胺,有多个电离位点,因此有更多的碎片离子。Spd母离子m/z146通过失去1个氨分子产生[M+H-NH3]+(m/z129),通过失去另1个氨分子产生[M+H-2 NH3]+(m/z112)。
m/z146也可以通过四中心氢重排以及诱导分裂产生两个互补的碎片离子(m/z72和m/z 75)。同时,碎片离子m/z129和m/z112可以继续失去中性烃分子,形成稳定的环状胺离子(m/z72),因此碎片离子m/z72具有最高的离子反应强度。Spe是一个骨架对称的四胺,当分子离子峰的活性位点在两个中心氮原子上时,会发生封闭反应,其中一个中性的NH3—(CH2)3—NH3分子失去,产生片段离子m/z129。在m/z129的片段离子中存在1个氨基,这可能导致1个氨分子的损失,从而产生m/z112的片段离子。另一个分子乙炔的损失产生了片段离子m/z84。多反应串联质谱监测是对已知化合物进行量化的最敏感的方法之一。根据欧盟委员会第2002/657/EC号决定,应选择两个主要的特征碎片离子作为定性和定量离子,并优化碰撞能量和采样电压以获得最大的特征碎片离子强度。优化后参数见表2,为进一步精准监控发酵过程中BAs形成奠定基础。
表2 多反应监测扫描模式的质谱参数
Table 2 Mass spectrometry parameters of multiple reaction monitoring scan mode
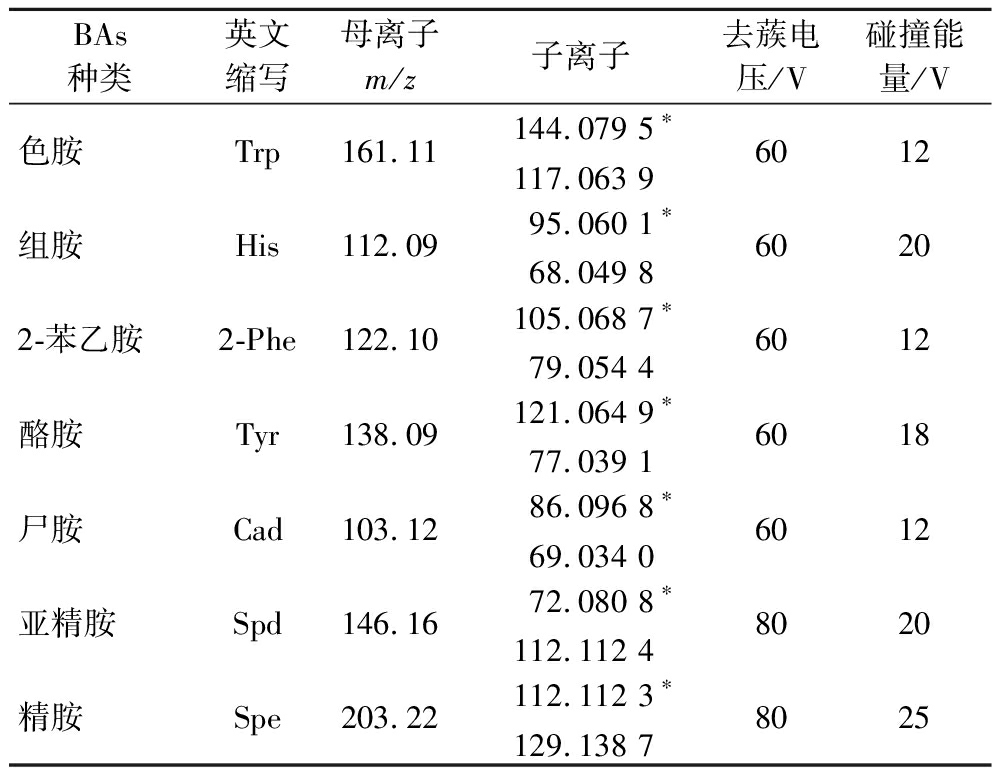
BAs种类英文缩写母离子m/z子离子去蔟电压/V碰撞能量/V色胺Trp161.11144.079 5∗117.063 9 6012组胺His112.0995.060 1∗68.049 8 60202-苯乙胺2-Phe122.10105.068 7∗79.054 4 6012酪胺Tyr138.09121.064 9∗77.039 1 6018尸胺Cad103.1286.096 8∗69.034 0 6012亚精胺Spd146.1672.080 8∗112.112 4 8020精胺Spe203.22112.112 3∗129.138 7 8025
注:*为定量离子。
2.2 甜瓣子发酵过程中BAs变化规律(空白组)
在甜瓣子的60 d发酵过程中,BAs的种类及含量均发生了显著的变化(表3)。在原料蚕豆中只能检测到Spe和Spd。当接种制曲后(霉豆瓣),总BAs含量由47.73 mg/kg下降到38.92 mg/kg。在发酵过程中,BAs含量呈现先下降(0~10 d)再升高的趋势(10~60 d)。特别是发酵60 d以后,BAs含量达到89.91 mg/kg,其中Tyr含量最高(33.21 mg/kg),其次为His(17.36 mg/kg)。
表3 甜瓣子发酵过程中BAs变化规律 单位:mg/kg
Table 3 Changes in BAs during fermentation of Tianbanzi
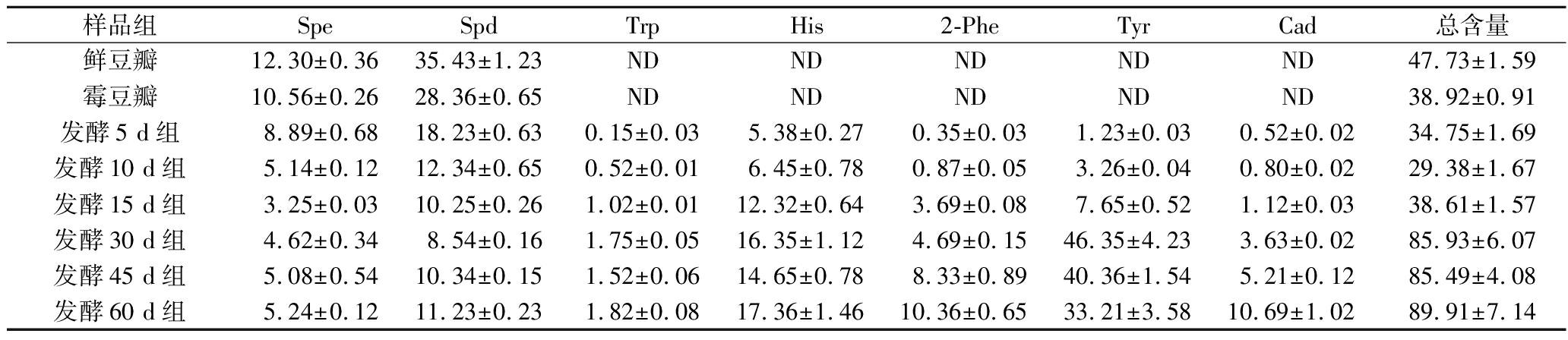
样品组SpeSpdTrpHis2-PheTyrCad总含量鲜豆瓣12.30±0.3635.43±1.23NDNDNDNDND47.73±1.59霉豆瓣10.56±0.2628.36±0.65NDNDNDNDND38.92±0.91发酵5 d组8.89±0.6818.23±0.630.15±0.035.38±0.270.35±0.031.23±0.030.52±0.0234.75±1.69发酵10 d组5.14±0.1212.34±0.650.52±0.016.45±0.780.87±0.053.26±0.040.80±0.0229.38±1.67发酵15 d组3.25±0.0310.25±0.261.02±0.0112.32±0.643.69±0.087.65±0.521.12±0.0338.61±1.57发酵30 d组4.62±0.348.54±0.161.75±0.0516.35±1.124.69±0.1546.35±4.233.63±0.0285.93±6.07发酵45 d组5.08±0.5410.34±0.151.52±0.0614.65±0.788.33±0.8940.36±1.545.21±0.1285.49±4.08发酵60 d组5.24±0.1211.23±0.231.82±0.0817.36±1.4610.36±0.6533.21±3.5810.69±1.0289.91±7.14
注:鲜豆瓣指未经发酵的去皮蚕豆;霉豆瓣指发酵后开始发霉的蚕豆;ND为未检出(下同)。
2.3 TP与EGCG对BAs的影响(处理组)
首先在鲜豆瓣原料中分别加入3种不同浓度的TP和EGCG,研究外源添加剂种类及含量对BAs形成的影响。当分别添加0.01%、0.05%和0.1% TP,甜瓣子发酵60 d后(表4),甜瓣子BAs总含量分别降低了24.39%、36.76%和37.63%。可以看出随TP添加量的增加,BAs总含量降低。TP能够抑制BAs生成,并且呈现量效关系。当分别添加0.01%、0.05%和0.1% EGCG以后,甜瓣子Bas总含量分别降低了32.10%、49.26%和44.01%。特别是His降低了58%。这与前人的研究中儿茶素能有效抑制His的产生基本一致[19]。当分别添加0.05%的EGCG和0.1%的TP时,甜瓣子的BAs含量最少。两种添加剂抑制效果对比表明,添加EGCG的效果略微优于TP。以往研究表明,添加3 g/kg EGCG对发酵模型系统中的微生物数量没有影响[20-21]。因此,本研究确认EGCG可以应用于抑制甜瓣子中BAs的形成。
表4 TP和EGCG的不同添加量对甜瓣子中BAs的影响 单位:mg/kg
Table 4 Effect of different TP and EGCG additions on BAs in Tianbanzi

组别SpeSpdTrpHis2-PheTyrCad总含量对照组5.24±0.1211.23±0.231.82±0.0817.36±1.4610.36±0.6533.21±3.5810.69±1.02 89.91±7.14TP/%0.014.56±0.3211.84±1.020.56±0.0712.32±1.1312.10±1.0223.35±2.133.25±0.5667.98±6.250.054.45±0.7410.73±0.38ND9.16±0.7810.35±0.6820.14±2.102.03±0.0656.86±4.740.105.21±0.2412.35±0.34ND7.65±0.128.99±0.6720.25±1.751.63±0.0856.08±3.2EGCG/%0.015.20±0.3110.55±0.98ND11.35±1.161.23±0.0328.35±3.104.37±0.1861.05±5.760.054.89±0.3510.35±0.87ND6.41±0.86ND23.15±1.430.82±0.0245.62±3.530.105.45±0.4612.02±1.05ND7.32±0.51ND23.21±1.332.34±0.1350.34±3.48
进一步研究添加0.05% EGCG对甜瓣子发酵过程中的BAs形成影响(表5),在发酵的0~10 d中,对BAs没有明显的抑制作用,从15~60 d,对BAs的抑制作用逐渐增强。发酵60 d后,添加EGCG的甜瓣子中7种BAs的总含量为45.62 mg/kg,比对照组(89.91 mg/kg)低49.26%。甜瓣子中的BAs主要由微生物产生的脱羧酶作用于不同的氨基酸代谢形成[11]。甜瓣子发酵中EGCG对BAs形成的抑制机理可能是EGCG能够与脱羧酶结合,抑制了脱羧酶活性。
表5 添加0.05% EGCG对甜瓣子中BAs形成的影响 单位:mg/kg
Table 5 Effect of 0.05% EGCG addition on BAs in Tianbanzi
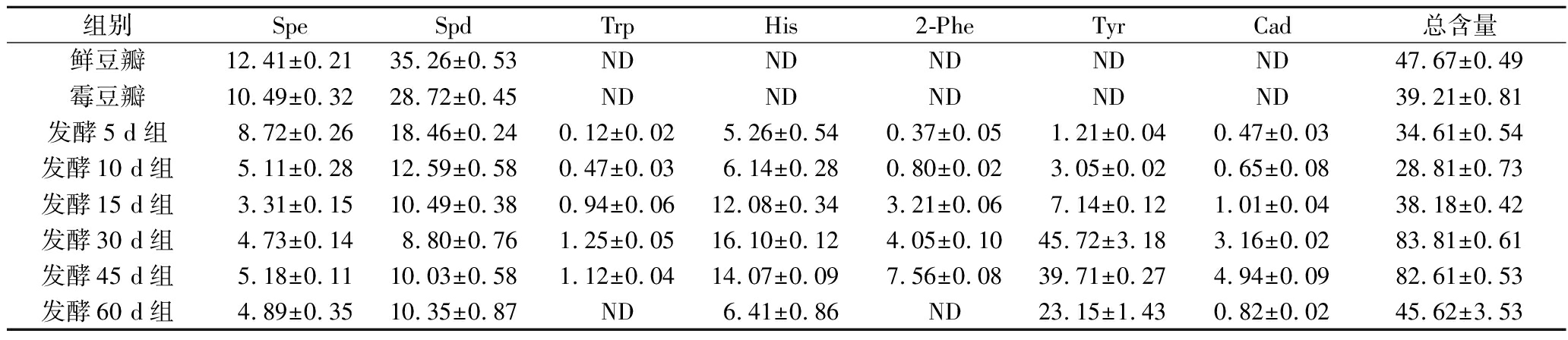
组别SpeSpdTrpHis2-PheTyrCad总含量鲜豆瓣12.41±0.2135.26±0.53NDNDNDNDND47.67±0.49霉豆瓣10.49±0.3228.72±0.45NDNDNDNDND39.21±0.81发酵5 d组8.72±0.2618.46±0.240.12±0.025.26±0.540.37±0.051.21±0.040.47±0.0334.61±0.54发酵10 d组5.11±0.2812.59±0.580.47±0.036.14±0.280.80±0.023.05±0.020.65±0.0828.81±0.73发酵15 d组3.31±0.1510.49±0.380.94±0.0612.08±0.343.21±0.067.14±0.121.01±0.0438.18±0.42发酵30 d组4.73±0.148.80±0.761.25±0.0516.10±0.124.05±0.1045.72±3.183.16±0.0283.81±0.61发酵45 d组5.18±0.1110.03±0.581.12±0.0414.07±0.097.56±0.0839.71±0.274.94±0.0982.61±0.53发酵60 d组4.89±0.3510.35±0.87ND6.41±0.86ND23.15±1.430.82±0.0245.62±3.53
2.4 感官评价
发酵60 d的甜瓣子的感官评价结果见图2。与空白对照组相比,两种添加剂在产品的感官方面都有改善作用,但差异不显著。在甜瓣子中加入0.1%的TP,略微增强了香气。因此,TP和EGCG的添加不会对甜瓣子的感官评价产生负面影响。
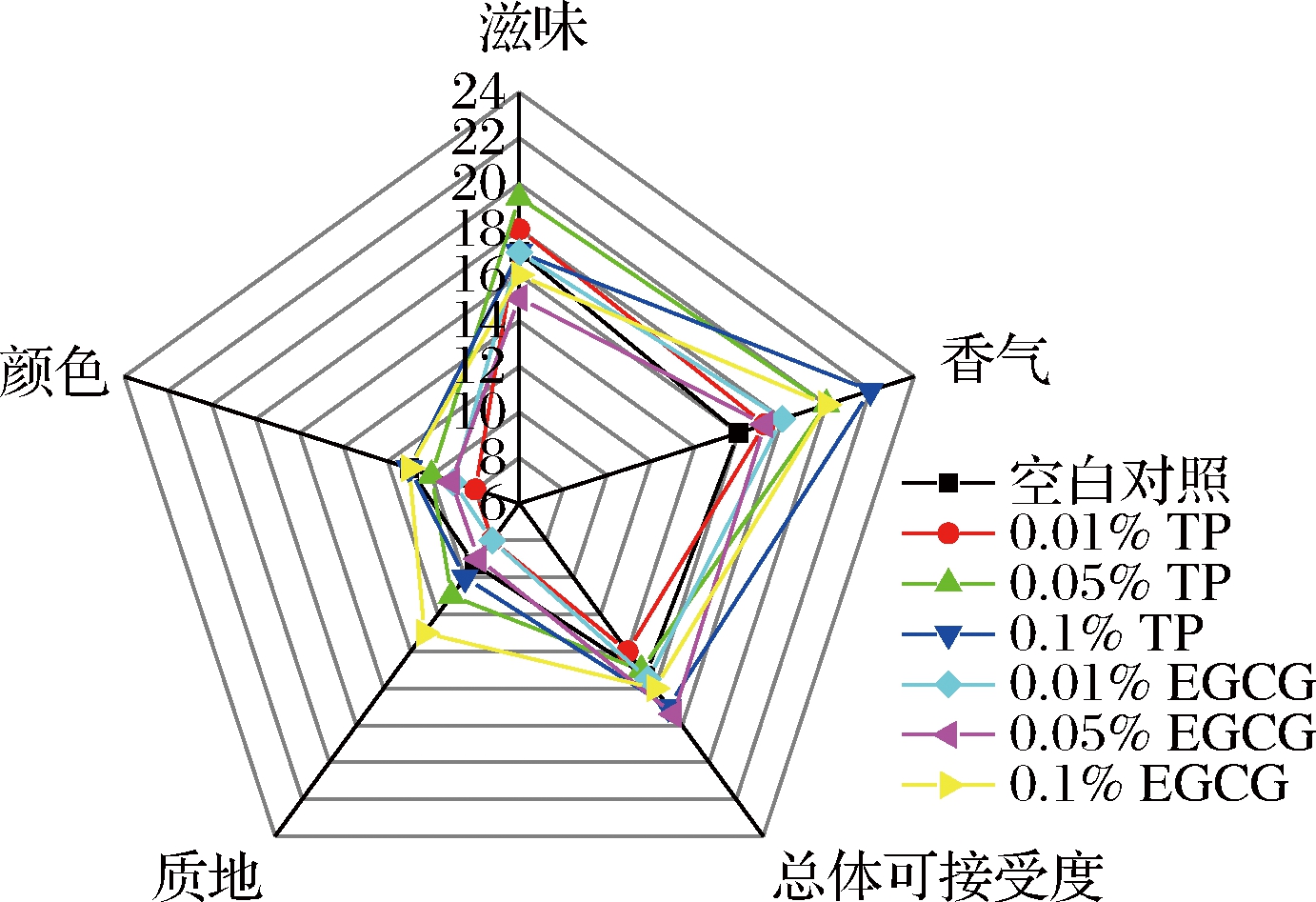
图2 感官评价图
Fig.2 Sensory evaluation chart
3 结论与讨论
本研究首先建立了基于UHPLC-QTOF/MS的7种BAs定性、定量检测的可靠方法。以郫县豆瓣的甜瓣子发酵过程为研究模型,通过在发酵过程添加TP和EGCG调控郫县豆瓣的BAs形成。两种添加剂对模型中BAs总量均有降低作用,其中2-Phe完全消失。在3个添加水平中,TP添加量为0.1%和EGCG添加量为0.05%时,对BAs的降低程度更高。其中,相同浓度下EGCG的降低作用更显著,进一步研究添加0.05% EGCG对甜瓣子发酵过程中的BAs形成影响,发现在发酵的0~10 d中,对BAs没有明显的抑制作用,15~60 d的发酵过程中,对BAs的抑制作用逐渐增强。此外,添加TP和EGCG不会对甜瓣子的感官评价产生负面影响,说明添加TP和EGCG降低BAs主要是基于降低发酵体系中脱羧酶的活性来实现的,不会对发酵微生物的活性产生影响。
[1] VISCIANOP, SCHIRONE M.Update on biogenic amines in fermented and non-fermented beverages[J].Foods (Basel, Switzerland), 2022, 11(3):353-365.
[2] 隋明,施鑫, 张崇军, 等.郫县豆瓣工业生产流程的研究[J].中国调味品, 2019, 44(4):139-142.
SUI M, SHI X, ZHANG C J, et al.Study on the industrial production process of Pixian bean paste[J].China Condiment, 2019, 44(4):139-142.
[3] 黄玉坤,宋亚宁, 陈芳, 等.基于响应面法优化柱前衍生-高效液相色谱法分析传统郫县豆瓣中8种生物胺[J].西华大学学报(自然科学版), 2020, 39(6):61-71.
HUANG Y K, SONG Y N, CHEN F, et al.Analysis for eight biogenic amines in traditional Pixian broadbean by a precolumn derivatization-HPLC method based on response surface optimization[J].Journal of Xihua University (Natural Science Edition), 2020, 39(6):61-71.
[4] VASCONCELOSH, DE ALMEIDA J M M M, MATIAS A, et al.Detection of biogenic amines in several foods with different sample treatments:An overview[J].Trends in Food Science &Technology, 2021, 113:86-96.
[5] OYELAKINO, TRAORÉ M, MBAYE E H B, et al.Spectrofluorometric determination of putrescine using orthophthaldehyde as a fluorophore:A novel method[J].Journal of AOAC International, 2016, 99(1):170-173.
[6] REDRUELLOB, LADERO V, DEL RIO B, et al.A UHPLC method for the simultaneous analysis of biogenic amines, amino acids and ammonium ions in beer[J].Food Chemistry, 2017, 217:117-124.
[7] DELA TORRE C A L, CONTE-JUNIOR C A.Detection of biogenic amines:quality and toxicity indicators in food of animal origin[J].Food Control and Biosecurity,2018:225-257.
[8] DURAK-DADOSA, MICHALSKI M, OSEK J.Histamine and other biogenic amines in food[J].Journal of Veterinary Research, 2020, 64(2):281-288.
[9] FEDDERNV, MAZZUCO H, FONSECA F N, et al.A review on biogenic amines in food and feed:Toxicological aspects, impact on health and control measures[J].Animal Production Science, 2019, 59(4):608.
[10] ALBERTOM R, ARENA M E, DE NADRA M C M.Putrescine production from agmatine by Lactobacillus hilgardii:Effect of phenolic compounds[J].Food Control, 2007, 18(8):898-903.
[11] NITTAY, KIKUZAKI H, UENO H.Food components inhibiting recombinant human histidine decarboxylase activity[J].Journal of Agricultural and Food Chemistry, 2007, 55(2):299-304.
[12] GARDINIF, MARTUSCELLI M, CARUSO M C, et al.Effects of pH, temperature and NaCl concentration on the growth kinetics, proteolytic activity and biogenic amine production of Enterococcus faecalis[J].International Journal of Food Microbiology, 2001, 64(1-2):105-117.
[13] RUIZ-CAPILLASC, HERRERO A M.Impact of biogenic amines on food quality and safety[J].Foods (Basel, Switzerland), 2019, 8(2):62.
[14] ZDOLECN, BOGDANOVI T, PAŽIN V, et al.Control of biogenic amines in dry sausages inoculated with dairy-originated bacteriocinogenic Enterococcus faecalisEF-101[J].Veterinarski Arhiv, 2020, 90(1):77-85.
T, PAŽIN V, et al.Control of biogenic amines in dry sausages inoculated with dairy-originated bacteriocinogenic Enterococcus faecalisEF-101[J].Veterinarski Arhiv, 2020, 90(1):77-85.
[15] VINCIG, MADDALONI L.Biogenic amines in alcohol-free beverages[J].Beverages, 2020, 6(1):17.
[16] MAHJ H, KIM Y J, HWANG H J.Inhibitory effects of garlic and other spices on biogenic amine production in Myeolchi-jeot, Korean salted and fermented anchovy product[J].Food Control, 2009, 20(5):449-454.
[17] BERTOLDIM, GONSALVI M, BORRI VOLTATTORNI C.Green tea polyphenols:Novel irreversible inhibitors of dopa decarboxylase[J].Biochemical and Biophysical Research Communications, 2001, 284(1):90-93.
[18] LYUW T, YUAN B, LIU S Y, et al.Assessment of lemon juice adulterationby targeted screening using LC-UV-MS and untargeted screening using UHPLC-QTOF/MS with machine learning[J].Food Chemistry, 2022, 373:131424.
[19] MELGAREJOE, URDIALES J L, S NCHEZ-JIMÉNEZ F, et al.Targeting polyamines and biogenic amines by green tea epigallocatechin-3-gallate[J].Amino Acids, 2010, 38(2):519-523.
NCHEZ-JIMÉNEZ F, et al.Targeting polyamines and biogenic amines by green tea epigallocatechin-3-gallate[J].Amino Acids, 2010, 38(2):519-523.
[20] LEEJ Y, KIM Y G, HER J Y, et al.Reduction of biogenic amine contents in fermented soybean paste using food additives[J].LWT, 2018, 98:470-476.
[21] KHALILR K S.Influence of Gallic acid and catechin polyphenols on probiotic properties of Streptococcus thermophilusCHCC 3534 strain[J].World Journal of Microbiology and Biotechnology, 2010, 26(11):2 069-2 079.