乳酸菌广泛存在于人类肠道中,是一类能利用可发酵碳水化合物产生大量乳酸的细菌的统称,同时也是国际上公认的食品安全级微生物。据报道,发酵食品、动物肠道和变质食品中都可以分离出乳酸菌[1]。乳酸菌在医疗保健、食品加工与生产等方面已经得到广泛应用。通过对乳酸菌的益生特性筛选和发酵工艺优化,发现一些乳酸菌具有抗氧化、抑制致病菌、降血糖等生物功能[2],具有广阔的市场开发价值。
戊糖片球菌属于乳酸菌的一种,隶属链球菌科片球菌属。戊糖片球菌已被批准为可食用菌种,现已广泛应用于动物生产、食品发酵等生产领域中,受到学者的高度重视[3]。戊糖片球菌生理功能广泛,在抗氧化、抗炎、抑菌、降血糖等方面均具有积极作用。孙艳菲等[4]研究表明,戊糖片球菌 F28-8 表面蛋白能改变菌体表面性质,增强黏附能力,表现出一定的抑菌能力。陈佩等[5-6]发现戊糖片球菌P36和S44对·OH、DPPH自由基均具有一定的清除作用,2株菌均表现出一定的抗氧化作用。
戊糖片球菌通常分离自发酵蔬菜、发酵乳制品中,具有优良的发酵性能。巨晓英等[7]发现戊糖片球菌可显著缩短泡菜的发酵周期,提高泡菜的食用安全性。戊糖片球菌存在于多种奶酪中,可促进奶酪中风味形成,并加快发酵的优势菌群,提高了发酵乳制品的功能性[8]。李曼等[9]将戊糖片球菌HM04添加到无花果浆进行发酵,发酵果浆中不仅生成醇类、醛类、酯类等芳香物质,而且超氧化物歧化酶活力显著增强。然而目前市场上应用的戊糖片球菌数量不多,多功能性菌株较少,因此开发多功能性戊糖片球菌刻不容缓。
本论文主要针对实验室保存的一株乳酸菌进行鉴定,并研究其体外耐酸性、耐胆盐性、耐热性和疏水性,然后对菌株及其代谢物进行α-淀粉酶和α-葡萄糖苷酶抑制能力、抗氧化能力以及抑菌能力分析,并将菌株应用于发酵乳,探究其发酵过程中的特性以及储存期的指数变化情况,以此衡量戊糖片球菌开发与应用的可行性。
1 材料与方法
1.1 材料与试剂
乳酸菌:本实验室从四川发酵的水白菜样品中,采用溶钙圈法,通过CaCO3-MRS固体培养基分离获得一株透明圈明显的乳酸菌,并对其进行菌株的纯化和保藏,命名为乳酸菌SBC5。
指示菌:金黄色葡萄球菌(Staphyloccocus aureus) ATCC 25923,大肠杆菌(Escherichia coli) ATCC 44752,河北科技大学酶工程实验室保藏。
实验试剂:猪胆盐、Na2CO3、二甲苯、淀粉溶液、碘液(0.01 mol/L),北京索莱宝科技有限公司;α-淀粉酶、α-葡萄糖苷酶、过氧化氢酶、胰蛋白酶、蛋白酶K、蛋白酶E、胃蛋白酶、过氧化氢酶,诺维信公司。所有试剂均为分析纯。
MRS液体培养基(g/L):葡萄糖20、蛋白胨10、牛肉膏10、酵母浸粉5、无水乙酸钠5、K2HPO42、柠檬酸三铵2、MnSO40.25、MgSO40.58、吐温-80 1 mL,pH 6.2~6.4,121 ℃高压灭菌15 min。
MRS固体培养基:在MRS液体培养基中加15 g/L琼脂,121 ℃高压灭菌15 min。
CaCO3-MRS固体培养基:MRS液体培养基中添加1.5% CaCO3和1.5%(质量分数)琼脂。
营养肉汤培养基(g/L):牛肉膏3、蛋白胨10、NaCl 5,pH 7.2~7.4,121 ℃高压灭菌20 min。
1.2 仪器设备
ZSD-A1160恒温培养箱、ZHWY恒温培养振荡器,上海智城分析仪器制造公司;Evolution 220紫外可见分光光度计,美国Thermo公司;3-18K高速冷冻离心机,德国SIGMA公司;CX31显微镜,日本奥林巴斯株式会社;Scan1200全自动菌落计数仪,法国Interscience公司。
1.3 菌株鉴定
1.3.1 形态鉴定
将乳酸菌SBC5接入MRS液体培养基,37 ℃恒温培养,连续活化2代后,划线至MRS固体培养基,37 ℃恒温培养24 h,观察菌落形态。将呈现单菌落的乳酸菌SBC5进行革兰氏染色,并镜检观察形态。
1.3.2 16S rDNA鉴定
将乳酸菌SBC5进行纯培养,送上海生工生物有限公司,进行菌株的16S rDNA序列测定。利用BLAST比对基因序列,分析乳酸菌的同源性,利用软件MEGA7构建系统发育树进行同源性比较。
1.4 乳酸菌SBC5的生物学特性研究
1.4.1 耐酸性和耐胆盐性
参照孙盛等[10]的方法进行,以未处理的菌株作为对照。
1.4.2 疏水性
参照李华等[11]的方法进行,以未作处理的菌液作为对照。
1.4.3 耐热性
将戊糖片球菌SBC5分别在40、50、60 ℃保温30 min,梯度稀释,涂布平板,以未处理的菌株作为对照。菌株存活率按公式(1)计算:
存活率![]()
(1)
式中:N0,不同温度下的活菌数,CFU/mL;N1,对照组的活菌数,CFU/mL。
1.5 乳酸菌SBC5的功能特性研究
1.5.1 乳酸菌SBC5菌悬液及发酵上清液制备
将乳酸菌SBC5加入MRS液体培养基中,37 ℃静置培养24 h,获得一代菌悬液;吸取一代菌悬液,按1%(体积分数,下同)接种量接种于MRS液体培养基中,37 ℃静止培养12 h,获得二代菌悬液;将二代菌悬液4 ℃下离心,取上清液过0.22 μm微孔滤膜,作为乳酸菌SBC5的发酵上清液。取离心沉淀的菌体,用0.85%的生理盐水清洗2~3次后进行重悬,调整菌悬液为1×109CFU/mL,获得乳酸菌SBC5的菌悬液。
1.5.2 对α-淀粉酶和α-葡萄糖苷酶的抑制特性
参照陈佩[12]的方法测定乳酸菌SBC5及其发酵上清液对α-淀粉酶和α-葡萄糖苷酶抑制特性。
1.5.3 抗氧化性
参考高涵等[13]的方法进行抗氧化性能的研究,测定乳酸菌SBC5及其发酵上清液对![]() 自由基、DPPH自由基的清除能力。
自由基、DPPH自由基的清除能力。
1.5.4 抑菌性
1.5.4.1 发酵上清液的抑菌作用
以大肠杆菌ATCC 44752及金黄色葡萄球菌ATCC 25923为指示菌,制备含有106CFU/mL的大肠杆菌或金黄色葡萄球菌的营养琼脂(nutrient agar,NA)培养基。采用牛津杯琼脂扩散法,进行发酵上清液的抑菌性研究。
1.5.4.2 菌悬液的抑菌作用
采用双层平板法,下层为MRS固体培养基,上层为含有106CFU/mL的大肠杆菌或金黄色葡萄球菌的NA培养基。将乳酸菌SBC5点种在MRS固体培养基上,待菌液扩散至培养基后,倾倒含有指示菌的NA培养基,测定菌体的抑菌活性。
1.6 乳酸菌SBC5的发酵性能研究
1.6.1 发酵乳凝乳时间的测定
将乳酸菌SBC5活化至对数期,以2%接种量接种于100 g/L的灭菌脱脂乳中,37 ℃静置培养,每隔2 h观察凝乳状况,记录凝乳时间。
1.6.2 发酵乳酸度的测定
将乳酸菌SBC5活化后以2%接种量接种于100 g/L的灭菌脱脂乳,37 ℃恒温静置培养,待凝乳后立刻置于4 ℃冷藏24 h,测定发酵乳的酸度。参照GB/T 5009.239—2016《食品酸度的测定》的方法测定酸度,用吉尔涅尔度(°T)表示[14]。
1.6.3 发酵乳保水率的测定
将活化至对数期的乳酸菌SBC5,以2%接种量接种于100 g/L灭菌脱脂乳中,37 ℃恒温静置培养得到发酵乳。参照林丽清等[15]的方法,计算发酵乳的保水率。
1.6.4 发酵乳脱水收缩能力的测定
取10 mL发酵乳,恒温静置于漏斗中(20 ℃、90 min),收集滤液称质量,脱水收缩率按公式(2)计算:
脱水收缩率![]()
(2)
式中:m,样品质量,g;m1,滤液质量,g。
1.6.5 发酵乳活菌数的测定
准确量取0.5 mL发酵乳,生理盐水梯度稀释,平板涂布MRS固体培养基,计算发酵乳中的活菌数。
1.6.6 发酵乳黏度的测定
使用黏度计,将发酵乳置于烧杯,离心机转速为0.6 r/min,记录第30 s时的数据。
1.6.7 发酵乳的感官评价
将凝乳后的发酵乳冷藏24 h,根据发酵乳的色泽、滋味、气味、组织状态评价发酵乳,感官评价成员由7人组成,均受过专业感官培训。感官评分标准如表1所示。
表1 发酵乳感官评价表
Table 1 Sensory evaluation table of fermented milk

项目特征评分色泽(10分)呈均匀乳白色、微黄色10~8 淡黄色7~6浅灰色或灰白色 5~4绿色、黑色斑点或霉菌生长、异常颜色3~0滋味和气味(40分)具有酸牛乳特有的滋味和气味,酸味、甜味比例适当50~35过酸或过甜 34~20有苦味 19~10有涩味9~5滋味或气味异常4~0组织状态(50分)组织细腻、均匀、表面光滑、无裂纹、无气泡、无乳清析出 50~40组织细腻、均匀、表面光滑、无裂纹、无气泡、有少量乳清析出39~30组织粗糙、有裂纹、无气泡、有少量乳清析出 29~20组织粗糙、有裂纹、有气泡、乳清析出19~10组织粗糙、有裂纹、有大量气泡、乳清析出严重、有颗粒9~10
2 结果与分析
2.1 菌株鉴定
2.1.1 形态鉴定
图1-a显示,乳酸菌SBC5的菌落颜色为乳白色,菌落形态为圆形凸起,边缘整齐,半透明,表面湿润光滑。图1-b显示,乳酸菌SBC5的革兰氏染色结果显示紫色,为革兰氏阳性菌,球状且无芽孢。

a-平板形态;b-显微形态
图1 乳酸菌SBC5的菌落形态与显微形态
Fig.1 Colony morphology and micromorphology of strain SBC5
2.1.2 分子鉴定
乳酸菌SBC5经过16S rDNA序列测定后,该乳酸菌与戊糖片球菌的相似性为100%,其中与Pediococcus pentosaceusSRCM100892(CP021474.1)的同源性为100%,与Pediococcus pentosaceusGG1(KX430829.1)和Pediococcus pentosaceusSS1-3(MH828357.1)的同源性为99.3%。
利用MEGA7软件构建乳酸菌SBC5的系统发育树,结果如图2所示,此菌株属于戊糖片球菌,将其命名为Pediococcus pentosaceusSBC5。

图2 Pediococcus pentosaceusSBC5的系统发育树
Fig.2 Phylogenetic tree of Pediococcus pentosaceusSBC5
2.2 戊糖片球菌SBC5的生物学特性
2.2.1 耐酸性与耐胆盐性
通过模拟人体的胃液和肠液,分析P.pentosaceusSBC5的体外耐受性,菌株孵育2 h的结果见表2。P.pentosaceusSBC5具有良好的胃酸耐受性,在pH 2.0条件下孵育2 h的存活率为49.42%,pH 4.0下的存活率为96.15%。由耐胆盐性的实验数据可知,P.pentosaceusSBC5具有良好的胆盐耐受性,其在0.30%胆盐环境中孵育2 h,存活率为65.38%。PHUONG等[16]从发酵的龙葵中分离到戊糖片球菌HN10在pH 4.0条件下孵育3 h,存活率为69.8%。在胆盐浓度为0.3%时,细胞存活率为62.78%。
表2 P.pentosaceusSBC5的耐酸性和耐胆盐性
Table 2 Resistance to acid and bile salts of P.pentosaceusSBC5
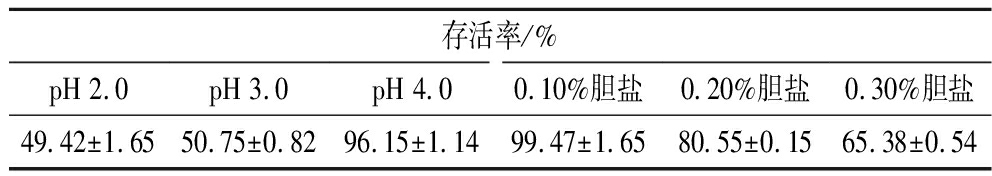
存活率/%pH 2.0pH 3.0pH 4.00.10%胆盐0.20%胆盐0.30%胆盐49.42±1.6550.75±0.8296.15±1.1499.47±1.6580.55±0.1565.38±0.54
2.2.2 疏水性分析
黏附性强的乳酸菌更容易在人体肠道中定殖,从而发挥益生作用[17],疏水性可作为考察菌株黏附能力的指标。本研究中P.pentosaceusSBC5的疏水性为21.58%。
2.2.3 耐热性分析
乳酸菌的耐热性研究对于乳酸菌的市场开发和应用具有重要价值。本研究对P.pentosaceusSBC5的温度耐受性进行研究,结果见表3。经40 ℃处理,P.pentosaceusSBC5的存活率为98.61%;50 ℃处理,存活率为74.15%;经60 ℃处理后,存活率也在22.76%。可见,P.pentosaceusSBC5对热具有较好的耐受性,利于其在应用和保存过程中的稳定性,对保持菌株活力具有重要的研究意义。
表3 P.pentosaceusSBC5的耐热性
Table 3 Thermostability of P.pentosaceusSBC5
温度/℃405060存活率/%98.61±3.9574.15±1.4522.76±1.31
2.3 戊糖片球菌SBC5的功能特性分析
2.3.1 对α-淀粉酶和α-葡萄糖苷酶的抑制特性
研究P.pentosaceusSBC5及其发酵上清液在体外对α-淀粉酶和α-葡萄糖苷酶的抑制特性,结果见表4。P.pentosaceus SBC5对α-葡萄糖苷酶和α-淀粉酶的抑制率较低,其菌体的作用效果不明显,这可能与乳酸菌细胞表面活性物质不能改变酶的构象有关,从而无法抑制酶活力[18]。
表4 P.pentosaceusSBC5及其发酵上清液对 α-淀粉酶和α-葡萄糖苷酶的抑制特性
Table 4 α-Amylase and α-glucosidase inhibition rates of P.pentosaceusSBC5 and its fermentation supernatant

对α-葡萄糖苷酶的抑制率/%对α-淀粉酶的抑制率/%发酵上清液菌悬液发酵上清液菌悬液10.25±1.963.25±0.7546.93±1.120.49±1.75
李向菲[19]研究发现多糖和丁酸是乳酸菌发挥降血糖作用的相关因素。可见,乳酸菌对α-淀粉酶和α-葡萄糖苷酶的抑制特性与其代谢物有关。表4显示,P.pentosaceusSBC5发酵上清液表现出对α-淀粉酶和α-葡萄糖苷酶抑制效果,其对α-淀粉酶的抑制效果较好,抑制率为46.93%;对α-葡萄糖苷酶的抑制率稍差,为10.25%;说明P.pentosaceusSBC5对α-淀粉酶和α-葡萄糖苷酶的抑制作用以胞外代谢物为主。
2.3.2 抗氧化性
P.pentosaceusSBC5的抗氧化性结果见表5。由表5可知,P.pentosaceusSBC5对DPPH自由基的清除率较高,其中,发酵上清液的清除率为18.98%,菌体清除率为10.23%。YANG等[20]研究表明,戊糖片球菌SC28 对DPPH自由基的清除率为17.83%,对ABTS阳离子自由基清除率为 8.65%。陈佩等[6]对戊糖片球菌 P36进行研究,其对 DPPH 自由基的清除率最高可达到 30%以上,对![]() 的清除能力随胞外多糖浓度的升高而增加,当胞外多糖质量浓度为5 mg/mL 时,其清除率可达到13.04%。
的清除能力随胞外多糖浓度的升高而增加,当胞外多糖质量浓度为5 mg/mL 时,其清除率可达到13.04%。
表5 P.pentosaceusSBC5及其发酵上清液的抗氧化性
Table 5 Antioxidant activity of P.pentosaceusSBC5 and its fermentation supernatant

对DPPH自由基清除率/%对·O-2清除率/%对·OH清除率/%发酵上清液菌悬液发酵上清液菌悬液发酵上清液菌悬液18.98±0.8710.23±2.2516.26±0.426.82±0.3913.56±0.948.11±0.73
2.3.3 抑菌性
选择大肠杆菌及金黄色葡萄球菌为指示菌,P.pentosaceusSBC5及其发酵上清液的抑菌结果见表6。由表6可知,P.pentosaceusSBC5对金黄色葡萄球菌和大肠杆菌均具有一定拮抗作用,且其发酵上清液对2种指示菌的抑菌圈直径均在20 mm以上。可见,P.pentosaceusSBC5在抑菌方面具有良好的应用前景。
曹振辉等[8]从云南萝卜泡菜中分离到的戊糖片球菌 L1 显著抑制了大肠杆菌 CMCC 44825 和鼠伤寒沙门氏菌 CMCC 50115 的生长,抑菌效果均显著高于参考菌株鼠李糖乳杆菌。LIU等[21]发现戊糖片球菌对南美对虾的免疫反应有协同作用,进而提高其抗菌能力。CHIU等[22]研究发现,戊糖片球菌as13对弧菌的生长有抑制作用。
表6 P.pentosaceusSBC5及其发酵上清液的抑菌作用
Table 6 Antimicrobial effect of P.pentosaceusSBC5 and its fermentation supernatant

指示菌大肠杆菌金黄色葡萄球菌菌体的拮抗作用++发酵液的抑菌圈直径/mm26.35±0.0720.21±1.56
注:“+”表示有拮抗作用,“-”表示没有拮抗作用
2.4 戊糖片球菌SBC5在发酵乳中的应用
2.4.1 凝乳时间的测定
在脱脂乳中测定单菌发酵的凝乳时间和终止发酵时间,结果表明P.pentosaceusSBC5凝乳时间较短,为12 h,发酵终止时间为26 h。巨晓英等[7]发现含有戊糖片球菌的发酵剂可显著缩短泡菜发酵周期,提高泡菜的食用安全性,与本文的研究结果一致。
2.4.2 发酵过程中的酸度和活菌数变化
测定P.pentosaceusSBC5发酵过程中的酸度变化,并对其活菌数进行分析,结果见图3。P.pentosaceus SBC5的产酸速度较为适中,6 h起产酸速率明显增加,到24 h趋于稳定,为85.52 °T。P.pentosaceus SBC5的pH在2 h到20 h之间变化较为明显,pH从6.61下降到4.73,20 h时之后趋于稳定。张开屏等[23]研究发现,添加戊糖片球菌可加快发酵羊肉干的产酸速率,与本文的研究结果一致。P.pentosaceusSBC5在发酵6 h已进入对数生长期,24 h基本处于稳定期,活菌数为1.66×109CFU/mL,后期可以通过优化凝乳发酵的条件或者采用复合发酵等方法进一步提高凝乳效率。

图3 发酵乳发酵过程中的指标变化
Fig.3 Performance changes of fermented milk during fermentation
2.4.3 发酵乳产品的特性分析
按照P.pentosaceusSBC5的最适凝乳时间结束发酵,测定发酵乳的保水率和滴定酸度,并进行感官评价。P.pentosaceusSBC5的保水率为65.42%,滴定酸度为79.92 °T,总体感官评价较高,为78.88分。
LI等[24]研究发现,戊糖片球菌是罗非鱼肠发酵过程中的核心挥发性风味物质,其总丰度在发酵结束时高达95%,对挥发性风味形成的贡献最大。SONG等[25]研究发现,用戊糖片球菌发酵酸菜,其氨基酸含量高于自然发酵酸菜,且酸菜感官品味与自然发酵酸菜具有较高的相似性。这些结果均表明戊糖片球菌可以提高发酵物的口感和风味。
2.4.4 发酵乳储存期的性能变化
发酵乳一般在后期储藏过程中滴定酸度的增幅在7.5~10 °T[26]。图4显示,P.pentosaceus SBC5后酸化能力相对较弱。冷藏18 d,酸度仅增长5.25 °T;但一周后酸度变化较为明显,继续增长了7.52 °T。HU等[27]研究发现,戊糖片球菌QK-1可以有效抑制豆浆储存期的酸度增长。由此推测,P.pentosaceus SBC5可以与其他乳酸菌混合发酵,以弥补后酸化的能力[12]。
由图4可知,发酵乳冷藏一周,其活菌数变化不明显;而一周后活菌数呈下降趋势,保藏24 d,P.pentosaceus SBC5的活菌数为2.04×108CFU/mL,高于国标规定的1.0×106CFU/mL。王艳婷等[28]研究发现,从蒙古干酪中提取的戊糖片球菌在乳制品防腐保鲜中发挥了良好的效果,有效延长了发酵乳的储存期。
发酵乳优良的黏度不但可以带来良好的口感,也会取代增稠剂等添加剂的使用。图4显示,P.pentosaceusSBC5的黏度在一周内缓慢上升,随后,随着储存时间的延长,黏度开始下降。ADEBAYO-TAYO等[29]研究同样表明,添加了戊糖片球菌的芒果汁在4 ℃下贮存,其口感、香气、色泽方面是最佳的。

图4 发酵乳储藏期的性能变化
Fig.4 Properties changes of fermented milk during storage
脱水收缩能力是评价发酵乳质量和稳定性的重要指标。由图4可知,P.pentosaceus SBC5制备的发酵乳在储存期间的脱水收缩能力稳定,发酵乳的性能优良。
3 结论与讨论
本文对实验室保存的一株乳酸菌进行鉴定和功能特性分析,并探究其发酵性能,该菌株被鉴定为戊糖片球菌,命名为Pediococcus pentosaceusSBC5。P.pentosaceusSBC5具有良好的耐受性和疏水特性。在pH 2.0条件下孵育2 h的存活率为50%左右,在0.3%胆盐浓度下孵育2 h的存活率在60%以上,说明该菌株有较好的耐酸耐胆盐性能。P.pentosaceusSBC5具有良好的黏附性,疏水性为21.58%,耐热性良好,50 ℃处理后存活率在70%以上。P.pentosaceusSBC5发酵上清液表现出多种功能特性,其对α-淀粉酶的抑制率为46.93%,对DPPH自由基清除率为18.98%,同时对金黄色葡萄球菌和大肠杆菌2种指示菌的抑菌圈直径均在20 mm以上。P.pentosaceusSBC5在发酵乳生产中具有潜在的应用价值,发酵性能测定结果表明,其凝乳时间较短,保水率为65.42%,总体感官评价较高,产酸能力在70~90 °T。合格的发酵乳产品,在保质期内理化性质要保持稳定,且活菌数要在合理的范围内才能达到发酵乳的益生作用。研究测定P.pentosaceus SBC5制备的发酵乳在储存期间的脱水收缩能力稳定,黏度适中,活菌数为2.04×108CFU/mL,高于国标规定的值。
综上所述,P.pentosaceusSBC5具有良好的耐受性和一定的α-淀粉酶抑制特性、抗氧化、抑菌功能,且应用于发酵乳中,其凝乳时间较短,总体发酵性能优良,发酵乳总体感官评价较高,储存期间发酵乳性能较为稳定,可为其进一步应用奠定基础。
[1] 王刚,朱慧越, 俞赟霞, 等.乳酸菌合成细菌素及对肠道菌群的影响[J].食品与发酵工业, 2019, 45(21):264-271.
WANG G, ZHU H Y, YU Y X, et al.Bacteriocin synthesized by lactic acid bacteria and its effect on gut microbiota[J].Food and Fermentation Industries, 2019, 45(21):264-271.
[2] JIANGS M, CAI L Z, LV L X, et al.Pediococcus pentosaceus, a future additive or probiotic candidate[J].Microbial Cell Factories, 2021, 20(1):45.
[3] QIY N, HUANG L, ZENG Y, et al.Pediococcus pentosaceus:Screening and application as probiotics in food processing[J].Frontiers in Microbiology, 2021, 12:762467.
[4] 孙艳菲,陈瑞, 王露, 等.戊糖片球菌表面蛋白性质及抑菌作用研究[J].食品科学技术学报, 2019, 37(1):54-61.
SUN Y F, CHEN R, WANG L, et al.Surface properties of Pediococcus pentosaceusand antibacterial effect[J].Journal of Food Science and Technology, 2019, 37(1):54-61.
[5] 陈佩,党辉, 郭红军, 等.戊糖片球菌S44胞外多糖抗氧化活性分析[J].食品研究与开发, 2019, 40(10):188-193.
CHEN P, DANG H, GUO H J, et al.Antioxidant activity analysis of expolysaccharide from Pediococcus pentosaceusS44 strains[J].Food Research and Development, 2019, 40(10):188-193.
[6] 陈佩,翟彩宁, 郭红军, 等.戊糖片球菌P36胞外多糖体外抗氧化能力的研究[J].陕西广播电视大学学报, 2019, 21(1):93-96.
CHEN P, ZHAI C N, GUO H J, et al.Study on the antioxidant capacity of exopolysaccharide of Pediococcus pentosaceusP36 in vitro[J].Journal of Shaanxi Radio &TV University, 2019, 21(1):93-96.
[7] 巨晓英,韩烨, 周志江.自然发酵泡菜中乳酸菌的分离鉴定[J].食品与机械, 2008, 24(5):29-31.
JU X Y, HAN Y, ZHOU Z J.Isolation and identification of lactic acid bacteria from natural fermentation pickles[J].Food &Machinery, 2008, 24(5):29-31.
[8] 曹振辉,潘洪彬, 张鲜焰, 等.戊糖片球菌的益生功能及其在食品科学领域中的应用[J].安徽农业科学, 2016, 44(9):106-108.
CAO Z H, PAN H B, ZHANG X Y, et al.Application of the beneficial function of Pediococcus pentosaceusin the field of food science[J].Journal of Anhui Agricultural Sciences, 2016, 44(9):106-108.
[9] 李曼,马扶强, 韩思睿, 等.戊糖片球菌HM04发酵对无花果浆主要代谢产物及抗氧化活性的影响[J].山东农业大学学报(自然科学版), 2022, 53(2):171-179.
LI M, MA F Q, HAN S R, et al.Effects of Pediococcus pentosaceusHM04 fermentation on main metabolites and antioxidant activities of Ficus caricaL[J].Journal of Shandong Agricultural University (Natural Science Edition), 2022, 53(2):171-179.
[10] 孙盛,陈作国, 俞赟霞, 等.贵州泡菜中润肠通便功能乳酸菌的筛选及其特性研究[J].中国酿造, 2021, 40(10):76-82.
SUN S, CHEN Z G, YU Y X, et al.Screening and characteristics of lactic acid bacteria with laxative function from Guizhou Paocai[J].China Brewing, 2021, 40(10):76-82.
[11] 李华,王扬, 李强, 等.灿烂弧菌的疏水性和生物被膜形成能力[J].中国水产科学, 2011, 18(5):1 084-1 091.
LI H, WANG Y, LI Q, et al.Cell surface hydrophobicity and biofilm formation ability of Vibrio splendidus[J].Journal of Fishery Sciences of China, 2011, 18(5):1 084-1 091.
[12] 陈佩.益生乳酸菌的降糖作用及其机制的研究[D].无锡:江南大学, 2014.
CHEN P.Study on the antidiabetic effect of probiotics and its mechanisms[D].Wuxi:Jiangnan University, 2014.
[13] 高涵,王志新, 高爽, 等.体外抗氧化试验筛选抗氧化肽的方法比较[J].食品研究与开发, 2019, 40(1):7-10.
GAO H, WANG Z X, GAO S, et al.Comparison of methods for screening antioxidant peptides by antioxidant assay in vitro[J].Food Research and Development, 2019, 40(1):7-10.
[14] 王俊钢,刘成江, 郭安民, 等.分子生物学技术在乳酸菌鉴定中的应用[J].乳业科学与技术, 2011, 34(4):190-193.
WANG J G, LIU C J, GUO A M, et al.Review on the molecular biotechnology for the identification of lactic acid bacteria[J].Journal of Dairy Science and Technology, 2011, 34(4):190-193.
[15] 林丽清,汪欣, 夏九学, 等.内蒙古奶豆腐中优良乳酸菌的筛选及发酵性能研究[J].中国乳品工业, 2018, 46(11):7-10.
LIN L Q, WANG X, XIA J X, et al.Study on the fermentation performances of lactic acid bacteria isolated from traditional fermented milk tofu in Inner Mongolia[J].China Dairy Industry, 2018, 46(11):7-10.
[16] PHUONGT T T, LE THI KIM T, LE MY TIEU N, et al.Characterization halotolerant lactic acid bacteria Pediococcus pentosaceusHN10 and in vivoevaluation for bacterial pathogens inhibition[J].Chemical Engineering and Processing-Process Intensification, 2021, 168:108576.
[17] 龚虹,王海霞, 马征途, 等.乳酸菌粘附力与生物膜、疏水性和自凝集特性的研究[J].中国微生态学杂志, 2016, 28(9):1 026-1 028;1 033.
GONG H, WANG H X, MA Z T, et al.Biofilm hydrophobicity and auto-agglutination properties of five Lactobacillusstrains[J].Chinese Journal of Microecology, 2016, 28(9):1 026-1 028;1033.
[18] KIMS, HONG S P, LIM S D.Physiological characteristics and anti-diabetic effect of Pediococcus pentosaceusKI62[J].Food Science of Animal Resources, 2021, 41(2):274-287.
[19] 李向菲.产胞外多糖乳酸菌对2型糖尿病的干预及其机制研究[D].无锡:江南大学, 2016.
LI X F.Effect of exopolysaccharides-producing lactic acid bacteria on type 2 diabetes and its mechanism[D].Wuxi:Jiangnan University, 2016.
[20] YANGS J, KIM K T, KIM T Y, et al.Probiotic properties and antioxidant activities of Pediococcus pentosaceusSC28 and Levilactobacillus brevisKU15151 in fermented black gamju[J].Foods (Basel, Switzerland), 2020, 9(9):1154.
[21] LIUL, CAI X N, AI Y, et al.Effects of Lactobacillus pentosuscombined with Arthrospira platensison the growth performance, immune response, and intestinal microbiota of Litopenaeus vannamei[J].Fish &Shellfish Immunology, 2022, 120:345-352.
[22] CHIUS T, CHU T W, SIMANGUNSONG T, et al.Probiotic, Lactobacillus pentosusBD6 boost the growth and health status of white shrimp, Litopenaeus vannameivia oral administration[J].Fish &Shellfish Immunology, 2021, 117:124-135.
[23] 张开屏,张保军, 田建军.一株戊糖片球菌对发酵羊肉干品质的影响[J].食品研究与开发, 2018, 39(13):99-104.
ZHANG K P, ZHANG B J, TIAN J J.Effect of an Pediococcus pentosaceuson quality of fermented semi-dry mutton[J].Food Research and Development, 2018, 39(13):99-104.
[24] LIC S, ZHAO Y, WANG Y Q, et al.Contribution of microbial community to flavor formation in tilapia sausage during fermentation with Pediococcus pentosaceus[J].LWT, 2022, 154:112628.
[25] SONGG, HE Z, WANG X Y, et al.Improving the quality of Suancai by inoculating with Lactobacillus plantarumand Pediococcus pentosaceus[J].Food Research International, 2021, 148:110581.
[26] 董佩佩,徐海燕, 辛国芹, 等.5种饲用乳酸菌耐热性能的研究[J].饲料广角, 2015(18):28-30.
DONG P P, XU H Y, XIN G Q, et al.Study on heat resistance of five kinds of feed lactic acid bacteria[J].Feed China, 2015(18):28-30.
[27] HUD, WU J Y, JIN L, et al.Evaluation of Pediococcus pentosaceusstrains as probiotic adjunct cultures for soybean milk post-fermentation[J].Food Research International, 2021, 148:110570.
[28] 王艳婷,汪立平, 唐潮, 等.蒙古干酪中产细菌素戊糖片球菌的筛选及其细菌素理化特性研究[J].食品与发酵工业, 2015, 41(10):14-19;24.
WANG Y T, WANG L P, TANG C, et al.Screening of bacteriocin-producing Pediococcus pentosaceusfrom Mongolia cheese and study on physicochemical characteristics of bacteriocin[J].Food and Fermentation Industries, 2015, 41(10):14-19;24.
[29] ADEBAYO-TAYO B C, OLOMITUTU F O, ADEBAMI G E.Production and evaluation of probioticated mango juice using Pediococcus pentosaceusand Pediococcus acidilacticiduring storage at different temperature[J].Journal of Agriculture and Food Research, 2021, 6:100202.