糖尿病以高血糖为主要特征,已成为威胁人类健康的代谢疾病之一。2型糖尿病为最常见类型,占糖尿病患者90%以上[1],机体餐后高血糖比空腹高血糖危害性更高[2]。α-淀粉酶和α-葡萄糖苷酶是调节餐后血糖水平的关键酶,通过抑制酶的活性使小肠上部吸收较少的碳水化合物,从而降低餐后血糖[3],因此也是治疗糖尿病的靶点之一。市面上已有的药品,如阿卡波糖、伏格列波糖,通过抑制α-淀粉酶或α-葡萄糖苷酶的活性来缓解高血糖症状[4],但长期服用会对机体产生副作用,引起胃肠道反应[5],因此寻找天然无副作用的抑制剂已成为当前研究热点。
鸡血藤为中国药典收录的中草药,是豆科植物密花豆(Spatholobus suberedus)的干燥藤茎,主要生长于广西、广东、云南等地[6],是广西推荐的“桂十味”道地药材之一。鸡血藤中含有黄酮类、酚酸类、苯丙素类、蒽醌等化学活性成分[7-8]。研究表明,鸡血藤具有抗肿瘤、抗氧化、抗炎、抗病毒、保护心脑血管等多种生物活性[8-12]。鸡血藤的水提物可以通过调节肠道菌群来缓解肥胖,维持葡萄糖稳定[13]。鸡血藤总黄酮能改善2型糖尿病模型大鼠的血脂代谢[14]。此外,鸡血藤能通过小鼠体内GLUT4的表达有效增强葡萄糖摄取,降低餐后血糖水平,且表现出有抑制α-葡萄糖苷酶的潜力[15]。这些均表明鸡血藤与降糖作用相关,但目前的研究内容仅限于鸡血藤的粗提物,对于粗提物分离后的作用效果及是否可以提高对α-淀粉酶和α-葡萄糖苷酶的抑制活性并未作报道。本文以α-淀粉酶和α-葡萄糖苷酶为靶点,首先比较水提物及醇提物对2种酶的抑制作用,进一步比较醇提物分离后各组分的抑制能力,分析酶动力学抑制类型。为后续深入研究鸡血藤降血糖作用机制以及开发新的降糖药物提供理论依据。
1 材料与方法
1.1 仪器与试剂
VIS-7220 N可见分光光度计,哈肯国际贸易有限公司;SQP分析天平,赛多利斯科学仪器有限公司;ZNHW数显电热套,上海力辰邦西仪器科技有限公司;HH-S2数显恒温水浴锅,金坛市医疗器械有限公司;KQ-400KDE高功率数控超声波清洗器,昆山市超声仪器有限公司。
鸡血藤,桂林药材市场;无水乙醇,天津市富于精细化工有限公司;碘标准溶液(0.1 mol/L),罗恩试剂;可溶性淀粉、HCl、二甲基亚砜、Na2CO3、KH2PO4、K2H2PO4、正丁醇、乙酸乙酯、CH2Cl2,西陇科学股份有限公司;α-淀粉酶,北京索莱宝科技有限公司;α-葡萄糖苷酶、4-硝基苯基α-D-吡喃葡萄糖苷、阿卡波糖水合物,阿拉丁试剂(上海)有限公司;试剂均为分析级及以上。
1.2 实验方法
1.2.1 样品制备
鸡血藤干燥块根与75%的乙醇(料液比1∶20,g∶mL)浸泡过夜,70 ℃下提取3次,每次1 h,旋转蒸发得醇提物(ethanol extract of S.suberedus,ESs)。取醇提后的鸡血藤进行水提(料液比1∶16,g∶mL),100 ℃下提取3次,每次1 h,水提液浓缩,95%的乙醇醇沉得水提物(water extract of S.suberedus,WSs)。
所得ESs用蒸馏水溶解,依次用二氯甲烷、乙酸乙酯和正丁醇分别萃取,得到4个组分:水萃取相(water extract ESs,W-ESs),二氯甲烷萃取相(dichloromethane extract ESs,D-ESs),乙酸乙酯萃取相(ethyl acetate extract ESs,E-ESs),正丁醇萃取相(N-butanol extract ESs,N-ESs)。鸡血藤提取路线图如图1所示。
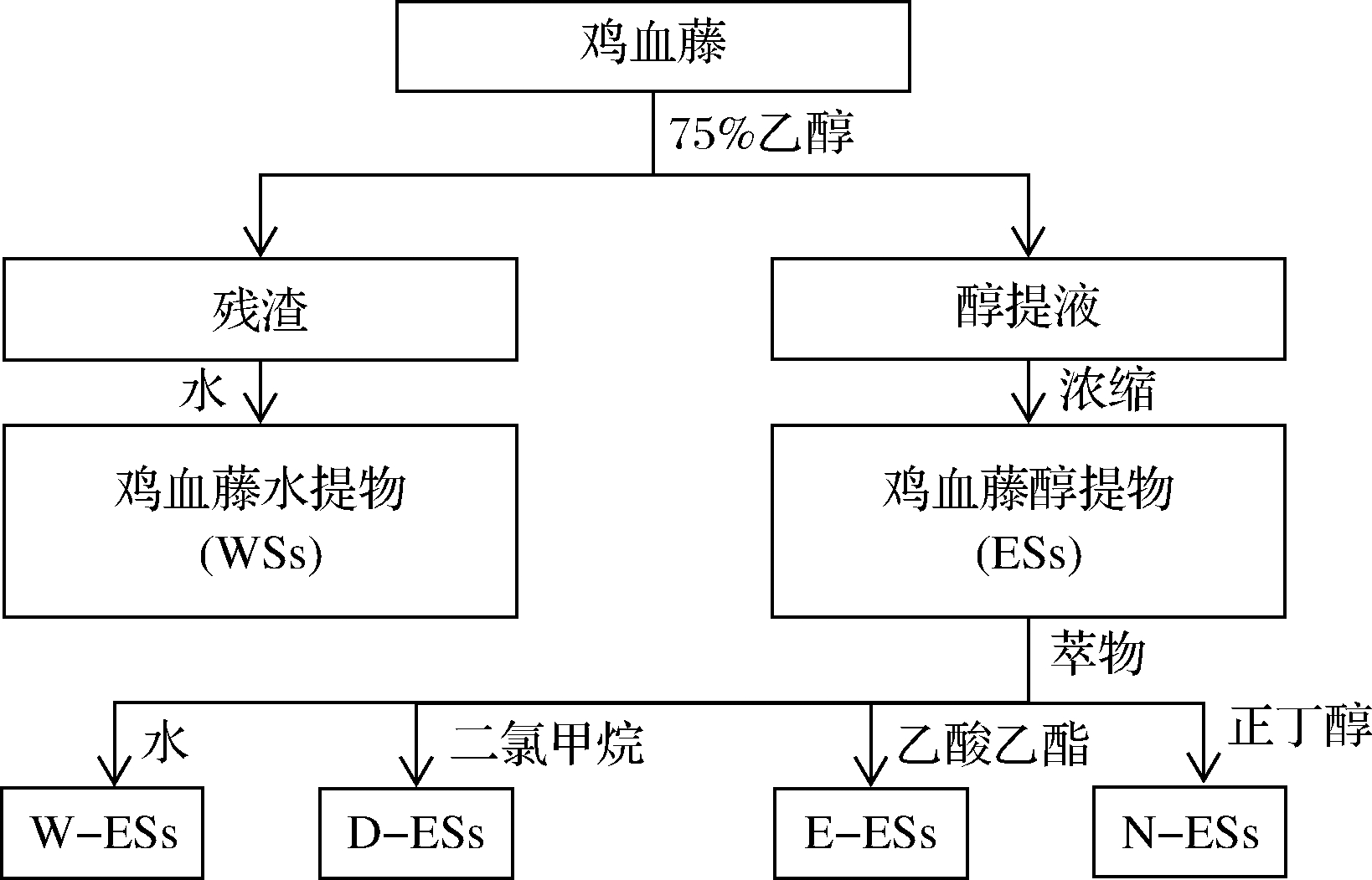
图1 鸡血藤提取分离工艺流程图
Fig.1 Extraction and fractionation scheme of S.suberedus
1.2.2 对α-淀粉酶的抑制作用
参考王宁丽等[16]的方法并略作修改,取0.4 mL样品溶液(0.2、0.4、0.6、0.8、1.0 mg/mL)与等体积的α-淀粉酶(3.0 U/mL)混合均匀,37 ℃孵育20 min后加入0.4 mL 5%(质量分数)的淀粉溶液,充分混匀,反应5 min后立即加入1 mL 2 mol/L HCl溶液终止反应,加入0.2 mL 0.01 mol/mL 碘标准溶液显色,最后加5 mL蒸馏水稀释,与660 nm下测定吸光度值A1。同样条件下以磷酸钾缓冲液代替α-淀粉酶测定吸光度A2;磷酸钾缓冲液代替样品溶液测定吸光度值A3;磷酸钾缓冲液代替α-淀粉酶及样品溶液测定吸光度值A4。以阿卡波糖为阳性对照,根据公式(1)计算α-淀粉酶抑制率:
α-淀粉酶抑制率![]()
(1)
1.2.3 对α-葡萄糖苷酶的抑制作用
参考JIANG等[17]的方法并略作修改,取50 μL样品溶液(10、20、40、60、80、100 μg/mL)与20 μL 0.2 U/mL的α-葡萄糖苷酶、8 μL DMSO和112 μL磷酸钾缓冲液(pH=6.8)充分混合,37 ℃下孵育20 min后加入20 μL 10 mmol/L pNPG溶液,37 ℃恒温反应15 min,最后加入80 μL Na2CO3溶液终止反应,与405 nm下测定吸光度值A1。同样条件下,以磷酸钾缓冲液代替样品溶液测定吸光度值A0。以阿卡波糖为阳性对照,根据公式(2)计算α-葡萄糖苷酶抑制率:
α-葡萄糖苷酶抑制率![]()
(2)
1.2.4 对α-淀粉酶的抑制作用类型
取质量分数为0.25%、0.5%、1.0%、2.0%、4.0% 的淀粉溶液,鸡血藤各提取物的质量浓度为0.2、0.5、1.0 mg/mL,α-淀粉酶浓度为0.3 U/mL。在以上条件下按1.2.2所述方法测定反应速率,以淀粉溶液质量分数倒数(1/[S])为横坐标,反应速率倒数(1/V)为纵坐标作图,得到Lineweaver-Burk 曲线,判断α-淀粉酶抑制类型。Lineweaver-Burk曲线是研究酶动力学最常用的方法,根据米氏方程,以V对[S]进行倒数处理,如式(3)所示:
(3)
由Lineweaver-Burk曲线,计算得出动力学参数Vmax和Km。
1.2.5 对α-葡萄糖苷酶的抑制类型
取pNPG浓度为 2.0、4.0、6.0、8.0、10.0 mmol/L,鸡血藤各提取物的质量浓度为 0、20、50 μg/mL,α-葡萄糖苷酶浓度为 0.2 U/mL。在以上条件下,按1.2.3所述方法测定反应速率,以pNPG浓度的倒数(1/[S])为横坐标,反应速率(1/V)为纵坐标作图,得到Lineweaver-Burk曲线,计算得出动力学参数Vmax和Km。
1.3 数据处理
采用GraphPad Prism 8进行统计处理,数据以平均值±方差表示,计算IC50值。
2 结果与分析
2.1 鸡血藤提取物对α-淀粉酶抑制率
如图2-a所示,随着浓度的升高,ESs及WSs对于α-淀粉酶的抑制率也逐渐增大。质量浓度为1.0 mg/mL时,α-淀粉酶抑制率达到最大值,分别为54.20%和5.32%。ESs的抑制作用明显高于WEs,其ESs的IC50值为(0.93±0.04) mg/mL。研究表明,一些中药的乙醇提取物对α-淀粉酶的抑制率显著优于水提取物[18],与本文的结果一致。进一步,利用不同极性溶剂萃取ESs,研究了各萃取组分的抑制作用,结果如图2-b所示,样品对α-淀粉酶抑制率随着样品的浓度增加而增大,且抑制作用能力大小依次是W-ESs>D-ESs>ESs>N-ESs>E-ESs。质量浓度为1.0 mg/mL时W-ESs、D-ESs、E-ESs、N-ESs的抑制率达到最大分别为59.41%、56.87%、42.58%、46.94%。计算可知W-ESs和D-ESs的IC50值分别为(0.88±0.02)、(0.89±0.01) mg/mL。结果表明,萃取分离的4个组分对α-淀粉酶均有一定抑制作用,W-ESs效果最好,其中W-ESs及D-ESs抑制活性均高于ESs,可知对ESs进一步萃取分离,可提高对酶的抑制活性。也有其他文献比较了中药不同极性萃取物对α-淀粉酶的抑制作用,发现也是水萃取物的活性最显著[19]。
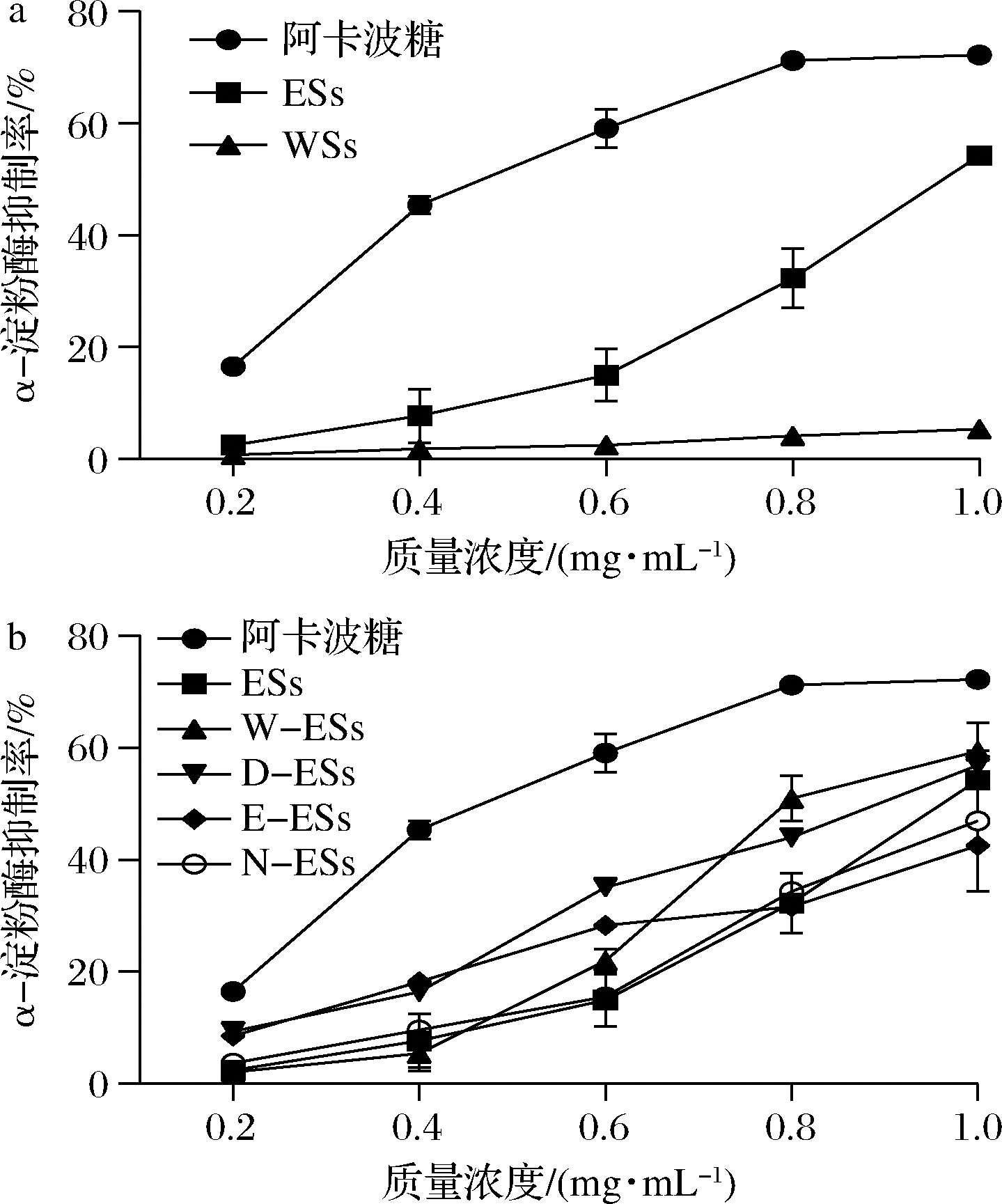
a-鸡血藤提取物;b-提取物萃取组分
图2 鸡血藤提取物对α-淀粉酶的抑制作用
Fig.2 α-Amylase inhibitory activities of the extracts from S.suberedus
2.2 鸡血藤提取物对α-葡萄糖苷酶抑制率
如图3-a所示,ESs及WSs对α-葡萄糖苷酶的抑制率随着浓度的增大而增大,相同浓度范围内,在浓度为100 μg/mL时达到最大抑制率71.99%和24.15%。ESs对α-葡萄糖苷酶的抑制活性明显优于WSs,IC50值为(29.83±1.32) μg/mL。ZHAO等[15]的研究也显示鸡血藤乙醇提取物对α-葡萄糖苷酶有抑制作用。进一步分离ESs,比较各组分的抑制作用,结果如图3-b。样品浓度与其对α-葡萄糖苷酶的抑制率呈现正相关趋势,在浓度为100 μg/mL时,达到最大抑制率,作用大小依次为W-ESs>ESs>N-ESs>E-ESs>D-ESs。其中W-ESs,D-ESs,E-ESs,N-ESs最高抑制率分别为77.99%、55.11%、60.78%、69.57%;IC50值分别为(15.82±2.79)、(90.67±7.21)、(50.21±2.04)、(35.93±3.17) μg/mL。本部分研究结果表明,萃取分离的4个组分对α-葡萄糖苷酶均有一定抑制作用,W-ESs抑制活性最好,这与对α-淀粉酶作用效果一致。W-ESs的抑制作用显著高于ESs,进一步说明对ESs萃取分离,可提高对酶的抑制活性。在中药石韦中也表现出了相同的抑制作用[19]。与上述α-淀粉酶抑制活性相比(图2),鸡血藤对α-葡萄糖苷酶的活性更好,这与中药蒲桃的作用效果一致[20]。
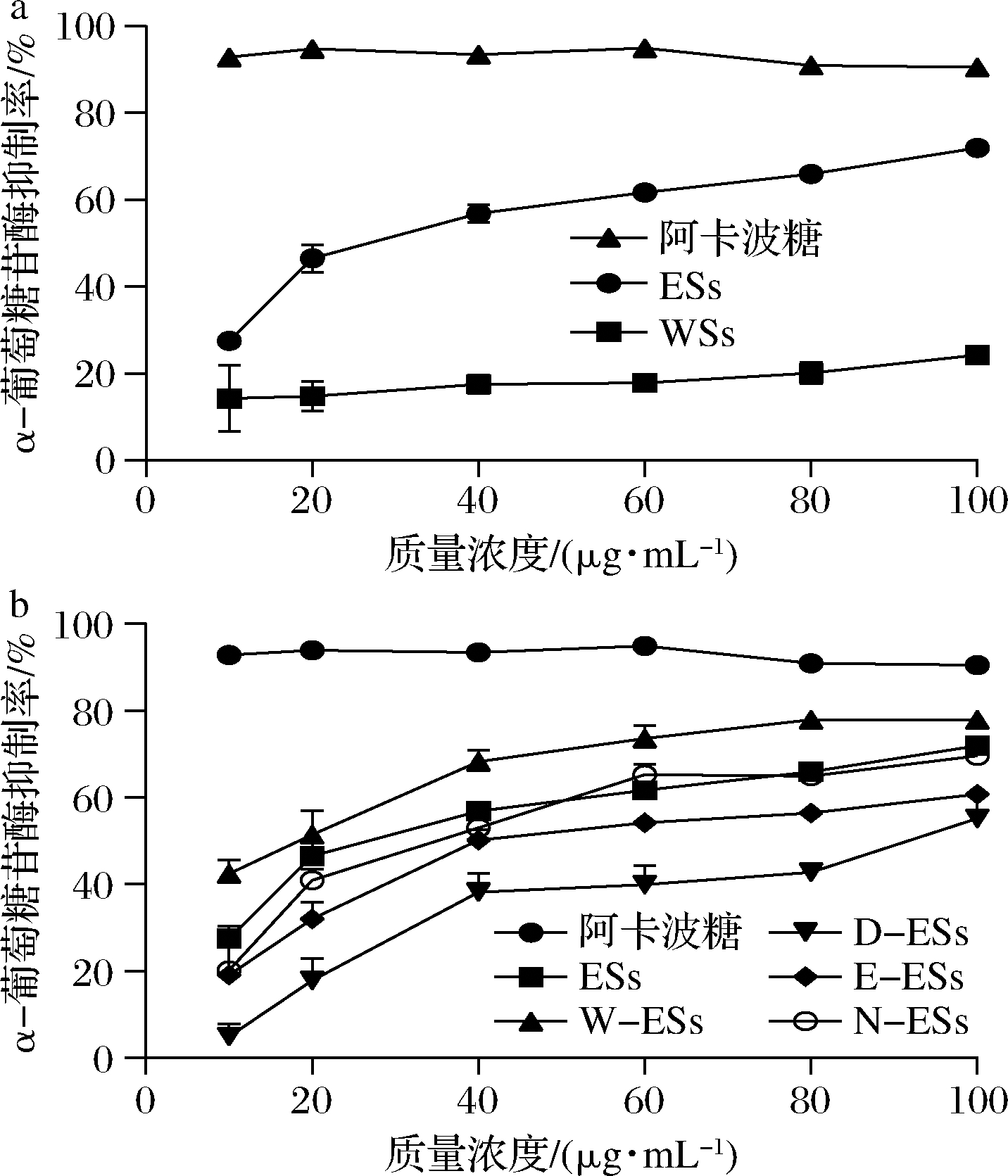
a-鸡血藤提取物;b-提取物萃取组分
图3 鸡血藤提取物对α-葡萄糖苷酶的抑制作用
Fig.3 α-Glucosidase inhibitory activities of the extracts fromS.suberedus
2.3 酶抑制动力学
2.3.1 鸡血藤提取物对α-淀粉酶的抑制作用类型
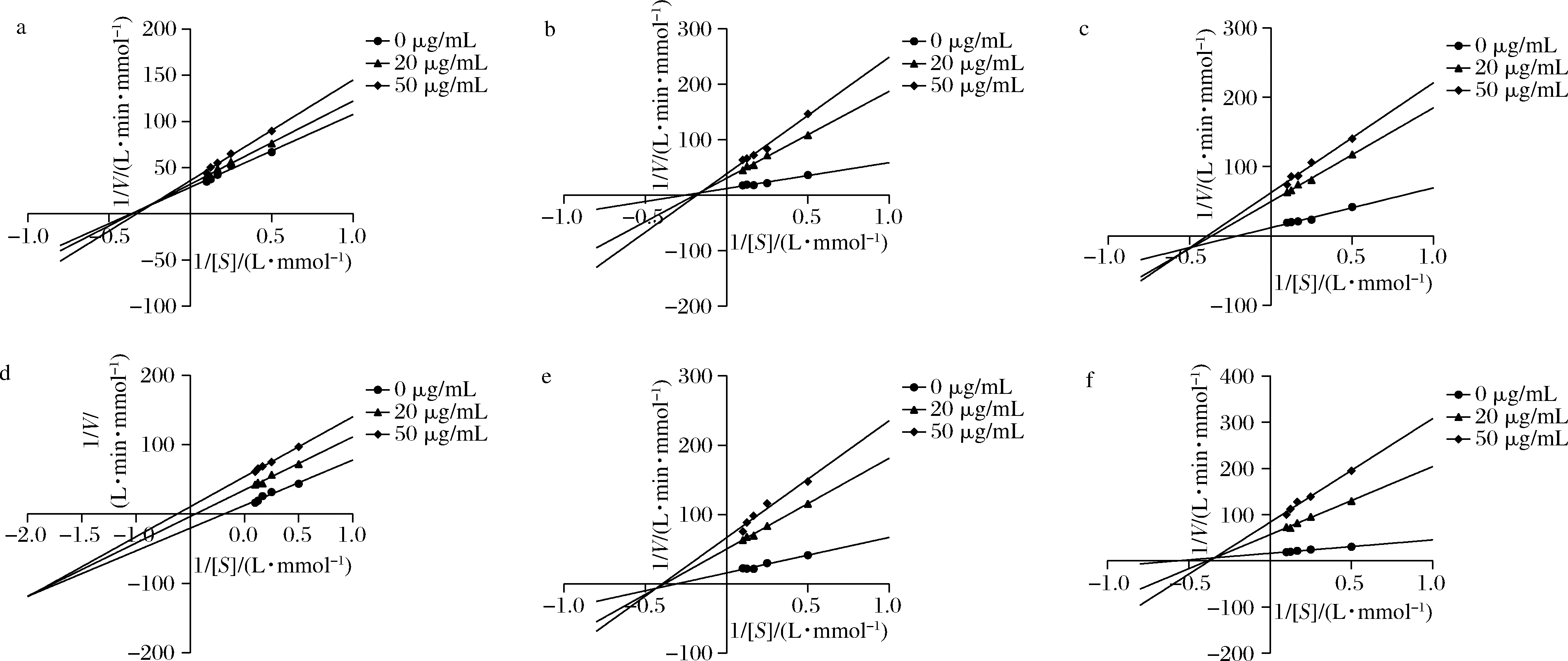
为确定鸡血藤提取物对α-淀粉酶的抑制类型,以淀粉浓度倒数(1/[S])为横坐标,反应速率倒数(1/V)为纵坐标作图,结果如图4所示。WSs、ESs、W-ESs及N-ESs的Lineweaver-Burk曲线均交于第一象限,且随着样品浓度增大(表1),Km减小,酶与底物的亲和力增大[21],表明酶与底物和抑制剂存在竞争性,由于其Vmax减小,为典型的反竞争性抑制[22],可知样品只能与酶-底物复合物结合抑制产物释放,进而降低酶活性,说明4种样品均为反竞争性抑制类型。D-ESs和E-ESs的Lineweaver-Burk曲线分别交于第二、第三象限(图4-d和图4-e),且随着样品浓度的增大(表1),Km减小,酶与底物的亲和力增大[21],表明酶与底物和抑制剂同样存在竞争性,由于其Vmax增大,为混合型抑制[23],可知样品可与底物竞争游离酶的结合位点,又可与酶-底物复合物结合来降低酶活性,说明D-ESs和E-ESs对α-淀粉酶的抑制类型为竞争性和非竞争性混合抑制类型。

a-WSs;b-ESs;c-W-ESs;d-D-ESs;e-E-ESs;f-N-ESs
图4 鸡血藤提取物抑制α-淀粉酶的Lineweaver-Burk曲线
Fig.4 Lineweaver-Burk curve of inhibitory effect of extracts from S. subereduson α-amylase
表1 α-淀粉酶的动力学参数
Table 1 Kinetic parameters of α-amylase

样品质量浓度/(mg·mL-1)0.20.5拟合曲线方程VmaxKm拟合曲线方程VmaxKmWSsy=65.43x-23.188R2=0.993 60.0432.822y=22.907x-8.402 7R2=0.983 00.0122.726ESsy=1.390 7x+1.788 5R2=0.988 80.5590.732y=1.193 8x+1.989 7R2=0.985 70.5020.600W-ESsy=4.752x-0.089 5R2=0.976 411.17353.095y=3.999 7x+0.314 3R2=0.965 03.18212.726D-ESsy=5.415 2x+4.771 3R2=0.945 80.2101.135y=2.810 5x+3.798 4R2=0.998 80.2630.740E-ESsy=35.113x-8.508 8R2=0.992 10.1184.127y=5.188 6x+2.022 9R2=0.996 60.4942.565N-ESsy=3.873 6x+0.438 8R2=0.981 82.2798.828y=1.464 3x+1.822 2R2=0.990 20.5490.804
2.3.2 鸡血藤提取物对α-葡萄糖苷酶的抑制作用类型
为确定鸡血藤提取物对α-葡萄糖苷酶的抑制类型,以pNPG浓度倒数(1/[S])为横坐标,反应速率倒数(1/V)为纵坐标作图,结果如图5所示。WSs、ESs和N-ESs的Lineweaver-Burk曲线交点均交于第二象限,且随着样品浓度的增加(表2),Km增大,酶与底物的亲和力减小[21],可知酶与底物和抑制剂存在竞争作用,由于其Vmax减小,为典型混合型抑制[24],表明样品能与游离酶和酶-底物复合物结合,复合物不能生产产物,进而降低酶活性,说明WSs、ESs和N-ESs对α-葡萄糖苷酶为反竞争性和非竞争性混合的抑制类型。W-ESs、D-ESs和E-ESs随着样品浓度的增加,Vmax减小,Km减小,酶与底物亲和力增大,Lineweaver-Burk曲线交点均交于第三象限(图5-c~图5-e),可知其抑制类型与WSs、ESs、W-ESs及N-ESs对α-淀粉酶的抑制类型相同,为反竞争性抑制类型。
鸡血藤提取物对α-淀粉酶和α-葡萄糖苷酶抑制类型不同,从而表现出与2种酶不同的结合方式,产生差异的原因可能是提取物所含化学成分不同,具体作用方式需进一步研究。
a-WSs;b-ESs;c-W-ESs;d-D-ESs;e-E-ESs;f-N-ESs
图5 鸡血藤提取物抑制α-葡萄糖苷酶的Lineweaver-Burk曲线
Fig.5 Lineweaver-Burk curve of inhibitory effect of extracts from S. subereduson α-glucosidase
表2 α-葡萄糖苷酶的动力学参数
Table 2 Kinetic parameters of α-glucosidase
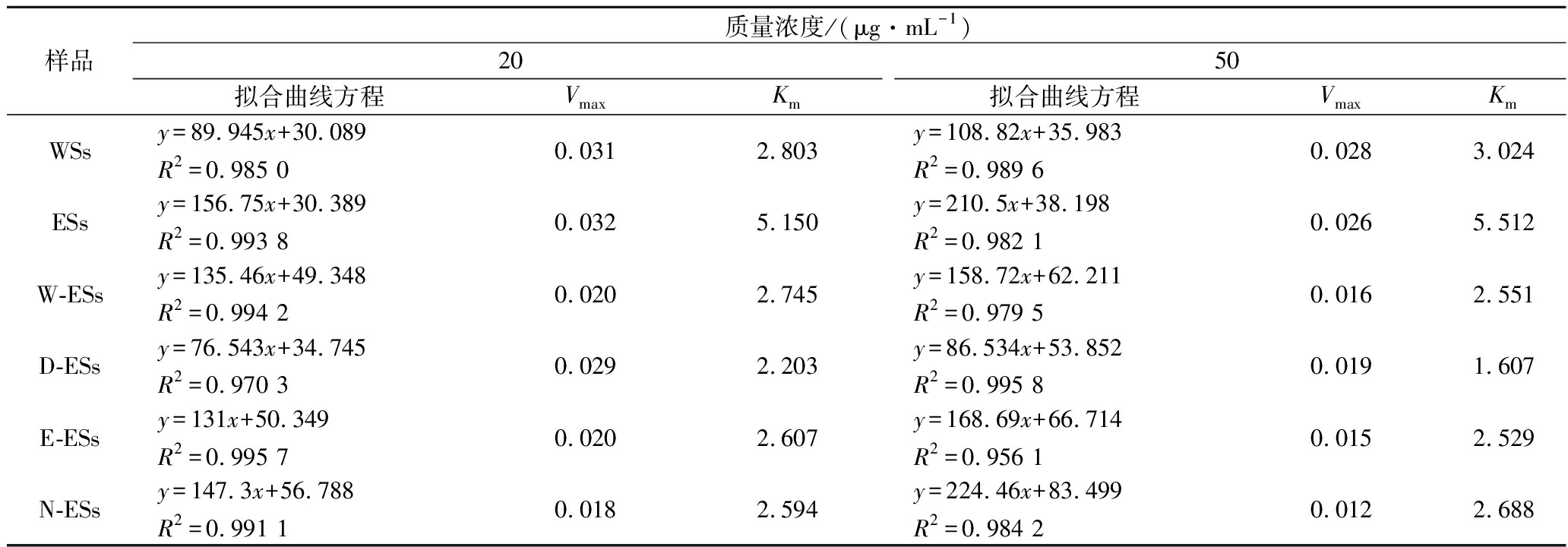
样品质量浓度/(μg·mL-1)2050拟合曲线方程VmaxKm拟合曲线方程VmaxKmWSsy=89.945x+30.089R2=0.985 00.0312.803y=108.82x+35.983R2=0.989 60.0283.024ESsy=156.75x+30.389R2=0.993 80.0325.150y=210.5x+38.198R2=0.982 10.0265.512W-ESsy=135.46x+49.348R2=0.994 20.0202.745y=158.72x+62.211R2=0.979 50.0162.551D-ESsy=76.543x+34.745R2=0.970 30.0292.203y=86.534x+53.852R2=0.995 80.0191.607E-ESsy=131x+50.349R2=0.995 70.0202.607y=168.69x+66.714R2=0.956 10.0152.529N-ESsy=147.3x+56.788R2=0.991 10.0182.594y=224.46x+83.499R2=0.984 20.0122.688
3 结论
本文首先比较了鸡血藤粗提物(ESs和WSs)对α-淀粉酶和α-葡萄糖苷酶的抑制活性。结果表明,ESs对2种酶的抑制作用明显高于WSs。对ESs进一步萃取分离,比较4个组分和ESs对酶的抑制活性。结果显示,萃取分离得到的W-ESs组分表现出最佳的酶抑制活性。同时,分析了鸡血藤提取物的酶抑制动力学类型。发现由于酶、底物和鸡血藤各提取物结合方式以及结合先后顺序的不同,鸡血藤各提取物表现出了不同的抑制类型。对于α-淀粉酶,WSs、ESs、W-ESs及N-ESs的抑制类型均为反竞争性抑制,而D-ESs和E-ESs的抑制类型为以竞争性为主导的混合抑制类型。对于α-葡萄糖苷酶,W-ESs、D-ESs和E-ESs为反竞争性抑制类型,WSs、ESs和N-ESs为以反竞争性抑制为主导的混合抑制类型。综上所述,鸡血藤具有抑制α-淀粉酶和α-葡萄糖苷酶活性的能力,且经过萃取分离后的鸡血藤粗提物表现出更明显的抑制活性,有望在未来分离出有降血糖作用的单体,开发新的降血糖药物。
[1] TUW J, XUE Y M, NIE D.The prevalence and treatment of diabetes in China from 2013 to 2018[J].JAMA, 2022, 327(17):1706.
[2] HIYOSHIT, FUJIWARA M, YAO Z M.Postprandial hyperglycemia and postprandial hypertriglyceridemia in type 2 diabetes[J].Journal of Biomedical Research, 2017, 33(1):1-16.
[3] JAGADEESANG, MUNIYANDI K, MANOHARAN A L, et al.Understanding the bioaccessibility, α-amylase and α-glucosidase enzyme inhibition kinetics of Allmania nodiflora(L.) R.Br.ex Wight polyphenols during in vitrosimulated digestion[J].Food Chemistry, 2022, 372:131294.
[4] 顾觉奋,陈紫娟.α-葡萄糖苷酶抑制剂的研究及应用[J].药学进展, 2009, 33(2):62-67.
GU J F, CHEN Z J.The studies and applications of α-glucosidase inhibitors[J].Progress in Pharmaceutical Sciences, 2009, 33(2):62-67.
[5] 李洪梅.α-葡萄糖苷酶抑制剂的临床应用[J].中国医刊, 2007, 42(10):19-21.
LI H M.Clinical application of α-glucosidase inhibitors[J].Chinese Journal of Medicine, 2007, 42(10):19-21.
[6] 国家药典委员会.中华人民共和国药典-二部:2010年版[M].北京:中国医药科技出版社, 2010.
Chinese Pharmacopoeia Commission. Chinese pharmacopoeia-Part Ⅱ: 2010 edition[M]. Beijing: The Medicine Science and Technology Press of China, 2010.
[7] 刘静,王晓静, 戴忠, 等.鸡血藤研究进展[J].中国药事, 2019, 33(2):188-194.
LIU J, WANG X J, DAI Z, et al.Research progress of Spatholobi caulis[J].Chinese Pharmaceutical Affairs, 2019, 33(2):188-194.
[8] 苏贤君.中药鸡血藤Spatholobus suberectusDunn.化学成分的研究[D].广州:广州中医药大学, 2016.
SU X J.Research on the chemical constituents of Spatholobus suberectusDunn.[D].Guangzhou:Guangzhou University of Chinese Medicine, 2016.
[9] 唐旗羚,曹颖男, 徐娟娟, 等.鸡血藤组方提取物的抗肿瘤作用及其机制初探[J].中国医药指南, 2018, 16(15):34;39.
TANG Q L, CAO Y N, XU J J, et al.Study of anti-cancer effect and the mechanism of Millettiaformulation extract[J].Guide of China Medicine, 2018, 16(15):34;39.
[10] FUY F, JIANG L H, ZHAO W D, et al.Immunomodulatory and antioxidant effects of total flavonoids of Spatholobus suberectusDunn on PCV2infected mice[J].Scientific Reports, 2017, 7:8676.
[11] HOUX K, MAO J S.Long noncoding RNA SNHG14 promotes osteosarcoma progression via miR-433-3p/FBXO22 axis[J].Biochemical and Biophysical Research Communications, 2020, 523(3):766-772.
[12] 李丽,王林萍.鸡血藤总黄酮对大鼠急性心肌缺血的保护作用[J].中成药, 2015, 37(10):2 303-2 306.
LI L, WANG L P.Protective effect of total flavonoids from Spatholobus suberectuson acute myocardial ischemia in rats[J].Chinese Traditional Patent Medicine, 2015, 37(10):2 303-2 306.
[13] ZHANGC H, LIU J Y, HE X Y, et al.Caulis spatholobiameliorates obesity through activating brown adipose tissue and modulating the composition of gut microbiota[J].International Journal of Molecular Sciences, 2019, 20(20):5150.
[14] 袁莎莎,杨宏杰, 范朝华, 等.鸡血藤总黄酮对2型糖尿病模型大鼠血脂、血液流变学的影响[J].中医学报, 2020, 35(10):2 178-2 181.
YUAN S S, YANG H J, FAN C H, et al.Effects of Spatholobus spatholobitotal flavonoids on blood lipids and hemorheology in type 2 diabetic rat[J].Acta Chinese Medicine, 2020, 35(10):2 178-2 181.
[15] ZHAOP J, ALAM M B, LEE S H, et al.Spatholobus suberectusexhibits antidiabetic activity in vitroand in vivothrough activation of AKT-AMPK pathway[J].Evidence-Based Complementary and Alternative Medicine:ECAM,2017, 2017:6091923.
[16] 王宁丽,魏鉴腾, 祝潇, 等.基于碘-淀粉显色的α-淀粉酶抑制剂筛选方法研究及应用[J].中国海洋药物, 2017, 36(5):75-78.
WANG N L, WEI J T, ZHU X, et al.Study and application of the method for screening of α-amylase inhibitors based on iodine-starch colorimetry[J].Chinese Journal of Marine Drugs, 2017, 36(5):75-78.
[17] JIANGL L, WANG Z, WANG X Y, et al.Exploring the inhibitory mechanism of piceatannol on α-glucosidase relevant to diabetes mellitus[J].RSC Advances, 2020, 10(8):4 529-4 537.
[18] KIMJ H, LEE S Y, PARK J M, et al.Antioxidant activity and inhibition activity against α-amylase and α-glucosidase of Juniperus rigidaSieb extracts[J].Korean Journal of Food Preservation, 2014, 21(3):396-403.
[19] 庄远杯,凌梅娣, 魏爱红, 等.石韦不同极性萃取物体外降血糖活性研究[J].广西植物, 2022, 42(5):855-859.
ZHUANG Y B, LING M D, WEI A H, et al.Hypoglycemic activities of different solvent extracts from PyrrosiaLingua in vitro[J].Guihaia, 2022, 42(5):855-859.
[20] 温正辉,凌梅娣, 余思萍, 等.蒲桃不同药用部位乙醇提取物对α-葡萄糖苷酶和α-淀粉酶活性的抑制作用研究[J].中国药房, 2019, 30(23):3 246-3 251.
WEN Z H, LING M D, YU S P, et al.Study on inhibitory effects of ethanol extract of different medicinal parts from Syzygium jamboson the activities of α-glycosidase and α-amylase[J].China Pharmacy, 2019, 30(23):3 246-3 251.
[21] 许建和.生物催化工程[M].上海:华东理工大学出版社, 2008.
XU J H. Biocatalysis Engineering[M]. Shanghai: East China Universityof Science and Technology Press, 2008.
[22] 郑丽婷,周鸿, 刘奕明, 等.黄柏碱对α-葡萄糖苷酶的体外抑制作用[J].南京中医药大学学报, 2020, 36(6):853-858.
ZHENG L T, ZHOU H, LIU Y M, et al.Inhibitory effect of phellodendrine on α-glucosidase in vitro[J].Journal of Nanjing University of Traditional Chinese Medicine, 2020, 36(6):853-858.
[23] 包正宇,樊铭聪, 李言, 等.乌饭树树叶蓝黑色素对α-葡萄糖苷酶的抑制活性研究[J].食品与机械, 2021, 37(7):165-170;176.
BAO Z Y, FAN M C, LI Y, et al.Study on the α-glucosidase inhibition of the dark blue pigment from the leaves of Vaccinium bracteatumThunb[J].Food &Machinery, 2021, 37(7):165-170;176.
[24] 李美萍,侯健, 刘燕, 等.细叶韭花醇提物体外抗氧化及对α-葡萄糖苷酶抑制作用的研究[J].中国调味品, 2022, 47(2):30-34.
LI M P, HOU J, LIU Y, et al.Study on antioxidation of ethanol extract from Allium tenuissimumL.flowers in vitroand its inhibition on α-glucosidase[J].China Condiment, 2022, 47(2):30-34.