乳酸菌是一类利用可发酵性碳水化合物产生乳酸,并使发酵食品具有益生特性的一类微生物[1],其在乳制品发酵过程中也起到至关重要的作用。乳酸菌具有维持肠道内菌群平衡,刺激肠道运动,改变排便,抑制有害菌增殖,减少有害物质的产生,治疗肠道功能紊乱等益生特性[2-4]。而乳酸菌细胞数量及细胞活力是影响乳酸菌益生特性的关键因素[5]。
目前真空冷冻干燥技术是最有利于保持乳酸菌益生特性的方法[6]。真空冷冻干燥法既可以保证生产出的乳酸菌发酵剂含菌量高,又能够长期保持产品稳定性、延长产品货架期且有方便运输等特性[7]。但是在冷冻-干燥过程中,细胞长期暴露在极端环境中,会对菌体细胞结构及细胞内关键酶活性产生损伤,这些损伤会导致细胞代谢异常,降低细胞活性,严重影响细胞的正常生长[8-9]。
目前大多数研究只关注膜系统和酶系统对细胞生理损伤的影响[10-11],但冻干过程中乳酸菌的主要生理变化尚不清晰。只有阐明导致冻干乳酸菌活力低下的主要原因,才能采取针对性的保护策略,提高乳酸菌的冻干活性。有研究表明冻干样品中水分含量与乳酸菌生理状态及活性密切相关,冻干样品中的含水量越低,细胞的延滞期越长,复苏活力也呈下降趋势[12]。但是单独的含水量并不能作为衡量乳酸菌活力的主要因素,而需要进一步考虑细胞内部水分对乳酸菌活力的影响。根据冷冻过程中细胞水分分布及状态的变化,细胞损伤主要分为机械损伤和溶质损伤。前者在冷冻过程中,细胞内水形成冰晶,对细胞造成损伤;后者细胞外水结冰,细胞内水分外溢出,电解质浓缩,导致细胞脱水收缩、细胞膜渗透性增加,并且细胞内高渗透压环境会使某些功能性蛋白结构发生变化,影响细胞活力。因此细胞内水分状态变化规律可以直观反映出菌体细胞的损伤情况。但是在技术上,很难对细胞内部水分分布及状态进行确定。
低场核磁共振技术(low-field nuclear magnetic resonance,LF-NMR)是一种对水分状态非常敏感的技术,被广泛用来研究细胞内部水分分布情况[13-14]。LF-NMR利用氢原子核在磁场中的自旋弛豫特性,通过自旋-自旋弛豫时间T2的变化从微观的角度解释样品中水分的分布及迁移情况,广泛应用于食品[15]、医药[16]以及多孔材料[17]等,具有快速、准确、无侵入等优点。本研究采用LF-NMR探究乳酸菌细胞内部水分状态、分布与含量,从而为后续采取针对性的保护策略,提高乳酸菌的冻干活性提供理论依据。
1 材料与方法
1.1 材料与仪器
冻干型乳酸菌粉(嗜酸乳杆菌,活菌总数≥1.0×1010CFU/g),山东中科嘉亿生物工程有限公司,使用前置于-20 ℃冰箱内保存;碘化丙啶(propidium iodide,PI)、MnCl2,分析纯,上海阿拉丁试剂;蔗糖(分析纯),国药集团;EDTA、NaH2PO4·2H2O、Na2HPO4·12H2O,均为分析纯,西陇化工股份有限公司;羧基二乙酸荧光素琥珀酰亚胺酯(carboxyfluorescein diacetate,CFDA),分析纯,上海麦克林生化科技有限公司。
NMRC12-010V低场核磁共振仪(配MultiExp Inv Analysis software核磁共振在线分析应用软件),苏州纽迈分析仪器股份有限公司;H1850R离心机,湘仪离心机有限公司;DK-8D超级恒温循环水浴,南京学静生物科技有限公司;VARIOSKAN FLASH多功能酶标仪,美国Thermo公司。
1.2 实验方法
1.2.1 乳酸菌细胞内部水分分布
称量乳酸菌冻干粉10 g,溶于10 mL水,37 ℃水浴复水24 h,8 000 r/min离心去除保护剂,得到菌泥,再将菌体重新悬浮于1 mL水中。取1 mL菌悬液放入1.5 mL色谱瓶中,将色谱瓶放置于低场核磁测试舱体的中心位置,选用Carr-Purcell-Meiboom-Gill(CPMG)序列采集横向弛豫时间T2信息。
1.2.2 顺磁Mn2+研究细胞水分状态及水分分布
称量冻干型乳酸菌冻干粉10 g,溶于10 mL水,37 ℃水浴复水24 h,8 000 r/min离心去除保护剂,得到菌泥,再将菌泥重新悬浮于1 mL 50 mmol/L MnCl2溶液中,然后置于LF-NMR测试舱体的核心位置,选用CPMG序列,每隔30 min采用LF-NMR进行测定。
1.2.3 利用LF-NMR研究乳酸菌细胞损伤机制
1.2.3.1 渗透压冲击对细胞水分状态及水分分布的影响
高渗透压缓冲液:36%蔗糖(质量分数)、2.5 mmol/LEDTA、20 mmol/L PB(pH 7.2);低渗透压溶液:冰水。
称量乳酸菌冻干粉10 g,溶于10 mL水,37 ℃水浴复水24 h,8 000 r/min离心去除保护剂,得到菌泥,将菌泥重新悬浮于1 mL水中,得到菌悬液。将菌悬液再次离心去除上清液,加入1 mL的渗透缓冲液(高渗溶液),充分混匀后,每隔5 min采用LF-NMR进行测定,30 min后8 000 r/min离心去除高渗透溶液,随后迅速加入1 mL冰水(低渗溶液)[18],同样每隔5 min采用LF-NMR进行测定。
1.2.3.2 反复冻融对细胞水分状态及水分分布的影响
称量冻干型乳酸菌冻干粉100 g,溶于100 mL水,37 ℃水浴复水24 h,8 000 r/min离心去除保护剂,得到菌泥。随后将菌泥重新悬浮于10 mL水中,得到菌悬液。将菌悬液分装10管,每管1 ml,编号为1、2、3、4、5、6、9,7、8、9、10。把1~10号样品全部置于-20 ℃冰箱内,冷冻2 h,37 ℃融化,重复10次直至细胞完全破裂[19]。每次融化后取1管采用LF-NMR进行测定。
1.2.3.3 反复冻融对细胞完整性的影响
用CFDA和PI双荧光染色法测定冷冻对细胞完整性的影响[20]。取1 mL样品稀释至OD600 nm为0.1~0.2,然后加入200 μL CFDA溶液,混合摇匀后避光37 ℃孵育30 min,加入10 μL PI溶液,摇匀后避光室温孵育30 min。洗涤染色样品,用1 mL蒸馏水重悬细胞沉淀。将得到的细菌溶液用多功能酶标仪进行荧光强度测定。PI(红光R)激发波长为536 nm,发射波长为617 nm,CFDA(绿光G)激发波长为490 nm,发射波长为530 nm。
2 结果与分析
2.1 乳酸菌细胞水分分布情况
图1是乳酸菌细胞的横向弛豫时间(T2)的反演波谱图,每个峰对应一种水分状态。与西兰花[13]、樱桃[21]等测定结果类似,乳酸菌细胞弛豫图谱中也含有3个峰,T2在0~10 ms之间的水分为结合水,T2在10~100 ms之间的水分为半结合水,其自由度介于结合水和自由水之间,T2>100 ms的水分为自由水。乳酸菌细胞内水质子的弛豫行为与细胞结构密切相关,水质子的横向弛豫时间(T2)不同,说明水质子所处的化学环境不同,弛豫时间越短,说明水分与底物结合越紧密,弛豫时间越长,说明水分越自由[13]。将曲线上的峰从左向右依次对其弛豫时间依次命名为T21、T22、T23,且T21<T22<T23;每个峰对应的峰面积依次为A21、A22、A23,峰面积可以表示每种水组分的含量[22]。此外,可以发现细胞的横向弛豫时间分布曲线图中,在大于1 000 ms的位置有一个峰(T24>1 000 ms),对应的水分是菌悬液中的上清水,峰面积为A24。
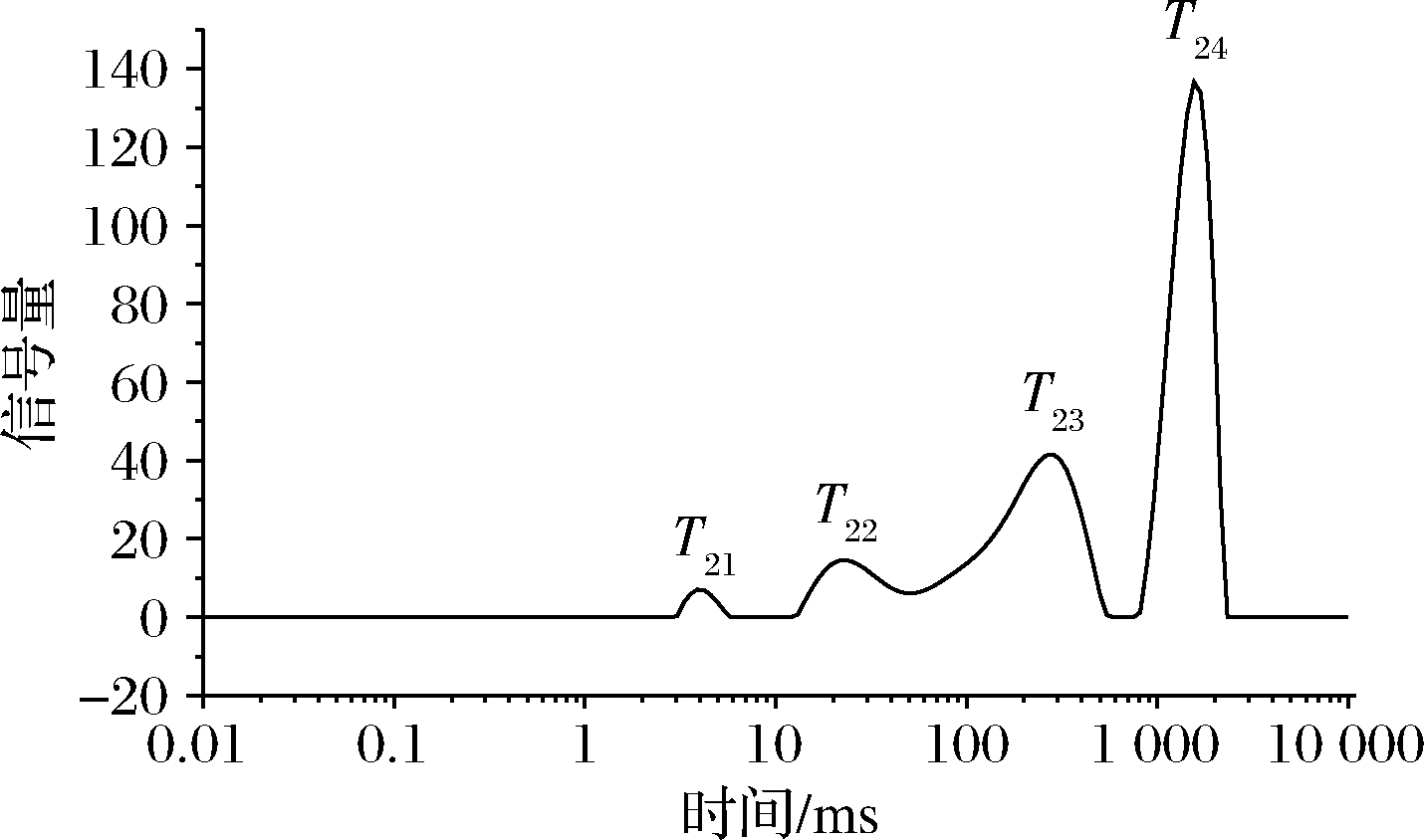
图1 乳酸菌细胞横向弛豫时间T2反演图谱
Fig.1 T2spectrum of lactic acid bacteria cells
考虑到乳酸菌细胞的组织结构,具有最长横向弛豫时间的组分(T23组分)对应于细胞间隙中的水分,具有较高的自由度。而T22组分则对应处于细胞质中较难移动的水分子,与生物大分子(如蛋白质、多糖)的相互作用较强,限制了可移动性,从而弛豫时间远小于T23组分的弛豫时间。对于T21组分,对应于细胞壁中的水分,具有最短的横向弛豫时间,是因为该部分水与细胞壁上的大分子相互作用强,限制了自由度从而可移动性最小[23]。接下来,将采用顺磁性金属离子Mn2+进一步探究乳菌细胞内部水分分布状况。
2.2 顺磁性金属离子(Mn2+)条件下细胞水分状态及水分分布
顺磁性金属离子(Mn2+)可以与水质子相互作用,生成络合物,影响水质子的弛豫速率,使得质子的核磁信号减弱。当样品浸渍于一定浓度的顺磁性金属离子(Mn2+)溶液中,Mn2+可以依次与各部分组织结构中的水质子发生络合反应,Mn2+与水质子相互作用会影响水质子的弛豫速率,使得弛豫时间减小,导致对应区域的水分含量减少,根据顺磁性Mn2+对1H质子弛豫时间及峰面积的改变,区分不同水分所处的组织结构[24]。
如图2所示,在CPMG衰减曲线中,随着浸渍时间的延长,样品从信号幅值最高点很快地下降至最低点所用的T2弛豫时间越来越短,衰减速度逐渐增加,说明水分在不断减少并与Mn2+结合形成络合物。CPMG衰减曲线只能提供物料整体的水分含量及流动性的相对变化趋势,不能给出内部水分的状态和分布状态。为了进一步了解乳酸菌细胞内水分分布情况,将CPMG信号导入核磁共振分析应用软件中反演得到T2图谱,T2图谱能够更好反映样品内部水分状态和分布情况[25]。
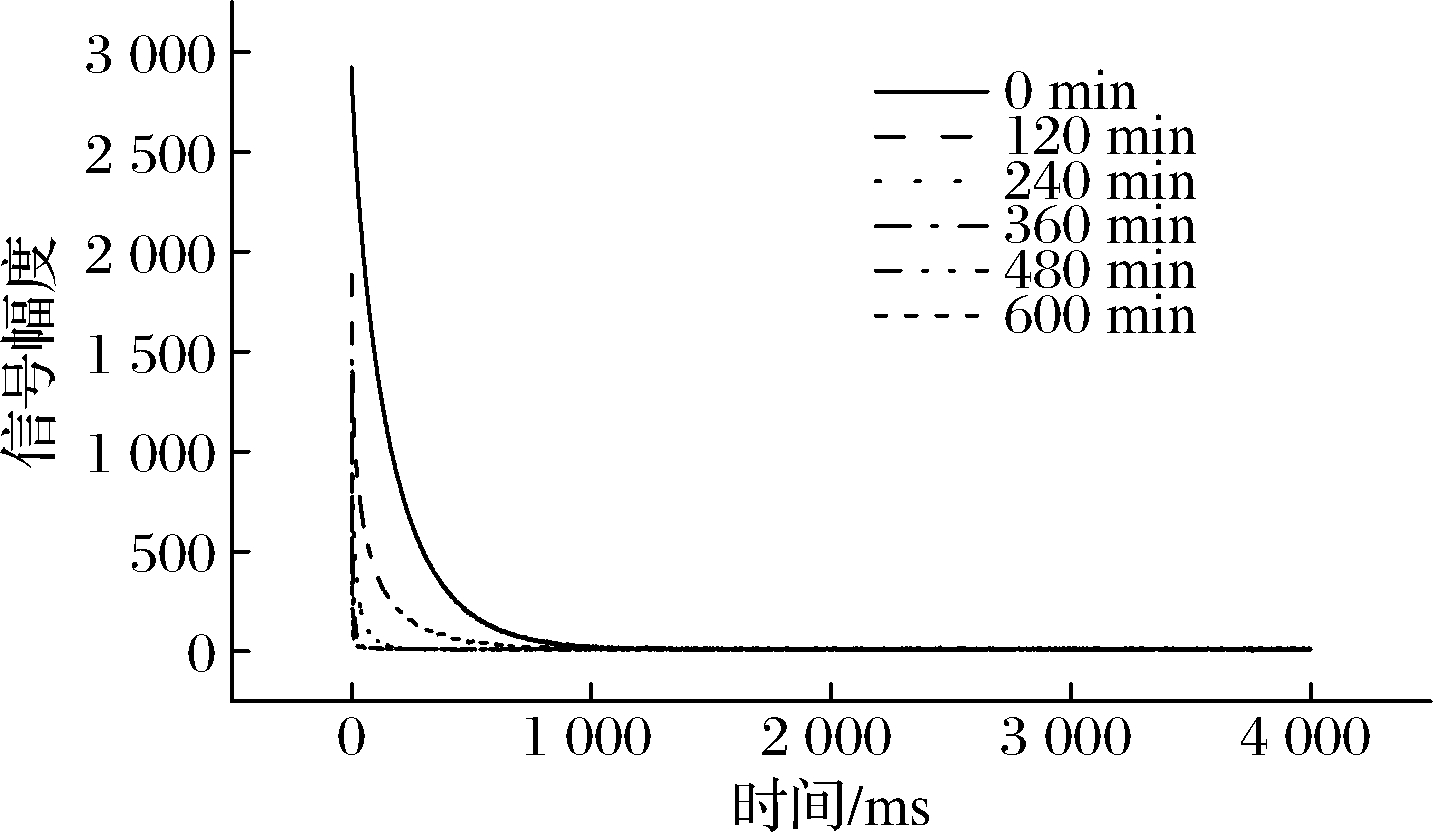
图2 乳酸菌浸渍于Mn2+溶液中不同时间 对应的CPMG信号衰减曲线
Fig.2 CPMG signal of lactic acid bacteria immersed into Mn2+solution with different times
图3是乳酸菌细胞浸渍过程中峰面积变化图,随着浸渍时间的延长,A2b峰面积逐渐增大,A2b对应的是水分子与Mn2+形成的络合物。在浸渍过程中,首先是A23在200 min后降低到最低值保持不变,说明在200 min时此部分水分最先完全与Mn2+结合,形成络合物;其次是A22,A22峰面积在前200 min内基本上没有变化,在250 min 后降低到最低值保持不变,说明此部分水分在250 min 时已经完全与Mn2+结合,形成络合物;最后是A21组分,A21组分在前200 min逐渐增加,300 min后降低,增加是由于络合物和A21组分具有较近的横向弛豫时间,络合物的信号和A21组分信号重叠[24],导致A21组分增加,减少是由于此部分水在250 min后完全与Mn2+结合,形成络合物。在乳酸菌细胞中,Mn2+首先与不受束缚的自由水,即细胞外水,形成络合物,其次与受束缚较小的半结合水,即细胞内与大分子蛋白质等结合的水分,形成络合物,最后与结合水,即与细胞结构结合的水分,形成络合物。
综上所述,在乳酸菌细胞中有3种水分分布状态,分别是结合水(T21<10 ms)对应与细胞结构紧密结合的水分,即细胞壁水;半结合水(10 ms<T22<100 ms)对应与细胞内与大分子蛋白质等结合的水分,即细胞内水;自由水(100 ms<T23<1 000 ms)对应细胞间隙中的水分。
2.3 渗透压冲击对乳酸菌细胞水分状态及分布情况的影响
图4是乳酸菌细胞浸渍在高渗透溶液中峰面积变化图。随着浸渍时间的延长,A21细胞壁水分基本上没有发生变化,说明此时的细胞结构完整,结合水可以起到支撑保护细胞结构的作用[14];A22逐渐减小,A23逐渐增大,在高渗溶液中导致细胞内水减少,细胞外水增加,分析原因是高渗透压环境导致细胞内水外渗,细胞皱缩。
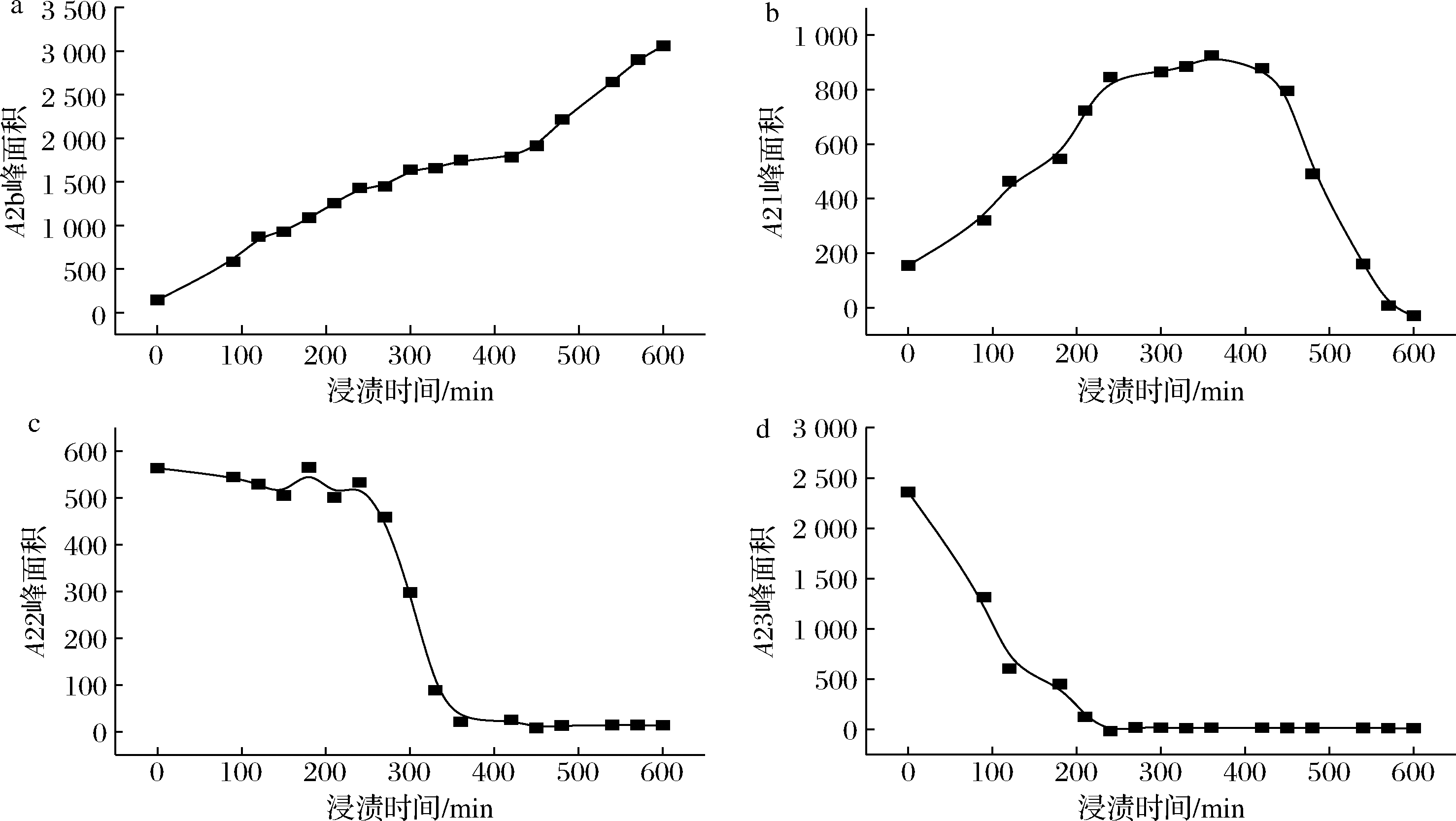
a-A2b 峰面积;b-A21 峰面积;c-A22 峰面积;d-A23峰面积
图3 乳酸菌浸渍于Mn2+溶液中不同时间对应的峰面积变化曲线
Fig.3 Peak area change of lactic acid bacteria immersed into Mn2+solution with different time

a-A21峰面积;b-A22峰面积;c-A23峰面积
图4 乳酸菌细胞浸渍在高渗透压渗透缓冲液中不同时间峰面积变化曲线
Fig.4 Peak area change of lactic acid bacteria cells immersed into high osmotic buffers with different time
图5是乳酸菌细胞在低渗溶液中峰面积变化图,可以看出在低渗溶液中A21逐渐减少,A22在0~10 min逐渐增加,10 min后逐渐减少,A23在0~10 min减少10 min后增加,说明在低渗溶液中,0~10 min A23向A22发生迁移,分析原因可能是在低渗溶液中,由于渗透压变化导致细胞外水迅速向细胞内迁移,细胞内水增加,细胞壁水和细胞间隙水减少,说明此时的细胞吸水膨胀而破裂,细胞结构遭到破坏。在浸渍10 min时乳酸菌细胞完全破裂,细胞水分的自由度增大。渗透压的变化会引起细胞水分分布发生变化,导致细胞结构受到破坏,从而造成细胞活性降低。
2.4 反复冻融对乳酸菌细胞水分分布情况及细胞损伤的影响
2.4.1 反复冻融对乳酸菌细胞水分分布情况的影响
图6是乳酸菌细胞在不同冻融次数下峰面积变化图。随着冻融次数的增加A21、A22、A23都呈逐渐降低趋势,A24呈逐渐增加趋势。A21在整个冻融过程一直呈逐渐降低的趋势,分析原因可能是在整个冷冻过程中形成的冰晶,对细胞造成机械损伤,导致细胞破裂,结构受到破环,细胞壁水分含量减少。A22在冻融1~3次一直呈降低趋势,在3次后维持恒定不变,分析原因可能是:细胞外水结冰,为维持渗透压,细胞内水向外渗出,冷冻形成的冰晶导致细胞破裂,细胞内水流出。A23在冻融第2次时逐渐降低,在第2次后维持恒定不变,分析原因是冷冻导致细胞破碎,细胞间隙变大,导致大部分的细胞间隙水向上清水发生迁移,所以A24在冻融第2次时一直呈增加趋势,在第3次后维持恒定不变,说明在反复冻融3次后菌体已经完全破裂。
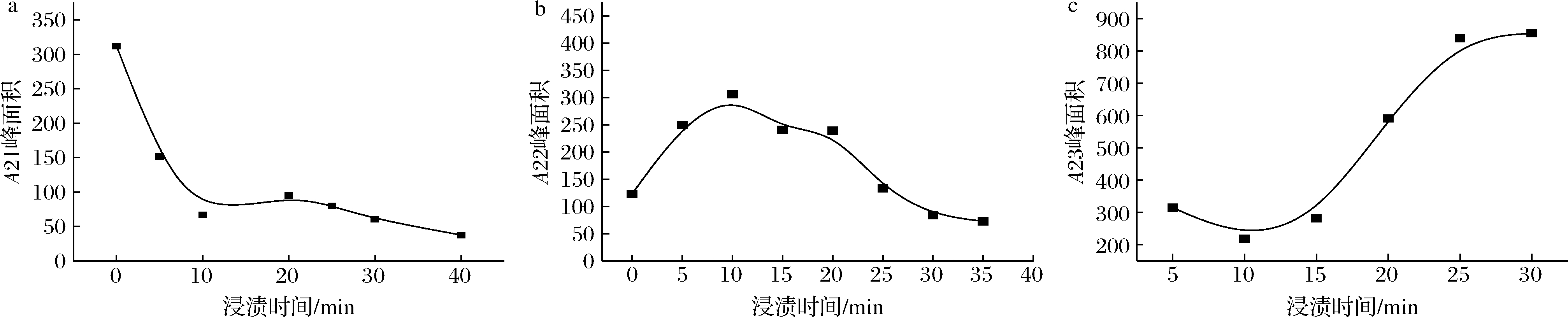
a-A21峰面积;b-A22峰面积;c-A23峰面积
图5 乳酸菌细胞浸渍在低渗透压渗透缓冲液中不同时间峰面积变化曲线
Fig.5 Peak area change of lactic acid bacteria cells immersed into low osmotic buffers with different time
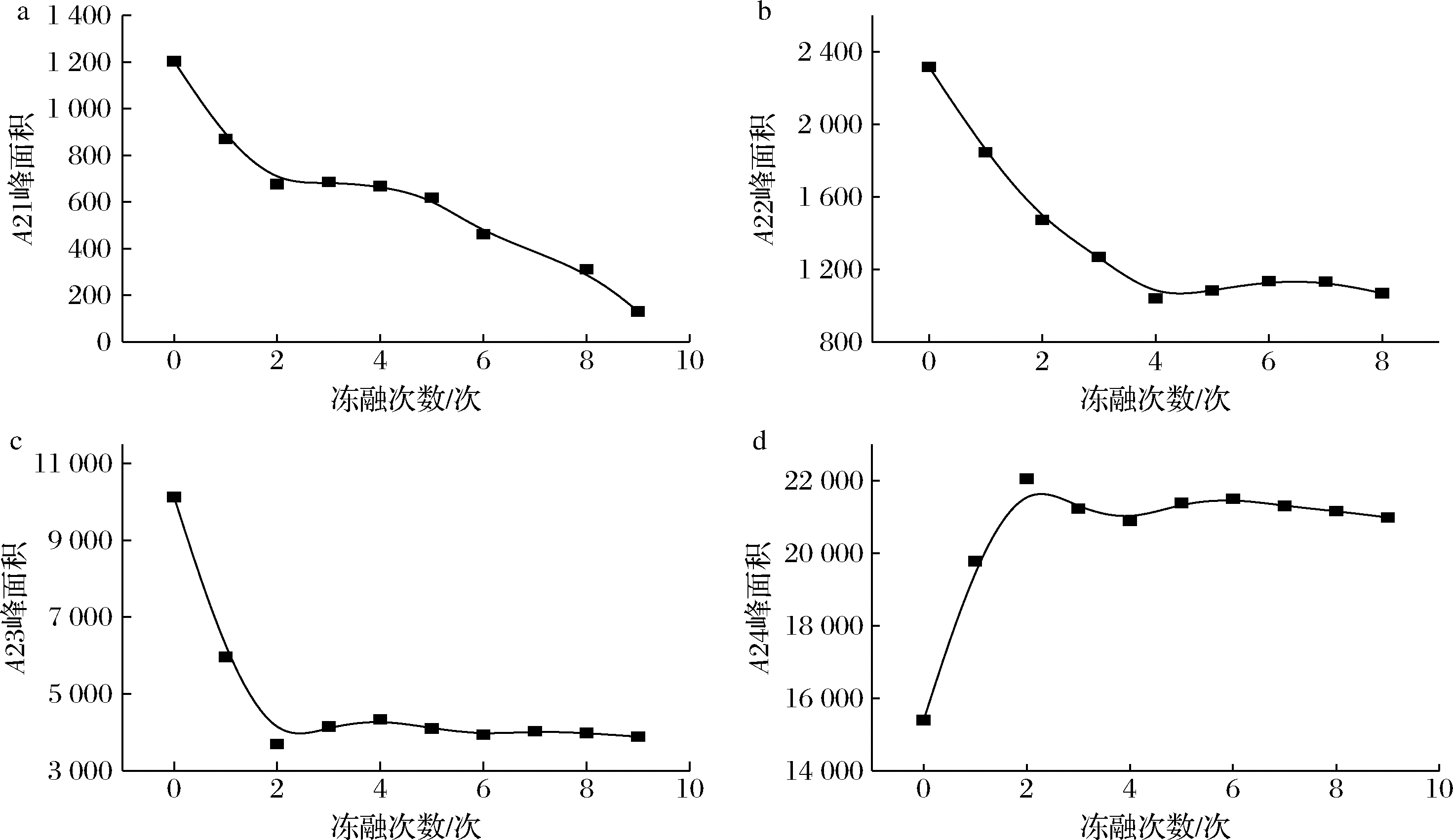
a-A21峰面积;b-A22峰面积;c-A23峰面积;d-A24峰面积
图6 乳酸菌细胞在不同冻融次数下峰面积变化曲线
Fig.6 Peak area change of lactic acid bacteria cells under different multigelation times
2.4.2 反复冻融对乳酸菌细胞损伤的影响
在冷冻过程中菌体细胞长期暴露在极端环境中会对细胞结构的完整性产生严重的损伤。采用CFDA和PI双荧光染色法,利用多功能酶标仪探究冷冻对细胞完整性的影响。
图7中是以活细胞荧光强度/死细胞荧光强度(G/R)为纵坐标,冻融次数为横坐标制备冻融过程中细胞结构完整性变化曲线。在反复冻融过程中,随着冻融次数的增加,细胞结构完整性逐渐降低,说明反复冻融对细胞结构造成破坏,影响细胞的正常生理代谢功能,最终导致细胞死亡。这与LF-NMR测定结果中细胞内外水分的变化规律相似,说明根据细胞水分规律可以用来分析细胞结构的完整性。
综上所述,反复冻融过程会对细胞结构造成破坏,细胞壁水分、细胞内水分含量减少,细胞间隙增大,细胞内某些功能性蛋白活性降低,细胞活性降低,并且这些变化与细胞内部水分状态及分布变化密切相关。
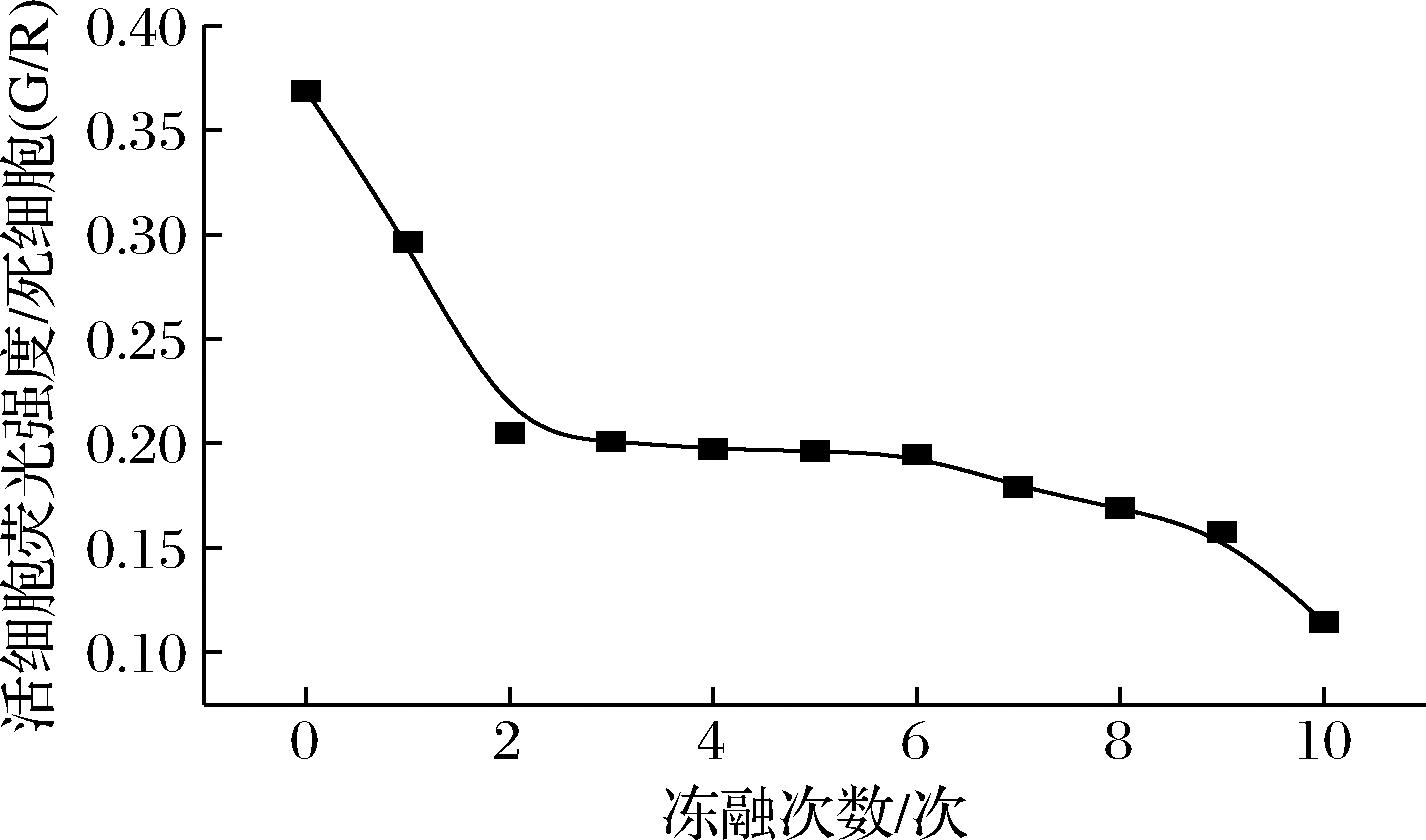
图7 乳酸菌细胞在不同冻融次数下细胞完整性变化曲线
Fig.7 Cell integrity change of lactic acid bacteria cells under different multigelation times
3 总结与讨论
本研究以乳酸菌为研究对象,利用LF-NMR,快速、准确地分析乳酸菌细胞水分状态与水分分布情况,并探究了渗透压冲击、反复冻融对细胞内部水分的影响,根据水分状态与分布的变化,分析细胞结构损伤情况。根据乳酸菌细胞中水质子的横向弛豫信息,证明了乳酸菌细胞中有3种水分状态,根据横向弛豫时间(T2)值的大小依次对应于结合水、半结合水以及自由水,且3种水分应分别处于不同的组织结构中。根据乳酸菌细胞的结构特点,结合顺磁性金属离子(Mn2+)浸渍实验结果,证明了结合水(T21<10 ms)对应于细胞壁中的水分,半结合水(10 ms<T22<100 ms)对应于细胞质中的水分,自由水(100 ms<T23<1 000 ms)对应细胞间隙中的水分。
渗透压冲击和反复冻融会对样品内的水分分布情况产生一定的影响。细胞外渗透压高,细胞内水分向细胞外渗出,细胞发生收缩,当达到平衡后,将细胞转入低渗溶液中,细胞外水迅速渗入胞内,引起细胞快速膨胀而破裂,导致细胞内水及细胞壁水含量减少,细胞外水分含量增大,水分自由度增大。在反复冻融过程中细胞内形成冰晶,对细胞结构造成损伤,当冰晶融化后,细胞结构塌陷破裂,使得细胞内水分等物质流失,另一方面是细胞外水结冰,为维持渗透压稳定,细胞内水向外渗出,细胞内电解质浓缩,导致细胞脱水、皱缩。
LF-NMR能够快速、准确地提供乳酸菌细胞内部水分分布信息,阐明细胞损伤机理,为获得高效、稳定的冻干乳酸菌发酵剂提供理论基础。
[1] SHUG W, WANG Z, CHEN L, et al.Characterization of freeze-dried Lactobacillus acidophilusin goat milk powder and tablet:Optimization of the composite cryoprotectants and evaluation of storage stability at different temperature[J].LWT, 2018, 90:70-76.
[2] GAREAUM G, SHERMAN P M, WALKER W A.Probiotics and the gut microbiota in intestinal health and disease[J].Nature Reviews Gastroenterology &Hepatology, 2010, 7(9):503-514.
[3] FANH, DU J, LIU X, et al.Effects of pentasa-combined probiotics on the microflora structure and prognosis of patients with inflammatory bowel disease[J].Turkish Journal Gastroenterology, 2019, 30(8):680-685.
[4] KOPPEL, MAFRA D, FOUQUE D.Probiotics and chronic kidney disease[J].Kidney International, 2015, 88(5):958-966.
[5] CARVALHOA S, SILVA J, HO P, et al.Relevant factors for the preparation of freeze-dried lactic acid bacteria[J].International Dairy Journal, 2004, 14(10):835-847.
[6] 程艳薇,刘春梅, 谭书明, 等.嗜酸乳杆菌菌粉的加工技术研究[J].食品科技, 2010, 35(9):46-50.
CHENG Y W, LIU C M, TAN S M, et al.The research onL.acidophilusbacteria powder processing technology[J].Food Science and Technology, 2010, 35(9):46-50.
[7] 李宝坤.乳酸杆菌冷冻干燥生理损伤机制及保护策略的研究[D].无锡:江南大学, 2011.
LI B K.Study on the physiology mechanism of cell damage caused by freeze-drying and protection strategies of Lactobacillus[D].Wuxi:Jiangnan University, 2011.
[8] WANGG Q, PU J, YU X Q, et al.Influence of freezing temperature before freeze-drying on the viability of various Lactobacillus plantarumstrains[J].Journal of Dairy Science, 2020, 103(4):3 066-3 075.
[9] MARTOSG I, MINAHK C J, FONT DE VALDEZ G, et al.Effects of protective agents on membrane fluidity of freeze-dried Lactobacillus delbrueckiissp.bulgaricus[J].Letters in Applied Microbiology, 2007, 45(3):282-288.
[10] 张英华,霍贵成, 郭鸰.冷冻干燥造成乳酸菌损伤的研究[J].食品与发酵工业, 2007, 33(1):142-146.
ZHANG Y H, HUO G C, GUO L.Study on the damage of lactic acid bacteria following freeze drying[J].Food and Fermentation Industries, 2007, 33(1):142-146.
[11] 刘振民,骆承庠.乳酸菌冷冻损伤研究[J].食品与发酵工业, 2002, 28(10):18-21.
LIU Z M, LUO C X.Studies on freezing damage of lactic acid bacteria[J].Food and Fermentation Industries, 2002, 28(10):18-21.
[12] 公丕民.保加利亚乳杆菌喷雾干燥过程中损伤机制及保护方法研究[D].哈尔滨:哈尔滨工业大学, 2019.
GONG P M.Study on damage mechanism and protection methods of Lactobacillus bulgaricusduring spray drying[D].Harbin:Harbin Institute of Technology, 2019.
[13] XUF F, JIN X, ZHANG L, et al.Investigation on water status and distribution in broccoli and the effects of drying on water status usingNMR and MRI methods[J].Food Research International, 2017, 96:191-197.
[14] 诸凯,李言洁, 王雅博, 等.蚕豆种子脱水过程中细胞层面各相态水分流动及形变特征[J].制冷学报, 2020, 41(4):144-150.
ZHU K, LI Y J, WANG Y B, et al.Water flow and deformation characteristics of cell phases in dehydration of broad bean seeds[J].Journal of Refrigeration, 2020, 41(4):144-150.
[15] 陈芳宇,陈超, 赵大伟, 等.低场核磁共振在线检测巧克力的熔化过程[J].食品工业科技, 2020, 41(23):247-252;259.
CHEN F Y, CHEN C, ZHAO D W, et al.Low-field NMR online detection of chocolate melting process[J].Science and Technology of Food Industry, 2020, 41(23):247-252;259.
[16] BRIGGSK T, TARABAN M B, YU Y B.Quality assurance at the point-of-care:Non-invasively detecting vaccine freezing variability using water proton NMR[J].Vaccine, 2020, 38(31):4 853-4 860.
[17] LIY Q, LI X N, CHEN C, et al.A rapid, non-invasive and non-destructive method for studying swelling behavior and microstructure variations of hydrogels[J].Carbohydrate Polymers, 2016, 151:1 251-1 260.
[18] 陈耀国.渗透压冲击法提取大肠杆菌周质中的人生长激素[J].齐鲁药事, 2012, 31(7):373-374.
CHEN Y G.The periplasmic release of human growth hormone by osmotic shock from Escherichia coli[J].Qilu Pharmaceutical Affairs, 2012, 31(7):373-374.
[19] 宋峰亮,田晔, 马慧慧, 等.细菌超广谱 β-内酰胺酶提取方法研究进展[J].中国微生态学杂志, 2017, 29(8):953-957.
SONG F L, TIAN Y, MA H H, et al.Extraction of ESBLs from ESBLs-producing bacteria:Research progress[J].Chinese Journal of Microecology, 2017, 29(8):953-957.
[20] WANGG Q YU X Q, LU Z S, et al.Optimal combination of multiple cryoprotectants and freezing-thawing conditions for high lactobacilli survival rate during freezing and frozen storage[J].LWT-Food Science and Technology, 2019, 99:217-223.
[21] ZHUD S, LIANG J Y, LIU H, et al.Sweet cherry softening accompanied with moisture migration and loss during low-temperature storage[J].Journal of the Science of Food and Agriculture, 2018, 98(10):3 651-3 658.
[22] 任永申,郑尧, 雷蕾, 等.低场核磁共振及成像技术分析天花粉干燥过程中水分变化规律[J].中南民族大学学报(自然科学版), 2019, 38(3):415-419.
REN Y S, ZHENG Y, LEI L, et al.Investigation on moisture transformation and transport rules during the drying process of Trichosanthes kirilowiiMaxim by low-field NMR and MRI[J].Journal of South-Central University for Nationalities (Natural Science Edition), 2019, 38(3):415-419.
[23] 阮榕生.核磁共振技术在食品和生物体系中的应用[M].北京:中国轻工业出版社, 2009.
[24] 许方方.借助核磁共振技术研究西兰花内部的水分状态与分布及热风干燥对其的影响[D].苏州:苏州大学, 2017.
XU F F.Investigation on water status and distribution in broccoli and the effects of drying on water using NMR methods[D].Suzhou:Soochow University, 2017.
[25] 盘喻颜.两种果干加工工艺研究[D].大连:大连工业大学, 2019.
PAN Y Y.Research on the processing technologies of two dried fruits[D].Dalian:Dalian Polytechnic University, 2019.