鞘氨醇单胞菌(Sphingomonas)是一种革兰氏阴性、短杆、好气性的工业用菌,所产胞外多糖通称为鞘氨醇胶(sphingans)[1]。其中,少动鞘氨醇单胞菌Sphingomonas paucimobilis ATCC 31461(旧名为Sphingomonas elodea和Pseudomonas elodea[1-2])发酵所产胞外多糖(exopolysaccharides,EPS)通称为结冷胶,具有优异的流变特性与多功能性[2-3],在食品和非食品工业应用广泛,具有高度商业价值。
少动鞘氨醇单胞菌发酵生产EPS(结冷胶),传统上多以酵母膏为氮源,蔗糖或葡萄糖为碳源,适宜的发酵条件为pH 7、30 ℃,搅拌转速200 r/min,48~72 h,取发酵上清液以乙醇或异丙醇沉淀收集并去杂,得到结冷胶初制品[4-6];结冷胶初制品经澄清化处理(0.7或0.22 μm微过滤)可获得凝胶透明的结冷胶[2,4]。结冷胶产量随培养基而异,采用传统培养基时产量为20~28.6 g/L[4-6];若氮源改为豆饼粉[7],收率降至17%;以豆饼粉和可溶性淀粉为培养基,产量为23.6 g/L[8];若采用二阶段发酵工程并添加腺苷二磷酸前体和色氨酸,则总产量可提高至43.6 g/L[4],但培养基成本偏高。近年来从食品工业副产物中寻找适合的氮源生产结冷胶成为趋势。豆粕粉具有低成本、高利用率和永续性等优点,是一种优质氮源。
少动鞘氨醇单胞菌所产EPS结冷胶的典型主干结构为:[→3)-β-D-Glc(1→4)-β-D-GlcA(1→4)-β-D-Glc(1→4)-α-L-Rha(1→]n,单糖比例为Rha∶Glc∶GlcA=1∶2∶1,其一葡萄糖上部分C2和C6基团分别衍生甘油酯基和乙酰酯基,重均分子质量约为500 kDa[1-2]。鞘氨醇单胞菌属所产EPS的单糖组成除了葡萄糖、葡萄糖醛酸和鼠李糖外,还有甘露糖、果糖、岩藻糖、半乳糖及阿拉伯糖等[9]。目前同属的少动鞘氨醇单胞菌的EPS糖组成与分子性质的多样性鲜见报道。采用工业副产物(如豆粕粉)作为培养基发酵生产结冷胶时,所得EPS可能含有非典型结冷胶结构的组分,因此有必要建立一套具有成本效益,可快速沉淀并富集其中结冷胶的处理方式。
本研究旨在研究少动鞘氨醇单胞菌在豆粕粉氮源下所产EPS的单糖组成与分子特征,并与传统氮源(酵母膏和蛋白胨)发酵得到的结冷胶和商业结冷胶进行比较,以建立有效评估结冷胶纯度的指标。同时探讨了沉淀条件(包括醇沉法、阳离子致凝胶法及复合处理)的影响,以决定较好的沉淀制备条件[7,10-12]。最后分析糖组成、分子参数及水溶性间的关系,以决定结冷胶纯度评估指标及关键的组成或分子指标,确立生产高水溶性兼具高纯度EPS的较适沉淀条件,建立具有成本效益的制备平台。
1 材料与方法
1.1 实验材料
1.1.1 菌株
少动鞘氨醇单胞菌Sphingomonas paucimobilisATCC 31461 GL-1变异株,上海食品微生物工程技术研究中心。
1.1.2 培养基
蔗糖、NaCl,阿达玛斯试剂有限公司;酵母膏、蛋白胨、牛肉膏,北京陆桥技术股份有限公司;琼脂粉,青岛高科技工业园海博生物技术有限公司;豆粕粉,北京索莱宝科技有限公司。
1.1.3 主要材料与试剂
标准品:鼠李糖(rhamnose, Rha)、阿拉伯糖(arabinose, Ara)、半乳糖(galactose, Gal)、葡萄糖(glucose, Glc)、木糖(xylose, Xyl)、甘露糖(mannose, Man)、半乳糖醛酸(galacturonic acid, GalA)、葡萄糖醛酸(glucuronic acid, GlcA)、醋酸钠,美国Sigma-Aldrich化学公司;商业结冷胶(Gellan-F),日本富士和光(Fujifilm Wako)纯药株式会社;KBr(光谱级)、三氟乙酸,上海阿拉丁生化科技股份有限公司;无水乙醇、NaOH,阿达玛斯试剂有限公司;苯酚、H2SO4、NaNO3、HCl等,上海沪试实验室器材股份有限公司。
1.1.4 仪器与设备
ML204分析天平,瑞士Mettler Toledo公司;C-MAGMS10磁力搅拌器,德国IKA公司;OSB—2100旋转蒸发仪,日本Eyela公司;SHZ-Ⅲ循环水式真空泵,上海亚荣生化仪器厂;AvantiJXN-26离心机,贝克曼库尔特(美国)股份有限公司;L5S型紫外可见分光光度计,上海仪电分析仪器有限公司;DionexTMICS-5000+离子交换色谱系统、傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FT-IR),美国Thermo Fisher Scientific公司;AligentTM1260高效分子筛色谱仪-多角度激光光散射(high performance size exclusion chromatography multiangle laser light scattering,HPSEC-MALLS),美国Wyatt Technology公司。
1.2 实验方法
1.2.1 培养方法
菌种活化。培养基配方(g/L):蔗糖10,酵母膏3,蛋白胨5,牛肉膏2,NaCl 5,琼脂20,115 ℃灭菌20 min后使用。取4 ℃保藏的斜面菌种,划线于平板培养基,置于30 ℃培养箱培养24 h。
种子培养。培养基配方(g/L):蔗糖10,酵母膏3,蛋白胨5,牛肉膏2,NaCl 5,pH 6.8~7.2,115 ℃灭菌20 min后使用。250 mL锥形瓶装液45 mL,接种量10%,200 r/min、30 ℃培养24 h。
液态摇瓶发酵培养。培养基配方(g/L):蔗糖30,豆粕粉6,K2HPO41,KH2PO41.5,MgSO40.6,pH 6.5~7.2,115 ℃灭菌20 min后使用。250 mL锥形瓶装液45 mL,接种量10%,200 r/min、30 ℃培养48 h。
5 L发酵罐培养。培养基配方(g/L):蔗糖30,豆粕粉6或10 (或酵母膏5或蛋白胨5),K2HPO41,KH2PO41.5,MgSO40.6,pH 6.5~7.2,115 ℃灭菌20 min后使用。装液量3 L,接种量10%,通气量1.0 vvm,200 r/min、30 ℃培养48 h。定期取样测定600 nm下的吸光值(A600),观察菌的生长曲线。
1.2.2 EPS制备
发酵罐培养终止后,发酵液经8 000 r/min离心20 min去除菌体沉淀物,取上清液,60 ℃下真空旋转蒸发浓缩至原体积的1/3,加入3倍体积95%乙醇醇沉[7],4 ℃静置过夜,8 000 r/min离心20 min提取沉淀,真空干燥。对胞外多糖粗制备物进行透析纯化,先将其溶解于去离子水,90 ℃水浴加热30 min,冷却后以去离子水透析(截留分子质量8 k~14 kDa)2~3 d,每4 h换1次水,8 000 r/min离心20 min去除絮状物,冻干,所得样品称质量,按公式(1)计算产量,实验重复3次。
产量/(g·L-1)=干燥后粗制备物质量(g)/发酵液体积(L)
(1)
1.2.3 金属离子沉淀方法
发酵罐终止培养后,8 000 r/min离心20 min去除发酵液中菌体沉淀物,取上清液,60 ℃下真空旋蒸浓缩至约1/3体积,分别加入乙醇醇沉、K+、K++乙醇沉淀、Ca2+和Ca2++乙醇沉淀,4 ℃静置过夜,8 000 r/min离心20 min取沉淀,真空干燥。K+和Ca2+的浓度分别为175和5 mmol/L时,为预备试验所发现最大EPS产量的离子浓度。所得胞外多糖的粗制备物进行透析纯化(条件同1.2.2),8 000 r/min离心20 min去除絮状物,冻干,根据醇沉和所采用的离子处理所得EPS命名为EPS-Et、EPS-K、EPS-KEt、EPS-Ca和EPS-CaEt。
1.2.4 总糖含量测定
采用苯酚-硫酸法测定总糖含量[13],根据得到的EPS单糖组成含量,使用的混糖标准品为Rha∶Glc∶GlcA,其摩尔比为2∶3∶4(质量比0.38∶0.69∶1)。称取10 mg混糖标准品,去离子水定容至10 mL容量瓶得标准液,并将标准液稀释成质量浓度为0.1 mg/mL标准液。称取5 mg样品溶于10 mL蒸馏水,经90 ℃加热30 min以完全溶解并冷却。取0.2 mL样品溶液于试管中,加入0.5 mL 3%(体积分数)苯酚溶液,混合均匀后迅速加入5 mL浓H2SO4溶液,再次混合均匀。在室温下反应30 min后于490 nm处测定吸光度。以混糖标准品质量浓度X(mg/mL)为横坐标,吸光度值Y为纵坐标,绘制标准曲线,计算后获得回归方程Y=4.580 3X+0.000 2(R2=0.999)。将样品的吸光度值代入其回归方程中,求出样品的可溶性总糖浓度,其中0.9为EPS中脱水单糖残基分子质量/标准物单糖分子质量比值。平行测定3次。样品可溶性总糖质量浓度按公式(2)计算:
总糖含量![]()
(2)
由总糖含量进一步计算碳源转化效率[14],碳源转化率按公式(3)计算:
碳源转化率![]()
(3)
1.2.5 蛋白质含量测定
蛋白质含量测定采用考马斯亮蓝法[15]。配制0.5 mg/mL牛血清白蛋白(bovine serum albumin, BSA)分别移取0、0.1、0.2、0.4、0.6、0.8、1.0 mL于试管中,加入去离子水至1 mL。同时分别称取样品1 mg,溶于1 mL蒸馏水,经90 ℃加热30 min以完全溶解并冷却后,将1 mL 1 mg/mL样品溶液移入试管中,再加入5 mL考马斯亮蓝G250溶液,摇匀,静置20 min。以去离子水为空白对照,在595 nm处测定吸光度值。以标准品的质量浓度X(mg/mL)为横坐标,吸光度值Y为纵坐标,绘制标准曲线,计算后获得回归方程Y=2.535X+0.035 5(R2=0.994)。将样品的吸光度值代入其回归方程中,样品中总蛋白质含量按公式(4)计算:
总蛋白质含量![]()
(4)
1.2.6 乙酰基含量测定
根据秦方等[16]的方法,准确称取EPS样品0.1 g于锥形瓶中,加水50 mL使其溶解,加入5滴酚酞指示剂,用0.1 mol/L NaOH溶液滴定至粉红色刚好不褪色为止;再准确加入25 mL 0.5 mol/L NaOH溶液,经60 ℃加热振荡20 min后,用0.3 mol/L HCl标准溶液滴定体系中过量的碱直至粉红色刚好褪去,记录所用HCl溶液的体积V0(mL);再用0.3 mol/L HCl溶液标定0.5 mol/L NaOH溶液作空白,记下所用HCl溶液的体积V1(mL)。样品中乙酰基含量按公式(5)计算:
乙酰基含量![]()
(5)
式中:c,HCl溶液的浓度,mol/L;m,样品质量,g;43,乙酰基团的分子质量,g/mol;0.001,体积转换,L/mL。
1.2.7 单糖组成测定
称取EPS样品10 mg,加入2 mL超纯水,90 ℃下加热搅拌30 min,使样品充分溶解,再加入2 mL 0.4 mol/L三氟乙酸溶液,密封后于110 ℃油浴2 h,使其充分水解。取出冷却至室温后用氮吹仪吹干,并反复3次加入甲醇至吹干,最后加入2 mL超纯水溶解水解物,稀释100倍,经0.22 μm微孔膜过滤后,进行高效阴离子交换色谱分析。采用Thermo ICS-5000+高效阴离子交换色谱串联脉冲安培检测器(high-performance anion-exchange chromatography/pulsed amperometric detection,HPAEC-PAD)分析样品的单糖组成,色谱柱为串连保护管柱(3 mm×30 mm)的CarboPacTMPA20(3 mm×150 mm),进样量为25 μL。洗脱条件:流动相A超纯水,流动相B 10 mmol/LNaOH,流动相C 1 mol/L NaAc和流动相D 200 mmol/LNaOH,洗脱程序:0 min,A 90% B 10%;20 min,A 90% B 10%;20.1 min,A 85% B 10% C 5%;30 min,A 70% B 10% C 20%;采线性梯度混合模式。流速0.5 mL/min;管柱温度30 ℃。采用Chromeleon 7软件进行数据采集、处理和分析。
1.2.8 分子质量及相关参数的测定
配制0.25 mg/mL的EPS样品溶液,加热溶解于0.1 mol/L NaNO3,经0.22 μm微孔过滤膜过滤后,进行HPSEC-MALLS分析。设备为AligentTM1260 Infinity II LC,串联3个检测器:MALLS、黏度检测器(DP)和示差折射检测器(refractive index detector, RI);串联SB-805 HQ和SB-803 HQ(8 mm×300 mm)两支色谱柱;流动相为0.1 mol/L NaNO3水溶液,流速0.6 mL/min,管柱温度40 ℃;进样量100 μL,跑样时间80 min。折射率增量(dn/dc)设置为0.145 mL/g。采用ASTRA 7.1.3软件进行数据采集、处理和分析,所得分子性质参数包括数均分子质量(Mn)、重均分子质量(Mw)、多分散性PI、固有黏度[η]、马克-霍温-樱田(MHS)关系式([η]=K×Mwa)指数a值、环动半径(Rg)以及水合动态半径(Rh)等。另计算非均向性构型参数ρ[17]。3次平行测定。
1.2.9 紫外全波长扫描
配制1 mg/mL的EPS溶液,90 ℃加热30 min,充分溶解后冷却,立刻使用L5S型紫外分光光度计在200~400 nm内进行全波长扫描。
1.2.10 FT-IR扫描
采用KBr压片法,分别将1 mg EPS粉末与100 mgKBr置于玛瑙研钵中研磨压片制成直径7 mm的薄片,使用傅里叶红外光谱仪对其进行测试,以空气作为背景,扫描范围:4 000~400 cm-1;扫描次数:64次;分辨率:16 s-1,使用OMNIC进行数据采集和图谱分析。
1.2.11 热水溶解动力学测定
称取EPS样品各0.1 g,加入10 mL纯水,于90 ℃条件下加热搅拌,持续观察溶解情况,每10 min取样一次直至完全溶解,苯酚-硫酸法进行总糖含量测定(公式2)。3次平行测定。假设EPS在90 ℃热水中的溶解动力学为一级反应模型[18],即溶解物的生成速率为未溶物浓度的一次函数,如方程式(6)所示,其中Cs,t和Cins,t分別为时间点t的已溶物和未溶物的浓度;ks1为溶解一级反应速率常数(h-1)。经对时间积分后重新整理可得方程式(7),其中C0和Ct分別为时间点0和t(h)的溶解物的浓度。因溶解度与溶解物浓度呈正比,如式(8)所示,其中S0和St分別为时间点0和t (h)的溶解度。将ln[(St-S0)/S0]对t作图可得斜率ks1(h-1)。采用3次平行测定的平均数据进行动力学分析,以减少操作误差。
![]() =ks1·Cins,t
=ks1·Cins,t
(6)
(7)
(8)
1.3 数据分析
实验数据皆以平均值±标准差表示。显著性差异分析用SPSS 21.0软件通过Duncan法进行多重比较确定,并在P<0.05时表示具有显著性差异或进行独立样本T检验显著性差异分析。以Origin Pro 2021b绘图,SIMCA 14.1软件进行主成分分析(pricipal component analysis,PCA)。
2 结果与讨论
2.1 豆粕粉氮源对菌株发酵生长曲线和EPS产量的影响
首先探讨少动鞘氨醇单胞菌在豆粕粉为氮源下发酵生长与生产EPS的情况,并与传统氮源(酵母膏、蛋白胨)作比较。观察该菌株的生长曲线,如电子增强出版附图1-a所示(https://doi.org/10.13995/j.cnki.11-1802/ts.032628),该菌在发酵培养基中生长的对数增长期为2~22 h,22 h后生长开始趋缓,直到48 h时趋于稳定期,豆粕粉(Sw)发酵的菌生长量(A600)和蛋白胨(Pe)的相似,说明成本较低的豆粕粉被该菌利用发酵的情形良好如蛋白胨;22 h后酵母膏(Ye)发酵的菌生长量高于Pe和Sw两组。进一步探讨豆粕粉浓度对发酵生产EPS产量的影响(电子增强附图1-b),豆粕粉质量分数为1%时EPS产量最高(31.1 g/L),高于质量分数0.6%时的产量(28.0 g/L);更高的豆粕粉质量分数(2%~5%)会导致EPS产量大为降低。综上,故选择1%豆粕粉作为氮源进行后续发酵实验。
2.2 氮源与沉淀处理对EPS产量与大致化学组成的影响
表1显示不同氮源和沉淀处理对少动鞘氨醇单胞菌EPS的产量、大致组成及碳源转化率的影响。氮源方面,同样乙醇沉淀得的EPS-Ye、EPS-Pe和EPS-Sw(即EPS-Et),EPS-Sw的产量(29.1 g/L)、可溶性总糖含量(80%)、乙酰基含量(4.00%)和碳源转化率(77.5%)皆显著高于EPS-Ye和EPS-Pe,蛋白质含量显著低于二者。比较5种沉淀处理得的EPS制备物,发现产量为EPS-CaEt>EPS-Et、EPS-KEt>EPS-K>EPS-Ca。复合处理(K+或Ca2+促凝胶法加上乙醇沉淀法)得的EPS制备物的产量(28.3~33.7 g/L)均高于单独乙醇沉淀的(EPS-Et,29.1 g/L)和单独金属离子促凝胶者,后者又以EPS-K显著高于EPS-Ca。不同沉淀制备物的可溶性总糖含量为74.4%~88.7%,类似产量的排序;总蛋白质含量为0.28%~4.50%(EPS-Ca最高),但样品之间的差异很小;乙酰基含量为3.23%~5.46%。相较于EPS-Ye和EPS-Pe,EPS-Sw制备物的大致化学组成近似商业结冷胶Gellan-F。上述EPS样品的乙酰基含量与可溶性总糖含量呈正相关(y=0.058x-0.441,R2=0.697,其中x=总糖含量,y=乙酰基含量)。综上,相较于EPS-Ye和EPS-Pe,EPS-Sw(EPS-Et)具有显著较高的产量、多糖纯度、乙酰基含量和碳源转化率。EPS-Sw以不同沉淀条件得的EPS制备物中,5 mmol/LCa2+加乙醇沉淀的复合处理可以促进自发酵液中沉淀最多的EPS产量,可作为后续快速收集EPS的综合处理方法。EPS-Sw(EPS-Et)的高碳源转化率可能与豆粕粉中潜在的可溶性大豆多糖有关,仍须进一步研究厘清真正的碳源转化率。
表1 不同氮源与沉淀处理对少动鞘氨醇单胞菌EPS产量、大致组成与碳源转化率的影响
Table 1 Effects of nitrogen sources and precipitation treatments on S.paucimobilis EPS yield, approxicate compositions, and carbon conversion efficiency
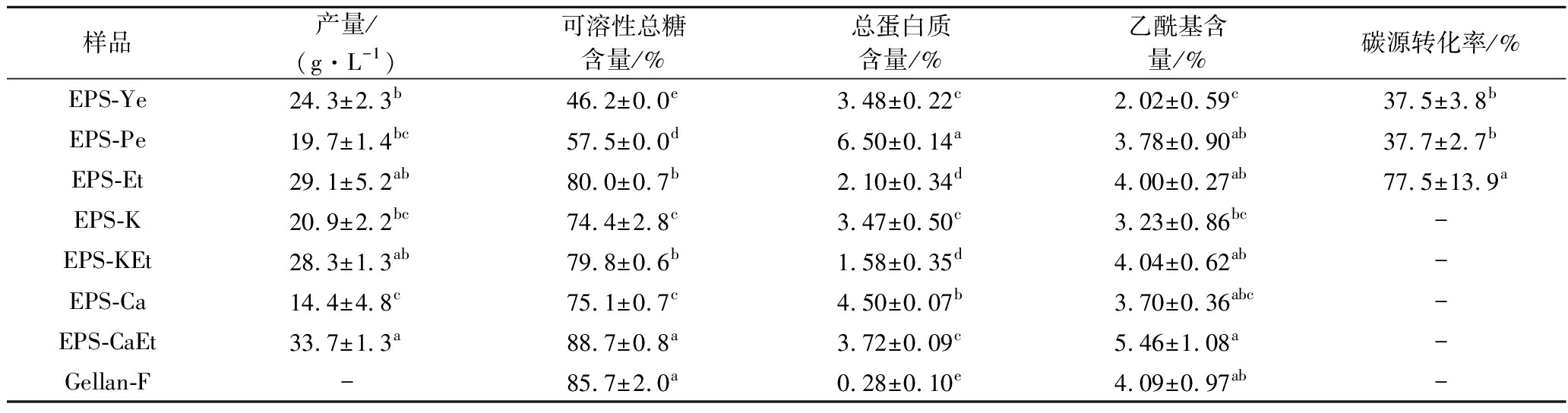
样品产量/(g·L-1)可溶性总糖含量/%总蛋白质含量/%乙酰基含量/%碳源转化率/%EPS-Ye24.3±2.3b46.2±0.0e3.48±0.22c2.02±0.59c37.5±3.8bEPS-Pe19.7±1.4bc57.5±0.0d6.50±0.14a3.78±0.90ab37.7±2.7bEPS-Et29.1±5.2ab80.0±0.7b2.10±0.34d4.00±0.27ab77.5±13.9aEPS-K20.9±2.2bc74.4±2.8c3.47±0.50c3.23±0.86bc-EPS-KEt28.3±1.3ab79.8±0.6b1.58±0.35d4.04±0.62ab-EPS-Ca14.4±4.8c75.1±0.7c4.50±0.07b3.70±0.36abc-EPS-CaEt33.7±1.3a88.7±0.8a3.72±0.09c5.46±1.08a-Gellan-F-85.7±2.0a0.28±0.10e4.09±0.97ab-
注:同一列数据上标不同字母代表数据有显著性差异(P<0.05)(下同)
针对少动鞘氨醇单胞菌ATCC 31461,本研究发现以豆粕粉氮源+蔗糖碳源、乙醇沉淀收集所得的EPS(结冷胶)产量(29~34 g/L)明显高于非豆粕粉氮源的结冷胶产量,包括酵母膏+葡萄糖发酵的产量(28.6 g/L)[4];酵母膏和蛋白胨+蔗糖(16.8 g/L)[5];玉米浆和尿素+葡萄糖(16.7 g/L)[19];酵母膏+葡萄粕发酵的(12.1 g/L)[10];以及酵母膏+糖化米麸发酵的(12 g/L)[20]。本研究上述结果也高于该菌ATCC31461的变异株FJAT-5627以豆饼粉+蔗糖发酵的结冷胶产量(23.9 g/L)[8];变异株QHZJUJW CGMCC2428以蛋白胨+蔗糖优化条件下发酵的(19.9 g/L)[6];以及新菌株S.azotifigens GL-1以黑糖蜜发酵的(14.8 g/L)[21]。但本研究采用Ca2+加乙醇复合沉淀法收集的EPS产量(33.7 g/L)与S.azotifigens GL-1-乳清发酵体系的产量(33.8 g/L)[21]相当高,具有商业应用的潜力。
2.3 EPS的单糖组成
商业结冷胶及各种EPS制备物的单糖组成色谱图如电子增强出版附图2所示,各样品测得单糖组成结果见表2。EPS-Ye和EPS-Pe含有摩尔百分比12.44%~14.11% Glc、15.99%~18.12% Rha、36.89%~41.87% GalA、28.61%~30.81% GlcA。如表3所示,Rha∶Glc∶GlcA∶GalA=1∶0.8∶(1.7~1.8)∶(2.0~2.6)。EPS-Ye含较多的GalA,而EPS-Pe有较多的Glc、Rha和GlcA。EPS-Sw(EPS-Et)含有16.96% Ara、15.79% Gal、9.97% Glc、10.64% Rha、18.16% GalA以及24.03% GlcA, Rha∶Glc∶GlcA∶GalA=1∶0.9∶2.3∶1.7,其他Ara∶Gal=1.6∶1.5。EPS-Sw的金属离子沉淀得的制备物主要单糖组成为13.18%~16.65% Ara、6.75%~18.84% Gal、10.42%~16.52% Glc、8.68%~12.52% Rha、18.17%~23.42% GalA以及21.42%~25.95% GlcA;Rha∶Glc∶GlcA∶GalA=(1∶0.8∶2.1∶1.9)~(1∶1.9∶2.5∶2.1),Ara∶Gal=(1.3∶0.5)~(1.5∶2.2),整体上近似EPS-Et的单糖组成。Gellan-F含有22.34% Glc、21.40% Rha、17.87% GalA及37.09% GlcA;Rha∶Glc∶GlcA∶GalA=1∶1∶1.7∶0.8。结冷胶的相对纯度以代表性结冷胶(EPS-Ye、EPS-Pe和商业结冷胶Gellan-F)的主要单糖百分比总和(=Glc%+Rha%+GlcA%+GalA%)表示,其相对纯度高达98.7%~100%(表3)。而EPS-Sw及其金属离子沉淀制备物的相对纯度为62.8%~72.3%。以绝对纯度(=Glc%+Rha%+GlcA%,以结冷胶典型结构的主要单糖组成为基准)观之,EPS-Ye与EPS-Pe的绝对纯度为57.0%~63.1%,EPS-Sw及其制备物为44.6%~50.6%,而Gellan-F为80.8%(表3)。
表2 氮源与沉淀处理对少动鞘氨醇单胞菌EPS的单糖组成的影响
Table 2 Effects of nitrogen sources and precipitation treatments on the monosaccharide compositions of S.paucimobilisEPS samples
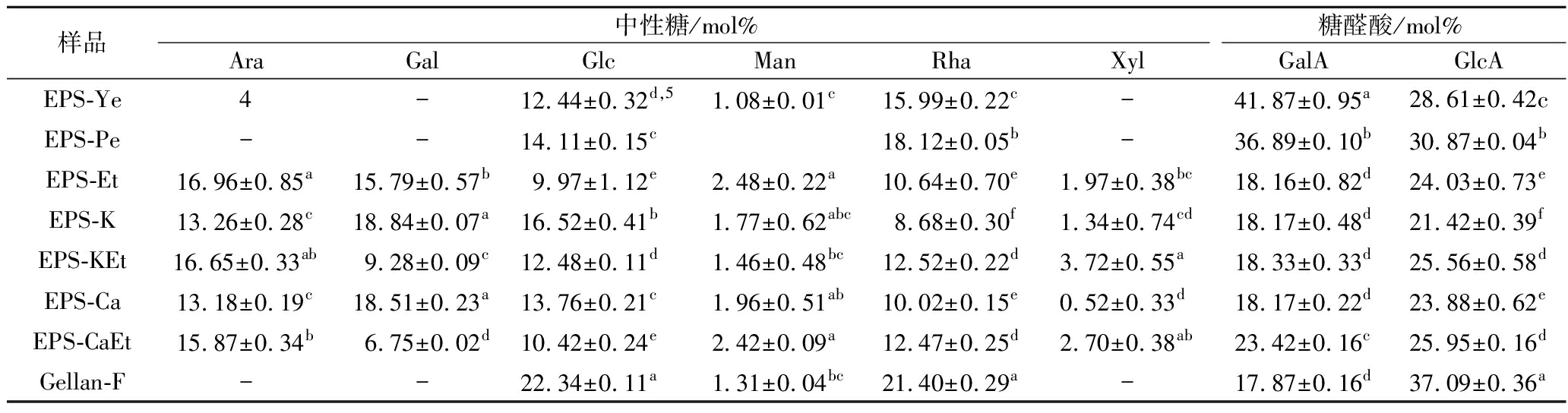
样品中性糖/mol%糖醛酸/mol%AraGalGlcManRhaXylGalAGlcAEPS-Ye4-12.44±0.32d,51.08±0.01c15.99±0.22c-41.87±0.95a28.61±0.42cEPS-Pe--14.11±0.15c18.12±0.05b-36.89±0.10b30.87±0.04bEPS-Et16.96±0.85a15.79±0.57b9.97±1.12e2.48±0.22a10.64±0.70e1.97±0.38bc18.16±0.82d24.03±0.73eEPS-K13.26±0.28c18.84±0.07a16.52±0.41b1.77±0.62abc8.68±0.30f1.34±0.74cd18.17±0.48d21.42±0.39fEPS-KEt16.65±0.33ab9.28±0.09c12.48±0.11d1.46±0.48bc12.52±0.22d3.72±0.55a18.33±0.33d25.56±0.58dEPS-Ca13.18±0.19c18.51±0.23a13.76±0.21c1.96±0.51ab10.02±0.15e0.52±0.33d18.17±0.22d23.88±0.62eEPS-CaEt15.87±0.34b6.75±0.02d10.42±0.24e2.42±0.09a12.47±0.25d2.70±0.38ab23.42±0.16c25.95±0.16dGellan-F--22.34±0.11a1.31±0.04bc21.40±0.29a-17.87±0.16d37.09±0.36a
注:-表示未测得
表3 氮源与沉淀处理对少动鞘氨醇单胞菌EPS的 糖比例与纯度的影响
Table 3 Effects of nitrogen sources and precipitation treatments on the monosaccharide ratio and purities of S.paucimobilis EPS samples
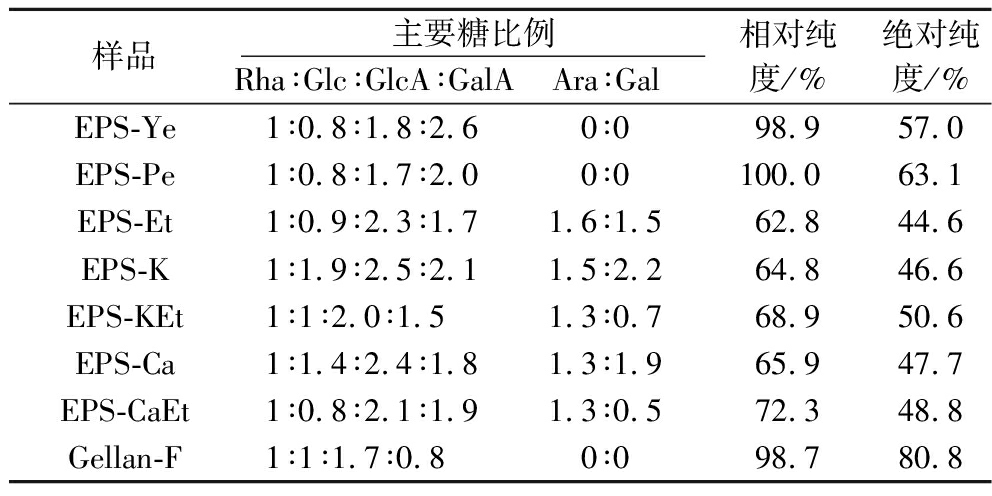
样品主要糖比例Rha∶Glc∶GlcA∶GalAAra∶Gal相对纯度/%绝对纯度/%EPS-Ye1∶0.8∶1.8∶2.60∶098.957.0EPS-Pe1∶0.8∶1.7∶2.00∶0100.063.1EPS-Et1∶0.9∶2.3∶1.71.6∶1.562.844.6EPS-K1∶1.9∶2.5∶2.11.5∶2.264.846.6EPS-KEt1∶1∶2.0∶1.51.3∶0.768.950.6EPS-Ca1∶1.4∶2.4∶1.81.3∶1.965.947.7EPS-CaEt1∶0.8∶2.1∶1.91.3∶0.572.348.8Gellan-F1∶1∶1.7∶0.80∶098.780.8
注:相对纯度=结冷胶的代表性的主要单糖组成的百分比总和=Glc%+Rha%+GlcA%+GalA%(以EPS-Ye、EPS-Pe和Gellan-F的主要单糖为基准);绝对纯度=Glc%+Rha%+GlcA%(以典型结构的结冷胶的主要糖组成为基准)
综上,EPS-Sw的糖醛酸以GlcA为主,但主要单糖组成较复杂,额外含有Ara和Gal(各16%左右)。EPS-Ye和EPS-Pe的结冷胶绝对纯度为Gellan-F的70%~78%,而EPS-Sw(EPS-Et)为Gellan-F的55%。K+和Ca2+复合乙醇的沉淀处理可提高EPS-Sw制备物中结冷胶相对纯度,且CaEt的效果高于KEt的。
本研究所探讨的EPS中,凡乙醇沉淀的EPS样品的Glc∶Rha=0.8~1.2,接近商业结冷胶Gellan-F(Glc∶Rha=1);单纯以K+或Ca2+促凝胶沉淀的样品的Glc∶Rha比会提高到1.4~1.9,较接近其他商业结冷胶(包括Gelrite®)的比例(1.5~2.1)[10]以及典型结构的比例(Rha∶Glc∶GlcA=1∶2∶1)[10]。本研究乙醇沉淀得的EPS皆含有较低的Glc∶Rha比例、明显较高的糖醛酸比例[(GlcA+GalA)∶Rha=3.5~4.4]。此外,ATCC 31461以酵母膏加葡萄粕发酵得的结冷胶(Rha∶Glc∶GlcA∶Fru= 1∶4.7∶1.7∶1.5)具有明显高的Glc∶Rha比例和额外的果糖组成[10]。
2.4 EPS分子特征
2.4.1 EPS分子质量分布色谱图
图1为该菌EPS及其制备物的分子质量分布色谱图。从折射指标(RI,与质量浓度有关)和光散(LS,与质量浓度和分子粒径两因素有关)的信号观之,EPS-Ye(图1-a)、EPS-Pe(图1-b)和Gellan-F(图1-d)图谱相似,含有3个分子区分:F1(17~25 min)、F2(25~28.5 min)及F3(28.5~35 min);而EPS-Sw(图1-c)主要含有F2(18.5~27.5 min)和F3(27.5~35 min),F1(16.5~18.5 min)量少仅小肩峰。上述样品的logMw与冲提时间的线性关系(图1-e)显示,EPS-Ye,EPS-Pe和Gellan-F大致遵循同一线性关系式:y=-0.158x+8.925,R2=0.969);而EPS-Sw的线性关系(y=-0.163x+9.262,R2=0.971)呈相似斜率但较高的截距,显示EPS-Sw分子构型较紧密,故在相同流析时间下分子质量较其他三者大。
根据上述关系式估计可知,EPS-Ye、EPS-Pe和Gellan-F的F1的Mw为94~1 700 kDa、F2 Mw30~94 kDa及F3 Mw2.5~30 kDa;而EPS-Sw的F1 Mw1 700~3 700 kDa、Mw60~1 700 kDa及F3 Mw3.6~60 kDa,区分物分子质量范围比前3种样品的大一倍左右。在金属离子促凝胶得的制备物方面,EPS-K(图1-f)和EPS-Ca(图1-h)分子质量分布极相近,根据图1-e可知其F2 Mw60 ~1 000 kDa,F3 Mw3.6~60 kDa,F3尖峰高度约F2的2.5倍。相较于无乙醇的处理组(EPS-K和EPS-Ca),复合乙醇沉淀处理组(EPS-KEt和EPS-CaEt)(图1-g和1-i)的F2在25~27 min的中分子组分相对量明显提高,且EPS-CaEt在30~35 min的小分子组分(Mw3.6~24 kDa)明显增加并新增34 min(Mw5 kDa)小尖峰。综上,HPSEC图谱显示,EPS-Ye、EPS-Pe和Gellan-F明显含有三区分和显著量的超大分子区分(F1,Mw>1 000 kDa),而EPS-Sw和其相关的制备物富含F2和F3,较少超大分子区分。

a-EPS-Ye;b-EPS-Pe;c-EPS-Sw (EPS-Et);d- Gellan-F;e-log Mw-流析时间关系;f-EPS-K;g-EPS-KEt;h-EPS-Ca;i-EPS-CaEt
图1 少动鞘氨醇单胞菌EPS样品分子质量分布的HPSEC色谱图
Fig.1 HPSEC chromatograms for molecular weight distributions of S.paucimobilis EPS samples
2.4.2 EPS分子特征与构型参数
电子增强出版附表1显示所得EPS与其区分物的分子特征,包括分子质量参数、固有黏度、MHS参数及粒径参数等。EPS-Sw(即EPS-Et)整体重均分子质量Mw=417.7 kDa,固有黏度([η])=391.3 mL/g,MHS构型参数a=1.01,环动半径Rg=51.5 nm,水合动态半径Rh=23.29 nm,非均向性构型参数ρ (=Rg/Rh)=2.22;其F1仅占6.2%,Mw高达4 060 kDa;F2占51.7%,Mw=271.5 kDa,Rg=40.5 nm及ρ=1.82;而F3占42.1%,Mw=39.7 kDa,Rg=41.6 nm及ρ=7.89。和EPS-Ye与EPS-Pe相比,EPS-Sw整体上具有较大Mw、最小的[η]、Rg及ρ。
电子增强出版附表2显示EPS-Sw经4种金属离子促凝胶沉淀制备物的F2和F3组成的分子特征,归纳可知金属离子处理(包括单纯和复合乙醇沉淀处理)组具有明显较低的Mw和Rg、但ρ值不变。
本研究所得EPS-Sw(EPS-Et)整体Mw(418 kDa)(电子版附表1)接近某一商业结冷胶的Mw(500 kDa左右)[1]以及联合国粮农组织/世界卫生组织食品添加剂专家委员会(Joint FAO/WHO expert committee on food additives, JECFA)所建议的食品添加物用途的结冷胶分子质量(500 kDa左右)[JECFA, Gellan Gum (INS No.418)],但略低于以酵母提取物+葡萄粕发酵得的结冷胶分子质量(688 kDa)[10]。已知商业来源的结冷胶分子质量在200~300 kDa(低乙酰基)、1 000~2 000 kDa(高乙酰基)[2,22]及1 000 kDa(Gelrite®)[10]之间。本研究所得EPS-Sw与其制备物的Mw(257~324 kDa)也达到上述商业结冷胶的最低Mw要求,和该菌以酵母膏+糖化米麸发酵得的结冷胶的Mw(288 kDa)[20]相近。相较于商业高乙酰的结冷胶(Mw=420~1 007 kDa、Rg=54~92 nm及ρ=1.67)[22],EPS-Sw(EPS-Et)整体分子与其制备物的F2的Mw、Rg及ρ值相近,在上述商品分子参数范围内;但EPS-Ye和EPS-Pe整体分子与F2的Mw明显偏低、Rg和ρ值明显偏高。综合单糖组成和总糖含量及主要分子参数(Mw、Rg与ρ值)等指标,本研究所得的EPS-Sw与其制备物皆符合商业结冷胶的总糖含量、糖组成与分子特征,极具开发与应用的价值。
2.4.3 EPS的MHS构型参数相关性
少动鞘氨醇单胞菌EPS样品的MHS方程式([η]= K×Mwa)[17]的参数随样品和区分物而异,有MHS的a越大、lgK值越小的趋势(电子版表1)。图2-a显示整体EPS的MHS参数lgK-a关系式为:y=-3.20x+0.665,相关系数R2=0.865,说明该方程式可解释86.5%数据变化。区分物的lgK-a关系更密切(图2-b),所有EPS的F1的lgK-a线性关系:y=-3.99x+1.60,R2高达0.999;所有EPS F2与F3(除EPS-CaEt的F3之外)的参数依循另一线性关系:y=-4.95x+1.98,R2高达0.976;单糖组成略不同的Gellan-F的线性关系:y=-4.56x+2.68(R2=0.980)。
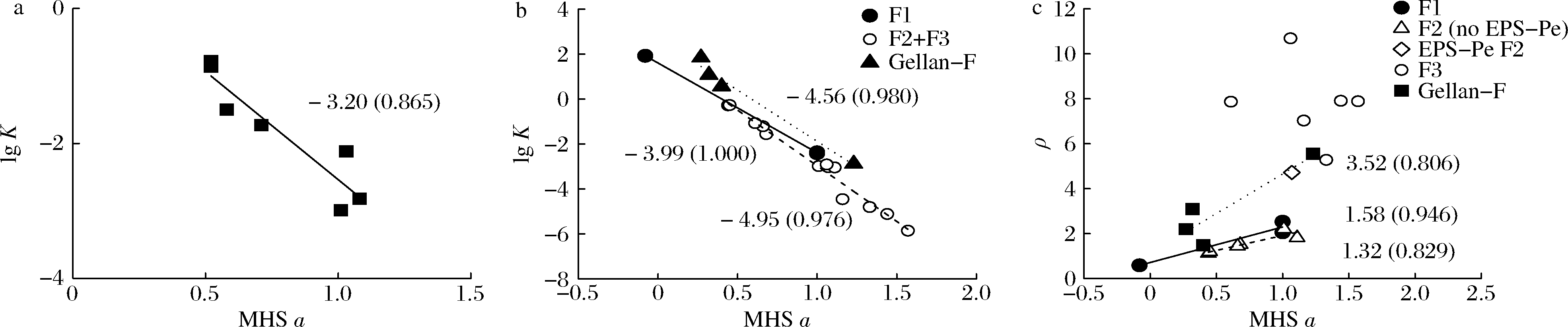
图2 少动鞘氨醇单胞菌EPS样品的马克-霍温-樱田方程式和构型参数关系
Fig.2 General relationships for Mark-Houwink-Sakurada (MHS) and conformational parameters of S.paucimobilis EPS samples 注:线旁标示的数字为斜率,括号内为相关系数R2值(下同)
图2-c显示F1、大部分F2(除EPS-Pe F2外)及Gellan-F的ρ值和MHS a之间呈良好的线性关系,斜率分别为1.58(R2=0.946)、1.32(R2=0.829)及3.52(R2=0.806);F3无ρ-a线性关系。综上,MHS lg K-a关系通式可适切地描述一系列分子特征;超大分子F1(Mw=454~4 060 kDa)的MHS参数关系的斜率比中小分子F2和F3(Mw=15.8~258 kDa)的低,此现象反映着此类EPS的大分子区分(尤其是EPS-Sw与Gellan-F的F1)呈较紧密的构型,而中小分子呈扩张性构型。
已知MHSa值和非均向性构型参数ρ值均反映多糖在溶液中的构象[23],两者值越小时,多糖分子链越柔软,构象呈越紧密的均向性球体;反之,值越大则多糖分子链刚性越大并扩张成非均向性构象。本研究发现少动鞘氨醇单胞菌EPS的ρ值皆随着区分物由F1到F3而提高(附表1)。以EPS-Et为例,其F1的a值约为0且ρ值0.59,呈现紧密球体;F2的a值1.11且ρ值1.82,呈半柔软伸展性链;F3的a值1.57且ρ值7.89,呈伸展性硬短杆状构型;整体EPS分子的构型参数与F2相近,呈半柔软伸展性链。其他4种EPS制备物(附表2)的整体分子和F2的构型参数皆相近,a值0.4~0.8且ρ值1.1~1.5(F2)或2.3~2.9(整体分子),兼具柔软无规则卷曲状与伸展性杆状;而F3的a值1.2~1.4且ρ值5.3~7.9,倾向半柔软伸展性硬短杆状。
2.4.4 EPS单糖组成随区分物含量的变化
图3表明少动鞘氨醇单胞菌的EPS样品主要单糖组成与区分物占比的相关性趋势,可推测该区分物的可能主要单糖组成。图3-a显示EPS-Ye、EPS-Pe和EPS-Sw 3个样品的Rha、GalA+GlcA以及GalA+GlcA+Rha+Glc总组成与F1占比(F1%)呈高度正相关,斜率分别为0.211、0.840及1.163,方程式可解释数据变化高达94.6%~98.6%。图3-b针对所有EPS和不同沉淀制备物上述糖组成对F2%的相关性皆呈负斜率,R2降低至0.358~0.633,但Ara与F2%呈正相关(R2=0.754)。因此,上述主要糖组成大致随F3%的增加而减少(图3-c),R2仅0.434~0.587。Glc和Gal组成与各区分物占比皆无相关性。综上,F1和F2含有已知的结冷胶典型的单糖组成(Rha、Glc、GlcA)以及新发现的GalA,为具代表结冷胶的区分物,其占比或可作为结冷胶纯度或应用领域的指标之一。
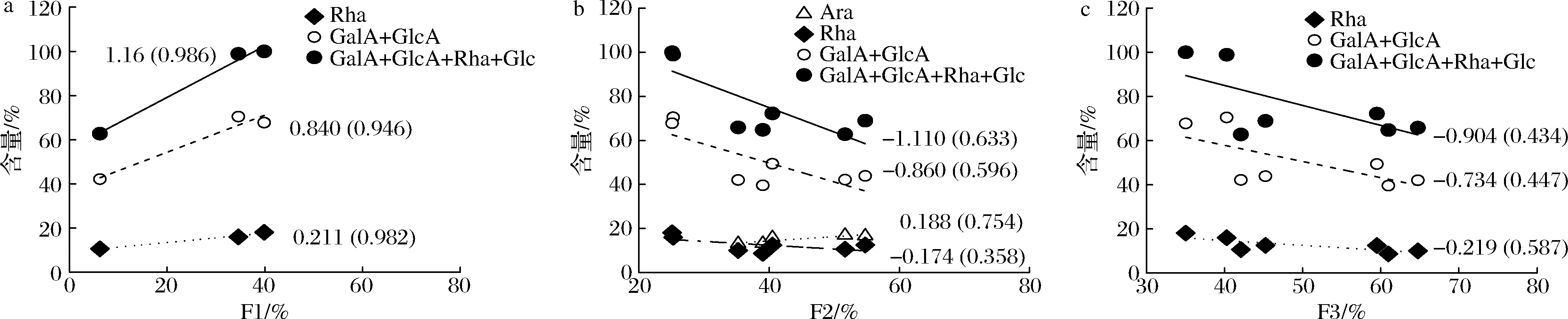
a-基于F1%;b-基于F2%;c-基于F3%
图3 少动鞘氨醇单胞菌EPS样品的主要单糖组成与区分物占比的关系
Fig.3 Relationships between monosaccharide composition and fraction percentages of S.paucimobilis EPS samples
2.5 EPS-Sw制备物的光谱特征
为了加强了解沉淀处理对产物结构指纹的影响,进一步分析EPS-Sw制备物的UV和FT-IR光谱图。图4-a为制备物的紫外吸收光谱图。EPS-Sw制备物在275 nm有特征吸收峰,且EPS-K、EPS-Ca和EPS-CaEt的吸收峰高于EPS-Et与EPS-KEt的,与其糖醛酸单元上的羧基和乙酰基含量有关。图4-b显示EPS-Sw制备物的FT-IR特征吸收峰,其中3 400~3 425cm-1吸收带,为多糖类共有的O-H伸缩振动的特征峰;1 730~1 751 cm-1的吸收峰来自于乙酰酯基的C![]() O伸缩振动[9];1 620~1 659 cm-1和1 400~1 418 cm-1的吸收峰与糖醛酸C6的游离羧基的C
O伸缩振动[9];1 620~1 659 cm-1和1 400~1 418 cm-1的吸收峰与糖醛酸C6的游离羧基的C![]() O伸缩振动有关[9-10];1 070~1 100 cm-1的吸收峰与吡喃糖环C—O—C的振动有关[12]。乙醇沉淀得的样品的1 730~1 751 cm-1肩峰讯号皆略大于单纯金属离子沉淀样品的,反应前者的乙酰基含量较高,与表1结果一致。
O伸缩振动有关[9-10];1 070~1 100 cm-1的吸收峰与吡喃糖环C—O—C的振动有关[12]。乙醇沉淀得的样品的1 730~1 751 cm-1肩峰讯号皆略大于单纯金属离子沉淀样品的,反应前者的乙酰基含量较高,与表1结果一致。
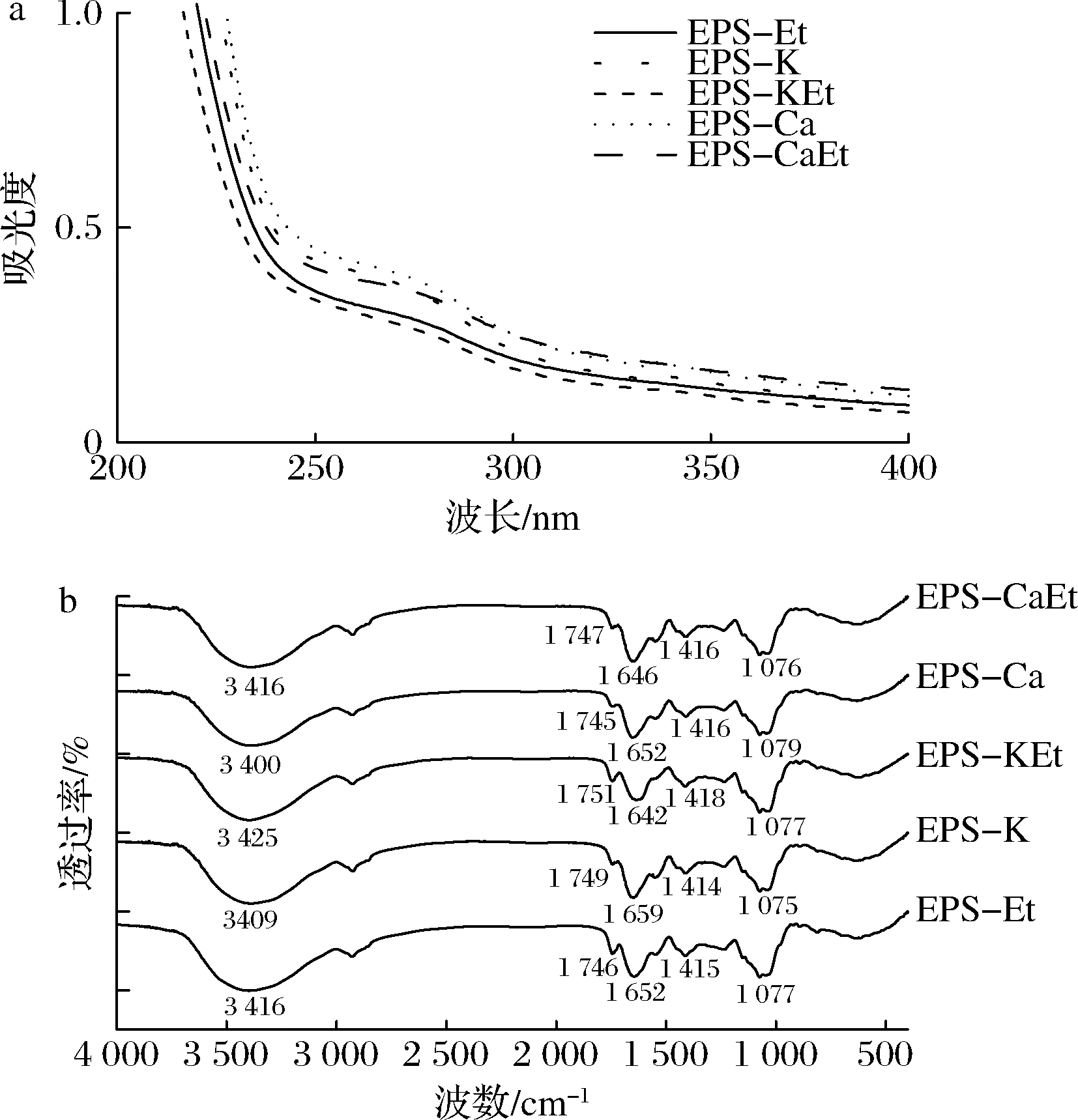
a-UV吸收光谱图;b-FT-IR图谱
图4 少动鞘氨醇单胞菌EPS-Sw沉淀制备物的光谱图
Fig.4 Spectra of S.paucimobilis EPS-Sw preparations
2.6 EPS的热水溶解动力学
2.6.1 EPS热水溶解动力学
图5显示上述EPS样品在90oC热水中溶解的样品量(以总糖浓度为溶解度指标)随时间而增加的趋势和一级动力学关系。图5-a显示起始加热时溶解的总糖浓度(C0,即既溶性)为Gellan-F>EPS-Sw>EPS-Ye与EPS-Pe;加热至30 min时趋于平稳最大值,所得已溶解的总糖浓度(C30)为Gellan-F(85.0%)≥EPS-Sw(80.1%)>EPS-Pe(54.7%)>EPS-Ye(40.1%);5种沉淀处理所得制备物(图5-b)中,EPS-CaEt和EPS-KEt的C0值提高到43%~46%,接近Gellan-F的C0(46.4%);在C30值方面,EPS-CaEt为88.7%,高于EPS-Et和EPS-KEt(80%),而EPS-K和EPS-Ca最低(74%~75%)。3种氮源发酵得的EPS和Gellan-F的热水溶解行为皆呈良好的一级动力学关系(图5-c),速率常数ks1(即斜率)介于0.143~0.954 h-1,且EPS-Sw>Gellan-F>EPS-Ye>EPS-Pe。不同制备物亦呈良好的一级溶解动力学关系(图5-d),ks1介于0.143~0.954 h-1,且EPS-CaEt与EPS-Et(即EPS-Sw)>EPS-K>EPS-KEt>EPS-Ca。所有关系式的决定系数R2值介于0.797~0.985,显示一级动力学模式可描述79.7%~98.5%的溶解度变化。在溶解速率常数ks1方面(图5-e),唯金属离子沉淀的样品与总糖含量呈正相关(R2=0.670),其他样品则否。综上,EPS-Sw的热水即溶性高于EPS-Ye和EPS-Pe的,溶解速率常数近似Gellan-F。EPS-CaEt和EPS-KEt具有高即溶性,类似Gellan-F,且EPS-CaEt与EPS-Et的溶解速率常数皆高于Gellan-F,与总糖含量部分相关。此外,C0和C30呈正相关(R2=0.690);ks1和乙酰基含量无相关性。
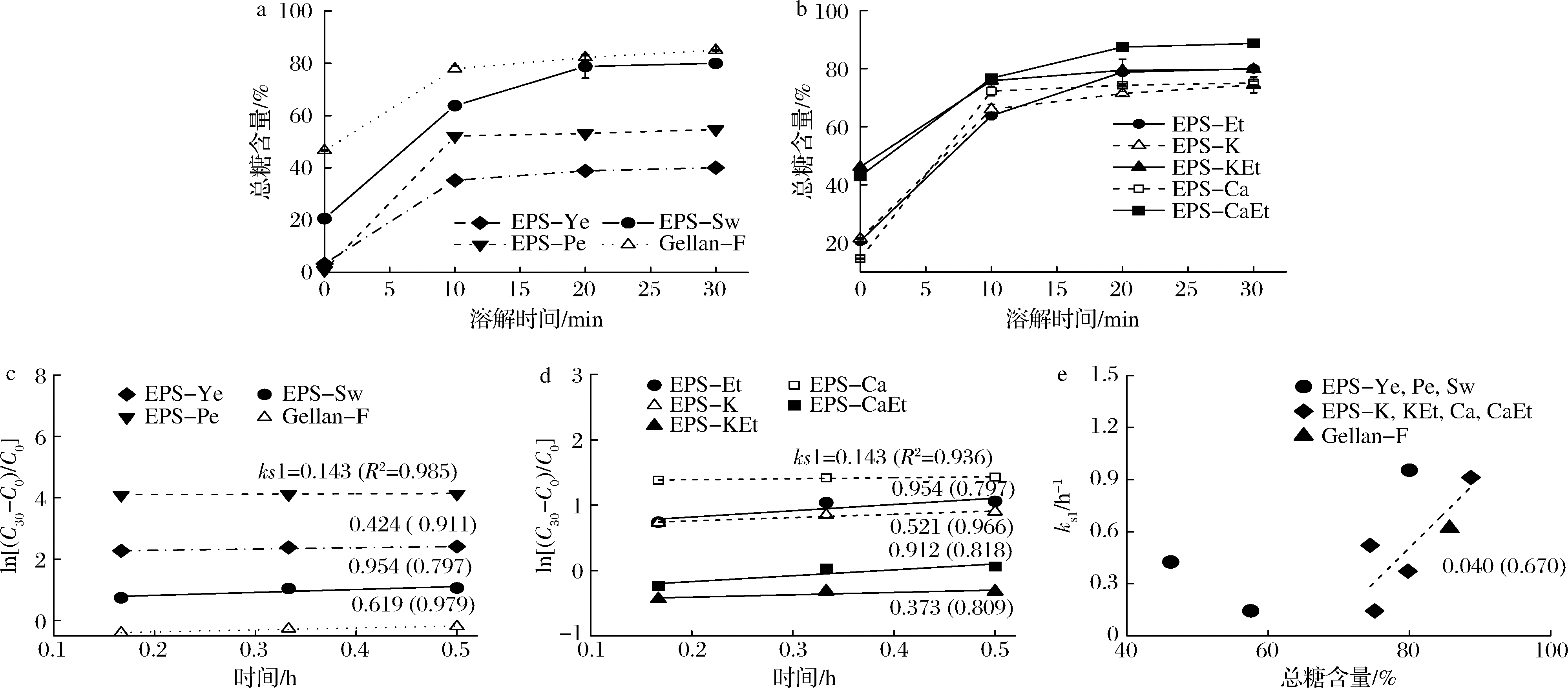
a-氮源的影响;b-沉淀处理的影响;c-氮源-一级动力学;d-沉淀处理-一级动力学;e-速率常数-总糖
图5 少动鞘氨醇单胞菌EPS样品的热水溶解度变化
Fig.5 Hot-water solubility changes for solubilization of S.paucimobilis EPS samples
2.6.2 EPS溶解参数与分子性质之关系
本研究发现上述溶解性参数与超大分子F1(Mw=454~4 060 kDa)参数之间的相关性非常密切,与F2和F3的相关性低或无,确定了F1为影响EPS溶解参数的决定因子之一。故针对含F1的EPS样品(EPS-Ye、EPS-Pe及EPS-Sw)的溶解参数与其F1分子特征的相关性,表明于图S3中,并与Gellan-F作比较。附图3-a显示含F1的EPS样品的溶解的总糖浓度C0和C30值皆与F1%呈密切的负相关,斜率分别为-0.59和-0.97,R2分別为0.999和0.756。C0和C30值亦随F1的构型参数ρ值提高而线性降低(附图3-b),R2分別为0.883和0.982。在溶解速率常数ks1方面,附图3-c指明ks1与EPS的F1%呈负相关,斜率为-0.022,R2高达0.960,相关性密切;若将Gellan-F并入计算,可得二次多项式的曲线方程式几乎完美解释数据的变化(R2=1.000)。当ks1对EPS中F1总量作图时(附图3-d),斜率为-0.046,R2高达0.998,相关系数比对F1%的R2更高。ks1对EPS中F1 Mw贡献量(logMw×F1%)(附图3-e)亦呈负相关(R2=0.970),大大高于ks1与logMw单一因素的相关性(R2=0.854,数据未显示),显示F1%的贡献远大于其分子质量(log Mw)。Gellan-F的C0、C30和ks1参数皆明显高于上述EPS样品的趋势线上方,此差异可能与其单糖组成或分子构型不同所致。
2.7 EPS的特征聚类
由于少动鞘氨醇单胞菌EPS样品组成多样化,随不同氮源、沉淀处理和不同发酵批次而异,故针对主要化学组成和溶解度参数进行多变量的PCA,解析其主成分因子,以提供该EPS生产时质量管控的参考依据。图6-a显示以主要化学组成为指标的PCA得分图,基于总糖含量、乙酰基含量及样品之间有明显差异的主要单糖组成(GlcA、GalA、Gal、Rha及Ara)。
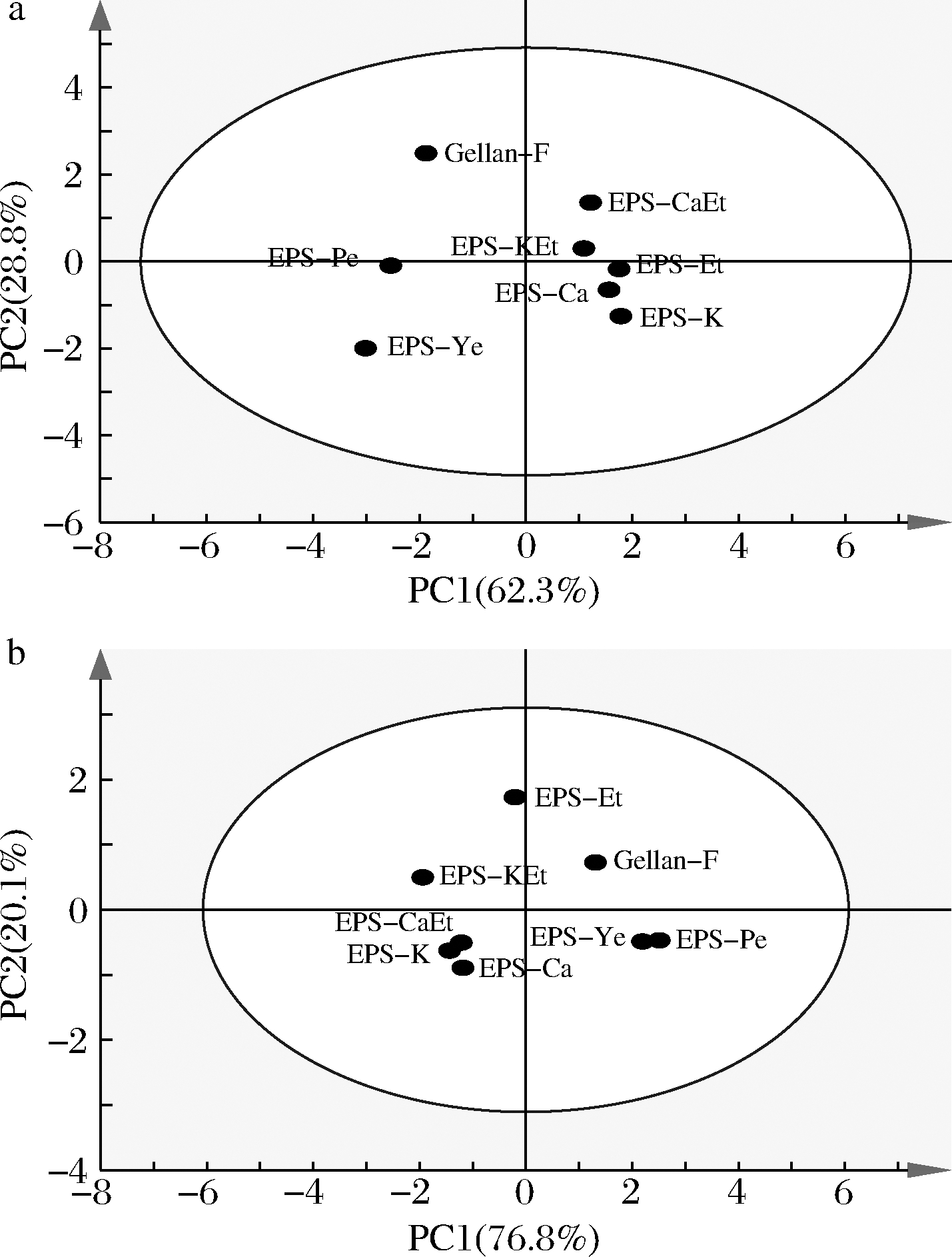
a-关键化学组成;b-分子参数
图6 少动鞘氨醇单胞菌EPS样品的特征聚类
Fig.6 Characteristic clustering of S.paucimobilis EPS samples 注:关键化学组成包括总糖含量、乙酰基含量及 主要差异的单糖组成
其主成分因子PC1和PC2分别可描述62.3%和28.8%、共91.1%的样品间的关系。EPS-Sw相关的样品皆PC1>0,其中EPS-Et在PC2~0;EPS-CaEt和ES-KEt在第1象限;EPS-Ca和EPS-K在第4象限。而EPS-Ye、EPS-Pe及Gellan-F皆为PC1<0,又EPS-Ye在第3象限;EPS-Pe在PC2~0上;而Gellan-F在第2象限。归纳得PC1主要为Gal和Ara组成,PC2主要为总糖含量/GlcA/Rha(皆同向变化)。乙酰基含量与总糖含量贡献相似但有限,因与总糖含量呈正相关(表1)但数据变化极有限。图6-b是基于F1%、F2%、F1-logMw、F2-logMw为指标的PCA得分图,PC1和PC2分别可描述76.8%和20.1%、共96.9%的样品间的关系。类似的可归纳得PC1主要为F1%,PC2主要为F2%。综上,上述PCA得分图皆可适当地描述上述EPS样品之间的聚类程度(反之,即差异程度),并可分辨不同氮源和沉淀方式所得样品之间的差异。针对所有EPS样品,关键的化学因子由Gal和Ara组成,其次为总糖含量;关键的分子因子为F1%,其次为F2%。
影响EPS热水溶解性的关键因素大致有3方面:Gal和Ara组成、总糖含量以及F1%。GlcA和Rha组成与总糖含量呈正相关,可能有间接的正向贡献。当EPS含有超大分子F1时,热水溶解性ks1的决定因素为F1总量(=F1%×总糖含量),其中F1%的贡献度大于总糖含量,因ks1与F1%单一因素的相关性非常密切(图7-c),但与总糖含量单一因素无相关性。金属离子沉淀样品的溶解度接近同源的EPS-Sw(EPS-Et),其溶解参数-总糖含量关系接近Gellan-F(尤其EPS-CaEt)。
2.8 讨论
2.8.1 产物组成导向的EPS合成路径与氮源的影响
本研究创新发现少动鞘氨醇单胞菌ATCC 31461 GL-1变异株产生的胞外多糖(主要为结冷胶)和结冷胶商品Gellan-F具有共同特征:皆含有结冷胶已知的部分组成(Rha、Glc和GlcA)以及未曾被发现的GalA,GalA(占18%~42%)的重要性不亚于GlcA(占24%~37%),且皆具有3个分子区分,无论采用何种氮源(酵母膏、蛋白胨和豆粕粉)或商品来源。上述单糖组成共同特征表明了GalA参与了结冷胶的合成过程。
因此,针对上述共同的单糖组成特征以及部分已知Rha、Glc及GlcA相关的合成路径[1,24],可进一步综合出GalA在结冷胶合成途径中可能的角色,并有助于厘清氮源可能的影响,如图7所示,以产物流为导向摘要说明如下。蔗糖进入细胞内进行糖酵解反应后,经磷酸化形成蔗糖-6-P,再水解成果糖-6-P和葡萄糖-6-P,果糖6-P异构化形成葡萄糖-6-P,而葡萄糖-6-P会分流形成葡萄糖-1-P(路径①)或氧化成葡萄糖酸6-P(路径②)。葡萄糖-1-P形成糖核苷酸前体, 分流形成尿苷二磷酸-葡萄糖(UDP-Glc)(路径③)或胸苷二磷酸-葡萄糖(dTDP- Glc)(路径④)、再脱氧形成dTDP-Rha;UDP-Glc分流为三部分:参与结冷胶合成、氧化成UDP-GlcA(路径⑤)[1]或异构化成UDP-Gal(路径⑥)再氧化成UDP-GalA。葡萄糖酸6-P可分流:一为生成丙酮酸(路径⑦)并脱羧形成乙酰辅酶A,参与三羧酸(tricarboxylic cycle,TCA)循环(路径⑧)、部分游离;二为进入五碳糖磷酸循环(pentose phosphate pathway,PPP)(路径⑨);三为生成甘油酸-2-P(路径⑩)。最后,UDP-Glc、UDP-GlcA、UDP-GalA、dTDP-Rha、甘油酸2-P及乙酰辅酶A经由胞外多糖合成酶组合成胞外多糖(结冷胶),且具有3种不同分子质量区分物(F1、F2及F3)。

图7 少动鞘氨醇单胞菌生产胞外多糖结冷胶的 可能合成途径
Fig.7 Possible biosynthetic pathway for diverse S.paucimobilisEPS gellan 注:P-磷酸;dTDP-脱氢-胸苷二磷酸;UDP-尿苷二磷酸
假设所合成的多糖的单糖组成主要决定于合成前糖核苷酸前体的浓度,本研究发现EPS-Ye、EPS-Pe和EPS-Sw(EPS-Et)的(Glc+GlcA+GalA)/Rha摩尔比值为4.5~5.2(表2),高于Gellan-F的3.5,相当于Rha占16%~18%(约1/6),即葡萄糖-1-P分流形成dTDP-Rha和UDP-Glc分别为~17%和~83%,不同氮源影响分流只1%~2%。在UDP-Glc方面,采用豆粕粉时UDP-Glc流向UDP-GlcA较UDP-GalA多,而采用酵母膏或蛋白胨时流向UDP-GalA较多。图7可作为未来设计生产特定结构的结冷胶的参考。然尚须更多的实验解析其他发酵条件(如C/N比、发酵温度、时间及氧化辅剂等)对所得结冷胶的结构与分子特征的影响,以建立其中关系图谱。
2.8.2 糖组成的异质多样性
由于EPS-Sw的GalA%(~18%)显著低于EPS-Ye和EPS-Pe的(36.9%~41.9%),参考品Gellan-F亦含有18% GalA,表明该菌在UDP-Glc分流形成GalA的活性即相当高,非采用豆粕粉所致,亦即GalA组成主要来自菌的代谢合成。但EPS-Sw所含Ara和Gal组成并未见于EPS-Ye和EPS-Pe中,说明Ara和Gal组成与豆粕粉有关,但影响因素相当复杂,可溶性大豆多糖(含Ara∶Gal∶GalA≈23∶46∶18)[25]仅为其一。同为Sphingomonas属的ATCC 31555所合成的维纶胶,与结冷胶同为鞘氨醇胶之一[1],也含有Ara和Gal等异质糖[9],证实Sphingomonas属具有将Ara和Gal合成胞外多糖的能力,随菌种和培养条件而异。异质培养基会影响结冷胶组成的情形也见于以葡萄粕为辅助氮源所得的结冷胶(含果糖组成且高Glc/Rha比例)[10]。已知该菌具有利用可溶性淀粉并代谢合成结冷胶的能力[4,8],是否也具有利用大豆多糖的能力,值得深入研究,有助于建立修饰结冷胶结构或分子特征的低成本的发酵工程方法。
2.8.3 复合沉淀与澄清处理的优势
采用金属离子复合乙醇沉淀处理可提高EPS-Sw制备物中结冷胶纯度,且Ca2+加乙醇沉淀的效果最好。但单一K+和Ca2+沉淀得的样品比其复合乙醇沉淀的样品具有较高的Glc∶Rha和(GlcA+GalA)∶Rha比例,尤其是EPS-K。根据与金属离子键结的敏感性[11-12],EPS-K和EPS-Ca相当于K型结冷胶和Ca型结冷胶[2],产量占比分别为EPS-Et的72%和49%(表1)。当EPS-Sw的制备物进一步经澄清化处理[24]所得样品中,单独乙醇沉淀者仍有约6%的超大分子区分F1(图1),但金属离子沉淀者皆富集了中小分子区分(F2和F3),无易形成微胶的F1;再者,金属离子复合乙醇沉淀处理可提高F2占比。此澄清效果源于结冷胶对Ca2+和K+离子键结的敏感性[11-12],稀浓度下即可形成微胶,经微过滤去除后,滤液中的结冷胶组分更为均一且有可控性,有利于后续应用时物性的调控与优化。综上,金属离子复合乙醇沉淀EPS-Sw样品具有多方优点,可提高产量、结冷胶纯度、可溶性总糖含量及热水溶解性等,且5 mmol/LCa2+的效果优于175 mmol/L K+的,5 mmol/LCa2+复合醇沉所得的产物具有接近商业结冷胶Gellan-F的可溶性总糖含量与热水溶解性。
3 结论
本研究发现,在30 ℃、pH 7、48 h为中心发酵条件下,少动鞘氨醇单胞菌以豆粕粉氮源发酵生产的EPS-Sw产量达29 g/L,显著高于以酵母膏和蛋白胨氮源发酵的产量。结冷胶的主要单糖组成主要受培养基氮源所影响,部分随沉淀条件而异。豆粕粉发酵得EPS具有额外的Ara和Gal,结冷胶相对纯度为62.8%,低于酵母膏和蛋白胨所得的EPS与商业结冷胶Gellan-F(相对纯度=98.7%~100%)。添加5 mmol/LCa2+复合乙醇沉淀处理可提高EPS-Sw的产量、可溶性总糖含量、乙酰基含量、结冷胶相对纯度、中小分子组成(F2+F3)、热水既溶性以及溶解速率常数等,其溶解性高、接近Gellan-F。本研究创新发现,所有样品和结冷胶商品含有除了结冷胶典型的单糖组成Rha、Glc和GlcA之外,尚含有显著量的GalA。上述4种糖组成总和可用于作为评估结冷胶相对纯度的指标。另外,F1%为最重要的分子参数指标。以总糖含量、单糖组成和Mw指标观之,本研究所得EPS-Sw与其制备物皆符合商业结冷胶Mw的要求,深具开发与应用价值。未来还需进一步探讨EPS-Sw区分物分离纯化条件、纯化组分的分子特征与单糖组成、以及浓度比例-分子特征-流变特性的关系图谱,为工业生产不同特性结冷胶提供理论依据。
[1] FIALHOA M, MOREIRA L M, GRANJA A T, et al.Occurrence, production, and applications of gellan:Current state and perspectives[J].Applied Microbiology and Biotechnology, 2008, 79(6):889-900.
[2] PRAJAPATIV D, JANI G K, ZALA B S, et al.An insight into the emerging exopolysaccharide gellan gum as a novel polymer[J].Carbohydrate Polymers, 2013, 93(2):670-678.
[3] GRAHAMS, MARINA P F, BLENCOWE A.Thermoresponsive polysaccharides and their thermoreversible physical hydrogel networks[J].Carbohydrate Polymers, 2019, 207:143-159.
[4] BAJAJI B, SAUDAGAR P S, SINGHAL R S, et al.Statistical approach to optimization of fermentative production of gellan gum from Sphingomonas paucimobilisATCC 31461[J].Journal of Bioscience and Bioengineering, 2006, 102(3):150-156.
[5] ZHUG L, SHENG L, TONG Q Y.A new strategy to enhance gellan production by two-stage culture in Sphingomonas paucimobilis[J].Carbohydrate Polymers, 2013, 98(1):829-834.
[6] ZHANGJ, DONG Y C, FAN L L, et al.Optimization of culture medium compositions for gellan gum production by a Halobacterium Sphingomonas paucimobilis[J].Carbohydrate Polymers, 2015, 115:694-700.
[7] HUX T, GOFF H D.Fractionation of polysaccharides by gradient non-solvent precipitation:A review[J].Trends in Food Science &Technology, 2018, 81:108-115.
[8] 胡桂萍,刘波, 朱育菁, 等.少动鞘脂单胞菌产结冷胶发酵培养基的响应面法优化[J].生物数学学报, 2012, 27(3):507-517.
HU G P, LIU B, ZHU Y J, et al.Optimization of fermentation culture cedium for producing gellan gum of Sphingomonas paucimobilisby response surface methodology[J].Journal of Biomathematics, 2012, 27(3):507-517.
[9] ZHAOM, ZHANG H, XU X Q, et al.A strategy for the synthesis of low-molecular-weight welan gum by eliminating capsule form of Sphingomonasstrains[J].International Journal of Biological Macromolecules, 2021, 178:11-18.
[10] ALTANKAMER D D, GUMUS T, PALABIYIK I, et al.Grape pomace as a promising source for gellan gum production[J].Food Hydrocolloids, 2021, 114:106584.
[11] SWORNG, STOUBY L.Gellan gum[M]//Handbook of Hydrocolloids.Amsterdam:Elsevier, 2021:855-885.
[12] DESOUZA F S, DE MELLO FERREIRA I L, DA SILVA COSTA M A, et al.Effect of pH variation and crosslinker absence on the gelling mechanism of high acyl gellan:Morphological, thermal and mechanical approaches[J].Carbohydrate Polymers, 2021, 251:117002.
[13] DUBOISM, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[14] 白雪蕊,聂麦茜, 谢铮胜, 等.共存碳源对克雷伯氏菌NⅢ2发酵蔗糖产絮凝剂的影响[J].工业微生物, 2016, 46(6):41-46.
BAI X R, NIE M Q, XIE Z S, et al.Effects of co-carbon source compounds on production of bioflocculant by Klebsiellasp.NⅢ2 with sucrose[J].Industrial Microbiology, 2016, 46(6):41-46.
[15] BRADFORDM M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[16] 秦方,詹晓北, 朱莉, 等.Gellan Gum(激冷胶)中酰基含量的测定[J].食品与机械, 1997, 13(5):32-33.
QIN F, ZHAN X B, ZHU L, et al.Acyl determination in gellan gum[J].Food and Machinery, 1997, 13(5):32-33.
[17] MASUELLIM A.Viscometric study of pectin.Effect of temperature on the hydrodynamic properties[J].International Journal of Biological Macromolecules, 2011, 48(2):286-291.
[18] HUW W, YE X Q, CHANTAPAKUL T, et al.Manosonication extraction of RG-I pectic polysaccharides from citrus waste:Optimization and kinetics analysis[J].Carbohydrate Polymers, 2020, 235:115982.
[19] 李传宝,黄金, 何军邀, 等.微生物多糖结冷胶的发酵过程优化[J].食品与发酵工业, 2013, 39(4):76-80.
LI C B, HUANG J, HE J Y, et al.Optimization of fermentation process of microbial polysaccharide-gellan gum[J].Food and Fermentation Industries, 2013, 39(4):76-80.
[20] DAMLAALTAN KAMER D, GUMUS T, PALABIYIK I, et al.The fermentation-based production of gellan from rice bran and the evaluation of various qualitative properties of gum[J].International Journal of Biological Macromolecules, 2022, 207:841-849.
[21] WANGD X, KIM H, LEE S, et al.Improved gellan gum production by a newly-isolated Sphingomonas azotifigensGL-1 in a cheese whey and molasses based medium[J].Process Biochemistry, 2020, 95:269-278.
[22] KANGD, CAI Z X, WEI Y, et al.Structure and chain conformation characteristics of high acyl gellan gum polysaccharide in DMSO with sodium nitrate[J].Polymer, 2017, 128:147-158.
[23] GUOR, TIAN S, LI X J, et al.Pectic polysaccharides from purple passion fruit peel:A comprehensive study in macromolecular and conformational characterizations[J].Carbohydrate Polymers, 2020, 229:115406.
[24] BAJAJI B, SURVASE S A, SAUDAGAR P S, et al.Gellan gum:Fermentative production, downstream processing and applications[J].Food Technology and Biotechnology, 2007, 45(4):341-354.
[25] SALARBASHID, BAZELI J, TAFAGHODI M.Environment-friendly green composites based on soluble soybean polysaccharide:A review[J].International Journal of Biological Macromolecules, 2019, 122:216-223.