蛹虫草(Cordyceps militaris)是我国重要的传统食药用菌[1],也是虫草属的模式菌[2]。蛹虫草中含有丰富的生物活性成分,包括多糖、虫草素、虫草酸(甘露醇)、麦角甾醇、腺苷、N6-(2-羟乙基)腺苷等核苷类化合物[3-8]。虫草素(cordycepin) 即3′-脱氧腺苷(3′-deoxyadenosine)是蛹虫草重要活性成分之一,1950年CUNNINGHAM等[9]首次从蛹虫草寄生的昆虫不腐烂组织中分离得到的抗菌物质,也是第一个从真菌中分离出来的核苷类抗菌素。虫草素具有抗肿瘤[10-12]、治疗白血病[13-14]、抗病毒[15]、抗菌抗炎[16-17]、抗肥胖[18]等多种生物活性作用。虫草素在生物体内易被腺苷脱氨酶(adenosine deaminase,ADA)降解为3′-脱氧肌苷,动物研究表明虫草素在大鼠体内的半衰期只有1.6 min[19],因此,大大影响虫草素在抗癌中的临床应用。为了提高虫草素抗癌作用效果,英国牛津大学与NUCANA生物制药公司利用ProTide技术,将5-O-phenyl-(benzyloxy-L-alaninyl)-phosphate基团连接在虫草素上,合成一种新型化疗药物NUC-7738,NUC-7738对ADA降解有抵抗力,能将活性3′-脱氧一磷酸腺苷(deoxyadenosine 3′-monophosphate, 3′-dAMP)释放到细胞中并迅速转化为关键的抗癌代谢物3′-脱氧三磷酸腺苷(deoxyadenosine 3′-triphosphate, 3′- dATP),临床实验表明在晚期实体瘤患者中具有很强的抗癌活性[20],这一研究发现将极大推动虫草素的抗癌应用。因此对蛹虫草中虫草素的合成途径进行深入研究具有重要应用价值。
虫草素的合成途径研究历史悠久,1961年KREDICH等[21]就采用碳同位素示踪法研究虫草素合成途径,后又有研究在培养基中添加腺苷[22]、14C腺苷和3H核糖[23],发现虫草素是通过腺苷转化而来。2011年蛹虫草全基因组测序数据公布[24],虫草素合成途径研究进入基因组和转录组时代。2017年,中国科学院王成树研究员团队发现虫草素合成的基因簇cns1-cns4,其中cns1和cns2编码的是腺苷合成虫草素中的关键酶——氧化还原酶和磷酸水解酶,cns3编码的核苷酸激酶参与喷司他丁(pentostatin)的合成过程,cns4可能参与喷司他丁的转运[25],同时也确定了虫草素合成途径的中间产物,是目前为止虫草素合成途径研究中证据最为充分的,也为虫草素合成途径的深入研究提供了详实的研究基础。
代谢组学是一种研究微生物代谢产物差异及代谢机理的重要方法,目前关于蛹虫草的代谢组学研究报道主要集中在以下3方面:一是人工栽培蛹虫草与野生蛹虫草或者冬虫夏草代谢物的差异分析[26-27],鉴定蛹虫草品质;二是对蛹虫草同一菌株的不同培养时期[28]和不同培养条件[29]进行代谢组测定,分析差异代谢物及代谢通路,为蛹虫草活性成分的研究提供依据;三是对蛹虫草不同菌株进行代谢组测定,挖掘差异代谢物并进行代谢网络分析[30]。目前蛹虫草的代谢组研究主要集中在代谢产物差异研究上,对虫草素的合成途径研究较少,因此本研究以蛹虫草出发菌株CM08、经过离子束注入诱变筛选得到的高产虫草素正突变菌株CM09和低产虫草素负突变菌株CM10为研究对象,对3个菌株液体发酵培养7 d,分离得到菌丝体进行非靶向代谢组数据测定,通过统计学分析和生物信息学分析,找出CM08、CM09和CM10菌株之间代谢产物的差异,在CM09 vs CM08和CM10 vs CM08的共同差异代谢物中筛选相对含量上调和下调相反的差异代谢物,结合差异代谢物所在的代谢途径分析与虫草素合成途径的关系,阐明其在虫草素合成途径中的作用,结合现有报道的虫草素合成途径,预测蛹虫草中虫草素合成途径,对蛹虫草中虫草素产量提升和虫草素生物合成研究具有重要理论意义。
1 材料与方法
1.1 材料与试剂
菌种:蛹虫草(Cordyceps militaris)出发菌株CM08,通过离子束注入诱变筛选获得的高产虫草素正突变菌株CM09和低产虫草素负突变菌株CM10,本单位微生物实验室保存。
试剂:乙腈(色谱纯),Meker;乙酸铵,Sigma;氨水,Fluka。
蛹虫草液体培养基(g/L):蔗糖31.11,蛋白胨31.78,KH2PO41.01。
1.2 仪器与设备
REX-500A人工气候箱,宁波江南仪器厂;ZHWY-2112B摇床,上海智诚分析仪器制造有限公司;AB Triple TOFTM5600高分辨质谱仪,美国应用生物系统公司;Agilent 1290 Infinity LC超高效液相色谱仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 蛹虫草菌丝体样品的制备方法
取出-80 ℃冷冻菌丝体样品,称量60 mg样本,加入200 μL水进行匀浆,涡旋振荡60 s,加入800 μL预冷的甲醇乙腈溶液(1∶1,体积比),涡旋振荡60 s,低温超声2次,每次30 min,-20 ℃放置1 h沉淀蛋白,14 000 r/min,4 ℃离心20 min,取上清液冷冻干燥。将冻干样品加入100 μL乙腈水溶液[V(乙腈)∶V(水)=1∶1]复溶,涡旋,14 000 r/min,4 ℃离心15 min,取上清液备用。
1.3.2 超高效液相色谱测定条件
样品采用Agilent 1290 Infinity LC超高效液相色谱系统(ultra high performance liquid chromatography, UHPLC)HILIC色谱柱进行分离,柱温25 ℃,流速0.3 mL/min,流动相A:25 mmol/L乙酸铵+25 mmol/L氨水的水溶液,B:乙腈;梯度洗脱程序:0~1 min,95% B;1~14 min,B从95% 线性变化至65%;14~16 min,B从65%线性变化至40%;16~18 min,B维持在40%;18~18.1 min,B从40%线性变化至95%;18.1~23 min,B维持在95%;进样体积2 μL。
1.3.3 质谱测定条件
分别采用电喷雾电离(electron spray ionization, ESI)正离子和负离子模式进行检测。样品经UHPLC分离后用Triple TOFTM5600质谱仪(AB SCIEX)进行质谱分析,ESI源条件如下:喷雾电压±5 500 V(正负离子模式),离子源温度600 ℃,雾化气辅助加热气压力(Gas1)60 psi,辅助加热气压力(Gas2)60 psi,气帘气压力30 psi;一级荷质比检测范围:60~1 000 Da,一级质谱扫描累积时间0.20 s/spectra;二级子离子荷质比检测范围:25~1 000 Da,二级质谱采用数据依赖型采集模式(information dependent acquisition,IDA)获得,并且采用峰强度值筛选模式,去簇电压(declustering potential,DP):±60 V(正负离子模式),碰撞能量:(35±15) eV。
1.4 数据处理与分析方法
非靶向代谢组方法测定得到的原始数据经过ProteoWizard软件转换成.mzXML格式,然后采用XCMS软件进行峰对齐、保留时间校正和提取峰面积。通过与本地数据库中代谢物的保留时间、分子质量(分子质量误差在<25 ppm内)、二级碎裂谱图、碰撞能等信息进行匹配,对样品中的代谢物进行结构鉴定,并对鉴定结果进行严格的人工二次核对、确认。应用软件SIMCA-P 14.1(Umetrics,Umea,Sweden)进行模式识别,数据经Pareto-scaling预处理后,进行多元统计分析,包括无监督主成分分析(principal component analysis, PCA),有监督偏最小二乘法判别分析(partial least squares discrimination analysis, PLS-DA)和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis, OPLS-DA)。对分析得到的差异代谢物进行生物信息学分析,挖掘与虫草素合成途径相关的关键化合物,完善蛹虫草中虫草素合成途径。
2 结果与分析
2.1 PCA
采用UPLC-Q-TOF-MS非靶向代谢组学方法检测和鉴定3组蛹虫草菌丝体样品的代谢物,正离子模式检测得到共同代谢物381种,负离子模式检测得到共同代谢物104种,正负离子模式共检测得到485种共同代谢物,其中氨基酸及其衍生物的种类最多,其次为核苷、核苷酸及其类似物,此外还有有机酸、糖类等。对蛹虫草菌株CM08、CM09和CM10这3组样品正负离子模式下检测得到的代谢物进行PCA,图1中3组样品平行样本之间聚集在一起,说明组内样品重复性好;3组样品之间分离较好,说明各组样品之间差异明显。
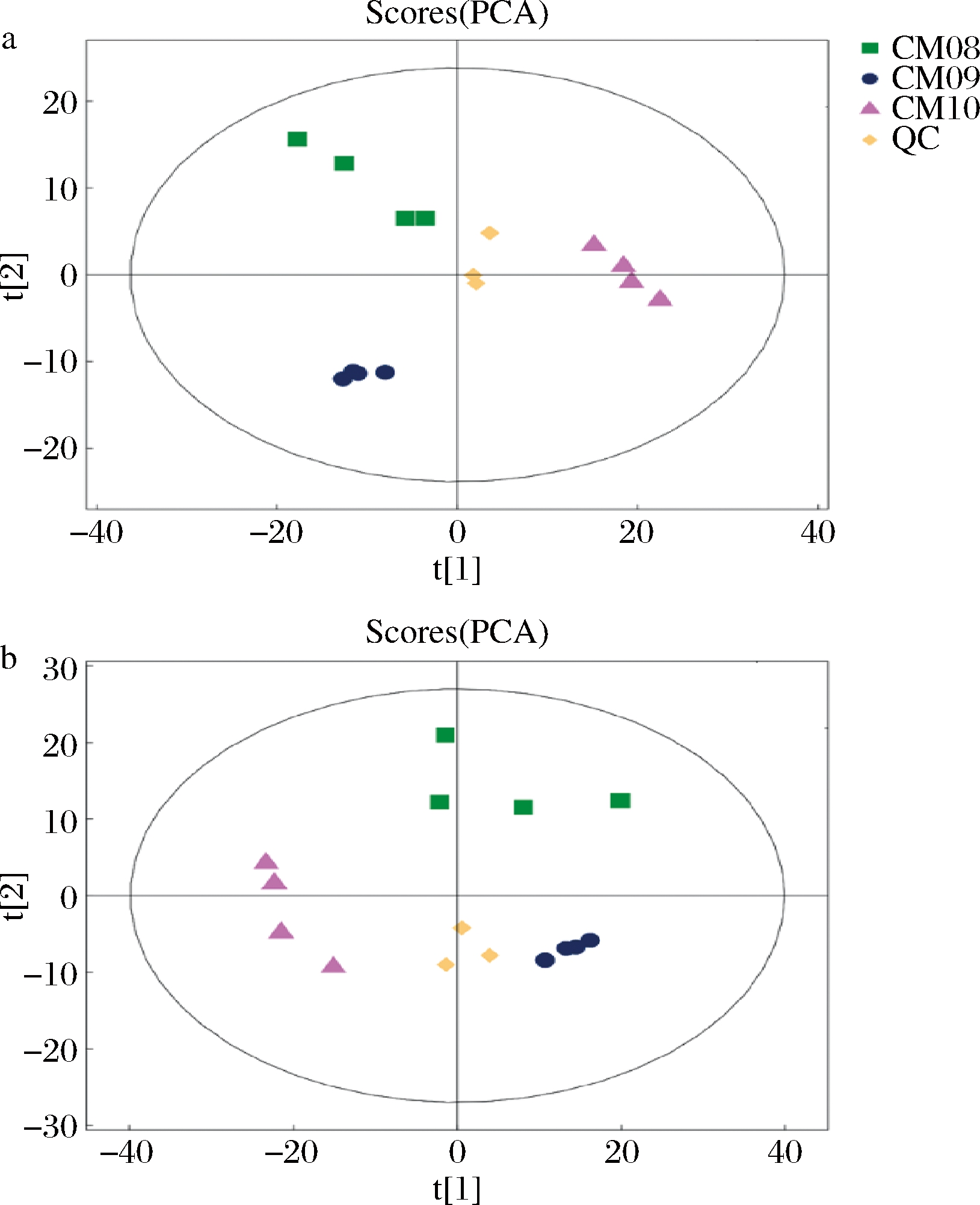
a-正离子模式;b-负离子模式
图1 CM08、CM09和CM10 PCA得分图
Fig.1 PCA scores plot of CM08, CM09, and CM10
2.2 OPLS-DA
PCA是一种没有监督的分组方法,当对样品分组时,出现组内差异大于组间差异时,该分组方式就变得不够清晰。因此,采用一种有监督的分析方法十分必要[31]。OPLS-DA可以滤除分类信息无关的噪音,提高模型的解析能力和有效性,OPLS-DA模型的R2X、R2Y、Q2分别代表X变量解释性、Y变量解释性和模型预测性,因此值越接近于1,模型的拟合度越高。经过7次循环交互验证得到OPLS-DA模型的参数(R2Y、Q2),一般Q2>0.5表明模型稳定可靠。本研究中3组蛹虫草菌丝体样品OPLS-DA模型的参数分别为:CM09 vs CM08和CM10 vs CM08正离子模式模型的 R2X、R2Y和Q2值分别为:(0.655、0.997、0.950)、(0.704、0.995、0.957),负离子模式模型的 R2X、R2Y和Q2值分别为:(0.828、1.000、0.937)、(0.866、0.997、0.977)。上述模型参数R2X、R2Y、Q2的值均大于0.5,说明这4个模型拟合度高,且稳定可靠。为避免有监督模型在建模过程中发生过拟合,采用置换检验对模型进行检验,以保证模型的有效性,图2显示随着置换保留度逐渐降低,随机模型的R2和Q2均逐渐下降,说明原模型不存在过度拟合现象,模型稳定性好。上述分析表明本研究中蛹虫草菌株代谢物OPLS-DA模型拟合度高且稳定性好。
2.3 差异代谢物的分析
根据OPLS-DA模型得到的变量权重值(variable importance for the projection, VIP)来衡量各代谢物的表达模式对各组样本分类判别的影响强度和解释能力,其中VIP>1并且P<0.05的代谢物为差异代谢物。根据上述判定标准,CM09 vs CM08的差异代谢物64种,其中52种差异代谢物上调,12种差异代谢物下调;CM10 vs CM08差异代谢物147种,其中116种差异代谢物上调,31种差异代谢物下调。正突变菌株CM09、负突变菌株CM10与出发菌株CM08相比较,差异代谢物主要有核苷类化合物,氨基酸及其类似物,糖、糖醇、糖胺类代谢物,有机酸类及其他类代谢物。
在CM09 vs CM08和CM10 vs CM08的差异代谢物中,氨基酸及其类似物种类最多,分别为15种和79种,其中共同的差异代谢物有9种,分别为D-脯氨酸(D-proline)、L-酪氨酸(L-tyrosine)、L-色氨酸(L-tryptophan)、L-亮氨酸(L-leucine)、L-正亮氨酸(L-norleucine)、N-α-乙酰-L-精氨酸(N-α-acetyl-L-arginine)、
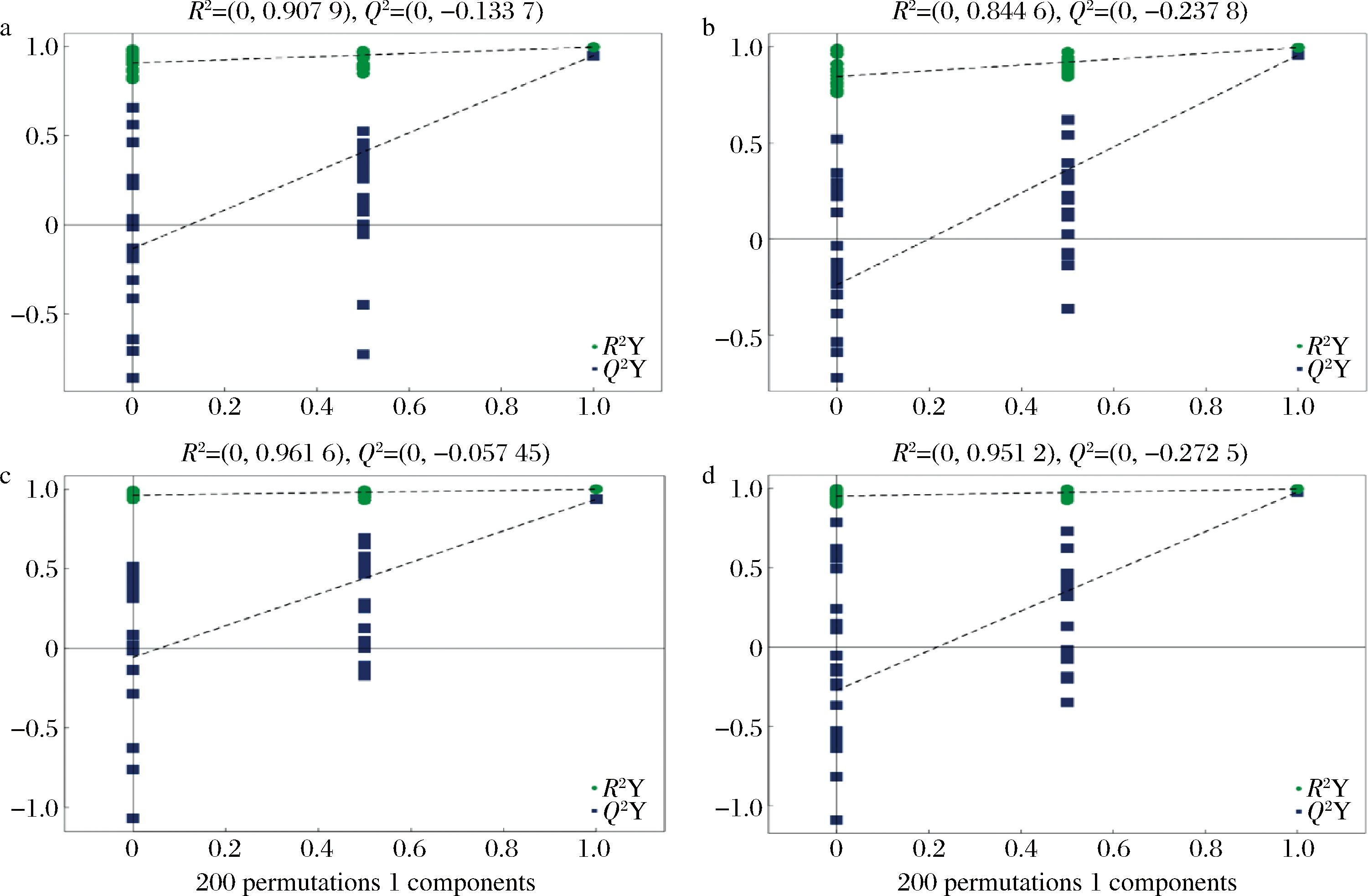
a-正离子模式CM09 vs CM08;b-正离子模式CM10 vs CM08;c-负离子模式CM09 vs CM08;d-负离子模式CM10 vs CM08
图2 CM09 vs CM08和CM10 vs CM08 OPLS-DA置换检验
Fig.2 OPLS-DA permutation test results of CM09 vs CM08 and CM10 vs CM08 注:图中横坐标表示置换保留度,即与原模型Y变量顺序一致的比例,纵坐标表示R2和Q2的值。 两条虚线分别表示R2和Q2的回归线,右上角的R2和Q2表示置换保留度等于1,即原模型的R2和Q2值。
亮氨酰-丙氨酸(Leu-Ala)、甘氨酰-精氨酸(Gly-Arg)和麦角硫因(ergothioneine),这9种氨基酸在正负突变菌株中均表现为相对含量上调,但是差异倍数不同,说明在蛹虫草突变菌株中氨基酸含量高低有差异,同时CM10 vs CM08中的差异氨基酸数量远多于CM09 vs CM08,可能是由于负突变菌株CM10产生的变异更大。与CM08相比,CM09中牛磺酸(taurine)和亚牛磺酸(hypotaurine)相对含量显著上调,牛磺酸是人体的必需氨基酸,具有缓解疲劳、提高免疫力等活性作用,CM09在虫草素产量提高的基础上也产生了牛磺酸相关的有益突变。
在CM09 vs CM08和CM10 vs CM08的差异代谢物中,糖和糖醇类差异代谢物分别为15种和16种,其中共同的差异代谢物有7种,分别为D-甘露醇(D-mannitol)、ADP核糖(ADP-ribose)、L-岩藻糖(L-fucose)、半乳糖醇(dulcitol)、N-乙酰-D-葡萄糖胺(N-acetyl-D-glucosamine)、D-氨基葡萄糖-1-磷酸(D-glucosamine 1-phosphate)和D-山梨醇(D-sorbitol)。其中D-甘露醇即为虫草酸,CM09和CM10中相对含量均上调,说明虫草酸产量与虫草素产量没有相关性。ADP核糖则是在CM09中相对含量上调,在CM10中相对含量下调,参与嘌呤代谢途径,与核苷类化合物合成直接相关,与虫草素合成密切相关。
核苷、核苷酸及类似物很多与虫草素合成相关,因此是最重点关注的差异代谢物,CM09 vs CM08与CM10 vs CM08差异代谢物中核苷、核苷酸及其类似物分别为10种和11种(表1),二者共同的差异代谢物有5种,分别为虫草素(3′-deoxyadenosine)、2′-脱氧腺苷(2′-deoxyadenosine)、一磷酸腺苷(adenosine monophosphate,AMP)、腺苷(adenosine)和尿嘧啶(uracil)。其中虫草素的VIP值最大,P值最小,说明虫草素在核苷类差异代谢物中影响强度最大,这也与正突变菌株CM09虫草素产量提高和负突变菌株CM10虫草素产量降低的特性相符合。
对正负离子模式下CM09 vs CM08与CM10 vs CM08的所有差异代谢物进行分析对比,发现CM09 vs CM08与CM10 vs CM08中相对含量上调和下调相反的差异代谢物有7种,虫草素、2′-脱氧腺苷、腺苷、喷司他丁、ADP-核糖和D-氨基葡萄糖-1-磷酸这6种差异代谢物在CM09 vs CM08中下调,在CM10 vs CM08中上调;AMP在CM09 vs CM08中上调,在CM10 vs CM08中下调,差异代谢物详细信息见表1中1~7号。
表1 CM09 vs CM08和CM10 vs CM08的差异代谢物
Table 1 Differential metabolites of CM09 vs CM08 and CM10 vs CM08
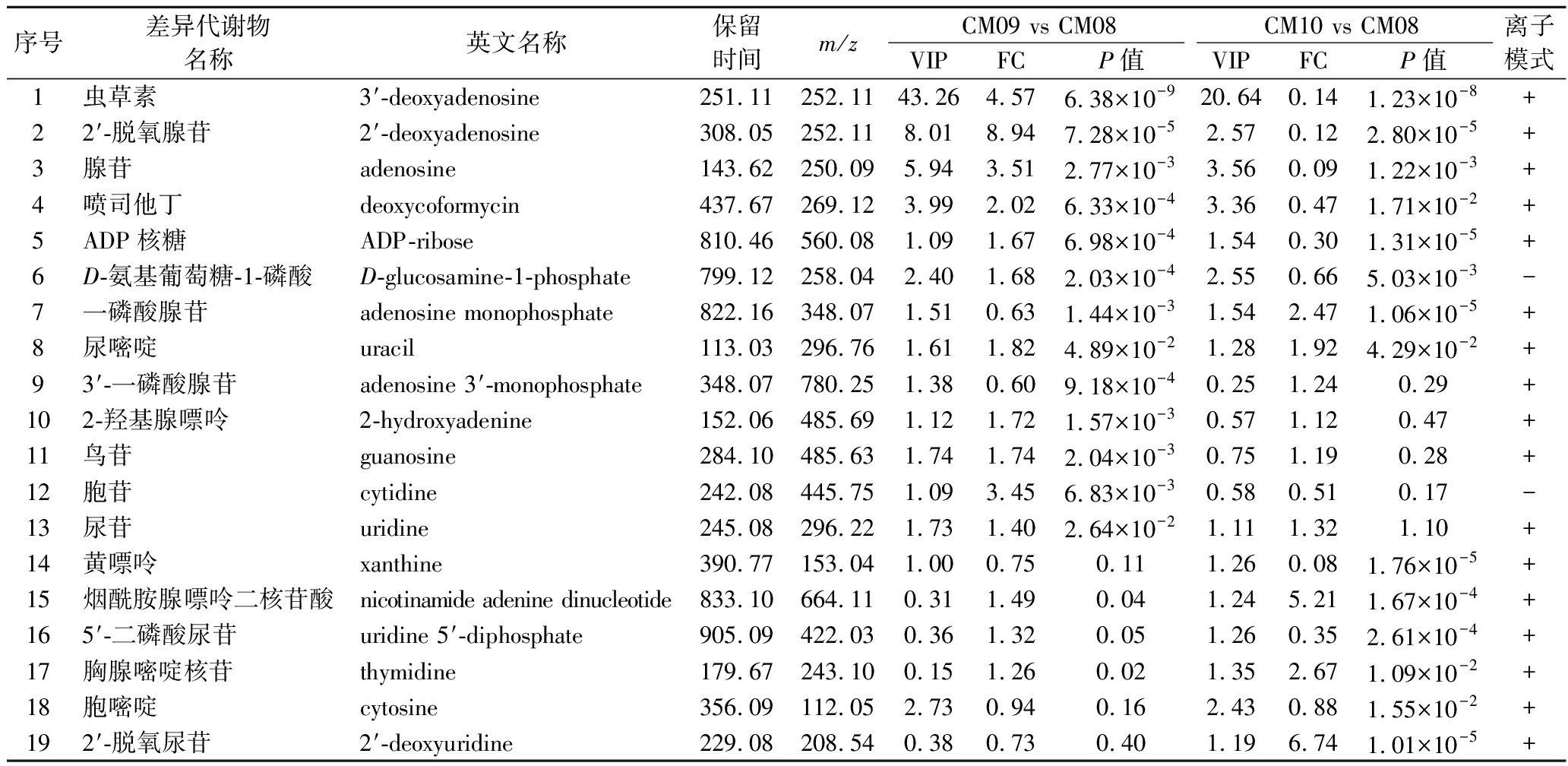
序号差异代谢物名称英文名称保留时间m/zCM09 vs CM08CM10 vs CM08VIPFCP值VIPFCP值离子模式1虫草素3′-deoxyadenosine251.11252.1143.264.576.38×10-920.640.141.23×10-8+22′-脱氧腺苷2′-deoxyadenosine308.05252.118.018.947.28×10-52.570.122.80×10-5+3腺苷adenosine143.62250.095.943.512.77×10-33.560.091.22×10-3+4喷司他丁deoxycoformycin437.67269.123.992.026.33×10-43.360.471.71×10-2+5ADP核糖ADP-ribose810.46560.081.091.676.98×10-41.540.301.31×10-5+6D-氨基葡萄糖-1-磷酸D-glucosamine-1-phosphate799.12258.042.401.682.03×10-42.550.665.03×10-3-7一磷酸腺苷adenosine monophosphate822.16348.071.510.631.44×10-31.542.471.06×10-5+8尿嘧啶uracil113.03296.761.611.824.89×10-21.281.924.29×10-2+93′-一磷酸腺苷adenosine 3′-monophosphate348.07780.251.380.609.18×10-40.251.240.29+102-羟基腺嘌呤2-hydroxyadenine152.06485.691.121.721.57×10-30.571.120.47+11鸟苷guanosine284.10485.631.741.742.04×10-30.751.190.28+12胞苷cytidine242.08445.751.093.456.83×10-30.580.510.17-13尿苷uridine245.08296.221.731.402.64×10-21.111.321.10+14黄嘌呤xanthine390.77153.041.000.750.111.260.081.76×10-5+15烟酰胺腺嘌呤二核苷酸nicotinamide adenine dinucleotide833.10664.110.311.490.041.245.211.67×10-4+165′-二磷酸尿苷uridine 5′-diphosphate905.09422.030.361.320.051.260.352.61×10-4+17胸腺嘧啶核苷thymidine179.67243.100.151.260.021.352.671.09×10-2+18胞嘧啶cytosine356.09112.052.730.940.162.430.881.55×10-2+192′-脱氧尿苷2′-deoxyuridine229.08208.540.380.730.401.196.741.01×10-5+
此外,在CM08、CM09和CM10菌丝体中鉴定得到的代谢物有D-甘露醇、左旋肉碱、麦角硫因、L-苹果酸、烟酰胺、甜菜碱(betaine)、喷司他丁、乌苯美司(bestatin),这些都是重要的生物活性成分。其中左旋肉碱是一种促使脂肪转化为能量的类氨基酸,作为食品添加剂广泛用于婴幼儿食品、减肥食品、运动员食品、中老年人的营养补充剂、素食主义者的营养强化剂和动物饲料添加剂等;麦角硫因是一种天然抗氧化剂,具有很强的抗氧化活性;喷司他丁是一种抗代谢类抗肿瘤临床用药,对急性及慢性淋巴细胞白血病、毛细胞白血病、非霍奇金淋巴瘤、皮肤T细胞淋巴瘤及毛细胞白血病有效,对抗干扰素的病人使用本品仍非常有效(来源:尼喷提药品说明书);乌苯美司是一种临床用药,有胶囊和片剂等剂型,可增强免疫功能,用于抗癌化疗、放疗的辅助治疗,老年性免疫功能缺陷等。可配合化疗、放疗及联合应用于白血病、多发性骨髓瘤、骨髓增生异常综合症及造血干细胞移植后,以及其它实体瘤患者(来源:乌苯美司药品说明书)。由此可见,蛹虫草中含有多种待开发研究的活性化合物,具有很高的药用价值。
2.4 差异代谢物KEGG代谢通路富集分析
对CM08、CM09和CM10菌株得到的差异代谢物在KEGG数据库中检索并进行注释和富集分析,发现CM09 vs CM08和CM10 vs CM08差异代谢物分别富集代谢通路为108条和143条,显著富集代谢通路分别为40条和53条,显著富集代谢通路具体名称如图3所示。对CM09 vs CM08和CM10 vs CM08显著富集的代谢通路差异丰度得分进行绘图(图3)。
图3-a显示在所有代谢通路中只有PI3K-Akt信号途径(PI3K-Akt signaling pathway)和FoxO信号途径(FoxO signaling pathway)这2条代谢通路上的差异代谢物均为下调,得分值为-1;有23条代谢通路上的差异代谢物全部上调,得分值为1,包括磷酸戊糖途径(pentose phosphate pathway)和三羧酸循环(TCA cycle)等代谢通路;有9条代谢通路上的差异代谢物既有上调又有下调,得分值为0~1,包括嘌呤代谢(purine metabolism)和ABC转运蛋白(ATP-binding cassette transporters)等代谢通路;有6条代谢通路上的差异代谢物上调和下调的数量相等,得分值为0。图3-b显示在所有代谢通路中只有嘌呤代谢中差异代谢物下调的数量大于上调的数量,得分值为-0.33;有26条代谢通路上的差异代谢物全部上调,得分值为1,包括三羧酸循环和氨酰tRNA生物合成(aminoacyl-tRNA biosynthesis,ko00970)等代谢通路;有19条代谢通路上的差异代谢物既有上调又有下调,得分值为0~1,包括ABC转运蛋白和氨基酸生物合成(biosynthesis of amino acids,ko01230)等代谢通路;有7条代谢通路上的差异代谢物上调和下调的数量相等,得分值为0。总体来说,CM10 vs CM08显著富集的差异代谢通路数量比CM09 vs CM08多13条,可能与CM10 vs CM08差异代谢物数量多有关,CM09 vs CM08和CM10 vs CM08差异代谢物共同富集的代谢通路101条,显著富集的共同代谢通路有31条。CM09和CM10这2个菌株嘌呤代谢途径差异较大,其中CM09的嘌呤代谢途径中差异代谢物既有上调也有下调,而CM10的嘌呤代谢途径中所有差异代谢物均为下调,嘌呤代谢是直接与虫草素合成途径关联的代谢途径,CM10中下调的代谢产物与虫草素合成能力降低关系密切。

a-CM09 vs CM08;b-CM10 vs CM08
图3 显著富集代谢通路的差异丰度得分图
Fig.3 Differential abundance score of significantly enriched metabolic pathways 注:图中Y轴表示差异通路的名称,X轴坐标表示差异丰度得分(DA socre);DA socre为代谢途径中所有代谢物的整体总变化,得分1表示该通路中所有鉴定到的代谢物表达趋势上调,-1表示该通路中所有鉴定到的代谢物表达趋势下调。线段的长度表示DA score的绝对值,线段端点的圆点大小表示该通路中代谢物的数目多少,点越大表示代谢物数目越多,线段和圆点颜色的深浅和DA score值成比例,红色越 深,表示该通路整体表达情况越倾向于上调,蓝色越深,表示该通路整体表达情况倾向于下调
2.5 虫草素合成相关代谢通路分析
自从上世纪50年代虫草素被发现时起,其合成途径一直是研究的热点,但是目前仍无明确的合成途径。结合现有的文献报道[22-23,25,32],根据出发化合物不同可以分为以葡萄糖为起始的从头合成途径和以腺苷、mRNA为起始的直接合成途径,(1)从葡萄糖出发,与2′-脱氧腺苷的合成途径类似,葡萄糖(glucose)→葡萄糖-6-磷酸(glucose-6-P)→核糖-5-磷酸(ribose-5-P)→ 5-磷酸核糖-1-焦磷酸(5-phosphoribosyl 1-pyrophosphate, PRPP)→次黄嘌呤核苷酸(hypoxanthine nucleotide, IMP)→腺苷酸琥珀酸(adenylosuccinate)→AMP→二磷酸腺苷(ADP)→ 3′-二磷酸脱氧腺苷(3′-dADP)→3′-一磷酸脱氧腺苷(3′-dAMP)→虫草素;(2)从腺苷出发,腺苷→3′-AMP→2′-羰基-3′-脱氧腺苷(2′-carbonyl-3′-deoxyadenosine, 2′-C-3′-dA)→虫草素;(3)从mRNA出发,mRNA→2′, 3′-环磷酸腺苷(2′,3′-cyclic adenosine phosphate, 2′,3′-cAMP)→3′-AMP→2′-C-3′-dA→虫草素。KEGG数据库中无虫草素合成途径,因此本研究对虫草素合成相关的代谢通路进行分析。嘌呤代谢途径有很多代谢产物与虫草素合成相关;磷酸戊糖途径主要是合成核糖,合成的核糖再进入嘌呤代谢途径;虫草素是在细胞的脂滴内合成的[25],合成后要迅速运输到细胞外以减小对细胞自身的毒性,因此负责转运虫草素的转运蛋白非常重要,主要是ABC转运蛋白途径。综上所述,嘌呤代谢途径、磷酸戊糖途径和ABC转运蛋白途径与虫草素合成途径密切相关,主要对这3条代谢途径上富集的差异代谢物进行分析。
在嘌呤代谢途径中,CM09 vs CM08中富集的差异代谢物有6种,包括AMP、腺苷、鸟苷、ADP-核糖、2′-脱氧腺苷和3′-AMP;CM10 vs CM08中富集的差异代谢物有6种,包括AMP、L-谷氨酰胺、腺苷、ADP-核糖、黄嘌呤(xanthine)和2′-脱氧腺苷。在磷酸戊糖途径中,CM09 vs CM08中富集的差异代谢物有4种,包括D-核糖(D-ribose)、D-葡萄糖酸(D-gluconate)、甘油酸(glyceric acid)、2′-脱氧-D-核糖(2′-deoxy-D-ribose);CM10 vs CM08中富集的差异代谢物有2种,包括3-磷酸-D-甘油酯(3-phospho-D-glycerate)和甘油酸。在ABC转运蛋白途径中,CM09 vs CM08中富集的差异代谢物有16种,包括D-核糖、2′-脱氧腺苷、腺苷等;CM10 vs CM08中富集的差异代谢物有15种,包括腺苷、2′-脱氧腺苷、L-谷氨酸和L-谷氨酰胺等。
ADP-核糖是嘌呤代谢途径中的起始化合物,通过进一步反应合成核糖-5-P,嘌呤代谢途径中的核糖-5-P和PRPP还有一部分来自于磷酸戊糖代谢途径,在磷酸戊糖途径中核糖-5-P可以生成PRPP和D-核糖(D- ribose),在CM09 vs CM08中,ADP-核糖(FC值为1.67)相对含量上调,可能导致核糖-5-P产量增加,但是本研究中核糖-5-P相对含量并未有显著变化,推测可能在磷酸戊糖代谢途径中多余的核糖-5-P生成了D-核糖,致使D-核糖(FC值为2.20)的相对含量上调;在CM10 vs CM08中,ADP-核糖(FC值为0.30)相对含量下调,可能导致核糖-5-P产量降低,但是本研究中核糖-5-P相对含量并未有显著变化,可能部分来源于磷酸戊糖等代谢途径。
AMP是嘌呤代谢途径中的重要中间产物,也是虫草素合成中的重要中间产物,AMP有4种去向:一是在5′-核苷酸酶(5′-NT)的作用下生成腺苷,腺苷也可以在腺苷激酶(adenosine kinase, ADK)的作用下生成AMP;二是生成2′-ADP、2′-dADP、2′-dAMP和2′-脱氧腺苷;三是在AMP脱氨酶(AMP deaminase)作用下生成IMP;四是生成3′-ADP、3′-dADP、3′-dAMP和3′-脱氧腺苷(虫草素)。在CM09 vs CM08中,AMP(FC值0.63)相对含量下调,而其产物虫草素(FC值4.57)、2′-脱氧腺苷(FC值8.94)和腺苷(FC值3.51)相对含量均上调,说明减少的AMP用于合成虫草素、2′-脱氧腺苷和腺苷;CM10 vs CM08中AMP(FC值2.47)的相对含量上调,而其产物虫草素(FC值0.14)、2′-脱氧腺苷(FC值0.12)和腺苷(FC值0.09)相对含量均大幅度下调,说明用于合成虫草素、2′-脱氧腺苷和腺苷的AMP消耗较少,因此导致AMP累积而相对含量上调。本研究中AMP的去向主要是2′-脱氧腺苷和腺苷(进一步合成3′-AMP、2′-C-3′-dA,而后是虫草素)。3′-AMP是虫草素合成途径中的重要中间产物,在CM09 vs CM08中,3′-AMP(FC值0.60)相对含量下调,推测是大量的3′-AMP用于合成虫草素而导致相对含量降低;在CM10 vs CM08中,3′-AMP(FC值1.24,P值0.29)相对含量变化不显著,合成虫草素的量较少,因此消耗的3′-AMP的量也较少,所以3′-AMP相对含量差异不显著。
喷司他丁是ADA抑制剂,能够抑制虫草素被ADA降解为3′-脱氧肌苷,从而起到保护虫草素的作用,对虫草素的产量具有重要影响。在CM09 vs CM08中,喷司他丁相对含量显著上调(FC值2.02),说明在正突变菌株CM09的菌丝体中存在较多的喷司他丁,能够对虫草素起到很好的保护作用免于被降解,利于虫草素的积累和转运出胞外,因此CM09中虫草素产量大幅度提高;而在CM10 vs CM08中喷司他丁相对含量显著下调(FC值0.47),说明在负突变菌株CM10的菌丝体中喷司他丁含量较少,在没有足够的喷司他丁做保护剂,虫草素合成后易被降解,不利于虫草素的累积,因此CM10中虫草素产量大大降低。
综合上述分析,与出发菌株CM08相比,正负突变菌株CM09和CM10中,与虫草素合成相关的ADP-核糖、AMP、2′-脱氧腺苷、腺苷和3′-AMP等相对含量均有较大差异,且在正负突变菌株中上下调相反,说明上述5种化合物是虫草素合成途径的必要代谢产物。ADP核糖直接合成核糖-5-P,直接进入嘌呤代谢途径;AMP是嘌呤代谢途径的重要中间产物,可以合成腺苷,也可由腺苷合成,是虫草素合成途径中重要中间产物;2′-脱氧腺苷是嘌呤代谢途径中的重要产物;腺苷在Cns3酶的作用下生成3′-AMP,这是腺苷合成虫草素的第一步反应,也是最关键的一步。上述这些虫草素合成相关步骤的阐述对已有报道的虫草素合成途径起到很好的完善作用,即ADP-核糖→核糖-5-P,AMP→腺苷,腺苷→AMP,腺苷→3′-AMP。结合已有的文献报道和本文研究结果,绘制预测虫草素合成途径如图4所示。

图4 虫草素合成途径预测
Fig.4 Predicted biosynthesis pathway of cordycepin 注:purA-腺苷琥珀酸合成酶;purB-腺苷琥珀酸裂解酶; ADK-腺苷激酶;5′-NT-5′-核苷酸酶;RNR-核苷酸还原酶; AK-腺苷酸激酶;ADA-腺苷脱氨酶;Cns1-氧化还原酶GFO/IDH/ MOCA家族或者脱氢酶MviM家族;Cns2-磷酸水解酶依赖金属的 HDc家族;Cns3-ATP磷酸核糖转移酶的N-末端核苷/核苷酸 激酶(NK)和C-末端HisG家族;Cns4-ABC转运蛋白的PDR家族; ???-将虫草素转运到胞外的未知酶
图4中标绿色的反应为本研究印证在蛹虫草中存在的反应步骤,与现有文献报道具有不同之处:(1)本研究预测虫草素合成途径部分与XIA等[25]报道相同,即从腺苷到虫草素这3步反应,但是本研究将虫草素合成途径向前延伸至糖类原料;(2)本研究中未检测到3′-dADP和3′-dAMP,且目前该途径中3′-dAMP到虫草素这一步反应也尚未找到证据证明,因此不能证明虫草素合成途径与2′-脱氧腺苷相似,即从ADP到虫草素;(3)本研究中未检测到2′,3′-cAMP,不能证明虫草素合成途径是从mRNA开始经过2′,3′-cAMP和3′-AMP再合成虫草素。因此结合现有文献报道以及本研究完善的几步反应,预测虫草素合成途径为:ADP-核糖→核糖-5-P→PRPP→IMP→腺苷酸琥珀酸→AMP→腺苷→3′-AMP→2′-C-3′-dA→虫草素。
3 结论
本研究中所用的CM09和CM10是通过对出发菌株CM08进行离子束注入辐射诱变选育得到的,CM09为高产虫草素正突变菌株,CM10为低产虫草素负突变菌株,因此对3个菌株进行代谢组学数据分析更能揭示菌株之间的代谢物差异以及虫草素合成的变化。首先对3个菌株的菌丝体提取测定非靶向代谢组数据,然后对所有代谢产物进行归一化处理,进行统计分析与生物信息学分析,发现CM09 vs CM08中差异代谢物64种,其中52种差异代谢物上调,12种差异代谢物下调,CM10 vs CM08中差异代谢物147种,其中116种差异代谢物上调,31种差异代谢物下调。CM09 vs CM08与CM10 vs CM08的共同差异代谢物总计30种,其中虫草素、2′-脱氧腺苷、喷司他丁、ADP-核糖、腺苷和D-氨基葡萄糖-1-磷酸这6种差异代谢物在CM09 vs CM08中相对含量下调,在CM10 vs CM08中相对含量上调;AMP在CM09 vs CM08中相对含量上调,在CM10 vs CM08中相对含量下调。KEGG代谢通路富集分析结果表明,CM09 vs CM08差异代谢物富集到108条代谢通路,显著富集代谢通路40条,CM10 vs CM08差异代谢物富集到143条代谢通路,显著富集代谢通路总计53条,CM09 vs CM08和CM10 vs CM08差异代谢产物共同富集代谢通路101条,显著富集的共同代谢通路有31条,其中嘌呤代谢途径、磷酸戊糖代谢途径、ABC转运蛋白途径中富集的差异代谢物腺苷、AMP、ADP-核糖、2′-脱氧腺苷、3′-AMP等均是虫草素合成途径中的关键化合物,对虫草素合成具有重要影响。结合已有文献报道虫草素合成途径及本研究结果,预测完善虫草素合成途径为:ADP-核糖→核糖-5-磷酸→5-磷酸核糖-1-焦磷酸→次黄嘌呤核苷酸→腺苷酸琥珀酸→AMP→腺苷→3′-AMP→2′-羰基-3′-脱氧腺苷→虫草素。
[1] 黄年来,林志彬, 陈国良, 等.中国食药用菌学[M].上海:上海科学技术文献出版社, 2010:1 763.
[2] LIANT T, YANG T, YANG T, et al.Variations of SSU rDNA group I introns in different isolates of Cordyceps militarisand the loss of an intron during cross-mating[J].Journal of Microbiology, 2014, 52(8):659-666.
[3] 朱丽娜,刘艳芳, 张红霞, 等.培养基和栽培方式对蛹虫草子实体活性成分的影响[J].菌物学报, 2021, 40(11):3 034-3 045.
ZHU L N, LIU Y F, ZHANG H X, et al.Effects of culture media and culture technique on the bioactive and nutrition components in Cordyceps militarisfruiting bodies[J].Mycosystema, 2021, 40(11):3 034-3 045.
[4] 于悦,陈卓, 王亚非, 等.蛹虫草胞外多糖的制备、结构分析及其免疫活性[J].食品科学, 2021, 42(23):106-113.
YU Y, CHEN Z, WANG Y F, et al.Preparation, structure and immuneomodulatory activity of exopolysaccharide from Cordyceps militaris[J].Food Science, 2021, 42(23):106-113.
[5] 刘朋肖,马婕馨, 刘警鞠, 等.优良性状蚕蛹虫草的筛选及高产虫草素液态发酵条件优化[J].菌物学报, 2021, 40(11):3 046-3 057.
LIU P X, MA J X, LIU J J, et al.Screening of Cordyceps militariswith excellent traits and optimization of liquid fermentation conditions for highly yielding cordycepin[J].Mycosystema, 2021, 40(11):3 046-3 057.
[6] 刘桂君,周思静, 林金星.培养基质对蛹虫草中虫草酸及核苷类物质的影响[J].食品与发酵工业, 2015, 41(5):94-98.
LIU G J, ZHOU S J, LIN J X.Effects of culture medium on cordycepic acid and nucleosides in Cordyceps militaris[J].Food and Fermentation Industries, 2015, 41(5):94-98.
[7] 孙志双,姜小天, 施溯筠.HPLC法同时测定蛹虫草中虫草素、腺苷和麦角甾醇的含量[J].食品研究与开发, 2020, 41(19):173-176.
SUN Z S, JIANG X T, SHI S Y.Determination of cordycepin, adenosineand ergosterol in Cordyceps militarisby HPLC[J].Food Research and Development, 2020, 41(19):173-176.
[8] 刘宽博,王芬, 柴一秋, 等.广义虫草类真菌来源的N6-(2-羟乙基)腺苷的研究开发现状与思考[J].菌物学报, 2017, 36(1):6-13.
LIU K B, WANG F, CHAI Y Q, et al.Research and exploitation of N6-(2-hydroxyethyl)-adenosine from Cordyceps s.l.:Progress and problems[J].Mycosystema, 2017, 36(1):6-13.
[9] CUNNINGHAMK G, MANSON W, SPRING F S, et al.Cordycepin, a metabolic product isolated from cultures of Cordyceps militaris(Linn.) link[J].Nature, 1950, 166(4 231):949.
[10] LEEJ H, HONG S M, YUN J Y, et al.Anti-cancer effects of cordycepin on oral squamous cell carcinoma proliferation and apoptosis in vitro[J].Journal of Cancer Therapy, 2011, 2(2):224-234.
[11] WEIC L, YAO X J, JIANG Z B, et al.Cordycepin inhibits drug-resistance non-small cell lung cancer progression by activating AMPK signaling pathway[J].Pharmacological Research, 2019, 144:79-89.
[12] LEED, LEE W Y, JUNG K, et al.The inhibitory effect of cordycepin on the proliferation of MCF-7 breast cancer cells, and its mechanism:An investigation using network pharmacology-based analysis[J].Biomolecules, 2019, 9(9):414.
[13] CHOUS M, LAI W J, HONG T W, et al.Synergistic property of cordycepin in cultivated Cordyceps militaris-mediated apoptosis in human leukemia cells[J].Phytomedicine, 2014, 21(12):1 516-1 524.
[14] LIAOY H, LING J Y, ZHANG G Y, et al.Cordycepin induces cell cycle arrest and apoptosis by inducing DNA damage and up-regulation of p53 in Leukemia cells[J].Cell Cycle, 2015, 14(5):761-771.
[15] UEDAY, MORI K, SATOH S, et al.Anti-HCV activity of the Chinese medicinal fungus Cordyceps militaris[J].Biochemical and Biophysical Research Communications, 2014, 447(2):341-345.
[16] CUNNINGHAMK G, HUTCHINSON S A, MANSON W, et al.Cordycepin, a metabolic product from cultures of Cordyceps militaris(Linn.) link.Part I.Isolation and characterisation[J].Journal of the Chemical Society (Resumed), 1951(0):2 299-2 300.
[17] LEIJ J, WEI Y L, SONG P C, et al.Cordycepin inhibits LPS-induced acute lung injury by inhibiting inflammation and oxidative stress[J].European Journal of Pharmacology, 2018, 818:110-114.
[18] SHINY K, YE M B, KIM S W, et al.3’-Deoxyadenosine inhibitspre-adipocyte differentiation and biosynthesis of triacylglycerol in 3T3-L1 cells[J].Journal of Functional Foods, 2014, 6:331-338.
[19] TSAIY J, LIN L C, TSAI T H.Pharmacokinetics of adenosine and cordycepin, a bioactive constituent of Cordyceps sinensisin rat[J].Journal of Agricultural and Food Chemistry, 2010, 58(8):4 638-4 643.
[20] SCHWENZERH, ZAN E D, ELSHAN M, et al.The novel nucleoside analogue ProTide NUC-7738 overcomes cancer resistance mechanisms in vitro and in a first-in-human phase I clinical trial[J].Clinical Cancer Research, 2021, 27(23):6 500-6 513.
[21] KREDICHN M, GUARINO A J.Studies on the biosynthesis of cordycepin[J].Biochimica et Biophysica Acta, 1961, 47(3):529-534.
[22] SUHADOLNIKR J, CORY J G.Further evidence for the biosynthesis of cordycepin and proof of the structure of 3-deoxyribose[J].Biochimica et Biophysica Acta (BBA)-Specialized Section on Nucleic Acids and Related Subjects, 1964, 91(4):661-662.
[23] LENNONM B, SUHADOLNIK R J.Biosynthesis of 3’-deoxyade-nosine by Cordyceps militaris[J].Biochimica et Biophysica Acta (BBA)-Nucleic Acids and Protein Synthesis, 1976, 425(4):532-536.
[24] ZHENGP, XIA Y L, XIAO G H, et al.Genome sequence of the insect pathogenic fungus Cordyceps militaris, a valued traditional Chinese medicine[J].Genome Biology, 2011, 12(11):R116.
[25] XIAY L, LUO F F, SHANG Y F, et al.Fungal cordycepin biosynthesis is coupled with the production of the safeguard molecule pentostatin[J].Cell Chemical Biology, 2017, 24(12):1 479-1 489.
[26] 王升厚,牛世莉, 徐方旭, 等.基于代谢组学的功能性蛹虫草成分研究[J].微生物学杂志, 2018, 38(2):1-7.
WANG S H, NIU S L, XU F X, et al.Metabolomic analysis for component of functional Cordyceps militaris[J].Journal of Microbiology, 2018, 38(2):1-7.
[27] CHENL, LIU Y T, GUO Q F, et al.Metabolomic comparison between wild Ophiocordyceps sinensisand artificial cultured Cordyceps militaris[J].Biomedical Chromatography, 2018:e4279.
[28] 李亚洁,温志新, 孟楠, 等.柞蚕蛹培养蛹虫草不同时间后的代谢组分析[J].菌物学报, 2021, 40(5):1 023-1 038.
LI Y J, WEN Z X, MENG N, et al.Metabolomic analyses of tussah pupa-cultivated Cordyceps militarisat different growth stages[J].Mycosystema, 2021, 40(5):1 023-1 038.
[29] 蔡昭宁.不同碳源对蛹虫草液体发酵代谢组的影响及发酵液抑菌能力探究[D].重庆:西南大学, 2016.
CAI Z N.Effects of different carbon sources on metabolome of Cordyceps militarisfermentation and preliminary study on the antibacterial ability of the zymotic fluid[D].Chongqing:Southwest University,2016.
[30] 秦鹏,路等学, 赵玉卉, 等.虫草素产量不同的蛹虫草菌株代谢组差异[J].菌物学报, 2021, 40(5):1 039-1 053.
QIN P, LU D X, ZHAO Y H, et al.Differential metabolomic analyses of Cordyceps militarisstrains with different capacity for cordycepin production[J].Mycosystema, 2021, 40(5):1 039-1 053.
[31] 何亚琼,彭凡, 赵铖, 等.人工培养柞蚕蝉花不同部位的代谢组差异[J].微生物学通报, 2021, 48(2):480-492.
HE Y Q, PENG F, ZHAO C, et al.Metabolomic differences amongdifferent parts of Isaria cicadaecultured on Antheraea pernyi[J].Microbiology China, 2021, 48(2):480-492.
[32] LINS, LIU Z Q, XUE Y P, et al.Biosynthetic pathway analysis for improving the cordycepin and cordycepic acid production inHirsutella sinensis[J].Applied Biochemistry and Biotechnology, 2016, 179:633-649.