大豆蛋白,如大豆分离蛋白(soy protein isolate,SPI)作为大宗植源性蛋白的重要来源,具有多种优良的功能特性与极高的营养价值,在食品加工和产品开发等领域受到广泛应用。由于大豆蛋白具有两亲性(亲水性和疏水性),越来越多的研究者开始关注其乳化和起泡等界面功能性质。然而大豆蛋白的致密球形结构使得蛋白质分子在界面难以展开,导致界面性质较差,限制了其在食品工业上的应用[1]。大豆蛋白主要由β-伴大豆球蛋白(β-conglycinin,7S)和大豆球蛋白(glycinin,11S)组成,约占大豆蛋白总含量的70%[2]。7S蛋白分子质量较小(150~200 kDa),是由α亚基、α′亚基和β亚基组成的三聚体;而11S蛋白分子质量较大(约360 kDa),是由酸性多肽链A和碱性多肽链B通过二硫键相连而成的三聚体进一步堆叠形成的六聚体[3]。7S/11S蛋白作为大豆蛋白的主要蛋白,常用作起泡剂和乳化剂。但各自的界面功能也因二者的分子质量、蛋白结构之间的不同而存在差异。如7S蛋白具有较小的分子质量,可以快速吸附在油水界面上并展开、重排,进而降低界面张力;从而获得较为优异的起泡性和乳化性[4]。与之相比,11S蛋白由于高分子质量和二硫键的特性使对油滴表面的吸附能力降低,乳化效果较差;但在凝胶能力上要优于7S蛋白[5]。这些研究表明7S/11S蛋白不同的结构特性可能会对界面特性产生不同影响。
近年来,针对大豆蛋白的界面性质的提升进行了大量的研究。其中大多数主要集中于传统的改性方法,如物理加工、化学改性及酶修饰,而对酚类小分子改性方式研究较少[6]。基于多酚与蛋白的相互作用构建新型复合体系逐渐成为学者们的研究热点。GUO等[7]利用绿原酸共价修饰SPI,在80 μmol/L的绿原酸用量时,蛋白的起泡性、乳化性与抗氧化能力均得到显著提升;CHEN等[8]发现适宜浓度的茶多酚与高压处理协同降低大豆蛋白的表面疏水性,并将蛋白的乳化能力提升约3倍。周思多[9]研究表明绿原酸、没食子酸与表没食子儿茶素没食子酸酯3种不同多酚均可与大豆7S蛋白结合,并使7S蛋白表面疏水性降低。然而,这些研究大多数关注于大豆蛋白混合物如大豆分离蛋白(soybean protein isolate,SPI),但对于大豆蛋白具体组分如7S/11S蛋白鲜有研究。大豆7S/11S蛋白在分子质量、构象等方面的差异,使二者在与多酚等小分子互作时界面功能情况各异[10]。因此,深入了解多酚对大豆蛋白具体组分界面功能的影响差异十分必要。
黑米中富含花青素,其中以矢车菊素-3-O-葡萄糖苷(cyanidin-3-glucoside,C3G)的含量居多[11]。C3G是类黄酮类植物多酚中典型的花青素代表之一,具有多羟基取代的“C6-C3-C6”结构。这种特殊的结构不仅赋予其优异的抗氧化、抗癌抗炎能力与预防、辅助治疗慢性疾病的功效[12],还使C3G与蛋白质有较好的亲和力。已有研究证实C3G可以影响包含大豆蛋白在内的多种蛋白的结构,并在一定程度上改善它们的功能特性。SUI等[13]研究表明,与C3G共价结合后,SPI的多肽链发生解折叠,二级结构改变,起泡性能与乳化性能得到显著改善。MENG等[14]发现C3G主要以疏水相互作用与牛奶中的蛋白质相结合,改变蛋白氨基酸残基的微环境,并显著提升蛋白的抗氧化能力。王婧等[15]制备了C3G-SPI共价复合物,发现蛋白质分子质量分布发生改变,且复合后蛋白的体外消化性与抗氧化能力均得到改善。然而, C3G作为一种优异的功能改性剂,鲜有研究探索其作为界面功能改良剂的潜力[16]。尽管有研究表明C3G的添加能够改善大豆蛋白的功能特性,并通过多光谱技术探索了C3G与大豆7S/11S的相互作用[3, 17],相关研究尚未涉及C3G对大豆蛋白具体组分的界面功能改性效果。因此,深入探究黑米花青素对大豆7S/11S蛋白结构与界面功能特性的影响差异,进一步明晰复合体系结构与功能性质之间的联系是十分必要的。
本文在课题组研究的基础上[18],以大豆7S/11S蛋白和C3G为研究对象,采用荧光光谱技术分析二者的互作情况,探讨两种蛋白三级结构改变的差异性,并通过测定复合物的粒径电位、表面疏水性、起泡/乳化性及其稳定性,揭示C3G对7S/11S蛋白界面功能特性的影响效果。该研究旨在为花青素与大豆蛋白具体组分的互作提供见解,为增强大豆蛋白在食品加工领域中的应用提供参考建议。
1 材料与方法
1.1 材料与试剂
脱脂豆粕,山东禹王实业有限公司;黑米花青素为实验室自制,纯度≥95%(以C3G为标准);葵花籽油,市售;8-苯胺基-1-萘磺酸钠(sodium 8-anilino-1-naphthalenesulfonate,ANS-Na),纯度≥97%,东京化成工业株式会社;其他化学试剂均为分析纯,实验用水为去离子水。
1.2 仪器与设备
ALPHA 1-4LSC冷冻干燥机,德国Christ公司;NANO ZS90粒度及电位分析仪,英国马尔文仪器有限公司;T18高速均质机,德国IKA公司;UV-2600紫外可见分光光度仪、RF-6000荧光分光光度计,日本Shimadzu公司。
1.3 实验方法
1.3.1 大豆7S/11S蛋白的制备
参考WU等[19]的方法并稍作改动。粉碎脱脂豆粕并过100目筛,将得到的脱脂大豆粉分散于10倍体积的去离子水中。室温条件下,先用2 mol/L的NaOH溶液调pH至7.5,随后在4 ℃、10 000×g条件下离心30 min,取上清液加入无水亚硫酸钠,使质量浓度为0.98 g/L,并用2 mol/L的HCl溶液将其pH调至6.4,4 ℃冷藏过夜。以4 ℃、6 500×g的条件离心20 min,沉淀物即为11S蛋白。在上清液中加入NaCl(0.25 mol/L)并用HCl溶液调pH至5.0,4 ℃、10 000×g的条件下离心30 min,用等体积去离子水稀释所得上清液,将pH调至4.8,再以4 ℃、6 500×g的条件离心20 min,沉淀物即为7S蛋白。
利用去离子水充分水洗7S/11S蛋白沉淀物后再次溶解,用2 mol/L的NaOH溶液调pH至7.5,随后透析48 h(3 500 Da),冷冻干燥后即可得到7S/11S蛋白粉末。
1.3.2 大豆7S/11S蛋白-黑米花青素复合体系的制备
用10 mmol/L PBS(pH 7.0)溶解7S/11S蛋白粉末,室温下磁力搅拌2 h,4 ℃下过夜充分水化。按照m(7S/11S蛋白)∶m(花青素)分别为20∶0、20∶1、20∶2、20∶4将花青素溶于上述蛋白溶液中,室温避光充分搅拌90 min得到1~4号样品,将未加入花青素的样品1设置为空白对照组,最终蛋白质量浓度为10 mg/mL。
1.3.3 紫外-可见光谱分析
取1.3.2所配制的7S/11S-C3G样品,利用UV-2600紫外可见分光光度仪进行紫外-可见光谱的测定。设置发射波长为200~500 nm,扫描速度为中速,狭缝宽度为2 nm,数据间隔为0.5 nm。
1.3.4 内源荧光光谱分析
取1.3.2所配制的7S/11S-C3G样品置于荧光比色杯中,利用RF-6000荧光分光光度计测定各样品的荧光光谱。设置激发波长为280 nm,发射波长为300~500nm,激发狭缝和发射狭缝均为5 nm,扫描速度600 nm/min,数据间隔为0.2 nm。
1.3.5 外源荧光光谱分析
参考DAI等[20]的方法并稍作调整,以ANS作荧光探针,通过RF-6000荧光分光光度计采集的荧光信号测定蛋白的表面疏水性。取1.3.2配制好的7S/11S-C3G溶液5 mL,加入8 mmol/L的ANS溶液25 μL,漩涡振荡25 s,避光静置15 min。在发射波长400~600 nm测定混合溶液的荧光强度,具体参数设置为:发射狭缝2.5 nm,激发狭缝5 nm,激发波长390 nm,扫描速度1 200 nm/min,数据间隔为0.2 nm。
1.3.6 三维荧光光谱分析
将1.3.2所配制的7S/11S-C3G样品稀释200倍后,分别测定其三维荧光光谱,参数设定如下:激发波长200~350 nm,发射波长200~500 nm,间隔为5 nm;激发狭缝和发射狭缝均为5 nm,扫描速度2 000 nm/min。
1.3.7 粒径与电位分析
将1.3.2所配制的7S/11S-C3G样品用10 mmol/LPBS(pH 7.0)进行适度稀释(溶液蛋白质质量浓度为0.25 mg/mL),避免颗粒过度聚集,随后进行粒径和电位的测定。测定ζ电位前应先将稀释后样品通过0.45 μm水系膜。
1.3.8 起泡特性分析
参考SUI等[13]的方法并稍作调整。取1.3.2中所配制的7S/11S-C3G样品各40 mL,依次利用高速均质机在13 400 r/min的条件下均质60 s,将所产生的泡沫迅速转移至量筒中并对其初始体积进行记录,在25 ℃下静置15 min和30 min后再次记录泡沫体积。样品的起泡性和起泡稳定性分别按照公式(1)和(2)计算。
起泡性![]()
(1)
起泡稳定性![]() 或 起泡稳定性
或 起泡稳定性![]()
(2)
式中:V,均质前样品溶液的体积,mL(40 mL);V0,均质后泡沫的初始体积,mL;V1,均质后15 min泡沫的体积,mL;V2,均质后30 min泡沫的体积,mL。
1.3.9 乳化特性分析
参考李杨等[21]的方法并稍作调整。取1.3.2中所配制的7S/11S-C3G样品以3∶1(体积比)与葵花籽油充分搅拌混合,利用高速均质机以10 000 r/min均质1 min,立即从底部吸取50 μL乳液并用10 g/L十二烷基硫酸钠溶液稀释100倍。振荡混匀后测定样品在500 nm处的吸光度A0与静置10 min后的吸光度A10,样品的乳化性和乳化稳定性分别按照公式(3)和(4)计算:
乳化性![]()
(3)
乳化稳定性![]()
(4)
式中:A0,均质后测定的样品吸光度;A10,静置10 min后样品的吸光度;φ,油相的体积分数,25%;L,比色皿厚度,1 cm;ρ,蛋白质质量浓度,10 mg/mL;n,稀释倍数,100。
1.3.10 数据统计与分析
本研究中每组实验平行重复3次,利用SPSS 26.0软件进行数据整理与ANOVA差异显著性分析,P<0.05为差异显著;采用Origin 8.0进行数据分析与图表制作。
2 结果与分析
2.1 紫外-可见吸收光谱分析
紫外-可见吸收光谱是一种常用来检测蛋白质-多酚复合物构象状态与变化的手段,在230 nm附近的吸收峰反映羰基为主的多肽链骨架结构信息,在280 nm附近的吸收峰主要代表Trp、Tyr等芳香族氨基酸残基的微环境信息。如图1所示,加入C3G后,7S/11S蛋白的吸收光谱两段峰值均升高,前段峰伴有轻微红移,后段峰出现蓝移现象。这说明C3G与7S/11S蛋白形成复合物,促进蛋白中Trp与Tyr残基芳香杂环的π-π*跃迁,使蛋白的多肽链骨架伸展,氨基酸残基周围的极性增加[22],相同的结果在YOU等[23]的研究中也有报道:表没食子儿茶素没食子酸酯可以与SPI结合,并使蛋白的多肽链伸展,暴露出芳香性疏水基团。这表明C3G可能渗入7S/11S蛋白疏水核心发生相互作用,并可能影响了蛋白质氨基酸微环境。
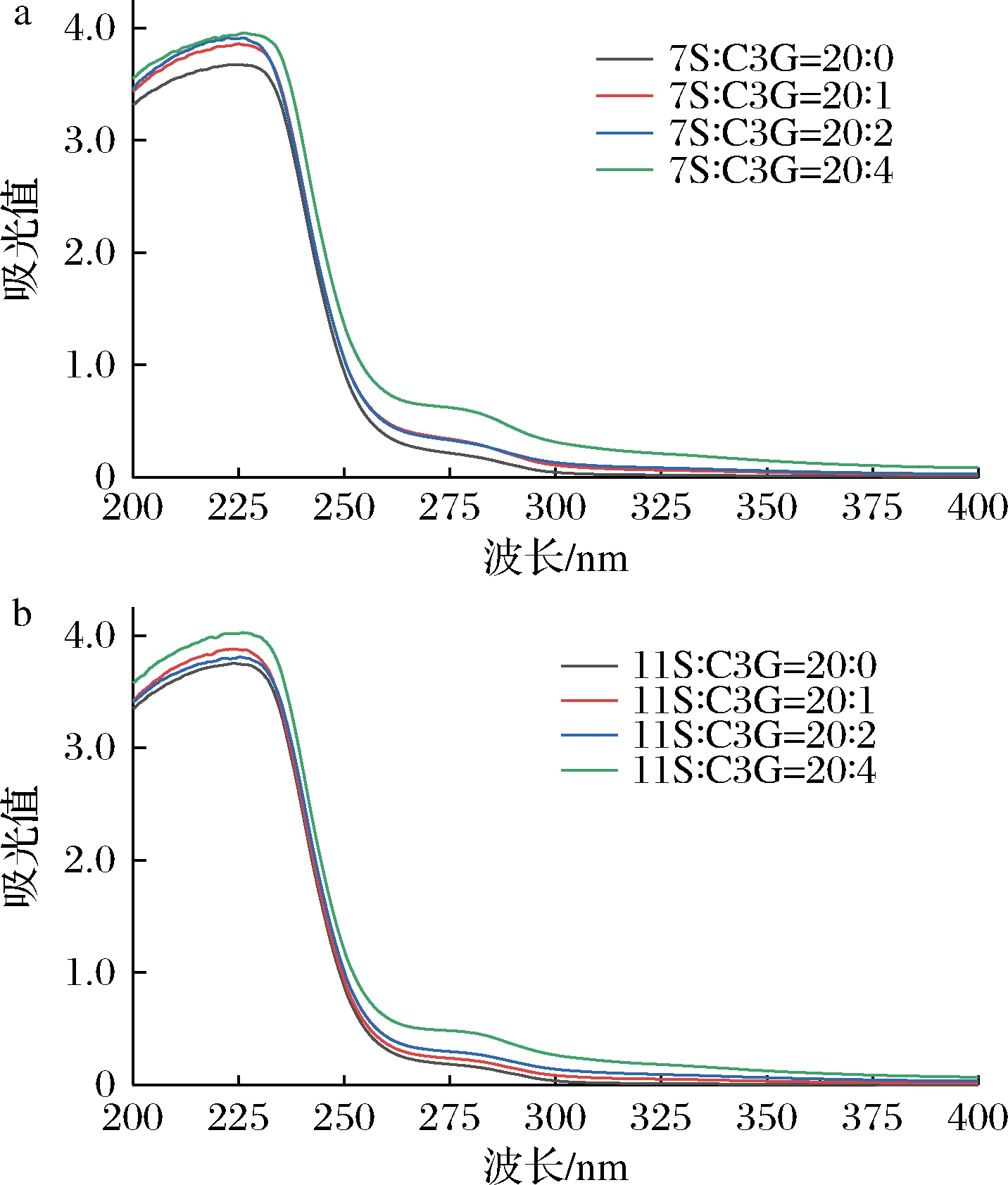
a-7S;b-11S
图1 不同C3G浓度下7S、11S的紫外-可见吸收光谱曲线
Fig.1 UV-Vis spectra of 7S and 11S at different C3G concentration
2.2 内源荧光光谱分析
内源荧光光谱分析已经成为表征与多酚互作后蛋白质三级结构变化的重要手段。在280 nm的激发波长下,蛋白质的内源荧光主要是由Trp和Tyr残基引起的[16]。如图2所示,相较于7S蛋白,11S蛋白的荧光强度更大,说明其具有更高含量的Trp和Tyr残基,与REN等[3]的实验结果一致。加入C3G后,7S/11S蛋白均发生了荧光猝灭现象,且猝灭效果具有明显的浓度依赖性。最大添加量时11S蛋白荧光被猝灭的程度更大,即C3G与11S蛋白的相互作用更强[24]。

a-7S;b-11S
图2 不同C3G浓度下7S、11S的荧光光谱曲线
Fig.2 Fluorescence spectra curve of 7S and 11S at different C3G concentration
此外,C3G的添加使7S/11S蛋白的最大吸收波长均红移2.5 nm,这说明C3G使两种蛋白的肽链舒展,导致掩埋在疏水空腔中的Trp和Tyr残基暴露在极性溶剂中[23]。YIN等[16]发现C3G同样可以猝灭酪蛋白水解物的内源荧光,并出现红移现象,即酪蛋白水解物氨基酸残基周围的疏水性有所降低,与本文的研究一致。
2.3 三维荧光光谱分析
为了进一步了解C3G对7S/11S蛋白构象的影响,我们测定有/无C3G条件下两种蛋白的三维荧光光谱,从而提供蛋白质结构微环境变化更具体的信息。如图3所示,峰a为瑞利散射峰(λEx=λEm),峰1为Trp与Tyr残基产生的特征峰(λEm≈340 nm,λEx≈280 nm)[21]。加入C3G后,7S/11S蛋白的峰a荧光强度分别被猝灭57.28%和57.70%,说明形成了C3G-7S/11S复合物并抑制了光散射作用[25];峰1荧光强度分别被猝灭66.47%和68.03%,且均发生轻微红移,说明C3G改变了7S/11S蛋白的结构,诱导Trp和Tyr残基周围微环境的极性增大[26],这也验证了内源荧光分析的结果。区别于本研究,ZHANG等[27]利用三维荧光分析发现维生素B12同样可以猝灭大豆7S/11S蛋白峰1的荧光强度,但最大吸收峰发生蓝移,说明维生素B12可以使7S/11S蛋白构象折叠,掩埋部分氨基酸残基。大豆蛋白与C3G等小分子结合时由于各自的复杂结构及其他因素的影响,其自身构象变化情况具有特异性,未来应结合其他技术手段深入研究大豆蛋白与C3G之间的相互作用。
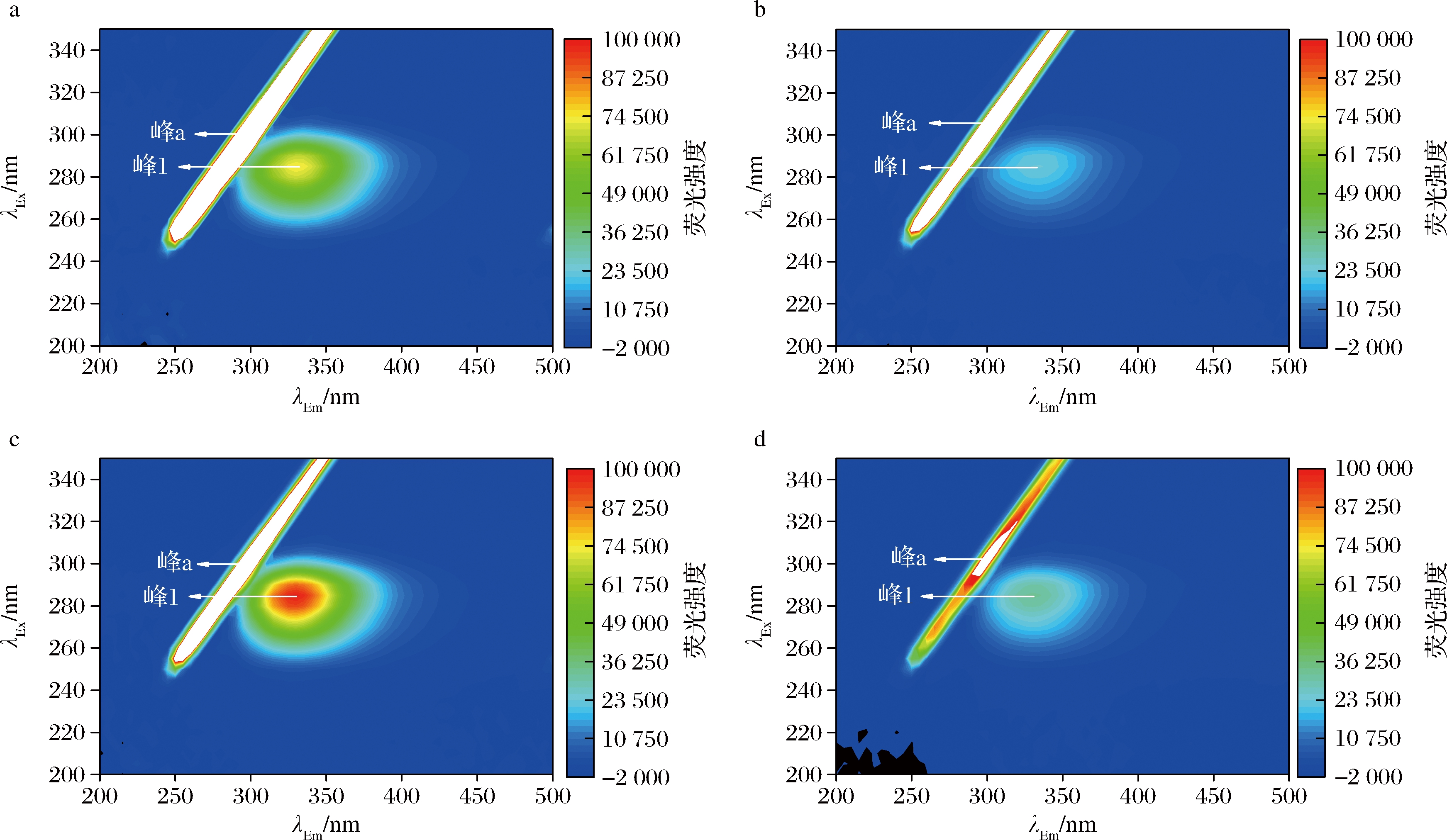
a-7S蛋白;b-7S-C3G复合物;c-11S蛋白;d-11S-C3G复合物
图3 有/无C3G条件下7S/11S蛋白的三维荧光光谱
Fig.3 Three-dimensional fluorescence spectra of 7S/11S with and without C3G
2.4 C3G对7S/11S蛋白外源荧光光谱的影响
图4为7S/11S蛋白的ANS探针荧光光谱,可根据其判断C3G对两种蛋白表面疏水性的影响情况。11S蛋白荧光强度高于7S,即具有更高的表面疏水性,这可能是因为11S蛋白具有更高含量的疏水性基团与不带电荷的氨基酸[3]。随着C3G浓度的增加,两种蛋白的外源荧光强度均降低,即表面疏水性降低,这可能是因为加入的C3G与7S/11S蛋白的疏水区域结合,从而抑制ANS与两种蛋白的疏水基团结合[20];同时C3G含有大量酚羟基等极性基团,提升7S/11S蛋白表面的亲水性;此外,C3G还可能渗入蛋白质的疏水空腔从而使蛋白解折叠,被掩埋的亲水区域暴露,降低蛋白的表面疏水性[17]。WU等[19]发现金丝桃苷使11S蛋白的表面疏水性略有降低,但却显著提高了7S蛋白的表面疏水性,这也说明了7S/11S蛋白结构的差异性会影响它们与多酚的互作,但具体互作效果的差异也被多酚的特异性所左右。
a-C3G-7S;b-C3G-11S
图4 C3G-7S、C3G-11S复合物的表面疏水性
Fig.4 Surface hydrophobicity of C3G-7S complex and C3G-11S complex
2.5 粒径与电位分析
图5为C3G添加前后7S和11S蛋白的平均粒径与ζ电位值。ζ电位越大,代表颗粒间相互吸引程度越大,进而说明蛋白溶液的稳定性越好[28]。7S/11S蛋白的ζ电位均为负值,表明蛋白表面带负电的基团占主导。加入C3G后,7S/11S蛋白的ζ电位绝对值均有所增加,这可能是由于含有较多酚羟基的C3G在中性条件下的去质子化作用使其呈负电性,与蛋白结合后中和蛋白表面的正电荷,从而相对增加了蛋白表面的负电荷,这与江连洲等[25]的研究一致。11S蛋白表面负电荷较少,与C3G的静电斥力更小,因此二者更容易进行结合[3],这与内源荧光光谱的研究结果一致。此外,C3G使两种蛋白解折叠,暴露更多负电基团的可能性也不应忽视[28]。低浓度C3G的加入使7S/11S蛋白平均粒径显著降低(P<0.05),这可能是由于2种蛋白表面的净电荷增加,蛋白颗粒间静电排斥力增大,聚集程度降低,从而使平均粒径减小[29]。但随着C3G浓度提高,2种蛋白平均粒径又显著增大,这可能是由于C3G可以促进7S/11S蛋白交联聚集,并在互作中起主导作用,大于静电排斥力带来的影响,从而形成蛋白颗粒的聚集体,提高平均粒径[29]。此现象在大豆7S蛋白与橙皮素及其糖化产物[30]的互作中也有报道。此外,11S蛋白颗粒的聚集效果相较于7S蛋白更明显,这可能归因于在蛋白浓度等实验条件相同的情况下,分子质量较大的11S蛋白具有更强的自组装能力,从而更易在C3G的诱导下形成聚集体[31]。

a-7S;b-11S
图5 不同C3G浓度下7S、11S的平均粒径与ζ电位
Fig.5 The average particle size and ζ-potential of 7S and 11S at different C3G concentration 注:不同大小写字母代表差异显著,P<0.05(下同)
2.6 乳化特性分析
大豆蛋白含有多种两亲性的氨基酸,因而具有良好的乳化特性,包括乳化性与乳化稳定性。乳化性指7S/11S-C3G复合物吸附并稳定油-水界面的能力,而乳化稳定性是指复合物维持乳化状态的能力[23]。
如图6所示,随着C3G浓度的增加,7S/11S蛋白的乳化性均得到改善,C3G含量最高时(2 mg/mL),7S蛋白乳化性提升12.71%,11S蛋白乳化性提升22.90%(P<0.05);两种蛋白的乳化稳定性均先上升后下降。这可能是由于C3G一方面使7S/11S蛋白解折叠,一些有利于提升蛋白对油-水界面亲和力的基团暴露(如芳香基团);另一方面蛋白结构得到舒展,有利于在油-水界面上有序重排,形成稳定且具有一定黏弹性的界面薄膜,降低表面张力[20, 23]。其次,C3G被公认为是良好的氢供体,与蛋白形成复合物后引入大量酚羟基,从而改善蛋白吸附至界面的能力,这种现象在具有类似结构的蓝莓花青素与乳清分离蛋白和牛血清蛋白的互作中也有报道[32]。同时,很多研究表明多酚使蛋白表面的电荷量增大的现象对蛋白的乳化性和乳化稳定性有促进效果[33],本文对7S/11S蛋白ζ电位的研究结果也印证了这一观点。

a-7S;b-11S
图6 不同C3G浓度下7S、11S的乳化性与乳化稳定性
Fig.6 Emulsification activity and emulsion stability of 7S and 11S at different C3G concentration
此外,本研究中的高质量浓度C3G(2 mg/mL)会降低7S/11S蛋白的乳化稳定性,这一现象可以归因于过量的C3G不仅会使蛋白颗粒交联、聚集,而且C3G优先吸附在界面上并弱化薄膜结构,在黑豆蛋白-槲皮素[34]和SPI-表没食子儿茶素没食子酸酯[23]的相互作用的研究中也得到了相似的现象与结论。
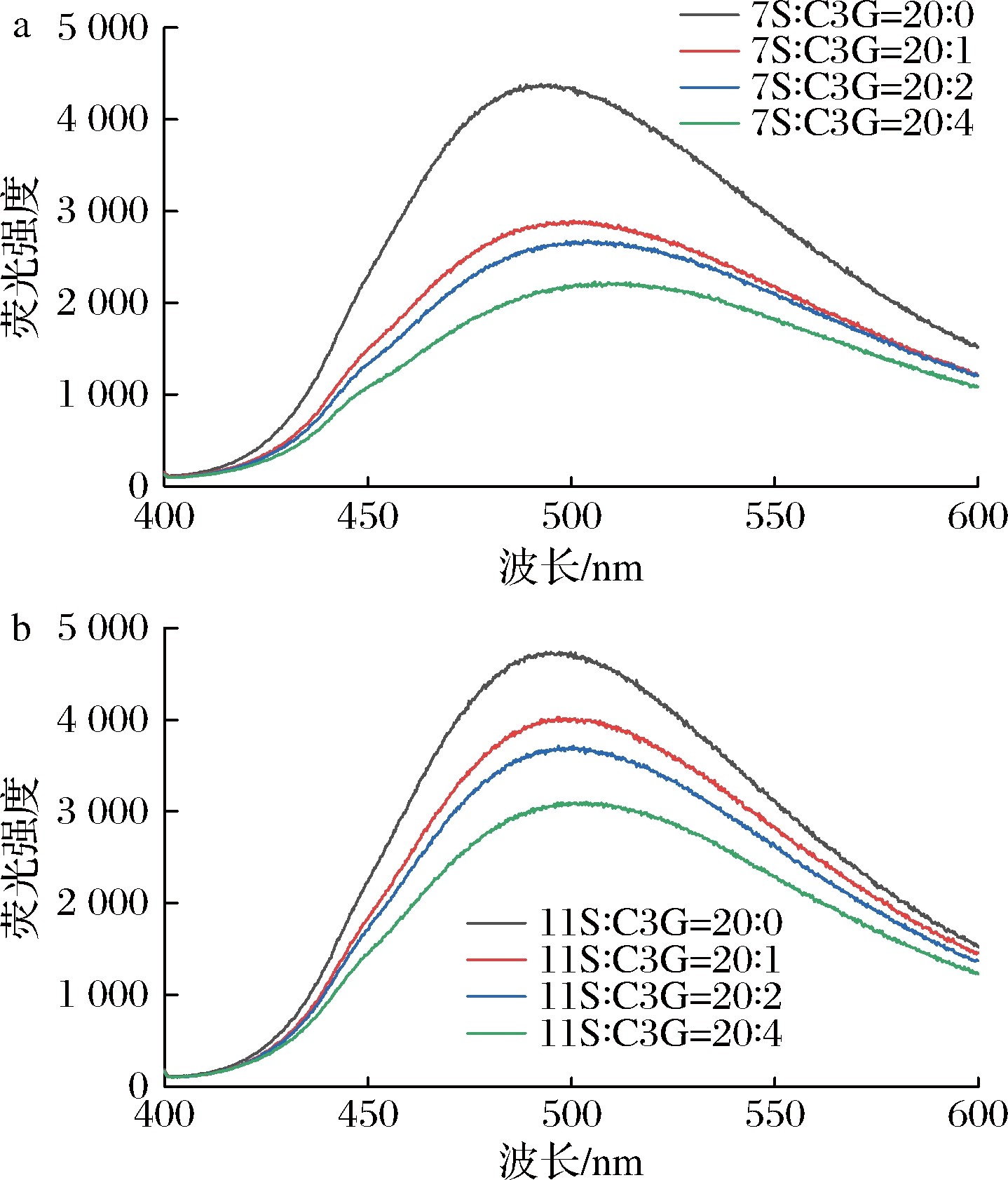
2.7 起泡特性分析
蛋白质的起泡性和起泡稳定性与其化学结构密切相关[13]。如图7所示,未加入C3G的两种蛋白起泡性均较低,这可能归因于大豆蛋白的球形构象和较大的分子质量,界面吸附性较差[4]。而11S蛋白的起泡性明显低于7S蛋白,这可能是因为11S蛋白具有刚性球形结构与更大分子质量,迁移并吸附到界面较为困难,与ZHU等[10]的研究一致。7S和11S蛋白的起泡性均随C3G浓度的增大而得到显著改善(P<0.05),起泡稳定性整体升高,这可能是由于C3G的加入使蛋白结构舒展,更容易被界面吸附并解折叠,并提高蛋白薄膜的韧性,以增强气泡应对外界干扰的灵活性,提升其稳定性[35]。但对于7S蛋白,过度加入C3G反而会降低其起泡稳定性,与RUAN等[35]的实验结果相似,这可能归因于游离C3G大量吸附在界面,弱化了蛋白薄膜强度,不利于维持气泡的稳定性。李杨等[21]发现黑米花青素同样可以一定程度上提升SPI的起泡性与起泡稳定性,说明与大豆蛋白整体与具体组分的起泡特性受黑米花青素的调控效果基本一致。综上,C3G可以作为一种良好的界面性质调节剂,改善大豆蛋白的起泡特性与乳化特性,从而提升大豆蛋白在食品加工中的应用效果,其中C3G-7S蛋白复合物更具应用潜力。
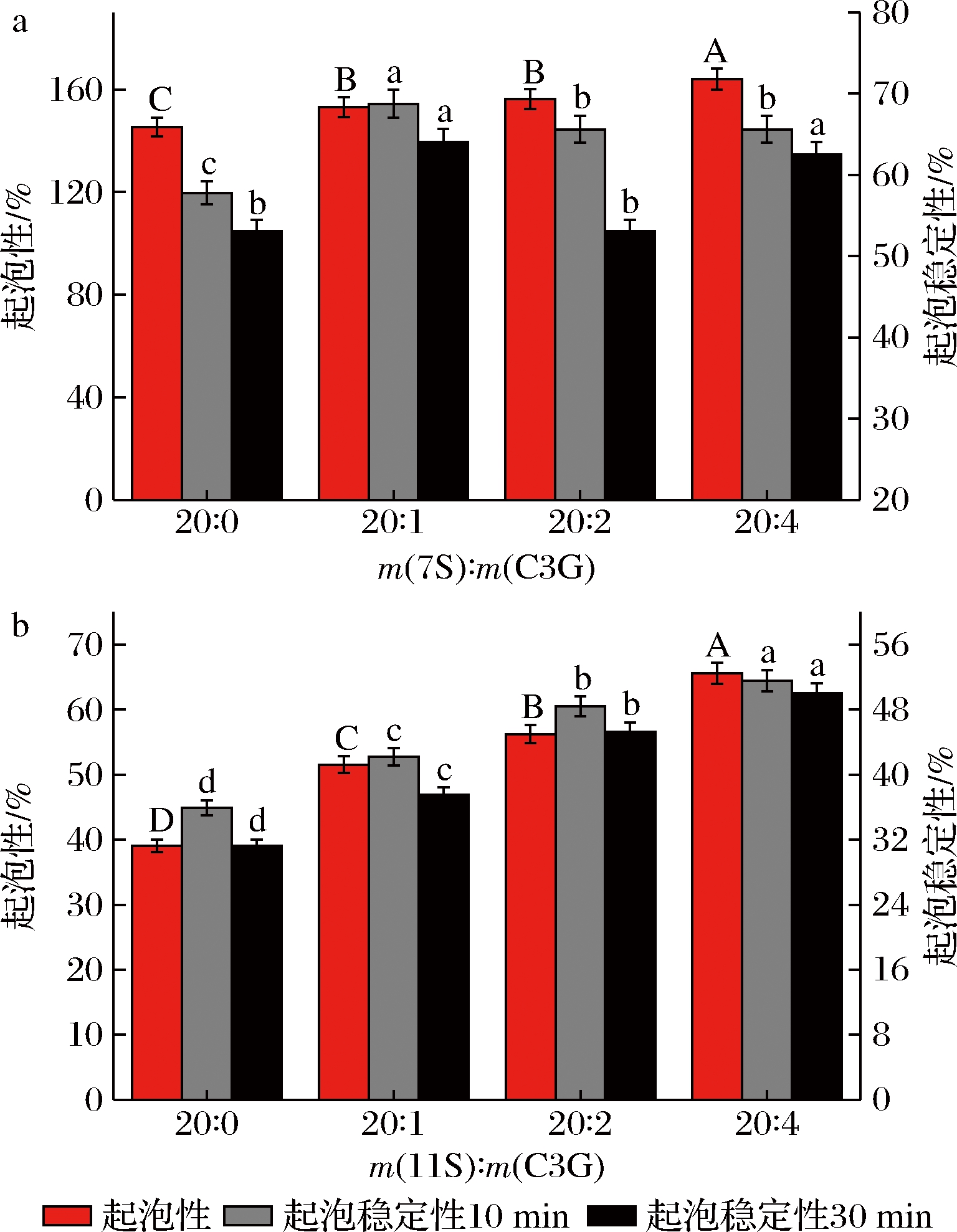
a-7S;b-11S
图7 不同C3G浓度下7S、11S的起泡性与起泡稳定性
Fig.7 Foaming capacity and foaming stability of 7S and 11S at different C3G concentration
3 结论
本研究探讨了C3G对大豆7S/11S蛋白结构、界面特性与理化性质的影响,得到如下结论:
(1)C3G可以与7S/11S蛋白结合形成复合物,且对11S蛋白的亲和度更大;互作过程中,C3G猝灭7S/11S蛋白的内源和外源荧光,蛋白的表面疏水性降低,并且结构发生解折叠,掩埋在疏水空腔中的基团暴露在亲水环境中。
(2)添加小于1 mg/mL的C3G,7S/11S蛋白的ζ电位绝对值增加,平均粒径减小,起到稳定蛋白溶液的作用,且可以提升两种蛋白的起泡性、乳化性及其稳定性。然而,C3G添加量达到2 mg/mL时,促进蛋白交联的效果占主导,平均粒径增大,且自组装能力较强的11S蛋白更易受C3G诱导而相互聚集,同时7S蛋白的起泡稳定性与7S/11S蛋白的乳化稳定性也有一定程度的降低。
(3)7S蛋白具有较小的分子质量与较灵活的结构,加入适量C3G后具有更好的界面功能特性,因此具有更好的应用潜力。同时须注意,在利用C3G等多酚对大豆蛋白进行改性的加工过程中,应严格控制多酚用量。
[1] MOZAFARPOURR, KOOCHEKI A, MILANI E, et al.Extruded soy protein as a novel emulsifier:Structure, interfacial activity and emulsifyingproperty[J].Food Hydrocolloids, 2019, 93:361-373.
[2] SUIX N, ZHANG T Y, JIANG L Z.Soy protein:Molecular structure revisited and recent advances in processing technologies[J].Annual Review of Food Science and Technology, 2021, 12:119-147.
[3] RENC, XIONG W F, LI J, et al.Comparison of binding interactions of cyanidin-3-O-glucoside to β-conglycinin and glycinin using multi-spectroscopic and thermodynamic methods[J].Food Hydrocolloids, 2019, 92:155-162.
[4] SIRISONJ, ISHII T, MATSUMIYA K, et al.Comparison of surface and foaming properties of soy lipophilic protein with those of glycinin and β-conglycinin[J].Food Hydrocolloids, 2021, 112:106345.
[5] RICKERTD A, JOHNSON L A, MURPHY P A.Functional properties of improved glycinin and β-nglycinin fractions[J].Journal of Food Science, 2004, 69(4):FCT303-FCT311.
[6] AKHARUMEF U, ALUKO R E, ADEDEJI A A.Modification of plant proteins for improved functionality:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1):198-224.
[7] GUOK Y, ZHOU G W, LOK U S, et al.Improving interface-related functions and antioxidant activities of soy protein isolate by covalent conjugation with chlorogenic acid[J].Journal of Food Measurement and Characterization, 2022, 16(1):202-213.
[8] CHENG, WANG S T, FENG B, et al.Interaction between soybean protein and tea polyphenols under high pressure[J].Food Chemistry, 2019, 277:632-638.
[9] 周思多.膳食多酚与大豆蛋白相互作用及其复合物功能性质研究[D].南京:南京农业大学, 2019.
ZHOU S D.Study on the interaction of dietary polyphenols with soybean protein and the functional properties of their complexes[D].Nanjing:Nanjing Agricultural University, 2019.
[10] ZHUL J, YIN P, XIE T Y, et al.Interaction between soyasaponin and soy β-conglycinin or glycinin:Air-water interfacial behavior and foaming property of their mixtures[J].Colloids and Surfaces B:Biointerfaces, 2020, 186:110707.
[11] HOUZ H, QIN P Y, ZHANG Y, et al.Identification of anthocyanins isolated from black rice (Oryza sativaL.) and their degradation kinetics[J].Food Research International, 2013, 50(2):691-697.
[12] LIY T, HE D, LI B, et al.Engineering polyphenols with biological functions via polyphenol-protein interactions as additives for functional foods[J].Trends in Food Science &Technology, 2021, 110:470-482.
[13] SUIX N, SUN H B, QI B K, et al.Functional and conformational changes to soy proteins accompanying anthocyanins:Focus on covalent and non-covalent interactions[J].Food Chemistry, 2018, 245:871-878.
[14] MENGY Y, HAO L L, TAN Y, et al.Noncovalent interaction of cyanidin-3-O-glucoside with whey protein isolate and β-lactoglobulin:Focus on fluorescence quenching and antioxidant properties[J].LWT, 2021, 137:110386.
[15] 王婧,张雨晴, 陈红宇, 等.花青素调控大豆蛋白体外消化性能及抗氧化性研究[J].食品与发酵工业, 2019, 45(23):90-96.
WANG J, ZHANG Y Q, CHEN H Y, et al.Study on the in vitrodigestibility and antioxidation of soy protein regulated by anthocyanin[J].Food and Fermentation Industries, 2019, 45(23):90-96.
[16] YINZ C, WU Y R, CHEN Y, et al.Analysis of the interaction between cyanidin-3-O-glucoside and casein hydrolysates and its effect on the antioxidant ability of the complexes[J].Food Chemistry, 2021, 340:127915.
[17] 刘英杰,隋晓楠, 黄国, 等.花青素与大豆分离蛋白的不同共价交联法对蛋白结构的影响[J].食品科学, 2019, 40(8):1-7.
LIU Y J, SUI X N, HUANG G, et al.Effects of covalent interaction of anthocyanin and soy protein isolate on protein structure under enzymatic and alkaline conditions[J].Food Science, 2019, 40(8):1-7.
[18] 朱颖,王中江, 李杨, 等.花青素对大豆蛋白质二级结构影响的多重光谱分析[J].农业机械学报, 2018, 49(6):368-374;426.
ZHU Y, WANG Z J, LI Y, et al.Effects of anthocyanins on the secondary structure of soybean protein isolate by multiplex spectroscopy[J].Transactions of the Chinese Society for Agricultural Machinery, 2018, 49(6):368-374;426.
[19] WUD, TANG L, DUAN R, et al.Interaction mechanisms and structure-affinity relationships between hyperoside and soybean β-conglycinin and glycinin[J].Food Chemistry, 2021, 347:129052.
[20] DAIT T, CHEN J, MCCLEMENTS D J, et al.Protein-polyphenol interactions enhance the antioxidant capacity of phenolics:Analysis of rice glutelin-procyanidin dimer interactions[J].Food &Function, 2019, 10(2):765-774.
[21] 李杨,孙红波, 董济萱, 等.花青素与大豆分离蛋白非共价/共价作用对其界面功能性质的影响[J].食品科学, 2018, 39(6):32-38.
LI Y, SUN H B, DONG J X, et al.Effects of non-covalent/covalent interactions between anthocyanins and soybean protein isolate on its interfacial function[J].Food Science, 2018, 39(6):32-38.
[22] CHENY R, NAI X, LI M Y, et al.A comprehensive research on lactone sophorolipid (LSL) and soy protein isolate (SPI) interacting mixture[J].Journal of Molecular Liquids, 2021, 339:117239.
[23] YOUY H, YANG L, CHEN H, et al.Effects of (-)-epigallocatechin-3-gallate on the functional and structural properties of soybean protein isolate[J].Journal of Agricultural and Food Chemistry, 2021, 69(7):2 306-2 315.
[24] LIJ F, LI Y T, GUO S T.The binding mechanism of lecithin to soybean 11S and 7S globulins using fluorescence spectroscopy[J].Food Science and Biotechnology, 2014, 23(6):1 785-1 791.
[25] 江连洲,陈思, 李杨, 等.大豆分离蛋白-花青素复合物的制备及其蛋白结构与功能性质分析[J].食品科学, 2018, 39(10):20-27.
JIANG L Z, CHEN S, LI Y, et al.Effects of complexation with anthocyanin on the structural and functional properties of denatured soybean protein[J].Food Science, 2018, 39(10):20-27.
[26] ZHANGM L, CHAI Y Q, HAN B Y.Mechanistic and conformational studies on the interaction between myriocin and human serum albumin by fluorescence spectroscopy and molecular docking[J].Journal of Solution Chemistry, 2019, 48(6):835-848.
[27] ZHANGJ, TIAN Z G, LIANG L, et al.Binding interactions of β-conglycinin and glycinin with vitamin B12[J].The Journal of Physical Chemistry.B, 2013, 117(45):14 018-14 028.
[28] HUANGX, SUN L, LIU L, et al.Study on the mechanism of mulberry polyphenols inhibiting oxidation of beef myofibrillar protein[J].Food Chemistry, 2022, 372:131241.
[29] WANGY S, LIU C Q, MA T Y, et al.Physicochemical and functional properties of γ-aminobutyric acid-treated soy proteins[J].Food Chemistry, 2019, 295:267-273.
[30] TIANY, XU G, CAO W W, et al.Interaction between pH-shifted β-conglycinin and flavonoids hesperetin/hesperidin:Characterization of nano complexes and binding mechanism[J].LWT, 2021, 140:110698.
[31] OCHNIOM E, MART NEZ J H, ALLIEVI M C, et al.Proteins as nano-carriers for bioactive compounds.the case of 7S and 11S soy globulins and folic acid complexation[J].Polymers, 2018, 10(2):149.
NEZ J H, ALLIEVI M C, et al.Proteins as nano-carriers for bioactive compounds.the case of 7S and 11S soy globulins and folic acid complexation[J].Polymers, 2018, 10(2):149.
[32] ZANGZ H, CHOU S R, GENG L J, et al.Interactions of blueberry anthocyanins with whey protein isolate and bovine serum protein:Color stability, antioxidant activity, in vitrosimulation, and protein functionality[J].LWT, 2021, 152:112269.
[33] GÜNAL-KÖRO LUD, TURAN S, CAPANOGLU E.Interaction of lentil protein and onion skin phenolics:Effects on functional properties of proteins and in vitrogastrointestinal digestibility[J].Food Chemistry, 2022, 372:130892.
LUD, TURAN S, CAPANOGLU E.Interaction of lentil protein and onion skin phenolics:Effects on functional properties of proteins and in vitrogastrointestinal digestibility[J].Food Chemistry, 2022, 372:130892.
[34] XUH X, ZHANG T T, LU Y Q, et al.Effect of chlorogenic acid covalent conjugation on the allergenicity, digestibility and functional properties of whey protein[J].Food Chemistry, 2019, 298:125024.
[35] RUANQ J, WANG M P, ZOU Y, et al.Interfacial stabilization of aqueous foam based on soy protein-rhamnolipids interacting mixture[J].Industrial Crops and Products, 2020, 153:112587.