酒精的过量摄入会激发机体产生应激反应,导致肝细胞坏死、病变等[1-3]。因此,解酒、护肝、养胃成了亟待解决的问题。目前中西药类解酒产品配方主要是维生素、激素类、氨基酸,但其存在毒副作用。生物活性肽是一类既能清除人体内氧化自由基,又能激活肝脏酶系解毒,同时因其分子质量小、易吸收,同时对胃黏膜起到保护作用,达到解酒保健功效。生物活性肽因其种类多,分子质量小,生产制备需要极高的技术。目前酸或碱水解具有破坏氨基酸成分、产生有毒物质、产生异味和水解难控制等问题,酶法水解因其具备过程和结果可控性、条件温和、安全性高等诸多优势,使其为标准化生产奠定了基础。动物源蛋白酶,例如胃蛋白酶、胰蛋白酶等,能促进蛋白水解释放出抗氧化性肽类物质[4];微生物源蛋白酶,例如碱性蛋白酶、风味蛋白酶等,能够促进蛋白水解成大肽、小肽和游离的氨基酸[5-6]。乙醇脱氢酶(alcohol dehydrogenase,ADH)是参与酒精解毒的关键酶[1-3]。刘鹏[2]采用双酶解玉米黄粉制备低分子质量玉米肽,就是以ADH的激活率作为促乙醇代谢的指标。赵谋明等[3]采用木瓜蛋白酶和胰酶复合酶解玉米粉制备玉米肽,以ADH的激活率作为高效醒酒活性的评价指标。
海洋因其低温高盐等极端的条件,海洋生物的活性肽氨基酸组成和序列具有显著差异,因此海洋生物活性肽具备着独特的生物学优势,从而成为目前研究的热点[5,7-8]。LIU等[9]报道鲑鱼蛋白水解物对DPPH自由基清除能力为(42.88±1.85)%和对·OH清除能力为(61.83±3.05)%。QIAN等[10]采用胃蛋白酶、胰蛋白酶和MaxiproPSP多酶水解牡蛎4 h,获得软组织肽,具有较强的DPPH自由基清除能力。叶昱辉[11]研究发现,近江牡蛎酶解时间5.19 h,pH 8.31,加酶量2.12%时,蛋白质回收率为(64.5±0.6)%,清除氧自由基吸收能力405.53 TE μmol/g。鱿鱼水解物对ABTS的清除率达64%,血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制达82.28%[12]。江敏等[13]以鱿鱼为原料,温度55 ℃、pH 8、反应时间5 h,加酶量为40%时,鱿鱼的水解度为56.82%;对![]() 和·OH的IC50分别为7.276 5和0.112 1 mg/mL。江建梅[14]对鱿鱼进行酶解,DPPH自由基的清除率由酶解前的48.4%,上升至酶解(3 h)后的77.7%。鱿鱼来源广泛、价格低廉,且具备人体必需的多种氨基酸,其酶解产物具有较好的抗氧化活性和ACE抑制等作用,因此,鱿鱼蛋白原料具备养胃护肝的潜力,但是关于鱿鱼在解酒护肝领域酶解条件的研究却较少。
和·OH的IC50分别为7.276 5和0.112 1 mg/mL。江建梅[14]对鱿鱼进行酶解,DPPH自由基的清除率由酶解前的48.4%,上升至酶解(3 h)后的77.7%。鱿鱼来源广泛、价格低廉,且具备人体必需的多种氨基酸,其酶解产物具有较好的抗氧化活性和ACE抑制等作用,因此,鱿鱼蛋白原料具备养胃护肝的潜力,但是关于鱿鱼在解酒护肝领域酶解条件的研究却较少。
关于多肽的分离纯化仍是一项艰巨而重要的任务[4,15-16],目前的纯化方法主要有制备型高效液相色谱仪纯化法、凝胶渗透色谱分离纯化法[7]、超临界色谱法、有机溶剂提取法等,这些方法均存在难以工业化应用和有毒物质残留等问题;其中膜分离法、树脂吸附以及离子交换法具备工业化应用的可行性。
针对上述问题,本试验选取鱿鱼为蛋白原料,采用现代酶解技术模拟人体胃肠道消化吸收,选取动物源的胃蛋白酶以及微生物源的碱性蛋白酶和风味酶,通过多酶联合工艺对原料蛋白进行中度酶解,并以蛋白质回收率和体外ADH激活率对酶解工艺进行筛选、评价。结合膜分离及树脂吸附法对酶解液中的疏水性小肽进行高效分离纯化,获得纯度高、活性高、易吸收、安全高效的小分子解酒肽产品。
1 材料与方法
1.1 材料与试剂
新鲜鱿鱼,市售;碱性蛋白酶(200 U/mg)、菠萝蛋白酶(300 U/mg)、风味蛋白酶(20 U/mg)、木瓜蛋白酶(800 U/mg)、胰蛋白酶(2 500 U/mg)、胃蛋白酶(30 U/mg),源叶生物技术有限公司;ADH(7.5 kU/mL),美国Sigma公司;ADH测定试剂盒,南京建成生物科技有限公司有限公司;DPPH,北京沃凯生物技术有限公司;SDS、过硫酸铵、N,N,N′,N′-四甲基乙二胺 (tetramethylethylenediamine,TEMED)、丙烯酰胺/甲叉双丙烯酰胺(30%溶液)(19∶1)、Tris-HCl、标准蛋白质(code No.3454A)、4× buffer,上海生工;无水乙醇、HCl、NaOH等试剂,国产分析纯级,国药集团化学试剂有限公司。
1.2 仪器与设备
SpectraMax®Paradigm®多功能酶标仪,美谷分子仪器(上海)有限公司;UV1000D紫外可见分光光度计,翱艺仪器上海有限公司;Agilent 1290高效液相色谱仪,安捷伦科技(中国)有限公司;Avanti J-E离心机,美国贝克曼库尔特有限公司;SHJ-1磁力搅拌水浴锅,常州德科仪器制造有限公司;垂直版电泳槽,美国伯乐;ME1002/02电子天平,上海精科天美科学仪器有限公司;K9860全自动凯氏定氮仪,海能未来技术集团股份有限公司;FreeZone®4.5L冷冻干燥机,北京中科科尔仪器有限公司;5E-MAC IV全自动水灰测试仪,长沙开元仪器有限公司;JJLBG-125U红外分光测油仪,吉林北光分析仪器厂。
1.3 试验方法
1.3.1 鱿鱼小分子肽的制备工艺流程
清洗→破碎→匀浆→酶解→灭酶→固液分离→色谱精制→浓缩→干燥→活性肽产品
1.3.2 酶解工艺条件优化
1.3.2.1 酶种类对鱿鱼蛋白质回收率和体外ADH激活率的影响
制备鱿鱼糜,料液比1∶10(g∶mL),酶添加量为0.2%(质量分数,下同),装液量100 mL/250 mL瓶,设置7个试验组,pH、温度如下:组1:CK(无外源酶、37 ℃);组2:碱性蛋白酶(pH 7.0、50 ℃);组3:菠萝蛋白酶(pH 7.0、50 ℃)、组4:风味蛋白酶(pH 7.0、50 ℃)、组5:木瓜蛋白酶(pH 7.0、50 ℃)、组6:胰蛋白酶(pH 8.0、37 ℃)、组7:胃蛋白酶(pH 8.5、37 ℃)。连续酶解3 h后沸水浴灭酶10 min,将酶解液离心取上清液,测定其蛋白回收率和体外ADH激活率。
1.3.2.2 酶组合对鱿鱼蛋白质回收率和体外ADH激活率的影响
依据蛋白酶的特性、对肽键裂解区域的倾向性(例如末端肽和内部区的域特性)[5]设计6组酶组合试验,组A:木瓜蛋白酶∶风味蛋白酶=1∶1(质量比,下同);组B:碱性蛋白酶∶风味蛋白酶=1∶1;组C:碱性蛋白酶∶菠萝蛋白酶=1∶1;组D:胃蛋白酶∶碱性蛋白酶∶风味蛋白酶=1∶1∶1;组E:胃蛋白酶∶胰蛋白酶∶风味蛋白酶=1∶1∶1;组F:碱性蛋白酶∶胃蛋白酶∶菠萝蛋白酶=1∶1∶1,其他条件同1.3.2.1。
1.3.2.3 料液比对鱿鱼蛋白质回收率和体外ADH激活率的影响
酶解组合D的料液比(g∶mL湿重)分别为1∶5、1∶10、1∶20,其他条件同1.3.2.1。
1.3.2.4 加酶量对鱿鱼蛋白质回收率和体外ADH激活率的影响
酶解组D的酶添加量为0.2%、0.4%、0.6%,其他条件同1.3.2.1。
1.3.3 小分子解酒肽产品的精制及活性的考察
制备鱿鱼糜400 g(湿重),根据料液比1∶10(g∶mL),选择酶解组合D,酶添加量为0.2%,其他条件同1.3.2.1。酶解液调节pH为3.0~6.0,经色谱吸附、洗杂,并采用梯度乙醇检测洗脱,同时检测洗脱液在紫外波长220 nm和280 nm处的吸光度值。洗脱液经纳滤、浓缩、冷冻干燥,获得小肽产品;并测定其ADH激活率、DPPH自由基清除率、灰分、水分、总氮、总糖、总油。
1.3.4 检测方法
1.3.4.1 SDS-PAGE对酶解液蛋白水解产物的表征
参照《分子克隆实验指南》(第四版)进行蛋白质的SDS-PAGE[17]。
1.3.4.2 酶解液蛋白质回收率
采用凯氏定氮法测定酶解液蛋白含量[3],蛋白质回收率按公式(1)计算:
酶解液蛋白质回收率![]()
(1)
1.3.4.3 体外ADH激活率的测定[3]
各组别依次加入缓冲液试剂一0.65 mL(空白组 0.70 mL)(1∶1超纯水稀释),0.05 mL 试剂二乙醇溶液;对照组加0.03 mL浓度为1.0 U/mL ADH溶液和0.02 mL超纯水;实验组加 0.03 mL浓度为1.0 U/mLADH溶液和 0.02 mL活性肽酶解液;充分混匀后,取混合液 100 μL 置于干净紫外酶标板孔隙内,37 ℃温育5 min,弹出加入100 μL 辅酶试剂三(粉剂,临用前10 mL 超纯水稀释),立即推入且全程保持恒温,340 nm下扫描测定各反应孔内吸光值(每1 min测定一次,共测定10次),取线性关系良好反应曲线中初始值为A1,结束值为A2,ADH激活率按公式(2)计算:
ADH激活率![]()
(2)
1.3.4.4 DPPH抗氧化能力的测定[11]
设备调零:1 mL无水乙醇+ 1 mL蒸馏水;将1 mLDPPH溶液置于试管中,加入1 mL 样品稀释液,振荡混匀,室温避光放置30 min 后,在517 nm处测其吸光值(Ai);以1 mL DPPH溶液+ 1 mL蒸馏水为对照,在波长为517 nm下测定吸光值(Ac);1 mL样品稀释液和1 mL无水乙醇混合后测定吸光值(Aj)。样品对DPPH自由基的清除能力用抑制率R表示,按公式(3)计算:
(3)
1.3.4.5 分子质量分布的测定
柱温25 ℃;流速0.5 m/min;进样量20 μL;色谱柱:SEC-125 column (XIYU Tech, Shanghai);流动相A为V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1;检测波长220 nm。
1.3.4.6 其他指标
总油含量使用红外分光测油仪测定;总糖含量采用苯酚硫酸法测定;水分、灰分使用水分灰分测定仪测定。
1.3.5 数据处理与分析
实验结果用平均数±标准方差表示,重复3次,运用软件SPSS 19.0,经比较均值、单因素方差分析,采用LSD、Duncan 多重检验分析实验,P<0.05 为差异显著,并用软件Origin 9.0 绘图。
2 结果与分析
2.1 酶种类对鱿鱼蛋白质回收率和ADH激活率的影响
如图1所示,通过对酶解液蛋白回收测定,组2、组5、组7的酶解液中蛋白回收率分别为63.33%、69.19%、61.46%;其中组6、组7的上清液通过SDS-PAGE检测发现,存在大量的大片段蛋白质未充分酶解,在此未呈现相关结果。其中对体外ADH酶激活率测定,组2、组3、组5的酶解液对ADH的激活率为63.42%、43.22%、35.54%。
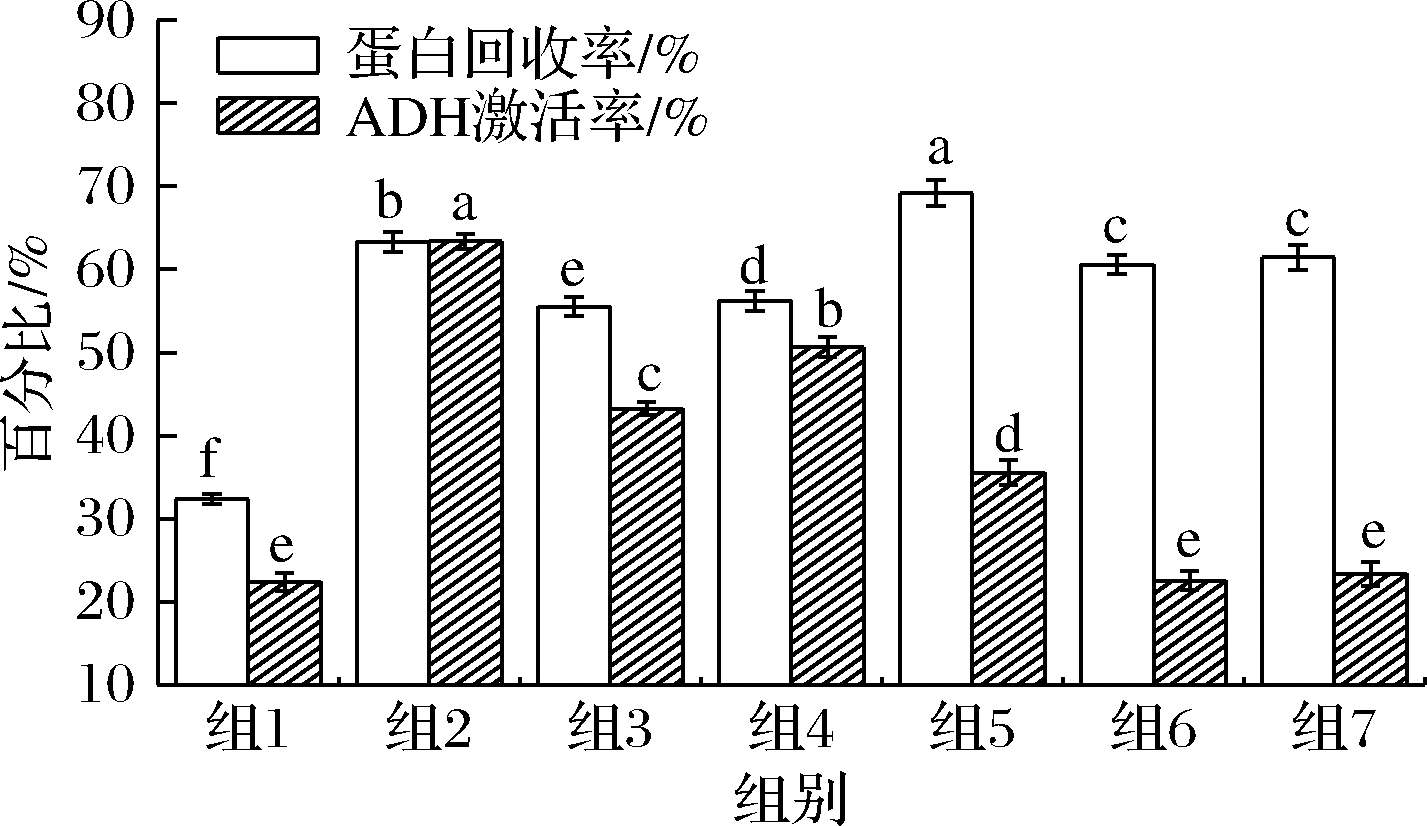
图1 酶种类对酶解液的蛋白回收率和ADH激活率的影响
Fig.1 Effects of different enzymes on protein recovery ratio and ADH activation ratio 注:在P<0.05的水平上,用不同字母表示各 试验组间差异显著性(下同)
HOU等[5]发现微生物源蛋白酶(碱性蛋白酶、菠萝蛋白酶、风味蛋白酶)水解较易产生小分子多肽[5],与本实验中结果一致,即碱性蛋白酶、菠萝蛋白酶、风味蛋白酶的酶解较易产生激活ADH的小肽、寡肽、氨基酸。
单酶存在酶解效率不彻底以及ADH激活率局限的缺点,后期优选风味蛋白酶作为进一步酶解组合的主要酶组合,以期提高其蛋白回收率以及增强ADH激活率。
2.2 酶组合对鱿鱼蛋白质回收率和ADH激活率的影响
如图2所示,测定酶解液蛋白回收率均在70%以上,其中组合D可达80.31%,其酶解液对体外ADH酶激活率为82.43%,与单酶相比效果显著。本实验中酶组合D为最优酶组合,与SHAVANDI等[18]和SABLE等[19]报道的酶组合能够提高酶解液的活性结果一致。
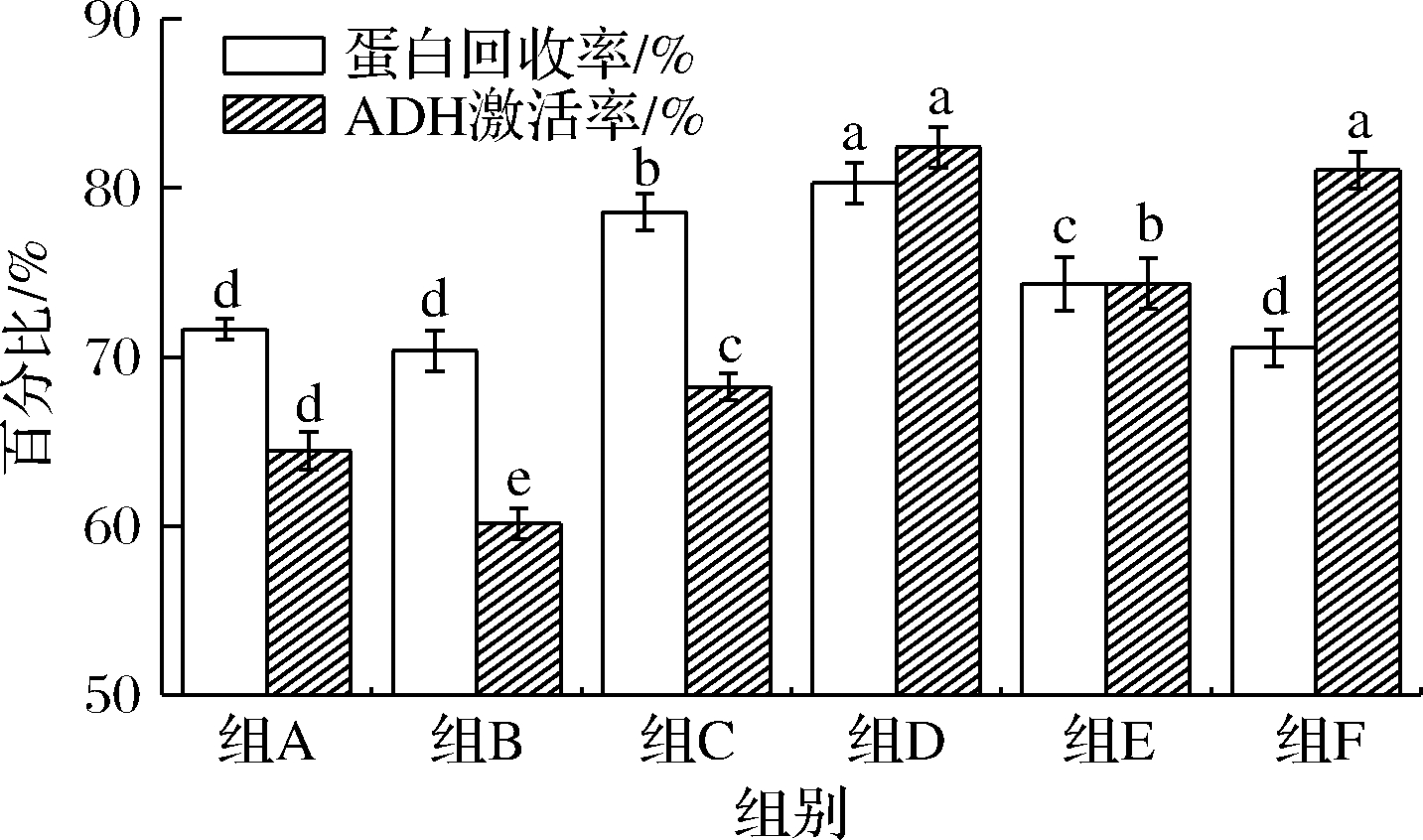
图2 酶组合对酶解液的蛋白回收率和 ADH激活率的影响
Fig.2 Effects of enzyme combination on protein recovery ratio and ADH activation ratio
多肽产品肽摄入体内的生物利用度是目前首要问题,尤其是胃肠道蛋白酶的分解问题[20]。本实验以模拟人体胃消化系统为原则,分别阶段性地添加各类酶,充分发挥各酶的特性,为后期的服用作了前瞻性考量。相比叶昱辉[11]采用Alcalase2.4L 酶解法制备近江牡蛎多肽,酶解时间为5.19 h,蛋白质回收率为(64.5±0.6)%,本实验在酶解时间和蛋白回收率上具有显著优势,属于中度酶解,与文献报道的中度水解产物具有更高的ADH激活能力的观点基本一致[18]。
2.3 料液比对鱿鱼蛋白质回收率和体外ADH激活率的影响
酶组合D的料液比为1∶5、1∶10、1∶20(g∶mL),对鱿鱼糜酶解液的蛋白回收率及ADH的激活率测定结果如图3所示。
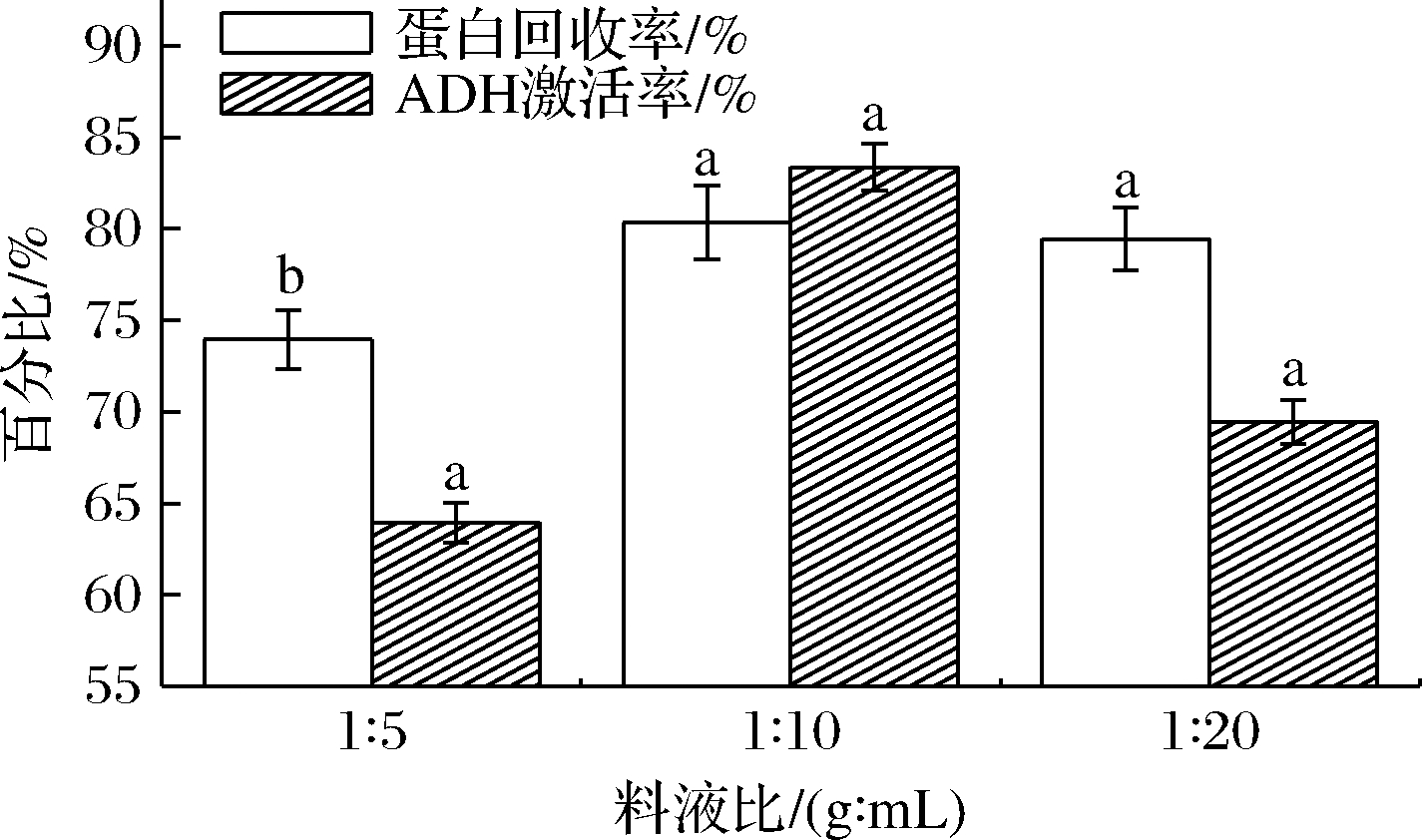
图3 料液比对酶解液的蛋白回收率和体外 ADH激活率的影响
Fig.3 Effects of solid-liquid ratio on protein recovery ratio and ADH activation ratio
通过对酶解液蛋白回收测定,料液比为1∶5时,蛋白回收率为73.95%,考虑底物浓度过大,比较黏稠,酶与底物的接触不够充分;在料液比为1∶10、1∶20,蛋白回收率分别为80.34%、79.44%,无显著区别,考虑经济成本,优选料液比1∶10。在料液比为1∶5、1∶10、1∶20时,对ADH的激活率分别为63.95%、83.37%、69.44%;可能料液比为1∶5时其蛋白酶解不彻底;而料液比为1∶20时可能存在过度水解,优选料液比为1∶10作为进一步试验条件。
2.4 加酶量对鱿鱼蛋白质回收率和体外ADH激活率的影响
酶组合D的加酶量分别为0.2%、0.4%、0.6%,对鱿鱼糜酶解液的蛋白回收率及ADH的激活率测定结果如图4所示。
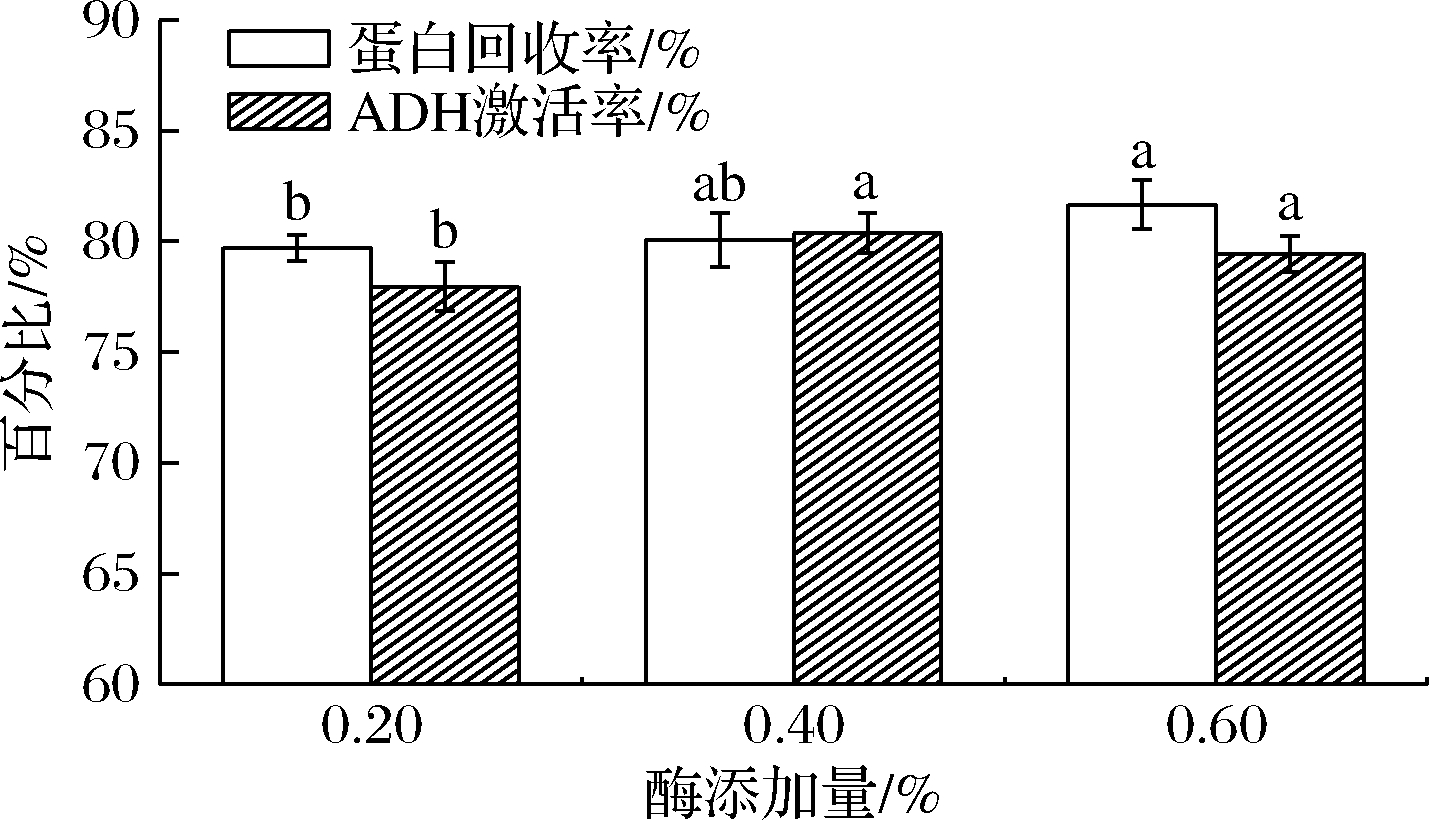
图4 酶添加量对酶解液的蛋白回收率和体外 ADH激活率的影响
Fig.4 Effects of enzyme content on protein recovery ratio and ADH activation ratio
加酶量为0.2%、0.4%、0.6%,其酶解液对蛋白回收率分别为79.71%、80.07%、81.66%,对ADH激活率分别为77.96%、80.37%、79.44%;其酶解液的颜色依次为淡白色、淡黄色和褐黄色。在上述酶添加量下,其对蛋白回收率以及体外ADH激活无显著影响。综合考虑,优选加酶量为0.2%。
2.5 酶解液的精制过程研究
按照1.3.3制备的酶解液通过色谱精制,采用不同梯度的乙醇洗脱(0~10%),对洗脱液进行220 nm和280 nm的吸光度监测(图5)。将出现的尖峰进行收集,经纳滤、浓缩、冻干,获得小分子活性多肽(biologically active peptide,BAP)产品。

图5 洗脱液在220 nm和280 nm的紫外色谱图
Fig.5 UV chromatogram of elution solution at 220 nm and 280 nm
含疏水氨基酸残基(Pro、Tyr、Val、Leu、Ile、Phe和Met),有利于清除脂相自由基,提高抗氧化活性、保护机体[10,20-21]。同时疏水性肽也能够提高ADH的激活率[22]。因此,本研究采用疏水性大孔吸附树脂吸附酶解液,采用梯度乙醇洗脱,收集10%乙醇组分,制备高纯度疏水性小肽产品。
2.6 小分子解酒肽的产品特性研究
将2.5制备的BAP进行产品特性评估,表1为产品的组分含量,本实验制备的小分子活性肽产品的回收率为20.56%,其蛋白氮含量>15%,与市场海洋低聚肽产品(诺利如一生物技术有限公司)相比,本产品具有纯度更高,杂质少的优势。
表1 小分子活性肽产品的组分情况
Table 1 Composition of small molecule active peptide products

组分含量/%蛋白95.81±0.12氮15.33±0.11灰分0.99±0.08水分1.63±0.05总油0.52±0.06总糖0.63±0.02其他0.42±0.04
表2为产品BAP的分子质量分布情况,本实验制备的小分子活性肽,其分子质量分布在3 000 Da以下占比为99.96%,其中180~500 Da占比46.996%,主要以二肽到五肽为主。小分子活性肽具有易吸收、活性更高等优势,尤其是二肽、三肽可被直接吸收,且随着肽链的延长吸收速度下降[2,5,12]。
图6为产品的体外ADH激活率以及对DPPH自由基清除的情况。本实验制备的小分子活性肽在0.1、1、2、3、5、10 mg/mL时,其对ADH的激活率分别为14.12%、24.98%、31.08%、59.06%、122.71%、216.02%;其对DPPH的激活率分别为8.6%、11.19%、27.59%、35.11%、65.43%、92.01%。刘鹏[2]报道的酶解液质量浓度为10 mg/mL,对ADH的激活率斜率为负值,考虑酶解液中的杂质或色素干扰;对比发现本产品的纯度高、活性稳定,对ADH的激活率成一定的线性关系。SHAVANDI等[18]报道胃蛋白酶与胰蛋白酶双酶对鱿鱼蛋白水解24 h,其酶解产物(4 mg/mL)的DPPH自由基清除率为51.48%;与本产品的DPPH自由基清除能力相当,说明本产品能够在3 h内酶解并分离纯化获得具有较高抗氧化水平的小肽产品。
表2 小分子活性肽产品的分子质量分布
Table 2 Molecular weight distribution of small molecule active peptide products
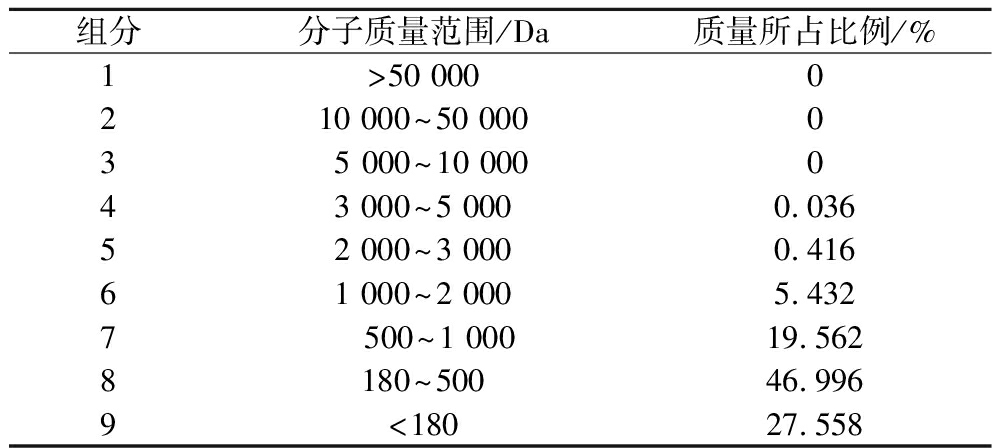
组分分子质量范围/Da质量所占比例/%1>50 000 0210 000~50 000035 000~10 000043 000~5 000 0.03652 000~3 0000.41661 000~2 000 5.4327500~1 00019.5628180~50046.9969<18027.558
DPPH自由基结构简单、反应容易控制,是海洋微生物源抗氧化自由基筛选的重要评价方法,90%以上的酒精通过肝脏酶系统进行氧化代谢[11,18,23]。本实验制备的小分子解酒肽与隋玉杰等[24]的玉米解酒肽相似,同时具有能够激活ADH和抗氧化的能力。其一方面能够协同ADH促进酒精代谢,另一方面能够清除机体氧化自由基,因此其具备解酒护肝养胃的能力。
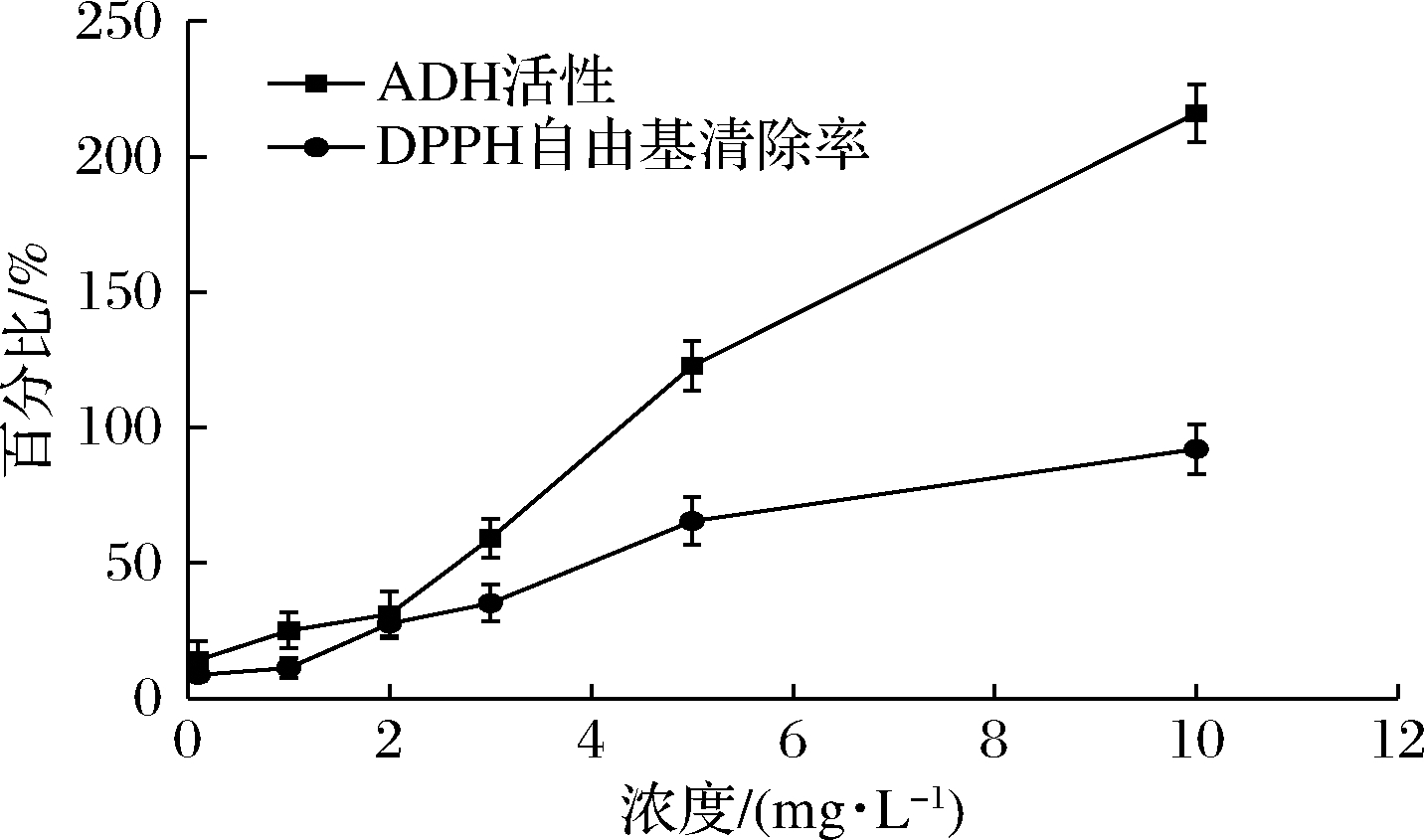
图6 小分子肽ADH的激活率和对DPPH自由基的清除能力
Fig.6 The ADH activation ratio and DPPH free radical scavenging of small peptide
3 结论
本研究以鱿鱼为蛋白原料,采用多酶中度水解,以蛋白质回收率和ADH激活率为回归指标,以此确定最优酶解工艺。最佳酶解条件为胃蛋白酶∶碱性蛋白酶∶风味蛋白酶=1∶1∶1(质量比),酶添加量0.2%、料液比为1∶10(g∶mL)、反应时间3 h。在此酶解条件下,酶解液的蛋白回收率为80.34%,ADH激活率>83.37%。为进一步提纯小肽并提升其功能活性,对酶解液进行精制工艺研究,采用树脂吸附疏水性肽组分,用梯度乙醇洗脱,收集液浓缩、干燥,获得淡黄色产品肽粉末。其蛋白肽纯度为95.33%,其中分子质量<3 000 Da的组分占比99.96%,其ADH的酶活率为122.71%(5 mg/mL),对DPPH自由基的清除率可达92.01%(10 mg/mL)。
研究结果表明,本实验制备的小分子鱿鱼肽具有很强的ADH激活率,同时具备较好的抗氧化能力;其一方面能够协同ADH促进酒精代谢,另一方面能够清除机体氧化自由基,因此具备解酒护肝养胃的能力,说明该方法能够制备具有解酒功能活性小分子肽。本研采用酶解法制备小分子解酒肽,具有高蛋白回收率、条件温和、反应时间短、酶添加量少等诸多特点,其在解酒、护肝、养胃等功能性食品领域具有广阔的应用前景。
[1] YOKOYAMAH, BARAONA E, LIEBER C S.Upstream structure of human ADH7gene and the organ distribution of its expression[J].Biochemical and Biophysical Research Communications, 1995, 216(1):216-222.
[2] 刘鹏.低分子量促乙醇代谢玉米肽制备与蛋白成分对活性贡献关系研究[D].广州:华南理工大学,2015.
LIU P.Preparation of corn originated low-molecular-weight peptides with anti-alcoholism activity and the contribution of different protein components to activity[D].Guangzhou:South China University of Technology,2015.
[3] 赵谋明,马梅,苏国万,等.具有醒酒活性的玉米肽的制备、富集和鉴定[J].中国食品学报,2020,20(9):86-94.
ZHAO M M,MA M,SU G W, et al.Preparation, enrichment and identificationof corn peptides with facilitating alcohol metabolism activity[J].Journal of Chinese Institute of Food Science and Technology, 2020,20(9):86-94.
[4] WUR B, WU C L, LIU D, et al.Overview of antioxidant peptides derived from marine resources:The sources, characteristic, purification, and evaluation methods[J].Applied Biochemistry and Biotechnology, 2015, 176(7):1 815-1 833.
[5] HOUY Q, WU Z L, DAI Z L, et al.Protein hydrolysates in animal nutrition:Industrial production, bioactive peptides, and functional significance[J].Journal of Animal Science and Biotechnology, 2017, 8(1):24.
[6] HAYESM, MORA L.Alternative proteins as a source of bioactive peptides:The edible snail and generation of hydrolysates containing peptides with bioactive potential for use as functional foods[J].Foods (Basel, Switzerland), 2021, 10(2):276.
[7] WANGX Q, YU H H, XING R E, et al.Characterization, preparation, and purification of marine bioactive peptides[J].BioMed Research International, 2017, 2017:9746720.
[8] KIMS K, NGO D H, VO T S.Marine fish-derived bioactive peptides as potential antihypertensive agents[J].Advances in Food and Nutrition Research, 2012, 65:249-260.
[9] LIUD, HUANG J F, WU C L, et al.Purification, characterization, and application for preparation of antioxidant peptides of extracellular protease from Pseudoalteromonassp.H2[J].Molecules (Basel, Switzerland), 2019, 24(18):3373.
[10] QIANB J, ZHAO X, YANG Y, et al.Antioxidant and anti-inflammatory peptide fraction from oyster soft tissue by enzymatic hydrolysis[J].Food Science &Nutrition, 2020, 8(7):3 947-3 956.
[11] 叶昱辉.近江牡蛎多肽的分离纯化及其抗氧化、抗光老化活性研究[D].广州:华南理工大学, 2018.
YE Y H.Purification of Ostrea rivularispeptides and their antioxidant, antiphotoaging activities[D].Guangzhou:South China University of Technology, 2018.
[12] DEJ FIMBRES-ROMERO M, CABRERA-CH VEZ F, EZQUERRA-BRAUER J M, et al.Utilization of collagenolytic enzymes from sierra fish (Scomberomorus sierra) and jumbo squid (Dosidicus gigas) viscera to generate bioactive collagen hydrolysates from jumbo squid muscle[J].Journal of Food Science and Technology, 2021, 58(7):2 725-2 733.
VEZ F, EZQUERRA-BRAUER J M, et al.Utilization of collagenolytic enzymes from sierra fish (Scomberomorus sierra) and jumbo squid (Dosidicus gigas) viscera to generate bioactive collagen hydrolysates from jumbo squid muscle[J].Journal of Food Science and Technology, 2021, 58(7):2 725-2 733.
[13] 江敏,胡小军, 杨彩凤, 等.鱿鱼酶解工艺优化及酶解液抗氧化活性的研究[J].中国酿造, 2012, 31(6):143-146.
JIANG M, HU X J, YANG C F, et al.Optimization of enzymatic technology of squid and antioxidant activities of its hydrolyzate[J].China Brewing, 2012, 31(6):143-146.
[14] 江建梅.鱿鱼酶解工艺及其酶解物的研究[D].天津:天津科技大学, 2010.
JIANG J M.Study on hydrolysis processing of squid and its hydrolysates[D].Tianjin:Tianjin University of Science &Technology, 2010.
[15] 刘铭,刘玉环, 王允圃, 等.制备、纯化和鉴定生物活性肽的研究进展及应用[J].食品与发酵工业, 2016, 42(4):244-251.
LIU M, LIU Y H, WANG Y P, et al.Research progress on production, purification and identification of bioactive peptides and its challenges in application[J].Food and Fermentation Industries, 2016, 42(4):244-251.
[16] 林燕,王鸿飞, 李和生, 等.鱿鱼皮酶解产物的功能特性[J].中国食品学报, 2011, 11(5):83-88.
LIN Y, WANG H F, LI H S, et al.Functional properties of enzymatic hydrolysates from squid skin[J].Journal of Chinese Institute of Food Science and Technology, 2011, 11(5):83-88.
[17] MANIATIS T.Molecular Cloning:A Laboratory Manual[M].Cold Spring Harbor:Cold Spring Harbor Laboratory Press, U.S., 1989.
[18] SHAVANDIA, HU Z H, TEH S, et al.Antioxidant and functional properties of protein hydrolysates obtained from squid pen chitosan extraction effluent[J].Food Chemistry, 2017, 227:194-201.
[19] SABLER, PARAJULI P, JOIS S.Peptides, peptidomimetics, and polypeptides from marine sources:A wealth of natural sources for pharmaceutical applications[J].Marine Drugs, 2017, 15(4):124.
[20] 邹媛婷,张健, 王共明, 等.生物活性肽在特殊医学用途配方食品中的应用研究进展[J].食品与发酵工业, 2022, 48(17):336-344.
ZOU Y T, ZHANG J, WANG G M, et al.Research progress on the application of bioactive peptides in Food for Special Medical Purpose[J].Food and Fermentation Industries, 2022, 48(17):336-344.
[21] 李富强,张廷新, 朱丽萍, 等.食物蛋白源免疫调节肽研究进展[J].食品与发酵工业, 2022, 48(1):308-314.
LI F Q, ZHANG T X, ZHU L P, et al.Advance of immunomodulatory peptides from dietary-protein source[J].Food and Fermentation Industries, 2022, 48(1):308-314.
[22] HASEBAT, YAMAMOTO I, KAMII H, et al.Alcohol dehydrogenase (ADH) isozymes in the AdhN/AdhN strain of Peromyscus maniculatus(ADH-deermouse) and a possible role of class III ADH in alcohol metabolism[J].Biochemical Genetics.1995,33(9):349-363.
[23] 叶松,任凌丽, 陈曦, 等.王氏保赤丸对急性酒精损伤小鼠醒酒护肝/胃作用及机制研究[J].中国中药杂志, 2021, 46(15):3 900-3 906.
YE S, REN L L, CHEN X, et al.Protective effect and mechanism of Wangshi Baochi Pills against acute alcoholic liver/stomach injury in mice[J].China Journal of Chinese Materia Medica, 2021, 46(15):3 900-3 906.
[24] 隋玉杰,何慧, 石燕玲, 等.玉米肽的醒酒活性体外试验及其醒酒机理研究[J].中国粮油学报, 2008, 23(5):54-58.
SUI Y J, HE H, SHI Y L, et al.A study on mechanism and tests in vitrofor corn peptides facilitating alcohol metabolism[J].Journal of the Chinese Cereals and Oils Association, 2008, 23(5):54-58.