山茱萸,是山茱萸属山茱萸科植物(Cornus officinalisSieb.et Zucc.)干燥成熟果肉,是药食同源中药材[1],富含黄酮类、环烯醚萜苷类、五环三萜类、鞣质类等化学物质。其中,黄酮类化合物为山茱萸重要活性成分之一,具有较高医药价值,也是人们日常饮食重要组成成分[2],该物质能显著降低胆固醇水平[3]、阻止人口腔鳞癌细胞的增殖和凋亡[4]、清除自由基和抗氧化能力[5]、对神经功能系统和心血管损伤的保护作用[6]、抗动脉粥样硬化[7]和抗抑郁等功能活性,在食品、药品、日化等方面有很大应用前景。但黄酮类化合物溶解度差,且对光照、温度、pH、氧等外界环境敏感,以及在人体胃肠道中渗透性差,限制了在人体内的吸收,降低了这些活性成分的生物利用率。此外,山茱萸黄酮类化合物味酸涩,直接食用难以被人们接受,限制其在食品领域的应用。因此,选择一种合适的方法克服上述存在问题,扩大山茱萸黄酮在保健食品领域的应用具有十分重要的意义。
微胶囊化是一种将生物活性成分包裹在成膜性高分子材料内以保护活性成分的理化性能、提高其贮藏稳定性的一种技术[8]。用于制备微胶囊的壁材种类繁多,包括碳水化合物、蛋白质、脂质以及纤维素类等。阿拉伯胶(gum Arabic,GA)是一类纯天然高分子阴性多糖,这类多糖有着显著的溶解性、优质乳化性和成膜性,从而可与大分子物质粘合,作为生物活性成分的包封壁材有效保护内容物的稳定性[9]。乳清分离蛋白(whey protein isolate,WPI)是一种是从乳清中提取出的营养成分,具有很高的营养价值、良好乳化、凝胶以及易消化吸收等特性[10]。因此,WPI作为天然传递壁材可用于传递食品成分,使具有高抗氧化能力的黄酮类物质呈现更好的药物包封率和生物利用度。
本试验以药食同源中药材山茱萸提取物中的黄酮为芯材,以阿拉伯胶和乳清分离蛋白为壁材,采用喷雾干燥技术制备山茱萸黄酮微胶囊。通过控制壁材质量分数、pH、壁材成分比例、芯壁体积比和加热器温度对山茱萸微胶囊包埋率的影响,采用响应面优化山茱萸黄酮微胶囊制备工艺,并利用差示扫描量热仪(differential scanning calorimeter,DSC)、扫描电镜(scanning electron microscope,SEM)、激光粒度分析仪、红外光谱(Fourier transform infrared spectroscopy,FTIR)、荧光光谱以及紫外光谱对微胶囊粉末热性能、形貌结构、粒径、化学键以及包埋率进行综合评价。旨在探究一种新型微胶囊制备工艺,提高山茱萸黄酮生物利用率以及促进其在功能性保健食品领域的开发应用。
1 材料与方法
1.1 材料与试剂
新鲜山茱萸果实采自河南省南阳市西峡县,样品采用微波冷冻干燥处理,使含水率达到0.09 g/g,粉碎,过60目网筛,置于干燥器中备用。
WPI(纯度≥90%),武汉冠赢生物科技有限公司;阿拉伯胶,天津市科密欧化学试剂有限公司;芦丁(纯度≥98%)、DPPH(纯度≥97%),上海源叶生物科技有限公司;NaNO2、Al(NO3)3,分析纯,南京都莱生物技术有限公司;无水乙醇、NaOH、NaH2PO4、Na2HPO4,均为分析纯,天津市德恩化学试剂有限公司。
1.2 仪器与设备
YC-015实验型喷雾干燥机,上海雅程仪器设备有限公司;UV-2600型紫外可见分光光度计,上海龙尼柯仪器有限公司;EMS-30型恒温磁力搅拌水浴锅,常州诺基仪器有限公司;A25型高剪切分散乳化均质机,上海欧河机械设备有限公司;TG16-WS型高速离心机,湘仪离心机仪器有限公司;DSC Ⅰ型差示扫描量热仪,瑞士Mettler-Toledo公司;TM3030Plus型电子扫描显微镜,日本岛津公司;LA-960型激光粒度分析仪,日本HORIBA;VERTEX70型傅立叶变换中远红外光谱仪,德国BRUKER公司;Cary eclpise型荧光分光光度计,美国Aglient Cary elipse公司。
1.3 试验方法
1.3.1 山茱萸黄酮提取物的制备工艺
参考孙建瑞等[11]的方法,采用超声辅助浸提法提取山茱萸黄酮,并进行一定修改。准确称取一定量山茱萸粉末于圆底烧瓶中,以1∶15的体积比加入乙醇溶液,超声波处理3次,每次30 min,收集滤液,离心,40 ℃旋转蒸发浓缩,然后对提取物分离纯化,去除蛋白质、糖等杂质,经旋转蒸发得到山茱萸黄酮提取物(色价35.56)。
1.3.2 黄酮含量测定
参考李加兴等[12]的方法,采用NaOH-Al(NO3)3法测定黄酮含量,以芦丁浓度为横坐标,吸光度为纵坐标绘制标准曲线,得回归方程:y=11.213x+0.002 9(R2=0.996)。
1.3.3 山茱萸黄酮微胶囊的制备
将WPI与GA溶解在水中配制成一定浓度,40 ℃下搅拌2 h,调节pH将溶液置于4 ℃冰箱中溶胀过夜。根据芯壁体积比加入芯材,持续搅拌30 min,均质得到乳化液,在喷雾干燥机中干燥得到山茱萸黄酮微胶囊粉末。
1.3.4 微胶囊包埋率的测定
包埋率测定需要分别测定微胶囊表面黄酮含量(Ws)以及总黄酮含量(Wt),参考孙亚利等[13]的方法测定黄酮含量,包埋率依据公式(1)进行计算:
包埋率![]()
(1)
1.3.5 微胶囊制备工艺优化
1.3.5.1 单因素试验
在搅拌温度40 ℃、搅拌速率(350±50) r/min、进料流速600 mL/h的恒定条件下,探究壁材质量分数、壁材质量比、pH、芯壁体积比、加热器温度对山茱萸黄酮微胶囊包埋率的影响,其中壁材质量分数为:6%、8%、10%、12%、14%;壁材添加成分比例[m(WPI)∶m(GA)]:3∶1、2∶1、1∶1、1∶2、1∶3;pH:2、3、4、5、6;芯壁体积比:1∶8、1∶9、1∶10、1∶11、1∶12;加热器温度:140、150、160、170、180 ℃。以微胶囊包埋率为评价指标进行试验。
1.3.5.2 响应面试验
根据单因素试验的结果,采用Design-Expert 8.0.6程序软件,确定对包埋率影响较大的壁材质量比、壁材质量分数、芯壁体积比为试验因素,设计响应面优化试验。因素及水平见表1。
表1 响应面试验因素水平编码表
Table 1 Horizontal coding table of response surface test factors
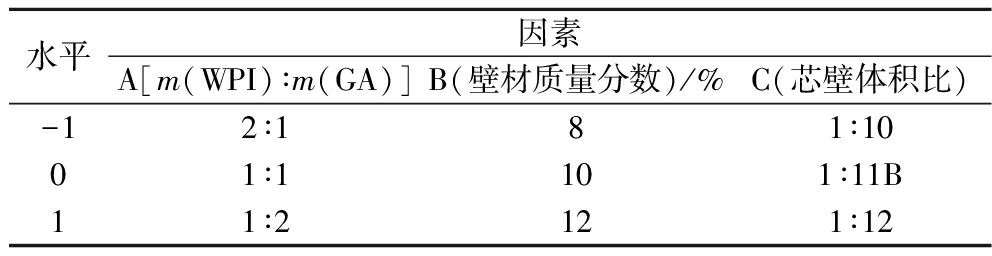
水平因素A[m(WPI)∶m(GA)]B(壁材质量分数)/%C(芯壁体积比)-12∶181∶1001∶1101∶11B11∶2121∶12
1.3.6 山茱萸黄酮微胶囊理化特性测定
1.3.6.1 含水率测定
水分含量是粉体的一个重要性能指标,它关系到粉体的干燥效率。准确称取一定质量最优条件下制备的山茱萸黄酮微胶囊粉末放置在105 ℃烘箱中干燥,质量恒定后,计算质量损失。
1.3.6.2 溶解度测定
微胶囊溶解度参考文献[14]的测定方法,并略有改动。将1 g微胶囊样品加入到蒸馏水中,磁力搅拌30 min,离心收集上清液在105 ℃烘箱中干燥至恒重。通过质量差计算溶解度(%)。
1.3.6.3 微胶囊色价及比容的测定
山茱萸黄酮微胶囊色价、比容的测定根据任广跃等[15]的方法进行测定,微胶囊粉末的比容,按公式(3)计算:
(2)
式中:P,比容,mL/g;V,微胶囊体积,mL;m,微胶囊粉末质量,g。
1.3.6.4 DPPH自由基清除活性
参考HU等[16]的方法。取200 μL样液,加入3.8 mLDPPH(6×10-5mol/L)溶液,避光静置30 min,于517 nm下测定吸光度,按照公式(3)计算清除率:
DPPH自由基清除率![]()
(3)
式中:A0,空白吸光度;A1,样品吸光度。
1.3.6.5 微胶囊热性能分析
称取5~10 mg微胶囊样品于铝坩埚中,采用差示扫描量热仪以10 ℃/min的升温速率从25 ℃升到250 ℃进行测量,其中N2流速为100 mL/min。
1.3.7 山茱萸黄酮微胶囊结构特性表征
1.3.7.1 微胶囊形貌观察
将经过干燥处理得到的微胶囊粉末均匀地平铺在样品台上,喷金,采用扫描电子显微镜观察微胶囊的表面形态。
1.3.7.2 微胶囊粒径测定
参考文献[17]的方法,略有改动。称取一定质量微胶囊样品分散在蒸馏水中室温溶解,分散液置于激光粒度分析仪中测定样品粒径。测量条件:材料折射率为1.473,水分散剂折射率为1.333。
1.3.7.3 微胶囊短程有序性结构分析
红外光谱可用于分析壁材与壁材、壁材与芯材相互作用机制,从而分析微胶囊形成机制。利用KBr压片法,以1∶100的比例将样品与干燥的KBr充分研磨,制片,样品的光谱扫描范围4 000~400 cm-1,分辨率4 cm-1,扫描次数32次[13]。
1.3.7.4 微胶囊荧光光谱分析
将一定质量微胶囊粉末样品溶解在磷酸盐缓冲盐水中,采用荧光分光光度计在282 nm波长下激发,发射光谱波长范围300~600 nm,扫描速率为1 200 nm/min。
1.3.7.5 微胶囊紫外光谱分析
将一定量黄酮微胶囊粉末溶解在无水乙醇中,超声处理30 min,经0.45 μm滤膜过滤后于190~700 nm波长范围内进行紫外光谱全扫描,以未经超声处理的黄酮微胶囊为空白对照。
1.3.8 数据处理
所有试验平行进行3次,利用SPSS 26.0和Origin2021软件对所有试验数据进行方差分析与作图。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 壁材质量分数对山茱萸黄酮微胶囊包埋率的影响
由图1可知,随着壁材质量分数的增加,山茱萸黄酮微胶囊包埋率也不断增加,当壁材质量分数为10%时,黄酮包埋率达到最大值,而后出现下降趋势。当壁材质量分数较低时,壁材对黄酮不能很好地包封,产生较少的微胶囊颗粒且壳体厚度不均匀,易破裂,导致黄酮溢出;当壁材质量分数超过10%时,体系黏度过高,阻碍山茱萸黄酮分子在壁材间的流动且产生微胶囊相互黏连的现象,从而导致山茱萸黄酮包埋效果变差。

图1 壁材质量分数对山茱萸黄酮微胶囊包埋率的影响
Fig.1 Effect of wall material mass fraction on embedding rate of flavonoids microcapsules from C. officinalis
2.1.2 壁材添加物比例对山茱萸黄酮微胶囊包埋率的影响
由图2可知,随着WPI和GA质量比的增加,山茱萸黄酮微胶囊包埋率呈现先增加后下降的趋势,当WPI和GA的质量比为1∶1时,微胶囊包埋效果最佳。这是因为壁材质量比持续增加,WPI和GA之间的相互作用减弱,此外,随着GA质量增加,乳化液黏度增加引起喷雾干燥效果不佳,导致包埋率下降。
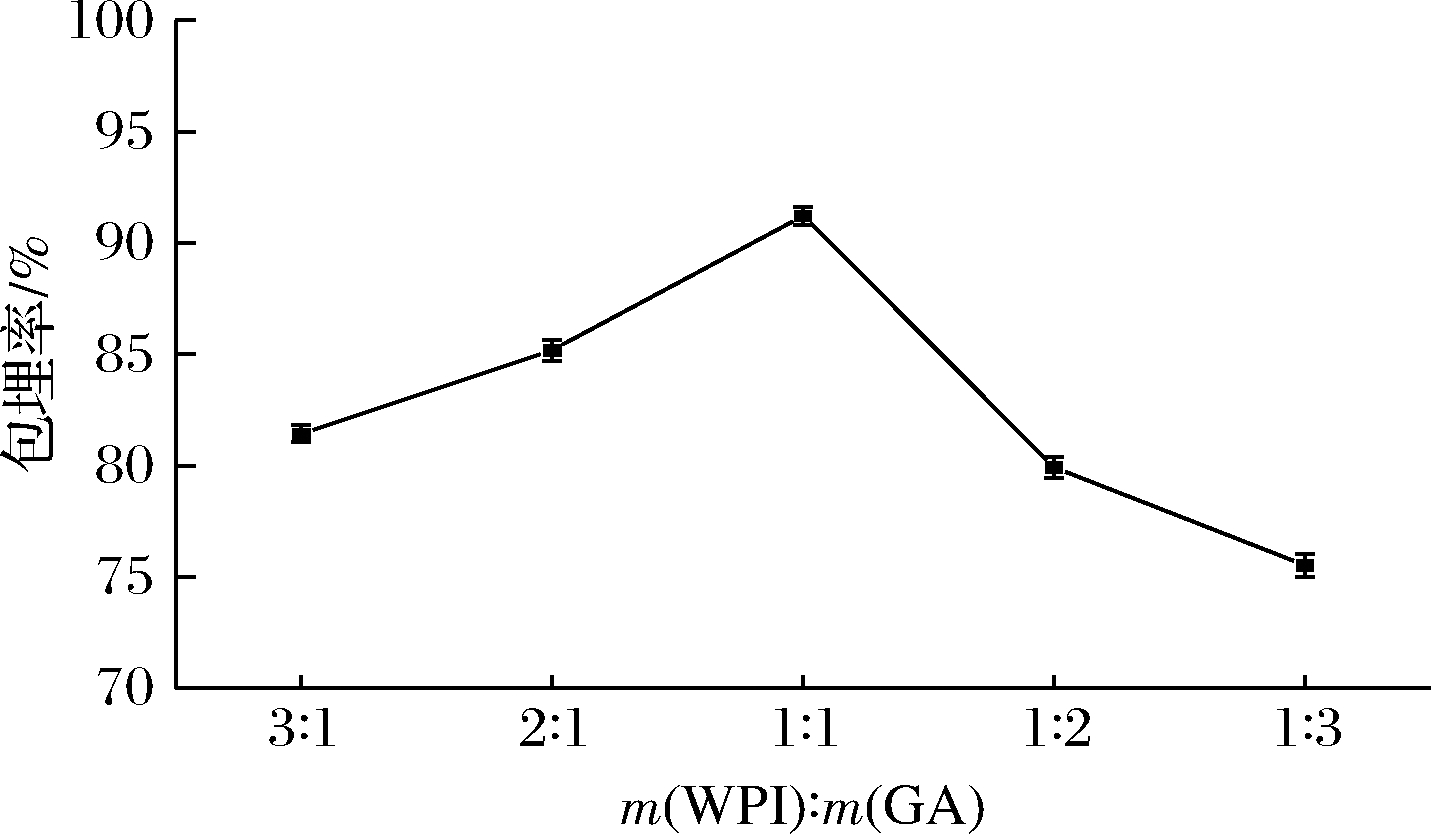
图2 壁材添加物比例对山茱萸黄酮微胶囊包埋率的影响
Fig.2 Effect of wall material mass ratio on embedding rate of flavonoids microcapsules from C. officinalis
2.1.3 pH对山茱萸黄酮微胶囊包埋率的影响
由图3可知,随着pH增加山茱萸黄酮微胶囊包埋率呈现先增加后下降的趋势,且pH值为3时,WPI和GA表现出较好的成膜性,山茱萸黄酮微胶囊包埋效果最佳,与MOGHBELI等[18]的研究结果类似。当pH较高时WPI和GA形成复合物黏度较高、成膜性差,导致山茱萸黄酮微胶囊包埋率降低。
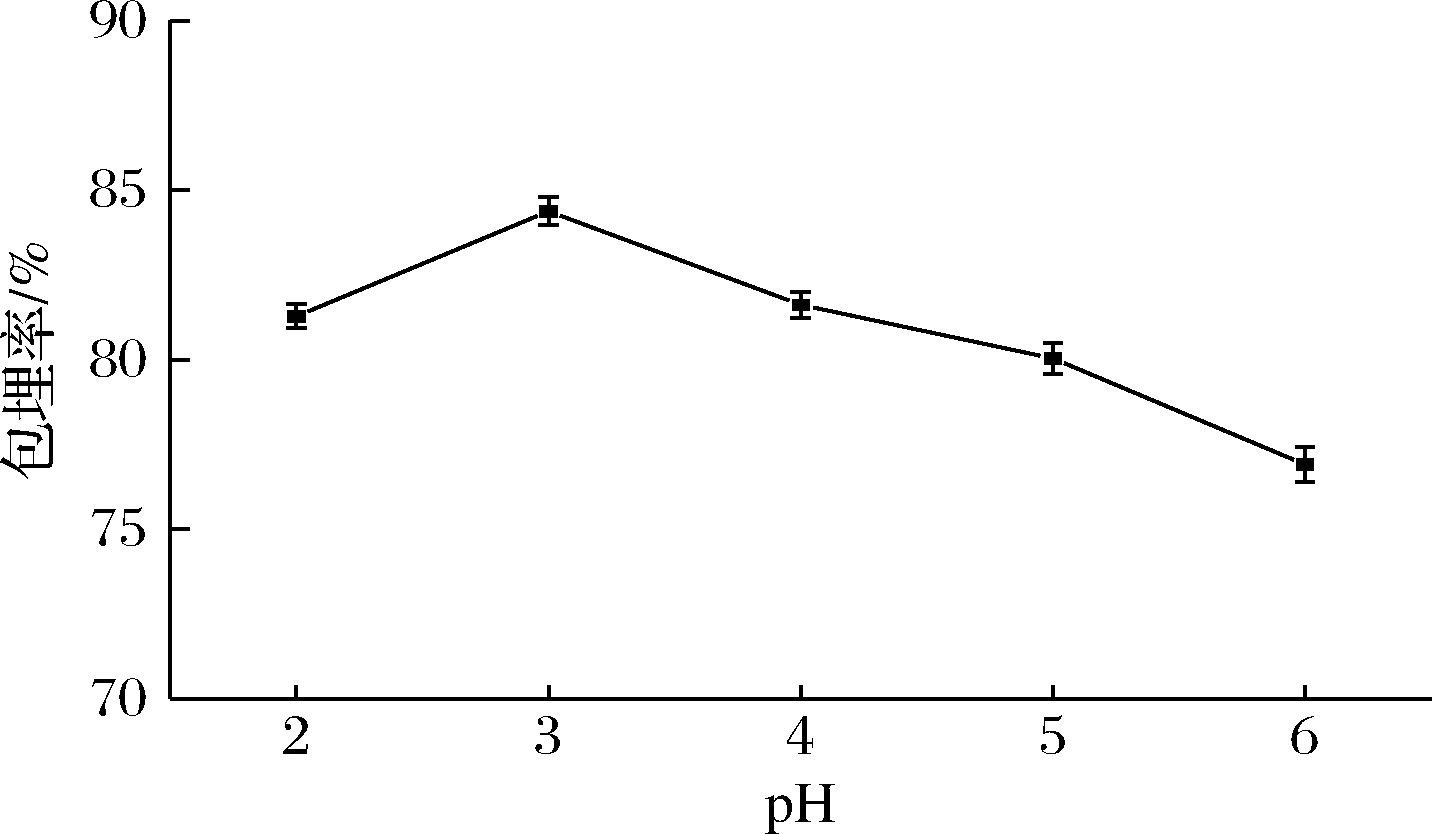
图3 pH对山茱萸黄酮微胶囊包埋率的影响
Fig.3 Effect of pH on embedding rate of flavonoids microcapsules from C. officinalis
2.1.4 芯壁体积比对山茱萸黄酮微胶囊包埋率的影响
壁材和芯材是微胶囊产品主要生产材料,芯壁体积比是直接影响微胶囊包埋率以及成本的一个重要因素。壁材含量较低时不能对芯材包裹完全,形成微胶囊壳体相对柔软且不稳定,干燥过程中易皲裂,造成包埋率不佳。由图4可知,山茱萸黄酮微胶囊包埋率随着芯壁体积比上升出现了先升高后降低趋势,即当芯材和壁材的比值约为1∶11时,黄酮微胶囊包埋率最佳。这是因为随着壁材添加量增加,包裹在山茱萸黄酮周围的壁材量增加,导致微胶囊壳体厚度增加,黄酮包埋率也下降,同时增加加工成本。
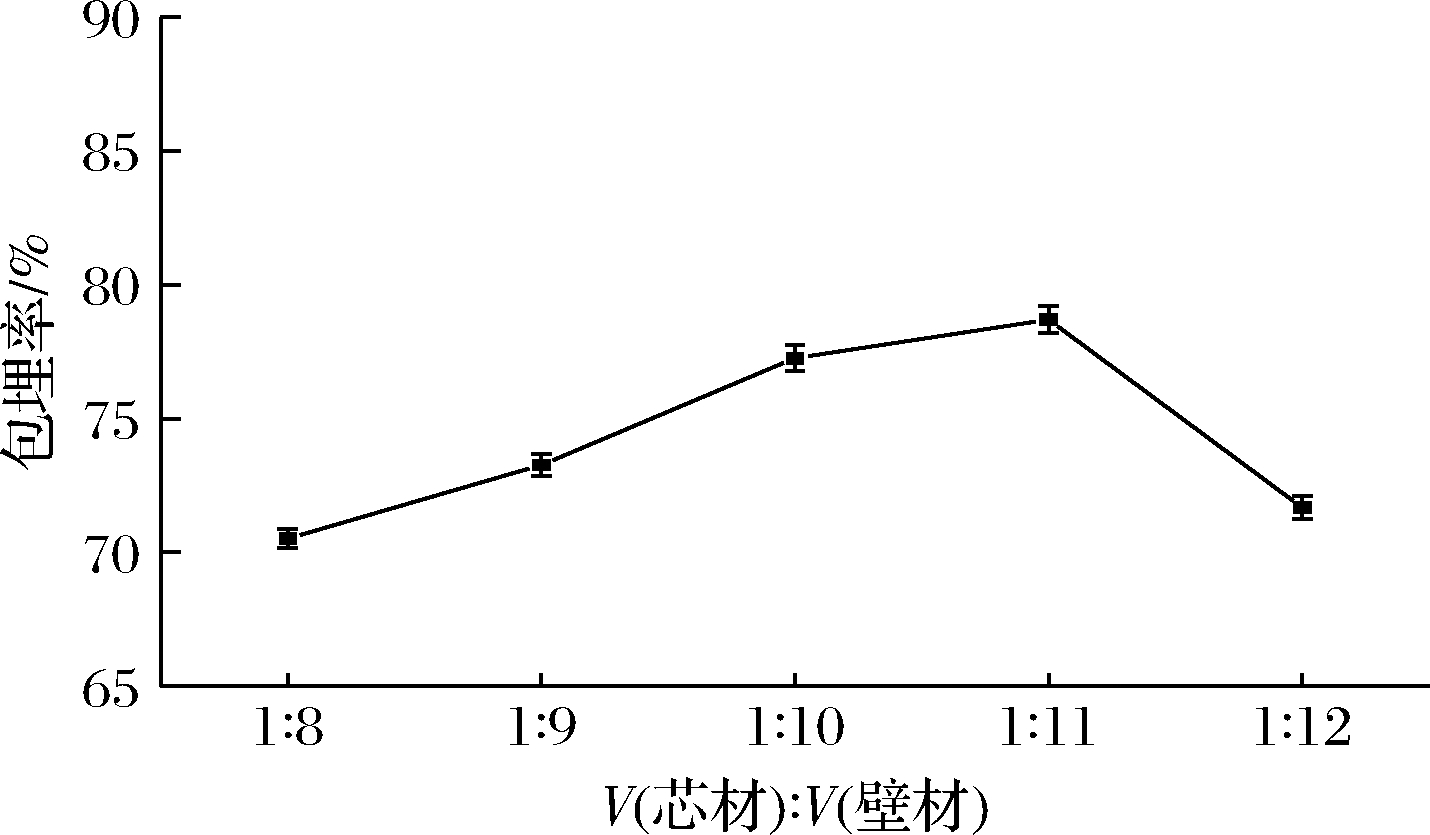
图4 芯壁体积比对山茱萸黄酮微胶囊包埋率的影响
Fig.4 Effect of core wall volume ratio on embedding rate of flavonoids microcapsules from C. officinalis
2.1.5 加热器温度对山茱萸黄酮微胶囊包埋率的影响
由图5可知,随着加热器温度的增加,山茱萸黄酮的包埋率也随之增加,在加热器温度为170 ℃时山茱萸黄酮微胶囊的包埋率达到最大值。随着加热器温度超过170 ℃时,微胶囊包埋率则产生下降现象。当加热器温度较低时液滴雾化时间延长,微胶囊产品水分含量高,稳定性、成膜性差且易粘连,因此降低了微胶囊包埋率。但是,加热器温度过高时,一方面可能会导致黄酮热分解,另一方面液滴水分蒸发速度过快,造成微胶囊表面产生硬壳、皱缩、皲裂现象,因此造成了包埋率低[19]。
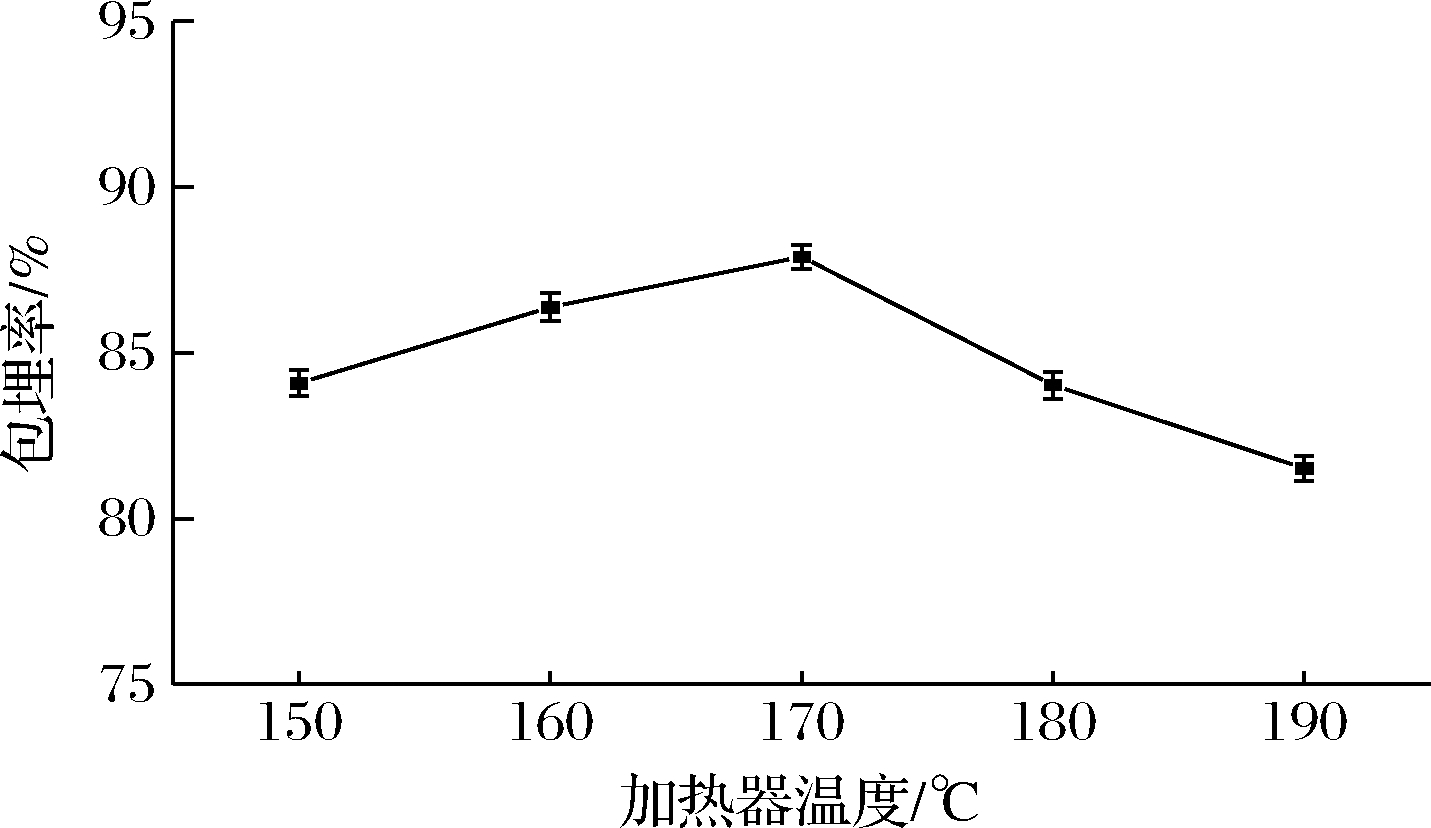
图5 加热器温度对山茱萸黄酮微胶囊包埋率的影响
Fig.5 Effect of heater temperature on embedding rate of flavonoids microcapsules from C. officinalis
2.2 山茱萸黄酮微胶囊制备的响应面优化试验
2.2.1 响应面模型与方差分析
为了优化山茱萸黄酮微胶囊化工艺参数,在上述单因素试验结果的基础上进行响应面优化试验,7个试验组合响应面设计及试验结果如表2所示。
表2 响应面设计及试验结果
Table 2 Response surface design and test results
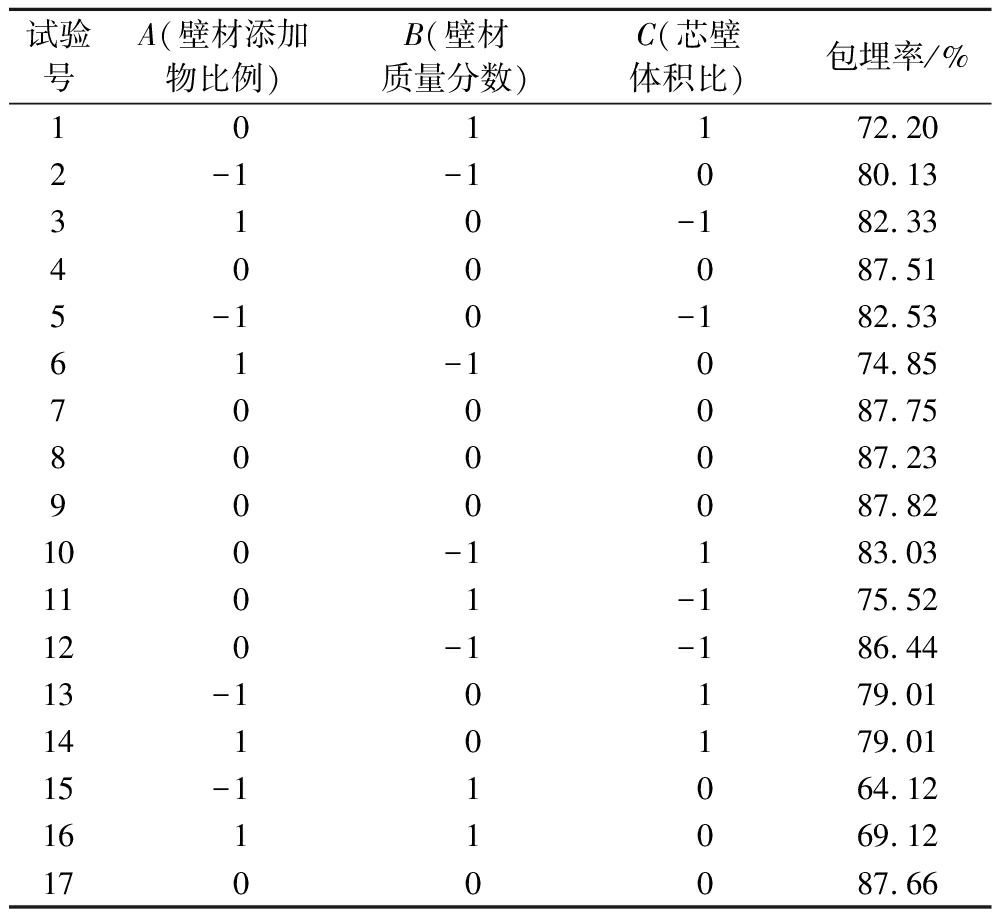
试验号A(壁材添加物比例)B(壁材质量分数)C(芯壁体积比)包埋率/%1 0 1 172.202-1-1080.13310-182.33400087.515-10-182.5361-1074.85700087.75800087.23900087.82100-1183.031101-175.52120-1-186.4413-10179.011410179.0115-11064.121611069.121700087.66
根据Design-Expert 8.0.6软件对表2试验数据进行二次完全回归拟合,得到山茱萸黄酮微胶囊包埋率对壁材质量比、壁材质量分数和芯壁体积比的回归方程,并对该方程进行显著性分析,结果如表3所示,回归方程为:Y=87.59-0.06A-5.44B-1.7C+2.57AB+0.05AC+0.023BC-7.06A2-8.48B2+0.18C2。根据表3可知,回归模型F值为2 907.23,其对应P<0.000 1,说明该模型极显著;失拟项F值=0.014,P值=0.997 3<0.05,失拟项不显著,说明该模型对试验结果拟合情况好,误差小,可以较好地描述各试验因素与响应值(包埋率)之间的关系;模型回归系数R2=0.998 9,说明山茱萸黄酮微胶囊实际值与模型预测值具有较好的重合度。
由表3可知,影响山茱萸黄酮对微胶囊包埋率的主要试验因素影响主次比是:壁材质量分数(B)>芯壁体积比(C)>壁材质量比(A)。其中B、C、A2、B2对微胶囊包埋率影响极显著(P<0.01);A、C2对微胶囊包埋率影响并不明显(P>0.05)。
图6为AB、AC、BC对包埋率影响的响应面和等高线图。A(壁材添加物质量比)与B(壁材质量分数)之间的交互作用对山茱萸黄酮微胶囊包埋率影响极显著,等高线图呈现椭圆且扁平;A(壁材添加物质量比)与C(芯壁体积比)之间交互作用对微胶囊包埋率影响较为显著,响应面曲线完全较陡;B(壁材质量分数)与C(芯壁体积比)之间交互作用响应面较为平缓,对山茱萸黄酮微胶囊包埋率影响较小。试验因素交互作用影响主次为:AB>AC>BC。
表3 二次多项式回归模型方差分析
Table 3 Analysis of variance of quadratic polynomial regression model
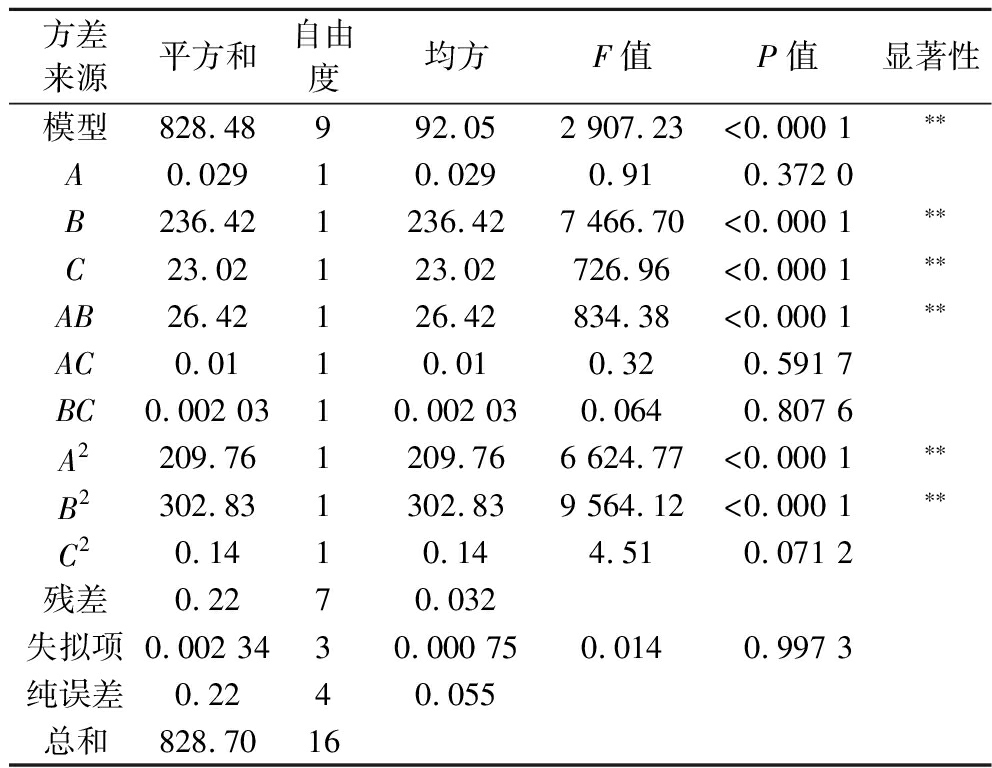
方差来源平方和自由度均方F值P值显著性模型828.48992.052 907.23<0.000 1∗∗A0.02910.0290.910.372 0B236.421236.427 466.70<0.000 1∗∗C23.02123.02726.96<0.000 1∗∗AB26.42126.42834.38<0.000 1∗∗AC0.0110.010.320.591 7BC0.002 0310.002 030.0640.807 6A2209.761209.766 624.77<0.000 1∗∗B2302.831302.839 564.12<0.000 1∗∗C20.1410.144.510.071 2残差0.2270.032失拟项0.002 3430.000 750.0140.997 3纯误差0.2240.055总和828.7016
注:**P<0.01,极显著。
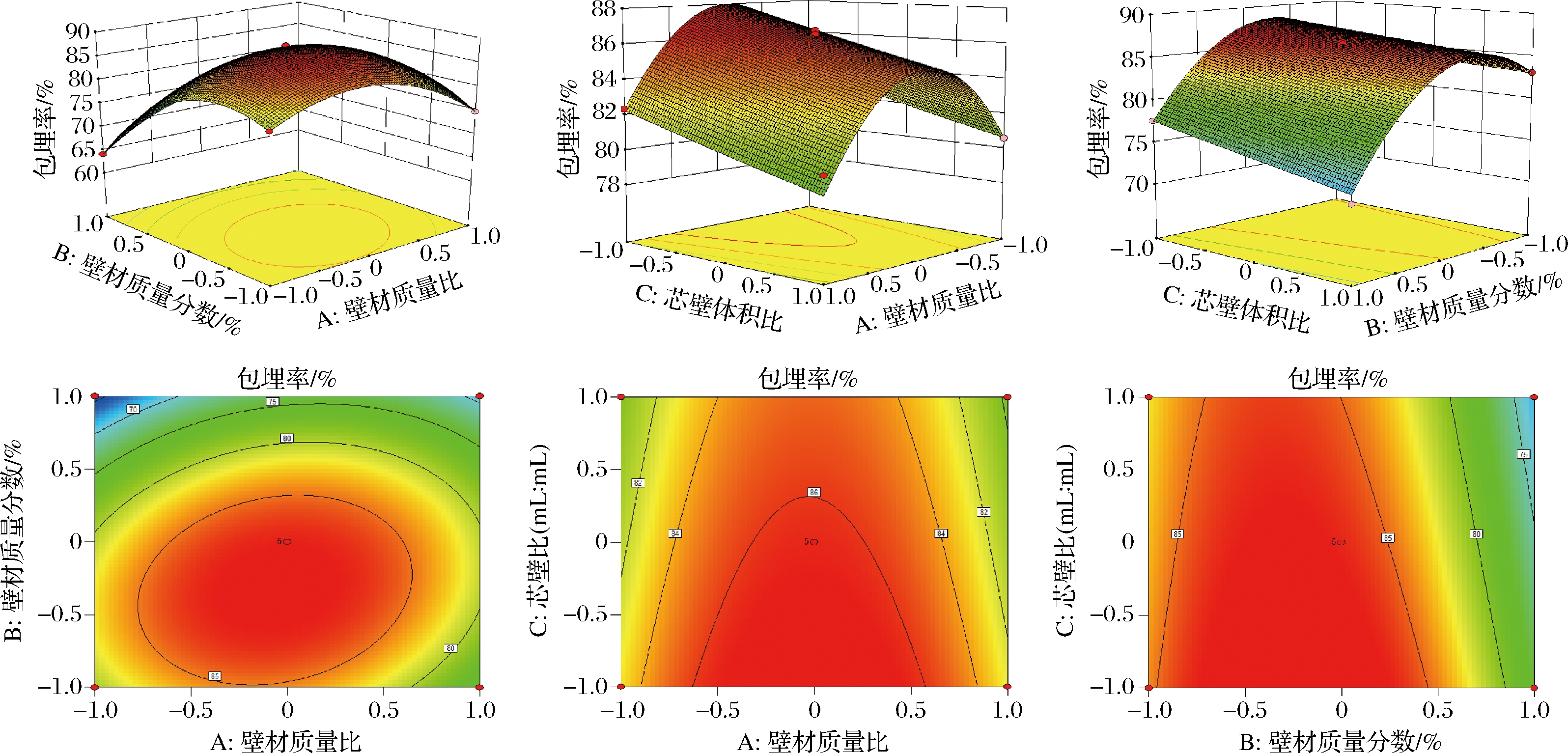
图6 因素交互作用对山茱萸黄酮微胶囊包埋率影响的响应面图与等高线图
Fig.6 Response surface diagram and contour diagram of the influence of factor interaction on the embedding rate of C. flavonoids microcapsules
2.2.2 工艺参数优化
通过Design-Expert 8.0.6软件分析结果,得到制备山茱萸黄酮微胶囊最佳工艺参数:壁材质量分数9.34%、壁材质量比1.07∶1、芯壁体积比1∶10。在此条件下山茱萸黄酮微胶囊理论包埋率可达到90.39%。为了检验最优工艺参数下黄酮微胶囊理论包埋率与实际包埋率是否一致,考虑在实际操作过程中的便利性,在壁材质量分数9%、壁材添加物质量比1∶1、芯壁体积比为1∶10的条件下,得到山茱萸黄酮微胶囊平均包埋率为88.61%,相对误差约为1.76%,表明响应面优化试验所得结果可靠,较适合山茱萸黄酮微胶囊制备工艺。
2.3 山茱萸黄酮微胶囊制备理化性质分析
2.3.1 微胶囊含水率、溶解度、色价、比容以及DPPH自由基清除能力
按照优化工艺条件下制备的山茱萸黄酮微胶囊产品外观为淡粉色粉末,颗粒细腻均匀,无特殊异味。微胶囊溶解度为75.2%;色价为3.89±0.24;比容为3.14±0.25;DPPH自由基清除率为(59.51±1.73)%;产品含水率为2.1%,低于食品中粉末制品最低要求(<4%),较低含水率环境中微生物生长受到抑制,有利于产品贮藏稳定性[20]。研究发现,根据人类饮食习惯的不同对于黄酮物质摄入来源有一定差异,但正常摄入黄酮含量仅有几百毫克[21]。富含黄酮类化合物的食物在食用前均需要加工处理,由于黄酮化合物稳定性差,对环境敏感,加工条件必然会影响其生物活性。通过此方法将黄酮包裹在壁材内,可以提高黄酮稳定性,添加到食品中,可用于生产功能性产品应用到日常生活中。
2.3.2 微胶囊热性能分析
DSC揭露了被包裹物质在封装系统中的热稳定性,侧面反映了微胶囊的贮藏条件及缓释特性。由图7可知,空载微胶囊以及山茱萸黄酮微胶囊的熔融温度分别为85.48、90.34 ℃,说明山茱萸黄酮微胶囊在室温下保存可以保持稳定的玻璃态,经热处理后产品形态结构仍能保持完整,同时有利于加工及贮藏,延长产品货架期。与空载微胶囊相比,加入黄酮后的微胶囊没有新的峰出现,说明壁材与芯材之间没有发生化学作用,但从图7中可看出熔点向更高温度转变。这种热变化与物质之间物理相互作用有关[16]。
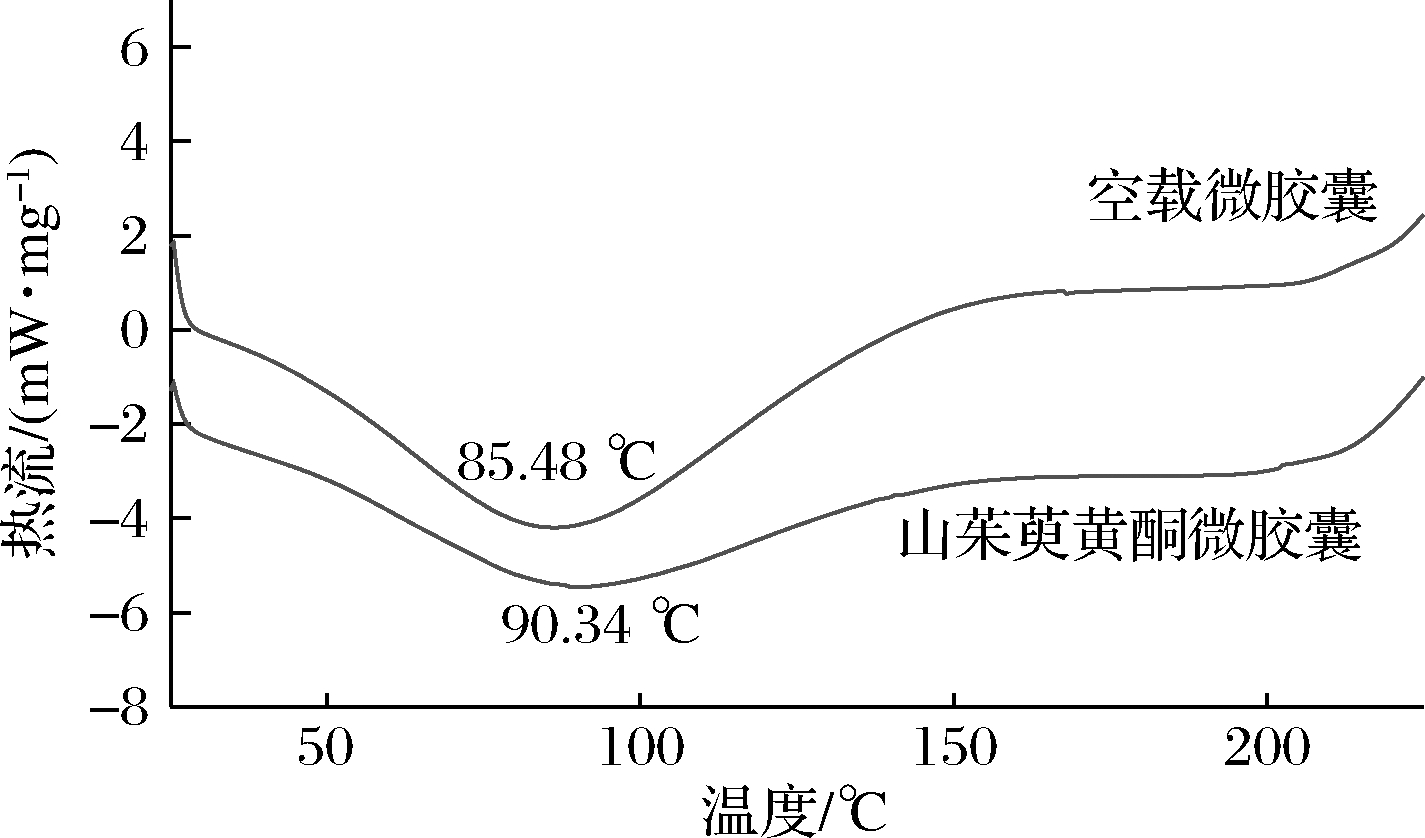
图7 山茱萸黄酮微胶囊的差示扫描量热图
Fig.7 Differential scanning calorimetry of flavonoids microcapsules from C. officinalis
2.4 微胶囊形态分析
微胶囊的性质与其本身结构形态有很大关系,比如胶囊内活性成分的缓释速率以及微胶囊的流动性。山茱萸黄酮微胶囊最佳包埋条件下的形貌如图8所示。喷雾干燥条件下制备的山茱萸黄酮微胶囊呈现球形,结构完整且光滑,颗粒大小相对均匀,另外,部分颗粒表面出现凹陷和褶皱,这是喷雾干燥粉末产品一个非常常见的现象。可能的原因是喷雾干燥过程中颗粒水分迅速蒸发以及微胶囊内部晶体结构受损,从而导致颗粒表面产生不规则凹陷现象[22]。而喷雾干燥处理后的乳滴,黄酮被完全包裹在壁材内,无皲裂、空洞现象,说明壁材可以起到很好的支撑作用。

图8 山茱萸黄酮微胶囊形貌
Fig.8 Morphology of flavonoids microcapsules from C. officinalis
2.5 微胶囊粒径分析
微胶囊的粉末颗粒大小影响了其最终质量和特性,颗粒越小,包埋效果越好且包埋物越易释放[23]。由图9可知,最佳包埋工艺条件下山茱萸黄酮微胶囊的粒径呈正态分布且较狭窄,一般粒度为23 μm,这是由于在喷雾干燥过程中,雾化压力增加,引起乳液喷出速率加快,从而减少液滴的粒径,另外,喷雾干燥法技术干燥速率快,能耗低,可有效降低微胶囊制备成本。综上所述,采用喷雾干燥法制备微胶囊产品,可保证产品性能。
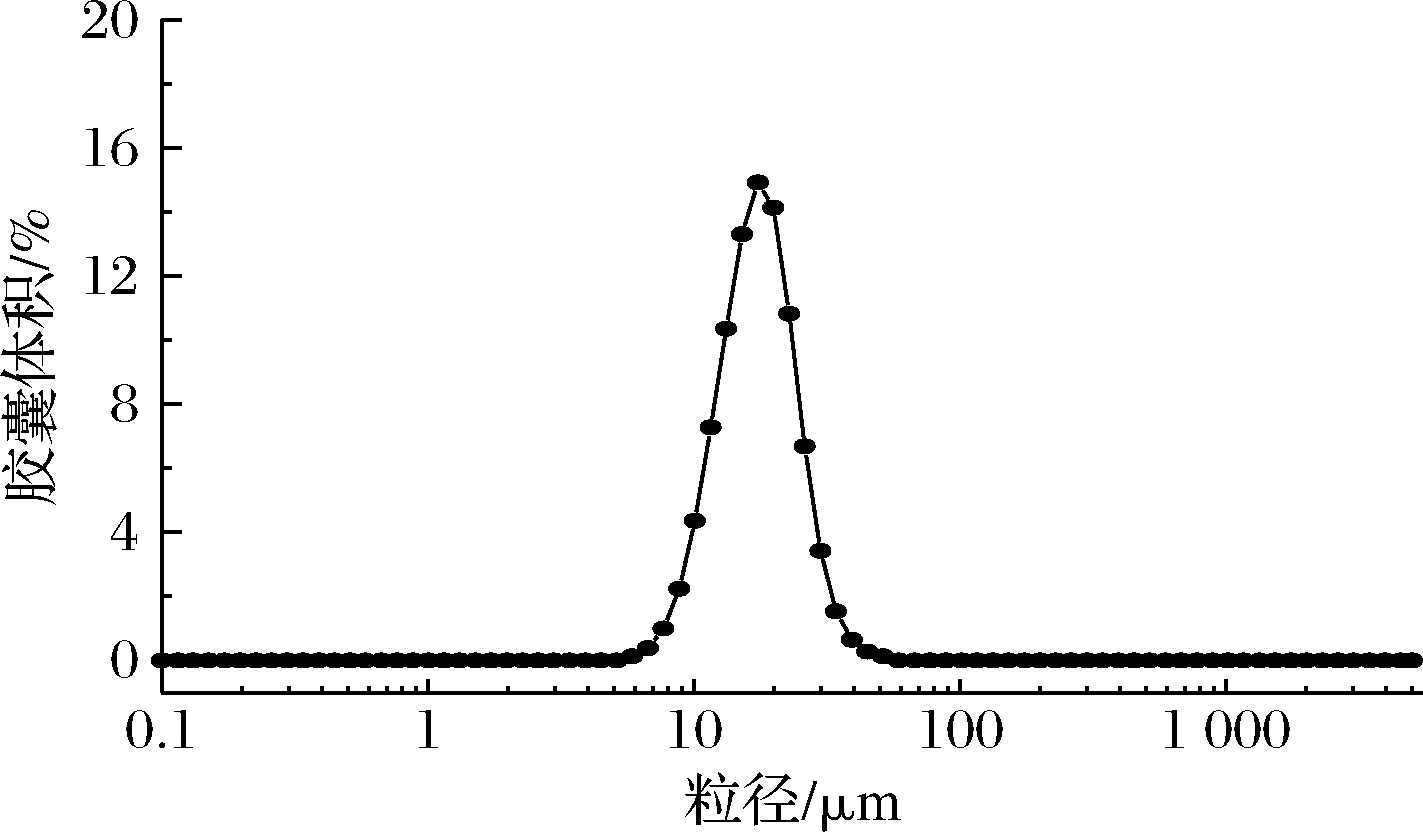
图9 山茱萸黄酮微胶囊粒径分布
Fig.9 Particle size distribution of flavonoids microcapsules from C. officinalis
2.6 微胶囊短程有序性结构分析
红外光谱图为分子振-转光谱,每个化学键和官能团都可产生多种振动形式,在红外光区可找到相应的吸收峰位置,用于分析化合物特性以及物质之间相互作用[24]。由图10-a可知,山茱萸黄酮在3 406 cm-1处具有明显的—OH特征振动吸收峰,这说明有酚羟基或糖上羟基的存在,在1 698、1 635 cm-1分别对应C![]() O和C
O和C![]() C伸缩振动峰,在2 934、1 316 cm-1附近处有明显的—CH2和—CH3吸收峰的存在,说明饱和碳原子上存在较多的氢,在1 075 cm-1处吸收峰很强,是C—O—C反对称伸缩振动峰。此外,观察到位于在1 455 cm-1处具有苯环(C
C伸缩振动峰,在2 934、1 316 cm-1附近处有明显的—CH2和—CH3吸收峰的存在,说明饱和碳原子上存在较多的氢,在1 075 cm-1处吸收峰很强,是C—O—C反对称伸缩振动峰。此外,观察到位于在1 455 cm-1处具有苯环(C![]() C)振动特征吸收峰[25]。比较图10-b~图10-e的红外光谱图中可以看出,乳清分离蛋白与阿拉伯胶的物理混合物与其单体成分相比没有发生任何变化,说明两者之间没有相互作用;空载微胶囊与纯乳清分离蛋白和阿拉伯胶相比没有发生本质变化,这说明两者之间在形成复合物过程中只存在静电相互作用,没有形成新的化学键。根据图10-f红外光谱图可知,同图10-a相比较,壁材与芯材经过喷雾干燥形成微胶囊后红外光谱图无根本改变,保留了山茱萸黄酮的吸收特征峰,只是在1 500~1 200 cm-1范围内的光谱吸收峰减弱,1 635 cm-1处C
C)振动特征吸收峰[25]。比较图10-b~图10-e的红外光谱图中可以看出,乳清分离蛋白与阿拉伯胶的物理混合物与其单体成分相比没有发生任何变化,说明两者之间没有相互作用;空载微胶囊与纯乳清分离蛋白和阿拉伯胶相比没有发生本质变化,这说明两者之间在形成复合物过程中只存在静电相互作用,没有形成新的化学键。根据图10-f红外光谱图可知,同图10-a相比较,壁材与芯材经过喷雾干燥形成微胶囊后红外光谱图无根本改变,保留了山茱萸黄酮的吸收特征峰,只是在1 500~1 200 cm-1范围内的光谱吸收峰减弱,1 635 cm-1处C![]() C伸缩振动峰消失,这是因为黄酮进入微胶囊内,导致化学键伸缩振动受限。此外,1 650、1 540、1 074 cm-1处产生更加强而宽的吸收峰,这是因为黄酮与壁材之间具有坚固的结合作用。
C伸缩振动峰消失,这是因为黄酮进入微胶囊内,导致化学键伸缩振动受限。此外,1 650、1 540、1 074 cm-1处产生更加强而宽的吸收峰,这是因为黄酮与壁材之间具有坚固的结合作用。
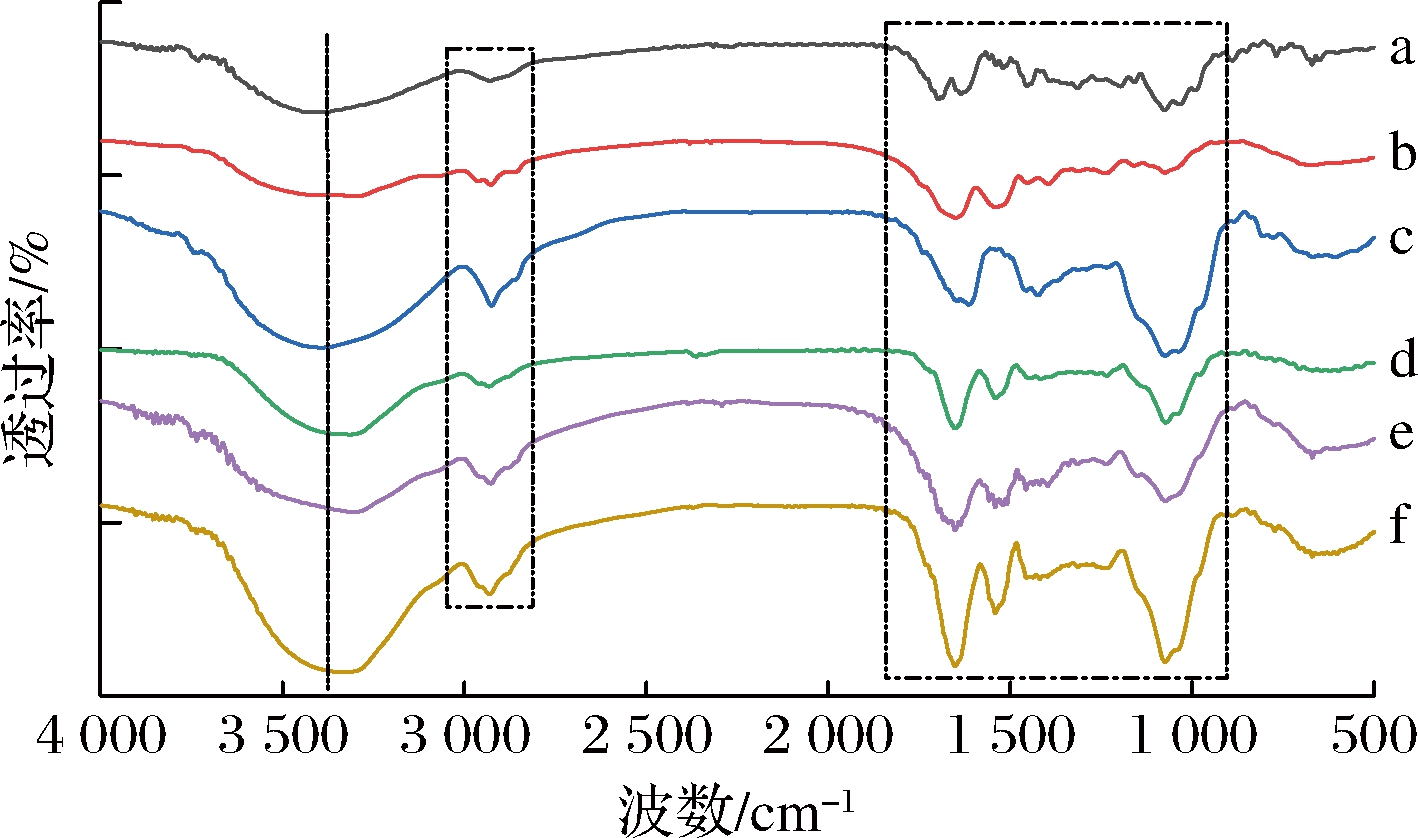
a-山茱萸黄酮;b-WPI;c-空载微胶囊;d-GA: e-WPI-GA物理混合物;f-山茱萸黄酮微胶囊
图10 山茱萸黄酮微胶囊及其单体成分红外光谱图
Fig.10 Infrared spectra of flavonoids microcapsules and their monomers from C. officinalis
2.7 微胶囊荧光光谱分析
蛋白质分子内的荧光强度可以用来反映蛋白质结合程度。由图11可知,对比纯乳清分离蛋白,复合物的荧光强度均有所降低,且荧光发射最大值产生一定程度的红移。相比较空载微胶囊,由于黄酮的加入,导致明显的荧光猝灭效应,这是因为黄酮与壁材的疏水区相互作用,使得荧光基团暴露在疏水环境中,同时说明了微胶囊能够产生更加牢固的屏蔽效应,结构也更加紧密,通过样品的红外光谱图得到相似的结果。
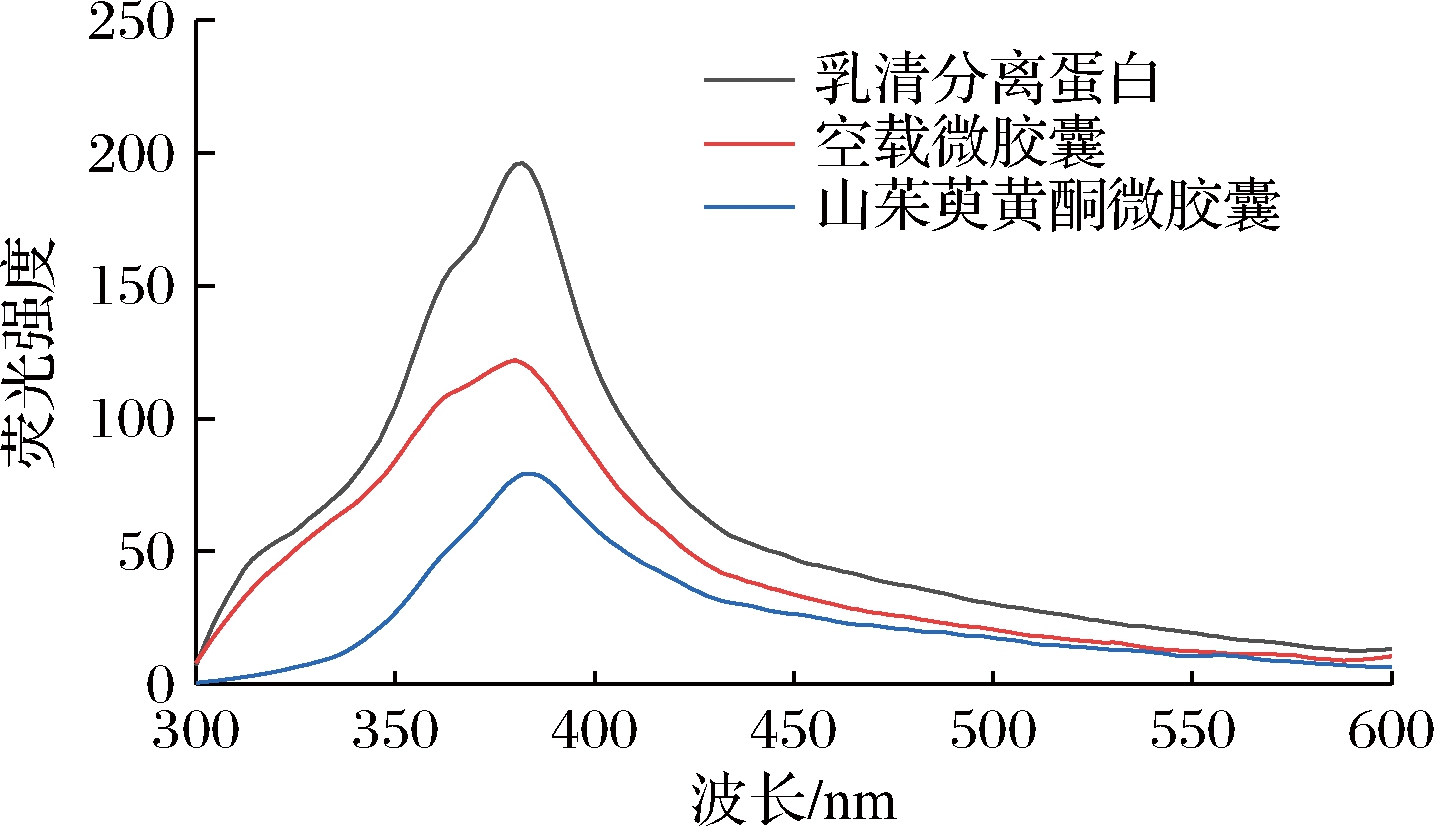
图11 山茱萸黄酮微胶囊荧光光谱图
Fig.11 Fluorescence spectra of flavonoids microcapsules from C. officinalis
2.8 微胶囊紫外光谱分析
图12为喷雾干燥法制备山茱萸黄酮微胶囊经过超声波处理后的紫外光谱图。超声波处理后黄酮微胶囊样品出现2个吸收峰,分别是240~300 nm吸收峰Ⅱ带和300~400 nm吸收峰Ⅰ带,其中吸收峰Ⅰ带是相对较弱的肩峰,吸收Ⅰ带明显弱于吸收Ⅱ带,但均属于黄酮类化合物的紫外可见吸收光谱特征峰[23]。未经超声波处理的黄酮微胶囊紫外扫描光谱有较小的特征峰,说明黄酮化合物与壁材的结合作用,使得黄酮被紧密地包裹在胶囊中,从而使微胶囊表面黄酮含量更少。结合包埋率、微观结构以及粒径结果表明,最佳包埋工艺下制备微胶囊具有良好品质。
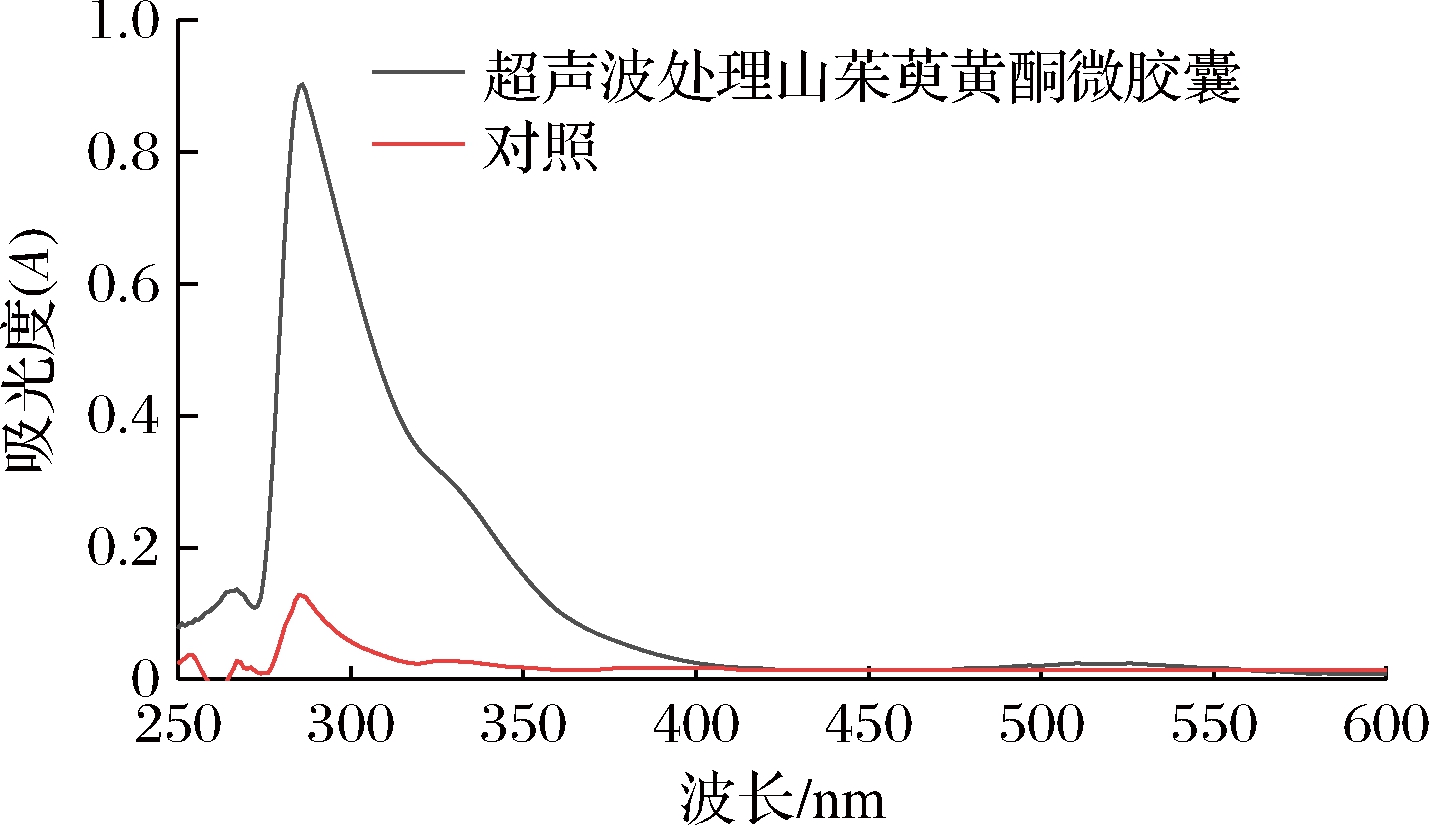
图12 山茱萸黄酮微胶囊紫外-可见光谱图
Fig.12 UV-vis spectra of flavonoids microcapsules from C. officinalis
3 结论与讨论
本研究以乳清分离蛋白、阿拉伯胶为壁材,通过单因素和响应面试验优化山茱萸黄酮微胶囊制备工艺,得出最佳制备工艺参数:壁材质量分数9.34%、壁材质量比1.07∶1、芯壁体积比1∶10、进料温度170 ℃、pH 3,山茱萸黄酮微胶囊包埋率达到90.39%。最佳制备工艺参数下,山茱萸黄酮微胶囊具有良好热性能,其熔融温度为90.34 ℃,高于贮藏温度(25 ℃),可在常温下保存。扫描电镜显示微胶囊具有良好形态,表面光滑且结构完整,平均粒径为23 μm。通过对微胶囊进行光谱分析表明,山茱萸黄酮被有效地包裹在壁材中,且芯材与壁材未产生化学相互作用,保证了山茱萸黄酮的生物活性和完整性。进一步说明了所选制备方式及壁材能够成功包埋山茱萸黄酮,切实提高山茱萸黄酮化合物在人体内的生物利用度;同时采用乳清分离蛋白作为壁材,可赋予微胶囊产品更高的营养价值。
[1] LIUY H, ZHU W X, LUO L, et al.Drying characteristics and process optimization of vacuum far-infrared radiation drying on Cornus officinalis[J].Advanced Materials Research, 2012, 554-556:1 459-1 465.
[2] PAWLOWSKAA M, CAMANGI F, BRACA A.Quali-quantitative analysis of flavonoids of Cornus masL.(Cornaceae) fruits[J].Food Chemistry, 2010, 119(3):1 257-1 261.
[3] D’COSTAA S, BORDENAVE N.Inhibition of starch digestion by flavonoids:Role of flavonoid-amylase binding kinetics[J].Food Chemistry, 2021, 341(Pt 2):128256.
[4] DONGY, FENG Z L, CHEN H B, et al.Corni Fructus:A review of chemical constituents and pharmacological activities[J].Chinese Medicine, 2018, 13:34.
[5] POPOVI B M, STAJNER D, SLAVKO K, et al.Antioxidant capacity of cornelian cherry (Cornus masL.):Comparison between permanganate reducing antioxidant capacity and other antioxidant methods[J].Food Chemistry, 2012, 134(2):734-741.
B M, STAJNER D, SLAVKO K, et al.Antioxidant capacity of cornelian cherry (Cornus masL.):Comparison between permanganate reducing antioxidant capacity and other antioxidant methods[J].Food Chemistry, 2012, 134(2):734-741.
[6] KESARKARS, BHANDAGE A, DESHMUKH S, et al.Flavonoids:An overview[J].Journal of Pharmacy Research, 2009, 2(6):1 148-1 154.
[7] HOSSEINPOUR-JAGHDANIF, SHOMALI T, GHOLIPOUR-SHAHRAKI S, et al.Cornus mas:A review on traditional uses and pharmacological properties[J].Journal of Complementary &Integrative Medicine, 2017, 14(3):1-9.
[8] 俞邱豪,程焕, 王楠, 等.类黄酮微胶囊技术及其在食品工业中的应用进展[J].中国食品学报, 2017, 17(7):175-183.
YU Q H, CHENG H, WANG N, et al.Research progress on microencapsulation of flavonoids and application in food industry[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(7):175-183.
[9] SHADDELR, HESARI J, AZADMARD-DAMIRCHI S, et al.Use of gelatin and gum Arabic for encapsulation of black raspberry anthocyanins by complex coacervation[J].International Journal of Biological Macromolecules, 2018, 107:1 800-1 810.
[10] 庞佳坤,郑远荣, 刘振民, 等.超高压对乳清分离蛋白结构和抗氧化活性的影响[J].食品与发酵工业, 2020, 46(4):72-77.
PANG J K, ZHENG Y R, LIU Z M, et al.Effects of ultra-high pressure on structure and antioxidant activity of whey protein isolates[J].Food and Fermentation Industries, 2020, 46(4):72-77.
[11] 孙建瑞,赵君峰, 原江锋, 等.响应面法优化豫西山茱萸叶黄酮的提取及其抑菌和抗氧化活性[J].天然产物研究与开发, 2020, 32(4):672-680.
SUN J R, ZHAO J F, YUAN J F, et al.Extraction process optimization of flavonoids from Cornus officinalisleaves and its antibacterial and antioxidant activity[J].Natural Product Research and Development, 2020, 32(4):672-680.
[12] 李加兴,陈选, 邓佳琴, 等.黄秋葵黄酮的提取工艺和体外抗氧化活性研究[J].食品科学, 2014, 35(10):121-125.
LI J X, CHEN X, DENG J Q, et al.Extraction and antioxidant activity in vitroof okra flavonoids[J].Food Science, 2014, 35(10):121-125.
[13] 孙亚利,周文美, 黄永光, 等.以聚合乳清蛋白为壁材的苦荞黄酮微胶囊化及其品质分析[J].食品科学, 2020, 41(12):259-266.
SUN Y L, ZHOU W M, HUANG Y G, et al.Microencapsulation and quality analysis of Tartary buckwheat flavonoids using polymerized whey protein as wall material[J].Food Science, 2020, 41(12):259-266.
[14] KUCKL S, NORE A C P Z.Microencapsulation of grape (Vitis labruscavar.Bordo) skin phenolic extract using gum Arabic, polydextrose, and partially hydrolyzed guar gum as encapsulating agents[J].Food Chemistry, 2016, 194:569-576.
A C P Z.Microencapsulation of grape (Vitis labruscavar.Bordo) skin phenolic extract using gum Arabic, polydextrose, and partially hydrolyzed guar gum as encapsulating agents[J].Food Chemistry, 2016, 194:569-576.
[15] 任广跃,刘亚男, 乔小全, 等.基于变异系数权重法对怀山药干燥全粉品质的评价[J].食品科学, 2017, 38(1):53-59.
REN G Y, LIU Y N, QIAO X Q, et al.Quality evaluation of Chinese yam drying powder based on variation coefficient weight[J].Food Science, 2017, 38(1):53-59.
[16] HUY, LI Y, ZHANG W L, et al.Physical stability and antioxidant activity of citrus flavonoids in Arabic gum-stabilized microcapsules:Modulation of whey protein concentrate[J].Food Hydrocolloids, 2018, 77:588-597.
[17] JAINA, THAKUR D, GHOSHAL G, et al.Microencapsulation by complex coacervation using whey protein isolates and gum Acacia:An approach to preserve the functionality and controlled release of β-carotene[J].Food and Bioprocess Technology, 2015, 8(8):1 635-1 644.
[18] MOGHBELIS, JAFARI S M, MAGHSOUDLOU Y, et al.Influence of pectin-whey protein complexes and surfactant on the yield and microstructural properties of date powder produced by spray drying[J].Journal of Food Engineering, 2019, 242:124-132.
[19] 毛莹,帅晓艳, 王惠玲, 等.基于内源乳化法和喷雾干燥优化制备花色苷微胶囊及其稳定性分析[J].食品科学, 2020, 41(2):267-275.
MAO Y, SHUAI X Y, WANG H L, et al.Preparation and stability evaluation of anthocyanin microcapsules by emulsification/internal gelation with optimized spray drying[J].Food Science, 2020, 41(2):267-275.
[20] EDRISA E, KALEMBA D, ADAMIEC J, et al.Microencapsulation of Nigella sativaoleoresin by spray drying for food and nutraceutical applications[J].Food Chemistry, 2016, 204:326-333.
[21] FUY, LIU W N, SOLADOYE O P.Towards innovative food processing of flavonoid compounds:Insights into stability and bioactivity[J].LWT, 2021, 150:111968.
[22] JIAC S, CAO D D, JI S P, et al.Whey protein isolate conjugated with xylo-oligosaccharides via Maillard reaction:Characterization, antioxidant capacity, and application for lycopene microencapsulation[J].LWT, 2020, 118:108837.
[23] MAHDIA A, MOHAMMED J K, AL-ANSI W, et al.Microencapsulation of fingered citron extract with gum Arabic, modified starch, whey protein, and maltodextrin using spray drying[J].International Journal of Biological Macromolecules, 2020, 152:1 125-1 134.
[24] 陈程莉,李丰泉, 刁倩, 等.黑枸杞花青素微胶囊优化及理化特性分析[J].食品与发酵工业, 2020, 46(5):208-214.
CHEN C L, LI F Q, DIAO Q, et al.Optimization and analysis of physical and chemical properties of black Lycium ruthenicumMurr anthocyanin microcapsules[J].Food and Fermentation Industries, 2020, 46(5):208-214.
[25] 陈瑾,陈晶华, 刘利平, 等.枸杞叶黄酮提取物的纯化及组成结构分析[J].食品工业科技, 2019, 40(18):28-34;40.
CHEN J, CHEN J H, LIU L P, et al.Purification and structural analysisof flavonoids from Lycium barbarumleaves[J].Science and Technology of Food Industry, 2019, 40(18):28-34;40.