由于人工合成的色素添加剂的潜在安全风险,消费者和食品厂商越来越青睐天然色素添加剂。天然色素叶绿素广泛分布于绿色水果和蔬菜中,是高等植物和其他所有能进行光合作用的生物体含有的一类绿色色素。高等植物中的叶绿素主要是叶绿素a和叶绿素b,比例约为3∶1。叶绿素有着多种生理功能,如抗氧化、抗癌、抗突变的功能,但是其稳定性差,在光、酸、氧、高温等环境下容易分解[1]。叶绿素分解后直接导致果蔬制品色泽发生变化,不仅影响果蔬制品的感官品质,同时影响其自身的生理活性。叶绿素由于其含有高度疏水的酯化植醇尾部(C20H39),在水环境中溶解性不好,不利于在食品工业的开发利用。而采用微胶囊技术对叶绿素进行包埋则是一种较好的保护方式,可有效避免叶绿素与外界不良环境接触,防止叶绿素的破坏与损失,有利于维持叶绿素原有的性能与生物活性[2]。
近年来采用微胶囊技术包埋脂溶性植物化学物质的研究越来越多。JAIN等[3]确定了利用酪蛋白和黄芪胶作为复合壁材对β-胡萝卜素进行包埋的最佳条件为酪蛋白与黄芪胶的质量比为2∶1,pH为4.35,包埋率达79%。苗欣月等[4]利用喷雾干燥法对糜子壳油进行微胶囊化包埋,确定了乳化剂添加量1.8%,麦芽糊精和大豆分离蛋白的混合溶液与糜子壳油的质量比为3∶1,麦芽糊精与乳清分离蛋白的质量比为1.2∶1,可以使得糜子壳油微胶囊的包埋率达90%。在众多方法中,复合凝沉法制备微胶囊不需要使用大型仪器,易操作,经济成本低,效率高,能够广泛应用于食品工业中。其原理是利用带相反电荷的生物大分子通过静电相互作用结合而产生复合结构[5],将需要包封的物质包封于复合结构内,以达到包封效果。
明胶是胶原部分水解后的一种大分子的亲水胶体,广泛应用于照相、食品、医药等领域,具有价格低廉、生物降解性良好与组织相容性等特点,可以单独或者与其他材料复合凝沉形成包埋封装材料[6]。果胶是一种天然的大分子多糖,是植物细胞壁的组成成分,在食品行业中也是一种重要的乳化剂,广泛用作果酱、酸奶、果汁和冰淇淋等食品中的稳定剂或增稠剂[7]。已有研究利用明胶和果胶包埋封装肉桂醛[8],证明它们是优质的包埋材料,而目前还没有采用二者包埋叶绿素的研究。前期试验发现明胶可以同叶绿素提取液形成胶体溶液,为进一步采用复合凝沉法制备叶绿素微胶囊提供了前提条件。据此,本研究利用复合凝沉法并结合中心组合设计研究明胶/果胶-叶绿素微胶囊的制备工艺,得到其最优工艺参数并研究制备的叶绿素微胶囊的性质,为脂溶性天然色素在食品工业中的应用提供借鉴和参考。
1 材料与方法
1.1 材料与试剂
菠菜,重庆市北碚区天生丽街永辉超市;乙醇、正己烷和丙酮,均为分析纯,重庆川东化工(集团)有限公司;果胶半乳糖醛酸(CAS:9000-69-5),上海麦克林生化科技有限公司;明胶(CAS:9000-70-8),上海迈瑞尔化学技术有限公司;乙酸铵、高效液相色谱纯丙酮和甲醇,Sigma-Aldrich贸易有限公司。
1.2 仪器与设备
Vortex-2涡旋混匀仪,上海沪析实业有限公司;离心机,湖南湘仪实验室仪器开发有限公司;磁力搅拌器,上海力辰邦西仪器科技有限公司;pH计,赛多利斯科学仪器(北京)有限公司;三孔电热恒温水槽、电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;KQ5200DE型数控超声波清洗器,昆山市超声仪器有限公司;WR-18精密色差仪,深圳市威福光电科技有限公司;Agilent 1290超高效液相色谱仪,美国Agilent公司;Mastersizer 3000(Malvern Nano ZS90)型激光粒度分析仪,英国Malvern Panalytical公司;扫描电镜(Phenom Prox, software version 4.5.5),荷兰Phenom World公司;Talos F200X透射电镜,美国Thermo Fisher Scientific公司;Alpha 2-4 LSCplus冷冻干燥机,德国Christ公司。
1.3 实验方法
1.3.1 叶绿素的提取与检测
参考张秀君等[9]的方法并稍作改进,先将购买的菠菜洗净,去除根茎。将叶片剪碎,并加入适量体积分数95%的乙醇,匀浆后,用8层纱布过滤,弃去第1次滤液(大部分为水及部分色素),继续用95%乙醇提取菠菜中的叶绿素,直至菠菜渣颜色逐渐变黄。将所得的滤液40 ℃减压旋转挥干乙醇,弃去水分,用无水乙醇溶解黏附在蒸发瓶上的叶绿素,并超声3 min,将所得的提取液离心(2 000 r/min)5 min。过滤(0.22 μm)后即为叶绿素乙醇溶液。
叶绿素的检测采用超高效液相-二极管阵列检测器(ultra-high performance liquid phase-diode array detector,UPLC-DAD)进行,UPLC型号为Agilent 1290,配有自动进样系统和DAD检测器。分析柱为C18柱(Poroshell 120,1.9 μm),2.1 mm×100 mm,并配有同等材质的保护柱。检测方法参考实验室已经建立的方法[10-11]进行。UPLC流速为0.2 mL/min,流动相A为V(甲醇)∶V(水)=8∶2,流动相B为V(甲醇)∶V(丙酮)=1∶1,流动相中均加入50 mmol/L乙酸铵。采用梯度洗脱程序:0~15 min,25%B~100%B;15~20 min,100%B;20~25 min,25%B。DAD检测器记录190~800 nm信号,分别在410、430、450 nm下检测叶绿素及其衍生物,结合实验室标准品、保留时间、吸光性质定性叶绿素及其衍生物,并利用已经建立的标准曲线定量叶绿素及其衍生物。
1.3.2 复合凝沉法制备明胶/果胶微胶囊的单因素试验设计
选取pH(3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0)、明胶与果胶的质量比(2∶1、3∶1、4∶1、5∶1、6∶1)、明胶与叶绿素的质量比(20∶1、30∶1、40∶1、50∶1、60∶1、70∶1)为试验因素,探究其对明胶/果胶微胶囊包埋率的影响。
利用三孔电热恒温水槽在40 ℃条件下制备质量分数0.4%的明胶和果胶溶液。参考JAIN等[3]的方法并稍作改进,将对应质量的叶绿素m1加入明胶溶液,在磁力搅拌器400 r/min的条件下搅拌30 min,将叶绿素与明胶混匀。将制备的30 mL果胶溶液加入叶绿素与明胶的混合溶液,再次在磁力搅拌器400 r/min的条件下搅拌10 min,形成明胶-叶绿素-果胶复合物,向体系滴加0.1 mol/L盐酸或0.1 mol/L NaOH溶液以达到相应pH,静置5 min,在10 000 r/min条件下离心15 min,分离上清液和微胶囊。取微胶囊加入正己烷,用Vortex-2涡旋混匀仪低速涡旋3 min,逐次洗至正己烷相为无色,用以分离微胶囊表面未包埋的叶绿素。往微胶囊中加入20 mL丙酮,涡旋振荡后超声处理10 min,直至微胶囊颜色逐渐变白。检测丙酮溶液中叶绿素的含量m2。
叶绿素包埋率的计算如公式(1)所示:
包埋率![]()
(1)
1.3.3 响应面因素及水平设置
单因素试验结果反映出各因素的水平,设计Box-Behnken响应面试验,响应面试验因素和水平见表1。具体试验过程与单因素试验过程相同。
表1 因素及水平表
Table 1 Factors and levels table

因素水平-101A 明胶与果胶的质量比3∶15∶17∶1B 明胶与叶绿素的质量比20∶130∶140∶1C pH3.54.55.5
1.3.4 微胶囊的性质测定
通过Box-Behnken响应面试验得到的最优化结果大量制备样品,将样品冷冻干燥(-63 ℃,24 h),并研磨成粉末状,以进行以下的性质测定。
1.3.4.1 耐光性测定
参考KHAN等[12]的方法并改进,将50 mg微胶囊粉末溶于10 mL 5%乙醇溶液中,在阳光下放置21 d,在0、21 d时加入4倍体积的丙酮,离心,过滤(0.22 μm),上样UPLC-DAD检测分析叶绿素的含量和分布。
1.3.4.2 抗酸性测定
参考KHAN等[12]的方法并改进,利用pH计加酸调整10 mL 5%乙醇溶液的pH到2.5、4.5、6.5,将50 mg微胶囊粉末溶于相应pH的乙醇溶液中,并利用Vortex-2涡旋混匀仪在最高速度下涡旋振荡20 min后,调节pH值为7,加入4倍体积的丙酮,离心,过滤(0.22 μm),上样UPLC-DAD检测分析叶绿素的含量和分布。
1.3.4.3 色泽测定
参考黄山等[13]的方法,使用WR-18精密色差仪测定微胶囊样品的颜色特征。首先用黑白板进行颜色校正,然后测定样品L*、a*、b*值,重复测定6次,其中L*表示样品的黑白度(值越小越偏黑,值越大越偏白);a*表示红绿度(值越小越偏绿,值越大越偏红);b*表示黄蓝度(值越小越偏蓝,值越大越偏黄),c*表示饱和度,数值越大表示饱和度越高;h°表示色调,数值从0°到60°再到180°逆时针变化,色调从红到黄到绿变化,数值从0°到-60°到-180°顺时针变化,色调变化从红到蓝到绿[14]。
1.3.4.4 粒径测定
参考雷爱玲等[15]的方法并作适当修改,以纯水为分散系,折射率为1.33,向纯水中加入明胶/果胶微胶囊样品,利用激光粒度分析仪测定微胶囊样品粒径及其分布,重复测量6次。
1.3.4.5 微观结构测定
参考汤彩碟等[16]的方法,将明胶/果胶微胶囊样品固定于载物台上,对其喷涂金层,使其具有导电性,在10 kV加速电压条件下利用扫描电子显微镜观察明胶/果胶微胶囊的微观结构。放大倍数为1 500倍。
将液体样品滴加到专用的铜网(300目)上,在防尘条件下干燥,使用透射电子显微镜进行观察。
1.4 数据分析
除特殊说明外,每组实验平行测定3次,利用Data analysis对超高效液相色谱结果进行数据分析,利用Design Expert 8.0.6进行响应面试验设计,用SPSS Statistics 20数据分析软件分析实验结果,用Origin 2018绘制图像。
2 结果与分析
2.1 单因素试验结果
由图1可知,明胶与果胶的质量比为5∶1时有最大的包埋率,约70%,于是选取5∶1为响应面因素水平中心点;而在明胶与叶绿素质量比单因素试验中,选取30∶1为中心点;在pH单因素中,包埋率在pH≤5的范围内变化不大,均在60%~70%,但当pH>5.5时,包埋率急剧下降,可以知道明胶/果胶微胶囊的适宜酸碱度为偏酸环境,当酸碱度偏中性时,明胶/果胶的包埋效果急剧下降,因此选取pH 4.5为响应面因素水平中心点。

a-明胶与果胶质量比;b-明胶与叶绿素质量比;c-pH
图1 单因素试验结果
Fig.1 The results of single factor experiment
2.2 响应面试验结果
2.2.1 响应面试验设计及结果
应用Design-Expert软件得到响应面试验设计及结果,见表2。
表2 响应面试验设计及结果
Table 2 Design and experimental results of Box-Behnken central composite
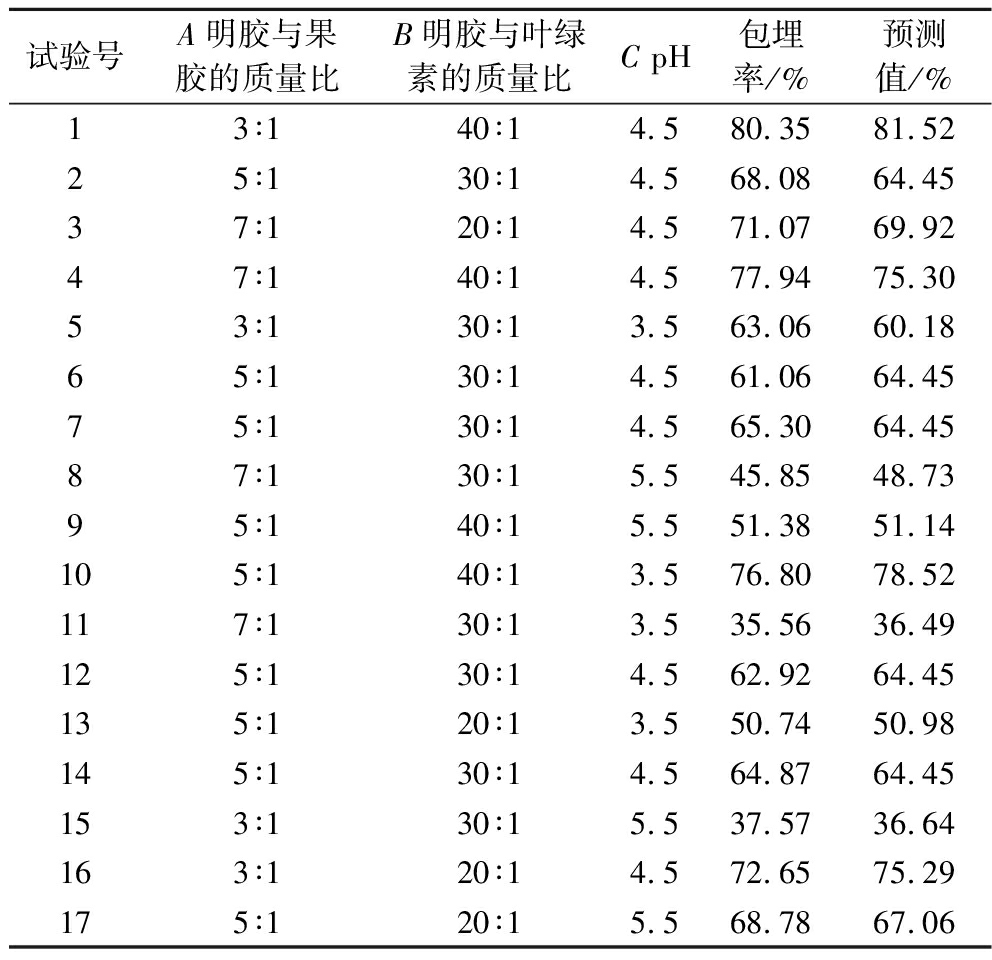
试验号A明胶与果胶的质量比B明胶与叶绿素的质量比C pH包埋率/%预测值/%13∶140∶14.580.3581.5225∶130∶14.568.0864.4537∶120∶14.571.0769.9247∶140∶14.577.9475.3053∶130∶13.563.0660.1865∶130∶14.561.0664.4575∶130∶14.565.3064.4587∶130∶15.545.8548.7395∶140∶15.551.3851.14105∶140∶13.576.8078.52117∶130∶13.535.5636.49125∶130∶14.562.9264.45135∶120∶13.550.7450.98145∶130∶14.564.8764.45153∶130∶15.537.5736.64163∶120∶14.572.6575.29175∶120∶15.568.7867.06
对结果进行分析拟合,得到2次回归方程。其中根据实际因素得出的最终方程式为:
包埋率/%=-194.236 12-14.567 50A-3.009 95B+153.720 75C-0.010 375AB+4.472 50AC-1.086 50BC-0.669 81A2+0.137 36B2-16.256 75C2
2.2.2 方差分析
表3中描述了每个因素的显著性,其中A、B、C项均是影响显著的因素,AC、BC、B2、C2项均是影响极显著的因素。图2直观描述了3个因子交互作用对响应值的影响,由图2-b可知,响应面的等高线扁平,明胶与果胶的质量比和环境pH值相互作用明显,这可以由pH与等电点的关系来说明:当pH>两性离子的等电点时,两性离子释放质子带负电;当pH<两性离子的等电点时,两性离子质子化带正电[17]。图2-c中响应面的倾斜程度较大,明胶与叶绿素的质量比和环境pH值的关系也显著,可以从叶绿素不稳定性来解释,容易在酸性条件下分解[1]。图2-a中响应面倾斜程度低,AB交互作用不显著,说明明胶与果胶的质量比和明胶与叶绿素的质量比关系小,具体来说就是由于明胶/果胶通过静电相互作用产生的微胶囊结构和芯材浓度交互作用小。
表3 回归模型的方差分析及显著性检验
Table 3 Analysis of variance and significance test of regression model

来源平方和自由度均方F值P值显著性模型2 837.839315.3132.03<0.000 1∗∗A67.34167.346.840.034 6∗B67.45167.456.850.034 5∗C63.73163.736.470.038 4∗AB0.1710.170.0170.898 5不显著AC320.051320.0532.510.000 7∗∗BC472.191472.1947.960.000 2∗∗A230.22130.223.070.123 2不显著B2794.401794.4080.69<0.000 1∗∗C21 112.7711 112.77113.03<0.000 1∗∗残差68.9179.84失拟41.10313.671.960.262 2不显著纯误差27.9146.98总和2 906.7416R2=0.976 3
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)

a-m(明胶)∶m(果胶)和m(明胶)∶m(叶绿素)对包埋率影响的 响应面图;b-m(明胶)∶m(果胶)和pH对包埋率影响的响应面图; c-m(明胶)∶m(叶绿素)和pH对包埋率影响的响应面图; d-实际包埋率和预测包埋率的关系图
图2 响应面试验结果
Fig.2 The result of the response surface
模型的F值为32.03,P<0.000 1,模型具有极显著性;模型的决定系数R2=0.976 3>0.95,表明模型的相关度非常好;模型的失拟项P=0.262 2>0.05,表明模型的失拟项不显著。
综合以上方差分析,可以根据该数学模型,预测和分析明胶-果胶复合凝沉形成的微胶囊在不同的配料比和酸碱度下的包埋率。图2-d是响应面的预测值和实际值的比较,可以发现,预测值与实际值相近,响应面预测结果合理。
由响应面的优化结果可知,明胶/果胶包埋叶绿素的最佳pH为4.17,这与MUHOZA等[8]和GOMEZ-ESTACA等[18]的研究结果相近,但其他复合凝沉包埋材料的最佳pH相对较高[19],这可能是由于明胶/果胶形成的复合物是在阴离子基团的电解离pH和明胶的等电点之间[20],而其中的阴离子基团的电解离pH偏低,在低pH条件下明胶/果胶复合物由于明胶的氨基得到质子,从而使得明胶的氨基与果胶的羧基之间的静电相互作用增加而肿胀[21],由此微胶囊能够包埋更多的芯材;明胶与果胶的混合质量比决定了复合物的结构与凝聚程度,过量的明胶会使得明胶分子自身凝聚,造成微胶囊的不均匀,显著影响包埋率。在本研究中最佳明胶与果胶的质量比为4.11,这与MUHOZA等[8]和DEVI等[21]的研究结果相近;明胶与叶绿素的最佳质量比为38.33,反映出所加的包埋物的质量的大小,与苗欣月等[4]的2种壁材的最优壁芯比结果差异大,而DEVI等[21]利用明胶/果胶对茶碱进行复合凝沉包埋,在额外加入戊二醛的条件下,当明胶与茶碱的质量比约为1∶1时,有好的包埋效果,也与本研究的结果相差甚远,可能是由于芯材的性质差异所致。通过计算可以发现本研究的叶绿素的芯材浓度较小,可能是由于高浓度的包埋物会引起黏度增加,降低物质的流动性,一定程度上影响微胶囊的形成[22]。响应面最优化的包埋率为80.68%,这与MUHOZA等[8]和DEVI等[21]的研究结果相近,反映出明胶/果胶能够作为优异的包埋材料进行复合凝沉,对叶绿素进行包埋时效果也不逊色于对其他物质的包埋。值得注意的是,叶绿素在酸性条件下不稳定,但是,在本研究中,即使在pH值接近4的条件下,叶绿素的包埋率也可达80%。究其原因应是明胶和果胶的作用,同叶绿素存于同一体系有保护作用。
因此,本研究通过响应面优化得到明胶/果胶包埋叶绿素的最佳条件为pH 4.17,明胶与果胶的质量比4.11∶1,明胶与叶绿素的质量比38.33∶1,包埋率为80.68%。为了简化数据以应用于工业,调整条件为pH 4,明胶与果胶的质量比4∶1,明胶与叶绿素的质量比40∶1,测得包埋率为(80.21±1.18)%,接近优化得到的最大包埋率。
2.3 叶绿素-明胶/果胶微胶囊性质
2.3.1 耐光性和抗酸性
图3-a~图3-e为典型叶绿素检测液相色谱图。

a~e-典型样品超高效液相色谱检测谱图,其中1-叶绿素b;2-叶绿素b异构体;3-氧化型叶绿素a;4-叶绿素a;5-叶绿素a异构体; 6-氧化型脱镁叶绿素b;7-脱镁叶绿素b;8~10-氧化型脱镁叶绿素a;11-脱镁叶绿素a;12-脱镁叶绿素a异构体;13-焦脱镁叶绿素a; 其中a、b为21 d自然光处理;d、e为pH 2.5条件下的酸处理;f、g图分别为光处理、酸处理后叶绿素保留量结果图
图3 叶绿素微胶囊的耐光性和抗酸性试验结果
Fig.3 Acid and light resistance of chlorophyll microcapsule
从菠菜中提取出的叶绿素原液(图3-c)其叶绿素组成基本只是简单的叶绿素a和叶绿素b,与文献报道中的一致[23],经过21 d光照后(图3-a),绝大多数叶绿素已经降解。而叶绿素微胶囊化后(图3-b),大部分叶绿素转变为脱镁叶绿素和氧化型脱镁叶绿素。而在酸处理结果中(图3-d~图3-e),叶绿素在微胶囊前后也会发生类似的变化。说明经过明胶-果胶凝沉微胶囊化后,在同样的强酸和强光环境,叶绿素会发生脱镁和氧化反应[24],但是并不会完全降解为无色物质。
叶绿素-明胶/果胶微胶囊耐光性结果如图3-f所示,光处理条件下,叶绿素原液组保留量不到5%,而有微胶囊保护叶绿素时叶绿素保留量显著提高,在21 d的光照下,接近一半的叶绿素未分解,有较强的耐光性。
叶绿素-明胶/果胶微胶囊抗酸性结果如图3-g所示,叶绿素原液在pH 6.5、4.5、2.5的条件下,叶绿素保留量不断下降。可见随着酸性的增强,叶绿素越容易被分解,体现出叶绿素在强酸条件下易分解的特性。而当有微胶囊对叶绿素进行保护时,在pH 2.5、4.5、6.5的条件下,叶绿素的保留量均较高,即使在pH值为2.5时,也达到了85%,体现了明胶/果胶微胶囊对叶绿素良好的保护效果。
2.3.2 叶绿素-明胶/果胶微胶囊微观性质
叶绿素-明胶/果胶微胶囊如图4-a、图4-d所示,其颜色指标同微胶囊的色泽一致,为墨绿色。叶绿素-明胶/果胶微胶囊的粒径分布结果如图4-b所示,平均粒径(Z-Ave)为337 nm,聚合物分散性指数(polymer dispersion index,PdI)为0.234,PdI<0.5,说明叶绿素-明胶/果胶微胶囊分布均匀,分散性良好。SARAVAN等[25]同样利用明胶/果胶进行包埋,发现微胶囊的粒径接近100 μm,与本研究中的粒径差异显著,可能是由于包埋的芯材性质差异显著导致的。

a-微胶囊样品;b-微胶囊样品粒径分布图;c-微胶囊扫描电镜图;d-微胶囊颜色指标;e-微胶囊透射扫描图
图4 微胶囊样品相关物理性质测定的结果
Fig.4 Physical properties of the microcapsule samples
图4-c是叶绿素-明胶/果胶微胶囊放大1 500倍的微观结构图,图4-e是叶绿素-明胶/果胶微胶囊的透射扫描图。可知,微胶囊形态各异,但大多数微胶囊呈不规则球型结构,疏松多孔,表面粗糙,凹凸不平,表面有碎屑存在。可能是由于明胶与果胶复合凝沉产生微胶囊的壁厚度较低,在冷冻干燥时内部的水分急剧升华,速率较快,导致内部结构疏松多孔,形态结构各异。而在SARAVAN等[25]的研究中,使用明胶/果胶对3种物质进行包埋,通过扫描电子显微镜观察发现3种物质都近似球状,部分表面不光滑,与本研究中的微观形状相类似。
3 结论与讨论
本研究通过明胶/果胶复合凝沉法制备叶绿素微胶囊,并利用响应面优化,得到明胶/果胶包埋叶绿素的最佳条件为:pH 4,明胶与果胶的质量比4∶1,明胶与叶绿素的质量比40∶1,包埋率可达80%,所得叶绿素-明胶/果胶微胶囊颜色墨绿,色泽均一,粒径达纳米级,形态不规则,疏松多孔,可有效对抗光处理和酸处理,研究结果为脂溶性植物化学物质在食品工业中的应用提供借鉴和参考。
[1] KANGY R, PARK J, JUNG S K, et al.Synthesis, characterization, and functional properties of chlorophylls, pheophytins, and Zn-pheophytins[J].Food Chemistry, 2018, 245:943-950.
[2] 吴隆坤,李佩, 德青玉珍, 等.微胶囊化元宝枫籽油粉末油脂的工艺优化及稳定性研究[J].中国粮油学报, 2022, 37(1):106-114.
WU L K, LI P, DE Q Y Z, et al.Research on preparation technology of microencapsulated Acer truncatumseed oils and stability[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(1):106-114.
[3] JAINA, THAKUR D, GHOSHAL G, et al.Characterization of microcapsulated β-carotene formed by complex coacervation using casein and gum tragacanth[J].International Journal of Biological Macromolecules, 2016, 87:101-113.
[4] 苗欣月,朱立斌, 朱丹, 等.糜子壳油微胶囊工艺优化及其理化特性分析[J].中国粮油学报,2022,37(5):136-143.
MIAO X Y, ZHU L B, ZHU D, et al.Optimization of preparation process of Panicum miliaceumL.shell oil microcapsules and analysis of their physicochemical properties[J].Journal of the Chinese Cereals and Oils Association, 2022,37(5):136-143.
[5] 董志俭,赵帅, 孙丽平, 等.CMC/阿拉伯胶/明胶复合凝聚橘油微胶囊的制备方法[J].中国食品学报, 2013, 13(6):69-76.
DONG Z J, ZHAO S, SUN L P, et al.Preparation of CMC/gum Arabic/gelatin microcapsules encapsulating orange oil by complex coacervation[J].Journal of Chinese Institute of Food Science and Technology, 2013, 13(6):69-76.
[6] SAHOON, SAHOO R K, BISWAS N, et al.Recent advancement of gelatin nanoparticles in drug and vaccine delivery[J].International Journal of Biological Macromolecules, 2015, 81:317-331.
[7] ESPITIAP J P, DU W X, DE JES S AVENA-BUSTILLOS R, et al.Edible films from pectin:Physical-mechanical and antimicrobial properties-A review[J].Food Hydrocolloids, 2014, 35:287-296.
S AVENA-BUSTILLOS R, et al.Edible films from pectin:Physical-mechanical and antimicrobial properties-A review[J].Food Hydrocolloids, 2014, 35:287-296.
[8] MUHOZAB, XIA S Q, CAI J B, et al.Gelatin and pectin complex coacervates as carriers for cinnamaldehyde:Effect of pectin esterification degree on coacervate formation, and enhanced thermal stability[J].Food Hydrocolloids, 2019, 87:712-722.
[9] 张秀君,孙钱钱, 乔双, 等.菠菜叶绿素提取方法的比较研究[J].作物杂志, 2011(3):57-60.
ZHANG X J, SUN Q Q, QIAO S, et al.A comparative study of chlorophyll extraction methods[J].Crops, 2011(3):57-60.
[10] CHENK W, ROCA M.Cooking effects on bioaccessibility of chlorophyll pigments of the main edible seaweeds[J].Food Chemistry, 2019, 295:101-109.
[11] 侍江春,肖宇雪, 俸贵强, 等.不同干条斑紫菜和烤条斑紫菜光合色素含量分析[J].食品与发酵工业, 2020, 46(23):169-177.
SHI J C, XIAO Y X, FENG G Q, et al.Analysis of photosynthetic pigment content of different dried and roasted laver[J].Food and Fermentation Industries, 2020, 46(23):169-177.
[12] KHANA, WANG C N, SUN X M, et al.Preparation and characterization of whey protein isolate-DIM nanoparticles[J].International Journal of Molecular Sciences, 2019, 20(16):3917.
[13] 黄山,汪楠, 张月, 等.机械球磨处理对麻竹笋壳膳食纤维理化性质及结构的影响[J].食品与发酵工业, 2020, 46(5):115-120.
HUANG S, WANG N, ZHANG Y, et al.Effect of mechanical ball milling on physicochemical properties and structure of Dendrocalamus latiflorusshell dietary fiber[J].Food and Fermentation Industries, 2020, 46(5):115-120.
[14] 张小燕,赵凤敏, 李少萍, 等.鲜切马铃薯丁贮藏期间颜色动力学变化[J].食品科技, 2016, 41(5):185-191.
ZHANG X Y, ZHAO F M, LI S P, et al.Color dynamic changes of fresh-cut diced potatoes during storage[J].Food Science and Technology, 2016, 41(5):185-191.
[15] 雷爱玲,范盛玉, 王亚楠, 等.大豆分离蛋白/魔芋葡甘聚糖复合脂肪模拟物的制备及结构分析[J].食品与发酵工业, 2021, 47(15):111-119.
LEI A L, FAN S Y, WANG Y N, et al.Preparation and structure analysis of soybean protein isolate/konjac glucomannan complex fat substitute[J].Food and Fermentation Industries, 2021, 47(15):111-119.
[16] 汤彩碟,张甫生, 杨金来, 等.机械球磨处理对方竹笋全粉理化特性及微观结构的影响[J].食品与发酵工业, 2022,48(12):175-182.
TANG C D, ZHANG F S, YANG J L, et al.Effect of mechanical ball milling treatment on physicochemical properties and microstructure of Chimonobambusa quadrangularispowder[J].Food and Fermentation Industries, 2022,48(12):175-182.
[17] 骆杨庆,吴增林, 李升福, 等.响应面法优化玉米浸液蛋白提取工艺及单细胞蛋白发酵的研究[J].食品工业科技, 2022, 43(10):231-237.
LUO Y Q, WU Z L, LI S F, et al.Study on extraction process of corn steep liquor protein by response surface methodology and single cell protein fermentation[J].Science and Technology of Food Industry, 2022, 43(10):231-237.
[18] GOMEZ-ESTACAJ, COMUNIAN T A, MONTERO P, et al.Encapsulation of an astaxanthin-containing lipid extract from shrimp waste by complex coacervation using a novel gelatin-cashew gum complex[J].Food Hydrocolloids, 2016, 61:155-162.
[19] CHANGP G, GUPTA R, TIMILSENA Y P, et al.Optimisation of the complex coacervation between canola protein isolate and chitosan[J].Journal of Food Engineering, 2016, 191:58-66.
[20] 王颖,赵萌, 黄雪, 等.复合凝聚法包埋功能性食品组分的研究进展[J].食品科学, 2018, 39(9):265-271.
WANG Y, ZHAO M, HUANG X, et al.Progress in microencapsulation of functional food ingredients by complex coacervation method[J].Food Science, 2018, 39(9):265-271.
[21] DEVIN, DEKA C, NATH P, et al.Encapsulation of theophylline in gelatin A-pectin complex coacervates[J].Advances in Experimental Medicine and Biology, 2018, 1 052:63-74.
[22] ROCHA-SELMIG A, FAVARO-TRINDADE C S, GROSSO C R F.Morphology, stability, and application of lycopene microcapsules produced by complex coacervation[J].Journal of Chemistry, 2013, 2013:1-7.
[23] 吴平,韩静毅, 陈海香.菠菜中叶绿素的提取及紫外光谱研究[J].广州化工, 2016, 44(19):144-145.
WU P, HAN J Y, CHEN H X.Extraction of chlorophyll from spinach and its ultraviolet spectrum[J].Guangzhou Chemical Industry, 2016, 44(19):144-145.
[24] CHENK W, R OS J J, PÉREZ-G
OS J J, PÉREZ-G LVEZ A, et al.Development of an accurate and high-throughput methodology for structural comprehension of chlorophylls derivatives.(Ⅱ) Dephytylated derivatives[J].Journal of Chromatography A, 2015, 1412:90-99.
LVEZ A, et al.Development of an accurate and high-throughput methodology for structural comprehension of chlorophylls derivatives.(Ⅱ) Dephytylated derivatives[J].Journal of Chromatography A, 2015, 1412:90-99.
[25] SARAVANANM, RAO K P.Pectin-gelatin and alginate-gelatin complex coacervation for controlled drug delivery:Influence of anionic polysaccharides and drugs being encapsulated on physicochemical properties of microcapsules[J].Carbohydrate Polymers, 2010, 80(3):808-816.