虾青素(astaxanthin,AST)是一种学名为3,3′-二羟基-β,β-胡萝卜素-4,4′-二酮的红色色素,广泛存在于各种微生物、浮游植物、海洋动物和海鲜中的一种类胡萝卜素。据报道,AST具有包括抗氧化、抗炎、抗肿瘤、抗衰老、预防老年性黄斑变性等在内的广泛的生物活性[1-2]。与其他类胡萝卜素类似,AST具有较低的生物利用率[3]。
AST因其突出的生物活性和生理功能,在饲料、食品、化妆品、医药等领域具有很高的经济价值和广泛的应用前景[4]。研究发现,通过向母鸡饲粮中添加富含AST的雨生红球藻可以获取富含AST的营养强化鸡蛋,这类鸡蛋中的AST沉积在蛋黄中,其含量与饲粮中AST含量存在剂量效应[5]。
蛋黄粉是由以蛋黄液为原料,通过干燥脱水工艺制得的含水量较低的干制蛋产品,其干燥方式主要有:真空冷冻干燥、喷雾干燥和微波干燥[6]。真空冷冻干燥可将蛋液快速冷冻,在真空环境中将水分直接升华为水蒸气,其优点在于缺氧和较低的干燥温度可使产品保留其原有营养物质和理化特性,适合氧敏性和热敏性的物质,缺点在于耗能大、干燥时间长与工作效率低。喷雾干燥可将蛋液通过雾化器雾化成小液滴进入干燥室,并同时由鼓风机将干热空气送入干燥室,雾化液滴瞬间受热蒸发干燥成为粉末,其优点在于干燥速度快,生产效率高,缺点在于较高的干燥温度可能造成部分营养元素的流失。微波干燥是将蛋液处在快速变化的高频磁场内,通过分子之间的碰撞摩擦达到加热干燥的目的,其优点在于干燥均匀快速、节能环保,缺点在于干燥温度不易控制。在工业生产中,基于经济效应和连续化生产的目的,一般选用喷雾干燥技术对蛋黄粉进行干燥[7]。
AST具有极高的不饱和结构,很容易在光、热、氧气等作用下发生降解[8],因此,将富含AST的蛋黄进一步脱水干燥成为蛋黄粉的过程,以及贮藏过程中,AST很容易发生降解。据文献报道[9],相比于喷雾干燥而言,真空干燥可有效提高AST的保留率。AHMED等[10]从干燥方式、贮藏温度与包装方式3方面对雨生红球藻粉的贮藏条件进行优化,结果表明冷冻干燥方式下AST的保留率相对喷雾干燥提高了41%,低的贮藏温度(-20、4 ℃)、真空包装方式有利于提高贮藏过程中AST的稳定性。MIAO等[11]研究表明,真空、4 ℃、避光保存条件是雨生红球藻粉最经济适用的贮藏条件。
由于AST化学性质不稳定,增强AST产品的稳定性至关重要。迄今为止,关于AST强化蛋黄粉的干燥方式及贮藏条件鲜有报道。本文对采用不同干燥方式制备的AST强化蛋黄粉的理化性质进行研究,并探究贮藏期间温度、光照、氧气3种影响因素对蛋黄粉的影响;此外,通过研究蛋黄中AST的生物可给率,为蛋黄作为补充AST的良好膳食来源提供理论依据。
1 材料与方法
1.1 材料与试剂
AST强化鸡蛋,山东松山岛食品科技有限公司;大豆油,市售;MDA试剂盒,南京建成生物工程有限公司;DPPH、ABTS,美国Sigma公司;氯仿、甲醇、硫酸亚铁、硫氰酸铵,均为分析纯,国药集团化学试剂有限公司;四氢呋喃、甲醇、乙酸乙酯、甲基叔丁基醚,均为HPLC级,国药集团化学试剂有限公司。
1.2 仪器与设备
B-290小型充氮喷雾干燥机,德国BUCHI公司;BA-PWGZ1000B小型喷雾干燥机,长沙巴跃仪器有限公司;SCIENTZ-10 N冷冻干燥机,宁波新芝生物科技股份有限公司;5430R高速离心机,德国Eppendorf公司;T25高速剪切机,德国IKA公司;DGG-9140A型电热恒温鼓风干燥箱,上海森信实验仪器有限公司;THS-15数控超级恒温槽,宁波天恒仪器有限公司;CS-812高精度色差分析仪,宁波科诚仪器有限公司;UV-2600紫外分光光度计,日本岛津公司。
1.3 实验方法
1.3.1 AST强化蛋黄粉的制备
取新鲜的AST强化鸡蛋,去壳后分离蛋清和蛋黄,用去离子水以1∶2质量比稀释蛋黄,均匀搅拌后,用100目筛过滤得到稀释蛋黄液,将稀释蛋黄液进行普通喷雾干燥/充氮喷雾干燥得到干燥蛋黄粉,喷雾干燥条件:进风温度170 ℃,出口温度70 ℃。
AST鸡蛋去壳后分离蛋清和蛋黄,将蛋黄在擦手纸上滚动吸去多余的蛋清,戳破蛋黄膜收集蛋黄,将得到的蛋黄进行真空冷冻干燥。冷冻干燥条件:冷阱温度-60 ℃, 真空度20 Pa以下,干燥时间48 h。
1.3.2 AST强化蛋黄粉AST含量测定
AST的提取和测定参照DANSOU等[12]的方法,并进行适当修改。向0.5 g蛋黄粉中添加5 mL四氢呋喃/甲醇(1∶1,体积比),涡旋2 min充分混匀,在60 ℃水浴中加热20 min,再次涡旋2 min,接着加入5 mL乙酸乙酯后进行第3次涡旋(2 min),然后在4 ℃下4 000×g离心5 min。随后吸取1 mL上清液于1.5 mL试管中,在4 ℃下10 000×g离心10 min。最终将上清液通过0.45 μm膜过滤到高效液相色谱棕色小瓶中待测。液相色谱条件如下,色谱柱:YMC C30(250 mm×4.6 mm, 5 μm, 日本YMC公司);流动相:A相为甲醇, B相为叔丁基甲基醚,C相为水,洗脱方式为等度洗脱,流动相比例为78∶14∶8(体积比);流速1.0 mL/min;柱温25 ℃;进样量10 μL;检测器:紫外-可见光检测器;检测波长471 nm。
1.3.3 AST强化蛋黄粉理化性质检测
按照国标GB 5009.5—2016《食品中蛋白质的测定》、GB 5009.6—2016 《食品中脂肪的测定》、GB/T 5009.3—2016《食品中水分的测定》、GB/T 5413.29—2010《婴幼儿食品和乳品中溶解性的测定》分别测定蛋黄粉的蛋白质、脂质、水分和溶解度。
水分散性的测定参考BUSCH等[13]的方法并做适当修改。称取0.3 g的蛋黄粉于盛有30 mL的去离子水的离心管中,涡旋5 min后使用离心机在转速5 000 r/min下离心5 min,然后量取10 mL上清液在105 ℃下干燥6 h至恒重,水分散性计算如公式(1)所示:
水分散性![]()
(1)
将蛋黄粉装在透明塑封袋中,用高精度分光测色仪测量样品的L*、a*和b*值。使用前先用标准黑白背景板校准,再用空的塑封袋校准。
参照GUO等[14]的方法测定蛋黄粉的乳化性。将蛋黄粉加去离子水制备质量浓度为5 g/L的蛋黄溶液,向50 mL离心管加15 mL蛋黄溶液和15 mL大豆油,在高速剪切机10 000 r/min下剪切2 min,在静置0和10 min后从乳液底层吸取100 μL乳液加入到10 mL SDS溶液(1 g/L)中,然后在500 nm处测定其吸光值。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)计算如公式(2)(3)所示。
(2)
(3)
式中:k,稀释倍数;ρ,乳液蛋白质质量浓度,g/mL;φ,乳液中油的体积分数,%;t,静置时间,s;A0,乳液在静置0 min时的吸光值;A10,乳液在静置10 min时的吸光值。
1.3.4 AST强化蛋黄粉的加速氧化实验
将充氮喷雾干燥得到的蛋黄粉平均分为4份,每份分装进5个包装袋中,每袋中装15 g蛋黄粉,A组:蛋黄粉装进铝箔袋(12 cm×17 cm,0.22 mm),用真空封口机封口,在25 ℃下储藏;B组:蛋黄粉装进铝箔袋,用普通封口机封口,在25 ℃下储藏;C组:蛋黄粉装进透明袋(12 cm×17 cm,0.22 mm)中,用真空封口机封口,在光照、25 ℃下储藏;D组:蛋黄粉装进铝箔袋,用真空封口机封口,在4 ℃下储藏。每隔1周测定蛋黄粉的AST含量、色差、脂质氧化产物和自由基清除率。
丙二醛(malondialdehyde,MDA)是油脂次级氧化产物之一,被广泛用于评价脂质氧化程度的重要指标。采用MDA检测试剂盒检测蛋黄粉中MDA水平。该试剂盒的原理是将硫代巴比妥酸与MDA络合形成复合物,通过测定复合物的量来计算MDA的含量。
DPPH自由基和ABTS阳离子自由基清除率的测定参照RODJAN等[15]的方法并做适当修改。DPPH自由基清除率:准确称取DPPH 0.039 4 g,用无水乙醇定容至100 mL,再用无水乙醇进行稀释,配制成最终浓度为1×10-4mmol/L的DPPH溶液。称取2 g蛋黄粉,加18 g去离子水溶解。取100 μL上述蛋黄溶液,加入2.9 mL配好的DPPH溶液,混合均匀。在室温下避光孵育30 min后,在510 nm处测量吸光值。
ABTS阳离子自由基清除率:配制浓度为7 mmol/L的ABTS溶液和浓度为2.45 mmol/L的过硫酸钾溶液,然后将以上2种溶液按照等体积混合均匀制成ABTS工作母液,将其在室温下避光存放12~16 h。测量前,先使用磷酸盐缓冲溶液(5 mmol/L,pH 7.0)将ABTS工作液稀释至吸光值为(0.70±0.02)。取100 μL上述蛋黄溶液,加入3.9 mL ABTS工作溶液,混合均匀。在室温下避光孵育18 min后,在734 nm处测量吸光值。
1.3.5 AST强化蛋黄粉的体外消化实验
参照文献[16]的方法对充氮喷雾干燥AST强化蛋黄粉及蛋黄液进行体外模拟消化,并作适当修改。消化方法及步骤如表1和表2所示。消化结束后,将消化液置于冰水浴中30 min,停止消化,然后取20 mL消化液在10 000 r/min,4 ℃下离心30 min, 上层清液即为胶束层,分别测定消化前样品、小肠消化液样品、胶束层样品的AST含量,并根据公式(4)(5)计算AST的生物可给率和生物保留率。
生物可给率![]()
(4)
生物保留率![]()
(5)
式中:mMicelle,胶束团中AST质量,g;mDigesta,小肠消化液中AST质量,g;mSample,消化前样品中AST质量,g。
表1 模拟消化步骤及消化液成分表
Table 1 Simulated digestion steps and components of digestive juice
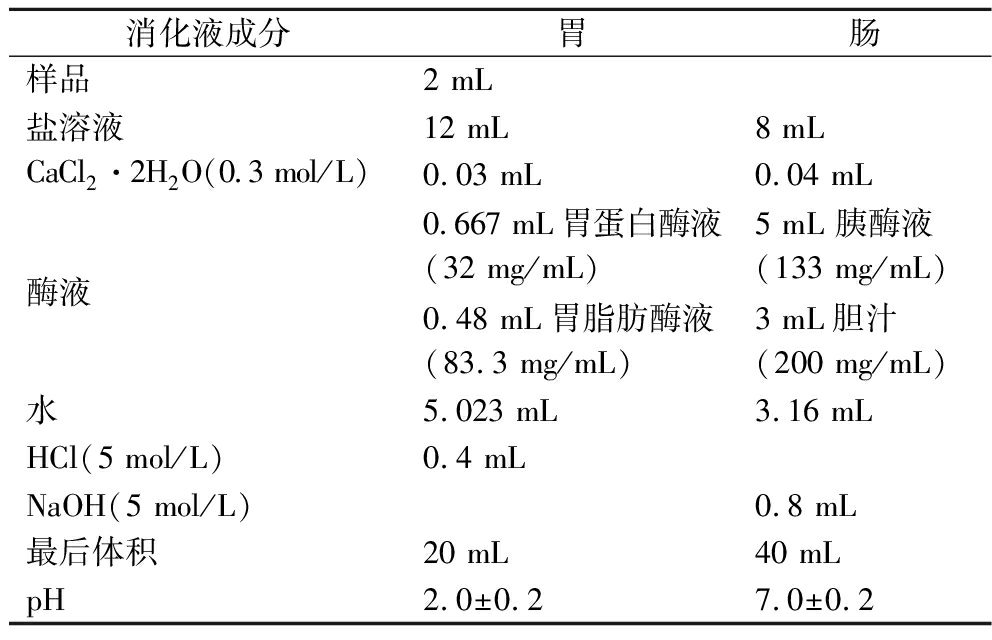
消化液成分胃肠样品2 mL盐溶液12 mL8 mLCaCl2·2H2O(0.3 mol/L)0.03 mL0.04 mL酶液0.667 mL胃蛋白酶液(32 mg/mL)5 mL 胰酶液(133 mg/mL)0.48 mL胃脂肪酶液(83.3 mg/mL)3 mL胆汁(200 mg/mL)水5.023 mL3.16 mLHCl(5 mol/L)0.4 mLNaOH(5 mol/L)0.8 mL最后体积20 mL40 mLpH2.0±0.27.0±0.2
注:胃消化2 h,肠消化2 h,整个模拟消化过程均在180 r/min的37 ℃摇床内进行
表2 盐溶液成分表
Table 2 Composition of salt solution
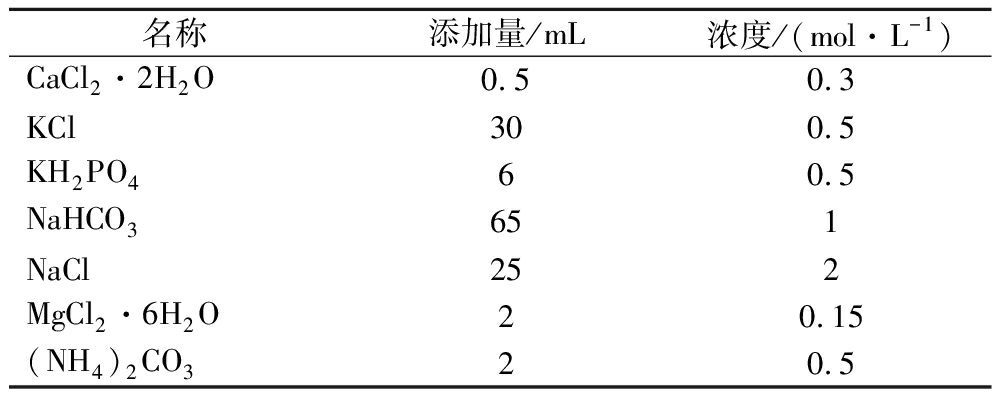
名称添加量/mL浓度/(mol·L-1)CaCl2·2H2O0.50.3KCl300.5KH2PO460.5NaHCO3651NaCl252MgCl2·6H2O20.15(NH4)2CO320.5
1.4 数据分析
每组数据至少采用3个平行,数据表示为平均值±标准差。采用Origin 2018和SPSS 22.0软件进行数据分析及作图,多重比较之间的差异采用单因素方差分析和Duncan检验进行显著性分析(P<0.05)。
2 结果与讨论
2.1 不同干燥方式对制备蛋黄粉理化性质的影响
如图1-a所示,3种干燥方式得到的蛋黄粉AST含量由高到低顺序为:冻干蛋黄粉>充氮喷雾干燥蛋黄粉>普通喷雾干燥蛋黄粉。以冻干蛋黄粉为100%参照,普通喷雾干燥下AST的保留率为61.94%,充氮喷雾干燥下AST的保留率为91.06%,结果表明,充氮喷雾干燥是提高蛋黄粉中AST保留率的有效方法。AHMEDF等[10]的研究表明,与常规喷雾干燥相比,雨生红球藻粉采用冷冻干燥方式可使AST回收率提高41%。本研究中采用的充氮喷雾干燥方式相对真空冷冻干燥同样可以达到较高的AST保留率,真空冷冻干燥成本高、耗时长,因此,充氮喷雾干燥可以替代冻干成为AST强化蛋黄粉的干燥方法。
如图1-b所示,L*亮度值由高到低依次为:充氮喷雾干燥蛋黄粉>普通喷雾干燥蛋黄粉>冻干蛋黄粉。由图1-c、图1-d可知,冻干蛋黄粉a*红绿值、b*黄蓝值数值最大,充氮喷雾干燥蛋黄粉次之,普通喷雾干燥蛋黄粉数值最低,表示蛋黄粉颜色红、黄程度从高到低顺序为:冻干蛋黄粉>充氮喷雾干燥蛋黄粉>普通喷雾干燥蛋黄粉。不同干燥方式色差上的差异一方面可能是由于干燥方式不同,王家镔等[17]研究发现喷雾干燥制成的蛋黄粉的亮度值、红绿值、黄蓝值均显著高于冷冻干燥蛋黄粉;另一方面可能是由于AST含量的影响,a*红绿值、b*黄蓝值与AST的含量高低一致,结果表明AST含量越高,蛋黄粉颜色的红黄程度越高。

a-AST含量;b-L*;c-a*;d-b*
图1 不同干燥方式对蛋黄粉AST保留率和色差的影响
Fig.1 Effects of different drying methods on physicochemical properties of yolk powder
如图2-a所示,冻干蛋黄粉比喷雾干燥蛋黄粉、充氮喷雾干燥蛋黄粉的水分含量低,具有显著差异(P<0.05),高水分含量会使食品更容易发生化学变化和微生物的生长繁殖,因此冷冻干燥制备的蛋黄粉化学稳定性更高,更利于贮藏、不易变质。这种差异可能与喷雾干燥参数的设置和冷冻干燥条件的设置有关。如图2-b和图2-c所示,冻干蛋黄粉的溶解度、水分散性、乳化性显著高于喷雾干燥蛋黄粉,而充氮喷雾干燥与普通喷雾干燥无显著差异(P>0.05),可能是由于一方面真空冷冻干燥喷雾蛋黄粉粉末更加细腻均匀,另一方面干燥过程中蛋白质会产生一定程度的变性。沈青等[18]研究发现真空冷冻干燥全蛋粉的溶解性、起泡性与乳化性均优于喷雾干燥全蛋粉,本文研究结论与其一致。
2.2 不同储藏方式对AST强化蛋黄粉性质的影响
2.2.1 AST含量
AST由于化学结构高度不饱和,化学稳定性较差,在储藏过程中极易发生降解。由图3所示,蛋黄粉中的AST含量随着储存时间的延长而降低,AST含量的降解速率由高至低依次为:25 ℃、光照、真空包装组>25 ℃、避光、非真空包装>25 ℃、避光、真空包装组>4 ℃、避光、真空包装组,结果表明,真空包装、避光、低温都抑制了蛋黄粉中AST的降解速率,从结果中可以看出,3种影响因素中对贮藏期间AST的稳定性影响由大到小依次为:光照>温度>氧气。AHMEDF等[10]对不同贮藏温度(-20、4、25、37 ℃)和不同包装方式(真空包装/普通包装)对雨生红球藻粉中的AST稳定性进行研究,结果表明低温储藏(-20、4 ℃)和真空包装下雨生红球藻粉中的AST稳定性更高;赵晓燕等[19]以AST油树脂为原料,研究不同温度、光照、金属离子、pH对AST的稳定性的影响,结果表明AST在避光、低温环境下较为稳定,本研究结果与上述研究结论相一致。
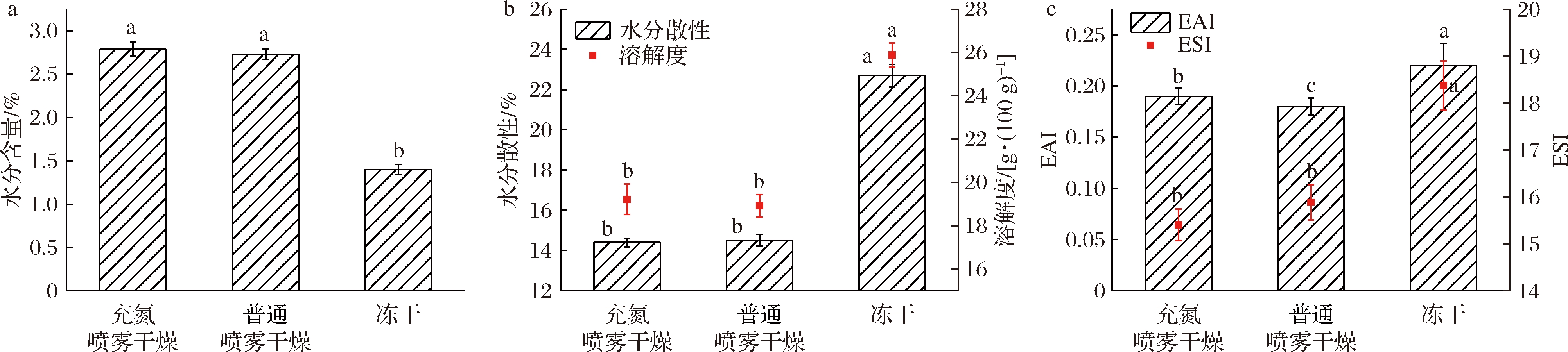
a-水分含量;b-水分散性和溶解度;c-EAI和ESI
图2 不同干燥方式对蛋黄粉理化性质的影响
Fig.2 Effects of different drying methods on physicochemical properties of yolk powder

图3 不同温度、光照、氧气对AST强化蛋黄粉 在贮藏期间AST含量的影响
Fig.3 Effects of temperature, light, and oxygen on astaxanthin content of astaxanthin enriched egg yolk powder during storage
2.2.2 丙二醛含量
脂肪在空气中的光、热、氧的作用下,氧化生成初级氧化产物(POV),然后继续氧化形成二级氧化产物,包括醛类、酮类、环氧化合物、聚合物[20]。如图4所示,随着储藏时间的增加,各组储藏条件下的蛋黄粉的MDA含量均有所增加,增长速率由高到低依次为:25 ℃、光照、真空包装组>25 ℃、避光、非真空包装组>25 ℃、避光、真空包装组>4 ℃、避光、真空包装组。结果表明,25 ℃、光照和氧气都在一定程度上促进了脂质氧化。陈伊凡等[21]将二十二碳六烯酸(docosahexaenoic acid,DHA)强化蛋黄粉在不同温度、光照和氧气条件下贮藏,结果表明高温、氧气和光照对脂质氧化均有促进作用,这与本研究所得结论一致。WANG等[22]将鸡蛋在4和22 ℃贮藏40 d后发现MDA含量分别上升到0.15和0.29 mg /kg,可能是由于高温、光照等因素为脂质氧化提供更多的活化能[23]。如图2和图3所示,各组MDA含量增长速率与AST含量高低的次序相反,蛋黄粉中AST含量越高,MDA增长速率越低,结果表明蛋黄粉中的AST在一定程度上抑制了脂肪氧化。

图4 不同温度、光照、氧气对AST强化蛋黄粉 在贮藏期间脂质氧化的影响
Fig.4 Effects of temperature, light, and oxygen on lipid oxidation of astaxanthin enriched egg yolk powder during storage
2.2.3 抗氧化能力
蛋黄粉在贮藏过程中的抗氧化能力如图5所示,各组蛋黄粉对DPPH自由基和ABTS阳离子自由基的清除率均随贮藏时间的延长而降低。各组蛋黄粉自由基清除速率由高至低依次为:4 ℃、避光、真空包装组>25 ℃、避光、真空包装组>25 ℃、避光、非真空包装组>25 ℃、光照、真空包装组,结果表明,避光、低温、真空包装在一定程度上降低了蛋黄粉自由基清除能力的下降速率。袁磊等[24]比较了不同类胡萝卜素(AST、β-胡萝卜素、番茄红素和叶黄素)的自由基清除率,结果发现AST对DPPH自由基、·OH和![]() 的清除能力都是最强的。如图3和图5所示,自由基清除率的高低次序与AST的含量次序一致,表明AST在蛋黄粉内发挥了其极强的抗氧化能力,AST含量越高,蛋黄粉抗氧化能力越强。
的清除能力都是最强的。如图3和图5所示,自由基清除率的高低次序与AST的含量次序一致,表明AST在蛋黄粉内发挥了其极强的抗氧化能力,AST含量越高,蛋黄粉抗氧化能力越强。
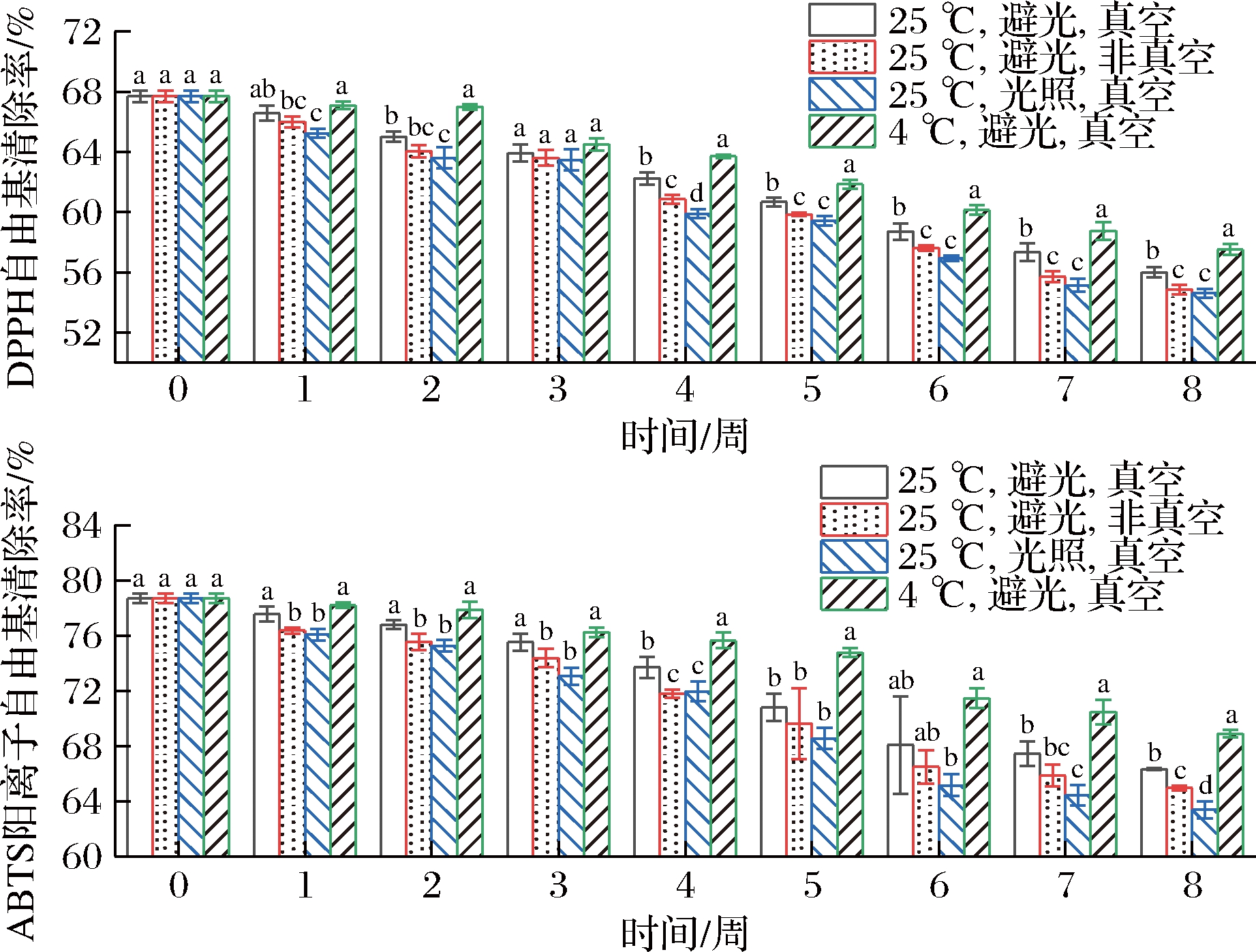
图5 不同温度、光照、氧气对AST强化蛋黄粉 在贮藏期间抗氧化能力的影响
Fig.5 Effects of temperature, light, and oxygen on radical scavenging activity of astaxanthin enriched egg yolk powder during storage
2.3 AST生物可给率
如图6所示,AST强化蛋黄粉的AST生物保留率为49.52%。AST的化学性质不稳定,37 ℃和胃部pH 2.0的酸性环境都会加速AST的降解,因此AST的生物保留率较低。AST强化蛋黄粉的AST生物可给率为92.62%。经过胃肠道消化,AST与胆盐、卵磷脂、游离脂肪酸等物质形成胶束团。有文献指出AST与食用油脂一起食用时,可以增加AST的吸收[25]。可能是由于蛋黄粉中脂质含量较高,对提高AST这类脂溶性生物活性物质的生物可给率起到了积极作用[26]。结果表明,以蛋黄为AST的膳食来源是一种优良选择。
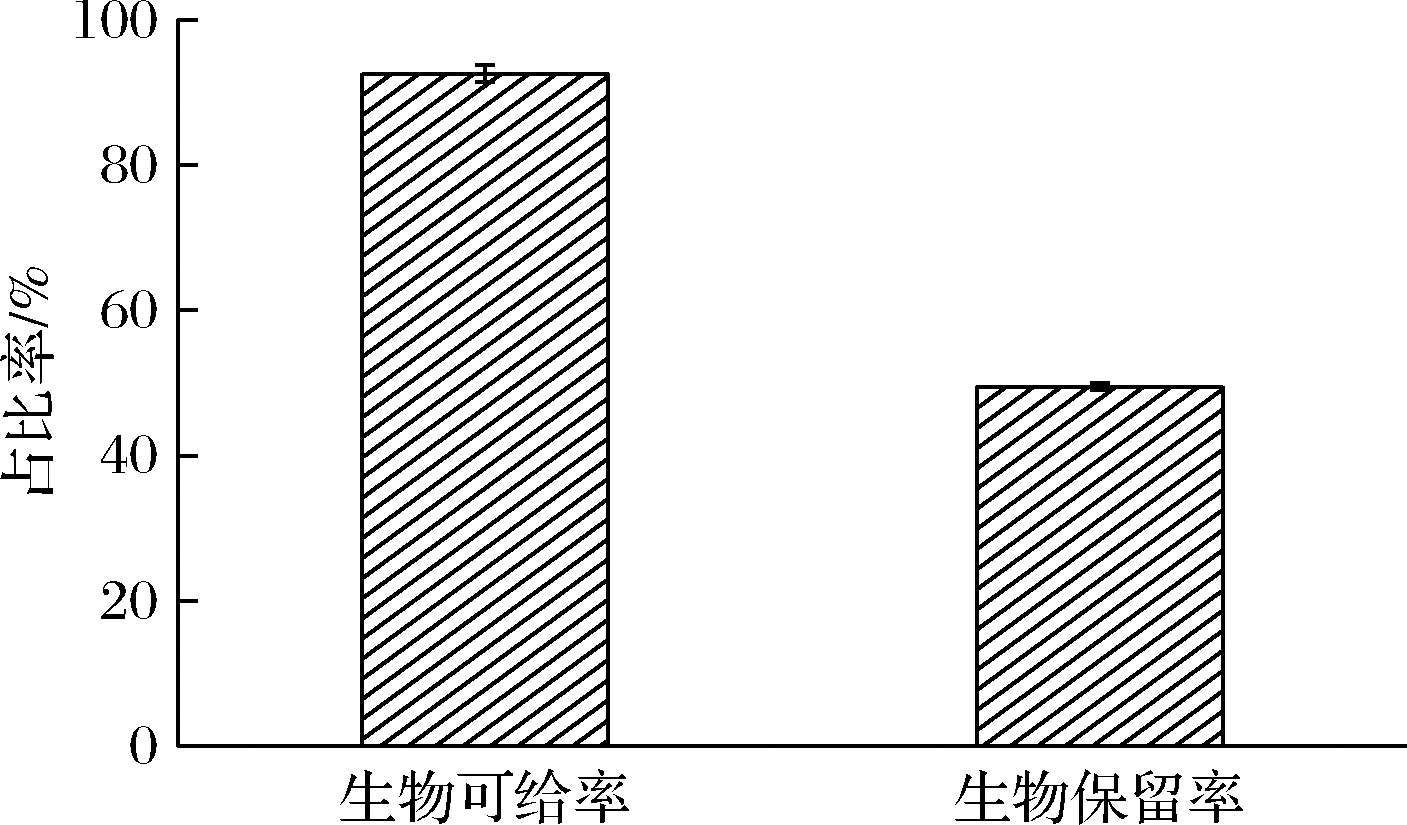
图6 AST强化蛋黄粉在体外模拟消化后的AST消化率
Fig.6 Astaxanthin digestibility of astaxanthin enriched egg yolk powder afterin vitro simulated digestion
3 结论
本文对冷冻干燥、普通喷雾干燥和充氮喷雾干燥3种方式制得的蛋黄粉的理化性质进行分析,并将充氮喷雾干燥AST强化蛋黄粉按照不同温度、光照和氧气条件下贮藏,并研究蛋黄粉的贮藏稳定性,最后对AST强化蛋黄粉的体外消化率进行研究。结果表明,冷冻干燥蛋黄粉的水分含量较低,溶解度、水分散性、乳化性较高,普通喷雾干燥和充氮喷雾干燥蛋黄粉之间并无显著性差异。充氮喷雾干燥相对普通干燥方式能有效提高AST的保留率,推测是由于充氮喷雾干燥的低氧环境降低了AST的降解。由于冷冻干燥耗能大、生产效率低,可以考虑将充氮喷雾干燥方式替代冷冻干燥成为AST产品的干燥方式。充氮喷雾干燥得到的AST强化蛋黄粉在低温、避光、无氧条件下贮藏,具有更高的AST稳定性、氧化稳定性和自由基清除率,可能是由于一方面低温、避光、真空贮藏条件下AST含量更高,AST极强的抗氧化能力抑制了脂质氧化;另一方面高温、光照为氧化反应提供了更多的活化能。由于脂质物质能够提高AST等脂溶性物质的生物可给率,AST强化蛋黄粉具有较高的生物可给率,表明AST蛋黄粉可以成为获取AST的营养食品原料。
[1] CHENY T, KAO C J, HUANG H Y, et al.Astaxanthin reduces MMP expressions, suppresses cancer cell migrations, and triggers apoptotic caspases ofin vitroandin vivomodels in melanoma[J].Journal of Functional Foods, 2017, 31:20-31.
[2] KAMATHB S, SRIKANTA B M, DHARMESH S M, et al.Ulcer preventive and antioxidative properties of astaxanthin from Haematococcus pluvialis[J].European Journal of Pharmacology, 2008, 590(1-3):387-395.
[3] FAKHRIS, ABBASZADEH F, DARGAHI L, et al.Astaxanthin:A mechanistic review on its biological activities and health benefits[J].Pharmacological Research, 2018, 136:1-20.
[4] ZHUY Z, YIN L, GE J S, et al.Astaxanthin supplementation enriches productive performance, physiological and immunological responses in laying hens[J].Animal Bioscience, 2021, 34(3):443-448.
[5] WALKERL A, WANG T, XIN H W, et al.Supplementation of laying-hen feed with palm tocos and algae astaxanthin for egg yolk nutrient enrichment[J].Journal of Agricultural and Food Chemistry, 2012, 60(8):1 989-1 999.
[6] 马爽,刘静波, 王二雷.蛋粉加工及应用的研究现状分析[J].食品工业科技, 2011, 32(2):393-397;400.
MA S, LIU J B, WANG E L.Existing condition analysis of processing and application of egg powder[J].Science and Technology of Food Industry, 2011, 32(2):393-397;400.
[7] 赵媛,苏宇杰, 杨严俊.全蛋粉喷雾干燥工艺研究[J].安徽农业科学, 2015, 43(15):243-246.
ZHAO Y, SU Y J, YANG Y J.Study on process conditions of spray-drying whole egg powder[J].Journal of Anhui Agricultural Sciences, 2015, 43(15):243-246.
[8] YANGL, GU J Y, LUAN T L, et al.Influence of oil matrixes on stability, antioxidant activity, bioaccessibility and bioavailability of astaxanthin ester[J].Journal of the Science of Food and Agriculture, 2021, 101(4):1 609-1 617.
[9] NIAMNUYC, DEVAHASTIN S, SOPONRONNARIT S, et al.Kinetics of astaxanthin degradation and color changes of dried shrimp during storage[J].Journal of Food Engineering, 2008, 87(4):591-600.
[10] AHMEDF, LI Y, FANNING K, et al.Effect of drying, storage temperature and air exposure on astaxanthin stability from Haematococcus pluvialis[J].Food Research International, 2015, 74:231-236.
[11] MIAOF P, LU D Y, LI Y G, et al.Characterization of astaxanthin esters in Haematococcus pluvialisby liquid chromatography-atmospheric pressure chemical ionization mass spectrometry[J].Analytical Biochemistry, 2006, 352(2):176-181.
[12] DANSOUD M, WANG H, NUGROHO R D, et al.Assessment of response to moderate and high dose supplementation of astaxanthin in laying hens[J].Animals:An Open Access Journal from MDPI, 2021, 11(4):1138.
[13] BUSCHV M, PEREYRA-GONZALEZ A,  EGATIN N, et al.Propolisencapsulation by spray drying:Characterization and stability[J].LWT, 2017, 75:227-235.
EGATIN N, et al.Propolisencapsulation by spray drying:Characterization and stability[J].LWT, 2017, 75:227-235.
[14] GUOQ,MU T H.Emulsifying properties of sweet potato protein:Effect of protein concentration and oil volume fraction[J].Food Hydrocolloids, 2011, 25(1):98-106.
[15] RODJANP, WATTANASIT S, FAROONGSARNG D, et al.Garlic oil granules coated with enteric polymer:Effects on performance, egg quality, yolk antioxidants, yolk cholesterol, blood biochemistry and hepatic lipid metabolism in laying hens[J].Animal Feed Science and Technology, 2021, 274:114854.
[16] BRODKORBA, EGGER L, ALMINGER M, et al.INFOGEST static in vitrosimulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1 014.
[17] 王家镔,林军, 曲可欣, 等.喷雾干燥与冷冻干燥鸡蛋粉特性研究[J].食品科技, 2020, 45(3):80-86.
WANG J B, LIN J, QU K X, et al.Comparison of microstructure and physicochemical properties of spray drying and freeze-dried egg powder[J].Food Science and Technology, 2020, 45(3):80-86.
[18] 沈青,赵英, 迟玉杰, 等.真空冷冻与喷雾干燥对鸡蛋全蛋粉理化性质及超微结构的影响[J].现代食品科技, 2015, 31(1):147-152.
SHEN Q, ZHAO Y, CHI Y J, et al.Effects of freeze-drying and spray-drying on the physicochemical properties and ultrastructure of whole-egg powder[J].Modern Food Science and Technology, 2015, 31(1):147-152.
[19] 赵晓燕,孟昂, 刘红开, 等.雨生红球藻中虾青素油树脂的稳定性研究[J].食品科技, 2018, 43(8):285-289.
ZHAO X Y, MENG A, LIU H K, et al.The stability of astaxanthin oleoresin from Haematococcus pluvialis[J].Food Science and Technology, 2018, 43(8):285-289.
[20] M RQUEZ-RUIZG, HOLGADO F, GARC
RQUEZ-RUIZG, HOLGADO F, GARC A-MART
A-MART NEZ M C, et al.A direct and fast method to monitor lipid oxidation progress in model fatty acid methyl esters by high-performance size-exclusion chromatography[J].Journal of Chromatography A, 2007, 1 165(1-2):122-127.
NEZ M C, et al.A direct and fast method to monitor lipid oxidation progress in model fatty acid methyl esters by high-performance size-exclusion chromatography[J].Journal of Chromatography A, 2007, 1 165(1-2):122-127.
[21] 陈伊凡,李欢欢, 唐宏刚, 等.二十二碳六烯酸强化蛋黄粉的制备及其贮藏稳定性[J].浙江农业学报, 2020, 32(12):2 226-2 231.
CHEN Y F, LI H H, TANG H G, et al.Preparation and storage stability of docosahexaenoic acid enriched egg yolk powder[J].Acta Agriculturae Zhejiangensis, 2020, 32(12):2 226-2 231.
[22] WANGQ L, JIN G F, WANG N, et al.Lipolysis and oxidation of lipids during egg storage at different temperatures[J].Czech Journal of Food Sciences, 2017, 35(3):229-235.
[23] JING F, ZHANG J H, YU X, et al.Crude lipoxygenase from pig muscle:Partial characterization and interactions of temperature, NaCl and pH on its activity[J].Meat Science, 2011, 87(3):257-263.
[24] 袁磊,刘晓庚, 唐瑜.不同类胡萝卜素清除自由基能力的比较[J].包装与食品机械, 2015, 33(2):7-11.
YUAN L, LIU X G, TANG Y.The comparison of free radical scavenging capacity of carotenoids[J].Packaging and Food Machinery, 2015, 33(2):7-11.
[25] AMBATIR R, PHANG S M, RAVI S, et al.Astaxanthin:Sources, extraction, stability, biological activities and its commercial applications:A review[J].Marine Drugs, 2014, 12(1):128-152.
[26] LIUX J, ZHANG R J, MCCLEMENTS D J, et al.Nanoemulsion-based delivery systems for nutraceuticals:influence of long-chain triglyceride (LCT) type onin vitrodigestion and astaxanthin bioaccessibility[J].Food Biophysics, 2018, 13(4):412-421.