卵磷脂,是存在于动植物组织及卵黄中的一组黄褐色的油脂性物质[1],具有调节血清脂质水平,保护肝脏,改善记忆力,加强免疫力等生物活性[2-3]。蛋黄卵磷脂中磷脂酰胆碱(phosphatidylcholine,PC)的含量比大豆磷脂高3倍[4],而磷脂酰胆碱又是体现磷脂功能性质的主要成分,因此蛋黄是一种优质的提取卵磷脂的原料。
有机溶剂提取法是提取蛋黄卵磷脂的常用方法,具有生产周期短、生产能力大、易于实现规模化量产等优点,一般采用两步法提取蛋黄卵磷脂,首先采用非极性溶剂(如正己烷、氯仿、丙酮等)从蛋黄中脱去油脂,然后利用极性溶剂(如乙醇、丁醇等)从脱油后的蛋黄残渣中提取卵磷脂[5]。但也存在着有机溶剂残留等问题,因而限制在医药产品中的应用。相比溶剂法,超临界CO2萃取卵磷脂是一种绿色安全的生产技术[6],通过压力、流速与温度等条件改变流体密度,调整萃取效果,乙醇作为夹带剂能大大提高蛋黄卵磷脂的提取率,生物安全性高,可以获得满足医药产品使用标准的蛋黄卵磷脂[7]。同时由于提取过程中CO2可以循环使用,避免使用大量有机试剂造成浪费。同时,工艺相对简单,而且提取速度很快。
对于超临界提取卵磷脂后的脱脂蛋黄粉,再利用程度比较低,多数作为蛋白质辅料添加到动物饲料、焙烤食品中,并没有发挥其最大价值[8]。通过对夹带剂乙醇的使用量对蛋黄磷脂提取纯度、脱脂蛋黄粉溶解度机理变化的研究,探究脱脂蛋黄粉作为副产物再利用的可能性,为后续拓宽脱脂蛋黄粉的应用范围提高其产品附加值提供理论基础。
1 材料与方法
1.1 材料与试剂
蛋黄粉,黑龙江中农兴和生物科技股份有限公司;BCA蛋白浓度测定试剂盒,北京索莱宝科技有限公司;无水乙醇、硼酸、盐酸、CuSO4·5H2O、甲酸、正庚烷,均为分析纯,天津市大茂化学试剂厂;NaOH(分析纯),天津市东丽区天大化学试剂厂;甲基红指示剂(分析纯),天津市光复精细化工研究所;溴甲酚绿指示剂(分析纯),上海麦克林生物有限公司;K2SO4(分析纯),天津市光复科技发展有限公司;浓H2SO4(分析纯),北京化工厂;无水乙醚(分析纯),上海国药集团化学试剂有限公司;KBr(分析纯),大连博诺有限公司;NaCl(分析纯),天津市石英钟厂霸州市化工分厂。
1.2 仪器与设备
HA220-50-06-C型超临界CO2萃取装置,南通市华安超临界萃取有限公司;MK-6S棒状薄层色谱分析仪,日本雅特隆公司;JSM-7800F热场发射扫描电镜,英国牛津仪器公司;Spectrum One-B型傅里叶变换红外光谱仪,美国PerkinElmer公司;HitachiF-2700荧光分光光度计、CF16RXⅡ高速冷冻离心机,日本Hitachi公司;Infinite M200多功能酶标仪,瑞士TECAN公司;DSC250差示扫描量热仪,上海研锦科学仪器有限公司;BSA223S电子分析天平,赛多利斯科学仪器(北京)有限公司;98-2强磁力搅拌器,巩义市予华仪器有限责任公司。
1.3 试验方法
1.3.1 蛋黄卵磷脂及脱脂蛋黄粉的制备
采用超临界CO2萃取蛋黄粉中脂质[9]。250 g蛋黄粉装进料筒,垫上脱脂棉与定性滤纸,放进超临界设备萃取釜中,萃取釜温度45 ℃,分离釜温度35 ℃,萃取压力25 MPa。萃取30 min,获取萃取物,记作样品1,从夹带剂料筒中加入250 g无水乙醇,再次萃取30 min后,从分离釜中获取萃取物,记作样品2,以此类推,重复上述操作直至接出的油脂乙醇混合溶液澄清透明。
1.3.2 蛋黄油脂成分测定
蛋黄油脂的脂质组成分析采用棒状薄层色谱-氢火焰离子化检测法(thin layer chromatography-hydrogen flame ionization detection, TLC-FID)[10]。蛋黄油脂溶解于三氯甲烷中使其质量浓度达到10 mg/mL,用点样针吸取1 μL,该溶液分5~7次点在10 cm硅胶色谱棒起点处,将点样完毕后的硅胶棒置于展开剂[V(正庚烷)∶V(无水乙醚)∶V(甲酸)=42∶28∶0.3]的密闭展开槽中展开20 min;待展开完毕后取出色谱棒,挥发掉残留溶剂后进行FID检测,检测器设置参数:扫描速度200 mm/min,H2流量160 mL/min,空气流量2 L/min,扫描实时获得油脂中各组分的谱图由软件自动对各组分谱图的峰面积积分后进行归一化处理,得各脂质组分百分含量。
1.3.3 脱脂蛋黄粉蛋白质含量和溶解度测定
脱脂蛋黄粉中总的蛋白质含量测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》自动凯氏定氮法。称取蛋黄粉0.200 g至消化管中,加入0.2 g CuSO4、6 g K2SO4及12.5 mL浓硫酸(12 mol/L)于消化炉进行消化。待消化完全后将消化管置于自动凯氏定氮仪中,计算总蛋白质含量(换算系数取6.25)。
可溶性蛋白质含量测定参考MORR等[11]的方法。称取500 mg脱脂蛋黄粉放置在150 mL烧杯内,0.1 mol/L NaCl溶液溶解并定容至50 mL,磁力搅拌器搅拌1 h充分溶解后,8 000 r/min离心20 min,过滤取上清液用BCA试剂盒对蛋白质含量进行测定。绘制蛋白质浓度标准曲线,以蛋白质浓度(x)为横坐标,吸光度(y)为纵坐标,得线性回归方程y=0.832 7x+0.011 6,R2= 0.997 6,并将测得的不同条件下的样品的吸光度值(A)代入方程中,得到不同乙醇洗脱次数下的脱脂蛋黄粉的可溶解性蛋白质浓度,再换算成可溶解性蛋白质含量。
溶解度![]()
(1)
1.3.4 脱脂蛋黄粉微观结构表征
利用热场发射扫描电子显微镜对经过不同次数乙醇洗脱后的脱脂蛋白粉进行电镜扫描[12]。将洁净的铝箔片粘附于样品台上,称取1 mg脱脂蛋白粉样品置于铝箔片上,将样品台置于离子溅射仪的样品舱中,在15 mA电流下喷金90 s,将样品台装入电子显微镜观察室,选取清晰视野进行观察。
1.3.5 脱脂蛋黄粉热变性表征
称取5 mg样品粉末于铂金坩埚中,设置一个空白铂金坩埚作为对照,热重分析仪测热稳定性。设置参数:升温范围30~120 ℃,升温速率3 ℃/min。
1.3.6 脱脂蛋黄粉红外光谱表征
称取1 mg脱脂蛋黄粉固体粉末与100 mg干燥的KBr粉末混合,研磨均匀,装入压片模具中压成透明薄片,将薄片放置于样品架,利用Perkin Elmer红外光谱仪测定脱脂蛋黄粉的红外光谱图,在400~4 000 cm-1范围内进行扫描,扫描速度为2.8 mm/s,叠加64次。
1.3.7 脱脂蛋黄粉表面疏水性表征
将脱脂蛋黄粉溶于0.1 mol/L NaCl溶液,离心过滤,酶标仪测蛋白质吸光度,4种蛋白质的浓度统一为1 mg/mL。使用荧光分光光度计测量荧光强度,激发波长280 nm,测定范围为250~500 nm。动态荧光扫描时,记录300 nm处发射荧光。扫描速度1 500 nm/min,狭缝5.0 nm。
1.3.8 数据分析与处理
试验数据采用3次平行试验的平均值,数据间的差异通过SPSS软件进行统计分析,结果以平均值±标准差表示。数据采用Origin 2019软件绘图。
2 结果与分析
2.1 超临界CO2萃取蛋黄磷脂过程中乙醇洗脱次数的选择
超临界CO2萃取蛋黄卵磷脂过程中,夹带剂的乙醇洗脱次数不同,导致乙醇的颜色和其中的卵磷脂含量发生变化,变化情况见图1和图2。CO2在超临界状态下能够有效地萃取蛋黄粉中非极性脂质[13],萃取组分中,甘油三酯含量大于85%,胆固醇占5%,加入乙醇后,通过改变流体极性萃取卵磷脂[14]。与无乙醇组相比,甘油三脂的含量随乙醇洗脱次数增加而降低,磷脂纯度在逐渐增加,乙醇溶液颜色逐渐由黄色转为透明,当乙醇洗脱次数超过5次时,磷脂含量趋于最低。因此,探究乙醇洗脱次数对脱脂蛋黄粉理化性质的影响,将从0、1、3和5次乙醇洗脱这4个梯度进行探索。

图1 不同洗脱次数的乙醇颜色变化
Fig.1 The color change of ethanol with different elution times

图2 不同洗脱次数下乙醇中磷脂、胆固醇、 甘油三酯含量变化
Fig.2 Changes in the content of lecithin, cholesterol, and triglyceride in ethanol with different elution times
2.2 脱脂蛋黄粉傅里叶红外光谱分析
乙醇不同洗脱次数对脱脂蛋黄粉中蛋白质红外光谱影响如图3所示。波数1 700~1 600 cm-1的酰胺Ⅰ区是蛋白质二级结构傅里叶变换红外光谱中信息量最大的部分。酰胺I振动模式与C![]() O的拉伸振动有关,属于与面内N—H弯曲和C—N拉伸弱耦合的酰胺基。如图3所示,在1 651和1 658 cm-1处观察4种样品带,属于α-螺旋结构[15]。随乙醇洗脱次数增大,酰胺I带由1 658 cm-1移动到1 651 cm-1,由蛋白质的变性程度增大所致。ZHOU等[16]对3种纳米凝胶(由蛋黄的低密度脂蛋白与不同多糖结合形成不同的凝胶)进行红外光谱测试研究发现,酰胺Ⅰ带从1 653 cm-1移动到1 616~1 598 cm-1归因于LDL蛋白部分变性和加热过程诱导的疏水相互作用。1 537~1 545 cm-1处的条带为酰胺Ⅱ区,酰胺Ⅱ振动模式归因于N—H平面内弯曲和C—N拉伸振动的异相组合,C—O平面内弯曲以及C—C和N—C拉伸振动的贡献较小[13]。2 925、2 854 cm-1和1 742 cm-1处条带属于脂质链中CH2基团的不对称和对称拉伸振动[17]。4种样品相比,3次和5次乙醇洗脱后脱脂蛋黄粉的2 849和2 851 cm-1处频带及1 748和1 749 cm-1频带几乎消失,表明3次和5次乙醇洗脱后脱脂蛋黄粉的脂质含量降低,脂蛋白结构遭到破坏。FOOKSON等[18]研究表明磷脂在970 cm-1左右有特征带。乙醇未洗脱的脱脂蛋黄粉和1次乙醇洗脱的脱脂蛋黄粉明显有磷脂特征条带,表明3次与5次乙醇洗脱可以有效脱除磷脂。
O的拉伸振动有关,属于与面内N—H弯曲和C—N拉伸弱耦合的酰胺基。如图3所示,在1 651和1 658 cm-1处观察4种样品带,属于α-螺旋结构[15]。随乙醇洗脱次数增大,酰胺I带由1 658 cm-1移动到1 651 cm-1,由蛋白质的变性程度增大所致。ZHOU等[16]对3种纳米凝胶(由蛋黄的低密度脂蛋白与不同多糖结合形成不同的凝胶)进行红外光谱测试研究发现,酰胺Ⅰ带从1 653 cm-1移动到1 616~1 598 cm-1归因于LDL蛋白部分变性和加热过程诱导的疏水相互作用。1 537~1 545 cm-1处的条带为酰胺Ⅱ区,酰胺Ⅱ振动模式归因于N—H平面内弯曲和C—N拉伸振动的异相组合,C—O平面内弯曲以及C—C和N—C拉伸振动的贡献较小[13]。2 925、2 854 cm-1和1 742 cm-1处条带属于脂质链中CH2基团的不对称和对称拉伸振动[17]。4种样品相比,3次和5次乙醇洗脱后脱脂蛋黄粉的2 849和2 851 cm-1处频带及1 748和1 749 cm-1频带几乎消失,表明3次和5次乙醇洗脱后脱脂蛋黄粉的脂质含量降低,脂蛋白结构遭到破坏。FOOKSON等[18]研究表明磷脂在970 cm-1左右有特征带。乙醇未洗脱的脱脂蛋黄粉和1次乙醇洗脱的脱脂蛋黄粉明显有磷脂特征条带,表明3次与5次乙醇洗脱可以有效脱除磷脂。
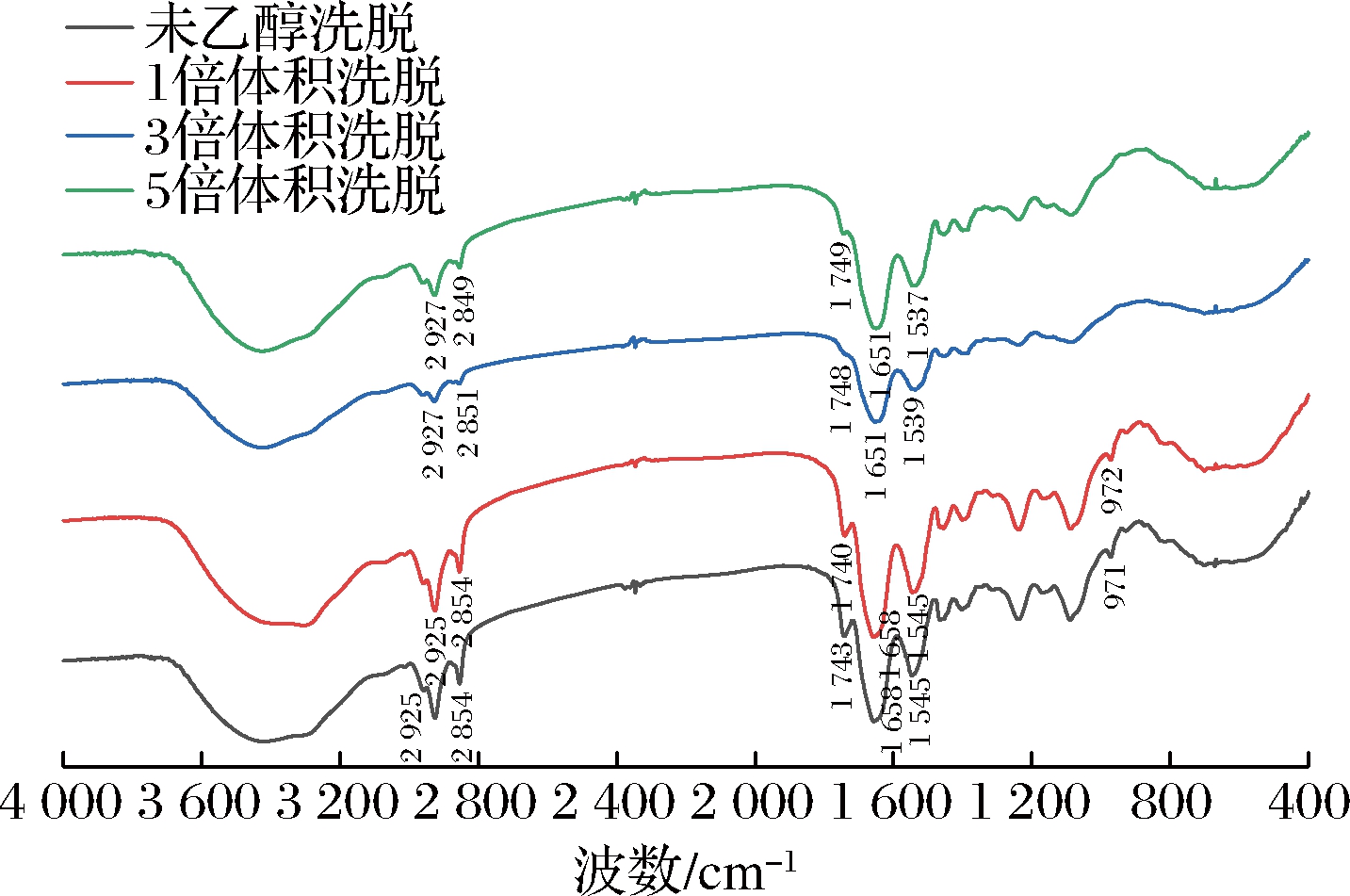
图3 乙醇洗脱次数对脱脂蛋黄粉红外光谱的影响
Fig.3 Effect of ethanol elution times on the external spectrum of defatted egg yolk powder
2.3 脱脂蛋黄粉荧光光谱分析
表面疏水性是判断蛋白质构象变化的重要指标之一。如图4所示,与未用乙醇洗脱的脱脂蛋黄粉相比,其余3组疏水性呈现递增趋势,其中5次乙醇洗脱的脱脂蛋黄粉疏水性最强。随乙醇洗脱次数增加,在超临界CO2流体的辅助下充分与蛋黄粉进行反应,蛋白质空间结构改变,暴露疏水性氨基酸残基,增加肽链的疏水性。罗舜菁等[19]研究也表明,乙醇分子的极性较大,会导致蛋白分子结构展开,内部的疏水基团暴露,最终使其表面疏水性升高。傅里叶变换红外光谱结果同样证明,属于α-螺旋结构的频带随乙醇洗脱次数增大而蓝移,同样证明蛋白质受乙醇影响,空间结构被破坏[20]。

图4 脱脂蛋黄粉荧光光谱图
Fig.4 Fluorescence spectrum of defatted egg yolk powder
2.4 脱脂蛋黄粉差示扫描量热法(differential scanning calorimetry, DSC)分析
采用蛋白质差示扫描量热法研究了脱脂蛋黄粉的乙醇洗脱次数对其热稳定性的影响。如表1所示,未经乙醇洗脱的脱脂蛋黄粉主要吸热峰在77.84 ℃,经乙醇洗脱样品组的变性温度低于其变性温度。王迎新等[21]测定普通蛋黄粉变性温度为67.80 ℃,改性蛋黄粉(用磷脂酶修饰过的蛋黄粉)变性温度94.54 ℃,提高了25 ℃以上,改性后的蛋黄粉具有更强的耐热性。与普通蛋黄的变性温度相比,运用超临界CO2脱脂使蛋黄粉发生变性,具有更高的耐热性,与蛋白质解折叠有关。焓值是吸热(氢键破坏)和放热变化(疏水相互作用或蛋白质聚集的破坏)组合的净值。因此,在加工处理过程中蛋白质结构的损失通过残余焓的降低来表示[22]。表1中无乙醇洗脱的脱脂蛋黄粉焓值最高,随乙醇洗脱次数增加,焓值逐渐下降,表明蛋白质结构遭到破坏。之前荧光强度实验表明蛋白质疏水性呈逐渐递增的趋势,同样表明蛋白质结构发生了改变。
表1 乙醇洗脱次数对脱脂蛋黄粉变性程度的影响
Table 1 Effect of ethanol elution times on the degree of protein denaturation in defatted egg yolk powder

乙醇洗脱次数焓值/(J·g-1)变性温度/℃061.22±0.12a77.84±0.06a149.56±0.08b77.46±0.04b346.37±0.10c77.08±0.06c545.06±0.06d77.48±0.08b
注:不同小写字母代表不同试验组之间存在显著性差异(P<0.05)。
2.5 脱脂蛋黄粉微观结构分析
4种样品的热场扫描电镜图如图5所示,脱脂蛋黄粉中大多数蛋白质通过极性和非极性脂质分子的聚集形成胶束和颗粒结构[23],未经乙醇洗脱的脱脂蛋黄粉中大分子蛋白质表面附着不同大小的脂质小球,超临界CO2萃取油脂的方式比较温和,没有破坏脂蛋白的内部结构,脂质小球附着在蛋白质表面,结构较为稳定。1次乙醇洗脱后的脱脂蛋黄粉脂质小球附着数量减少,球形颗粒塌陷或起皱并有轻微破裂。3次乙醇洗脱后的脱脂蛋黄粉内部结构未完全暴露,表面不光滑,外表褶皱不平。5次乙醇洗脱后的脱脂蛋黄粉颗粒严重受损和暴露,促进脂质释放,有利于油脂提取。随乙醇洗脱次数增加,脂蛋白结构逐渐被破坏,5次乙醇洗脱对脱脂蛋黄粉的结构损害最严重,由完整的球形结构变为片状结构,蛋白质结构破坏程度较大,与DSC实验结果显示的随着乙醇添加量变大,焓值逐渐降低,蛋白质分子结构破坏程度增大的结果相符。与荧光光谱测定结果相符。

A-对照组(×200倍);B-洗脱1次(×200倍);C-洗脱3次(×200倍);D-洗脱5次(×200倍); a-对照组×1 000倍;b-洗脱1次×1 000倍;c-洗脱3次×1 000倍;d-洗脱5次×1 000倍
图5 乙醇洗脱次数对蛋黄粉微观结构的影响
Fig.5 The effect of ethanol elution times on the microstructure of egg yolk powder
2.6 脱脂蛋黄粉溶解度分析
溶解度是一种功能特性,是在不同加工条件下蛋白质成分潜在应用于饮料、液体食品和乳液的关键条件[24]。如图6所示,与对照组(未经乙醇洗脱)相比,5次乙醇洗脱下的蛋黄粉总蛋白质含量最高。SU等[25]的研究表明,从蛋黄粉中提取油脂后,剩余成分发生了显著变化。

图6 不同洗脱次数对蛋黄粉可溶性蛋白含量、 总蛋白质含量和蛋白质溶解度的影响
Fig.6 The effect of different elution times on the soluble protein content, total protein content, and protein solubility of egg yolk powder 注:不同小写字母代表不同试验组之间存在显著性差异(P<0.05)
原蛋黄粉的成分中含有31.55%的蛋白质,对于乙醇洗脱后的蛋黄粉,蛋白质含量为44.74%,与丙烷辅助亚临界流体萃取油脂后的蛋白质含量相比,差异显著(P<0.05)。原蛋黄粉的溶解度为18.06%,经过丙烷辅助亚临界萃取油脂后的溶解度为12.31%,略低于原蛋黄粉。然而,有机试剂单独提取油脂后的蛋黄粉几乎不溶,可能是由于提取过程中蛋白质在有机试剂下发生严重变性,这与MAO等[26]获得的脱脂核桃粉溶解度的结果相似。对照组溶解度28.94%与3次乙醇洗脱下蛋黄粉溶解度29.14%、5次乙醇洗脱下蛋黄粉溶解度30.01%无显著差异(P>0.05)。蛋黄颗粒中高密度脂蛋白往往与磷脂以磷钙桥的方式结合在一起,从而保持结构稳定[27]。从傅里叶红外光谱分析得出在3次与5次乙醇洗脱后,磷脂条带消失,结合溶解度的测定,表明磷钙桥结构被损坏。与1次乙醇洗脱相比,3次和5次乙醇洗脱下溶解度显著降低。很多因素可能影响蛋白质溶解度,如蛋白质变性程度、氨基酸组成、氢键、离子强度、芳香族/脂肪族比例和疏水性。这些因素通常是相互影响的。在这些因素中,蛋白质疏水性对蛋白质溶解度的影响是研究最多的一个因素[28]。荧光光谱分析结果表明蛋白质疏水性随着乙醇洗脱量的增加而逐渐增大。乙醇可能导致蛋黄粉的疏水核心暴露,这是一种蛋白质去折叠、疏水相互作用现象,也会导致溶解度降低。1次乙醇洗脱后的脱脂蛋黄粉的溶解度与对照组相比显著增大(P<0.05),是因为适量乙醇使蛋白质部分疏水基团暴露,傅里叶红外光谱测定结果表明还残存部分游离脂蛋白通过疏水相互作用结合。荧光光谱的结果表明,1次乙醇洗脱的蛋黄粉表面疏水性小于5次乙醇洗脱的蛋黄粉,避免了由游离脂蛋白漂浮引起的分层,从而提高了溶解度[29]。TANG等[30]的研究表明,酶解改变了蛋黄粉的溶解度,枯草杆菌酶解蛋黄粉的溶解度从原来15%增加至98.16%,这可能是由于枯草杆菌蛋白酶作用于大量具有亲脂性的疏水氨基酸残基的侧链,通过疏水相互作用与游离脂蛋白结合,系统的表面疏水性降低,同时避免了游离脂蛋白漂浮造成的分层,从而提高了其溶解度。
3 结论
通过分次添加无水乙醇的实验结果表明,添加5次乙醇洗脱辅助超临界CO2萃取油脂可以得到理想的效果。3~5次乙醇洗脱得到的油脂变为极性磷脂,同时也达到了纯化磷脂的目标。对于超临界CO2萃取磷脂后的脱脂蛋黄粉,1次乙醇洗脱后的溶解度与0、3、5次组有显著性差异(P<0.05)。适量乙醇使蛋白质部分疏水基团暴露出来,通过疏水相互作用与游离脂蛋白结合,提高了脱脂蛋黄粉溶解度,未洗脱与洗脱3、5次组无显著性差异(P>0.05)。故经过3次和5次乙醇洗脱的脱脂蛋黄粉仍有较好的溶解度。
[1] 田育苗.蛋黄卵磷脂纯化工艺研究[D].北京:北京化工大学, 2013.
TIAN Y M.Purification technology of egg yolk lecithin[D].Beijing:Beijing University of Chemical Technology, 2013.
[2] 王元好,马岩, 袁起新, 等.南极磷虾油制备技术及其生理功能的研究进展[J].食品研究与开发, 2020, 41(21):220-224.
WANG Y H, MA Y, YUAN Q X, et al.Research progress on extraction and function of Antarctic krill oil[J].Food Research and Development, 2020, 41(21):220-224.
[3] 陈晋.蛋黄卵磷脂活性组分的分离纯化及其辅助增强记忆功能研究[D].大连:大连工业大学, 2019.
CHEN J.Research on the separation and purification of active component of egg yolk lecithin and its effects on memory improvement[D].Dalian:Dalian Polytechnic University, 2019.
[4] SUNN, CHEN J, WANG D, et al.Advance in food-derived phospholipids:Sources, molecular species and structure as well as their biological activities[J].Trends in Food Science &Technology, 2018, 80:199-211.
[5] 李欣,刘欣.蛋黄卵磷脂提取工艺的研究[J].现代食品, 2017(12):98-99.
LI X, LIU X.Study on extraction technology of egg yolk lecithin[J].Modern Food, 2017(12):98-99.
[6] 高佳佳,王伟宁, 郝凯越, 等.超临界CO2萃取粉末磷脂的研究[J].中国粮油学报, 2020, 35(12):79-86.
GAO J J, WANG W N, HAO K Y, et al.Supercritical CO2extraction of powdered phospholipids[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(12):79-86.
[7] 邓鹏,孙文佳, 徐同成, 等.超临界CO2法萃取花生油脚中磷脂工艺条件的优化[J].中国食物与营养, 2017, 23(1):55-59.
DENG P, SUN W J, XU T C, et al.Optimizationon supercritical CO2extraction technology of phospholipids from peanut oil sediment[J].Food and Nutrition in China, 2017, 23(1):55-59.
[8] 焦涵,陈杰, 顾璐萍, 等.卵黄多肽的工业化制备及脱色工艺研究[J].食品与发酵工业, 2021, 47(11):139-145.
JIAO H, CHEN J, GU L P, et al.Industrial production and decolorization of egg yolk polypeptides[J].Food and Fermentation Industries, 2021, 47(11):139-145.
[9] 戴桂芳,陈云, 陈小玲, 等.咖啡挥发油的超临界二氧化碳萃取及其成分分析[J].粮食与油脂, 2021, 34(5):51-54;58.
DAI G F, CHEN Y, CHEN X L, et al.Supercritical CO2extraction and components analysis of coffee volatile oil[J].Cereals &Oils, 2021, 34(5):51-54;58.
[10] YINF W, LIU X Y, FAN X R, et al.Extrusion of Antarctic krill (Euphausia superba) meal and its effect on oil extraction[J].International Journal of Food Science &Technology, 2015, 50(3):633-639.
[11] MORRC V, GERMAN B, KINSELLA J E, et al.A collaborative study to develop a standardized food protein solubility procedure[J].Journal of Food Science, 1985, 50(6):1 715-1 718.
[12] 林松毅,王可, 刘静波.电子束辐照技术提高玉米蛋白粉酶解效果[J].农业工程学报, 2014, 30(22):300-308.
LIN S Y, WANG K, LIU J B.Improving effect of enzyme hydrolysis of corn gluten meal by assistant of electron beam irradiation[J].Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(22):300-308.
[13] KUDRET G, BEJJANKI S K, KANWATE B W, et al.Comparative study on physicochemical and functional properties of egg powders from Japanese quail and white Leghorn chicken[J].International Journal of Food Properties, 2018, 21(1):957-972.
[14] 高进,马美湖, 姚茂君, 等.超临界CO2萃取蛋黄卵磷脂工艺条件的研究[J].食品工业, 2009, 29(1):30-32.
GAO J, MA M H, YAO M J, et al.Experiment on supercritical CO2extraction of lecithin from egg yolk[J].The Food Industry, 2009, 29(1):30-32.
[15] MATHEUSS, FRIESS W, MAHLER H C.FTIR and nDSC as analytical tools for high-concentration protein formulations[J].Pharmaceutical Research, 2006, 23(6):1 350-1 363.
[16] ZHOUM Y, HU Q B, WANG T R, et al.Effects of different polysaccharides on the formation of egg yolk LDL complex nanogels for nutrient delivery[J].Carbohydrate Polymers, 2016, 153:336-344.
[17] KRILOVD, BALARIN M, KOSOVI M, et al.FT-IR spectroscopy of lipoproteins:A comparative study[J].Spectrochimica Acta.Part A, Molecular and Biomolecular Spectroscopy, 2009, 73(4):701-706.
M, et al.FT-IR spectroscopy of lipoproteins:A comparative study[J].Spectrochimica Acta.Part A, Molecular and Biomolecular Spectroscopy, 2009, 73(4):701-706.
[18] FOOKSONJ E, WALLACH D F H.Structural differences among phosphatidylcholine, phosphatidylethanolamine, and mixed phosphatidylcholine/phosphatidylethanolamine multilayers:An infrared absorption study[J].Archives of Biochemistry and Biophysics, 1978, 189(1):195-204.
[19] 罗舜菁,耿勤, 颜小燕, 等.不同脱脂条件下米渣蛋白的结构及功能性质[J].食品科学, 2017, 38(5):202-207.
LUO S J, GENG Q, YAN X Y, et al.Structural and functional properties of rice dreg protein prepared by different degreasing methods[J].Food Science, 2017, 38(5):202-207.
[20] ALIEVAR R, KUDRYASHEVA N S.Variability of fluorescence spectra of coelenteramide-containing proteins as a basis for toxicity monitoring[J].Talanta, 2017, 170:425-431.
[21] 王迎新,迟玉杰.磷脂酶修饰提高蛋黄磷脂乳化性及稳定性的研究[J].中国粮油学报, 2009, 24(10):107-111.
WANG Y X, CHI Y J.Improvement of emulsifying property and stability of yolk phospholipid by phospholipase modification[J].Journal of the Chinese Cereals and Oils Association, 2009, 24(10):107-111.
[22] CHALAMAIAHM, ESPARZA Y, TEMELLI F, et al.Physicochemical and functional properties of livetins fraction from hen egg yolk[J].Food Bioscience, 2017, 18:38-45.
[23] KIOSSEOGLOUV.Egg yolk protein gels and emulsions[J].Current Opinion in Colloid &Interface Science, 2003, 8(4-5):365-370.
[24] DEC SSIA S SOUSA R, COIMBRA J S R, GARCIA ROJAS E E, et al.Effect of pH and salt concentration on the solubility and density of egg yolk and plasma egg yolk[J].LWT-Food Science and Technology, 2007, 40(7):1 253-1 258.
SSIA S SOUSA R, COIMBRA J S R, GARCIA ROJAS E E, et al.Effect of pH and salt concentration on the solubility and density of egg yolk and plasma egg yolk[J].LWT-Food Science and Technology, 2007, 40(7):1 253-1 258.
[25] SUY J, JI M Y, LI J H, et al.Subcritical fluid extraction treatment on egg yolk:Product characterization[J].Journal of Food Engineering, 2020, 274:109805.
[26] MAOX Y, HUA Y F.Chemical composition, molecular weight distribution, secondary structure and effect of NaCl on functional properties of walnut (Juglans regiaL) protein isolates and concentrates[J].Journal of Food Science and Technology, 2014, 51(8): 1 473-1 482.
[27] STRIXNERT, WÜRTH R, KULOZIK U.Combined effects of enzymatic treatment and spray drying on the functional properties of egg yolk main fractions granules and plasma[J].Drying Technology, 2013, 31(13-14):1 485-1 496.
[28] SHAWK L, GRIMSLEY G R, YAKOVLEV G I, et al.The effect of net charge on the solubility, activity, and stability of ribonuclease Sa[J].Protein Science, 2001, 10(6):1 206-1 215.
[29] KIMJ S, MARUYAMA A, AKAIKE T, et al.In vitrogene expression on smooth muscle cells using a terplex delivery system[J].Journal of Controlled Release, 1997, 47(1):51-59.
[30] TANGS T, ZHOU X, GOUDA M, et al.Effect of enzymatic hydrolysis on the solubility of egg yolk powder from the changes in structure and functional properties[J].LWT, 2019, 110:214-222.