南美白对虾(Litopenaeus vannamei)又叫凡纳滨对虾,属于对虾科、滨对虾属,营养丰富、口感鲜甜,是世界养殖产量最高的三大名优虾类之一。根据《中国渔业统计年鉴》,2021年我国南美白对虾海水养殖总量高达127.36万t,其加工产品主要是虾仁、虾糜等制品,由此产生大量虾壳、虾头等加工副产物,占整虾质量的40%~60%[1]。干虾壳含15%~40%甲壳素、20%~40%蛋白质以及20%~50%碳酸钙[2],然而这些副产物仅部分加工制备成低值化的饲料等产品,大部分未得到充分利用,造成资源的严重浪费和环境污染问题。目前,工业上已利用虾壳提取甲壳素、虾青素等高附加值产品,而作为虾壳主要成分之一的蛋白质的高值化转化却相对匮乏。研究表明,虾壳蛋白质资源化利用可通过蛋白酶水解,从而制备成活性多肽,进一步加工应用[3]。然而,活性肽对氨基酸的组成、数量以及排列顺序有一定要求[4],高提取率与高生物活性往往不能完全统一[5]。此外,虾壳蛋白水解物的苦味、腥味也是阻碍虾壳蛋白质资源高附加值利用的关键[6]。因此,如何最大程度地提高虾壳蛋白质的提取率,同时提高蛋白质水解产物的生物活性、改善产物的风味是虾壳蛋白质高值化利用的关键。
美拉德反应产物(Maillard reaction products, MRPs)具有一定的抗氧化活性[7]。HE等[8]利用葡萄糖对牡蛎蛋白水解产物进行美拉德反应改性,产物风味和抗氧化活性得到显著改善。董烨等[9]通过美拉德反应增强了鳙鱼皮水解物风味,并且产物具有较好的抗氧化活性。然而,针对虾壳蛋白质水解物的美拉德反应产物及其抗氧化活性,尤其是细胞层面的抗氧化作用研究鲜有报道。
本研究利用碱性蛋白酶提取虾壳蛋白质,再利用核糖对其进行美拉德反应改性,并对其体外抗氧化活性以及人肾小管上皮细胞内抗氧化活性进行研究,以期为虾壳蛋白质在新型抗氧化剂制备方面的应用提供依据,推动虾壳资源的深度开发与综合利用。
1 材料与方法
1.1 材料与试剂
南美白对虾壳由厦门玖芳食品有限公司提供,虾壳从新鲜的南美白对虾剥离后,立即收集并低温转运至实验室进行处理;人肾小管上皮细胞(HK-2)和胰蛋白酶,武汉普诺赛生命科技有限公司;CCK-8检测试剂盒,日本同仁化学研究所;ABTS、2,4,6-三吡啶基三嗪(tripyridine triazine, TPTZ),上海阿拉丁生化科技有限公司;DPPH,上海麦克林生化科技有限公司;碱性蛋白酶 (8×105U/g),上海源叶生物科技有限公司;D-(-)-核糖(纯度>98%),生化级,生工生物工程(上海)股份有限公司;NaOH、柠檬酸、甲醛等均为国产分析纯试剂。
1.2 仪器与设备
CR22 N型高速冷冻离心机,日本日立有限公司;FDU-1200型冷冻干燥机,东京理化器械株式会社;Synergy H1MF型全功能酶标仪,美国伯腾仪器有限公司;Nicolet iS50型傅里叶变换红外光谱仪,赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1 虾壳蛋白质的水解与美拉德反应改性
(1)虾壳预处理。新鲜南美白对虾壳用超纯水洗净,80 ℃烘干后进行粉碎,过80目标准筛,收集通过筛孔部分的虾粉,用质量分数为8%的柠檬酸溶液在室温下反应1 h脱除碳酸盐,离心后收集沉淀,水洗至中性,105 ℃烘干后密封保存于玻璃瓶中备用。
(2)虾壳中蛋白质含量测定。参照国标GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法测定虾壳原料的含氮量,并参照SHAHIDI等[10]的方法进行适当改动,测定虾壳中的甲壳素含量,再按照公式(1)计算虾壳的蛋白质含量。
蛋白质含量/%=(wN-wC×6.89%)×6.25×100
(1)
式中:wN,虾壳中的总氮质量分数,%;wC,虾壳中的甲壳素质量分数,%;6.89%,甲壳素理论含氮量;6.25,氮换算成蛋白质的折算系数。
经测定,可知虾壳原料中甲壳素含量为28.6%,蛋白质含量为34.6%(以干重计)。
(3)虾壳蛋白质的酶水解。脱钙虾壳粉用缓冲液混匀后,加入碱性蛋白酶,置于水浴锅中,反应结束后,迅速置于沸水浴中加热10 min使酶失去活性,离心后收集上清液,即为虾壳蛋白酶水解液,其中的虾壳蛋白酶水解产物编号为SSP,采用甲醛滴定法[11]测定酶水解液中游离氨基酸态氮(amino acid nitrogen,AAN)的含量。
(4)美拉德反应产物制备。将一定浓度的核糖水溶液加入到虾壳蛋白酶水解液中,通过水浴锅控制反应温度,反应过程辅以磁力搅拌,反应结束后迅速冷却,通过冷冻干燥设备进行干燥,获得浅黄色粉末状产物,即为MRPs,储存于-20 ℃备用。
(5)MRPs的表征。美拉德反应产物通过真空冷冻干燥设备进行干燥,获得粉末产物,将其与KBr按照一定比例混匀后进行研磨、压片,利用红外光谱仪进行扫描,扫描波数4 000~400 cm-1。
1.3.2 MRPs体外抗氧化活性
(1)DPPH自由基清除活性。参考王亮等[12]的方法稍作修改,将100 μL样品溶液、空白溶液分别加入到96孔板中,然后加入100 μL 0.2 mmol/L DPPH乙醇溶液,迅速混匀,于室温避光反应30 min,用酶标仪测定其在517 nm处的吸光度。
(2)ABTS阳离子自由基清除活性。参考王亮等[12]的方法稍作修改,ABTS (7.00 mmol/L)与K2S2O8(2.45 mmol/L)按体积比1∶1混合,室温避光反应12 h,获得ABTS自由基储备溶液,使用前用0.2 mol/L的PBS (pH 7.4) 将上述储备液稀释至734 nm处的吸光度达到0.70±0.05,即为ABTS工作液。
将100 μL样品溶液、空白溶液分别加入到96孔板中,然后加入100 μL ABTS工作液,迅速混匀,于室温避光反应5 min,用酶标仪测定其在734 nm处的吸光度。
(3)·OH清除活性。参考LI等[13]的方法稍作修改,依次加入等体积6 mmol/L FeSO4、6 mmol/L水杨酸、样品溶液以及6 mmol/L H2O2,混合均匀,在37 ℃静置反应30 min,用酶标仪测定其在510 nm处的吸光度,同时测定空白组和对照组的吸光度。
(4)铁离子还原能力(ferric reducing antioxidant power,FRAP)。参考LI等[13]的方法稍作修改,将0.30 mol/L醋酸缓冲液、10 mmol/LTPTZ、20 mmol/L FeCl3溶液按照体积比10∶1∶1混合制备FRAP工作液,现配现用。取180 μL FRAP工作液与20 μL样品溶液于96孔板中,迅速混匀后在37 ℃下静置反应30 min,用酶标仪测定其在595 nm处的吸光度,同时以Trolox (20~160 μg/mL)为标准品,按照相同方法测定其FRAP,绘制标准曲线,样品的还原能力以Trolox当量(Trolox equivalent,TE)表示,μmol TE/g。
1.3.3 MRPs细胞毒性与细胞内抗氧化活性
以人肾小管上皮细胞(HK-2)为模型,使用含有1%双抗、10%胎牛血清的MEM(含NEAA)培养基,培养条件为5% CO2、37 ℃、95%饱和湿度。
(1)MRPs的细胞毒性。将活化的HK-2细胞用胰酶消化、计数,按1×104个细胞/孔接种到96孔板中,继续孵育,待细胞贴壁后,弃去旧培养液,加入含有0~800 μg/mL MRPs的新鲜培养基继续孵育24 h,同时设置正常对照组(加入不含药品的培养基)。通过CCK-8法检测细胞存活率。首先细胞用PBS洗涤3次,再分别加入100 μL新鲜的培养基和10 μL CCK-8溶液,继续孵育1 h后测450 nm吸光度,每组实验重复15次。按照公式(2)计算细胞活力:
细胞活力![]()
(2)
式中:A药品、A空白、A对照分别为药品组、空白组、对照组的OD值。
(2)MRPs对H2O2诱导HK-2细胞氧化应激损伤的干预作用。设置对照组、氧化损伤组(H2O2)、糖基化产物处理组(H2O2和糖基化产物)。将活化的细胞用胰酶消化、计数,按1×104个细胞/孔接种到96孔板中,继续孵育,待细胞贴壁后,按照上述分组情况分别加入糖基化产物和H2O2,处理时间为4 h,每组设置15个重复。培养结束后,通过CCK-8法检测细胞存活率。
1.3.4 数据处理
使用Excel 2021处理数据,采用SPSS 26.0进行显著性分析。
2 结果与分析
2.1 酶水解虾壳蛋白质最适条件的筛选
碱性蛋白酶属于丝氨酸型内切酶,相比其它常用的蛋白酶,其酶切位点较宽,对水产品中的蛋白质具有较为彻底的水解效果,且价格适中,是应用最广泛的工具酶之一[14]。因此,将碱性蛋白酶用于虾壳蛋白质的提取,以水解液中氨基酸态氮含量为蛋白质脱除评价指标,结果如图1所示。
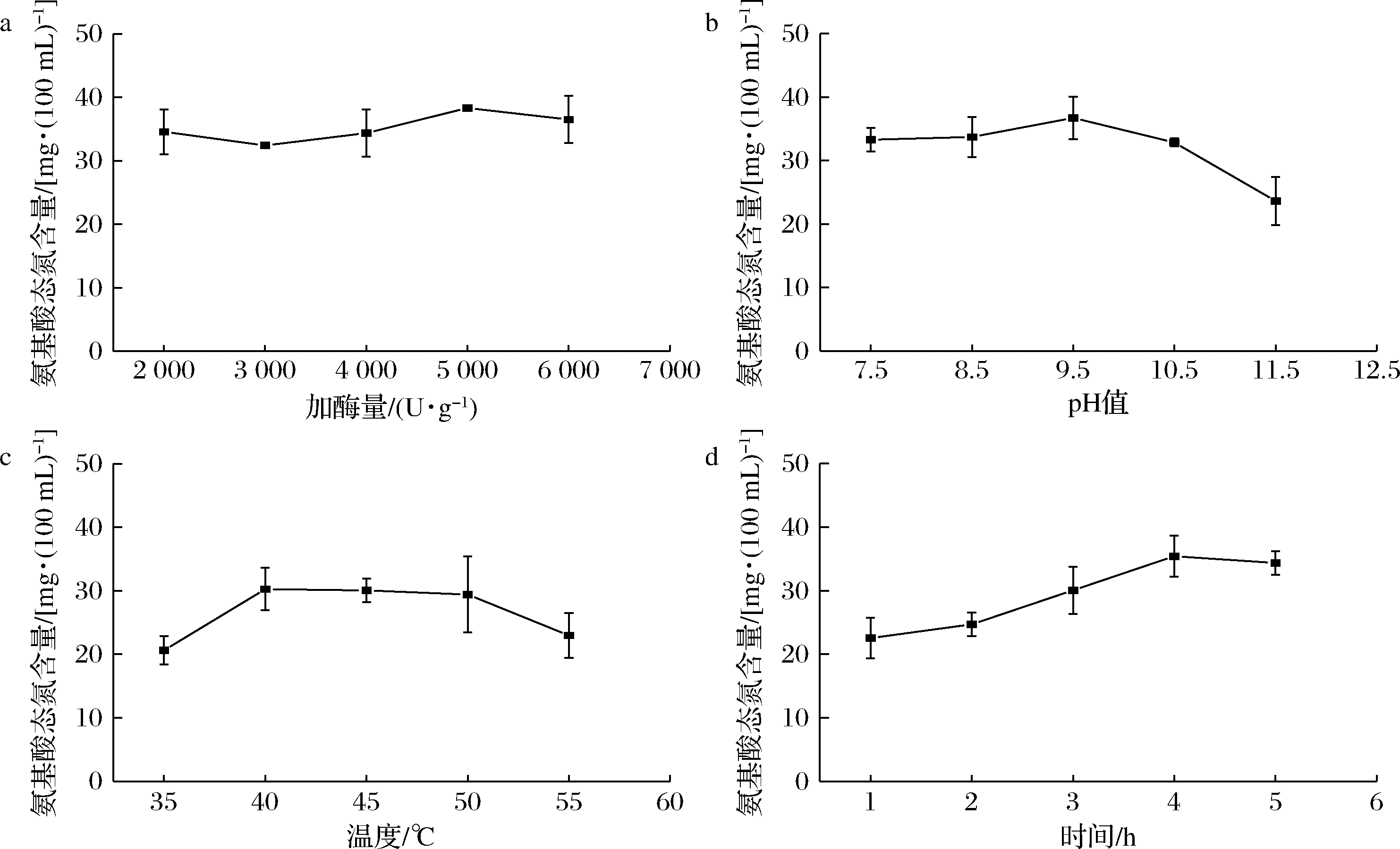
a-酶用量;b-pH值;c-温度;d-时间
图1 酶水解条件对虾壳蛋白质水解的影响
Fig.1 Effect of enzymatic hydrolysis conditions on the proteolysis of shrimp shells
图1-a结果表明,随着酶用量增加,氨基酸态氮含量呈现缓慢上升的趋势,在加酶量为5 000 U/g时达到最高值,此后,氨基酸态氮含量趋于稳定。因此,后续实验酶用量均为5 000 U/g。图1-b结果表明,随着pH值升高,氨基酸态氮的释放量先缓慢增加,pH值为9.5时,氨基酸态氮含量最高;当pH值高于9.5时,碱性环境不利于酶活力释放,导致氨基酸态氮释放量迅速降低。因此反应pH值宜控制在9.5左右。由图1-c可知,蛋白质酶水解反应对温度较为敏感,当温度控制在40~50 ℃时,酶促反应速率较快,而当温度超过这个范围,氨基酸态氮释放量明显减少。因此,后续酶水解反应温度控制在40 ℃。如图1-d所示,酶水解时间在0~4 h,氨基酸态氮不断积累,当时间超过4 h后,产物含量趋于稳定。因此,蛋白质水解反应时间控制在4 h即可。综合上述因素对游离氨基酸态氮释放的影响,选择虾壳蛋白质酶水解较优条件为:加酶量5 000 U/g,pH值9.5,40 ℃下酶解4 h。
2.2 虾壳蛋白质水解物的美拉德反应改性
利用核糖对虾壳蛋白水解产物进行美拉德反应改性,提高产物抗氧化活性。由图2可知,虾壳蛋白水解物加热前后的DPPH自由基清除率均低于20%。而据文献[5]报道,南美白对虾壳的蛋白酶水解产物由于抗氧化肽的生成而具有一定的抗氧化活性,与本研究结果不一致。造成这种现象的原因可能是酶的来源以及蛋白质水解程度不同导致水解产物结构以及抗氧化活性有所差异。
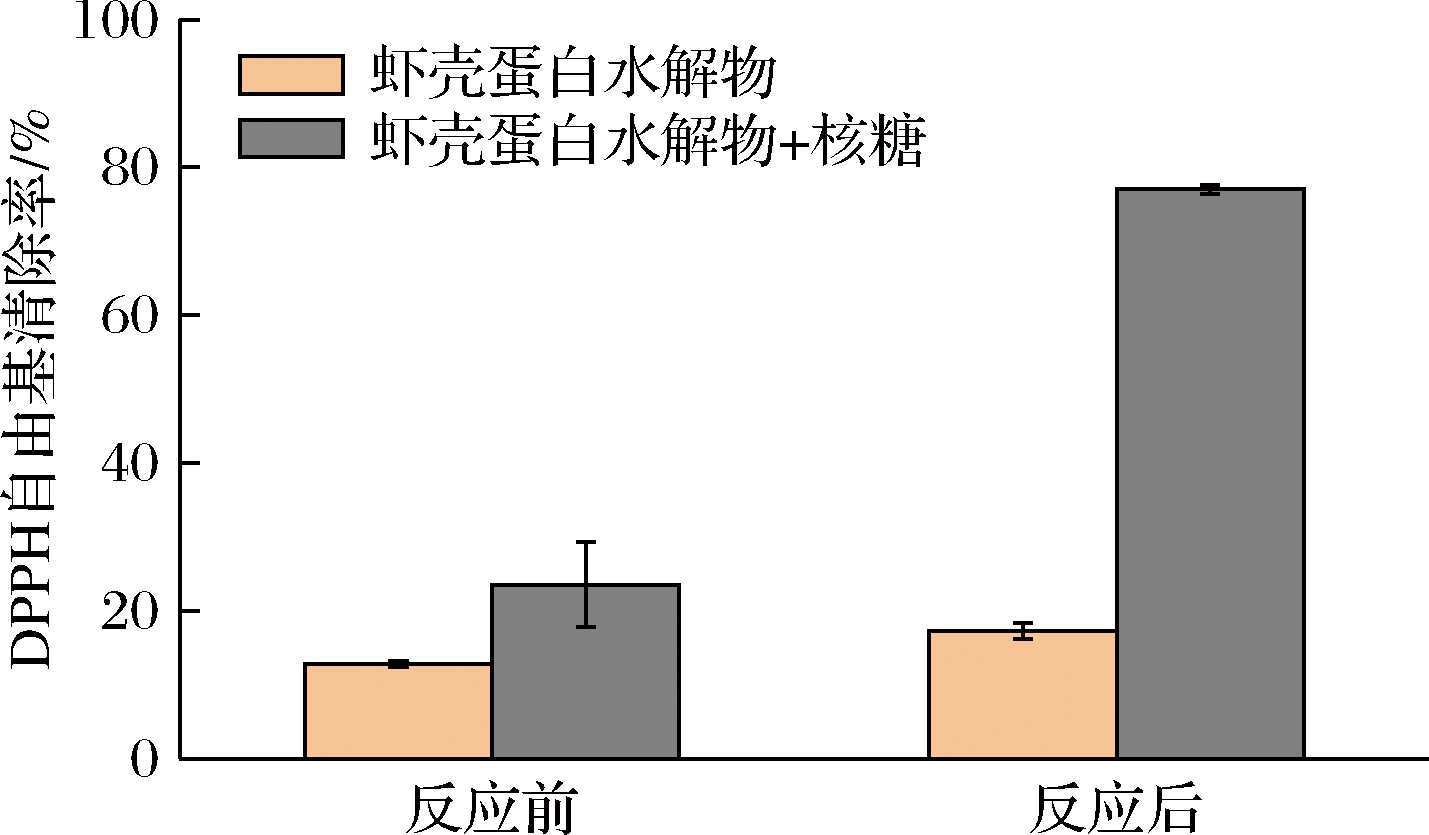
图2 美拉德反应改性前后虾壳蛋白水解物 DPPH自由基清除率
Fig.2 DPPH radical scavenging rate of shrimp shell protein hydrolysates before and after Maillard reaction modification
上述结果进一步表明,抗氧化肽具有特殊的氨基酸组成,其形成对原料、酶来源以及工艺参数的控制要求较高[15]。经过核糖改性后,反应体系的DPPH自由基清除率从反应前的23.5%显著提高到77.0%,这表明核糖改性对提高虾壳蛋白质水解物抗氧化活性具有较好效果。
进一步,以DPPH自由基清除率作为评价指标,考察pH值、核糖浓度和反应时间等因素对MRPs抗氧化活性的影响。反应初始pH值对MRPs抗氧化活性影响结果如图3-a所示,随着pH值升高,产物颜色逐渐加深,而DPPH自由基清除率先急剧升高,后又缓慢下降。pH 5~7有利于抗氧化活性产物的积累,其中pH值为5时达到最大值。核糖浓度对产物抗氧化活性的影响如图3-b所示,随着核糖浓度升高,DPPH自由基清除率逐渐增加,质量浓度达到0.025 g/mL左右变化趋势减小。因此,较高浓度的核糖底物有利于形成抗氧化活性成分,0.025 g/mL核糖质量浓度较为适宜。此外,抗氧化活性与反应温度的关系如图3-c所示。随着反应时间延长,不同反应温度下的DPPH自由基清除率均呈现先升高后趋于稳定的变化规律。在较低温度下(60和90 ℃时),反应至少需要8 h才能达到平衡状态,而较高温度所需反应时间明显降低,120 ℃仅需4 h产物即达到最大清除率。其中,90 与120 ℃下反应产物的最大DPPH自由基清除率达到90%左右,明显高于60 ℃。考虑到120 ℃时,可能有焦糖化等副反应发生,因此,选择美拉德反应温度为90 ℃,反应时间控制在8 h。

a-pH值;b-核糖质量浓度;c-温度和时间
图3 美拉德反应条件对产物DPPH自由基清除率的影响
Fig.3 Effect of Maillard reaction conditions on DPPH radical scavenging rate of products
2.3 美拉德反应产物的红外光谱分析
为了进一步确认经过核糖改性后产物化学结构变化,利用傅里叶红外光谱仪对上述优化条件下的产物进行表征,结果如图4所示。核糖在3 600~3 000 cm-1区域内的特征吸收峰归属为羟基的O—H伸缩振动,而MRPs在此区域内的峰数量和展宽与核糖明显不同,并且不同于SSP在此区域内较弱的特征吸收峰,表明SSP的引入破坏了核糖分子间的氢键相互作用;MRPs与核糖在1 500~1 200 cm-1区域内的特征吸收峰存在明显差异,表明反应后核糖分子构象发生变化[16]。SSP在1 400 cm-1处存在明显的特征吸收峰,而核糖在此处呈现出较弱的肩峰,改性后MRPs在此处的特征吸收峰蓝移至1 410 cm-1,对应美拉德反应产物的特征吸收峰[17]。SSP酰胺Ⅰ带和酰胺Ⅱ带对应的特征峰分别在1 644和1 567 cm-1,MRPs酰胺I带和酰胺II带的特征峰(分别在1 651和1 586 cm-1)发生蓝移,这可能是生成了Amadori化合物、席夫碱等新物质[18]。以上结果表明,SSP与核糖之间发生了美拉德反应,形成的美拉德反应产物可能对其生物活性产生影响。
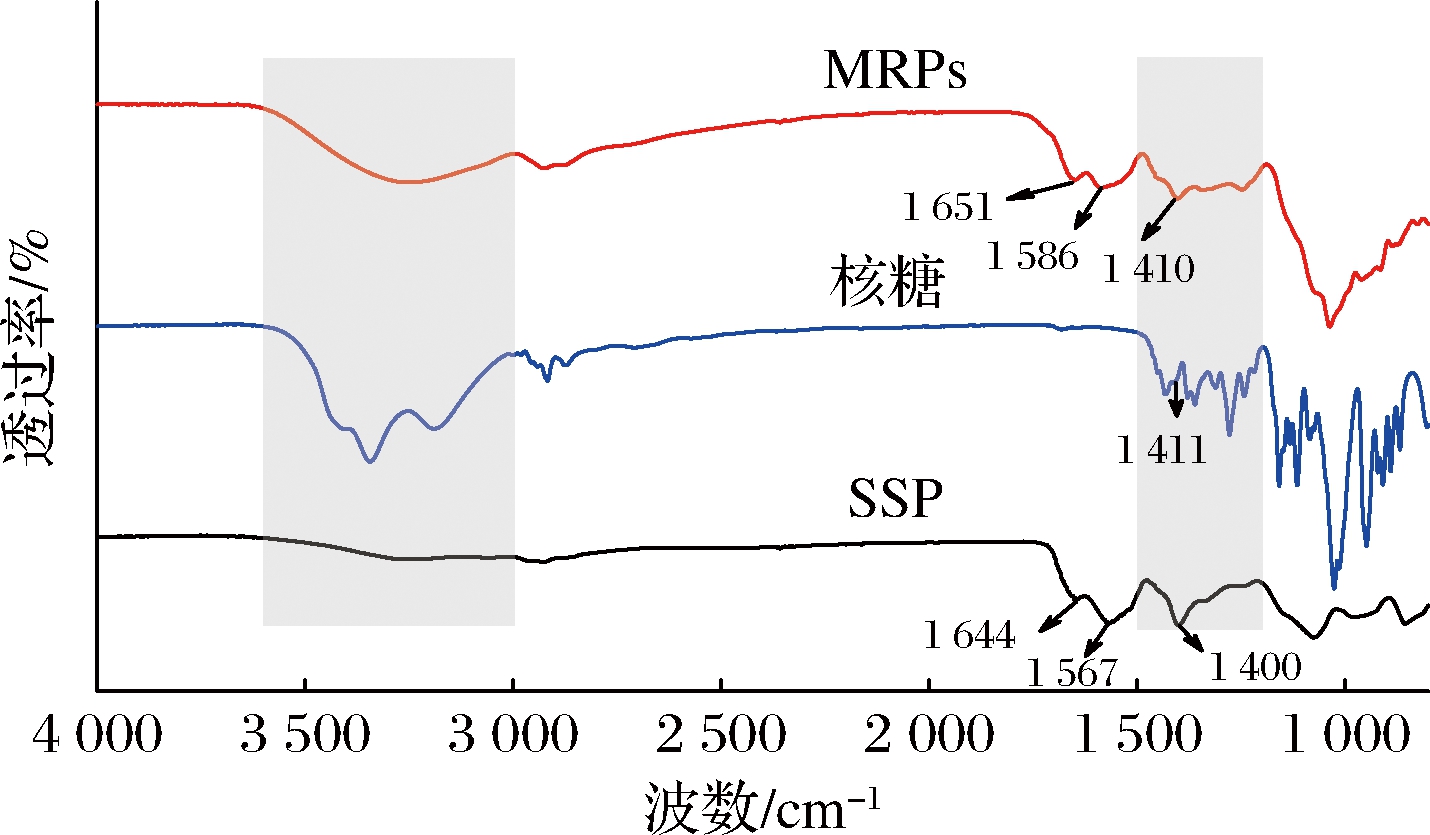
图4 美拉德反应产物的红外光谱
Fig.4 Infrared spectra of Maillard reaction products
2.4 美拉德反应产物的抗氧化活性分析
上述结果表明虾壳蛋白水解物-核糖美拉德反应液具有一定的DPPH自由基清除活力。为进一步对真空冷冻干燥后MRPs的体外抗氧化活性进行评估,以DPPH自由基、ABTS阳离子自由基、·OH清除率以及总还原能力为评价指标,结果如图5所示。MRPs对3种自由基均表现出一定的清除活性,并且具有一定的还原能力;MRPs的抗氧化活性与浓度有关,浓度越高,活性越强。其中,MRPs对3种自由基清除效果为ABTS>DPPH>·OH,0.09 mg/mL MRPs对ABTS阳离子自由基清除率高达100%;3种自由基对应的IC50值依次增大,分别为(0.024±0.001)、(0.612±0.132)和(2.056 0±0.094)mg/mL;总还原能力实验表明,MRPs还原能力约为58 μmol Trolox当量/g。

a-自由基清除能力和还原能力; b-不同分子质量产物对抗氧化活性的贡献率
图5 美拉德反应产物自由基清除能力和还原能力
Fig.5 Free radical scavenging and reducing ability of Maillard reaction products
为了确定抗氧化活性成分的分子质量分布,通过超滤离心将MRPs分为小分子产物(<3 kDa)和大分子产物(>3 kDa),不同分子质量产物对抗氧化活性的贡献度如图5-b所示。针对不同的抗氧化测试方法,分子量对抗氧化的贡献率不同,对DPPH、ABTS和FRAP而言,大分子产物抗氧化贡献率较高;而对·OH而言,小分子产物抗氧化贡献率更高。上述结果表明不同分子量产物均能起到一定的抗氧化作用,但是在不同抗氧化体系中可能存在不同的抗氧化机理[13]。美拉德反应产物中抗氧化活性成分还不明确,抗氧化作用可能主要通过还原酮、醛类以及N、S杂环化合物等中间反应产物对自由基的清除作用以及螯合金属离子、还原过氧化物等途径来实现[19]。
氧化应激是在紫外线辐照、过度疲劳、吸烟、酗酒等因素刺激下,机体内氧化系统和抗氧化系统之间的平衡遭到破坏,产生过多活性氧簇(reactive oxygen species, ROS)的一种状态,继而对细胞、组织造成损伤。研究表明,氧化应激与多种退行性和慢性疾病的致病机理密切相关[20]。H2O2是一种重要的内源性活性氧物质,易透过细胞膜,在细胞内Fe2+和Cu2+催化下产生反应活性极强的·OH,是一种常用的细胞氧化损伤造模诱导剂。根据前期研究,H2O2的加入导致人肾小管上皮细胞(HK-2)内产生过量ROS,降低超氧化物歧化酶活性,加剧线粒体的氧化损伤,调节线粒体凋亡途径相关蛋白和基因的表达,从而影响细胞活力[21]。
以HK-2细胞为评价模型,采用不同质量浓度MRPs(0~800 μg/mL)处理细胞,通过CCK-8法对MRPs的细胞毒性进行研究,结果如图6所示。
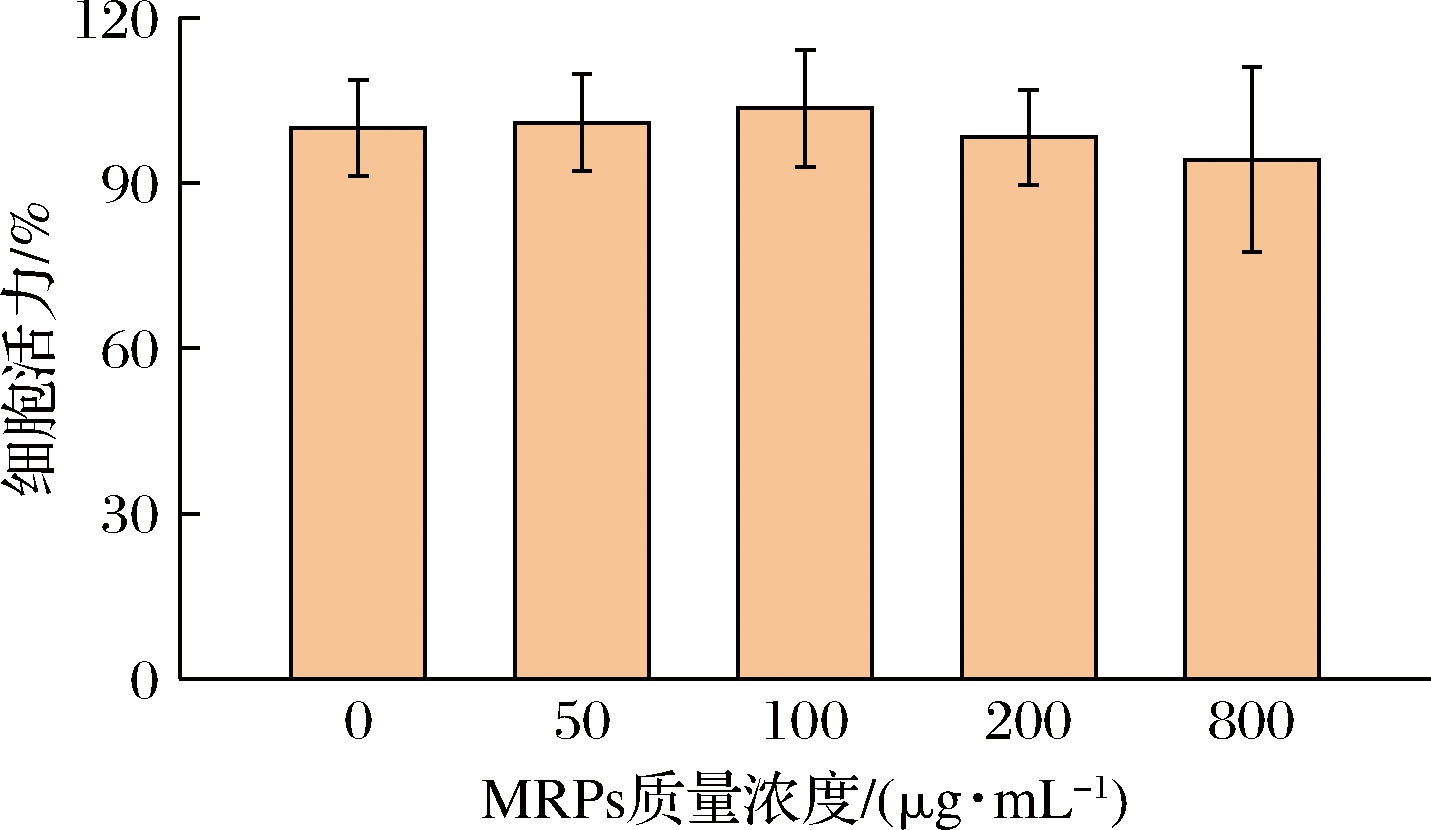
图6 美拉德反应产物浓度对HK-2细胞活力的影响
Fig.6 Effect of Maillard reaction product concentration on HK-2 cell viability
当MRPs质量浓度在0~800 μg/mL时,随着浓度的升高,细胞活力没有明显变化(P>0.05),这表明在此浓度范围内MRPs对HK-2细胞无明显的细胞毒性。在此基础上,使用50 μmol/L H2O2处理HK-2细胞,细胞活力为45.8%。加入MRPs处理后,细胞活力的变化如图7所示。

图7 美拉德反应产物浓度对氧化损伤HK-2 细胞活力的影响
Fig.7 Effect of Maillard reaction product concentration on the viability of HK-2 cells after oxidative damage 注:**P<0.01,****P<0.0001
随着MRPs浓度的增加,细胞活力逐渐提高,当MRPs质量浓度为800 μg/mL时,HK-2细胞活力明显增加到81%,与对照组比较,具有显著性差异(P<0.000 1)。以上研究结果表明,MRPs对H2O2诱导的HK-2细胞氧化应激损伤具有较好的修复作用。结合体外实验结果以及文献报道,推测美拉德反应产物在细胞内抗氧化作用可能表现在以下几个方面:(1)与H2O2发生氧化还原反应,阻碍其进一步转化为活性较强的自由基;(2)螯合促进氧化的金属离子,减少自由基的生成[22];(3)清除H2O2产生的相关活性自由基,如最具活性和破坏性的·OH;(4)诱导产生抗氧化酶;(5)抑制氧化应激损伤相关的细胞信号通路[23]。
肾脏是最重要的人体器官之一,ROS对肾脏有直接损伤作用,在肾脏相关疾病的发生和发展过程中扮演重要角色[24-25]。由此可见,虾壳蛋白质水解物-核糖美拉德反应产物对人体肾脏细胞氧化应激损伤具有一定的保护作用,作为一种潜在的新型抗氧化剂,具有一定的应用价值。
3 结论与讨论
本研究利用碱性蛋白酶对南美白对虾壳中蛋白质进行提取,通过核糖对虾壳蛋白质水解物进行美拉德反应改性,在pH 5、核糖质量浓度0.025 g/mL、反应温度90 ℃、反应时间8 h条件下,美拉德反应产物抗氧化活性最高。体外抗氧化结果表明MRPs的还原能力和ABTS阳离子自由基、DPPH自由基以及·OH清除率随浓度升高而增加,且MRPs中小分子量和大分子量产物对抗氧化性均有一定贡献。此外,MRPs对人肾小管上皮细胞(HK-2)表现出较低的细胞毒性,并且能够显著提高H2O2诱导损伤的HK-2细胞活力,表明基于核糖的美拉德反应改性可以作为一种提高虾壳蛋白质水解物抗氧化活性的有效途径。综上,本研究为新型抗氧化剂的开发提供了研究基础,为我国丰富的虾壳废弃物资源高值化利用提供了新思路,进一步优化改进工艺后可广泛应用于食品、生物医药等行业。
[1] HAQUER, SAWANT P B, SARDAR P, et al.Synergistic utilization of shrimp shell waste-derived natural astaxanthin with its commercial variant boosts physio metabolic responses and enhances colouration in discus (Symphysodon aequifasciatus)[J].Environmental Nanotechnology, Monitoring &Management, 2021, 15:100405.
[2] PAKIZEHM, MORADI A, GHASSEMI T.Chemical extraction and modification of chitin and chitosan from shrimp shells[J].European Polymer Journal, 2021, 159:110709.
[3] AMBIGAIPALANP, SHAHIDI F.Bioactive peptides from shrimp shell processing discards:Antioxidant and biological activities[J].Journal of Functional Foods, 2017, 34:7-17.
[4] 张红玉,李会珍, 张天伟, 等.抗氧化肽作用机制研究进展[J].食品安全质量检测学报, 2022, 13(12):3 981-3 988.
ZHANG H Y, LI H Z, ZHANG T W, et al.Research progress on the mechanism of antioxidant peptides[J].Journal of Food Safety &Quality, 2022, 13(12):3 981-3 988.
[5] 张风,夏旭, 周爱梅, 等.虾头虾壳蛋白质酶解制备抗氧化肽的研究[J].南方水产科学, 2015, 11(6):79-87.
ZHANG F, XIA X, ZHOU A M, et al.Research of antioxidant peptides produced from protein extracted from white shrimp head and shell[J].South China Fisheries Science, 2015, 11(6):79-87.
[6] SARABANDIK, GHAREHBEGLOU P, JAFARI S M.Spray-drying encapsulation of protein hydrolysates and bioactive peptides:Opportunities and challenges[J].Drying Technology, 2020, 38(5-6):577-595.
[7] NAIKR R, WANG Y, SELOMULYA C.Improvements of plant protein functionalities by Maillard conjugation and Maillard reaction products[J].Critical Reviews in Food Science and Nutrition, 2022, 62(25):7 036-7 061.
[8] HES, CHEN Y N, BRENNAN C, et al.Antioxidative activity of oyster protein hydrolysates Maillard reaction products[J].Food Science &Nutrition, 2020, 8(7):3 274-3 286.
[9] 董烨,张益奇, 张晓頔, 等.鳙鱼皮水解物美拉德反应产物抗氧化活性研究[J].核农学报, 2022, 36(11):2 199-2 209.
DONG Y, ZHANG Y Q, ZHANG X D, et al.Antioxidant activity of Maillard reaction products derived from bighead carp skin hydrolysates[J].Journal of Nuclear Agricultural Sciences, 2022, 36(11):2 199-2 209.
[10] SHAHIDIF, SYNOWIECKI J.Isolation and characterization of nutrients and value-added products from snow crab (Chionoecetes opilio) and shrimp (Pandalus borealis) processing discards[J].Journal of Agricultural and Food Chemistry, 1991, 39(8):1 527-1 532.
[11] ZHUW H, LUAN H W, BU Y, et al.Flavor characteristics of shrimp sauces with different fermentation and storage time[J].LWT, 2019, 110:142-151.
[12] 王亮,田玉潭, 刘军, 等.超声预处理对鸡骨香精基料美拉德反应及生物活性的影响[J/OL].食品与发酵工业.https://doi.org/10.13995/j.cnki.11-1802/ts.032596.
WANG L, TIAN Y T, LIU J, et al.Effect of ultrasound pretreatment on the Maillard reaction and bioactive properties of chicken bone essence basic material[J/OL].Food and Fermentation Industries.https://doi.org/10.13995/j.cnki.11-1802/ts.032596.
[13] LIM, XIE R S, LIU J, et al.Preparation of chitooligosaccharide acetate salts with narrow molecular size distribution and the antioxidative activity[J].Polymer Degradation and Stability, 2020, 182:109393.
[14] SHARMAM, GAT Y, ARYA S, et al.A review on microbial alkaline protease:An essential tool for various industrial approaches[J].Industrial Biotechnology, 2019, 15(2):69-78.
[15] 顾龙建,程学勋, 吴巨贤, 等.抗氧化肽来源及其抗氧化活性测定研究进展[J].广州化工, 2021, 49(14):25-27.
GU L J, CHENG X X, WU J X, et al.Research progress on sources of antioxidant peptides and determination methods of antioxidant activity[J].Guangzhou Chemical Industry, 2021, 49(14):25-27.
[16] 鲁彦,郭建宇.Gd(Ⅲ)、Tb(Ⅲ)与D-核糖配合物的合成及其FT-IR光谱研究[J].上海应用技术学院学报(自然科学版), 2005, 5(4):299-302.
LU Y, GUO J Y.Synthesis and FT-IR spectroscopy study of Gd(Ⅲ) and Tb(Ⅲ)-D-ribose complexes[J].Journal of Shanghai Institute of Technology, 2005, 5(4):299-302.
[17] ZHANGH C, YANG J, ZHAO Y Y.High intensity ultrasound assisted heating to improve solubility, antioxidant and antibacterial properties of chitosan-fructose Maillard reaction products[J].LWT-Food Science and Technology, 2015, 60(1):253-262.
[18] ZHAOT T, ZHANG Q, WANG S G, et al.Effects of Maillard reaction on bioactivities promotion of anchovy protein hydrolysate:The key role of MRPs and newly formed peptides with basic and aromatic amino acids[J].LWT, 2018, 97:245-253.
[19] 严昊,付惠, 谢冰.美拉德反应及其产物抗氧化活性研究进展[J].宜宾学院学报, 2007, 7(12):82-84.
YAN H, FU H, XIE B.Research progress in Maillard reaction and antioxidative activity of its products[J].Journal of Yibin University, 2007, 7(12):82-84.
[20] IZZOC, VITILLO P, DI PIETRO P, et al.The role of oxidative stress in cardiovascular aging and cardiovascular diseases[J].Life (Basel, Switzerland), 2021, 11(1):60.
[21] 伞勤.益肾降浊冲剂含药血清对H2O2损伤HK-2细胞的保护机制的研究[D].福州:福建中医药大学, 2020.
SAN Q.Study on protective mechanism of serum containing yishen Jiangzhuo Granule on H2O2damage to HK-2 cells[D].Fuzhou:Fujian University of Traditional Chinese Medicine, 2020.
[22] NOOSHKAMM, VARIDI M, BASHASH M.The Maillard reaction products as food-born antioxidant and antibrowning agents in model and real food systems[J].Food Chemistry, 2019, 275:644-660.
[23] GUOC, ZHU J Y, WU S, et al.Study on the protective effect of sevoflurane on H2O2-induced HK-2 cells[J].Journal of Biomaterials and Tissue Engineering, 2019, 9(5):687-693.
[24] 金珍杰,何平.氧化应激在肾脏疾病发生发展中作用的研究进展[J].山东医药, 2020, 60(14):103-105.
JIN Z J, HE P.Research progress on the role of oxidative stress in the occurrence and development of kidney diseases[J].Shandong Medical Journal, 2020, 60(14):103-105.
[25] SURESHBABUA, RYTER S W, CHOI M E.Oxidative stress and autophagy:Crucial modulators of kidney injury[J].Redox Biology, 2015, 4:208-214.