胶原蛋白是一种白色海绵状、不透明、无支链的生物大分子纤维蛋白,主要存在于动物牙齿、表皮、肌腱等组织中,与结缔组织统称为结构蛋白[1],在维持生物结构的完整性方面起着至关重要的作用。胶原蛋白具有强拉伸性、低抗原性及生物相容性等功能特性,被广泛应用于皮革工业、化妆品、药品和食品行业等[2]。哺乳动物胶原蛋白是工业应用胶原蛋白的主要来源,但目前提取其胶原蛋白受牛海绵状脑病、口蹄疫及宗教等的限制,故研究人员开始将目光从哺乳动物转向水生生物。研究表明,水产品加工副产物中同样含有丰富的胶原蛋白,可作为提取胶原蛋白的良好原料[3]。
2016年11月,我国农业部、国家食品药品监督管理局解除了养殖暗纹东方鲀(Takifugu obscurus)和红鳍东方鲀(Takifugu rubripes)的禁售令,不仅消费者的餐桌多了一道绝味美食,也推动了河豚养殖业的发展。现如今,随着人工养殖无毒河豚业的发展及消费者需求的增加,我国已成为海外河豚鱼供给的主要来源。其中,暗纹东方鲀为海淡水洄游鱼类,多集中于长江流域,江苏为主要养殖基地;红鳍东方鲀属底栖肉食性洄游鱼类,主要为海水养殖,养殖基地多在辽宁大连一带。河豚鱼加工生产过程中会产生大量的鱼皮等副产物,易造成资源浪费及环境污染,而鱼皮中含有丰富的胶原蛋白,为胶原蛋白生产的优质原料。
现有研究中对鱼皮胶原蛋白的提取主要集中在罗非鱼[4]、鲫鱼[5]、大鲵皮[6]等,河豚鱼皮胶原蛋白含量丰富,但对其研究较少。本文采用胃蛋白酶提取暗纹东方鲀和红鳍东方鲀鱼皮中的胶原蛋白,比较2种河豚鱼皮胶原蛋白结构、组成的异同等以及对抗氧化活性的影响,为河豚鱼皮的进一步利用及胶原蛋白在化妆品及医美行业的高值化利用提供理论基础。
1 材料与仪器
1.1 实验原料
暗纹东方鲀鱼皮,江苏中洋生态鱼类股份有限公司;红鳍东方鲀鱼皮,大连天正实业有限公司。
1.2 主要试剂
NaCl、NaOH、冰乙酸、氯胺T、浓硫酸、考马斯亮蓝、硼酸、苯酚、柠檬酸钠等,均为分析纯,上海麦克林生物科技有限公司。
1.3 实验仪器与设备
UV—2200紫外-可见分光光度计,美国Unico公司;Spotlight 400傅里叶变换红外光谱仪,英国PerkinElmer 公司;Hitachi S-3400 N扫描电镜,日立高新技术公司;HWS-24电热恒温水浴锅,上海一恒科学仪器有限公司;TG16-WS台式高速离心机,湖南湘仪实验室仪器开发有限公司;DHG-9140A电热鼓风干燥箱,上海慧泰仪器制造有限公司等。
2 实验方法
2.1 胶原蛋白的提取
参考ARUMUGAM等[7]方法并略作修改。称取50.0 g切碎后的河豚鱼皮,冷去离子水洗净,加入25倍体积0.1 mol/L NaOH溶液浸泡72 h(每隔6 h搅拌),去除非胶原物质及色素,12 000 r/min离心30 min,弃上清液,用去离子水将沉淀洗至中性。鱼皮中加入4倍体积0.5 mol/L冰乙酸及胃蛋白酶,胃蛋白酶的添加量为底物质量的2.0%,酶解48 h(间隔6 h搅拌1次)。收集滤液,进行盐析、离心、透析、真空冷冻干燥后得胶原蛋白成品。
2.2 氨基酸组成
参照国标GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》并略作修改,称取适量冻干后的河豚鱼皮胶原蛋白,用6 mol/L HCl溶液在110 ℃下真空水解22 h,滤液定容后取1 mL减压干燥,加入1 mL柠檬酸钠缓冲液溶解混匀,过0.22 μm滤膜后用氨基酸自动分析仪测定氨基酸组成。
2.3 紫外光谱扫描
参考CAPUTO等[8]方法稍有改动。取适量冻干后的河豚鱼皮胶原蛋白溶于0.5 mol/L冰乙酸中,配制成1 mg/mL的胶原蛋白溶液,10 000 r/min离心5 min,取上清液测定波长200~400 nm处的吸光度,速度2 nm/s,以0.5 mol/L冰乙酸为空白对照,绘制吸光度随波长变化的曲线图。
2.4 傅里叶红外光谱(Fourier transform infrared, FT-IR)扫描
称取适量冻干后的河豚鱼皮胶原蛋白样品,对其进行单点ATR模式样品采集,室内干燥(空气湿度小于40%)。样品的红外谱图以空气为背景,去除干扰。谱图扫描波数范围4 000~500 cm-1,速度0.2 cm/s。
使用Spectrum V10.4.3软件分析了产生的光谱,并使用PeakFit v4.12选择了1 600~1 700 cm-1区域来分析胶原蛋白的二级结构。
2.5 X射线衍射(X-ray diffraction, XRD)测定
参考仇雷雷等[9]方法分析胶原蛋白样品的晶体结构,光源为Cu靶Ka(λ=0.154 nm),电流为40 mA,电压为40 kV。扫描角度2θ为5°~60°,扫描速率为3.6°/min,并根据公式λ=2 dsinθ,计算d值。
2.6 SDS-PAGE测定
参考LAEMMLI等[10]和蔡路昀等[11]的方法。取适量胶原蛋白样品溶解于0.02 mol/L pH 7.2 PBS缓冲液中,配制质量浓度为1.50 mg/mL的胶原蛋白溶液,和上样缓冲液以体积比1∶1混匀,沸水浴5 min使蛋白质变质,Marker作为参照组,不添加上样缓冲液。将电泳胶置于电泳装置中,加入电泳缓冲液,随后取出梳状体并添加样品及Marker,施加80 V的电压,至样品形成一条直线后,将电压升高至120 V。停止后,将电泳胶置于考马斯亮蓝染色剂中染色1 h,随后脱色过夜至电泳胶成透明状,进行拍照。
2.7 扫描电镜(scanning electron microscope, SEM)
取适量冻干后鱼皮胶原蛋白置于样品盘上,离子溅射镀金,用扫描电镜观察胶原蛋白表面形态。
2.8 原子力显微镜(atomic Force Microscope, AFM)
分别用0.1 mol/L冰乙酸及超纯水溶解河豚鱼皮胶原蛋白,将其配制成0.1 g/mL的胶原蛋白溶液,各取1滴于新鲜剥离的云母片表面,室温阴干24 h,置于原子力显微镜下观察。
2.9 差示扫描量热法(differential scanning calorimetry, DSC)测定
称取约4 mg胶原蛋白置于差式扫描量热仪坩埚中,加盖密封,以空坩埚作对照,温度从20 ℃加热至70 ℃,升温速度为5 ℃/min,样品室的氮气流量为20 mL/min。
2.10 抗氧化活性的测定
将暗纹东方鲀胶原蛋白(Takifugu obscurusskin collagen,TOSK)、红鳍东方鲀胶原蛋白(Takifugu rubripes skin collagen,TRSK)及市售鱼皮胶原蛋白(commercial fish skin collagen,CFSK)分别配制成质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的胶原蛋白溶液。
DPPH自由基清除能力:取0.5 mL上述不同浓度胶原蛋白样品溶液与3 mL DPPH甲醇溶液混匀避光静置30 min,于517 nm处测定吸光度。DPPH自由基清除能力计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A0,超纯水代替样品吸光值;A1,样品与溶液混合吸光值;A2,样品溶液本身吸光值。
·OH清除能力:于试管中按顺序加入 9 mmol/L FeSO4溶液1 mL,9 mmol/L水杨酸-乙醇溶液2 mL及上述不同浓度胶原蛋白样品溶液1 mL,8.8 mmol/LH2O2溶液2 mL,37 ℃水浴30 min,于510 nm处测定吸光度。·OH清除率按公式(2)计算:
·OH清除率![]()
式中:A0,超纯水代替样品吸光值;A1,样品与溶液混合吸光值;A2,样品溶液本身吸光值。
2.11 数据统计分析
采用SPSS 25.0统计软件分析差异的显著性,P<0.05,差异显著。使用Origin 2018软件绘制图像,进行3次平行实验,结果取平均值。
3 结果与分析
3.1 胶原蛋白的氨基酸组成
河豚鱼皮胶原蛋白的氨基酸组成见表1。2种胶原蛋白样品均具有胶原蛋白的特征氨基酸,即Gly、Pro且不含Trp。其中Glu、Gly、Ala、Arg等氨基酸含量较高,而Cys、Ile、Tyr、His等氨基酸占比较低,符合胶原蛋白的一般特征[12],其中包括必需氨基酸Lys、Phe、Thr、Ile、Leu、Cys。
表1 河豚鱼皮胶原蛋白的氨基酸组成 单位:mg/g
Table 1 Amino acid composition of collagen in puffer fish skin

氨基酸种类TOSKTRSK天冬氨酸(Asp)94.21±0.59a92.54±0.84a色氨酸(Trp)∗N.D.N.D.苏氨酸(Thr)∗41.58±0.08a41.35±0.09a丝氨酸(Ser)64.56±0.78b66.77±0.73a谷氨酸(Glu)132.64±1.30a128.51±1.6b甘氨酸(Gly)374.24±3.56a364.18±4.01a丙氨酸(Ala)161.60±2.70a153.98±5.31a胱氨酸(Cys)∗N.D.1.19±1.69缬氨酸(Val)39.04±0.30a38.19±0.22a蛋氨酸(Met)∗18.75±2.34a25.38±2.12a异亮氨酸(Ile)∗13.03±0.58a14.66±1.00a亮氨酸(Leu)∗37.62±0.6a39.33±0.76a酪氨酸(Tyr)6.72±0.12b6.98±0.14a苯丙氨酸(Phe)∗33.90±0.02a33.95±0.63a赖氨酸(Lys)∗54.34±0.46a55.65±1.01a组氨酸(His)12.13±0.42a12.74±0.60a精氨酸(Arg)138.43±1.02a135.55±1.12aL-脯氨酸(Pro)207.52±0.33a206.57±4.97a
注:表中不同字母表示两组间差异显著(P<0.05);*表示必需氨基酸;N.D.表示未检出。
胶原蛋白区间序列的特征为Gly-X-Y氨基酸序列的重复,可见Gly占比最高,TOSK的Gly含量占氨基酸总质量的26.13%,TRSK的Gly含量占比为25.71%。且2种河豚鱼皮胶原蛋白各种氨基酸含量相似,说明鱼皮原料虽来源于2种河豚鱼,但都为鲀科东方属,所以各种氨基酸含量差异不明显(P>0.05),都符合I型胶原蛋白的特征。
3.2 胶原蛋白的光谱分析
3.2.1 紫外光谱
胶原多肽链中含有羰基(—C![]() O)、羧基(—COOH)和酰胺基团(—CO—NH2),可在230 nm处产生明显的吸收峰,这是胶原蛋白三股螺旋结构的特征吸收峰[13]。由图1可知,2种鱼皮胶原蛋白的紫外特征光谱基本一致,均在235 nm处产生最大吸收峰,最大吸收波长发生了红移,这可能是胶原蛋白在提取过程中暴露出了更多的发色基团[14]。2种河豚鱼皮胶原蛋白在280 nm附近存在宽钝的微弱吸收峰,可能是胶原蛋白内部含有少量Tyr、Phe等敏感的发色基团[15],这与上述氨基酸组成分析结果一致。
O)、羧基(—COOH)和酰胺基团(—CO—NH2),可在230 nm处产生明显的吸收峰,这是胶原蛋白三股螺旋结构的特征吸收峰[13]。由图1可知,2种鱼皮胶原蛋白的紫外特征光谱基本一致,均在235 nm处产生最大吸收峰,最大吸收波长发生了红移,这可能是胶原蛋白在提取过程中暴露出了更多的发色基团[14]。2种河豚鱼皮胶原蛋白在280 nm附近存在宽钝的微弱吸收峰,可能是胶原蛋白内部含有少量Tyr、Phe等敏感的发色基团[15],这与上述氨基酸组成分析结果一致。

图1 河豚鱼皮胶原蛋白紫外光谱图
Fig.1 UV spectroscopy of collagen in puffer fish skin
3.2.2 傅里叶红外吸收光谱
图2为河豚鱼皮胶原蛋白的红外光谱及蛋白质二级结构图,与尼罗河鲈鱼胶原蛋白的红外光谱相似[16]。胶原蛋白的特征主要是由酰胺A、B及Ⅰ、Ⅱ、Ⅲ带的吸收峰决定。酰胺A带的吸收峰出现在3 400~3 000 cm-1处,与N—H的伸缩频率有关,当N—H参与氢键的生成时,吸收峰会向低频处移动,往往出现在3 300 cm-1附近;酰胺B带与—CH2—的不对称拉伸有关,吸收峰通常出现在2 930 cm-1处[15]。酰胺Ⅰ、Ⅱ、Ⅲ带会影响蛋白质的形状,酰胺Ⅰ带是研究蛋白质二级结构的重要区带,与羰基(—C![]() O)的拉伸振动相关;酰胺Ⅱ带与C—N拉伸耦合及N—H伸缩振动有关;酰胺Ⅲ带参与生成胶原蛋白的三螺旋结构[17]。TOSK在3 295.34、2 948.79、1 644.13、1 554.73、1 237.03 cm-1处产生了酰胺A、B及Ⅰ、Ⅱ、Ⅲ带的吸收峰,TRSK在3 299.11、2 931.03、1 630.84、1 542.07、1 239.51 cm-1处也能产生酰胺A、B及Ⅰ、Ⅱ、Ⅲ 带的吸收峰,说明从鱼皮中提取的是三螺旋结构完整的胶原蛋白。
O)的拉伸振动相关;酰胺Ⅱ带与C—N拉伸耦合及N—H伸缩振动有关;酰胺Ⅲ带参与生成胶原蛋白的三螺旋结构[17]。TOSK在3 295.34、2 948.79、1 644.13、1 554.73、1 237.03 cm-1处产生了酰胺A、B及Ⅰ、Ⅱ、Ⅲ带的吸收峰,TRSK在3 299.11、2 931.03、1 630.84、1 542.07、1 239.51 cm-1处也能产生酰胺A、B及Ⅰ、Ⅱ、Ⅲ 带的吸收峰,说明从鱼皮中提取的是三螺旋结构完整的胶原蛋白。
TOSK中α-螺旋、β-折叠、β-转角及无规则卷曲含量占胶原蛋白二级结构的23.26%、37.59%、13.79%、25.36%,而TRSK中α-螺旋、β-折叠、β-转角及无规则卷曲含量分别为27.83%、33.88%、15.45%、22.84%。比较TOSK和TRSK,TOSK内部的α-螺旋含量较低,而无规则卷曲的含量较高, TRSK的二级结构较TOSK更加有序。

图2 河豚鱼皮胶原蛋白红外光谱(a)及二级结构图(b)
Fig.2 Fourier transform infrared spectroscopy (a) and secondary structure of collagen in puffer fish skin (b)
图3是河豚鱼皮胶原蛋白氨基酸和蛋白质二级结构的相关性热图。α-螺旋与Tyr、Val、Thr等11种氨基酸呈正相关(R>0.95);无规则卷曲则与Pro、Ala、Gly等11种氨基酸呈负相关(R<-0.95);而β-折叠及β-转角与氨基酸的相关性不显著。
3.2.3 X射线衍射
图4、表2为胶原蛋白X射线衍射分析结果。河豚鱼皮胶原蛋白有2个衍射峰,TOSK的衍射角(2θ)分别为8.22°、20.44°,TRSK的衍射角(2θ)分别为8.20°、20.69°。第一个峰值与胶原蛋白的三螺旋结构有关,峰1的d值可反映胶原蛋白分子链间距[18],两者均为1.07 nm。由于胶原蛋白纤维内部的众多结构层次引起漫散射,会使20°附近出现一个宽钝峰[19],由此可说明2种鱼皮胶原蛋白均保持完整的三股螺旋结构。

图3 河豚鱼皮胶原蛋白相关性热图
Fig.3 Correlation heatmap of collagen in puffer fish skin

图4 河豚鱼皮胶原蛋白X射线衍射图谱
Fig.4 X-ray diffraction pattern of collagen in puffer fish skin
表2 河豚鱼皮胶原蛋白X射线衍射峰对应的d值
Table 2 D values corresponding to X-ray diffraction peaks of collagen in puffer fish skin

组别衍射峰2θ/°d值/nmTOSK峰18.221.07峰220.440.43TRSK峰18.201.07峰220.670.43
3.3 SDS-PAGE分析
图5为2种河豚鱼皮胶原蛋白的电泳图,TOSK与TRSK的组成大致相同,主要包含2条α链,即α1链、α2链和1条β链。约110 kDa处出现α1、α2链,在200 kDa处有1条β链,为α链的二聚体,与罗非鱼胶原蛋白[4]、草鱼胶原蛋白[5]等研究结果一致,符合I型胶原蛋白的特征,且不含杂链蛋白,说明从2种鱼皮中提取的胶原蛋白纯度较高。
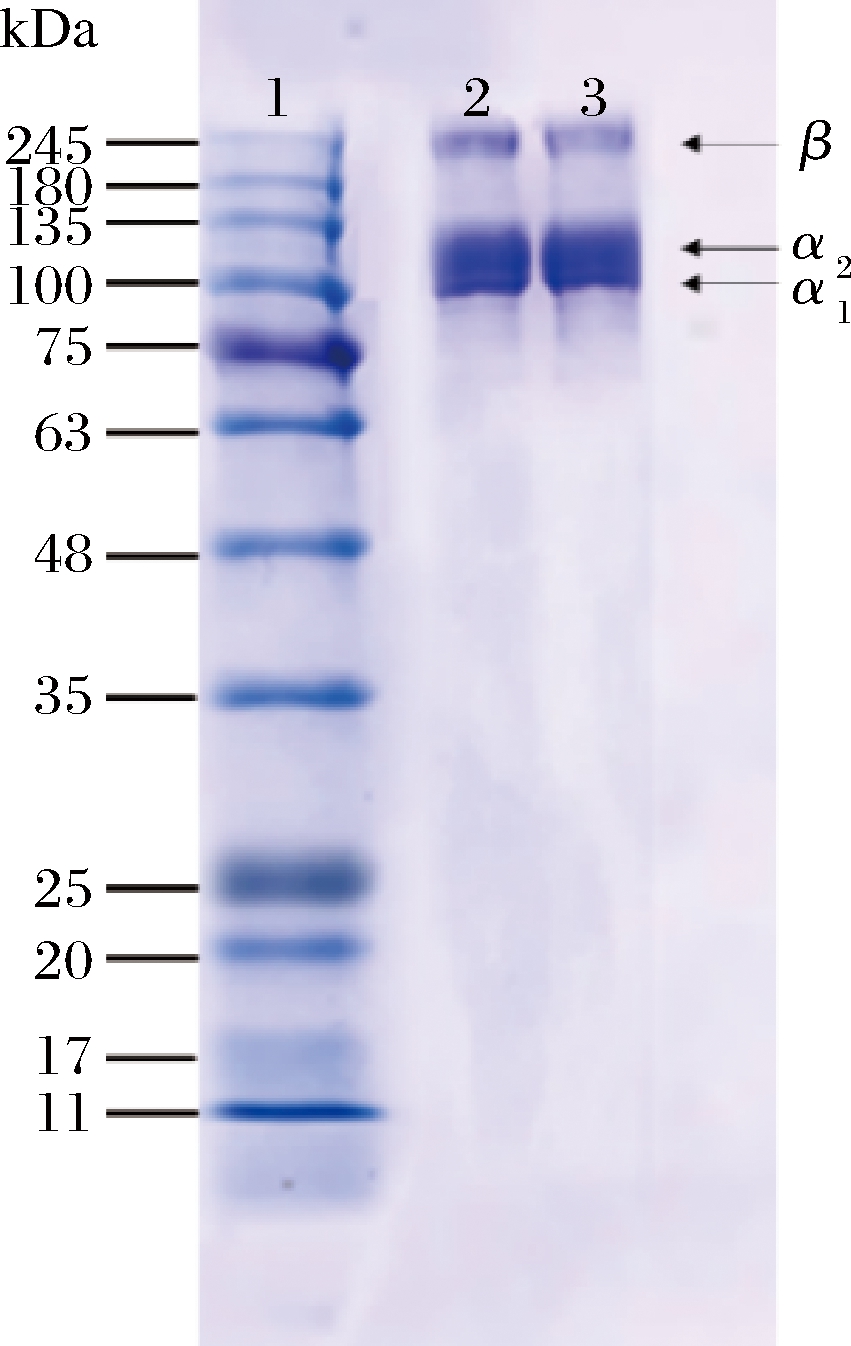
1-Marker;2-TOSK;3-TRSK
图5 河豚鱼皮胶原蛋白的聚丙烯酰胺凝胶电泳
Fig.5 SDS-PAGE patterns of collagen in puffer fish skin
3.4 胶原蛋白的微观结构分析
河豚鱼皮胶原蛋白的电镜扫描图如图6所示。对TOSK与TRSK进行微观结构观察,可以看出,2种鱼皮胶原蛋白呈光滑多孔的网状结构,分布相对均匀,说明其在提取的过程中本身的纤维结构被很好地保持,并未被破坏。

a-TOSK,×300;b-TOSK,×1 000;c-TRSK,×300; d-TRSK,×1 000
图6 河豚鱼皮胶原蛋白的扫描电镜图
Fig.6 Scanning electron micrograph of collagen in puffer fish skin
将2种河豚鱼皮胶原蛋白分别溶于冰乙酸和超纯水中后沉积在云母片上,采用原子力显微镜观察其微观结构。由图7-a、图7-c可以看出,胶原蛋白在酸溶液中能够完全溶解,均匀的分布在冰乙酸溶液中;从图7-b、图7-d可以看出,胶原纤维交联性强,结合紧密,虽能观察到胶原纤维的丝状结构,但胶原蛋白未能水解,有大量聚集,符合胶原蛋白不溶于水而溶于酸的特征。

a-TOSK鱼皮胶原蛋白酸溶液;b-TOSK鱼皮胶原蛋白水溶液; c-TRSK鱼皮胶原蛋白酸溶液;d-TRSK鱼皮胶原蛋白水溶液
图7 河豚鱼皮胶原蛋白的原子力图
Fig.7 Atomic force microscope of collagen in puffer fish skin
3.5 胶原蛋白的热稳定性分析
差式扫描量热法测定分析样品的热稳定性是一种用量少,分辨率高的热稳定性测量方法。从图8可以看出TOSK的热变性温度为37 ℃,TRSK的热变性温度为35 ℃,TRSK的热变性温度与TOSK相比略低。胶原蛋白的热稳定性与鱼种生长的水温有着密切的联系,水温越高,热稳定性越好[20],红鳍东方鲀常年生活在北太平洋西部的东海及黄渤海区域,气候相对暗纹东方鲀所处的长江中下游稍低。分析导致2种鱼皮胶原蛋白热变性温度存在差异的可能原因是亚氨基酸的含量不同。由氨基酸组成分析结果可知,TOSK中脯氨酸的含量高于TRSK。有研究表明,亚氨基酸如脯氨酸和羟脯氨酸中的吡咯环有助于三螺旋结构非共价键的形成,亚氨基酸的含量越高,三螺旋结构越稳定,热稳定性越好[21]。

图8 河豚鱼皮胶原蛋白的热变性温度
Fig.8 Thermal denaturation temperature of collagen in puffer fish skin
3.6 胶原蛋白的体外抗氧化特性
人皮肤中胶原蛋白的含量会随着年龄的增长而逐渐减少,皮肤呈现老化的现象。目前,胶原蛋白作为面霜、营养补充剂、植入剂等被广泛应用于化妆品中,可有效覆盖在皮肤上,减少水分流失,避免皮肤受到外界侵害,皮肤适宜的温度也能促进胶原蛋白的吸收。测定TOSK、TRSK对DPPH自由基和·OH的清除能力,并与CFSK进行比较,探究河豚鱼皮胶原蛋白的体外抗氧化能力。胶原蛋白在化妆品行业的广泛应用主要基于其显著的抗氧化特性。
如图9所示,在DPPH体系中,TOSK、TRSK和CFSK对自由基清除率在胶原蛋白质量浓度低于0.8 mg/mL时,随着质量浓度的增加而增加;达0.8 mg/mL后有下降趋势,在0.8 mg/mL处达最大值,且TOSK、TRSK对DPPH自由基清除率接近,分别为45.75%和44.94%,高于CFSK的最大清除率38.66%。

图9 鱼皮胶原蛋白的抗氧化能力
Fig.9 Antioxidant capacity of collagen in fish skin 注:图中不同字母表示差异显著(P<0.05)
H2O2在人体内极易裂解成·OH,而·OH是目前已知活性氧中对生物体毒性最强的一种自由基[22]。研究表明多肽序列中的Gly、Arg、Pro可能与·OH清除能力有关,而TOSK、TRSK两种胶原蛋白中这3种氨基酸的含量较高,因此具有较好的·OH清除能力。实验结果显示,TOSK在0.8 mg/mL时清除率最高,为63.57 %,与1.0 mg/mL时无显著差异(P>0.05),TRSK对自由基的清除能力随着浓度的增加而逐渐上升,在1.0 mg/mL 时的·OH清除能力为63.54%,两者均高于CFSK在0.8 mg/mL时的最大值44.90%。体外抗氧化实验结果表明,河豚鱼皮胶原蛋白的抗氧化性优于市售鱼皮胶原蛋白。
4 结论
本文通过对比TOSK及TRSK的理化特性得出:2种河豚鱼皮胶原蛋白均具有胶原蛋白的特征氨基酸,各种氨基酸含量无显著性差异(P>0.05),通过光谱分析、SDS-PAGE和扫描电镜微观结构分析证实了所提取的胶原蛋白为完整的三螺旋大分子结构;TOSK的热变性温度为37 ℃高于TRSK的热变性温度35 ℃。与CFSK相比较,提取的TOSK和TRSK体外抗氧化性能更好,TOSK及TRSK对DPPH自由基的清除率在0.8 mg/mL时最大,为45.75%和44.94%,高于CFSK的38.66%;对·OH清除能力TOSK在0.8 mg/mL时最大,为63.57%,TRSK在1.0 mg/mL时为63.54%,高于CFSK在0.8 mg/mL时的最大值44.90%。
[1] 李国英.胶原的类型及其结构特征[J].中国皮革, 2002, 31(17):20-21.
LI G Y.Types and structural characteristics of collagen[J].China Leather, 2002, 31(17):20-21.
[2] 王沥浩,王文慧, 郭咏昕, 等.胶原蛋白功能概述[J].黑龙江农业科学, 2014(3):150-156.
WANG L H, WANG W H, GUO Y X, et al.Summary on the function of collagen[J].Heilongjiang Agricultural Sciences, 2014(3):150-156.
[3] 黄利华,梁兰兰.水产加工副产物高值化利用的研究现状与展望[J].食品安全导刊, 2019(30):155-157.
HUANG L H, LIANG L L.Research status and prospect of high-value utilization of aquatic processing by-products[J].China Food Safety Magazine, 2019(30):155-157.
[4] 郝淑贤,林婉玲, 李来好, 等.不同提取方法对罗非鱼皮胶原蛋白理化特性的影响[J].食品科学, 2014, 35(15):59-62.
HAO S X, LIN W L, LI L H, et al.Effect of extraction methods on physico-chemical properties of collagen from Tilapiashin[J].Food Science, 2014, 35(15):59-62.
[5] HEL, LAN W T, WANG Y, et al.Extraction and characterization of self-assembled collagen isolated from grass carp and crucian carp[J].Foods (Basel, Switzerland), 2019, 8(9):396.
[6] 李莉,顾赛麒, 王锡昌, 等.响应面法优化酶法提取大鲵皮胶原蛋白工艺[J].中国水产科学, 2013, 20(4):876-883.
LI L, GU S Q, WANG X C, et al.Optimization of conditions for the extraction of pepsin-soluble collagen from the skin of Chinese giant salamander (Andrias davidianus)[J].Journal of Fishery Sciences of China, 2013, 20(4):876-883.
[7] ARUMUGAMG K S, SHARMA D, BALAKRISHNAN R M, et al.Extraction, optimization and characterization of collagen from sole fish skin[J].Sustainable Chemistry and Pharmacy, 2018, 9:19-26.
[8] CAPUTOI, LEPRETTI M, SCARABINO C, et al.An acetic acid-based extraction method to obtain high quality collagen from archeological bone remains[J].Analytical Biochemistry, 2012, 421(1):92-96.
[9] 仇雷雷,王博, 邹帅军, 等.水母胶原蛋白的提取及性能研究[J].药学实践杂志, 2020, 38(6):509-515.
QIU L L, WANG B, ZOU S J, et al.Isolation and characterization of collagen from the jellyfish Nemopilema nomurai[J].Journal of Pharmaceutical Practice, 2020, 38(6):509-515.
[10] LAEMMLIU K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227(5259):680-685.
[11] 蔡路昀,许晴, 曹爱玲.不同超声辅助解冻方式对海鲈鱼肌原纤维蛋白的影响[J].食品与发酵工业, 2020, 46(20):1-8.
CAI L Y, XU Q, CAO A L.Effects of different ultrasound-assisted thawing methods on the myofibrillar protein of the sea bass(Perca fluviatilis)[J].Food and Fermentation Industries, 2020, 46(20):1-8.
[12] SINGHP, BENJAKUL S, MAQSOOD S, et al.Isolation and characterisation of collagen extracted from the skin of striped catfish (Pangasianodon hypophthalmus)[J].Food Chemistry, 2011, 124(1):97-105.
[13] CHENS L, TANG L L, HAO G X, et al.Effects of α1/α2ratios and drying temperatures on the properties of gelatin films prepared from Tilapia (Tilapia zillii) skins[J].Food Hydrocolloids, 2016, 52:573-580.
[14] 赵鸾,夏杨毅, 王立宇, 等.鲜毛肚和盐渍毛肚胶原蛋白的结构表征[J].食品与发酵工业, 2021, 47(20):114-119.
ZHAO L, XIA Y Y, WANG L Y, et al.Characterization of collagen from fresh and salted tripe[J].Food and Fermentation Industries, 2021, 47(20):114-119.
[15] LINY K, LIU D C.Comparison of physical-chemical properties of type I collagen from different species[J].Food Chemistry, 2006, 99(2):244-251.
[16] MUYONGAJ H, COLE C G B, DUODU K G.Characterisation of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus)[J].Food Chemistry, 2004, 85(1):81-89.
[17] BERISIOR, VITAGLIANO L, MAZZARELLA L, et al.Crystal structure of the collagen triple helix model [(Pro-Pro-Gly)(10)](3)[J].Protein Science:a Publication of the Protein Society, 2002, 11(2):262-270.
[18] SUNL L, LI B F, SONG W K, et al.Characterization of Pacific cod (Gadus macrocephalus) skin collagen and fabrication of collagen sponge as a good biocompatible biomedical material[J].Process Biochemistry, 2017, 63:229-235.
[19] 姚行行,郭妍, 庄永亮.云南鲷鱼骨胶原蛋白的制备及其理化性质[J].食品科学, 2018, 39(13):35-40.
YAO H H, GUO Y, ZHUANG Y L.Preparation and physicochemical properties of collagen from bone of Yunnan bream[J].Food Science, 2018, 39(13):35-40.
[20] 高玲玲,侯成立, 高远, 等.胶原蛋白热稳定性研究进展[J].中国食品学报, 2018, 18(5):195-207.
GAO L L, HOU C L, GAO Y, et al.Research advances of thermal stability of collagen[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(5):195-207.
[21] BURJANADZET V, VEIS A.A thermodynamic analysis of the contribution of hydroxyproline to the structural stability of the collagen triple Helix[J].Connective Tissue Research, 1997, 36(4):347-365.
[22] 蔡卓,江彩英, 赵静, 等.流动注射化学发光法测定中草药对羟自由基的清除率[J].理化检验-化学分册, 2010, 46(9):1 096-1 098.
CAI Z, JIANG C Y, ZHAO J, et al.Determination of hydroxyl radical scavenging rate of Chinese herbal medicine by flow chemiluminescence method[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2010, 46(9):1 096-1 098.