成熟可以改善牛肉的嫩度和风味等品质。然而,目前传统的真空包装湿法成熟技术会因包装膜对生鲜肉造成的贴体挤压而导致严重的汁液渗出和微生物腐败,这一直是该传统成熟方法面临的主要问题[1]。因此,企业亟需开发一种非真空包装条件下的成熟技术来克服以上问题。CO2作为气调包装(modified atmosphere packaging,MAP)体系中最重要的气体组分[2],其可在抑制微生物生长的基础上避免包装膜对肉的贴体挤压,且抑菌效果已得到业界的广泛认可。研究显示,包装内的CO2浓度超过20%就能明显抑制好氧微生物的生长,且抑菌效果会随CO2浓度的增加而显著增强[3]。但也有学者指出CO2的有效抑菌浓度为20%~40%,一旦超过40%,其抑菌效果不再明显增加[4],而且过高的CO2浓度还会诱发肉的品质劣变。截至目前,专门研究不同浓度CO2,尤其是高浓度CO2对成熟牛肉微生物生长和品质影响的研究尚不多见,高浓度CO2的抑菌效果也尚无定论。无氧条件下的高浓度CO2包装技术已在海产品长期贮藏中得到广泛应用,且取得了较好的保鲜效果[5],但该包装模式在生鲜牛肉中的保鲜效果尚需进一步研究。因此,针对不同包装环境下CO2有效抑菌浓度的探索已成为肉品包装界的研究热点。
肉色和嫩度是评价生鲜肉品质的2个重要指标,在决定消费者购买意愿及食用满意度方面起着重要作用。有研究发现高浓度CO2包装(填充气体为N2)可能会对肉色产生负面影响,这可能是CO2溶于肉中的水产生H2CO3,降低了肉的pH值所致[6]。但是,也有研究发现即便包装内充入100% CO2也不会显著降低牛肉的pH值[7]。因此,高浓度CO2包装是否会对牛肉肉色造成负面影响还有待进一步研究。同时,发色作为牛肉后期展示过程中肉色形成的重要过程,在牛肉零售方面具有十分重要的实际意义。发色能力好的牛肉将会在短时间内获得较好的肉色来吸引消费者,相反,发色能力较弱的牛肉其展示期间通常不会得到理想的肉色。目前关于牛肉发色的研究主要集中在常规真空包装成熟后的发色能力,而对高浓度CO2包装成熟牛肉发色能力的探索却尚未发现。此外,高浓度CO2会对三文鱼的嫩度、感官评分产生不利影响,但是消费者在评定嫩度时往往具有一定的主观性,其对红肉嫩度好坏的评判标准就与对海产品嫩度的评判标准有很大差异[8],因此成熟期间高浓度CO2是否会对牛肉嫩度产生影响也值得深入研究。
基于以上问题,本研究以传统真空包装(vacuum packaging,VP)为对照,研究了不同高浓度CO2(40% CO2+60% N2和80% CO2+20% N2)MAP成熟条件对冷却牛肉品质和货架期的影响,旨在为牛肉保鲜和新型成熟包装方式的开发提供理论和技术指导。
1 材料与方法
1.1 实验材料和设计
原料肉均采自山东某肉牛屠宰企业的西门塔尔杂交牛(月龄:20~24月,胴体重:286~315 kg)。肉牛屠宰后,将胴体在0~4 ℃下排酸24 h,选出宰后pH值为5.4~5.6的6头牛胴体(n=6),取其左半胴体的腰背最长肌部位,真空包装,然后将样品置于冰上低温3 h内运回实验室。在经严格灭菌的操作台上将牛腰背最长肌分切成2.54 cm的牛排待用。
每头牛的牛排被随机分成3组(每组2块牛排),每组牛排分别采用充气包装机进行80% CO2MAP(80% CO2+20% N2)、40% CO2MAP(40% CO2+60% N2)或真空包装(VP;对照组),包装顶隙空间比设定为3∶1。包装材料为高阻隔收缩袋,氧气透过率20 cm3/(m2·24 h),水蒸气透过率5 g/(m2·24 h),袋内放置吸水垫。为防止包装内残氧的存在,每个包装处理内均使用了除氧袋(AnaeroPack,C-35)来清除残氧。将包装好的牛排放置于4 ℃成熟35 d,并采用Logtag温度记录仪监测成熟期间环境温度的波动情况。待成熟结束后,从同一种包装内取出牛排,一块牛排用于检测pH值、肉色、发色能力和微生物指标,另一块牛排用于检测嫩度、挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量和保水性。未包装前,每头牛随机选取2块牛排同上,直接用于成熟0 d各项初始指标的检测。
1.2 实验仪器
DZQ-600L台式外抽真空(充气)包装机,浙江佑天元包装机械制造有限公司;SP62便携式色差计,美国爱色丽仪器有限公司;SenvenGo pH计,瑞士梅特勒-托利多仪器有限公司;低温冷藏冰箱,佳郅机电设备有限公司;SPX型生化培养箱,宁波江南仪器厂;HH-4数显恒温水浴锅,常州市金坛友联仪器研究所;BagPage®400拍打器,法国英特塞恩斯有限公司;AB104-S天平,梅特勒-托利多有限公司;T6紫外可见分光光度计,北京普析通用仪器责任有限责任公司;IKA T18匀浆机,德国艾卡仪器设备有限公司;NMI20-015V-1 核磁共振成像分析仪,上海纽迈电子科技有限公司;Logtag温度记录仪,深圳中际冷链电子有限公司;TA-XT2i质构仪,英国Stable Micro System公司;K-355凯氏定氮仪,瑞士BUCHI公司。
1.3 实验方法
1.3.1 pH值的测定
使用便携式pH计测定0 d和成熟35 d时3种包装方式下打开包装后牛排的pH值,每块牛排测定3次,取其平均值。每次使用前pH计探头都要进行pH值为7.00和4.00的校正。
1.3.2 发色能力的测定
成熟0 d的牛排在分切后立即使用便携式色差计(测量孔径8 mm,光源A,标准视角10°)测定表面肉色,成熟35 d的牛排肉色则在打开包装后立即测定。随后再将牛排置于塑料托盘上(3±1) ℃下避光发色100 min,每隔20 min测定1次表面肉色,记录牛排表面的亮度L*、红度a*和黄度b*。每次随机选取6个位点进行检测,避开脂肪和结缔组织,并取平均值。
1.3.3 剪切力值的测定
在成熟0 d和35 d时将牛排置于80 ℃恒温水浴锅内加热至中心温度70 ℃时,取出室温冷却,倒出蒸煮过程中产生的汁液后置于4 ℃过夜备用。用直径为1.27 cm的圆形取样器沿着平行于肌纤维的方向钻切取样,每个样品取3~5个肉柱。取样后立即用质构仪进行测定,注意避开样品内部的肌内脂肪、筋腱等。具体样品制备过程和测定方法参照NY/T 1180—2006《肉嫩度的测定 剪切力测定法》。
1.3.4 贮藏损失率的测定
包装前先称取分切好牛排的质量,每块记为m0(g),待成熟结束后将牛排从包装内取出,再次称取质量,记为m(g),贮藏损失率按公式(1)计算:
贮藏损失率![]()
(1)
1.3.5 低场核磁共振成像
参照孙文彬等[9]的方法,剔除肉眼可见的脂肪、筋腱,用双边刀从肉样中央位置沿肌纤维自然方向分切成多个1 cm厚的肉块,再用陶瓷刀从1 cm厚的肉块中切出2 cm×1 cm×1 cm的肉柱,每块牛排至少制取3个肉柱。选取合适的待测肉样[质量(1.8±0.2) g]用玻璃棒缓慢放入核磁专用试管中,切勿过度按压以防止肉样中水分挤出,核磁管内肉样用封口膜进行封口,防止水分的蒸发。
T1和T2加权图像由核磁共振成像分析仪和成像软件通过自旋回波序列获取,成像之前要先使用标准油样进行自动校正,并对样品进行预扫描后进行正式成像。成像参数为:TR=500、TE=20、AVERAGES=3、FOV Read=80、FOV Phase=80,肉样成像厚度为3 mm,同一样品进行5层成像[9]。
1.3.6 微生物数量的测定
无菌环境中从牛排表面取25 g肉样放入装有225 mL质量分数为0.85% NaCl-0.1%蛋白胨生理盐水的拍打袋内,用拍机器拍打2 min。取均匀菌液1 mL依次进行10倍梯度稀释,选择2~3个合适的稀释度分别置于不同选择性培养基中培养,每个稀释度做3个平行。不同的选择性培养基及培养条件如表1所示。
表1 不同选择性培养基的培养条件
Table 1 Incubatory conditions of different selective media

微生物种类培养基培养条件菌落总数平板计数琼脂37 ℃/48 h乳酸菌MRS培养基37 ℃/48 h肠杆菌紫红胆盐葡萄糖琼脂37 ℃/24 h
1.3.7 TVB-N的测定
在牛肉表面和内部随机取样10 g,切碎后剔除可见的脂肪和筋腱,加入75 mL蒸馏水进行均质。将混合物浸泡30 min后,参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》,采用自动凯氏定氮仪进行测定。
1.4 数据处理与统计分析
实验采用裂区设计来研究不同包装方式和成熟时间对牛肉品质指标、理化指标和微生物指标的影响。利用SAS 9.0中的混合模型来进行显著性分析,对于pH值、嫩度、成熟肉色、贮藏损失、菌落总数、乳酸菌、肠杆菌和TVB-N指标,固定效应为包装方式、成熟时间以及其交互作用;对于发色能力指标,固定效应为包装方式、成熟时间和发色时间以及其交互作用,随机效应均为牛个体。差异显著水平为P<0.05。采用Origin 8.0软件作图。
2 结果与分析
2.1 包装方式对成熟期间冷却牛肉pH值的影响
如表2所示,包装方式和成熟时间的交互作用以及包装方式均对牛肉的pH值影响不显著(P>0.05),只有成熟时间对牛肉的pH值影响显著(P<0.05)。理论上,包装内的CO2会溶于肌肉中的脂肪和水分,生成H2CO3并解离成CO32-和H+,且初始CO2浓度越高,其在肉中的溶解量就越大[7],但本研究发现包装中CO2浓度对打开包装后牛肉的pH值并无显著影响,这与ROUSSET等[7]的结果一致,他们发现100% CO2包装贮藏42 d后牛肉的pH值仅降低了0.1。成熟期间,牛肉pH值随成熟时间延长而显著升高,这与KHAN等[10]的发现一致,其主要原因是牛肉中的微生物或内源性酶(钙蛋白酶)分解蛋白质产生了氨、胺类及其他碱性物质。值得注意的是,本研究各包装内牛肉在整个成熟过程中的pH值始终处于5.5~5.8的正常范围内,这可能与微生物的增长有限有关。
表2 成熟时间对包装牛肉pH值的影响
Table 2 Effects of aging time on the pH of packed beef
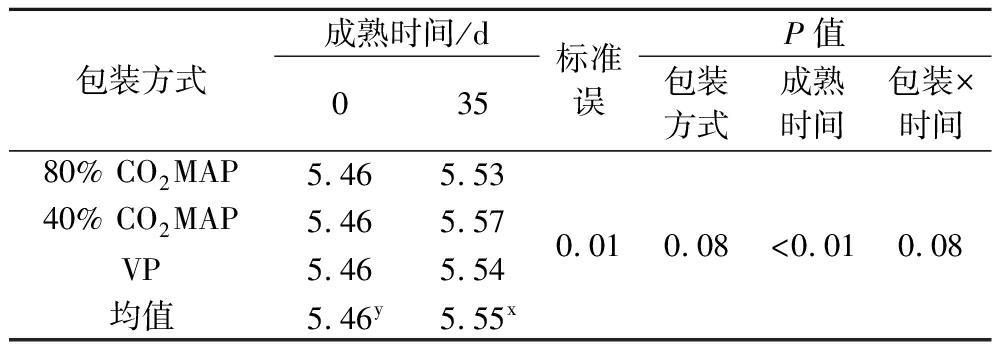
包装方式成熟时间/d035标准误P值包装方式成熟时间包装×时间80% CO2MAP5.465.5340% CO2MAP5.465.57VP5.465.54均值5.46y5.55x0.010.08<0.010.08
注:80% CO2MAP表示80% CO2+20% N2;40% CO2MAP表示40% CO2+60% N2;VP表示真空包装;上标字母x,y表示不同成熟时间差异达到显著水平(P<0.05)(下同)
2.2 包装方式对成熟期间冷却牛肉肉色及发色能力的影响
如图1所示,包装方式、成熟时间和发色时间的交互作用对L*值、a*值和b*值无显著影响(P>0.05),仅包装方式和成熟时间的交互作用对L*值影响显著(P<0.05),而成熟时间和发色时间的交互作用则对a*值和b*值影响显著(P<0.05)。成熟35 d后,不同包装内牛肉的L*值均显著降低。这与 MIECI
MIECI SKA等[11]的研究结果较一致,他们发现不同包装牛肉成熟前14 d的L*值均显著增加,但在成熟时间延长至21 d后则开始显著下降。有研究发现,成熟过程中蛋白质降解会使蛋白结构弱化,进而产生更大的光折射,表现为更高的L*值[12]。而随着成熟时间的延长,牛肉的肌原纤维小片化指数会逐渐增加,对光的吸收能力更强,从而使L*值降低[13]。同时,成熟35 d后,80% CO2MAP牛排的L*值显著高于VP和40% CO2MAP牛排,通常,L*值的大小与肉品表面自由水的含量有关,VP牛排相对较低的L*值可能是由于包装前抽真空产生的负压以及贮藏期间包装膜的挤压导致肉表面的自由水含量下降所致。
SKA等[11]的研究结果较一致,他们发现不同包装牛肉成熟前14 d的L*值均显著增加,但在成熟时间延长至21 d后则开始显著下降。有研究发现,成熟过程中蛋白质降解会使蛋白结构弱化,进而产生更大的光折射,表现为更高的L*值[12]。而随着成熟时间的延长,牛肉的肌原纤维小片化指数会逐渐增加,对光的吸收能力更强,从而使L*值降低[13]。同时,成熟35 d后,80% CO2MAP牛排的L*值显著高于VP和40% CO2MAP牛排,通常,L*值的大小与肉品表面自由水的含量有关,VP牛排相对较低的L*值可能是由于包装前抽真空产生的负压以及贮藏期间包装膜的挤压导致肉表面的自由水含量下降所致。
通常a*值是反映生鲜牛肉肉色的最重要指标,a*值越大代表肉色越鲜红,对消费者越具有吸引力[14]。随着成熟时间的延长,包装牛肉的发色能力显著增加,这可能是由于成熟过程中线粒体活性的降低和所需底物的消耗所致[15]。当成熟完成后的牛肉再次暴露在空气或高氧环境中,线粒体和肌红蛋白之间会竞争O2从而抑制鲜红色氧合肌红蛋白的形成,因此,成熟期间降低的线粒体O2消耗率有利于牛肉的发色。本研究发现,成熟0 d和35 d后牛肉的a*值均随发色时间延长而显著增加,和刚打开包装的初始a*值相比,2种成熟时间下的牛肉在发色20 min后,其a*值分别显著增加了30%和42%,且远高于消费者可接受的阈值(a*= 14.5)[16]。基于此数据,建议鲜切或CO2无氧包装下的牛肉应至少发色20 min后,再进行展示销售。未成熟(0 d)牛肉发色至40 min时,a*值已基本趋于稳定状态(P>0.05);而对于成熟35 d的牛肉,其发色时的a*值上升速度明显快于未成熟牛肉,但其充分发色的持续时间也相应更长,一直持续至80 min后a*值才趋于稳定(P>0.05)。此外,研究还发现包装方式对成熟后牛肉的发色a*值无显著影响。SEMAN等[6]研究表明在高浓度CO2MAP条件下,牛肉肉色会发生劣变,这可能与这些包装体系内存有残氧有关系,因为无氧包装中残氧量一旦超过0.1%就会导致棕褐色高铁肌红蛋白的快速生成[17]。鉴于本实验的包装体系内被添加了除氧剂,保证了3种包装内严格的无氧环境,高浓度CO2MAP在无残氧的情况下并不会引起牛肉肉色的劣变。
随着成熟时间延长,牛排的b*值显著增加,这与VERGARA等[18]的研究结果一致,这可能与高铁肌红蛋白的形成有关。同时,成熟0 d和35 d牛肉的b*值也随发色时间的延长显著增加,发色100 min后它们的b*值分别增加了18.3%和42.3%;未成熟(0 d)牛肉发色至20 min时,b*值增加了14.09%(P<0.05),随后基本趋于稳定状态(P>0.05),而成熟35 d的牛肉在发色60 min后b*值才趋于稳定状态(P>0.05),比发色前的b*值增加了39.6%(P<0.05),这与a*值的发色趋势基本一致。
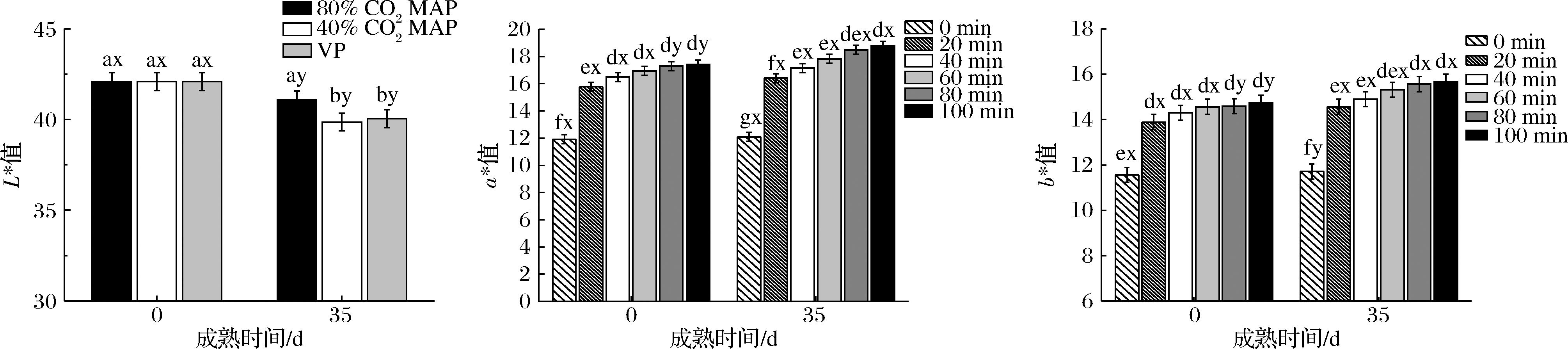
图1 不同包装方式和发色时间对成熟期间牛肉肉色的影响
Fig.1 Effects of different packing methods and aging times on the color of beef during aging 注:上标字母a、b表示不同包装方式差异达到显著水平(P<0.05),上标字母x、y表示不同成熟时间差异达到显著水平(P<0.05)(下同); d、e、f、g表示不同发色时间差异达到差异水平(P<0.05)
2.3 包装方式对牛肉成熟期间剪切力值的影响
如图2所示,包装方式和成熟时间的交互作用对牛肉嫩度影响显著(P<0.05)。随成熟时间的延长,3种包装牛肉的剪切力均显著降低(P<0.05),这主要是由于成熟过程中内源性蛋白酶系统和微生物的作用使肌肉中的肌原纤维蛋白发生降解[19]。KING等[20]研究表明,在较长时间(40 d)成熟过程中,牛肌肉组织会发生较大程度的蛋白水解进而改善嫩度,但嫩化效果会随成熟时间的增加而降低,成熟12 d后牛背最长肌约有50%的组织蛋白降解,再继续成熟28 d,牛组织蛋白的降解程度仅增加了不足20%。本研究发现,成熟35 d后,80% CO2MAP牛排的剪切力显著低于VP和40% CO2MAP,而VP和40% CO2MAP之间差异不显著,这说明80% CO2MAP在牛肉嫩化方面具有独特的优势。这可能是由于在牛肉熟制过程中,加热使肉中溶解的大量CO2快速释放出来,导致牛肉内部产生大量裂缝,破坏了肌原纤维结构,进而改善了成熟牛肉的嫩度。升高温度会降低CO2的溶解性,所以烹饪过程中溶于肉中的CO2很容易被释放出来[21]。SØRHEIM等[22]研究发现高CO2浓度包装牛排经烹饪后在其表面会有很多孔隙产生,这些孔隙主要位于肌原纤维和肌束膜的交界处,且孔隙数量会随CO2浓度的升高而增加。然而,本研究发现,VP包装牛肉的剪切力与40% CO2MAP牛肉的剪切力并无显著差异,说明40% CO2MAP不能起到上述的嫩化效果,只有较高浓度的CO2才可能会产生上述嫩化现象。
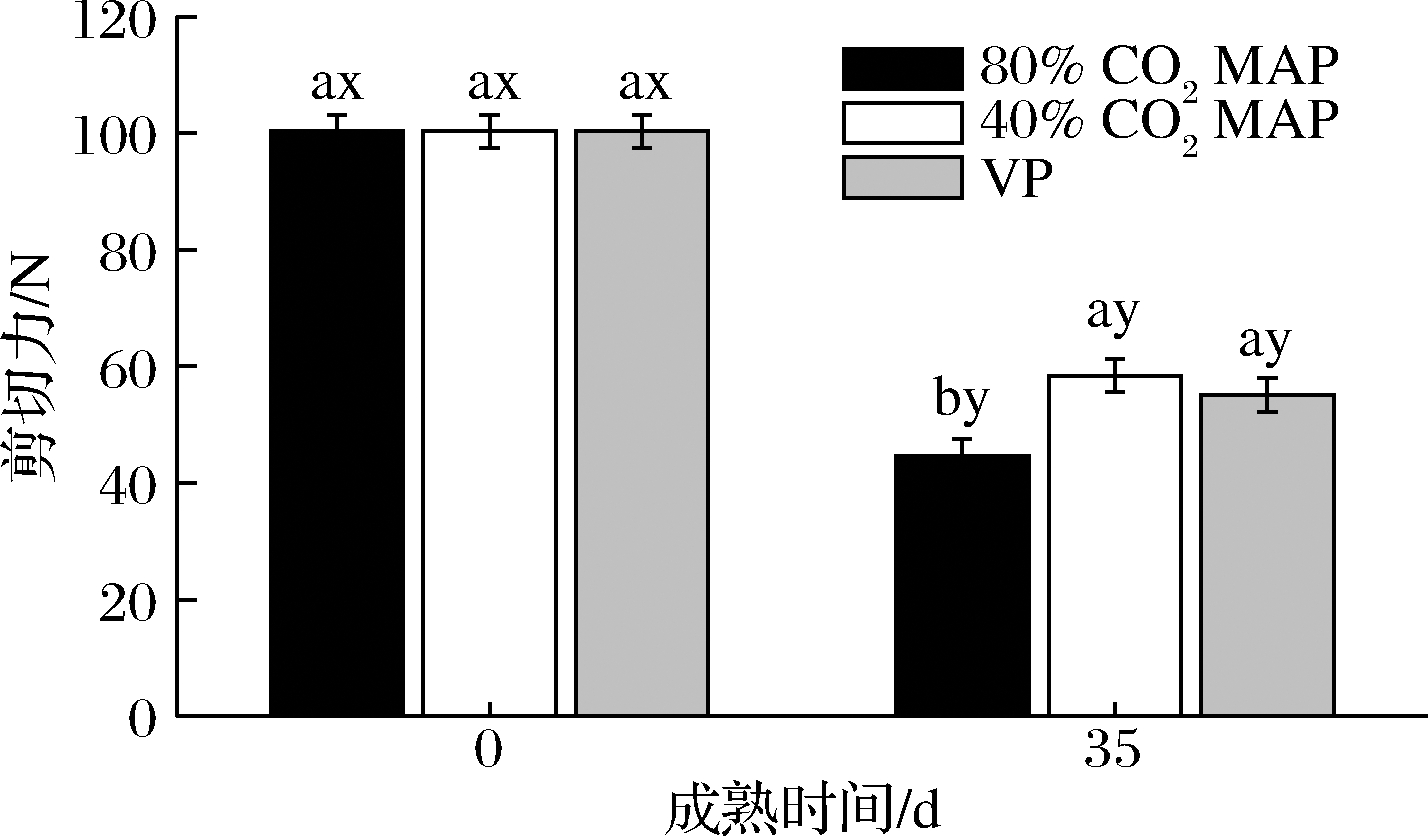
图2 不同包装方式对成熟期间牛肉嫩度的影响
Fig.2 Effects of packaging methods on the tenderness of beef during aging
2.4 包装方式对冷却牛肉成熟期间保水性的影响
2.4.1 包装方式对成熟期间牛肉贮藏损失的影响
冷鲜肉长期成熟过程中的汁液渗出是不可避免的,但是汁液的大量渗出不仅会影响肉的感官品质,造成经济损失,也会促进微生物的大量生长,影响肉的货架期[1]。如图3所示,包装方式对成熟期间牛肉的贮藏损失影响显著(P<0.05)。VP牛排的贮藏损失显著高于2个高浓度CO2处理组牛排。VP条件下成熟35 d牛排的贮藏损失率高达12.19%,而2个CO2处理组样品仅为8.5%左右,将贮藏汁液损失降低了大约3.6%。这主要是由于成熟过程中VP的包装膜会对肉品造成挤压,加剧肉中汁液的渗出,而2种充气包装则能很好地规避这种物理性挤压。2种浓度CO2包装(80% CO2MAP和40% CO2MAP)成熟牛排之间的贮藏损失无显著差异(P>0.05),这与STASIEWICZ等[23]的观点一致,即包装气体成分不会对贮藏期间肉品的贮藏损失产生影响。然而,SEIDEMAN[24]研究发现,100% CO2包装下牛肉的贮藏损失显著高于100% N2包装,他们猜测高浓度CO2溶解引起的pH值下降,可能会使牛肉的蛋白质发生变性和凝聚程度增加,导致其系水能力降低,但他们并未对不同CO2浓度下牛排的贮藏损失做进一步研究。而本研究并未发现高浓度CO2所引起的pH值改变,因此还有必要对高浓度CO2下牛肉的保水机制进行深入探讨。
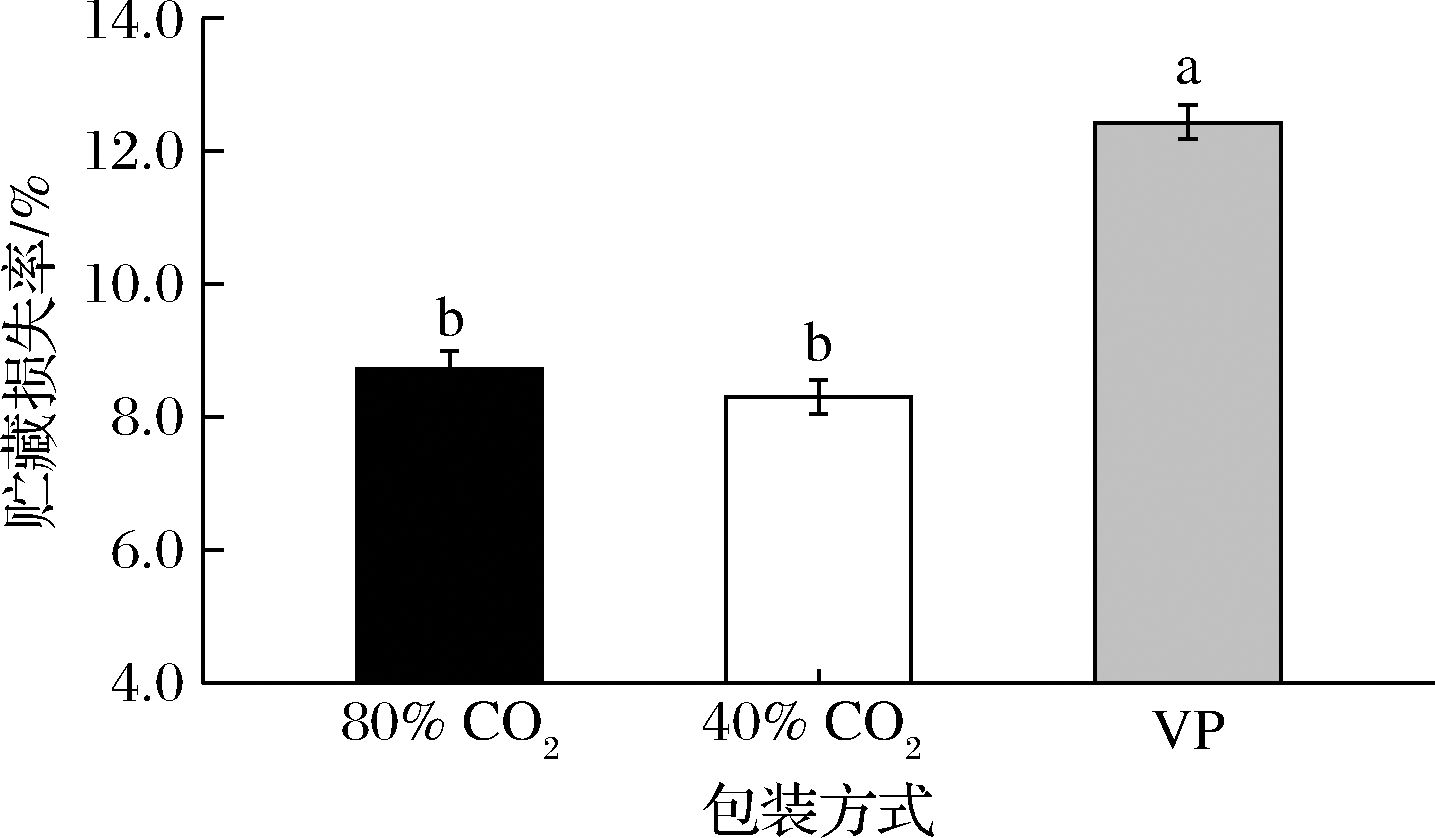
图3 不同包装方式对牛肉成熟期间贮藏损失的影响
Fig.3 Effects of packaging methods on weight losses of beef during aging
2.4.2 包装方式对成熟期间牛肉核磁成像的影响
核磁成像是最能直观反映食品中水分子空间分布状态的工具,本实验利用T1和T2加权图像研究了成熟过程中不同包装方式下牛排的水分分布状态。在伪彩色图像中,红色和绿色分别表示氢质子密度的高低。通常情况下,红色区域越密集,表明氢质子密度越高,水分含量也相应较高,反之绿色区域越密集,氢质子密度越分散,水分含量也越低[9]。由图4可以看出,新鲜样品(0 d)氢质子密度较高且分布均匀,而成熟35 d后的各包装内牛排的红色亮度均降低,说明成熟过程中存在汁液流失现象。这可能是由于成熟过程中肌纤维蛋白的降解和变性导致了部分不易流动水转化为自由水,通过滴滤损失的形式被释放出来。相对于2种CO2包装处理组,VP牛肉的图像呈现更多绿色粒子,说明VP样品的汁液损失更多,水分含量更低,这也与图3贮藏损失的结果一致。

a-新鲜样品(0 d);b-80% CO2MAP(35 d); c-40% CO2MAP(35 d);d-VP(35 d)
图4 成熟期间不同包装牛肉的质子密度图像
Fig.4 MRI pictures of beef under different packaging methods during aging
2.5 包装方式对成熟期间牛肉微生物数量的影响
对肉制品而言,微生物污染和繁殖是引起其腐败的最主要因素,而微生物的生长则受储存条件(包装方式、贮存温度等)的影响[1]。如表3所示,包装方式和成熟时间的交互作用对包装牛肉的菌落总数、乳酸菌和肠杆菌的数量影响显著(P<0.05)。成熟35 d后,VP牛肉的菌落总数已达到6.25 lg CFU/g,接近冷却肉的腐败临界值(7 lg CFU/g)[25];而2个高浓度CO2处理组的菌落数仍均在3 lg CFU/g以下,抑菌效果显著。与40% CO2MAP相比,80% CO2MAP处理组的抑菌效果更显著,其在35 d时的菌落总数仅为2.00 lg CFU/g,与其贮藏0 d时无显著增长,比对照组(VP)降低了4.25 lg CFU/g,这说明80% CO2MAP具有极其显著的抑菌效果(P<0.05)。这主要得益于CO2气体可以延长部分腐败微生物生长的延滞期并抑制其在对数期的生长速率[12]。类似地,YANG等[26]研究发现,与80% O2MAP(80% O2/20% CO2)相比,50% O2MAP(50% O2/40% CO2/10% N2)有效延缓了微生物生长,可将冷藏牛排的货架期延长至20 d以上。乳酸菌通常被认为是无氧包装肉中的优势腐败菌,其在3种包装方式下的生长趋势与菌落总数较为相似。成熟35 d后,VP包装牛肉的乳酸菌数量已达到4.98 lg CFU/g,而2种CO2组的乳酸菌数量仍均在2 lg CFU/g以下,且80% CO2MAP中对乳酸菌的抑制效果更显著,乳酸菌数量仅为1.58 lg CFU/g。这主要得益于CO2抑制了乳酸菌的生长,PATSIAS等[27]研究发现,与40% CO2MAP(40%CO2+30%O2+30%N2)相比,100%CO2MAP在抑制乳酸菌生长速率方面的作用更为显著。此外,成熟35 d,VP包装牛肉成熟肠杆菌数量已达到5.83 lg CFU/g,而2种CO2处理组内牛肉的肠杆菌数量均保持在较低水平,其数量甚至显著低于牛肉成熟前的肠杆菌数量,且CO2浓度越高,对肠杆菌的抑制效果越明显。BERRUGA等[28]研究发现,CO2浓度高于40%时会对包装内羊肉中的肠杆菌起到明显的抑制作用与本文结果一致。总体来说,2种CO2组对成熟35 d后牛肉的菌落总数、乳酸菌和肠杆菌数量均起到了较好的抑制作用,且80% CO2MAP的抑菌效果更为显著,可对生鲜牛肉起到较好的保鲜效果。
2.6 包装方式对成熟期间牛肉TVB-N的影响
TVB-N是评价肉品新鲜度的重要指标之一,其主要来自于微生物和肉中内源性蛋白酶降解使蛋白质产生的胺或氨类物质[10]。如表4所示,包装方式和成熟时间的交互作用对成熟牛肉的TVB-N值影响显著(P<0.05)。
表3 包装方式和成熟时间对成熟牛肉菌落总数、 乳酸菌和肠杆菌数量的影响
Table 3 Effects of packaging methods and aging time on total viable counts, lactic acid bacteria and Enterobacteriaceae of beef
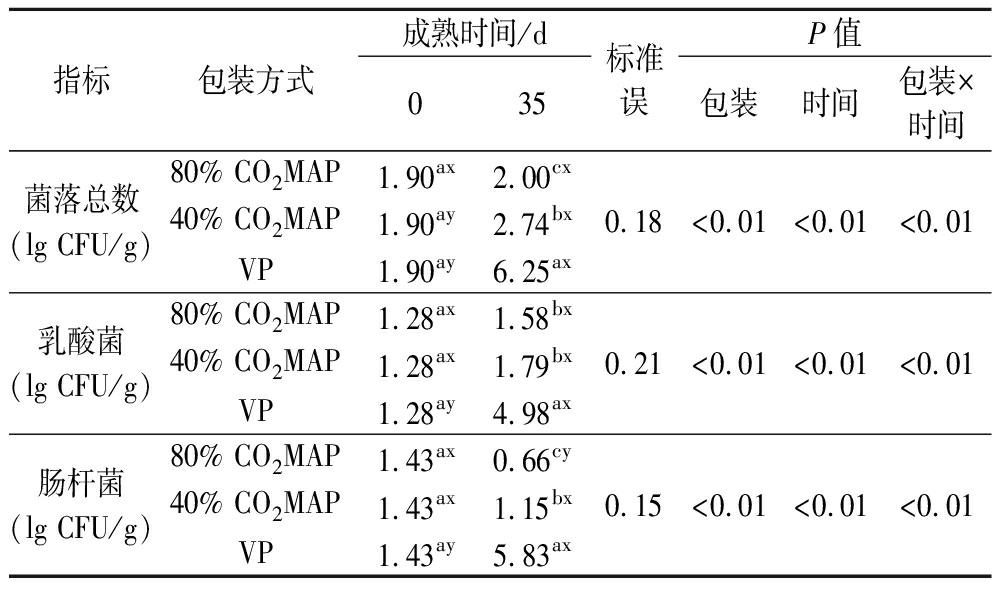
指标包装方式成熟时间/d035标准误P值包装时间包装×时间菌落总数(lg CFU/g)80% CO2MAP1.90ax2.00cx40% CO2MAP1.90ay2.74bxVP1.90ay6.25ax0.18<0.01<0.01<0.01乳酸菌(lg CFU/g)80% CO2MAP1.28ax1.58bx40% CO2MAP1.28ax1.79bxVP1.28ay4.98ax0.21<0.01<0.01<0.01肠杆菌(lg CFU/g)80% CO2MAP1.43ax0.66cy40% CO2MAP1.43ax1.15bxVP1.43ay5.83ax0.15<0.01<0.01<0.01
注:上标字母a、b、c表示不同包装方式差异达到显著水平(P<0.05),上标字母x、y表示不同成熟时间差异达到显著水平(P<0.05)(下同)
表4 包装方式和成熟时间对成熟牛肉TVB-N的影响
Table 4 Effects of packaging methods and aging time on the TVB-N of beef

指标包装方式成熟时间/d035标准误P值包装时间包装×时间TVB-N[mg·(100 g)-1]80% CO2MAP11.43ay12.83ax40% CO2MAP11.43ay12.98bxVP11.43ay14.78bx0.29<0.01<0.01<0.01
相较于与0 d时的TVB-N值,成熟35 d后的各包装组牛肉的TVB-N值均显著增加,尤其VP组的增幅最大,其TVB-N值已达到14.78 mg/100 g,接近GB 2707—2016限量标准(15 mg/100 g),表明牛肉已趋近于腐败,这与菌落总数的变化趋势相吻合。而80% CO2MAP和40% CO2MAP的TVB-N值分别为12.83和12.98 mg/100 g,显著低于VP组。这表明高浓度的CO2不仅能降低微生物的数量,还会抑制腐败微生物的生长代谢活动,进而减缓了TVB-N值的增加,使长期成熟的牛肉仍然保持较好的新鲜度。
3 结论
本实验研究了高浓度CO2气调包装成熟条件(80% CO2MAP和40% CO2MAP)对冷却牛肉品质指标、理化指标和微生物指标的影响。研究发现,相对于传统真空包装,2种高浓度CO2MAP均可显著降低其贮藏损失,有效抑制冷却牛肉成熟期间菌落总数、乳酸菌和肠杆菌的生长,以及挥发性盐基氮的产生,对冷却牛肉具有显著的保鲜效果;80% CO2MAP还能显著提高成熟牛肉的嫩度和亮度(L*值),对牛肉品质的改善效果优于40% CO2MAP。另外,2种高浓度CO2包装方式在本研究中对肉色(a*值和b*值)和pH值影响不显著,但成熟(35 d)可以显著提升牛肉的发色能力和发色持续时间,在发色20 min后即可赋予牛排较好的肉色。因此,80% CO2MAP可以替代传统真空包装用作冷却牛肉成熟期间的包装条件,在生鲜牛肉的未来生产中具有较广阔的应用前景。
[1] KIMY H B, MA D Y, SETYABRATA D, et al.Understanding postmortem biochemical processes and post-harvest aging factors to develop novel smart-aging strategies[J].Meat Science, 2018, 144:74-90.
[2] SINGHP, WANI A A, SAENGERLAUB S, et al.Understanding critical factors for the quality and shelf-life of MAP fresh meat:A review[J].Critical Reviews in Food Science and Nutrition, 2011, 51(2):146-177.
[3] MART NEZL, DJENANE D, CILLA I, et al.Effect of different concentrations of carbon dioxide and low concentration of carbon monoxide on the shelf-life of fresh pork sausages packaged in modified atmosphere[J].Meat Science, 2005, 71(3):563-570.
NEZL, DJENANE D, CILLA I, et al.Effect of different concentrations of carbon dioxide and low concentration of carbon monoxide on the shelf-life of fresh pork sausages packaged in modified atmosphere[J].Meat Science, 2005, 71(3):563-570.
[4] JAKOBSENM, BERTELSEN G.The use of CO2in packaging of fresh red meats and its effect on chemical quality changes in the meat:A review[J].Journal of Muscle Foods, 2002, 13(2):143-168.
[5] KIMBUATHONGN, LEELAPHIWAT P, HARNKARNSUJARIT N.Inhibition of melanosis and microbial growth in Pacific white shrimp (Litopenaeus vannamei) using high CO2modified atmosphere packaging[J].Food Chemistry, 2020, 312:126114.
[6] SEMAND L, DREW K R, CLARKEN P A, et al.Influence of packaging method and length of chilled storage on microflora, tenderness and colour stability of venison loins[J].Meat Science, 1988, 22(4):267-282.
[7] ROUSSETS, RENERRE M.Effect of CO2or vacuum packaging on normal and high pH meat shelf-life[J].International Journal of Food Science &Technology, 2007, 26(6):641-652.
[8] LERFALLJ, JAKOBSEN A N, SKIPNES D, et al.Comparative evaluationon the quality and shelf life of Atlantic salmon (Salmo salarL.) filets using microwave and conventional pasteurization in combination with novel packaging methods[J].Journal of Food Science, 2018, 83(12):3 099-3 109.
[9] 孙文彬,罗欣, 毛衍伟, 等.正常牛肉与DFD牛肉成熟过程中保水性和水分状态变化[J].食品科学, 2020, 41(13):14-21.
SUN W B, LUO X, MAO Y W, et al.Changes in water retention and moisture state of normal and dark, firm and dry beef during postmortem aging[J].Food Science, 2020, 41(13):14-21.
[10] KHANI, TANGO C N, OH D H.Development and evaluation of chitosan and its derivative for the shelf life extension of beef meat under refrigeration storage[J].International Journal of Food Science and Technology, 2017, 52(5):1 111-1 121.
[11]  MIECI
MIECI SKAK, DASZKIEWICZ T.Lipid oxidation and color changes in beef stored under different modified atmospheres[J].Journal of Food Processing and Preservation, 2021, 45(3):e15263.
SKAK, DASZKIEWICZ T.Lipid oxidation and color changes in beef stored under different modified atmospheres[J].Journal of Food Processing and Preservation, 2021, 45(3):e15263.
[12] MORTAZAVIS M H, KAUR M, FARAHNAKY A, et al.The pathogenic and spoilage bacteria associated with red meat and application of different approaches of high CO2packaging to extend product shelf-life[J].Critical Reviews in Food Science and Nutrition, 2021:1-22.
[13] ROWEL J, MADDOCK K R, LONERGAN S M, et al.Influence of early postmortem protein oxidation on beef quality[J].Journal of Animal Science, 2004, 82(3):785-793.
[14] HERN NDEZSALUE
NDEZSALUE A B, S
A B, S ENZ GAMASA C, DI
ENZ GAMASA C, DI EIRO RUBIAL J M, et al.CIELAB color paths during meat shelf life[J].Meat Science, 2019, 157:107889.
EIRO RUBIAL J M, et al.CIELAB color paths during meat shelf life[J].Meat Science, 2019, 157:107889.
[15] 魏直升,王勇峰, 余群力, 等.新疆褐牛不同部位牛肉在成熟过程中的品质变化[J].食品工业科技, 2020, 41(2):64-70.
WEI Z S, WANG Y F, YU Q L, et al.Quality changes in different parts of Xinjiang brown cattle beef during postmortem aging[J].Science and Technology of Food Industry, 2020, 41(2):64-70.
[16] HOLMANB W B, VAN DE VEN R J, MAO Y W, et al.Using instrumental (CIE and reflectance) measures to predict consumers’ acceptance of beef colour[J].Meat Science, 2017, 127:57-62.
[17] VENTURINIA C, CONTRERAS C J C, SARANT POULOS C I G L, et al.The effects of residual oxygen on the storage life of retail-ready fresh beef steaks masterpackaged under a CO2atmosphere[J].Journal of Food Science, 2006, 71(7):S560-S566.
POULOS C I G L, et al.The effects of residual oxygen on the storage life of retail-ready fresh beef steaks masterpackaged under a CO2atmosphere[J].Journal of Food Science, 2006, 71(7):S560-S566.
[18] VERGARAH, GALLEGO L.Effects of gas composition in modified atmosphere packaging on the meat quality of Spanish Manchega lamb[J].Journal of the Science of Food and Agriculture, 2001, 81(14):1 353-1 357.
[19] 李茜.包装方式结合冰温贮藏对牛肉品质的影响[D].太谷:山西农业大学, 2015.
LI Q.The effect of different packaging combined with controlled freezing-point storage on the quality of beef[D].Taigu:Shanxi Agricultural University, 2015.
[20] KINGD A, WHEELER T L, SHACKELFORD S D, et al.Effect of blade tenderization, aging time, and aging temperature on tenderness of beef longissimus lumborumandgluteus medius[J].Journal of Animal Science, 2009, 87(9):2 952-2 960.
[21] BRUCEH L, WOLFE F H, JONES S D M, et al.Porosity in cooked beef from controlled atmosphere packaging is caused by rapid CO2gas evolution[J].Food Research International, 1996, 29(2):189-193.
[22] SØRHEIMO, OFSTAD R, LEA P.Effects of carbon dioxide on yield, texture and microstructure of cooked ground beef[J].Meat Science, 2004, 67(2):231-236.
[23] STASIEWICZM, LIPI SKI K, CIERACH M.Quality of meat products packaged and stored under vacuum and modified atmosphere conditions[J].Journal of Food Science and Technology, 2014, 51(9):1 982-1 989.
SKI K, CIERACH M.Quality of meat products packaged and stored under vacuum and modified atmosphere conditions[J].Journal of Food Science and Technology, 2014, 51(9):1 982-1 989.
[24] SEIDEMANS C, SMITH G C, CARPENTER Z L, et al.Modified gas atmospheres and changes in beef during storage[J].Journal of Food Science, 1979, 44(4):1 036-1 040.
[25] PANIGRAHIS, BALASUBRAMANIAN S, GU H, et al.Design and development of a metal oxide based electronic nose for spoilage classification of beef[J].Sensors and Actuators B:Chemical, 2006, 119(1):2-14.
[26] YANGX Y, NIU L B, ZHU L X, et al.Shelf-life extension of chill-stored beef longissimussteaks packaged under modified atmospheres with 50% O2and 40% CO2[J].Journal of Food Science, 2016, 81(7):C1 692-C1 698.
[27] PATSIASA, CHOULIARA I, BADEKA A, et al.Shelf-life of a chilled precooked chicken product stored in air and under modified atmospheres:Microbiological, chemical, sensory attributes[J].Food Microbiology, 2006, 23(5):423-429.
[28] BERRUGAM I, VERGARA H, GALLEGO L.Influence of packaging conditions on microbial and lipid oxidation in lamb meat[J].Small Ruminant Research, 2005, 57(2-3):257-264.