白酒的主要成分是水和乙醇,大约占98%,剩下的大约2%的微量成分决定了白酒的品质。随着人民生活水平的提高,白酒的安全性也引起了消费者们的广泛关注。白酒酿造过程中产生的氨基甲酸乙酯(ethyl carbamate,EC),也称为尿烷,具有潜在的致癌性。EC广泛存在于葡萄酒、白兰地、黄酒以及白酒等各种酒精饮料中[1-3]。在白酒中EC的生成主要包括2种途径,一种是由乙醇和尿素反应产生,另一种是由氰化物产生[4]。随着酒精饮料的摄入,EC进入人体消化道。一系列动物实验研究发现,EC可引起多种疾病,如肝部肿瘤、肺腺瘤、乳腺肿瘤[5-6]等。2007年,国际癌症研究机构(International Agency for Research on Cancer,IARC)将EC列为2A类致癌物[7]。使用含有过量EC的饮料,人体患癌风险会大大增加[8-9]。
目前EC的国标测定方法GB 5009.223—2014《食品中氨基甲酸乙酯的测定》中,样品采用固相萃取结合气相色谱-质谱法测定,样品前处理比较耗时,而且有机试剂会对研究者的身体有害[10-12]。此外,有研究者采用高效液相色谱法结合荧光检测器测定酒精饮料中的EC,该方法需要样品衍生等前处理,对试验操作能力要求较高[13-14]。随后,一些研究人员使用固相微萃取结合气相色谱质谱法检测发酵食品中的EC,有效地节省了人力和物力,而且这种方法灵敏度好,检测限、定量限低[15-16]。
全二维气相色谱(two-dimentional gas chromatography,GC×GC)是在传统一维气相色谱基础上发展起来的一种新的色谱分离技术。不同极性的色谱柱通过调制柱连接,在一维色谱柱上分离的物质被调制器捕获,聚焦后流入二维色谱柱。通过2种不同极性的柱系统将复杂的基质分离,完美解决了一维柱上的共流出问题,还可以同时分离同分异构体,大大提高了色谱系统的分离能力,同时GC×GC通过调制柱的聚焦特性还提高了检测的灵敏度,可以适用于白酒中痕量组分的定性定量分析。顶空固相微萃取(headspace solid phase microextraction,HS-SPME)作为一种与全二维气相色谱-飞行时间质谱(comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry,GC×GC-TOFMS)联用的前处理方法,其操作简单、自动化程度高,将大大提高色谱的灵敏度和定性能力,是复杂样品定性定量分析的首选技术,该技术也同时应用于中国白酒、精油、尿液等一系列复杂的基质中痕量物质的定性与定量测定[17-19]。
飞行时间质谱在定量方向也具有性能优势,大幅提升了仪器的分析速度和灵敏度。本研究采用的新方法在测定白酒中关键的安全性指标EC的同时,又可以获得白酒中上千种挥发性组分,为白酒的EC测定和挥发性组分研究提供了一种便捷的方法。本文采用HS-SPME结合GC×GC-TOFMS开展白酒中EC的检测,以期为检测白酒中EC自动化快速测定提供有效的途径。
1 材料和方法
1.1 实验材料和仪器
白酒样品,市售。
氨基甲酸乙酯(99%)、D5-氨基甲酸乙酯(98%),J&KScientific;NaCl(分析纯),西陇科学。
色谱柱ZB-FFAP(60 m×0.25 mm×0.25 μm),飞诺美;DB-17HT(0.6 m×0.25 mm×0.15 μm),Agilent J&W;SPME Arrow 1.1 mm 20 mm×120 μm(DVB/carbon WR/PDMS)、顶空固相微萃取多功能自动进样系统,广州智达实验室科技有限公司;GGT 0620 GC×GC-TOFMS,广州禾信仪器股份有限公司。
1.2 溶液的配制
分别称取0.010 g EC和 D5-EC用 50%乙醇溶解定容至50 mL,分别配制质量浓度为200 mg/L EC储备液和D5-EC储备液。标准EC储备液用12%乙醇进行稀释,分别配制10、20、30、50、100、250、500 μg/L(含200 μg/L D5-EC)系列标准溶液待测。
1.3 样品前处理
根据白酒的酒精含量,用超纯水将白酒样品乙醇稀释至12%(体积分数),取10 mL稀释后的白酒样品于20 mL顶空瓶中,加入3.0 g NaCl及D5-EC内标加盖密封。萃取温度70 ℃,萃取时间40 min,萃取完成后,在气相色谱进样口250 ℃解吸附5 min,随后进行GC×GC-TOFMS分析,相同条件下分析3 次。
1.4 GC×GC-TOFMS仪器条件
GC×GC条件:一维柱ZB-FFAP(60 m×0.25 mm×0.25 μm),二维柱DB-17HT(0.6 m×0.25 mm×0.25 μm),进样口温度250 ℃,不分流模式;载气为高纯He(>99.999 5%),流速1.5 mL/min。色谱柱升温程序:初始温度40 ℃,5 min后以3 ℃/min升温至240 ℃,保持10 min。质谱条件:溶剂延迟4 min,采用EI电离源,电离电压-70 eV,离子源温度230 ℃,接口温度240 ℃。检测器电压-1 700 V,质谱扫描范围为35~500 m/z,扫描频率101 spectrum/s,二维数据由Canvas采集。Canvas scale工作站(版本1.0.0.19776)用于数据处理。
1.5 定量测定
采用内标法定量,对不同浓度的标准溶液进行分析,在选择离子模式下,EC以m/z 62为定量离子,D5-EC以 m/z64为定量离子,以EC峰面积与D5-EC面积的比值为纵坐标,EC浓度与D5-EC浓度的比值为横坐标,绘制标准曲线,并以标准曲线定量。
2 结果和讨论
2.1 HS-SPME条件的优化
采用HS-SPME对白酒样品中EC进行富集,由于萃取机理的原因,EC萃取平衡受到多种因素的影响,如萃取时间、萃取温度、离子强度和乙醇含量。实验比较选择了HS-SPME的最佳萃取条件。
2.1.1 酒精度的选择
由于乙醇会竞争吸附萃取头上的活性位点,降低EC响应值,采用不同浓度的乙醇溶液对目标进行萃取实验,研究了不同浓度乙醇对EC响应值的影响。取500 μg/L EC标准溶液,溶于10%、12%、14%、16%、18%的乙醇溶液中,加入NaCl至溶液饱和,按照实验方法进行测定,在选择离子模式下的自动积分(m/z62),目标峰面积与酒精度之间的关系如图1所示,当酒精度为12% vol时,EC的响应值最高。随着乙醇体积分数的增加,萃取头上的活性位点数量减少,导致目标物质响应值降低。由此可见,HS-SPME不适用于直接测定高乙醇体积分数酒精饮料中EC的含量,必须将酒精稀释到合适的含量。
2.1.2 NaCl添加量的优化
为了研究溶液离子强度对EC的影响,本实验固定其他试验条件,在系列相同浓度的标准溶液中,添加 0、1、2、3、4 g NaCl,在选择离子模式下进行自动积分(m/z62)。目标峰面积与NaCl含量关系如图1所示,目标物质的响应值随NaCl加入量的增加而增加,直到3 g左右达到饱和,此时响应值最高。因此,NaCl的加入确实能促进目标物的挥发,实验最终选择 3 g NaCl用来增强溶液的离子强度。
2.1.3 萃取时间优化
由于在HS-SPME系统中,萃取时间会影响目标物在固相、液相和气相的分配系数,因此本实验研究了萃取时间对目标物的影响。为了比较不同萃取时间对目标物质的影响,将系列相同浓度的标准溶液,分别在20、30、40、50、60 min条件下萃取。结果如图1所示,EC的响应值在40 min时最高,超过40 min响应值变化不明显,所以为了缩短总检测时间,选择40 min进行接下来的实验。
2.1.4 萃取温度优化
由于温度会影响小分子在固相、液相和气相中的分配系数,因此有必要探讨萃取温度对目标物的影响。为了比较不同温度对目标物的影响,在系列相同浓度的标准溶液中,分别在40、50、60、70、80 ℃萃取。从图1中可以看出,40 ℃和50 ℃时EC的响应值较低,当温度达到70 ℃时,EC响应值迅速增加,在70 ℃和80 ℃达到最大值,为了延长萃取头的工作时间,因此萃取EC的最佳萃取温度选择70 ℃。
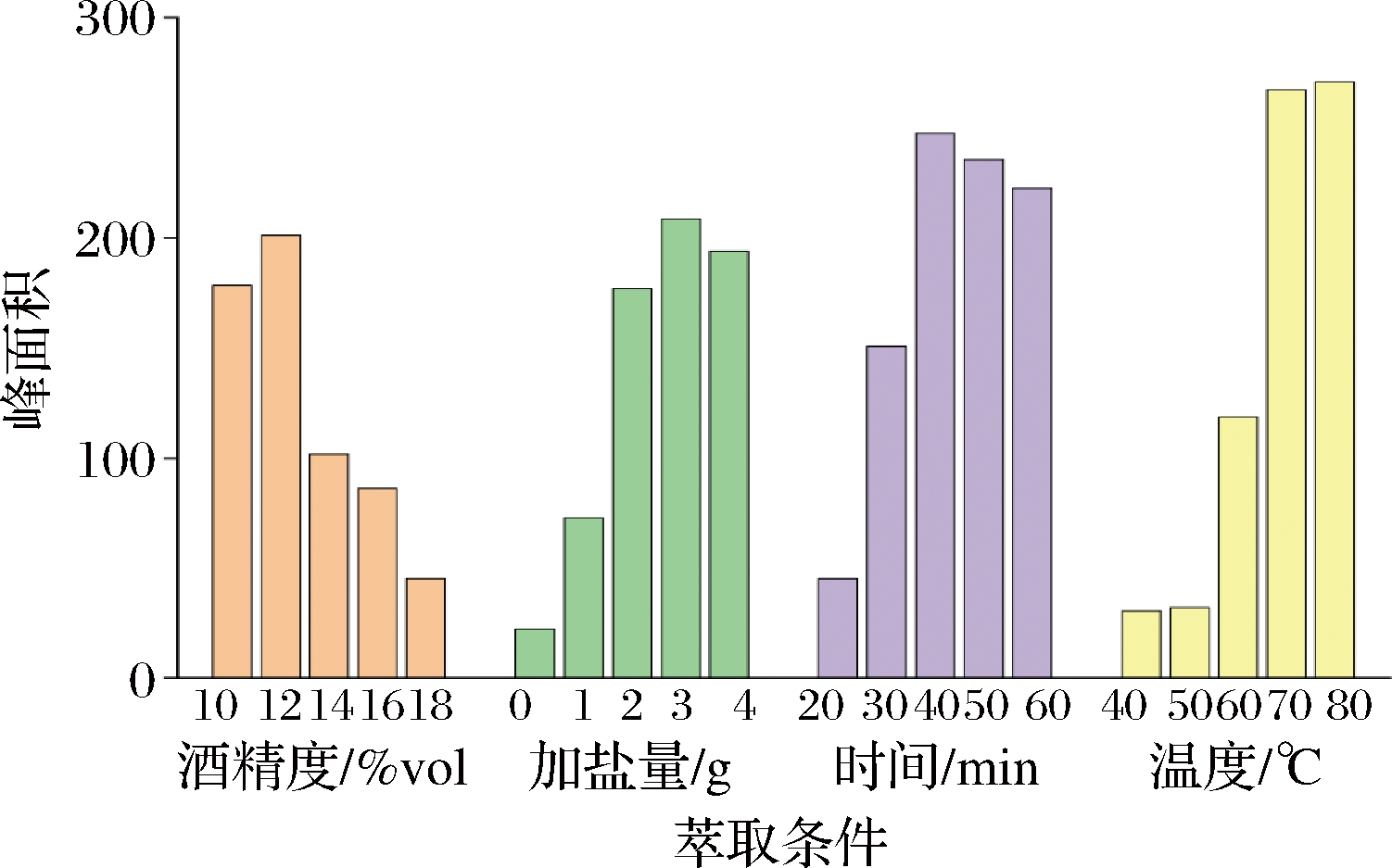
图1 SPME 的不同萃取条件与EC峰面积之间的关系
Fig.1 Relationship between different extraction conditions of SPME and EC peak area
图2是在选定的最佳萃取条件下,加入3 g NaCl,乙醇体积分数12%,70 ℃吸附40 min的GC×GC-TOFMS分析EC标准品在乙醇溶液中的二维色谱图。
图3是将目标物加入白酒基质中的二维色谱图。从图3-a可以看出,GC×GC-TOFMS成功地分离了白酒中的上千种挥发性化合物,在选择离子模式下的图3-b有助于从这个庞大的数据中找到目标物并且白酒基质对目标物没有任何的影响。
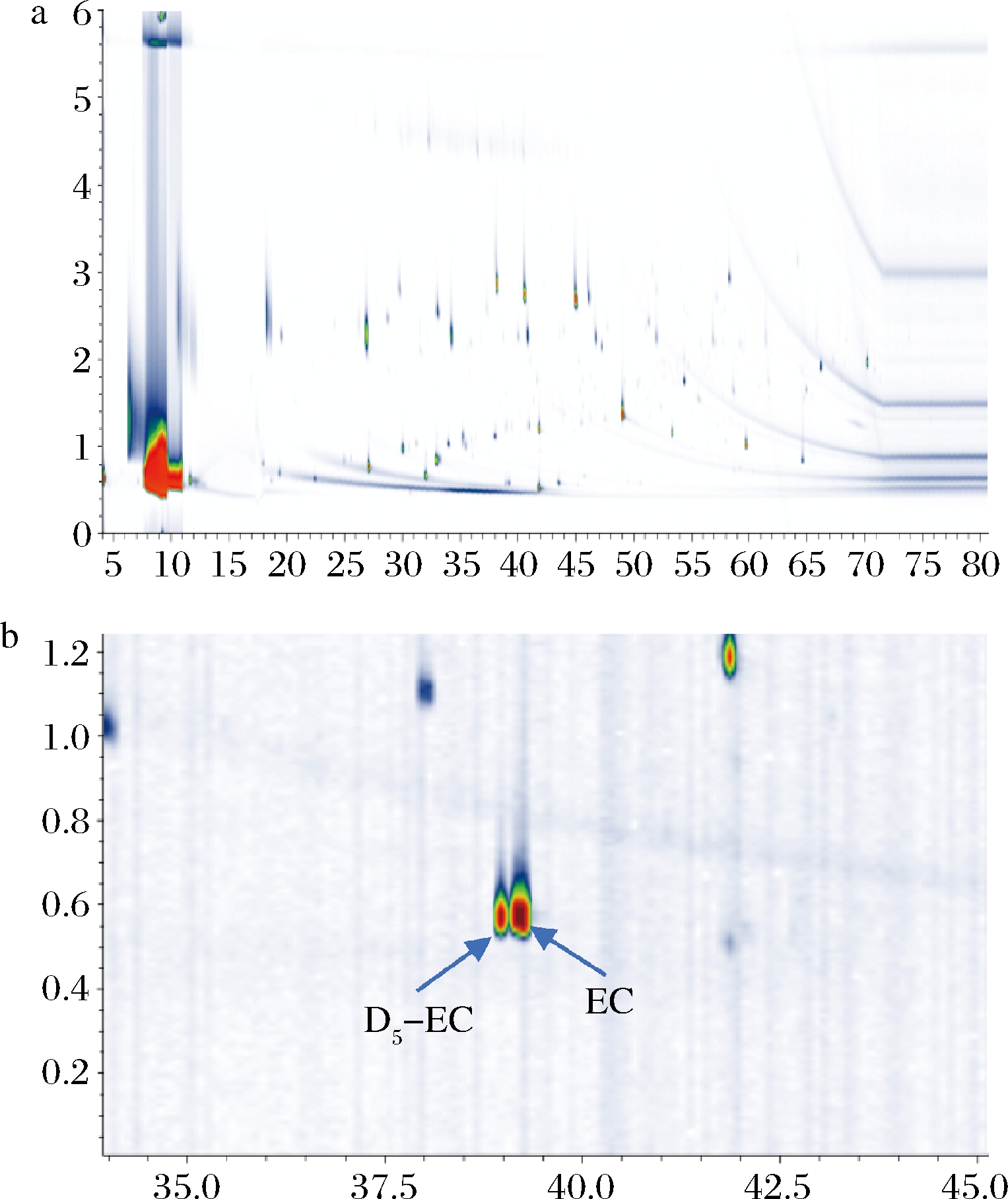
a-二维色谱图;b-选择离子模式(m/z62,64)二维色谱图
图2 EC和 D5-EC在12%乙醇溶液中的二维色谱图
Fig.2 Two-dimensional chromatogram of EC and D5-EC in 12% ethanol solution

a-二维色谱图;b-选择离子模式(m/z62,64)二维色谱图
图3 EC和 D5-EC在白酒中二维色谱图
Fig.3 Two-dimensional chromatogram of EC and D5-EC in Baijiu
2.2 线性关系及检出限
按照实验方法依次从低浓度到高浓度对标准溶液(含200 μg/L D5-EC)采用GC×GC-TOFMS进行分析,以EC峰面积与D5-EC面积的比值为纵坐标,EC浓度与D5-EC浓度的比值为横坐标,绘制标准曲线。在10~500 μg/L的范围内,线性方程为y=1.034 1 x,R2=0.998,以3倍的信噪比计算检出限,以10倍的信噪比计算定量限,检出限和定量限分别为0.19 μg/L,0.64 μg/L,检出限低于GB 5009.223—2014方法,且低于WANG等[20]报道的方法。
2.3 样品回收率
将随机选取的白酒(含EC 46.24 μg/L)用超纯水稀释至酒精度为12% vol,分别加入100、200、400 μg/L3个水平的EC(含200 μg/L D5-EC),计算回收率和精密度。每个水平做6次平行,在选择离子模式下,EC以m/z62为定量离子,D5-EC以 m/z64为定量离子,实验结果如表1所示。
由表1可知,3个水平的回收率为77.96%~110.88%,最大相对标准偏差为8.66%,具有良好的精密度,平均回收率为97.57%,证明该方法的准确度较高,可以适用于白酒中EC含量的测定。同时该实验的标准曲线是以乙醇和水作为基质建立的,由于水和乙醇是大多数酒精饮料的主成分,因此该方法也可用于其他高酒精度饮料酒中EC含量的测定。
2.4 方法准确性分析
采用上述方法测定不同类型白酒中EC的含量,并与国标法的测定结果进行比较,结果如表2所示。10种不同种类白酒中GC×GC-TOFMS测定与国标测定结果基本一致,无显著差异(P>0.05),该方法可以用于白酒中EC的准确测定。
表1 样品加标回收率(n=6)
Table 1 Recovery rate of spiked samples (n=6)
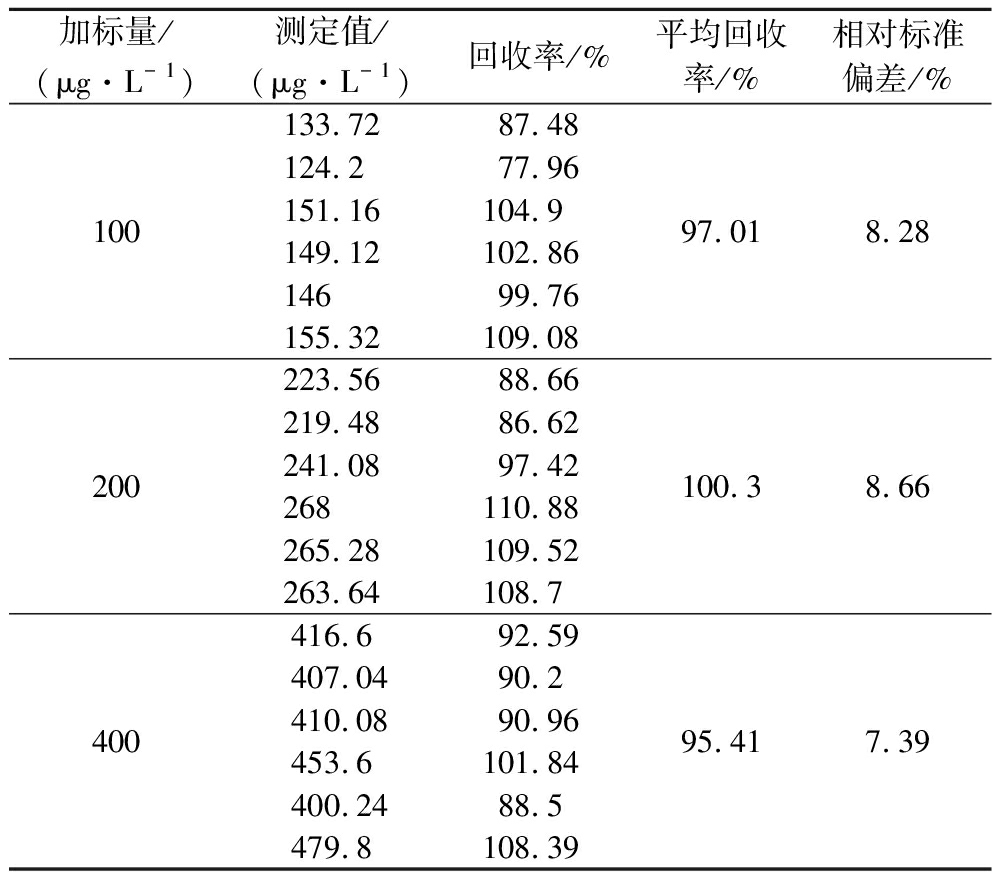
加标量/(μg·L- 1)测定值/(μg·L- 1)回收率/%平均回收率/%相对标准偏差/%100133.7287.48124.277.96151.16104.9149.12102.8614699.76155.32109.0897.018.28200223.5688.66219.4886.62241.0897.42268110.88265.28109.52263.64108.7100.38.66400416.692.59407.0490.2410.0890.96453.6101.84400.2488.5479.8108.3995.417.39
表2 GC×GC-TOFMS方法与国标GB 5009.223—2014测定结果比较 单位:μg/L
Table 2 Comparison of determination results between GC× GC-TOFMS method and GB 5009.223—2014

白酒样品白酒1白酒2白酒3白酒4白酒5白酒6白酒7白酒8白酒9白酒10国标法113.32149.31168.70169.59160.83146.59171.50161.63169.88144.62GC×GC-TOFMS法117.08153.20169.88164.36168.32154.72177.88154.72167.32154.88
3 结论
本文建立了HS-SPME结合GC×GC-TOFMS检测白酒中EC的方法,优化了HS-SPME的各项参数。结果表明,EC在10~500 μg/L范围内线性关系良好,回归系数(R2)>0.998,检出限0.19 μg/L,定量限0.64 μg/L,平均回收率97.57%,相对标准偏差<10%,对10种白酒样品的检测结果与国标相比无显著差异。本方法不需要繁琐的人工操作以及衍生试剂和有毒有害试剂的消耗,同时仍然保留了样品丰富的挥发性物质信息,且该仪器有效地减小了基质效应的影响,非常适合复杂样品的定性定量分析,结果表明GC×GC-TOFMS的确是分析白酒中EC的有力工具。同时,该实验也为白兰地、威士忌等高酒精度饮料酒中EC的定量测定提供了新方法,为发酵食品的安全生产提供了新思路。
[1] JUNGS, KIM S, KIM I, et al.Risk assessment of ethyl carbamate in alcoholic beverages in Korea using the margin of exposure approach and cancer risk assessment[J].Food Control, 2021, 124:107867.
[2] CONACHERH B S,PAGE B D, LAU B P Y, et al.Capillary column gas chromatographic determination of ethyl carbamate in alcoholic beverages with confirmation by gas chromatography/mass spectrometry[J].Journal of AOAC INTERNATIONAL, 1987, 70(4):749-751.
[3] ZHOUW Y, FANG R S, CHEN Q H.Effect of Gallic and protocatechuic acids on the metabolism of ethyl carbamate in Chinese yellow rice wine brewing[J].Food Chemistry, 2017, 233:174-181.
[4] JIAW, FAN Z B, DU A, et al.Recent advances in Baijiu analysis by chromatography based technology:A review[J].Food Chemistry, 2020, 324:126899.
[5] GURLEYK E, MOSER R D, KEMP C J.Induction of lung tumors in mice with urethane[J].Cold Spring Harbor Protocols, 2015, 2015(9):pdb.prot077446.
[6] FIELDK J, LANG C M.Hazards of urethane (ethyl carbamate):A review of the literature[J].Laboratory Animals, 1988, 22(3):255-262.
[7] GOWDV, SU H M, KARLOVSKY P, et al.Ethyl carbamate:An emergingfood and environmental toxicant[J].Food Chemistry, 2018, 248:312-321.
[8] LACHENMEIERD W, LIMA M C P, N BREGA I C C, et al.Cancer risk assessment of ethyl carbamate in alcoholic beverages from Brazil with special consideration to the spirits cachaça and tiquira[J].BMC Cancer, 2010, 10:266.
BREGA I C C, et al.Cancer risk assessment of ethyl carbamate in alcoholic beverages from Brazil with special consideration to the spirits cachaça and tiquira[J].BMC Cancer, 2010, 10:266.
[9] LACHENMEIERD W.Consequences of IARC re-evaluation of alcoholic beverage consumption and ethyl carbamate on food control[J].Deutsche Lebensmittel-Rundschau, 2007, 103(7):307-311.
[10] 巫景铭,洪瑞泽.SPE结合GC/MS测定黄酒中氨基甲酸乙酯[J].酿酒, 2010, 37(6):67-70.
WU J M, HONG R Z.Determination of ethyl carbamate in rice wines by solid-phase extraction and gas chromatography/mass spectrometry[J].Liquor Making, 2010, 37(6):67-70.
[11] 李晓芹,金尉, 袁小美.GC-MS内标法测定发酵食品中氨基甲酸乙酯的含量[J].中国调味品, 2017, 42(6):135-138.
LI X Q, JIN W, YUAN X M.Determination of ethyl carbamate content in fermented food by GC-MS internal standard method[J].China Condiment, 2017, 42(6):135-138.
[12] 吴平谷,陈正冬.固相萃取结合GC/MS法测定酒中氨基甲酸乙酯[J].卫生研究, 2004, 33(5):627-628.
WU P G, CHEN Z D.Determination of ethyl carbamate in wine by solid phase extraction combined with GC/MS[J].Journal of Hygiene Research, 2004, 33(5):627-628.
[13] MADRERAR R, VALLES B S.Determination of ethyl carbamate in cider spirits by HPLC-FLD[J].Food Control, 2009, 20(2):139-143.
[14] LIG H, ZHONG Q D, WANG D B, et al.Determination and formation of ethyl carbamate in Chinese spirits[J].Food Control, 2015, 56:169-176.
[15] LIUJ, XU Y, ZHAO G A.Rapid determination of ethyl carbamate in Chinese rice wine using headspace solid-phase microextraction and gas chromatography-mass spectrometry[J].Journal of the Institute of Brewing, 2012, 118(2):217-222.
[16] BAIW D, SUN S G, ZHAO W H, et al.Determination of ethyl carbamate (EC) by GC-MS and characterization of aroma compounds by HS-SPME-GC-MS during wine frying status in Hakkayellow rice wine[J].Food Analytical Methods, 2017, 10(6):2 068-2 077.
[17] IERIF, CECCHI L, GIANNINI E, et al.GC-MS and HS-SPME-GC×GC-TOFMS determination of the volatile composition of essential oils and hydrosols (by-products) from four Eucalyptusspecies cultivated in Tuscany[J].Molecules (Basel, Switzerland), 2019, 24(2):226.
[18] LIGORT, ZAWADZKA J, STR![]() CZY
CZY SKI G, et al.Searching for potential markers of glomerulopathy in urine by HS-SPME-GC×GC TOFMS[J].Molecules (Basel, Switzerland), 2021, 26(7):1817.
SKI G, et al.Searching for potential markers of glomerulopathy in urine by HS-SPME-GC×GC TOFMS[J].Molecules (Basel, Switzerland), 2021, 26(7):1817.
[19] WANGL L, GAO M X, LIU Z P, et al.Three extraction methods in combination with GC×GC-TOFMS for the detailed investigation of volatiles in Chinese herbaceous aroma-type Baijiu[J].Molecules (Basel, Switzerland), 2020, 25(19):4429.
[20] WANGC,WANG M,ZHANG M P.Ethyl carbamate in Chinese liquor (Baijiu):Presence, analysis, formation, and control[J].Applied Microbiology and Biotechnology, 2021,105(11):4 383-4 375.