细菌的自溶一般是指微生物细胞衰老、死亡或者遭受到环境胁迫之后,由细胞内的溶酶体释放水解酶进入细胞质内,使得其细胞中的营养物质被水解留下空壳或者细胞裂解的自然分解过程[1]。乳酸菌作为人体和动物体中不可缺少的有益微生物,广泛应用于食品、医药、饲料等生产领域。自溶现象也广泛存在于乳酸菌中,尤其是在发酵乳制品中。乳酸菌自溶是指乳酸菌在处于胁迫环境条件下维持菌群正常生存的一种自我保护现象。细菌的自溶与细胞壁的生物合成密切相关,图1是乳酸菌细胞壁的示意图[2]。当乳酸菌处于不利的生理条件时会导致细胞自发解体,从而激活自溶素,即细胞中能够水解细胞壁肽聚糖的酶。乳酸菌作为一类革兰氏阳性细菌,其胞壁质是由一个共价紧密相连的袋状聚合糖链与许多肽交联所形成的聚合物,因此,其主要的自溶酶是肽聚糖水解酶类。肽聚糖水解酶在乳酸菌细胞生长过程中起着扩张和溶解细胞膜胞壁质的作用,因为这些酶可以断开乳酸菌胞壁质肽聚糖网中的化学键,使新的亚基插入胞壁质中,此外这些酶在细胞分裂过程还起到断开中隔的作用,使处于分裂期的细胞得以顺利一分为二[3]。自溶过程由内源性自溶蛋白进行,自溶蛋白水解肽聚糖的共价键,在自溶过程中,菌体中的自溶酶会水解细胞壁,被水解后的细胞壁破裂而形成小孔,导致细胞质内的物质流失[4]。

图1 乳酸菌的细胞壁示意图
Fig.1 Schematic diagram of cell wall of lactic acid bacteria
自溶虽然是一种自然现象,但是当其发生在乳酸菌中时,会释放菌体中的肽酶、脂酶和胞内蛋白酶等多种酶类,这些酶可以将多肽、蛋白质以及脂肪分解成不同的风味物质或者风味前体物质,这些风味物质是乳制品特有的风味和质地的来源[5]。本文通过综述自溶对发酵乳制品的影响,乳酸菌自溶的影响因素和其与菌群群体感应之间的联系,探究其之间的联系,以期为今后的研究提供理论基础。
1 乳酸菌自溶对乳制品的影响
乳酸菌是乳制品生产中最常见的发酵剂,而乳酸菌的自溶对发酵乳制品的质量也有着很重要的影响。干酪和酸奶是最常见的发酵乳制品,但自溶对这2种乳制品的影响显著不同。首先,乳酸菌在干酪制造中起着十分关键的作用,它不但可以利用自身产酸,起凝乳作用,同时还具有许多酶特别是胞内蛋白酶,这些酶在干酪的成熟过程中也起着重要作用。在干酪成熟过程中,风味的产生不仅需要细胞外蛋白酶,还需要细胞内脂肪酶和肽酶。乳酸菌在自溶过程中会释放大量脂肪酶和肽酶,将牛奶中的脂肪、蛋白质和肽水解成风味物质,促进干酪成熟,带来其独特的风味和品质。一般来说,发酵剂的自溶会减少干酪的苦味,从而提高干酪中蛋白水解物质的含量和种类,尤其是游离氨基酸数量的增加,从而生产出具有更好风味的干酪。所以,乳酸菌自溶的快慢会直接关系到干酪成熟的速度和成熟后的风味。乳酸菌在自溶过程中所形成的蛋白酶、脂肪酶等酶类催化乳中蛋白质、脂肪和乳糖等成分的各种生化反应[6-9],因此乳酸菌的自溶会对发酵乳制品的感官特性和货架期品质产生一定的影响。DRAKE等[10]和CROW[11]等利用机械破壁等方法使得乳酸菌的自溶速率加快,从而使干酪快速成熟,BOUTROU等[12]通过利用不同自溶度的菌株制作切达干酪以提高干酪风味,不过自溶速度如果过快,就会造成发酵乳制品酸度不足或者乳糖残留过多等问题[13],影响最终产品。
在生产乳酸菌发酵剂时,自溶在菌体生长过程中起到的影响与其在干酪中的积极影响不同,自溶会使乳酸菌的活菌数难以达到生产时所需要的水平,从而影响产品的品质。因此在生产发酵剂时,需要通过一定的方法降低菌体的自溶率,使得发酵剂拥有较高的活菌数。除了对发酵剂的不良影响之外,乳酸菌自溶对发酵乳也有着负面的影响,自溶会破坏发酵乳的成分,同时随着乳酸菌活菌数量的降低,发酵乳的保健功效也会被削弱,而且自溶之后释放的胞内物质,会引起乳制品的流变学特性和产品固有的感官特性的改变[14]。在乳制品的发酵后期,乳酸菌自溶会释放出自身所有的肽酶,这是发酵乳制品产生特殊风味的基础[15]。通过对酸乳发酵剂的单菌株研究表明[16],菌株自溶程度对酸乳后酸化程度有着显著影响,因此,在乳制品的发酵过程中,通常会选择自溶度较高的菌株,这些菌株发酵的酸乳后酸化程度相对较低[17-18],有利于风味的形成。
2 乳酸菌自溶的影响因素
不同的菌种或菌株可以产生不同程度的自溶。而菌体的自溶特性不但与菌株本身有关,而且还受不同培养环境或生长条件的影响。在合适的范围内,随着培养温度和pH值的升高,自溶的能力会得到提升,但超过此范围时,过高或过低的培养温度和pH值都会限制自溶的发生。崔文明等[19]通过对保加利亚乳杆菌LJJ自溶影响因素的研究,当温度为50 ℃,pH值为6.0~8.0时,保加利亚乳杆菌LJJ的自溶速率最高。孙洁等[20]研究发现,当温度为55 ℃,pH值为6.0~7.0时,保加利亚乳杆菌LD3的自溶速率最高。表1列出了部分菌株发生自溶时的最适条件,可以看出不同菌株之间的自溶影响因素不同。
表1 菌株自溶条件
Table 1 Autolysis conditions of the strain
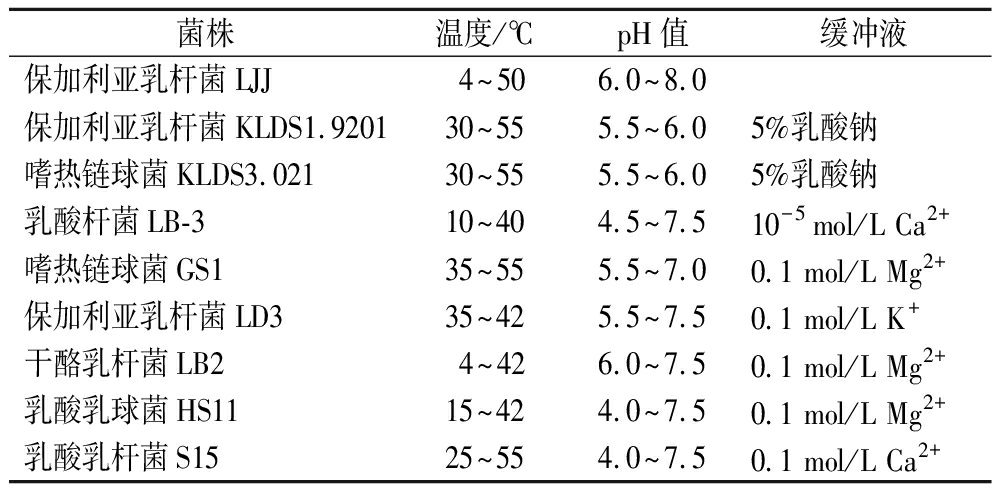
菌株温度/℃pH值缓冲液保加利亚乳杆菌LJJ4~506.0~8.0保加利亚乳杆菌KLDS1.920130~555.5~6.05%乳酸钠嗜热链球菌KLDS3.02130~555.5~6.05%乳酸钠乳酸杆菌LB-310~404.5~7.510-5 mol/L Ca2+嗜热链球菌GS135~555.5~7.00.1 mol/L Mg2+保加利亚乳杆菌LD335~425.5~7.50.1 mol/L K+干酪乳杆菌LB24~426.0~7.50.1 mol/L Mg2+乳酸乳球菌HS1115~424.0~7.50.1 mol/L Mg2+乳酸乳杆菌S1525~554.0~7.50.1 mol/L Ca2+
除温度和pH值外,缓冲溶液、盐浓度、金属离子以及培养时间对自溶也会有着一定的影响。冯镇等[21]证实了乳酸杆菌LB-3在从迟滞期到对数生长期的生长过渡时期的自溶度最大,约有73%的菌体出现自溶现象。延长培养时间会使许多乳酸菌发生自溶,正常情况下,菌体的自溶是有序进行的,一般不会导致菌体自溶,但是当菌体处于胁迫条件时,会导致分裂作用失序而引起自溶[22]。当乳酸菌在对数生长期时,其菌体细胞增加较快,生命活动活跃,此时会产生大量可以使细胞分裂的自溶酶,所以当菌体处于对数生长期时其自溶活性最高;当乳酸菌处于稳定期和衰退期时,其细胞活性逐渐下降直至衰亡,所以此时菌体的自溶率也会随之逐渐降低。以上研究结果表明,可以通过改变生长环境来控制菌株自溶的速率,使菌株的生长符合实际要求。其次在缓冲溶液的培养中,许多乳酸菌也能产生自溶现象,但是在酸性条件中自溶程度相对较低。因此,在乳酸菌培养中需要选择正确的培养液体系,以避免由于细胞内外渗透压差异过大而引起细胞破裂从而造成菌体自溶现象。RIEPE等[23]证实了氟化钠作为一种糖酵解抑制剂,可以显著提高在葡萄糖质量分数为1%的M17培养基中自溶不明显的菌株的自溶度。
乳酸菌的培养基成分组成也会对自溶产生一定的影响。尤其是当碳源和氮源耗尽时,菌株会立即发生自溶[24],将胞内的营养物质释放到环境中来缓解营养缺乏的情况。碳源消耗的时间也是自溶诱导的重要决定因素,谷小珍等[25]在研究中发现,生长抑制剂只有在葡萄糖耗尽的情况下,并且仅当葡萄糖耗尽在早期指数阶段时,才能引起乳酸菌菌株的自溶。HAZR等[26]在对几株自溶度较高的菌株的研究中发现,与乳糖、蔗糖和麦芽糖相比,当葡萄糖作为碳源添加到培养基时,菌株自溶率最高。此外,当缺乏碳水化合物、氨基酸和生长因子这些必要营养成分时,菌体的细胞壁的合成会受到抑制,导致乳酸菌迅速自溶。
3 乳酸菌群体感应对自溶的调控
群体感应是细菌的一种重要调节机制,在细菌的生长过程中,当细胞的密度达到一定数量之后,细胞会产生并感知特定的化学信号分子,以起到相互通信的作用。这些细胞之间的相互作用可以诱导特定基因的表达,激活抗各种环境胁迫、细菌毒性、细菌素生物合成及生物膜形成等相关行为[27-30],该信号通信在细菌的功能特性中起着非常重要的作用。群体感应通过产生、感应和响应小分子信号物质来调节细菌的各种生理生化功能[31]。近年来的科学研究表明,群体感应系统可以调节乳酸菌的各种关键生理生化功能,比如调节细菌内抗菌肽的合成[32]、肠道定殖能力[33]、调节生物膜的形成[34]以及胞外酶的合成[35]等。作为革兰氏阳性菌,乳酸菌的群体感应系统是由其自身诱导和双组分信号(two component signaling,TCS)系统组成[36]。相关研究成果指出,在对乳酸菌的基因组进行分析后,发现每个乳酸菌基因组均可以编码多种TCS系统[37],但许多TCS系统的生物学功能还没有展开进一步的探讨。已有研究证实有些TCS系统与胆汁耐受性相关,有些TCS系统与耐酸性相关,有些与细菌素的合成相关[38]还有的TCS系统与菌体的黏附相关。
PANG等[39]为探究乳酸菌自溶与群体感应之间的联系,运用基因敲除技术,成功敲除了保加利亚乳杆菌BAA-365中的2个功能不明的TCS编码基因,结果表明在敲除TCS编码基因之后,菌株的自溶率显著低于野生BAA-365菌株,这表明功能未知的TCS编码基因可能与保加利亚乳杆菌的自溶有关。随之对其进一步研究发现,保加利亚乳杆菌在生长过程中会产生一种信号肽分子,并释放到周围环境中,当环境中的信号肽分子的浓度达到一定量时,会刺激细胞壁上的组氨酸蛋白激酶vicK发生磷酸化反应,以此来调控蛋白的vicR磷酸化[40]。细胞磷酸化的vicR与位于lytM、ssaA和atlA的RNA聚合酶相结合,提高了这3种基因的表达能力,其表达产生的肽聚糖水解酶促进了细胞壁的裂解,从而能够有效控制保加利亚乳杆菌的自溶。信号分子通过TCS系统调节菌体密度,因此信号分子的群体调亡可能是降低乳酸菌自溶率和提高高密度发酵液中菌体密度的一种途径,也是改善乳制品品质和风味的一种途径。孙洁等[41]根据唾液链球菌嗜热亚种GS1-A8、德氏乳杆菌保加利亚亚种LD3-A3和乳酸乳杆菌S15-A3,3株菌株之间的共生及交互效应,得到一种可以应用于实际生产中的高质量复合酸乳发酵剂。
4 总结与展望
乳酸菌对维持机体微生态平衡起着关键作用,是人体和动物体中不可缺少的有益微生物。长期以来,乳酸菌被广泛应用于食品行业,医药行业和畜牧业中。自溶是乳酸菌在生长过程中不可避免的正常现象,也是影响乳制品的成熟和风味的重要因素之一。自溶对不同的乳制品的影响各异,因此在发酵过程中,如何控制乳酸菌的自溶显得尤为重要。综上所述,可以通过控制菌株生长的pH值、温度、生长时间以及营养条件等环境因素有效的改变乳酸菌在乳制品中的自溶速率,提高乳制品的质量。另外,乳酸菌的菌群互作和群体感应已成为当下热门的研究方向,因此可以利用菌群之间的共生及其他交互效应去发掘更多菌株之间的自溶调控方法,以选择更合适的发酵剂菌株。目前,国内外对自溶的机理已有较多研究,但是关于自溶在产业化中的应用研究较少,这就需要科研人员在已有的基础上对其进行更深入的研究。
[1] SHEMAROVAI V.Signaling mechanisms of apoptosis-like programmed cell death in unicellular eukaryotes[J].Comparative Biochemistry and Physiology.Part B: Biochemistry and Molecular Biology, 2010, 155(4):341-353.
[2] DELCOURJ, FERAIN T, DEGHORAIN M, et al.The biosynthesis and functionality of the cell-wall of lactic acid bacteria[J].Antonie Van Leeuwenhoek, 1999, 76(1-4):159-184.
[3] GARVIEE I.Bacterial lactate dehydrogenases[J].Microbiological Reviews, 1980, 44(1):106-139.
[4] ØSTLIEH M, VEGARUD G, LANGSRUD T.Autolysis of propionibacteria:Detection of autolytic enzymes by renaturing SDS-PAGE and additional buffer studies[J].International Journal of Food Microbiology, 2007, 117(2):167-174.
[5] SLATTERYL, O’CALLAGHAN J, FITZGERALD G F, et al.Invited review:Lactobacillus helveticus—a thermophilic dairy starter related to gut bacteria[J].Journal of Dairy Science, 2010, 93(10):4 435-4 454.
[6] MOUSSAIDS, BOUHLAL O, BENALI A, et al.Technological characterization of indigenous lactic acid bacteria from Moroccan camel milk for their potential use as starter or adjunct culture[J].Folia Microbiologica, 2021, 66(5):761-774.
[7] MENGZ X, ZHANG L W, XIN L, et al.Technological characterization of Lactobacillusin semihard artisanal goat cheeses from different Mediterranean areas for potential use as nonstarter lactic acid bacteria[J].Journal of Dairy Science, 2018, 101(4):2 887-2 896.
[8] BLAYAJ, BARZIDEH Z, LAPOINTE G.Symposium review: Interaction of starter cultures and nonstarter lactic acid bacteria in the cheese environment 1[J].Journal of Dairy Science, 2018, 101(4):3 611-3 629.
[9] GAGLIOR, TODARO M, SETTANNI L.Improvement of raw milk cheese hygiene through the selection of starter and non-starter lactic acid bacteria:The successful case of PDO pecorino siciliano cheese[J].International Journal of Environmental Research and Public Health, 2021, 18(4):1834.
[10] DRAKEM A, BOYLSTON T D, SPENCE K D, et al.Chemical and sensory effects of a Lactobacillusadjunct in Cheddar cheese[J].Food Research International, 1996, 29(3-4):381-387.
[11] CROWV L, GOPAL P K, WICKEN A J.Cell surface differences of lactococcal strains[J].International Dairy Journal, 1995, 5(1):45-68.
[12] BOUTROUR, SEPULCHRE A, PITEL G, et al.Lactococcal Lysisand curd proteolysis:Two predictable events important for the development of cheese flavour[J].International Dairy Journal, 1998, 8(7):609-616.
[13] CROWV L, COOLBEAR T, GOPAL P K, et al.The role of autolysis of lactic acid bacteria in the ripening of cheese[J].International Dairy Journal, 1995, 5(8):855-875.
[14] FERN NDEZMURGA M L, DE RUIZ HOLGADO A P, DE VALDEZ G F.Influence of the incubation temperature on the autolytic activity of Lactobacillus acidophilus[J]. Journal of Applied Bacteriology, 1995, 78(4):426-429.
NDEZMURGA M L, DE RUIZ HOLGADO A P, DE VALDEZ G F.Influence of the incubation temperature on the autolytic activity of Lactobacillus acidophilus[J]. Journal of Applied Bacteriology, 1995, 78(4):426-429.
[15] 刘彩虹,邵玉宇, 任艳, 等.高密度发酵和真空冷冻干燥工艺对乳酸菌抗冷冻性的影响[J].微生物学通报, 2013, 40(3):492-499.
LIU C H, SHAO Y Y, REN Y, et al.Effect of the technology of high cell density cultivation and vacuum freeze-drying on cryotolerance property of lactic acid bacteria[J].Microbiology China, 2013, 40(3):492-499.
[16] 孙洁,吕加平, 刘鹭, 等.乳酸菌发酵剂菌体自溶及产酶特性[J].食品工业科技, 2010, 31(12):164-167.
SUN J, LV J P, LIU L, et al.Lipase and protease activities and autolysis properties of lactic acid bacteria[J].Science and Technology of Food Industry, 2010, 31(12):164-167.
[17] 孙洁,沈瑾, 王希卓, 等.发酵剂菌体自溶对酸乳品质的影响[J].农业工程学报, 2012, 28(1):287-292.
SUN J, SHEN J, WANG X Z, et al.Effects of yogurt starters autolysis on quality of yogurt[J].Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(1):287-292.
[18] 孙洁,吕加平, 刘鹭, 等.N+注入诱变高自溶度的乳酸菌突变株[J].核农学报, 2010, 24(4):684-688;736.
SUN J, LYU J P, LIU L, et al.Screening of lactic acid bacteria with high autolysis rate by N+-implantation[J].Journal of Nuclear Agricultural Sciences, 2010, 24(4):684-688;736.
[19] 崔文明,刘鹭, 张书文, 等.保加利亚乳杆菌LJJ自溶的影响因素分析[J].食品与发酵工业, 2013, 39(7):6-12.
CUI W M, LIU L, ZHANG S W, et al.Analysis of factors influencing the autolysis of Lactobacillus delbrueckiisubsp.bulgaricusLJJ[J].Food and Fermentation Industries, 2013, 39(7):6-12.
[20] 孙洁.乳酸菌发酵剂菌株的自溶特性及机理研究[D].北京:中国农业科学院, 2010.
SUN J.Sdudies of autolysis properties and mechanism of lactobic acid bacteria starters[D].Beijing:Chinese Academy of Agricultural Sciences, 2010.
[21] 冯镇,张兰威, 姚伟.培养时间对乳酸菌自溶影响及菌体形态学变化[J].中国乳品工业, 2006, 34(7):28-30.
FENG Z, ZHANG L W, YAO W.Influence of incubation time on the autolytic activity of lactic acid bacteria and the morphological changes of lactic acid bacteria[J].China Dairy Industry, 2006, 34(7):28-30.
[22] 张玉玉,于江, 马建军, 等.德氏乳杆菌保加利亚亚种菌株自溶活性的比较研究[J].中国乳品工业, 2018, 46(7):18-20.
ZHANG Y Y, YU J, MA J J, et al.Comparative study on sutolytic sctivities of Lactobacillus delbrueckiisubsp.bulgaricusstrains[J].China Dairy Industry, 2018, 46(7):18-20.
[23] RIEPEH R, PILLIDGE C J, GOPAL P K, et al.Characterization of the highly autolytic Lactococcus lactissubsp.cremorisstrains CO and 2250[J].Applied and Environmental Microbiology, 1997, 63(10):3 757-3 763.
[24] HUSSON-KAOC, MENGAUD J, GRIPON J C, et al.The autolysis of Streptococcus thermophilusDN-001065 is triggered by several food-grade environmental signals[J].International Dairy Journal, 1999, 9(10):715-723.
[25] 谷小珍,薛玮祯, 汪惠丽, 等.生长抑制剂所诱导的乳酸乳球菌MG1363的自溶表型及其生长阶段特异的性质(英文)[J].微生物学通报, 2017, 44(6):1 322-1 330.
GU X Z, XUE W Z, WANG H L, et al.Autolysis of Lactococcus lactisMG1363 induced by growth inhibitors[J].Microbiology China, 2017, 44(6):1 322-1 330.
[26] HAZRDALCA S.Selection of autolytic lactic acid bacteria as potential adjunct cultures to accelerate ripening of white-brined cheeses[J].Mljekarstvo, 2018:320-330.
[27] AL-SHABIBN A, HUSAIN F M, REHMAN M T, et al.Food color ‘Azorubine’ interferes with quorum sensing regulated functions and obliterates biofilm formed by food associated bacteria:An in vitroand in silicoapproach[J].Saudi Journal of Biological Sciences, 2020, 27(4):1 080-1 090.
[28] BISWASS, MUKHERJEE P, MANNA T, et al.Quorum sensing autoinducer(s) and flagellum independently mediate EPS signaling in Vibrio choleraethrough LuxO-independent mechanism[J].Microbial Ecology, 2019, 77(3):616-630.
[29] REEN F J, GUTIÉRREZ-BARRANQUEROJ A, PARAGES M L, et al.Coumarin:A novel player in microbial quorum sensing and biofilm formation inhibition[J].Applied Microbiology and Biotechnology, 2018, 102(5):2 063-2 073.
[30] LIUX X, JI L, WANG X, et al.Role of RpoS in stress resistance, quorum sensing and spoilage potential of Pseudomonas fluorescens[J].International Journal of Food Microbiology, 2018, 270:31-38.
[31] MONNETV, GARDAN R.Quorum-sensing regulators in Gram-positive bacteria:‘cherchez le peptide’[J].Molecular Microbiology, 2015, 97(2):181-184.
[32] WASFIR, ABD EL-RAHMAN O A, ZAFER M M, et al.Probiotic Lactobacillussp.inhibit growth, biofilm formation and gene expression of caries-inducing Streptococcus mutans[J].Journal of Cellular and Molecular Medicine, 2018, 22(3):1 972-1 983.
[33] MEDELLIN-PE AM J, GRIFFITHS M W.Effect of molecules secreted by Lactobacillus acidophilusstrain La-5 on Escherichia coliO157:H7 colonization[J].Applied and Environmental Microbiology, 2009, 75(4):1 165-1 172.
AM J, GRIFFITHS M W.Effect of molecules secreted by Lactobacillus acidophilusstrain La-5 on Escherichia coliO157:H7 colonization[J].Applied and Environmental Microbiology, 2009, 75(4):1 165-1 172.
[34] LIUL, WU R Y, ZHANG J L, et al.Overexpression of luxSpromotes stress resistance and biofilm formation of Lactobacillus paraplantarumL-ZS9 by regulating the expression of multiple genes[J].Frontiers in Microbiology, 2018, 9:2628.
[35] PEZZULOA A, HORNICK E E, RECTOR M V, et al.Expression of human paraoxonase 1 decreases superoxide levels and alters bacterial colonization in the gut of Drosophila melanogaster[J].PLoS One, 2012, 7(8):e43777.
[36] STURMEM H J, FRANCKE C, SIEZEN R J, et al.Making sense of quorum sensing in lactobacilli:A special focus on Lactobacillus plantarumWCFS1[J].Microbiology (Reading, England), 2007, 153(Pt 12):3 939-3 947.
[37] BORLANDS, OUDART A, PRIGENT-COMBARET C, et al.Genome-wide survey of two-component signal transduction systems in the plant growth-promoting bacterium Azospirillum[J].BMC Genomics, 2015, 16(1):833.
[38] MARXP, MEIERS M, BRÜCKNER R.Activity of the response regulator CiaR in mutants of Streptococcus pneumoniaeR6 altered in acetyl phosphate production[J].Frontiers in Microbiology, 2015, 5:772.
[39] PANGX Y, LIU C P, LYU P C, et al.Identification of quorum sensing signal molecule of Lactobacillus delbrueckiisubsp.bulgaricus[J].Journal of Agricultural and Food Chemistry, 2016, 64(49):9 421-9 427.
[40] PANGX Y, ZHANG S W, LU J, et al.Identification and functional validation of autolysis-associated genes in Lactobacillus bulgaricusATCC BAA-365[J].Frontiers in Microbiology, 2017, 8:1367.
[41] 孙洁,王希卓, 刘鹭, 等.酸乳高自溶度复合发酵剂配方优化[J].农业工程学报, 2014, 30(8):272-279.
SUN J, WANG X Z, LIU L, et al.Formula optimization of high autolytic complex microbial agents for yogurt[J].Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(8):272-279.