炎症性肠病(inflammatory bowel disease,IBD)是一种会引起肠道炎症反应和上皮损伤的多因素慢性疾病,在欧洲和北美洲发病率较高,近些年来在亚洲的发病率也逐步升高[1]。根据遗传学和临床研究表明,IBD是一种多因素疾病,具体表现为宿主无法适应环境的动态变化导致肠道稳态发生破坏,进而引起一系列症状。目前关于IBD的发病机制尚不明确,通常认为与遗传、免疫、肠道微生物群及其代谢产物、生活习惯和环境因素均有关。IBD根据临床表现的不同可以分为两种:(1)克罗恩病(Crohn’s disease,CD),主要涉及结肠和小肠;(2)溃疡性结肠炎(ulcerative colitis,UC),其病症仅限于结肠[2-3]。
在过去的几十年中,通过临床及动物模型的研究,已经对IBD患者肠道上皮细胞屏障功能、机体免疫及修复机制有了全面的认知,揭示了许多与肠道炎症相关的细胞因子和细胞通路,对IBD临床靶向治疗的发展有着重要的作用。研究发现,缺乏调节性细胞因子IL-2、IL-10的基因敲除小鼠会发展为自发性结肠炎。此外,IBD会引起肠道微生物的改变、Toll样受体信号传导进而激活肠黏膜上固有层树突细胞和巨噬细胞产生大量的促炎因子,如IL-1β、IL-6和IL-18[4-5]。IBD往往伴随着结肠及血清中促炎因子含量上升和炎症抑制因子含量下降。
微生物通过代谢肠道中未被吸收的膳食纤维、脱落的上皮细胞和黏液,产生不同的代谢产物,在肠道中发挥着不同的生物活性。肠道中乳杆菌属和双歧杆菌属增多会促进结肠中乳酸的积累,乳酸通过激活细胞表面G蛋白偶联受体(G-protein-coupled receptor,GPR)GPR81的表达,抑制了结肠中树突细胞和巨噬细胞中炎症因子的表达[6-7]。短链脂肪酸(short-chain fatty acids,SCFAs)是指6个碳原子以下的脂肪酸,主要包括乙酸、丙酸、丁酸和戊酸。SCFAs作为结肠上皮细胞上G蛋白偶联受体蛋白GPR1909A、GPR43和GPR41的配体,可以与之结合促进抗炎因子的表达,同时抑制促炎因子,如IL-1β、IL-6、IL-12和TNF-α表达。此外,SCFAs还可以通过调节免疫细胞、维持结肠上皮细胞屏障直接或间接预防和治疗炎症性肠病[8-9]。
类干酪乳酪杆菌有着悠久的研究与食用历史,是常见的益生菌候选菌种。许多研究都表明类干酪乳酪杆菌对溃疡性结肠炎具有预防和改善作用。田春雨[10]的研究发现,Lactobacillus paracasei M5-L及Lactobacillus caseiQ8-L对葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导小鼠肠炎具有调节作用,能够明显改善小鼠结肠组织病变情况,同时显著上调血清中抗炎因子IL-10的含量,下调炎症因子TNF-α和IL-6的含量。CHEN等[11]研究表明, Lactobacillus paracaseisubsp.paracaseiNTU 101可以提高结肠炎小鼠抗氧化能力和结肠中抑炎因子的浓度,同时降低炎症因子的浓度。HUANG等[12]研究显示,Lactobacillus paracaseiR3可以通过调节 Th17/Treg 细胞平衡来达到预防结肠炎的效果。
本实验以分离自我国西藏拉萨地区当雄县自然发酵酸牦牛乳中的类干酪乳酪杆菌PC-01为研究对象,该菌株具有安全性,且在模拟消化液中耐受性良好,消化存活率达到88.6%,能以活得状态进入肠道中,具有潜在的益生特性[13]。本研究通过DSS诱导小鼠结肠炎模型,对菌株PC-01促进结肠炎恢复的具体益生功能进行评价,为该菌株的后续研究及益生菌产品的开发打下基础。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
Lacticaseibacillus paracaseiPC-01分离自西藏拉萨地区自然发酵牦牛乳中,由内蒙古农业大学“乳品生物技术与工程”教育部重点实验室馈赠,保藏于中国普通微生物菌种保藏管理中心,保藏号为 CGMCC No.17537。类干酪乳酪杆菌PC-01直投式菌粉由北京科拓恒通生物技术股份有限公司生产。
1.1.2 实验动物
50只6~8周龄SPF级C57BL/6J雄性小鼠,体重20~22 g,采购自北京华阜康生物科技股份有限公司并寄养于此。小鼠饲养于SPF级鼠房,温度在24~26 ℃,昼夜各12 h循环。实验小鼠在实验期间自由饮水和进食。本研究遵循华阜康生物科技股份有限公司动物伦理委员会的要求,伦理审查编号为IACUC-20210315。
1.1.3 实验试剂
葡聚糖硫酸钠,美国MP公司;Na2HPO4,北京红星化工厂;NaH2PO4,北京化工厂;NaCl,广东西陇化工厂;小鼠IL-1β酶联免疫试剂盒、IL-6酶联免疫试剂盒、IL-10酶联免疫试剂盒、髓过氧化物酶试剂盒,上海酶联生物科技有限公司;4%(体积分数)多聚甲醛通用型固定液,Biosharp公司;3-硝基苯肼·HCl(97%)、吡啶、N-(3-二甲基氨基丙基)-N-乙基碳二亚胺(EDC)·HCl,美国Sigma公司;甲酸(LC-MS级),上海CNW公司;乙腈(LC-MS级)、异丙醇,美国Fisher Scientific公司。
1.1.4 实验设备与仪器
立式低速离心机,德国Eppendorf公司;水浴锅,天津春著科技公司;BHG-8082型恒温培养箱,上海-恒科学仪器有限公司;HG-50高压灭菌锅,日本HIRAYAMA公司;OMNI Bead Ruptor 12均质机,三重四级杆质谱 SCIEX 6500+,美国OMNI公司;Kinetex®2.6 μm EVO C18 100A(2.1 mm×100 mm)色谱柱,美国Phenomenex公司。
1.2 实验方法
1.2.1 菌株的准备
取类干酪乳酪杆菌PC-01直投式菌剂溶于生理盐水中进行梯度稀释,并取合适梯度涂布于MRS平板上。将平板置于37 ℃培养箱培养48 h后进行计数,明确直投式菌剂实际活菌数用于后续实验。
按照每只小鼠每天灌胃0.1 mL菌液计算,将直投式菌剂按比例计算后溶于生理盐水中。为保证菌株活性,灌胃菌液每日现配现用。
1.2.2 动物实验分组
将50只雄性C57BL/6J小鼠随机分为5组,如表1所示,分别为正常组、DSS模型组、PC-01高剂量组、PC-01中剂量组和PC-01低剂量组。
表1 动物实验方案
Table 1 Procedure of mice experiment
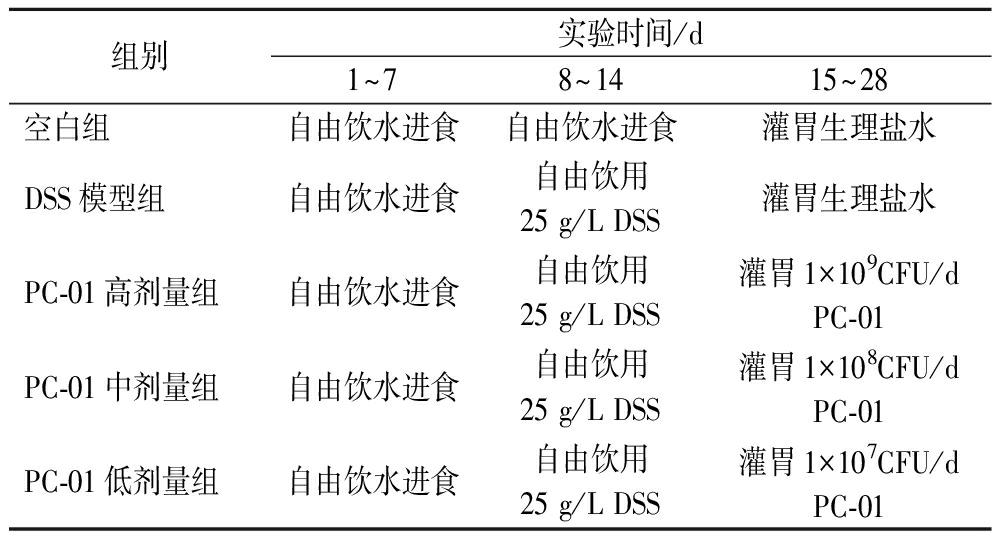
组别实验时间/d1~78~1415~28空白组自由饮水进食自由饮水进食灌胃生理盐水DSS模型组自由饮水进食自由饮用25 g/L DSS灌胃生理盐水PC-01高剂量组自由饮水进食自由饮用25 g/L DSS灌胃1×109CFU/d PC-01PC-01中剂量组自由饮水进食自由饮用25 g/L DSS灌胃1×108CFU/d PC-01PC-01低剂量组自由饮水进食自由饮用25 g/L DSS灌胃1×107CFU/d PC-01
实验模型参照田春雨[10]方案进行修改,所有小鼠在第1~7 天适应性饲喂,自由饮水进食。正常组在整个实验期间自由饮水进食,在第15~28天每天灌胃0.1 mL生理盐水;模型组及各实验组在第8~14天将饮用水换为25 g/L DSS水溶液,其他条件不变,自由饮水进食;模型组在第15~28天每天灌胃0.1 mL生理盐水;各实验组在第15~28天灌胃0.1 mL不同浓度的复溶菌粉,PC-01高剂量组灌胃1×109CFU/d,PC-01中剂量组灌胃1×108CFU/d,PC-01低剂量组灌胃1×107CFU/d。
实验期间根据疾病活动指数评分准则对所有小鼠进行评分,实验结束前1天取各组小鼠粪便。实验结束后取小鼠眼球血、结肠组织于-80 ℃保存,用于后续相关指标测定。
1.2.3 小鼠疾病活动指数(disease activity index,DAI)的测定及评分
根据MURANO等[14]的评分标准,对小鼠进行DAI的测定及评分,评分包含:体重变化、粪便形态及粪便出血3个方面。具体评分标准如表2所示。其中粪便形态分为4个状态,可以用镊子夹起、呈颗粒状且颜色偏深即为正常粪便;可以用镊子夹起,呈颗粒状但易松散为松软但成形粪便;粪便不成形且不易用镊子夹起为稀便;粪便无法用镊子夹起且易黏附于肛门为腹泻。
实验期间第8、11、14、21、24、28 天称量小鼠的体重,收集小鼠粪便观察形态并通过便隐血试剂盒对粪便进行测定。三者得分之和除以3即为小鼠最终的DAI评分。
表2 疾病活动指数评分标准
Table 2 DAI scoring standard

分数体重减少/%粪便形态粪便出血0<1正常便隐血测试阴性11~5松软但成形便隐血测试阳性25~10稀便肉眼可见便血3>10腹泻直肠出血
1.2.4 小鼠结肠长度测量及结肠组织切片
小鼠取眼球血处死后解剖,取出其结肠(盲肠末端至肛门),测量并记录结肠长度。测量后取1 cm左右结肠,放入加有体积分数4%多聚甲醛固定液的离心管中固定。将放入固定液后的结肠室温静置24 h后,送至塞维尔生物科技有限公司进行结肠组织石蜡包埋、H&E染色及数字切片扫描[15]。
1.2.5 小鼠血清中髓过氧化物酶(myeloperoxidase,MPO)及细胞因子的测定
取小鼠眼球血于离心管中,静置2 h后,4 000×g离心10 min,最上层即为血清。将血清分装于PCR管中,冻存于-80 ℃待用。每次取10 μL血清分别按照结肠MPO酶联免疫试剂盒及各细胞因子酶联免疫试剂盒说明书进行样品稀释、加样、孵育、洗涤、显色、孵育、终止及测定。并根据不同浓度标品绘制标准曲线用于后续浓度计算。
1.2.6 小鼠粪便中乳酸及短链脂肪酸的测定
根据蒿雨[16]的方法对小鼠粪便样品进行前处理,并通过UPLC-MS/MS测定粪便中乳酸及短链脂肪酸含量。
1.2.7 数据分析与可视化方法
数据表示为“平均值±标准差”,使用软件SPSS 19.0对数据进行显著性分析,采用t检验或单因素方差分析(ANOVA)。使用软件Origin 2019或R studio绘制数据图。
2 结果与讨论
2.1 小鼠体重变化
图1为各组小鼠在实验期间的体重变化情况。可以表明,在整个实验期间,空白组小鼠除了各取样点(第14、27 天)外,其余时间体重均保持在21~23 g。造模开始前4 d(第11 天),各造模组小鼠体重略有上升,而在造模最后1天(第14 天)各造模组小鼠体重出现了急剧下降。造模结束后,DSS模型组及不同剂量PC-01灌胃组小鼠体重继续下降,这是由于溃疡性结肠炎引起腹痛导致小鼠食欲不振、腹泻所导致的。在灌胃第4天(第18 天)PC-01高剂量组小鼠及DSS组小鼠体重率先开始上升,在灌胃第5天(第19 天)各组小鼠体重均开始回升,并在灌胃第10天(第24 天)开始稳定。可见,高剂量的PC-01对小鼠体重的恢复具有促进作用,这一变化规律也与KIM等[17]实验结果相似。

图1 实验期间小鼠体重
Fig.1 The body weight of mice during the experiment
2.2 小鼠DAI评分
图2为实验期间各组小鼠的DAI评分变化情况。在整个实验期间空白对照组小鼠的DAI评分稳定在0~0.3分。在造模第4天(第11 天),各造模组小鼠出现软便、便隐血的情况,DAI评分开始上升;在造模最后1天(第14 天),各造模组小鼠排稀便或软便,大多数小鼠出现肉眼可见便血,DAI评分达到最高,说明结肠炎造模取得成功;在灌胃1周后(第21 天),各造模组小鼠DAI评分下降,PC-01高、中、低灌胃组均低于DSS组,其中PC-01高剂量组与其他各组相比,DAI评分显著降低(P<0.05),表明菌株PC-01对结肠炎的恢复具有一定的促进作用,且与灌胃剂量有关。在灌胃第10天(第24天)后,各造模组DAI评分之间没有显著性差异(P>0.05)。这一结果与田春雨[10]实验中DAI评分变化趋势相一致,各造模组小鼠在造模完成后DAI评分最高,在恢复期DSS模型组与乳杆菌灌胃组DAI评分均逐步下降,且乳杆菌灌胃组DAI评分显著低于DSS模型组。此外,PAN等[18]的研究表明,灌胃1×1010和1×108CFU/mL类干酪乳杆菌LC-01的结肠炎小鼠DAI评分低于灌胃1×106CFU/mL的结肠炎小鼠,说明同一菌株对DAI评分的改善作用与灌胃剂量相关。
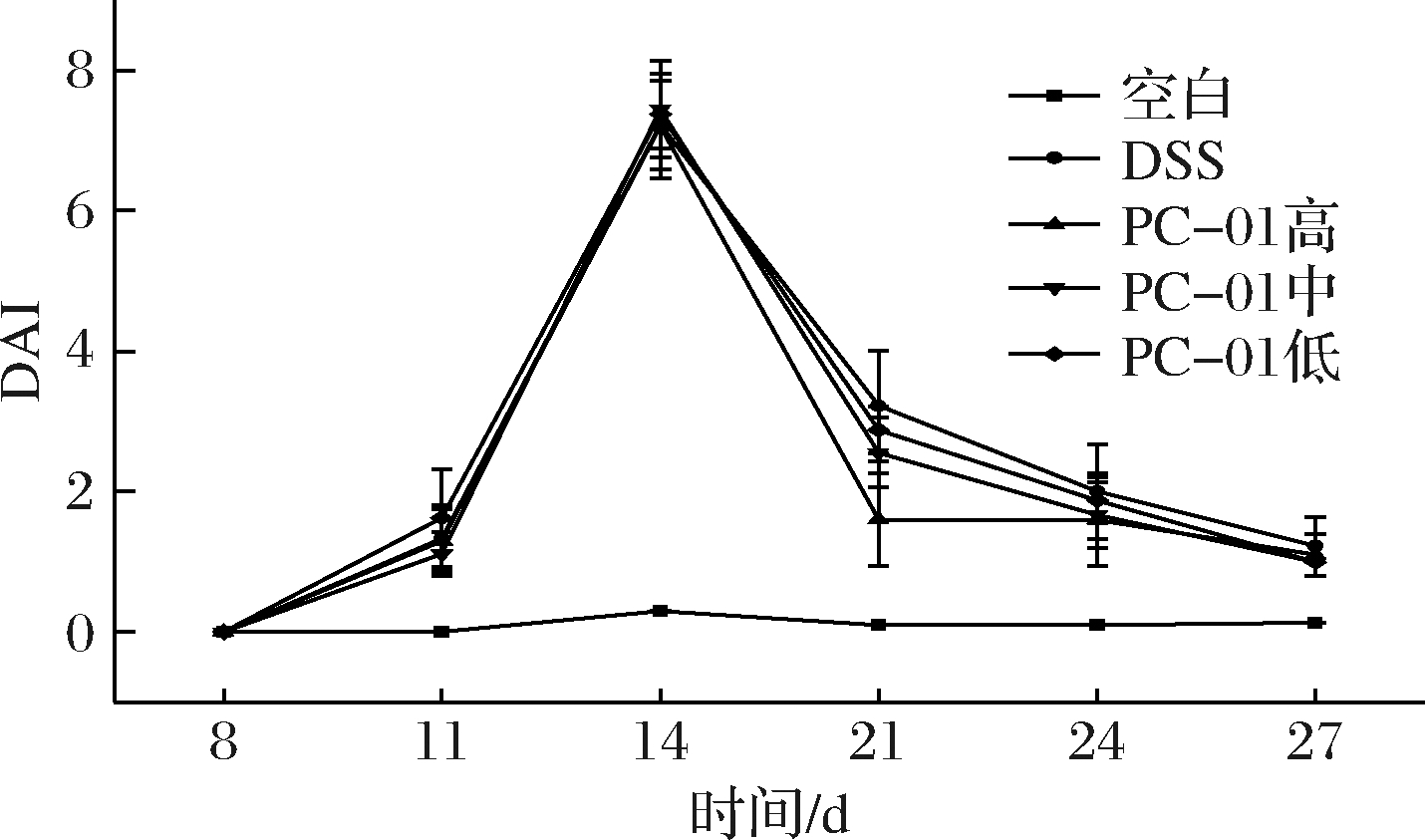
图2 实验期间小鼠DAI评分
Fig.2 The DAI score of mice during the experiment
2.3 小鼠存活率
各组小鼠存活率如图3所示,在适应性饲喂及造模期间各组小鼠未出现死亡,灌胃恢复的第1周出现小鼠死亡情况。
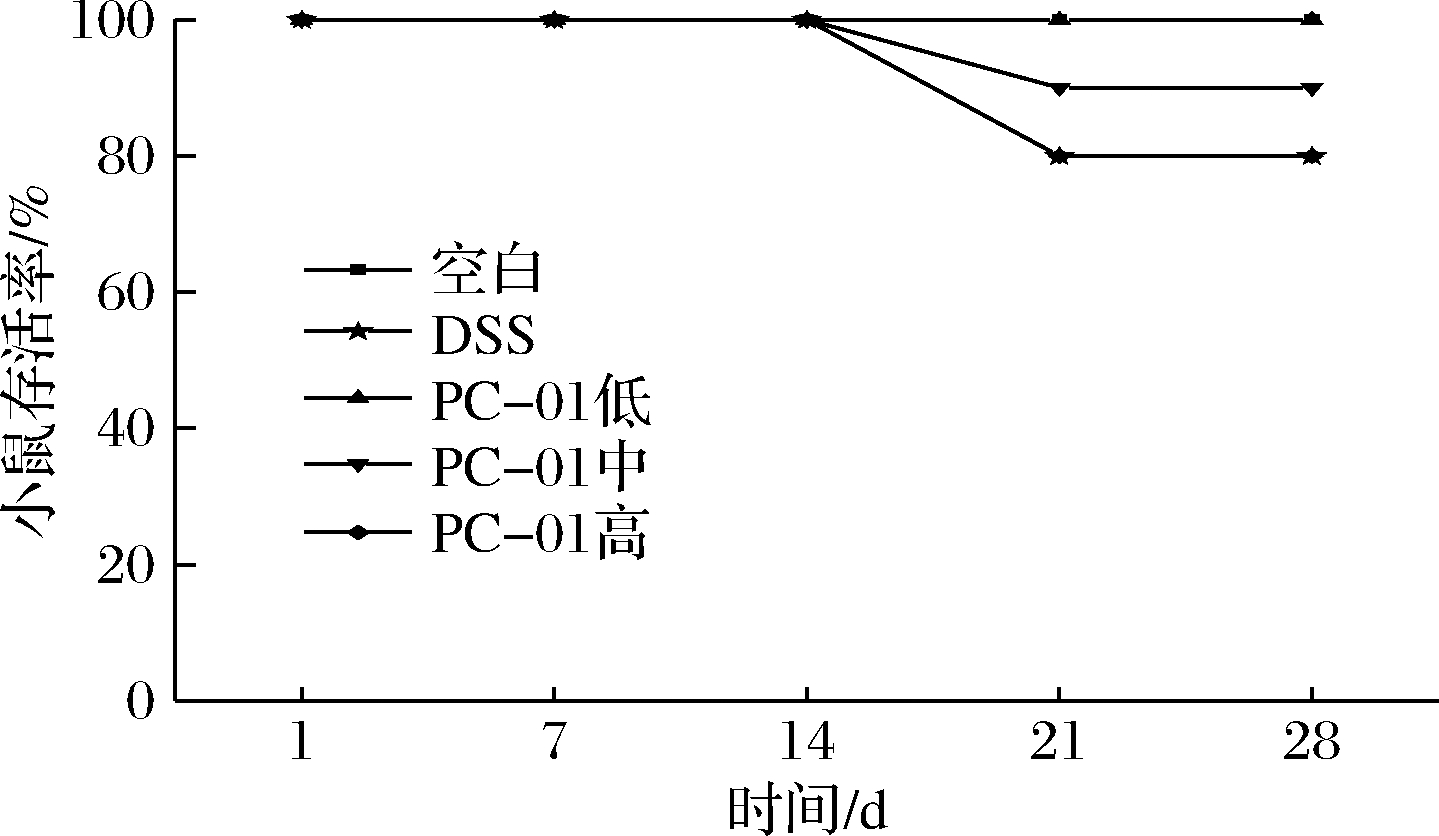
图3 实验期间小鼠存活率
Fig.3 Survival percent of mice during the experiment
经过DSS造模的4组小鼠中,DSS模型组和PC-01低剂量组小鼠各死亡2只,PC-01中剂量组小鼠死亡1只,PC-01高剂量组小鼠未出现死亡。各组死亡小鼠在恢复期体重持续下降,这可能是由于结肠炎引起小鼠进食减少、持续便血所导致的,并最终造成小鼠死亡。此结果表明,灌胃中、高剂量PC-01可以提高结肠炎小鼠的存活率,且存活率与灌胃剂量具有相关性。吴思琪[19]的研究也表明DSS诱导溃疡性结肠炎模型会导致大鼠出现死亡,而植物乳杆菌灌胃可以提高大鼠的存活率。
2.4 小鼠结肠长度及结肠病理组织切片
实验结束后,各组小鼠结肠长度如图4所示。各造模组小鼠结肠长度相较于空白对照组显著降低。各造模组小鼠中,PC-01高剂量组小鼠结肠长度最长,但各组之间并无显著性差异。

图4 小鼠结肠长度
Fig.4 Length of mice colon 注:空白、PC-01高n=10;DSS、PC-01中n=9;PC-01低n=8,(下同)。 小写字母代表差异显著,P<0.05,n表示每组样品数
H&E染色是常用的观察组织损伤的方法,由图5可知,空白组小鼠结肠组织各层结构清晰,黏膜上皮完整,肠腺数量丰富,排列紧密,肌层细胞形态正常,无炎性细胞润湿;DSS组小鼠结肠大范围黏膜上皮缺失,肠腺结构消失,被大量增生的结缔组织取代,无法观察到杯状细胞,黏膜层及黏膜下层可见大量炎性细胞浸润,肠腺上皮细胞增生,肠腺形状不规则,肠腔内可见大量炎性细胞浸出;PC-01高剂量组结肠出现局灶性肠腺结构消失,黏膜层及黏膜下层可见少量的炎性细胞浸润,对结肠组织损伤改善显著;PC-01中、低剂量组出现局灶性黏膜上皮细胞脱落,肠腺结构消失,黏膜层及黏膜下层可见炎性细胞浸润,周围少量肠腺形状不规则,对结肠损伤情况有所缓解但差异不明显。
通过以上结果可以得出,类干酪乳酪杆菌PC-01对结肠炎的组织损伤恢复具有促进作用,且与菌剂灌胃剂量相关,这与PAN等[18]实验结果一致。

a-正常对照组;b-DSS模型对照组;c-PC-01高剂量组; d-PC-01中剂量组;e-PC-01低剂量组
图5 结肠组织H&E染色恢复后小鼠结肠组织切片
Fig.5 Histological analysis of mice colon after recovery stained by H&E
2.5 小鼠血清中MPO及细胞因子浓度
MPO是一种溶酶体蛋白,在嗜中性粒细胞、巨噬细胞和单核细胞中都有发现。MPO可以与氧化氢和卤化物反应生成具有细胞毒性的产物次氯酸,从细胞释放以破坏外来微生物。同时,这类有毒物质也会对机体本身的正常组织造成破坏,进而诱发炎症的产生[20]。许多研究表明,机体中的MPO水平与IBD患者的疾病严重程度成正比。因而常将MPO作为判断结肠炎严重程度的生物标记物,MPO的含量越高,表明炎症情况越严重[21-22]。如图6所示,DSS组中MPO浓度最高,达到了(679.34±90.32)U/L。PC-01高中低剂量组相较于模型组血清中MPO的浓度均显著下降(P<0.05),特别是高剂量组,血清中MPO浓度为(564.83±47.02)U/L与DSS组间存在极显著的差异(P<0.01)。说明菌株PC-01对结肠炎的炎症反应起到了缓解作用,且菌株对炎症的缓解能力与浓度有关。王碧莹[23]通过比较不同剂量乳杆菌Q8-L和LGG对DSS诱导小鼠结肠炎调节能力得到相同结论,乳杆菌对MPO的调节能力与灌胃剂量相关。
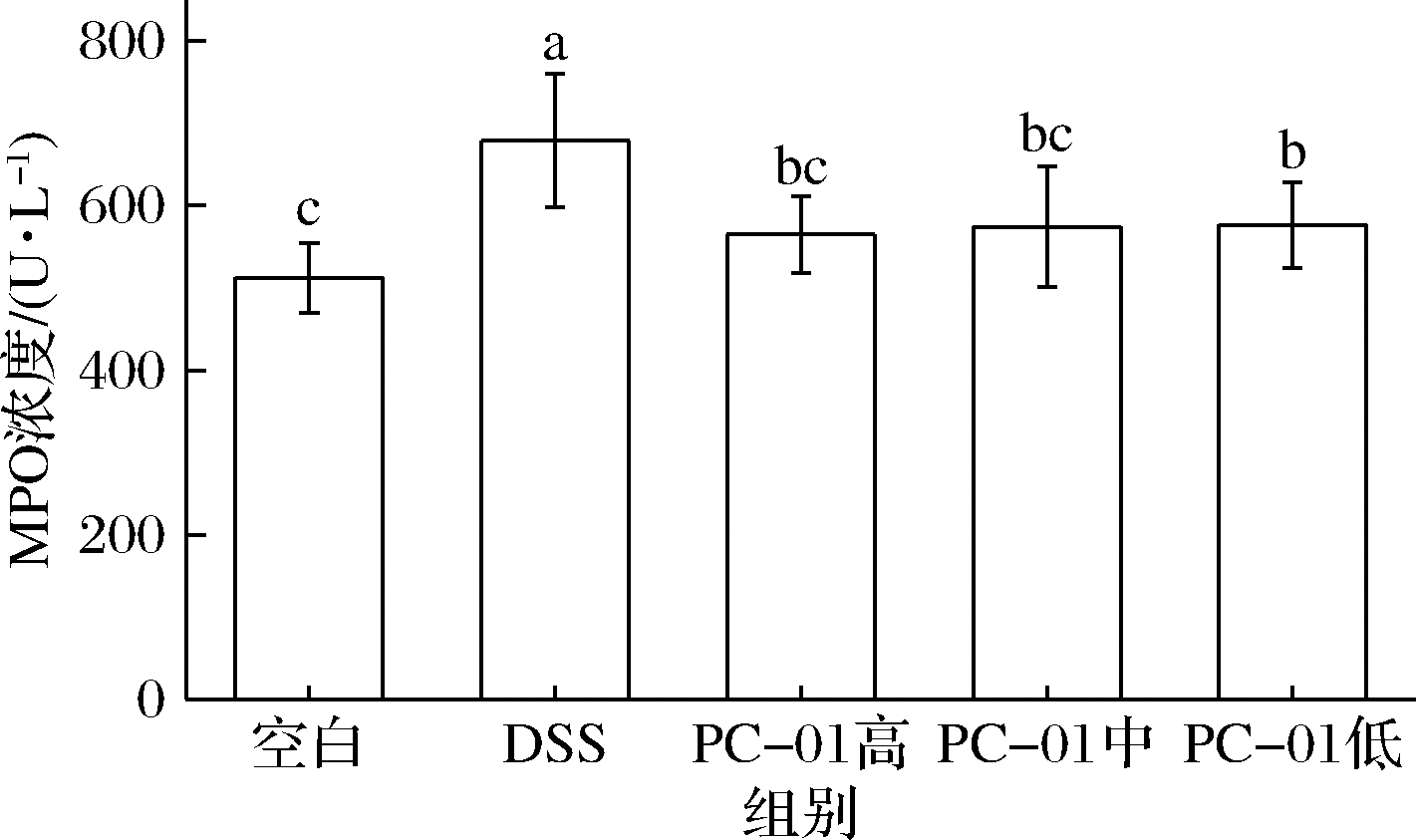
图6 MPO鼠血清中MPO浓度
Fig.6 Concentration of MPO in mice serum
白细胞介素1β(IL-1β)是典型的促炎因子,由IBD患者呈递抗原的关键细胞—肠道固有层树突细胞和巨噬细胞在受到抗原刺激后产生。目前已有研究表明,与正常人群相比,IBD患者肠道黏膜中IL-1受体拮抗剂与IL-1之间的比率显著下降,这说明IBD患者肠道的IL-1产生系统被激活。IL-1β越高,说明炎症越严重[4-5]。恢复结束后DSS模型组及PC-01高、中、低剂量组血清中IL-1β质量浓度分别为(120.40±6.96)、(109.80±8.85)、(113.53±6.49)和(113.42±10.27)pg/mL。如图7所示,小鼠在灌胃不同剂量类干酪乳酪杆菌PC-01后,血清中IL-1β的含量相较于DSS组均有所下降。其中PC-01高剂量组血清中IL-1β含量相较于DSS组显著下降(P<0.05)。结果表明类干酪乳酪杆菌PC-01对小鼠的炎症有所缓解,且缓解程度与灌胃剂量有关,随着菌株PC-01灌胃剂量的升高,血清中IL-1β浓度呈现下降趋势。
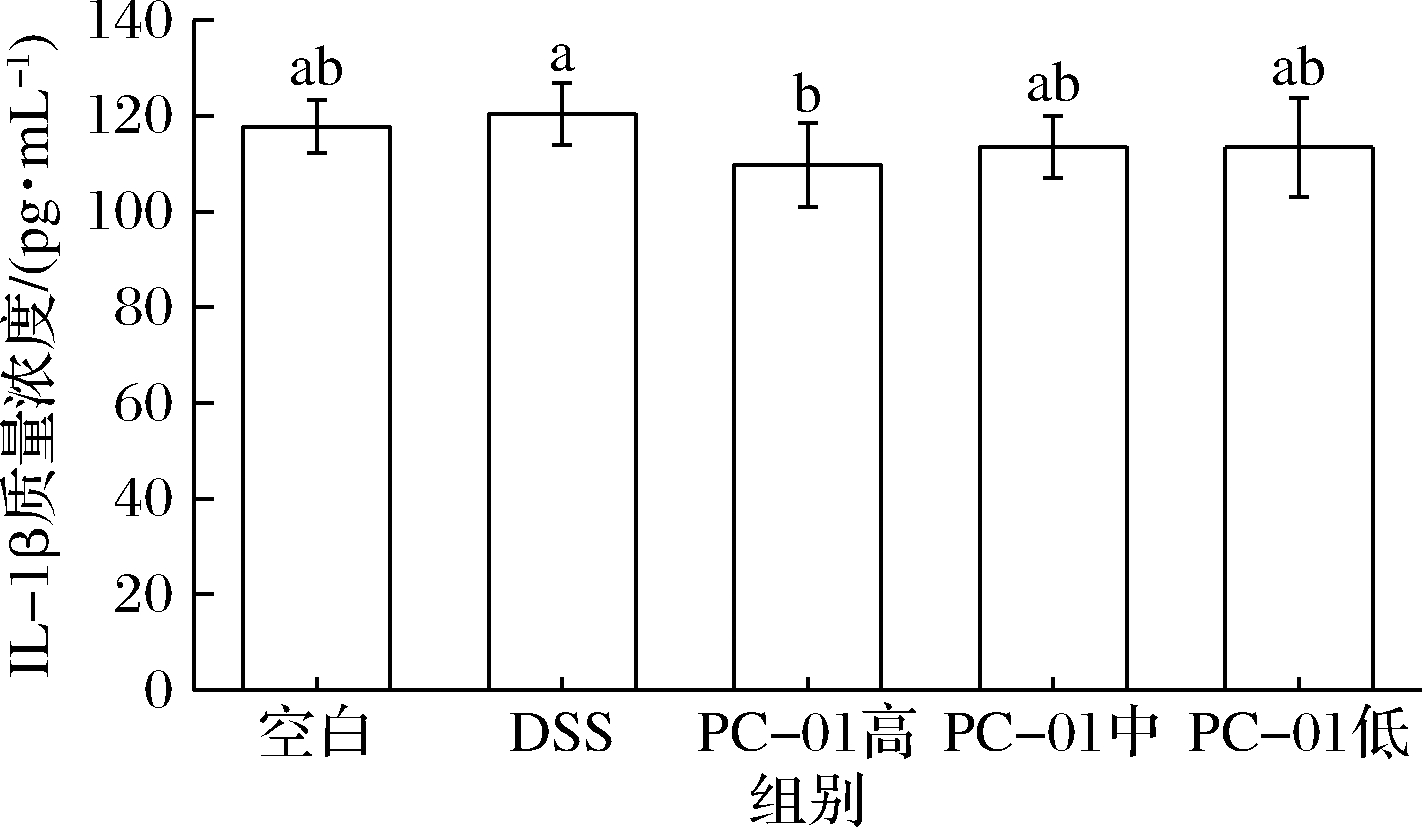
图7 小鼠血清中IL-1β浓度
Fig.7 Concentration of IL-1β in mice serum
IL-6的生物学功能广泛,是一种典型的炎症促进因子。研究表明,IL-6由巨噬细胞产生并且参与T淋巴细胞的活化。在结肠炎患者体内,IL-6与可溶性IL-6R(sIL-6R)结合,生成的IL-6-sIL-6R复合物通过与gp130表面分子结合从而激活肠道上的靶细胞[24]来发挥促炎功能。此外,IL-6-sIL-6R复合物还可以防止黏膜T细胞的凋亡,同时刺激这些细胞产生促炎因子[5]。
由图8可知,DSS模型组小鼠血清中IL-6质量浓度最高,达到(99.45±7.79)pg/mL。灌胃不同剂量类干酪乳酪杆菌PC-01后血清中IL-6质量浓度相较于DSS组均有不同程度的下降,其中PC-01高、中剂量组血清中IL-6质量浓度分别为(88.7±4.83)和(90.54±4.16)pg/mL,相比DSS组显著下降(P<0.05)。
在以往的一些研究中也发现,乳酸菌的摄入可以通过降低小鼠血清中促炎因子的含量来抑制炎症反应,且抑制作用与乳酸菌灌胃剂量相关[18, 23]。

图8 小鼠血清中IL-6浓度
Fig.8 Concentration of IL-6 in mice serum
IL-10是一种炎症抑制因子,能够降低抗原呈递,进而抑制抗炎因子的产生,通过负反馈调节,抑制巨噬细胞和T细胞的效应功能,降低炎症反应的程度。除此之外,IL-10还可以调节免疫系统和微生物之间的相互作用,使肠道处于动态平衡。ROERS等[25]的研究证实,IL-10、IL-10R基因缺陷型小鼠都会发展为自发性结肠炎。肠道中许多细胞(例如单核吞噬细胞和B细胞)都能产生IL-10,特别是CD4+T(cluster of differentiation 4 receptors)细胞,被证实是产生IL-10的关键细胞。GABRY OV
OV 等[26]通过实验证明转录因子c-Maf(musculoaponeurotic fibrosarcoma)是驱动CD4+T细胞、Treg(T-regulatory cells)细胞和Tr1(Type 1 regulatory T cell)产生IL-10的关键。
等[26]通过实验证明转录因子c-Maf(musculoaponeurotic fibrosarcoma)是驱动CD4+T细胞、Treg(T-regulatory cells)细胞和Tr1(Type 1 regulatory T cell)产生IL-10的关键。
由图9可知,在经过DSS诱导后,各造模组小鼠血清中IL-10的含量都有不同程度的上升。相较于DSS模型组,PC-01高剂量组和PC-01中剂量组小鼠血清中IL-10分别提高了16.28和5.45 pg/mL,但无统计学上差异(P>0.05)。由此得到,灌胃菌株PC-01对结肠炎小鼠血清中炎症抑制因子的含量有一定的上调作用,且与灌胃剂量呈正比,这一结果与王碧莹[23]研究相一致。此外,吴思琪[19]的研究中分别测定了相同细胞因子在血清及结肠组织中的含量,结果表明,各组大鼠结肠和血清中细胞因子整体变化趋势相一致,部分细胞因子在不同环境中测定结果的显著性存在差异。在后续的研究中可以通过多方面结果比较,更全面分析菌株干预对炎症水平的影响。

图9 小鼠血清中IL-10浓度
Fig.9 Concentration of IL-10 in mice serum
2.6 小鼠粪便中乳酸及短链脂肪酸的含量
在一般情况下,肠道中乳酸的含量较低。在摄入乳杆菌属和双歧杆菌属的菌株后,会促进回肠和结肠中乳酸的积累。WATANABE等[27]研究表明,Lactobacillus caseiShirota的摄入可以提高小肠中乳酸的浓度,进而降低了中性粒细胞的润湿程度和炎症因子的表达,抑制药物引起的小肠损伤。根据RANGANATHAN等[7]和ERREA等[6]研究,揭示了乳酸通过激活GPR81表达进而调节肠道稳态和抑制肠炎的新机制,对结肠炎的预防和治疗有着重要影响。如图10所示,在恢复期结束后(28 d),各造模组小鼠粪便中乳酸的含量都有所提升,特别是灌胃类干酪乳酪杆菌PC-01的各组。其中PC-01高、中剂量组小鼠粪便中乳酸质量分数分别为(858.97±411.93)和(810.95±238.54)μg/g,相较于DSS对照组乳酸质量分数(443.91±279.32)μg/g显著上升(P<0.05),这可是能是PC-01灌胃组促炎因子浓度降低,结肠损伤缓解的原因之一。

图10 小鼠粪便中乳酸浓度
Fig.10 Concentration of lactic acid in mice faeces
短链脂肪酸是通过膳食纤维在肠道厌氧发酵产生。研究表明,短链脂肪酸可以直接调节免疫细胞的分裂和信号的传递进而影响巨噬细胞和粒细胞的功能、树突细胞的抗原呈递功能以及通过影响T细胞和B细胞进而影响免疫反应。此外,还可以通过维持结肠上皮细胞屏障稳态,调节细胞因子的分泌进而间接预防和治疗结肠炎[8]。
由图11可知,PC-01高剂量组中乙酸和丁酸的含量相较于对照组有所提升,但各造模组之间无显著性差异(P>0.05);各组粪便中丙酸的含量也无显著性差异(P>0.05);相较于DSS模型组,灌胃类干酪乳酪杆菌PC-01的各组小鼠粪便中戊酸含量都有不同程度的升高;特别是PC-01高剂量组,戊酸含量显著提高(P<0.05)。
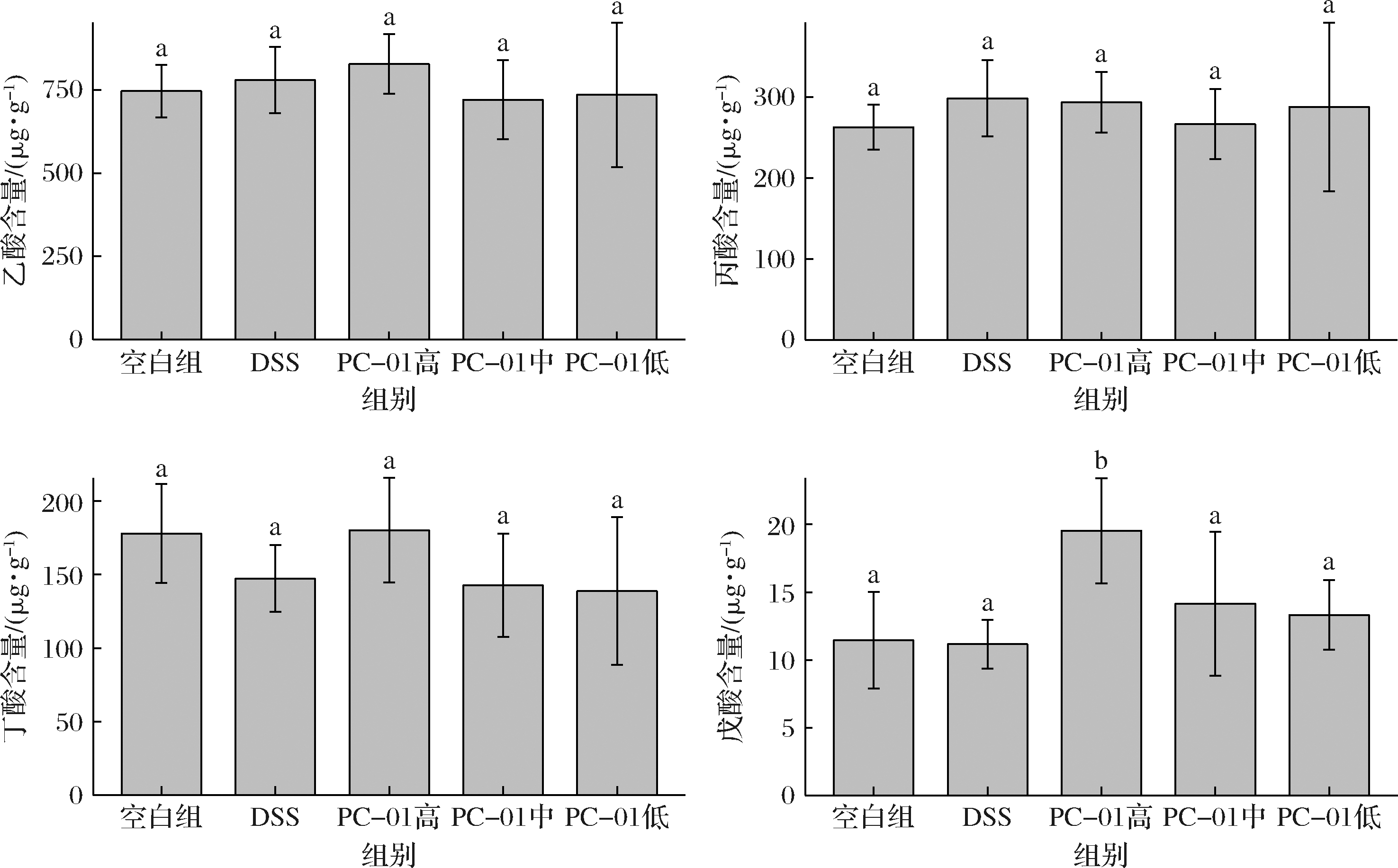
图11 小鼠粪便中短链脂肪酸浓度
Fig.11 Concentration of SCFAs in mice faeces
王彦博[28]与郑雨星等[29]研究表明,乳酸菌可以通过提高DSS造模小鼠结肠中乳酸及部分短链脂肪酸的含量来达到抑制炎症、改善结肠损失的效果,但并非所有具有改善炎症效果的菌株均能提高结肠中有机酸的含量。
3 结论
本实验通过DSS诱导小鼠结肠炎模型,评价了不同灌胃剂量类干酪乳酪杆菌PC-01对小鼠结肠炎恢复的促进作用。结果表明,菌株PC-01对小鼠结肠炎的恢复起到了促进作用,且小鼠结肠炎的恢复情况与PC-01的剂量有关,当灌胃高剂量(1×109CFU/d)的菌株PC-01时,对小鼠结肠炎的恢复的促进最为明显。灌胃高剂量PC-01加快了结肠炎小鼠体重的回升;在恢复1周时,高剂量的PC-01灌胃显著降低了小鼠的DAI评分,同时提高了小鼠的存活率。在恢复2周后(第28 天),各造模组小鼠DAI评分无显著性差异。结肠组织切片结果表明,DSS诱导结肠炎会引起结肠组织隐窝消失,结缔组织增生以及炎性细胞浸润,灌胃高剂量的PC-01可以明显减少结肠炎性细胞浸润范围,维持隐窝结构完整。同时,灌胃中、高剂量的PC-01可以显著降低第28 天时小鼠血清中髓过氧化物酶及促炎因子IL-1β和IL-6的含量,对于抑炎因子IL-10含量有提高作用但无显著性。对第28 天小鼠粪便中有机酸含量进行测量,显示PC-01高剂量组粪便中乳酸以及短链脂肪酸中戊酸含量相较于DSS模型组显著上升;PC-01中剂量组粪便中乳酸含量较于DSS组显著上升。
[1] RAMOSG P, PAPADAKIS K A.Mechanisms of disease:Inflammatory bowel diseases[J].Mayo Clinic Proceedings, 2019, 94(1):155-165.
[2] KHANI, ULLAH N, ZHA L J, et al.Alteration of gut microbiota in inflammatory bowel disease (IBD):Cause or consequence? IBD treatment targeting the gut microbiome[J].Pathogens (Basel, Switzerland), 2019, 8(3):126.
[3] 杨勇,刘作义.炎症性肠病[J].中国临床医生, 2009, 37(2):21-24.
YANG Y, LIU Z Y.Inflammatory bowel disease[J].Chinese Journal for Clinicians, 2009, 37(2):21-24.
[4] FRIEDRICHM, POHIN M, POWRIE F.Cytokine networks in the pathophysiology of inflammatory bowel disease[J].Immunity, 2019, 50(4):992-1 006.
[5] NEURATHM F.Cytokines in inflammatory bowel disease[J].Nature Reviews Immunology, 2014, 14(5):329-342.
[6] ERREAA, CAYET D, MARCHETTI P, et al.Lactate inhibits the pro-inflammatory response and metabolic reprogramming in murine macrophages in a GPR81-independent manner[J].PLoS One, 2016, 11(11):e0163694.
[7] RANGANATHANP, SHANMUGAM A, SWAFFORD D, et al.GPR81, a cell-surface receptor for lactate, regulates intestinal homeostasis and protects mice from experimental colitis[J].Journal of Immunology (Baltimore, Md.:1950), 2018, 200(5):1 781-1 789.
[8] PARADAVENEGAS D, DE LA FUENTE M K, LANDSKRON G, et al.Short chain fatty acids (SCFAs)-mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases[J].Frontiers in Immunology, 2019, 10:277.
[9] ZHUANGX J, LI T, LI M Y, et al.Systematic review and meta-analysis:Short-chain fatty acid characterization in patients with inflammatory bowel disease[J].Inflammatory Bowel Diseases, 2019, 25(11):1 751-1 763.
[10] 田春雨.乳酸杆菌对DSS-诱导的小鼠溃疡性结肠炎的抑制作用[D].哈尔滨:哈尔滨工业大学, 2018.
TIAN C Y.Lactobacillusinhibits dss-induced ulcerative colitis in mice[D].Harbin:Harbin Institute of Technology, 2018.
[11] CHENC L, HSU P Y, PAN T M.Therapeutic effects of Lactobacillus paracaseisubsp.paracaseiNTU 101 powder on dextran sulfate sodium-induced colitis in mice[J].Journal of Food and Drug Analysis, 2019, 27(1):83-92.
[12] HUANGJ, YANG Z Y, LI Y Y, et al.Lactobacillus paracaseiR3 protects against dextran sulfate sodium (DSS)-induced colitis in mice via regulating Th17/Treg cell balance[J].Journal of Translational Medicine, 2021, 19(1):356.
[13] 刘凯龙,康小红, 张哲, 等.副干酪乳杆菌PC-01益生特性和安全性研究[J].中国食品学报, 2021, 21(11):47-52.
LIU K L, KANG X H, ZHANG Z, et al.Studies on probiotic properties and safety of Lactobacillus paracaseiPC-01[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(11):47-52.
[14] MURANOM, MAEMURA K, HIRATA I, et al.Therapeutic effect of intracolonically administered nuclear factor κB (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis[J].Clinical and Experimental Immunology, 2001, 120(1):51-58.
[15] 王俊通.产共轭亚油酸乳酸菌对DSS诱导小鼠结肠炎的改善作用[D].无锡:江南大学, 2016.
WANG J T.Ameliorating effects of CLA-producing lactic acid bacteria on DSS-induced colitis in mice[D].Wuxi:Jiangnan University, 2016.
[16] 蒿雨.植物乳杆菌P9对农药暴露人群粪便胆汁酸和短链脂肪酸代谢的影响[D].呼和浩特:内蒙古农业大学, 2021.
HAO Y.Effect of Lactobacillus plantarumP9 on fecal bile acid and short-chain fatty acids metabolism of populations exposed to pesticide[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[17] KIMD H, KIM S, AHN J B, et al.Lactobacillus plantarumCBT LP3 ameliorates colitis via modulating T cells in mice[J].International Journal of Medical Microbiology, 2020, 310(2):151391.
[18] PANT, GUO H Y, ZHANG H, et al.Oral administration of Lactobacillus paracaseialleviates clinical symptoms of colitis induced by dextran sulphate sodium salt in BALB/c mice[J].Beneficial Microbes, 2014, 5(3):315-322.
[19] 吴思琪.植物乳杆菌Zhang-LL对DSS诱导大鼠慢性溃疡性结肠炎预防效果评价[D].北京:北京农学院, 2018.
WU S Q.Effect on DSS-induced chronic ulcerative colitis in rats of Lactobacillus plantarumZhang-LL[D].Beijing:Beijing University of Agriculture, 2018.
[20] CHAMIB, MARTIN N J J, DENNIS J M, et al.Myeloperoxidase in the inflamed colon:A novel target for treating inflammatory bowel disease[J].Archives of Biochemistry and Biophysics, 2018, 645:61-71.
[21] BOUGHTON-SMITHN K, WALLACE J L, WHITLE B J R.Relationship between arachidonic acid metabolism, myeloperoxidase activity and leukocyte infiltration in a rat model of inflammatory bowel disease[J].Agents and Actions, 1988, 25(1):115-123.
[22] HANSBERRYD R, SHAH K, AGARWAL P, et al.Fecal myeloperoxidase as a biomarker for inflammatory bowel disease[J].Cureus, 2017, 9(1):e1004.
[23] 王碧莹.四株乳酸杆菌对溃疡性肠道炎症的调节作用研究[D].哈尔滨:哈尔滨工业大学, 2017.
WANG B Y.Effect of four strains of Lactobacilluson ulcerative intestinal inflammation[D].Harbin:Harbin Institute of Technology, 2017.
[24] MUDTERJ, NEURATH M F.Il-6 signaling in inflammatory bowel disease:Pathophysiological role and clinical relevance[J].Inflammatory Bowel Diseases, 2007, 13(8):1 016-1 023.
[25] ROERSA, SIEWE L, STRITTMATTER E, et al.T cell-specific inactivation of the interleukin 10 gene in mice results in enhanced T cell responses but normal innate responses to lipopolysaccharide or skin irritation[J].The Journal of Experimental Medicine, 2004, 200(10):1 289-1 297.
[26] GABRY OV
OV L, HOWES A, SARAIVA M, et al. Interleukin-10 in Health and Disease.Berlin[M]. Heidelberg:Springer, 2014:157-190.
L, HOWES A, SARAIVA M, et al. Interleukin-10 in Health and Disease.Berlin[M]. Heidelberg:Springer, 2014:157-190.
[27] WATANABET, NISHIO H, TANIGAWA T, et al.Probiotic Lactobacillus caseistrain Shirota prevents indomethacin-induced small intestinal injury:Involvement of lactic acid[J].American Journal of Physiology.Gastrointestinal and Liver Physiology, 2009, 297(3):G506-G513.
[28] 王彦博.功能各异的益生菌复合缓解DSS诱导的溃疡性结肠炎机制研究[D].长春:吉林大学, 2019.
WANG Y B.Study on the mechanism of alleviating DSS-induced ulcerative colitis by the combination of probiotics with different functions[D].Changchun:Jilin University, 2019.
[29] 郑雨星,朱慧越, 焦婷, 等.鼠李糖乳杆菌FZJTZ46L6通过影响肠道内短链脂肪酸的水平缓解小鼠由葡聚糖硫酸钠导致的结肠炎[J].食品与发酵工业, 2020, 46(10):44-52.
ZHENG Y X, ZHU H Y, JIAO T, et al.Lactobacillus rhamnosusFZJTZ46L6 alleviates colitis induced by dextran sulfate sodium in mice through short-chain fatty acids regulation[J].Food and Fermentation Industries, 2020, 46(10):44-52.