我国新疆喀什地区是包括维吾尔族、哈萨克族、乌孜别克族等少数民族聚居的地区,多民族饮食习惯的融合使当地自然发酵酸奶具有丰富的营养价值和良好的保健功效,而且酸奶中的发酵微生物也具有抗性强、多样性好的特点,具有很好的应用潜力,极具发掘的价值[1]。
人类衰老过程中,机体各器官和组织的机能减弱,包括肌肉活动能力减弱,由于器官和肌肉功能衰退,机体的运动能力会随之下降。有研究表明长跑运动员的白细胞端粒酶活性高于普通人,良好运动能力可能会延缓衰老,同时长跑运动员的心率较慢、血压和胆固醇水平较低,这些状态都直接体现出运动能力与衰老有关联[2]。保持持续良好的运动能力对心血管系统的功能具有增强作用,良好的运动能力还可以促进新陈代谢,延缓动脉硬化,减轻器官衰退引发的疾病[3]。此外,衰老引起疲劳的原因较为复杂,体内能量物质的吸收和消耗平衡失调、有害代谢物质的积累、机体内循环的紊乱等。机体衰老引起的器官和肌肉功能下降、疲劳感增强都导致运动能力下降;保持合理的运动则可以改善人体机能、缓解身体的疲劳状态,保持机体活力,因此机体衰老和运动能力是相互影响的,机体健康既是良好运动能力的体现,良好的运动能力又能够促进持续运动,从而延缓衰老[4]。研究显示,乳酸菌通过肠道定殖抑制肠道内的有害菌,减少有毒物质在肠道中的积累;另外,乳酸菌的代谢产物或自身也可以作为益生元改善肠道环境,促进其他有益菌的增殖,这些途径都可以改善肠道菌群,从而提高肠屏障功能,起到延缓衰老的作用[5]。
机体的衰老过程是人体组织细胞不断产生的自由基持续积累的结果,自由基的积累导致 DNA 损伤,从而导致机体的衰老、器官功能的衰退和疾病的频发。同时,机体的衰老过程中体内的抗氧化酶活性和非酶抗氧化能力均明显下降,引起体内自由基持续积累,导致正常的代谢受到影响,使机体的疲劳度增强,运动能力随之下降,造成老年人群的生活质量下降。为了保持器官和组织的正常运转和健康状态,机体持续的抵抗氧化应激,减缓活性氧导致的机体衰老[6]。因此, 氧化应激、衰老和运动能力之间具有密切的联系,通过干预机体抗氧化能力,增强运动机能既是延缓衰老的有效途径;同时,机体衰老的减缓又使机体器官活力和肌肉活性加强,从而促进运动机能的加强。
来自于自然发酵食品的乳酸菌已经体现出良好的抗氧化作用,其中有发酵乳杆菌发挥了抗氧化效果和运动能力增强的作用[7]。本研究中的研究菌株Lactobacillus delbrueckii subsp.bulgaricusKSFY07(LDSBKSFY07)是本团队分离于喀什地区自然发酵酸奶的乳酸菌,通过D-半乳糖衰老小鼠模型,观察了LDSBKSFY07提高运动能力的效果,从而起到减轻氧化和衰老程度的作用,为进一步研究和利用LDSBKSFY07提供了理论依据,有利于具有自主知识产权益生菌资源的发掘和功能开发。
1 材料与方法
1.1 材料与试剂
Lactobacillus delbrueckiisubsp.bulgaricusKSFY07是本团队从新疆喀什地区牧民家庭采集到的自然发酵酸奶中分离并经16S rDNA鉴定出的一株乳酸菌,该菌株被专利保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号CGMCC 15714。
SPF级6周龄的昆明小鼠,雌雄各半,购自于重庆医科大学实验动物中心,生产许可证号为SCXK(渝)2018—0003。本动物实验经重庆市功能性食品协同创新中动物实验伦理委员会批准实施,批准号为2021070011B。
血尿素氮(blood urea nitrogen,BUN)、血乳酸(blood lactic acid,BLA)、丙二醛(malondialdehyde,MDA)、肝糖原(hepatic glycogen,HG)、肌糖原(muscle glycogen,MG)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒,上海酶联生物科技有限公司;TRIzol试剂,美国Invitrogen公司;苏木精-伊红(hematoxylin-eosin,H&E)染色剂,北京索莱宝科技有限公司;SYBR Green PCR Master Mix、qPCR引物,美国赛默飞世尔公司;MRS肉汤,青岛海博生物技术有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
YH-CS动物自主活动转轮笼系统,武汉一鸿科技有限公司;BX43显微镜,日本奥林巴斯公司;Nicolet Evolution 300紫外分光光度计、StoponePlus实时荧光定量PCR仪,美国赛默飞世尔公司。
1.3 实验方法
1.3.1 乳酸菌制备
将冻存的LDSBKSFY07菌种复苏接种于灭菌的MRS肉汤中,然后在37 ℃下培养24 h。然后吸取3 mL的上述含菌培养基置于5 mL的灭菌离心管中进行离心分离(3 000 r/min、10 min),将上层培养基丢弃后在下层菌体中加入3 mL的灭菌生理盐水后摇匀制成菌悬液,接着涂布于MRS固体培养基上后在37 ℃下培养48 h。挑取培养基上存活的乳酸菌于灭菌的MRS肉汤中,继续在37 ℃下培养24 h,然后离心分离(3 000 r/min、10 min)后根据下层菌量适当的加入蒸馏水摇匀,得到存活的LDSBKSFY07菌悬液,分光光度法测定菌悬液浓度后将LDSBKSFY07稀释为1.875×108CFU/mL的菌液待用。
1.3.2 动物模型
50只小鼠在(20±1)℃、相对湿度30%~40%下适应性喂养7 d,然后将小鼠平均分为5组,每组10只,分为正常组、衰老模型组、维生素C灌胃(Vc)组、LDSBKSFY07低剂量灌胃(LDSBKSFY07-L)组和LDSBKSFY07高剂量灌胃(LDSBKSFY07-H)组。根据《中国居民膳食指南科学研究报告(2021)》中人体每日维生素C摄入安全量(1 000 mg/d)计算出实验小鼠摄入维生素C的计量为150 mg/kg BW[8];根据GB/T 21732—2008《含乳饮料》中规定出厂时活菌型乳饮料需要达到每mL不低于107个活菌[9],结合市售益生菌饮料的建议每日摄入量,每日摄入益生菌建议量为1010个活菌,折合为小鼠摄入剂量为1.5×109CFU/kg BW[10]。实验周期为10周,实验开始后除正常组外其余各组小鼠每日按100 mg/kg BW剂量腹腔注射质量分数为5%的D-半乳糖溶液,持续6周[7],正常组小鼠则腹腔注射生理盐水(0.01 mL/kg BW)。从第7周开始正常组和衰老模型组小鼠每日灌胃蒸馏水(0.01 mL/kg BW),Vc组小鼠每日按剂量150 mg/kg BW灌胃维生素C,LDSBKSFY07-L和LDSBKSFY07-H组小鼠每日按剂量0.75×109和1.50×109CFU/kg BW灌胃LDSBKSFY07,持续灌胃4周。10周后小鼠进行跑步和力竭游泳实验,对小鼠采用毛细管眼眶取血后断颈法处死所有小鼠,解剖取小鼠肝脏、肾脏和骨骼肌待用。
1.3.3 小鼠跑步实验
灌胃样品实验结束后将小鼠跑步滚轮设置为20 r/min,强迫小鼠在滚轮上进行跑步,小鼠停止跑步时进行电击,连续电击5次,直到力竭,记录此过程的跑步时间。
1.3.4 小鼠力竭游泳实验
灌胃样品实验结束后将小鼠置于(28±2) ℃、深度为20 cm的自制恒温水箱中,保持小鼠持续游泳,直至小鼠出现下沉且不能浮到水面超过10 s,以此判定为小鼠为力竭,并记录此过程的游泳时间。
1.3.5 小鼠血清指标测定
眼眶取血并离心(4 ℃、1 500 r/min、10 min),分离出上层血清,然后分别按BUN、BLA、MDA、HG、MG、SOD和GSH-Px检测试剂盒中提供的方法进行测定[7]。
1.3.6 小鼠组织切片制作
解剖小鼠取到的肾脏、肝脏和骨骼肌组织用生理盐水清洗3次后即刻用体积分数10%的甲醛水溶液固定。然后将固定的组织置于4 ℃环境下脱水处理48 h,然后采用石蜡对组织样品进行包埋,再将包埋的组织切成5~10 μm薄片后用H&E染料染色,最后在光学显微镜下观察组织的病理变化[7]。
1.3.7 小鼠组织mRNA的表达检测
称取0.2 g小鼠的肝脏、肾脏和骨骼肌组织,用生理盐水洗净后在组织中各加入1.8 mL的生理盐水,匀浆后加入1.0 mL RNAzol溶液对组织中的RNA进行提取。然后测定RNA提取液在260和280 nm处的吸光度值,计算OD260/OD280后调整RNA的浓度为1 μg/μL。反转录后配制cDNA反应体系,体系溶液包括cDNA(1 μL)、SYBR Green PCR Master Mix(10 μL)、上游引物(1 μL)、下游引物(1 μL)和无菌蒸馏水(7 μL),引物序列如表1所示。反应溶液配制好后置于实时荧光定量PCR仪中,在设定条件下(95 ℃下60 s和95 ℃下15 s反应40个循环,然后55 ℃下30 s、72 ℃下35 s、95 ℃下30 s、55 ℃下35 s反应)进行mRNA的扩增,以GAPDH为内参,按2-ΔΔCt法计算各基因的相对表达强度[7]。
表1 本实验中使用的引物序列
Table 1 Primer sequences used in this experiment

名称上游引物序列下游引物序列Cu/Zn-SOD5′-AACCAGTTGTGTTGTGAGGAC-3′5′-CCACCATGTTTCTTAGAGTGAGG-3′Mn-SOD5′-CAGACCTGCCTTACGACTATGG-3′5′-CTCGGTGGCGTTGAGATTGTT-3′CAT5′-GGAGGCGGGAACCCAATAG-3′5′-GTGTGCCATCTCGTCAGTGAA-3′nNOS5′-TCGTCCAACTTCTGGGCTCTT-3′5′-CCTTCTCTTCCTCCCCTCTCTTC-3′iNOS5′-CAAAGGCTGTGAGTCCTGCAC-3′5′-ACTTTGATCAGAAGCTGTCCC-3′TNF-α5′-ATGGGGGGCTTCCAGAA-35′-CCTTTGGGGACCGATCA-3′Syncytin-15′-GTTAACTTTGTCTCTTCCAGAATCGA-3′5′-CATCAGTACGTGGGCTAGCA-3′GAPDH5′-TGACCTCAACTACATGGTCTACA-3′5′-CTTCCCATTCTCGGCCTTG-3′厚壁菌门5′-GCGTGAGTGAAGAAGT-3′5′-CTACGCTCCCTTTACAC-3′拟杆菌门5′-ACGCTAGCTACAGGCTTAACA-3′5′-ACGCTACTTGGCTGGTTCA-3′乳酸杆菌5′-CACCGCTACACATGGAG-3′5′-AGCAGTAGGGAATCTTCCA-3′双歧杆菌5′-TCGCGTCYGGTGTGAAAG-3′5′-CCACATCCAGCRTCCAC-3′总菌5′-ACTCCTACGGGAGGCAGCAGT-3′5′-ATTACCGCGGCTGCTGGC-3′
1.3.8 小鼠肠道内容物中微生物的mRNA表达测定
解剖小鼠后取大肠内0.2 g的内容物,根据1.3.7组织中mRNA的测定方法对小鼠肠道内容物中微生物的mRNA表达进行测定,用以观察小鼠肠道中的微生物组成,各菌的引物序列如表1。
1.4 数据统计学分析
对实验对象每只小鼠进行数据测定,结果以平均值±标准偏差进行表示。同时使用SPSS软件单因素方差法检验,各组实验结果间在P<0.05水平上是否有显著差异。
2 结果与分析
2.1 LDSBKSFY07对衰老小鼠运动能力的影响
由表2可知正常组小鼠跑步和力竭游泳时间均为各组中最长,而衰老模型组时间则最短。
表2 小鼠的跑步和力竭游泳时间
Table 2 Running and exhaustive swimming times in mice

组别跑步时间/s力竭游泳时间/s正常组55.68±2.17a354.23±24.69a衰老模型组30.88±2.05d173.05±19.81dVc组40.83±2.21c238.74±20.63cLDSBKSFY07-L组39.89±2.41c236.36±19.29cLDSBKSFY07-H组47.25±1.88b286.93±21.37b
注:不同小写字母表示组间有显著差异(P<0.05)(下同)
相比衰老模型组,LDSBKSFY07和维生素C均能显著(P<0.05)延长衰老小鼠的跑步和力竭游泳时间,且LDSBKSFY07-H的延长效果最好,效果显著优于LDSBKSFY07-L和Vc组。
2.2 小鼠血清中的 BUN、BLA、MDA、HG、MG、SOD 和 GSH-Px 水平
如表3所示,正常组小鼠血清中的 BUN、BLA、MDA水平均显著低于其他各组(P<0.05),而HG、MG水平和SOD、GSH-Px酶活力则显著高于其他组(P<0.05)。而衰老模型组以上指标呈现出和正常组相反的趋势。相对衰老模型组,LDSBKSFY07和Vc组可以使衰老小鼠血清中的BUN、BLA、MDA水平下降,而使HG、MG水平和SOD、GSH-Px酶活力升高,且LDSBKSFY07-H可以使这些血清指标最接近正常组。
表3 小鼠血清中的 BUN、BLA、MDA、HG、MG、SOD 和 GSH-Px 水平
Table 3 BUN, BLA, MDA, HG, MG, SOD, and GSH-Px levels in mouse serum

组别BUN/(mmol·L-1)BLA/(mmol·L-1)MDA/(mmol·mL-1)HG/(mg·mL-1)MG/(mg·mL-1)SOD/(U·mL-1)GSH-Px/(μmol·mL-1)正常组7.34±0.31d17.83±0.55d5.12±0.46d11.86±0.45a1.92±0.10a340.96±21.33a244.59±23.68a衰老模型组16.38±0.49a35.12±1.23a15.83±1.17a6.72±0.37d0.84±0.08d107.93±15.32d117.92±16.37dVc组13.42±0.39b28.05±0.87b11.12±0.59b8.39±0.29c1.21±0.07c202.36±29.36c155.60±17.06cLDSBKSFY07-L组13.63±0.32b28.65±0.76b11.88±0.67b7.98±0.36c1.16±0.06c189.69±20.63c143.57±18.20cLDSBKSFY07-H组10.19±0.42c22.91±0.68c7.41±0.40c9.92±0.38b1.63±0.08b271.06±22.53b196.25±19.52b
2.3 小鼠肝脏和肾组织的病理学变化
小鼠肝组织形态见图1-a,正常组小鼠肝小叶结构清晰且完整,肝细胞以中心静脉为中心呈放射状排列。衰老模型组小鼠的肝小叶结构被破坏,肝细胞的排列出现混乱,部分肝细胞出现细胞膜和细胞核破裂,显微镜视野下还出现凋亡小体。

a-肝脏;b-肾
图1 小鼠肝脏和肾组织的病理学H&E染色 切片观察(100×)
Fig.1 Observation of pathological H&E stained sections of mouse liver and kidney tissues (100×)
LDSBKSFY07和维生素C均可以减轻衰老小鼠肝细胞的损伤,LDSBKSFY07-H作用后肝小叶结构基本完整,而LDSBKSFY07-L组和Vc组小鼠肝细胞还存在部分细胞被破坏,细胞结构受损。对小鼠肾脏组织观察发现,衰老模型组小鼠肾脏组织中的肾小球形态不规则,部分肾小球破裂,组织间有严重的炎性细胞浸润(图1-b)。而正常组小鼠的肾小球及细胞结构完整,LDSBKSFY07和维生素C均能减轻衰老造成肾脏组织损伤,其中LDSBKSFY07-H效果最佳,能够使肾脏的组织形态与正常组接近。
2.4 小鼠肝脏、肾脏和骨骼肌组织的mRNA表达
如图2和图3所示,正常组小鼠肝脏和肾脏组织中的诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)mRNA表达强度最弱,上调神经型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)、Cu/Zn-SOD、Mn-SOD和过氧化氢酶(catalase,CAT)表达最强;而衰老模型组小鼠的iNOS和TNF-α表达最强,nNOS、Cu/Zn-SOD、Mn-SOD和CAT表达最弱。LDSBKSFY07可以下调衰老小鼠肝脏和肾脏组织中的iNOS、TNF-α表达和上调nNOS、Cu/Zn-SOD、Mn-SOD、CAT表达,且LDSBKSFY07-H对这些表达的调控能力最强,使这些表达接近正常组小鼠。骨骼肌组织的mRNA表达分析结果与肝脏和肾脏组织的TNF-α、iNOS、nNOS、Cu/Zn-SOD、Mn-SOD和CAT结果相同(图4)。另外,衰老模型组小鼠骨骼肌组织的syncytin-1表达最强,LDSBKSFY07-H、LDSBKSFY07-L和维生素C都可以下调衰老小鼠骨骼肌组织的syncytin-1表达,且LDSBKSFY07-H的下调效果最强,使syncytin-1表达最为接近正常组小鼠的骨骼肌组织。

图2 小鼠肝脏组织的TNF-α、iNOS、nNOS、Cu/Zn-SOD、Mn-SOD和CAT mRNA表达
Fig.2 The mRNA expression of TNF-α, iNOS, nNOS, Cu/Zn-SOD, Mn-SOD, and CAT in mouse liver tissue
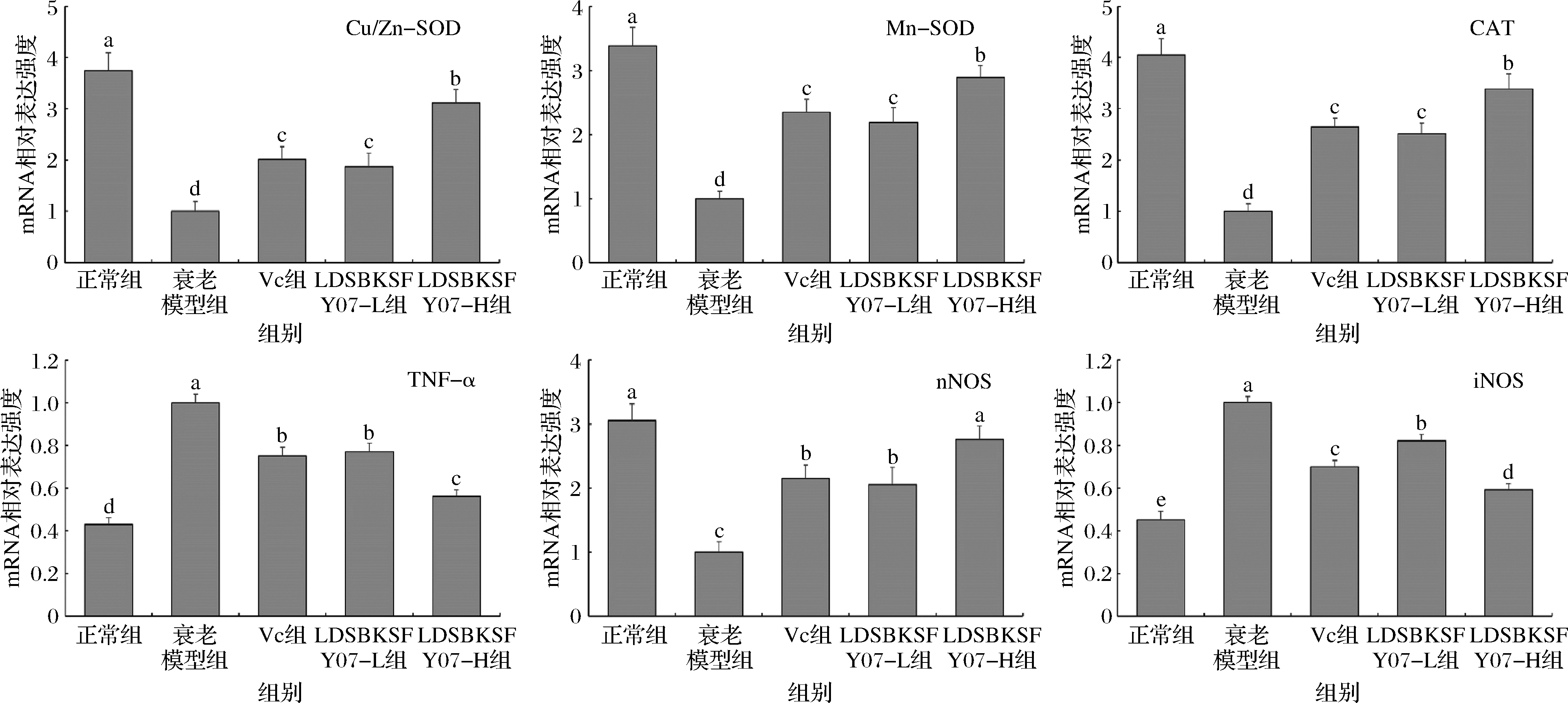
图3 小鼠肾脏组织的TNF-α、iNOS、nNOS、Cu/Zn-SOD、Mn-SOD和CAT mRNA表达
Fig.3 The mRNA expression of TNF-α, iNOS, nNOS, Cu/Zn-SOD, Mn-SOD and CAT in mouse kidney tissue
2.5 小鼠肠道内容物中微生物的mRNA表达
如图5所示,正常组小鼠肠道内容物中的厚壁菌门mRNA表达最低(P<0.05),而拟杆菌门、双歧杆菌表达最高,提示正常组小鼠肠道中的厚壁菌门微生物比例最低,而拟杆菌门微生物比例最高。
LDSBKSFY07作用于小鼠肠道后可以显著提高衰老小鼠肠道中拟杆菌门和双歧杆菌的比例,同时降低厚壁菌门的比例。同时,LDSBKSFY07摄入后LDSBKSFY07-L和LDSBKSFY07-H的乳杆菌比例大幅度提升,甚至大于正常组小鼠,显著(P<0.05)高于Vc组和衰老模型组。
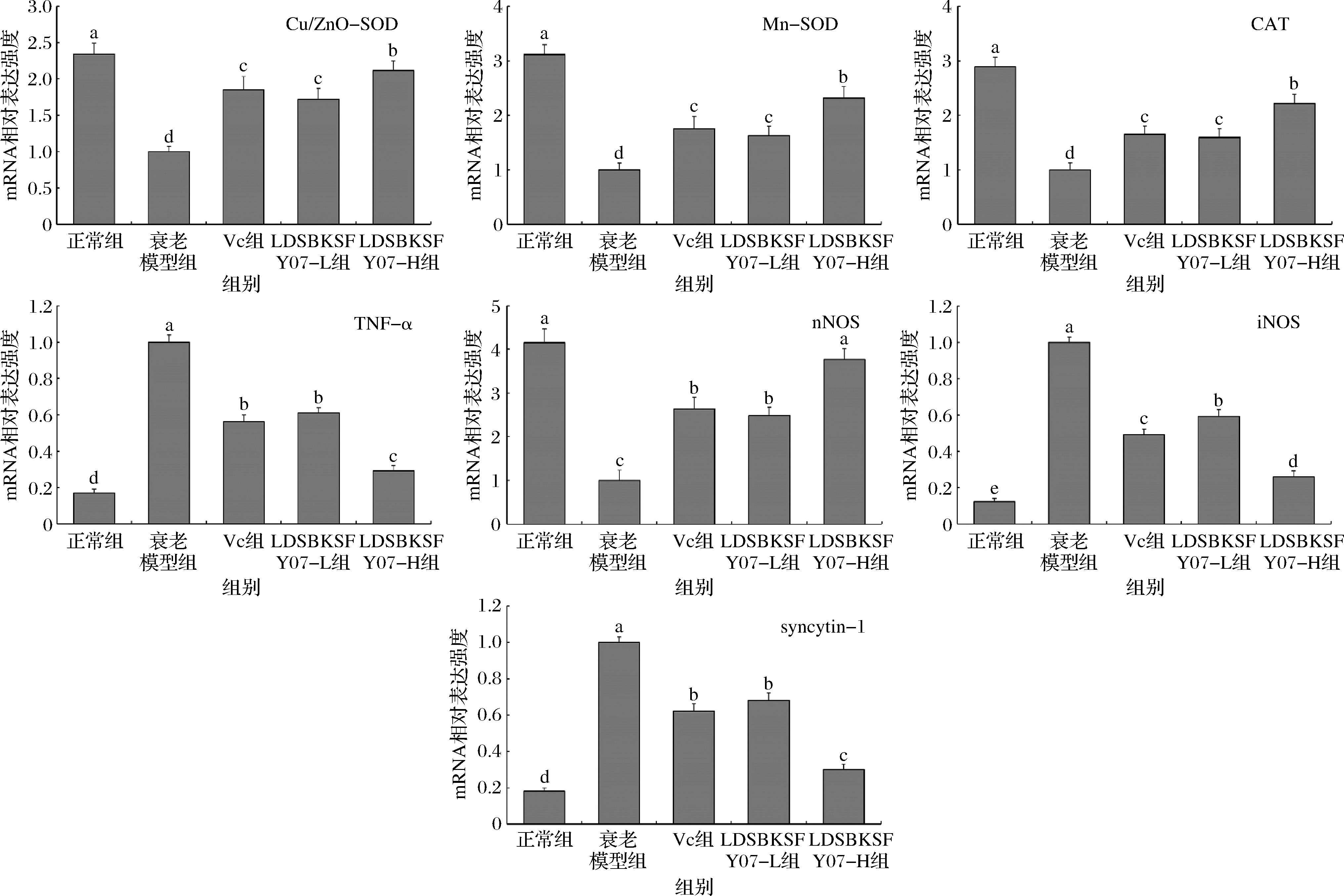
图4 小鼠骨骼肌组织的TNF-α、iNOS、nNOS、Cu/Zn-SOD、Mn-SOD、CAT和syncytin-1 mRNA表达
Fig.4 The mRNA expression of TNF-α, iNOS, nNOS, Cu/Zn-SOD, Mn-SOD, CAT and syncytin-1 in mouse skeletal muscle tissue
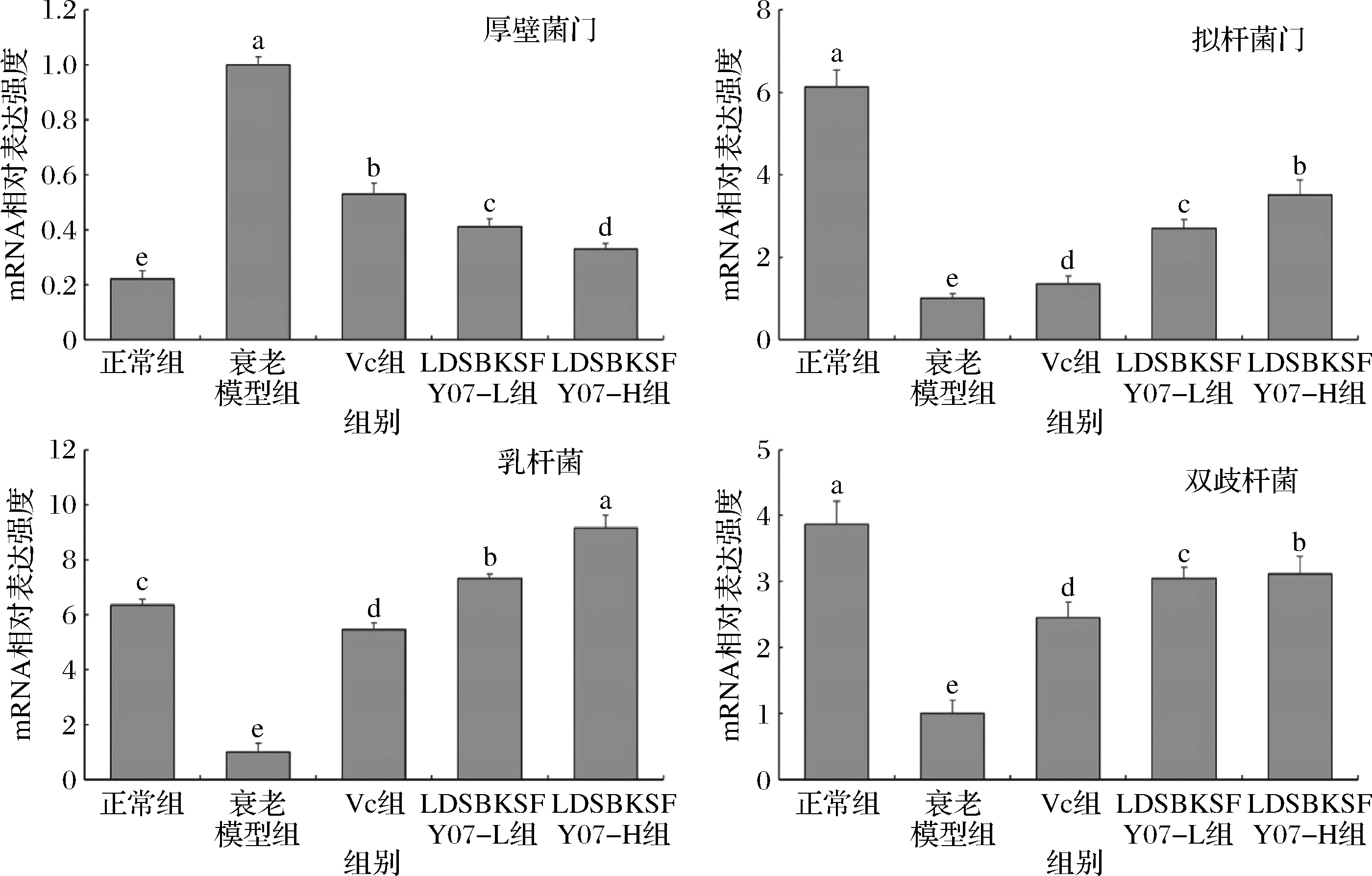
图5 小鼠肠道内容物中的厚壁菌门、拟杆菌门、乳杆菌和双歧杆菌的mRNA表达
Fig.5 The mRNA expression of Firmicutes, Bacteroidetes, Lactobacillus, and Bifidobacteriumin mouse gut contents
3 讨论
人体由于年龄的增长,机体的衰老造成体内的自由基增多,自由基的过度积累导致器官损伤和机能衰退,包括运动相关的器官和组织功能下降,最终使机体的运动能力下降并伴随疲劳的频繁发生。适宜的运动能够起到减少自由基对人体细胞膜损伤的效果,使正常的细胞能够维持氧化呼吸链的正常运行并保持线粒体结构和功能完整;同时良好的身体状态也有利于机体保持运动能力[11]。实验室条件下常用动物耐力跑步和游泳力竭实验来验证运动能力;运动能力的提高也是机体抵抗疲劳状态最直接的表现,同时也是机体抗衰老的一个重点表现[7]。现有研究已证实一些具有益生菌潜质的乳酸菌具有良好的抗氧化效果和抗衰老效果[12],由此也有可能发挥调节机体活力,增强运动能力的作用。本研究结果证实了LDSBKSFY07能够延长小鼠耐力跑步和力竭游泳的时间,提示LDSBKSFY07起到了增强运动能力的效果。
人体衰老后进行长时间的运动会使机体的糖代谢和脂代谢出现异常,大量消耗自身的蛋白质和氨基酸,从而使机体内的BUN含量过度提高。人体在剧烈运动时会暂时处于缺氧状态,从而使体内正常的能量代谢过程出现变化,肌肉中会短时间积累大量的乳酸,导致机体快速进入疲劳状态。同时,肌肉中积累的大量乳酸将逐步渗透到血液循环中形成血乳酸(blood lactic acid,BLA),因此,BLA也可作为判断身体抗疲劳状态的一个重要指标[13]。另外,机体组织中镁的含量也与人体的运动耐力和抗疲劳能力直接相关,当肌肉组织中的HG和MG含量减少时,肌肉中的供能物质随之减少,迫使MG通过糖酵解提供机体必须的能量。此时,大量乳酸也会堆积在肌肉组织并释放到血液中,这个过程同样使肌肉的活力减弱,影响运动能力[14]。过量的运动会造成体内自由基大大增加,这种现象在衰老状态下尤为明显。CAT、GSH-Px和SOD都是人体自身具有的重要的抗氧化酶,它们的存在可以维持机体正常的氧化应激水平并清除多余的自由基。GSH-Px在机体中起到催化H2O2,使之分解的重要作用,通过去除H2O2和脂质H2O2来保护细胞膜的结构和功能完整[15]。SOD是机体氧化与抗氧化平衡的重要调节酶,SOD能使氧自由基分解为O2和H2O2,有效清除超氧阴离子自由基,从而减少具有毒性的羟基自由基产生,保护细胞和组织。如果机体中堆积的自由基数远远超过抗氧化酶的防御能力,组织和细胞膜上的不饱和脂质会被自由基破坏,膜的流动性和细胞功能会降低,导致脂质过氧化,从而产生大量的MDA,而MDA又进一步地破坏细胞膜的结构,导致细胞肿胀进而坏死,因此MDA在机体中的水平也能间接反映机体自由基代谢的变化和组织过氧化损伤的程度[16]。随着机体的持续衰老,体内脂质过氧化物的水平持续升高,体内的抗氧化酶活性强弱是组织细胞受过度自由基损伤程度的决定性因素。通过检测机体内抗氧化酶的活性,不仅能反映身体抵抗氧化损伤的状态,还能够反映机体的疲劳程度和运动能力强弱[15]。本研究的实验结果显示LDSBKSFY07能够显著干预衰老小鼠血清的BUN、BLA、HG、MG、MDA、SOD和GSH-Px水平,从而起到了抑制衰老而发挥增强运动耐力和能力的效果。
肝脏是机体运行中氧化应激反应的中心器官,也是自由基和脂质过氧化物易于产生的器官。衰老引发的自由基增加可以清楚地表现在肝组织的病变上。另外,随着身体的衰老,肾脏出现逐渐萎缩,前列腺素分泌减少导致血管收缩和血流减少。随着衰老的延续,肝脏和肾脏的血管收缩频率下降,各器官的供血减少,这个过程直接降低了运动能力[17]。在本研究中,病理切片观察也证实衰老导致肝肾组织的损伤,LDSBKSFY07可以有效地减少肝肾脏组织衰退和损伤,其间接起到的重要作用之一可能是提高运动机能。
CAT的主要作用是分解H2O2,从而去除红细胞、过氧化物酶体和线粒体中的过氧化应激产物,起到阻止活性氧对细胞造成的损伤并抑制氧化应激[15]。Cu/Zn-SOD和Mn-SOD是哺乳动物体内SOD的2种形态。Cu/Zn-SOD存在于细胞质中,以Cu2+和Zn2+为活性中心;Mn-SOD则是在线粒体中以Mn4+为活性中心的SOD,这2种SOD都在体内发挥了极为重要的氧化应激抑制作用。随着年龄的增长,运动后机体的氧化应激程度会更大,产生的自由基也更多。要保持机体具备更好的运动能力和抑制衰老则需要有更高活性的CAT、Cu/Zn-SOD和Mn-SOD来抑制体内的自由基,并减轻疲劳感和提高运动能力[18]。本研究的实验结果也证实衰老小鼠的肝肾组织和骨骼肌组织由于一系列的氧化应激反应导致大量的自由基积累,LDSBKSFY07可以提高CAT、Cu/Zn-SOD和Mn-SOD的活力,提示LDSBKSFY07具有抗衰老的效果,从而发挥其保护机体和提高衰老小鼠运动能力的作用。
NOS分为在正常状态下表达的神经元型一氧化氮合酶(nNOS)、内皮型一氧化氮合酶(eNOS)和在损伤后诱导表达的诱导型一氧化氮合酶(iNOS)。NO的生成和NOS密切相关,NO在骨骼肌中会不断的产生,机体处于静态时骨骼肌中的NO含量相对较低,运动状态下骨骼肌收缩加剧造成NO的水平提高。肌纤维膜上分布有nNOS,研究显示在力竭运动后,nNOS的表达显著上调,而在运动疲劳恢复后,nNOS的表达则降低。iNOS的表达是由体内的内毒素和各种细胞因子,特别是一部分炎症细胞因子诱导的,主要分布在肝细胞、巨噬细胞和中性粒细胞中。iNOS是能够生成更多NO的NOS亚型,NO广泛参与氧化衰老的过程,是造成衰老的重要介质[19]。TNF-α是单核细胞和巨噬细胞分泌的多功能细胞因子,可促进巨噬细胞分泌活性氧,如·O2-、H2O2和NO,从而对机体的衰老起到促进作用[20]。因此,iNOS、nNOS和TNF-α的表达水平可以反映作用机体的氧化应激水平,从而判断出运动能力和疲劳程度。syncytin-1基因在免疫调节中能够发挥作用,骨骼肌中的syncytin-1高表达能够导致运动神经元受损。骨骼肌中syncytin-1高表达还能导致氧自由基的积聚和线粒体损伤。syncytin-1被氧化应激激活后会造成肌肉和神经损伤,影响运动机能[21]。在本研究中,LDSBKSFY07可以显著下调iNOS、nNOS、TNF-α和syncytin-1的表达,表明LDSBKSFY07可以缓解运动性疲劳和氧化应激,提高小鼠清除自由基的能力,增强小鼠的运动能力。
机体中内脏的健康和衰老程度与肠道菌群直接相关,肠道菌群也与器官的损伤和炎症有密切关系。健康的肠道菌群能够将某些食物转化的营养物质进一步转化,使之转化为代谢的调节因子,增强肌肉活力,从而提升运动能力[22]。同时,临床研究也证实有部分肠道菌株能够消耗运动中产生的大量乳酸,减轻乳酸对肌肉的影响,从而提高运动员的耐力[23]。人体衰老过程中肠道菌群的变化也会对肠道生理功能起到直接作用,肠道菌群的失衡直接或间接的影响肠道动力、肠道黏液分泌和肠道屏障功能。肠道功能的减弱又会对机体的排毒能力造成影响,导致毒素进入血液循环,加剧衰老。衰老过程中人体肠道微生物最明显的变化就是厚壁菌门和拟杆菌门微生物的比例改变,拟杆菌门微生物在老年人群肠道菌群中所占比例更高,同时老年人群肠道菌群中双歧杆菌的比例较低[24]。乳杆菌作为厚壁菌门微生物中的一类有益菌,在机体免疫调节和抗衰老上都具有一定的效果[25]。本研究对各组小鼠肠道内容物中微生物相对表达量的测定也得到相同的结果,在LDSBKSFY07的干预下,衰老小鼠的厚壁菌门微生物、双歧杆菌比例提高,拟杆菌门比例下降,另外由于LDSBKSFY07本身为乳杆菌,充分干预下衰老小鼠肠道乳杆菌的比例甚至大于正常小鼠。由此可见,小鼠肠道菌群和衰老状态直接相关,本研究显示衰老状态下小鼠的肠道菌群发生了明显变化,厚壁菌门与拟杆菌门的比值发生变化,其乳杆菌和双歧杆菌等有益菌比例也下降,与JENSEN等[25]的研究结果一致,即低脂饮食小鼠的衰老进程中肠道菌群发生了明显改变,出现了厚壁菌门比例下降和拟杆菌门比例的上升。包括乳杆菌在内的有益微生物可以抑制病原菌黏附,防止病原菌破环肠道屏障,减少炎性细胞因子的分泌,从而减轻衰老造成的机体炎症程度加剧。同时,另外,随着衰老的进程,维生素B7、B12、肌酸和肌酐等与微生物代谢过程密切相关的产物在机体中的含量也会减少,导致肌肉体积萎缩,运动功能降低,调节肠道微生物,促进肠道有益菌的代谢过程,产生对机体有利的活性物质可以改善衰老状态并提高运动机能[23-25]。LDSBKSFY07的干预改善了小鼠肠道菌群,起到了控制机体炎症的作用,进而也可能起到了调节肠胃微生物产活性物质代谢的过程,从而抑制了小鼠的衰老并增强其机体功能,以达到提高运动能力的作用。
本研究通过建立小鼠衰老模型,验证了LDSBKSFY07的抗氧化作用和提高小鼠运机能力的效果。实验结果表明,LDSBKSFY07能降低小鼠的氧化应激水平,起到抗衰老的功效,并能提高肌肉组织的活性,从而提高衰老小鼠的抗疲劳能力和运动能力,且在人体膳食建议摄入量标准下,LDSBKSFY07的效果优于维生素C。综上所述,LDSBKSFY07对衰老小鼠运动能力有提升效果,研究结果为今后开发用于抗疲劳和改善老年人运动功能的食源性抗氧化剂提供了参考,有利于开发具有自主知识产权的益生菌产品。但是本研究的结果还需要进一步的临床研究加以验证,这也是乳酸菌LDSBKSFY07的未来研究方向。
[1] ZHAOX, YI R K, ZHOU X R, et al.Preventive effect of Lactobacillus plantarumKSFY02 isolated from naturally fermented yogurt from Xinjiang, China, on D-galactose-induced oxidative aging in mice[J].Journal of Dairy Science, 2019, 102(7):5 899-5 912.
[2] BLOOMERR J, COLE B, FISHER-WELLMAN K H.Racial differences in postprandial oxidative stress with and without acute exercise[J].International Journal of Sport Nutrition and Exercise Metabolism, 2009, 19(5):457-472.
[3] HILLA M, BUCKLEY J D, MURPHY K J, et al.Combining fish-oil supplements with regular aerobic exercise improves body composition and cardiovascular disease risk factors[J].The American Journal of Clinical Nutrition, 2007, 85(5):1 267-1 274.
[4] KATZMANW B, VITTINGHOFF E, LIN F, et al.Targeted spine strengthening exercise and posture training program to reduce hyperkyphosis in older adults:Results from the study of hyperkyphosis, exercise, and function (SHEAF) randomized controlled trial[J].Osteoporosis International, 2017, 28(10):2 831-2 841.
[5] 潘杰,刘来浩, 牟建伟.肠道菌群与人类健康研究进展[J].山东师范大学学报(自然科学版), 2021, 36(4):337-365.
PAN J, LIU L H, MU J W.Research progress of gut microbiota and human health[J].Journal of Shandong Normal University (Natural Science), 2021, 36(4):337-365.
[6] SINGHA K, PANDEY P, TEWARI M, et al.Free radicals hasten head and neck cancer risk:A study of total oxidant, total antioxidant, DNA damage, and histological grade[J].Journal of Postgraduate Medicine, 2016, 62(2):96-101.
[7] ZHANGJ X, CHEN L, ZHANG L Y, et al.Effect of Lactobacillus fermentumHFY03 on the antifatigue and antioxidation ability of running exhausted mice[J].Oxidative Medicine and Cellular Longevity, 2021, 2021:8013681.
[8] LIF, HUANG H, WU Y K, et al.Lactobacillus fermentumHFY06 attenuates D-galactose-induced oxidative stress and inflammation in male Kunming mice[J].Food &Function, 2021, 12(24):12 479-12 489.
[9] 国家质量监督检验检疫总局,中国国家标准化管理委员会.含乳饮料:GB/T 21732—2008[S].北京:中国标准出版社, 2008.
GB/T 21 732-2008, Milk beverages[S].Beijing:Standards Press of China, 2008.
[10] 中国营养学会.中国居民膳食指南科学研究报告(2021) [R].北京:中国营养学会, 2021.
Chinese Nutrition Society.Scientific research report on dietary guidelines for Chinese residents(2021) [R].Biejing:Chinese Nutrition Society, 2021.
[11] VITALEG, SALVIOLI S, FRANCESCHI C.Oxidative stress and the ageing endocrine system[J].Nature Reviews Endocrinology, 2013, 9(4):228-240.
[12] ZHOUX R, DU H H, JIANG M Q, et al.Antioxidant effect of Lactobacillus fermentumCQPC04-fermented soy milk on D-galactose-induced oxidative aging mice[J].Frontiers in Nutrition, 2021, 8:727467.
[13] DIMITROVV G, ARABADZHIEV T I, DIMITROVA N A, et al.The spectral changes in EMG during a second bout eccentric contraction could be due to adaptation in muscle fibres themselves:A simulation study[J].European Journal of Applied Physiology, 2012, 112(4):1 399-1 409.
[14] SHIOSEK, TOBINA T, HIGAKI Y, et al.Effectiveness of sub-maximal intermittent exercise on muscle glycogen depletion, PGC-1αand PDK-4 gene expression[J].Open Journal of Molecular and Integrative Physiology, 2012, 2(4):119-126.
[15] YOONG A, PARK S.Antioxidant action of soy isoflavones on oxidative stress and antioxidant enzyme activities in exercised rats[J].Nutrition Research and Practice, 2014, 8(6):618-624.
[16] MICHAELA, NGUYEN THUY T, SINITSKII ANTON I, et al.Isolevuglandins (isoLGs) as toxic lipid peroxidation byproducts and their pathogenetic role in human diseases[J].Free Radical Biology and Medicine, 2021, 162(12):266-273..
[17] WILLEC M, LENHART R L, WANG S J, et al.Ability of sagittal kinematic variables to estimate ground reaction forces and joint kinetics in running[J].The Journal of Orthopaedic and Sports Physical Therapy, 2014, 44(10):825-830.
[18] L PEZ-CRUZR I, ZENTENO-SAV
PEZ-CRUZR I, ZENTENO-SAV N T, GALV
N T, GALV N-MAGA
N-MAGA A F.Superoxide production, oxidative damage and enzymatic antioxidant defenses in shark skeletal muscle[J].Comparative Biochemistry and Physiology.Part A, Molecular &Integrative Physiology, 2010, 156(1):50-56.
A F.Superoxide production, oxidative damage and enzymatic antioxidant defenses in shark skeletal muscle[J].Comparative Biochemistry and Physiology.Part A, Molecular &Integrative Physiology, 2010, 156(1):50-56.
[19] KIMT W, PARK S S, KIM B K, et al.Effects of sildenafil citrate on peripheral fatigue and exercise performance after exhaustive swimming exercise in rats[J].Journal of Exercise Rehabilitation, 2019, 15(6):751-756.
[20] GRANDIN, CADEDDU M, BLOMBERG J, et al.Contribution of type W human endogenous retroviruses to the human genome:Characterization of HERV-W proviral insertions and processed pseudogenes[J].Retrovirology, 2016, 13(1):67.
[21] UYGURB, LEIKINA E, MELIKOV K, et al.Interactions with muscle cells boost fusion, stemness, and drug resistance of prostate cancer cells[J].Molecular Cancer Research:MCR, 2019, 17(3):806-820.
[22] 耿雪,张双双, 李志慧, 等.肠道菌群对运动系统和运动机能的影响研究进展[J].中国运动医学杂志, 2021, 40(1):61-66.
GENG X, ZHANG S S, LI Z H, et al.Research progress on the influence of intestinal flora on motor system and motor function[J].Chinese Journal of Sports Medicine, 2021, 40(1):61-66.
[23] BARTONW, PENNEY N C, CRONIN O, 等.与久坐者相比,职业运动员的肠道菌群在代谢组分, 尤其是功能代谢水平上有所不同[J].英国医学杂志(中文版), 2017, 20 (7):417.
BARTON W, PENNEY N C, CRONIN O, et al.The microbiome of professional athletes differs from that of more sedentary subjects in composition and particularly at the functional metabolic level[J].BMJ(Chinese Edition), 2017, 20 (7):417.
[24] 张亚男,于雪.衰老和肠道菌群与动脉粥样硬化[J].中华老年医学杂志, 2020, 39(4):471-475.
ZHANG Y N, YU X.Aging, gut microbiota and atherosclerosis:An update review[J].Chinese Journal of Geriatrics, 2020, 39(4):471-475.
[25] JENSENB A H, HOLM J B, LARSEN I S, et al.Lysates of Methylococcus capsulatusBath induce a lean-like microbiota, intestinal FoxP3+RORγt+IL-17+Tregs and improve metabolism[J].Nature Communications, 2021, 12(1):1093.