灵芝是一种药用价值较高的名贵真菌,被视为延年益寿的珍品,灵芝孢子是其子实体成熟期从菌盖弹射出来的灵芝种子。研究表明,灵芝孢子粉富含多糖、肽、有机锗、氨基酸、生物碱、三萜、脂肪酸以及各种微量元素等[1-2],其具有抗肿瘤[3]、调节肠道菌群[4]、降血糖血脂、抗炎[5]、抗氧化[6]、清除自由基等作用[7]。皮肤衰老是最直观的衰老特征之一,表现为皮肤失去弹性和柔软性,出现皱纹、干燥角化、色素过量沉积等[8]。寻找天然安全有效成分以延缓皮肤衰老,是近年来人们关注与研究的热点之一,而对灵芝孢子粉延缓皮肤衰老机理方面的研究却鲜有报道。本文通过以天然产物灵芝孢子粉提取物(Ganoderma lucidumspore extract,GLSE)为研究对象,探讨其对体外新生儿人真皮成纤维细胞(human dermal fibroblasts neonatal,HDFn)抗衰老模型的作用及其抗氧化应激作用机制,旨在为GLSE在延缓皮肤衰老应用中提供科学依据。
1 材料与方法
1.1 细胞
HDFn,ATCC 63557078,美国模式培养物集存库。
1.2 主要试剂
灵芝孢子粉,修正药业;DMEM培养基、杜氏磷酸盐缓冲液(Dulbecco phosphate buffer solution,DPBS)、0.25%胰蛋白酶、胎牛血清,美国Gibco公司;叔丁基过氧化氢(tert-butyl hydroperoxide, TBHP),东京化成工业株式会社;总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(WST-8法)、总谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)检测试剂盒、丙二醛(malondialdehyde, MDA)检测试剂盒、β-半乳糖苷酶试剂盒、增强型CCK-8试剂盒,碧云天生物技术有限公司;线粒体膜电位检测试剂盒(JC-10),北京索莱宝科技有限公司。
1.3 主要仪器
AC2-4S1生物安全柜,新加坡艺思高科技有限公司;Observer.D1倒置显微镜,德国Zeiss公司;371二氧化碳培养箱、MULTISKAN GO全波长酶标仪,美国Thermo公司;3K15离心机,德国希格玛公司;ME104E电子分析天平,瑞士METTLER TOLEDO公司;S3E流式细胞仪,美国伯乐公司;SCIENTZ-IID超声波细胞破碎仪,宁波新芝生物有限公司。
1.4 实验方法
1.4.1 样品制备
参考刘世柱等[9]的方法并加以改进,采用水提法制备GLSE。称取灵芝孢子粉5 g,加入40 mL的超纯水超声波处理10 min,然后90 ℃浸提3 h,涡旋振荡后定容至50 mL,4 000 r/min离心10 min,取上清溶液,即为100 g/L GLSE。
1.4.2 细胞培养
HDFn培养于37 ℃、5% CO2的培养箱中,2~3 d传代1次。实验选取4~7代细胞。
1.4.3 细胞存活率测定
参照文献[10]的方法采用CCK-8检测法检测HDFn存活率。取对数生长期的细胞以104细胞/孔,接种于96孔板。培养24 h后,DPBS清洗2次,每孔加入100 μL终质量浓度为0.63、1.25、2.5、5、10 g/L GLSE的DMEM培养基培养,设置阴性对照(只加培养基)。继续培养24 h后,每孔加入CCK-8工作液,于培养箱内避光孵育2 h后用酶标仪检测各实验组在450 nm处的吸光度并按公式(1)计算细胞存活率。选取细胞存活率>70%的样品浓度为工作浓度进行下一步功效测试[11]。
细胞存活率![]()
(1)
1.4.4 TBHP诱导衰老模型建立
将细胞以104细胞/孔接种于96孔板中,培养24 h后,DPBS清洗2次,每孔加入100 μL含TBHP的培养基,终浓度分别为78.13、156.25、312.50、625.00、1 250.00 μmol/L,同时设置阴性对照(只加培养基),继续培养2 h后进行细胞存活率测定(方法及计算公式同1.4.3)。
1.4.5 GLSE对衰老模型的保护作用
为了进一步评估GLSE对氧化损伤细胞衰老模型的保护作用,将细胞以104细胞/孔接种于96孔板中,培养24 h后,DPBS清洗2次,加入终质量浓度为0.63、1.25、2.5、5、10 g/L GLSE的培养基处理24 h后,DPBS清洗2次,加入312.50 μmol/L TBHP孵育2 h后,进行细胞存活率测定(方法及计算公式同1.4.3),评价GLSE对氧化损伤后细胞的保护作用。
1.4.6 GLSE对HDFn内SOD、GSH-Px活力和MDA含量影响
收集对数生长期细胞,按照2×106细胞/皿接种于细胞培养皿,培养24 h后,加入终质量浓度为2.5、5、10 g/LGLSE的DMEM培养基。继续培养24 h后,DPBS清洗2次,加入312.50 μmol/L TBHP。同时设置阴性对照(只加培养基),以只加TBHP的细胞为模型对照。TBHP作用2 h后,DPBS清洗2次后裂解细胞。按照各试剂盒的操作方法进行SOD、GSH-Px、MDA的检测。
1.4.7 GLSE对细胞线粒体膜电位的影响
收集对数生长期细胞,按照2×105细胞/孔接种于6孔板,培养24 h后,加入终质量浓度为2.5、5、10 g/LGLSE的DMEM培养基。继续培养24 h后,DPBS清洗2次,加入312.50 μmol/L TBHP。同时设置阴性对照(只加培养基),以只加TBHP的细胞为模型对照。TBHP作用2 h后,按照线粒体膜电位检测试剂盒说明书进行操作,并通过流式细胞仪分析检测。
1.4.8 GLSE对HDFn中β-半乳糖苷酶活性的影响
收集对数生长期细胞,按照2×105细胞/孔接种于6孔板,培养24 h后,加入终质量浓度为2.5、5、10 g/LGLSE的DMEM培养基。继续培养24 h后,DPBS清洗2次,加入312.50 μmol/L TBHP。同时设置阴性对照(只加培养基),以只加TBHP的细胞为模型对照。TBHP作用2 h后,按照β-半乳糖苷酶试剂盒说明书进行操作。光学显微镜下观察细胞染色情况,并按公式(2)计算阳性细胞染色率。
阳性细胞染色率![]()
(2)
1.4.9 GLSE对HDFn中Nrf2/HO-1 mRNA表达的影响
收集对数生长期细胞,按照3×105细胞/孔接种于6孔板,培养24 h后,加入终质量浓度为2.5、5、10 g/LGLSE的DMEM培养基。继续培养24 h后,DPBS清洗2次,加入312.50 μmol/L TBHP。同时设置阴性对照(只加培养基),以只加TBHP的细胞为模型对照。TBHP作用2 h后,收集处理好的细胞,提取RNA并测定RNA浓度,按照反转录试剂盒说明书进行操作。反应条件:95 ℃ 5 min后,42 ℃ 5 min,95 ℃3 s,60 ℃ 30 s,重复40个循环,4 ℃ ∞以β-actin为内参,用2-ΔΔCt法计算目的基因相对表达量。结果根据目的基因与相应的β-actin的表达比值确定基因的表达水平高低。PCR引物序列见表1。
1.4.10 数据处理
采用SPSS 22.0软件进行统计分析。组间差异比较采用单因素方差分析(One-Way ANOVA),方差齐者采用LSD检验,方差不齐者采用Tamhane’s T2检验.##:与阴性对照相比P<0.01;*:与模型对照相比P<0.05;**:与模型对照相比P<0.01。
表1 PCR引物序列
Table 1 Primer sequences
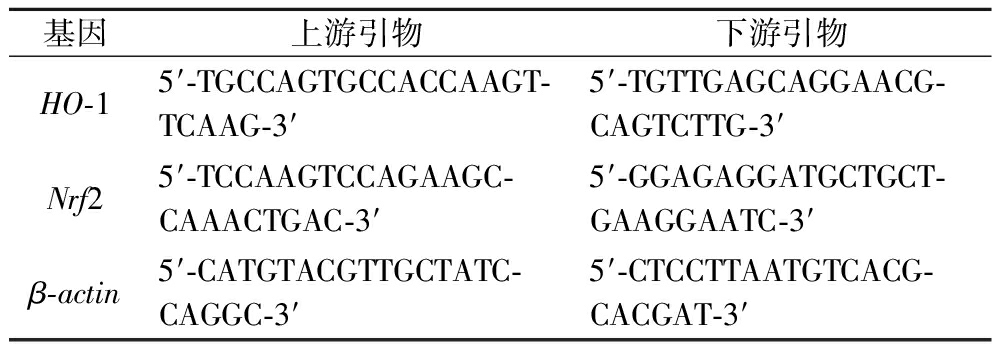
基因上游引物下游引物HO-15′-TGCCAGTGCCACCAAGT-TCAAG-3′5′-TGTTGAGCAGGAACG-CAGTCTTG-3′Nrf25′-TCCAAGTCCAGAAGC-CAAACTGAC-3′5′-GGAGAGGATGCTGCT-GAAGGAATC-3′β-actin5′-CATGTACGTTGCTATC-CAGGC-3′5′-CTCCTTAATGTCACG-CACGAT-3′
2 结果与分析
2.1 细胞存活率结果
使用CCK-8法研究不同质量浓度的GLSE对细胞存活率的影响。由图1可知,在试验质量浓度范围(0.63~10 g/L)内,细胞存活率均高于70%。说明在此质量浓度范围内无细胞毒性作用,可用于后续试验。

图1 GLSE对HDFn存活率的影响
Fig.1 Effects of GLSE on HDFn viability
2.2 TBHP诱导衰老模型建立
细胞衰老模型的构建是抗衰老研究的前提,TBHP是一种可在多种细胞系中诱导氧化应激及细胞损伤的氧化剂,可诱导细胞产生活性氧(reactive oxygen species,ROS),从而使所介导的生物分子损伤导致细胞凋亡及衰老,相比H2O2结构更稳定,现已被用于构建多种细胞衰老模型[12-14]。因此,采用TBHP诱导HDFn建立氧化应激皮肤早衰模型,筛选最佳TBHP使用浓度。图2为不同浓度TBHP对HDFn存活率影响的结果,不同浓度TBHP作用细胞后,细胞存活率随TBHP浓度的增加而减小,当浓度<156.25 μmol/L时,TBHP对HDFn的存活率影响甚微,而当浓度增加到312.50 μmol/L时,细胞的存活率显著降低至(65.34±4.66)%,对HDFn损伤效果显著(P<0.01),表明HDFn的存活率受到抑制。故选用312.50 μmol/L TBHP作为诱导HDFn形成氧化应激早衰模型的最佳浓度。
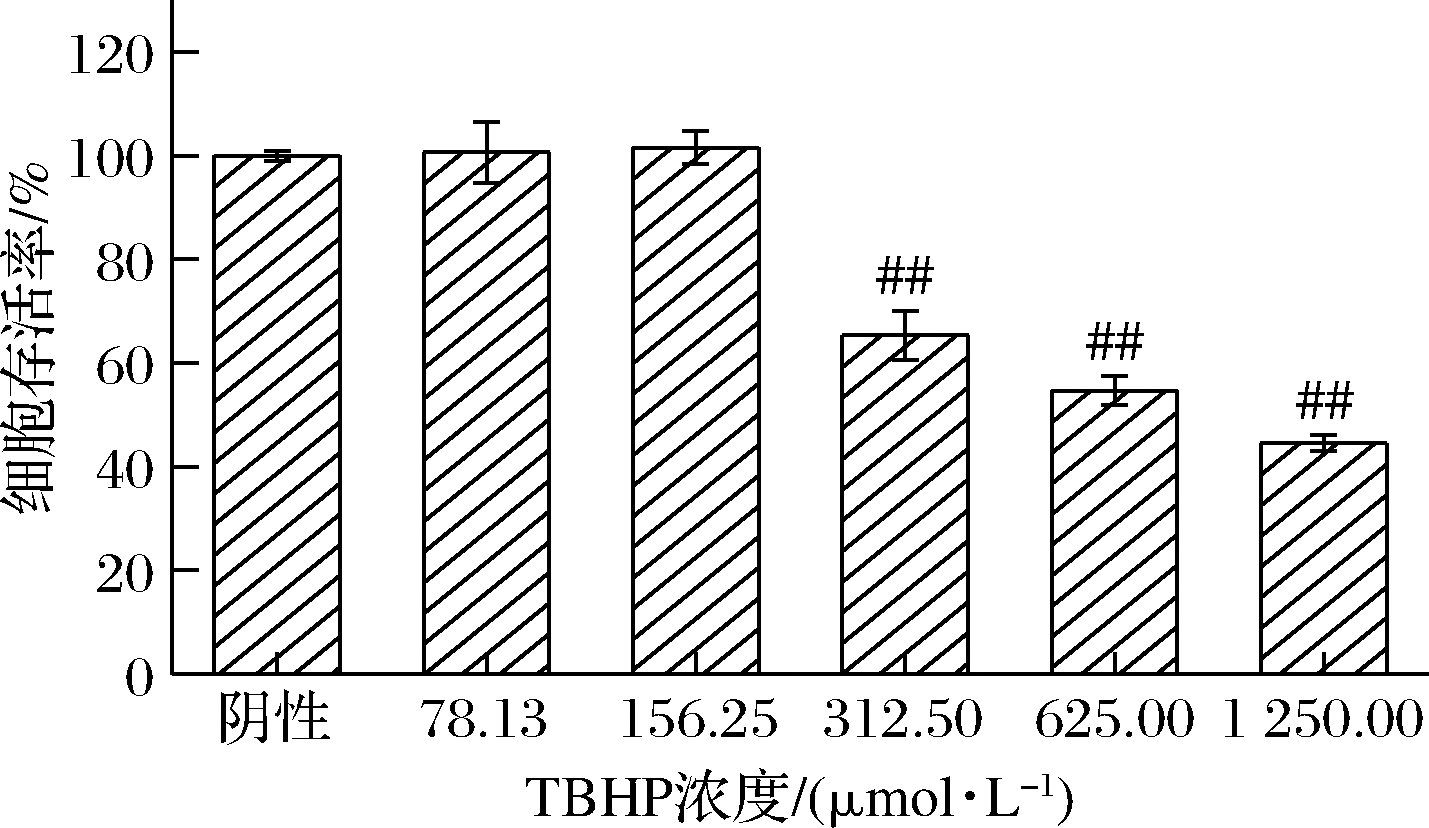
图2 TBHP对细胞存活率的影响
Fig.2 Effects of TBHP on HDFn viability
2.3 GLSE对体外细胞模型的保护作用
利用构建的TBHP氧化损伤模型,研究GLSE预处理后对氧化损伤HDFn的影响。如图3所示,与阴性对照组比较,模型对照组细胞存活率明显下降,细胞存活率为(62.78±2.98)%,且差异有统计学意义(P<0.01)。质量浓度为5 g/L和10 g/L GLSE在给药24 h后能够显著提高HDFn存活率(P<0.05)。以上结果表明,GLSE能够降低TBHP诱导HDFn氧化损伤作用。

图3 GLSE对体外细胞模型的保护作用
Fig.3 Protective effect of GLSE on cell model in vitro
2.4 GLSE对HDFn内SOD、GSH-Px活力和MDA含量影响
SOD活性、GSH-Px活性以及MDA含量的高低是反映细胞氧化损伤程度的重要指标。SOD是细胞内重要的抗氧化酶,是细胞防御氧化应激的重要组成部分,能有效清除活性氧自由基,防止脂质过氧化,提升机体的抗氧化能力[15]。GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,维持机体内部自由基的相对稳定,在保护细胞免受自由基损伤过程中起着关键作用[16]。ROS的过量产生和累积导致细胞膜脂质过氧化,产生脂质过氧化产物MDA,最终引起细胞的氧化损伤或凋亡,故MDA的含量可间接反映细胞氧化应激损伤的程度[17]。
GLSE对TBHP诱导氧化损伤的HDFn内SOD活力、GSH-Px活力和MDA含量影响的结果如表2所示。
表2 GLSE对HDFn内SOD、GSH-Px活力 和MDA含量的影响
Table 2 Effects of GLSE on SOD, GSH-Px activity and MDA content in HDFn
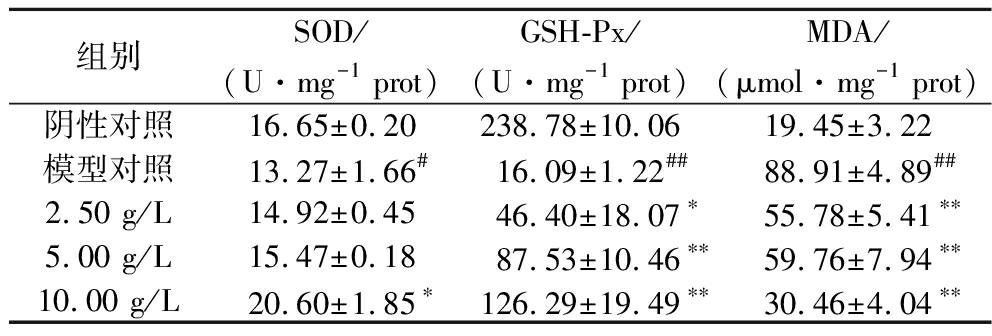
组别SOD/(U·mg-1 prot)GSH-Px/(U·mg-1 prot)MDA/(μmol·mg-1 prot)阴性对照16.65±0.20238.78±10.0619.45±3.22模型对照13.27±1.66#16.09±1.22##88.91±4.89##2.50 g/L14.92±0.4546.40±18.07∗55.78±5.41∗∗5.00 g/L15.47±0.1887.53±10.46∗∗59.76±7.94∗∗10.00 g/L20.60±1.85∗126.29±19.49∗∗30.46±4.04∗∗
与阴性对照组比较,模型对照组SOD和GSH-Px活力明显降低、MDA含量明显升高,差异均有统计学意义(P<0.05),说明TBHP对HDFn具有氧化损伤作用。与模型对照组相比,样品组SOD活力均有升高,随浓度的增大呈上升趋势,10 g/LGLSE作用HDFn后SOD活力升高,具有统计学差异(P<0.05);与模型对照组相比,2.5、5、10 g/L的GLSE作用HDFn GSH-Px活力均显著升高(P<0.01),并呈良好的剂量依赖关系;2.5、5、10 g/L的GLSE作用HDFn后MDA含量显著降低(P<0.01)。研究显示,灵芝酸、灵芝多糖、灵芝多糖肽对氧化损伤保护起到主要作用[2,18-19],与本文研究结果一致。
综上,GLSE作用于HDFn后,能显著提高TBHP诱导氧化损伤的细胞内SOD和GSH-Px活力,抑制脂质的过氧化,显著降低MDA含量,对TBHP诱导的HDFn氧化损伤具有保护作用。
2.5 GLSE对细胞线粒体膜电位的影响
线粒体是维持细胞正常功能的重要细胞器,细胞衰老时,线粒体膜电位降低,细胞凋亡增加,加速了细胞的衰老死亡过程[20]。GLSE对HDFn线粒体膜电位的影响见图4,与阴性对照相比,TBHP模型组能够降低HDFn的线粒体膜电位,并且模型组细胞相对荧光值相比阴性对照组明显降低(P<0.05),这表明TBHP作用HDFn 2 h后出现了大量细胞凋亡。
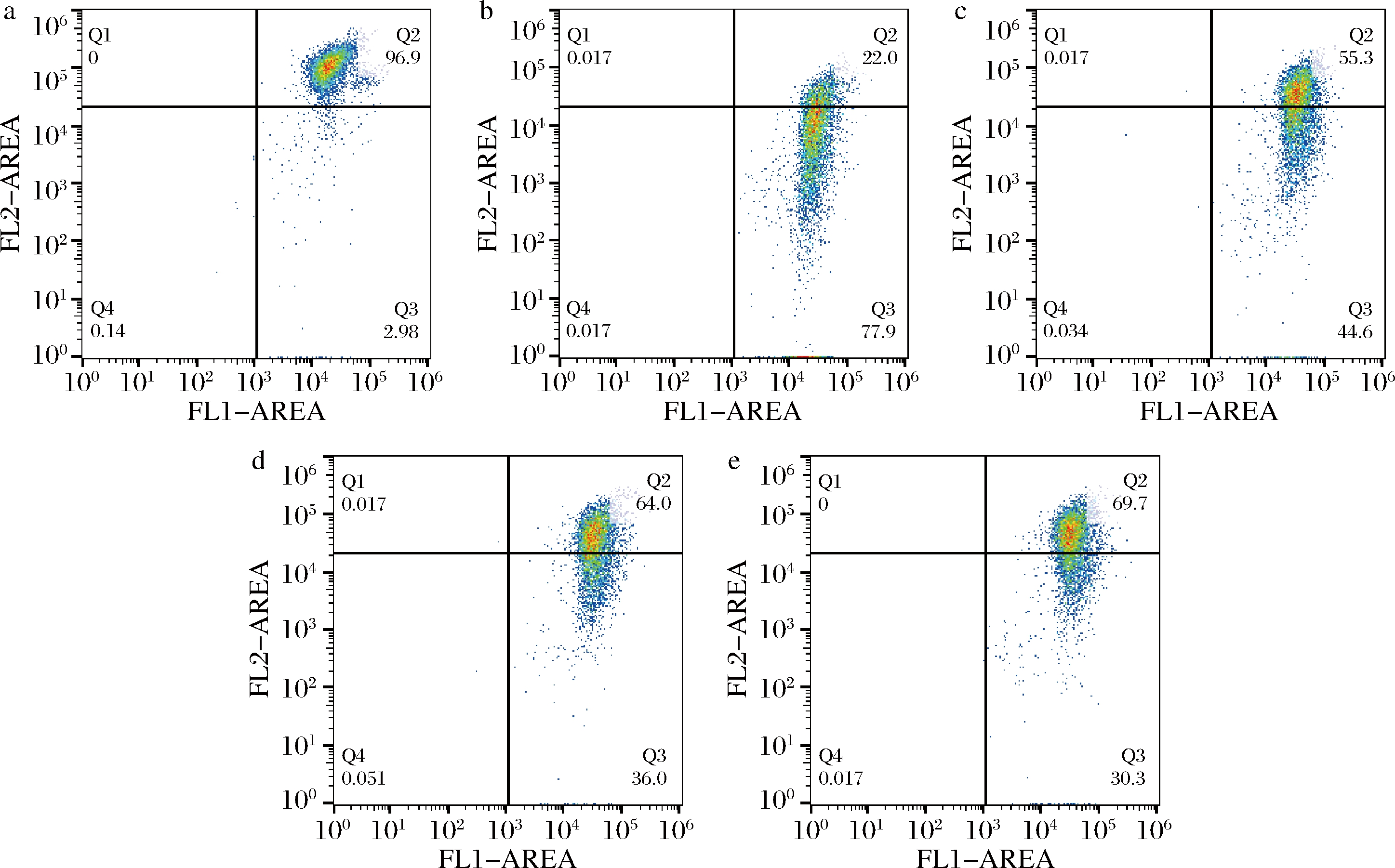
a-阴性对照组;b-模型对照组;c-2.50 g/L;d-5.00 g/L;e-10.00 g/L
图4 流式细胞仪检测GLSE对HDFn线粒体膜电位的影响
Fig.4 Effect of GLSE on mitochondrial membrane potential of HDFn detected by flow cytometry
如图5所示,GLSE作用HDFn后能够增加TBHP损伤后的细胞线粒体膜电位,说明GLSE能够抑制TBHP诱导HDFn的线粒体损伤。KOU等[21]研究发现灵芝三萜类成分对H2O2诱导的SH-SY5Y细胞具有保护作用,能够有效地降低线粒体膜电位。
2.6 GLSE对HDFn中β-半乳糖苷酶活性的影响
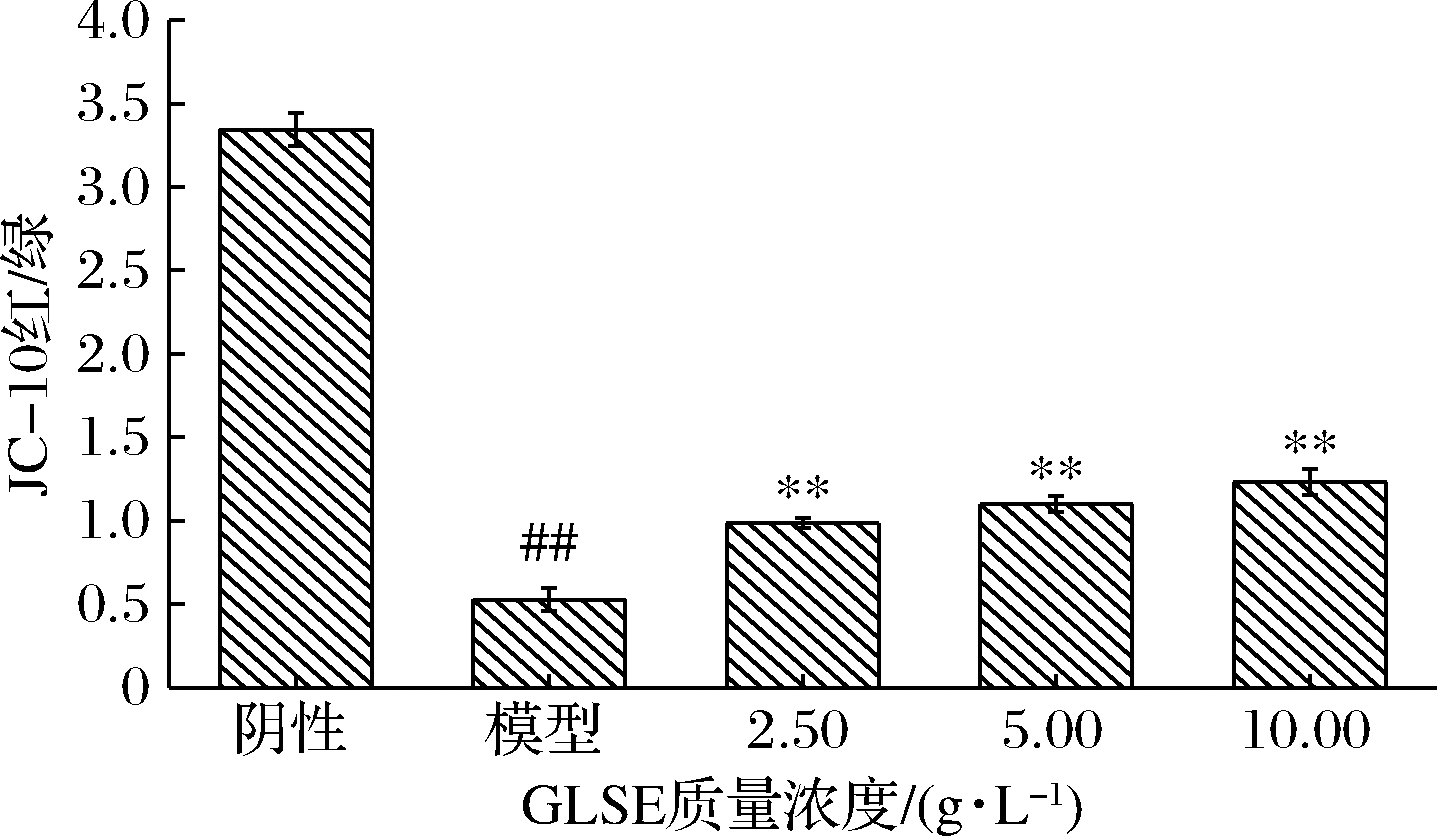
图5 GLSE对HDFn线粒体膜电位的影响
Fig.5 Effect of GLSE on mitochondrial membrane potential of HDFn
衰老相关β-半乳糖苷酶(senescence-associated β galactosidase,SA-β-gal)活性的检测用于识别细胞的衰老状态是目前使用最广泛的方法。模型组中大量的细胞被染成蓝色,即衰老阳性细胞,细胞发生衰老后,会出现细胞形态学改变、周期阻滞、衰老相关蛋白分子的变化等特点,其中SA-β-gal是经典的衰老标志物之一[22]。如图6和图7所示,模型对照组中SA-β-Gal染色率显著升高(P<0.01);当GLSE作用HDFn后,相比模型对照组SA-β-Gal染色率显著降低(P<0.01)。说明GLSE作用HDFn后SA-β-Gal活性减弱,从而达到延缓衰老的作用。根据邹美圣等[23]的研究,灵芝多糖对血管内皮细胞SA-β-Gal活性降低起到关键作用。
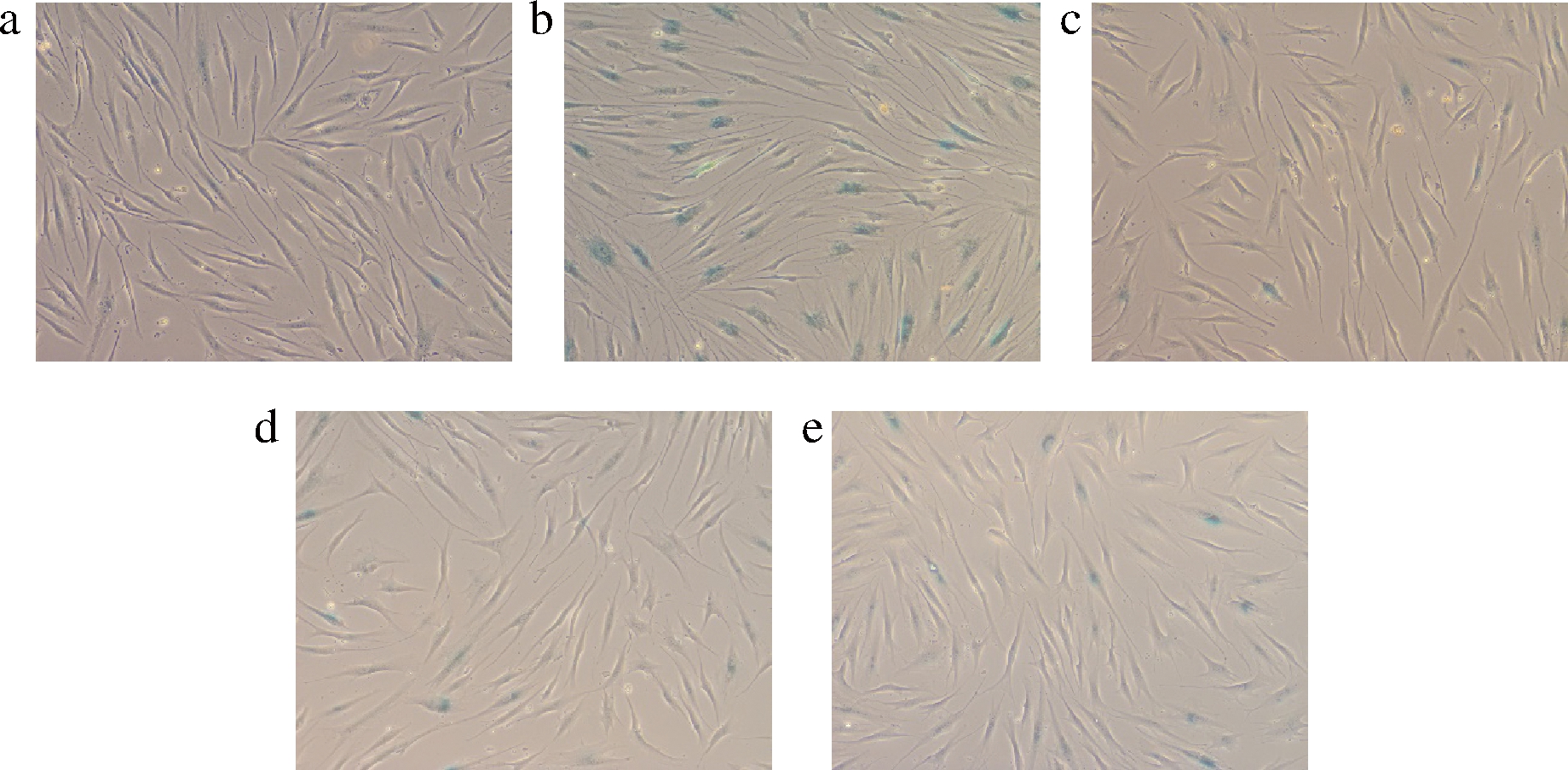
a-阴性对照组;b-模型对照组;c-2.50 g/L; d-5.00 g/L;e-10.00 g/L
图6 GLSE对SA-β-Gal活性的影响显微图片
Fig.6 Graphical representation of the effect of GLSE on HDFn SA-β-Gal activity under microscope
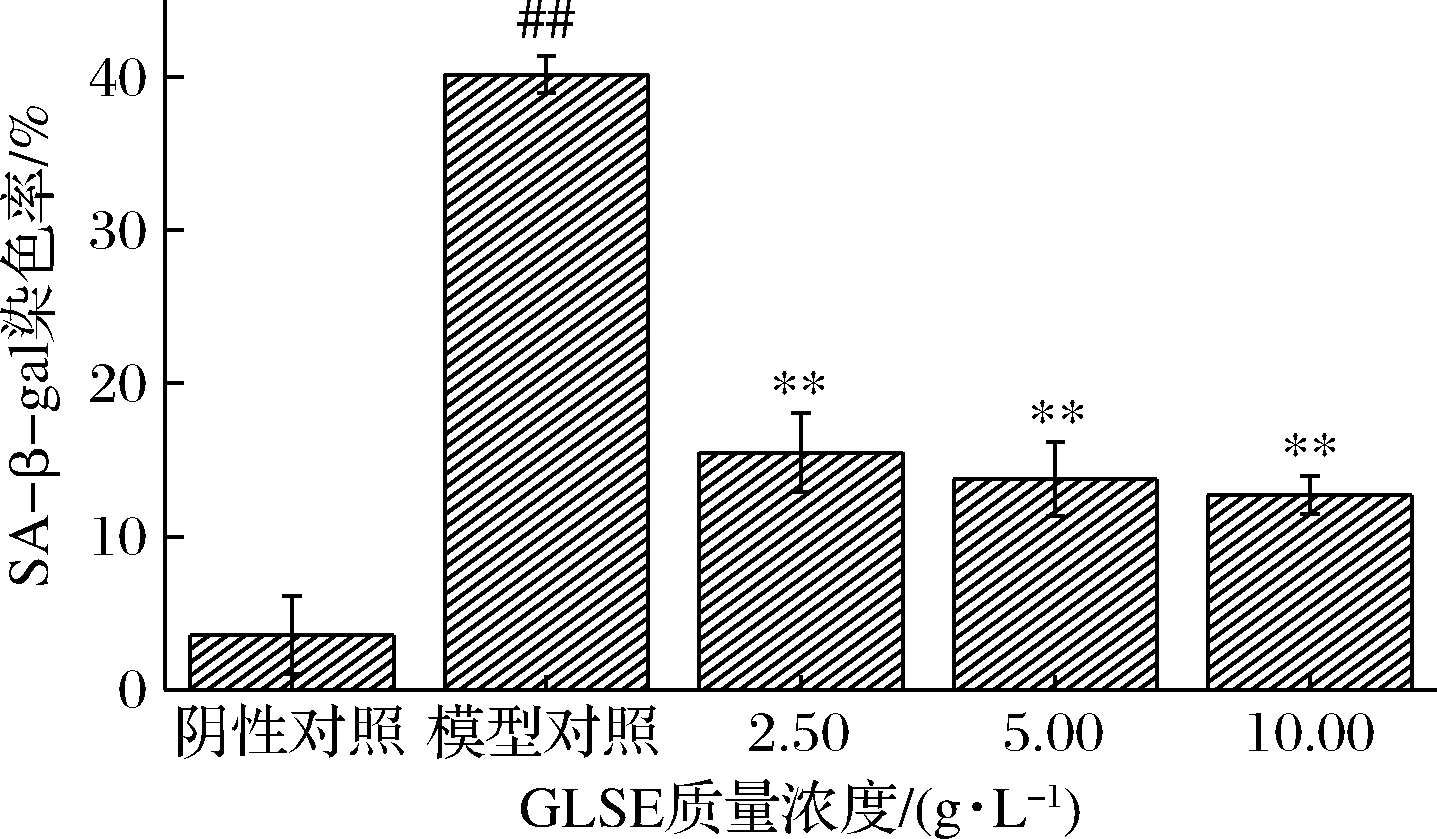
图7 GLSE对HDFn中SA-β-Gal活性的影响
Fig.7 Effect of GLSE on SA-β-Gal activity in HDFn
2.7 GLSE对HDFn中Nrf2/HO-1 mRNA表达的影响
Nrf2通路作为重要的内源性抗氧化应激通路,在氧化应激反应应答中起关键作用[24]。氧化应激状态下Nrf2信号通路激活后,启动抗氧化物酶HO-1的表达,进而影响机体内各种抗氧化酶GSH-Px和SOD的活性,在氧化/抗氧化系统中起到重要作用[25-26]。如图8所示,与模型组比较,10 g/L的GLSE作用于HDFn后Nrf2和HO-1表达量均显著增加(P<0.01)。说明GLSE能够通过激活Nrf2/HO-1通路发挥抗氧化应激的保护作用。张佳婵等[27]研究灵芝菌丝体多糖对人皮肤成纤维细胞氧化应激损伤,发现灵芝多糖抗氧化应激作用与Keap1-Nrf2/ARE信号通路密切相关。

图8 GLSE对HDFn中Nrf2/HO-1 mRNA 相对表达量的影响
Fig.8 Effect of GLSE on relative Nrf2/HO-1 mRNA expression of HDFn
3 结论
当GLSE质量浓度为10 g/L及以下时,HDFn的细胞存活率均超过70%,且细胞形态正常,说明GLSE在此质量浓度以下无细胞毒性作用,可用于后续试验。质量浓度为5 g/L和10 g/L的GLSE作用24 h后,能够明显提高因TBHP损伤后HDFn的活性。GLSE能够预防TBHP诱导氧化损伤,显著提高细胞内SOD和GSH-Px活力,抑制脂质的过氧化,显著降低MDA含量,从而达到延缓衰老的作用。GLSE作用于HDFn后能够增加TBHP损伤后的细胞线粒体膜电位,进一步说明其能够预防并抑制TBHP诱导HDFn的线粒体损伤。GLSE能够降低SA-β-Gal染色率,表明其能有效地抑制HDFn中 SA-β-gal活性的提升,从而达到抗衰老的作用。GLSE作用于HDFn后,能缓解TBHP诱导的细胞凋亡,同时GLSE能够上调Nrf2/HO-1基因mRNA表达,表明GLSE对TBHP诱导HDFn氧化早衰具有保护作用与Nrf2/HO-1信号通路有关。
本研究有助于阐明灵芝孢子粉提取物作为天然产物抗细胞损伤延缓皮肤衰老的作用机制,为进一步开发抗皮肤衰老保健品以及化妆品等提供了相关理论及实验依据,具有重要的社会和经济价值。
[1] 姚金福,赵婉军, 杨波, 等.灵芝孢子粉对脂多糖诱导的人气道上皮细胞损伤的保护作用[J].中国老年学杂志, 2015, 35(13):3 546-3 547.
YAO J F, ZHAO W J, YANG B, et al.Protective effect of Ganoderma lucidumspore powder on lipopolysaccharide-induced injury of human airway epithelial cells[J].Chinese Journal of Gerontology, 2015, 35(13):3 546-3 547.
[2] 刘乔,管晓辉, 黄翠菊, 等.GA的提取分离工艺优化及其体内抗氧化活性作用[J].食品科学, 2015, 36(24):89-94.
LIU Q, GUAN X H, HUANG C J, et al.Optimized extraction of crude ganoderic acid from Ganoderma lucidumspore and antioxidant effect in vivo[J].Food Science, 2015, 36(24):89-94.
[3] 刘春延,张国财, 程方志, 等.灵芝孢子粉破壁工艺优化及其抗肿瘤作用[J].食品科学, 2016, 37(14):51-55.
LIU C Y, ZHANG G C, CHENG F Z, et al.Optimization of disruption of Ganoderma lucidumspores and antitumor effect of the broken spores[J].Food Science, 2016, 37(14):51-55.
[4] 杨开,张雅杰, 张酥, 等.灵芝孢子粉低聚糖的制备及调节肠道菌群功能研究[J].食品与发酵工业, 2020, 46(9):37-42.
YANG K, ZHANG Y J, ZHANG S, et al.Preparation of Ganoderma lucidumspore oligosaccharide and its regulation on gut microbiota[J].Food and Fermentation Industries, 2020, 46(9):37-42.
[5] 刘洋,覃媚媚, 罗印斌, 等.灵芝孢子主要活性成分及其功能研究进展[J].北方园艺, 2020(5):138-146.
LIU Y, QIN M M, LUO Y B, et al.Research progress on component and function of Ganoderma lucidiumspore[J].Northern Horticulture, 2020(5):138-146.
[6] 包县峰,徐勇, 刘维明, 等.灵芝孢子粉生物活性成分及药理作用[J].食品工业科技, 2020, 41(6):325-331.
BAO X F, XU Y, LIU W M, et al.Research progress in bioactive ingredients and pharmacological functions of Ganoderma lucidumspores[J].Science and Technology of Food Industry, 2020, 41(6):325-331.
[7] 沐华,蔡铭, 徐靖, 等.破壁与去壁灵芝孢子粉的化学成分与抗氧化活性比较[J].食品工业科技, 2020, 41(10):32-37;51.
MU H, CAI M, XU J, et al.Comparative analysis of chemical composition and antioxidant activity of sporoderm-removal and sporoderm-broken Ganoderma lucidumspore powder[J].Science and Technology of Food Industry, 2020, 41(10):32-37;51.
[8] 李萌茹,周玉枝, 杜冠华, 等.中药黄酮类化合物抗衰老作用及其机制研究进展[J].药学学报, 2019, 54(8):1 382-1 391.
LI M R, ZHOU Y Z, DU G H, et al.Research progress about the anti-aging effect and mechanism of flavonoids from traditional Chinese medicine[J].Acta Pharmaceutica Sinica, 2019, 54(8):1 382-1 391.
[9] 刘世柱,吴欣灿, 胡丽玲, 等.灵芝破壁孢子粉功效成分提取条件优化及去壁全溶高含量孢子粉的制备[J].食药用菌, 2021, 29(1):56-60.
LIU S Z, WU X C, HU L L, et al.Preparation and optimization of extraction conditions of wall-removed and fully soluble high content Ganoderma lucidumspore powder[J].Edible and Medicinal Mushrooms, 2021, 29(1):56-60.
[10] 赵晶,李彦杰, 周厚勤, 等.甲基麦冬黄烷酮A降低缺氧复氧诱导PC12细胞凋亡及氧化损伤[J].中成药, 2020, 42(1):213-216.
ZHAO J, LI Y J, ZHOU H Q, et al.Methyl ophiopogon flavanone A reduces apoptosis and oxidative damage of PC12 cells induced by hypoxia/reoxygenation[J].Chinese Traditional Patent Medicine, 2020, 42(1):213-216.
[11] ISO.Biological Evaluation of Medical Devices—Part 5:Tests for in vitroCytotoxicity[S].2009.
[12] WEDELS, MARTIC I, HRAPOVIC N, et al.tBHP treatment as a model for cellular senescence and pollution-induced skin aging[J].Mechanisms of Ageing and Development, 2020, 190:111318.
[13] MANUT M, ANAND T, KHANUM F.Attenuation of cytotoxicity induced by tBHP in H9C2 cells by Bacopa monnieraand Bacoside A[J].Pathophysiology, 2018,25(2):143-149.
[14] KU ERAO, ENDLICHER R, ROU
ERAO, ENDLICHER R, ROU AR T, et al.The effect of tert-butyl hydroperoxide-induced oxidative stress on lean and steatotic rat hepatocytes in vitro[J].Oxidative Medicine and Cellular Longevity, 2014, 2014:752506.
AR T, et al.The effect of tert-butyl hydroperoxide-induced oxidative stress on lean and steatotic rat hepatocytes in vitro[J].Oxidative Medicine and Cellular Longevity, 2014, 2014:752506.
[15] 刘敏,刘晓峰, 张苏川, 等.L-茶氨酸抑制P53/P16改善D-半乳糖诱导的人脐静脉内皮细胞和心肌细胞损伤[J].临床心血管病杂志, 2020,36(1):79-82.
LIU M, LIU X F, ZHANG S C, et al.L-theanine protects against D-galactose-induced injury of human umbilical vein endothelial cells and cardiomyocytes via inhibiting P53/P16[J].Journal of Clinical Cardiology, 2020,36(1):79-82.
[16] 孟祥云,汪永锋, 杨丽霞, 等.中药多糖抗氧化作用及其机制研究进展[J].中华中医药杂志, 2018, 33(8):3 504-3 509.
MENG X Y, WANG Y F, YANG L X, et al.Research progress on antioxidant mechanism and effects of traditional Chinese medicine polysaccharides[J].China Journal of Traditional Chinese Medicine and Pharmacy, 2018, 33(8):3 504-3 509.
[17] 欧阳健明,彭花.植物多糖对细胞氧化损伤的保护和修复作用[J].暨南大学学报(自然科学与医学版), 2012, 33(5):516-523.
OUYANG J M, PENG H.Protective and repairing effects of plant polysaccharides on oxidative damaged cells[J].Journal of Jinan University(Natural Science &Medicine Edition), 2012, 33(5):516-523.
[18] 王冰心,钟铭, 卢颖裕, 等.不同多糖配伍对H2O2诱导的皮肤细胞老化的抑制作用[J].现代食品科技, 2019, 35(9):57-66;146.
WANG B X, ZHONG M, LU Y Y, et al.Inhibition of different polysaccharides on H2O2-induced skin cell aging[J].Modern Food Science and Technology, 2019, 35(9):57-66;146.
[19] ZHONGD D, WANG H K, LIU M, et al.Ganoderma lucidumpolysaccharide peptide prevents renal ischemia reperfusion injury via counteracting oxidative stress[J].Scientific Reports, 2015, 5:16910.
[20] 赵海梅,杨斌, 成蓓.衰老血管内皮细胞线粒体膜电位与活性氧的变化[J].中国组织工程研究, 2013, 17(15):2 729-2 734.
ZHAO H M, YANG B, CHENG B.Mitochondria membrane potentials and reactive oxygen species of vascular endothelial cells during senescence process[J].Chinese Journal of Tissue Engineering Research, 2013, 17(15):2 729-2 734.
[21] KOUR W, XIA B, WANG Z J, et al.Triterpenoids and meroterpenoids from the edible Ganoderma resinaceumand their potential anti-inflammatory, antioxidant and anti-apoptosis activities[J].Bioorganic Chemistry, 2022, 121:105689.
[22] HALLB M, BALAN V, GLEIBERMAN A S, et al.p16(Ink4a) and senescence-associated β-galactosidase can be induced in macrophages as part of a reversible response to physiological stimuli[J].Aging, 2017, 9(8):1 867-1 884.
[23] 邹美圣,刘凌, 刘泽, 等.灵芝多糖对血管紧张素Ⅱ诱导的血管内皮细胞衰老的干预研究[J].现代中西医结合杂志, 2012, 21(13):1 386-1 387;1 390.
ZOU M S, LIU L, LIU Z, et al.Ganoderma lucidumpolysaccharides’ intervention on the aged endothelial cell induced by angiotensin Ⅱ[J].Modern Journal of Integrated Traditional Chinese and Western Medicine, 2012, 21(13):1 386-1 387;1 390.
[24] QAISIYAM, CODA ZABETTA C D, BELLAROSA C, et al.Bilirubin mediated oxidative stress involves antioxidant response activation via Nrf2 pathway[J].Cellular Signalling, 2014, 26(3):512-520.
[25] HUT X, WEI G, XI M M, et al.Synergistic cardioprotective effects of Danshensu and hydroxysafflor yellow A against myocardial ischemia-reperfusion injury are mediated through the Akt/Nrf2/HO-1 pathway[J].International Journal of Molecular Medicine, 2016, 38(1):83-94.
[26] 李孟心,张枫惠, 韩高链, 等.Nrf2/HO-1信号通路在人诱导性多能干细胞氧化应激中的作用[J].中国生物化学与分子生物学报, 2019, 35(7):794-802.
LI M X, ZHANG F H, HAN G L, et al.The role of the Nrf2/HO-1signal pathway in oxidative stress of human induced pluripotent stem cells[J].Chinese Journal of Biochemistry and Molecular Biology, 2019, 35(7):794-802.
[27] 张佳婵,邵卿, 王倩, 等.灵芝菌丝体多糖对人皮肤成纤维细胞氧化应激损伤的防护机制[J].食品科学, 2020, 41(13):174-183.
ZHANG J C, SHAO Q, WANG Q, et al.Extraction and purification of Ganoderma lucidumpolysaccharides and mechanistic study of their protective effect against oxidative stress injury in human skin fibroblast cells[J].Food Science, 2020, 41(13):174-183.