金黄色葡萄球菌(Staphylococcus aureus)是食品中常见的致病菌,其分泌产生的肠毒素引起食物中毒的阈值仅为18 μg[1]。S.aureus形成的生物被膜为细菌构建的保护性生长环境,使其不断增殖扩散、产生毒素[2],并诱发食物中毒、食源性病原体交叉感染[3]。生物被膜不同于浮游细菌,是由细菌分泌的多糖基质、纤维蛋白、脂质蛋白等多聚物构成胞外基质,包裹自身并附着于惰性或活性实体表面的细菌聚集物[4],其形成是一个动态过程,可概括为4个阶段:黏附、生长、成熟、扩散[5]。致病菌的生物被膜可保护其菌落免受宿主免疫系统和抗菌治疗的影响,进而引发食物中毒等疾病,抑制致病菌的生物被膜对预防食源性疾病的暴发至关重要。
目前,控制致病菌生物被膜的方法有化学法、食品添加剂法、抗生素法、抗菌肽法等。但化学法如EDTA仅能抑制而不能清除被膜[6];食品添加剂、抗生素虽对被膜有一定的抑制作用[7-8],但易产生耐药性[9];细菌素是细菌在生长代谢过程中分泌的具有抗菌活性的多肽[10],其中最常见的乳酸链球菌素(nisin)具有安全、高效、无毒副作用等性质,并对S.aureus生物被膜有一定的抑制效果。马伊萨兰等[11]研究发现nisin对16株受试S.aureus菌株的最小抑菌浓度(minimum inhibitory concentration,MIC)范围为1~0.125 g/L,1/4MIC时对被膜有较好的抑制效果;在OKUDA等[12]的研究中,nisin对S.aureus生物被膜的MIC为1.25~2.5 μg/mL,显著低于其他种类的细菌素。但nisin的抑菌效果有限[11],并且成本较高。
现有研究发现,nisin与其他物质联用,能够增强其抑菌效果并扩大抑菌谱、降低剂量[13],可联合的物质包括植物精油、抗菌肽、中草药等。其中,中药由于具有来源广泛、价格低、毒副作用小、不易产生耐药性和作用靶位多等优点受到人们的关注,穿心莲内酯、黄连、五味子、黄芩素、和厚朴酚等被发现对生物被膜有显著抑制效果[14-17]。
本研究希望筛选出可与nisin联合抑制S.aureus生物被膜的中药成分,能够降低nisin的使用剂量并增强抑制效果,根据棋盘法确定二者联用时抑制被膜的最佳浓度配比,探究二者联用时在抑制被膜形成过程中的作用机制,并确定最佳抑制和清除时间,最后通过扫描电镜(scanning electron microscope,SEM)观察二者联用对被膜形态结构的影响。预期研究成果可为控制S.aureus生物被膜提供新策略,为防控食品中S.aureus的污染和研发更高效的天然食品防腐剂奠定基础。
1 材料与方法
1.1 材料与试剂
S.aureusATCC 25923、S.aureusATCC 6538、S.aureusATCC 29213,本实验室保存;1%结晶紫染液、nisin、XTT,上海源叶生物科技有限公司;黄芩素、穿心莲内酯、和厚朴酚,道斯夫生物科技有限公司;2.5%戊二醛,雷根生物科技有限责任公司;甲萘醌,北京索莱宝科技有限公司。
1.2 仪器与设备
SpectraMax i3酶标仪,Molecular Devices;SPX-150B-Z电热恒温培养箱、WG9220A电热鼓风干燥箱,上海博讯实业有限公司医疗设备厂;12孔/96孔板,Costar;SU8010场发射扫描电子显微镜、E-1010离子溅射仪,日立高新;EM CPD300全自动临界点干燥仪,徕卡。
1.3 实验方法
1.3.1 抑制S.aureus生物被膜中药成分的筛选
将100 μL培养至对数期的S.aureus菌悬液加入96孔板中,分别加入100 μL 1 mg/mL nisin、200 μg/mL穿心莲内酯、40 μg/mL黄芩素、10 μg/mL和厚朴酚、100 μL 0.01 mol/L PBS作对照,37 ℃培养24 h。培养后弃菌液,PBS洗涤2次,加入0.1%结晶紫溶液染色30 min,冲洗后加入0.1%乙酸和95%乙醇溶液各100 μL,用酶标仪于595 nm测定吸光值。
1.3.2 nisin与黄芩素对S.aureus生物被膜半数抑菌浓度的测定
将nisin和黄芩素进行二倍稀释,在96孔板中加入100 μL nisin或黄芩素,及100 μL菌液,以100 μL 0.01 mol/L PBS作对照,置于37 ℃培养24 h。培养后去菌液,洗涤2次,加入158 μL含20 g/L葡萄糖的PBS缓冲液、40 μL XTT和2 μL甲萘醌,覆盖铝箔置于37 ℃避光培养3 h。移取100 μL液体至一新96孔板中,于492 nm测定吸光值。
1.3.3 nisin与黄芩素联用对S.aureus生物被膜的抑制效果
采用棋盘法在96孔板中检测nisin与黄芩素的联用效果。在96孔板中按梯度加入100 μL不同终浓度的nisin和黄芩素,及100 μL菌液,以100 μL 0.01 mol/L PBS作对照,于37 ℃培养24 h,测定nisin与黄芩素联合作用效果,方法同1.3.2。通过部分抑菌浓度指数(fractional inhibitory concentration,FIC)判定联合作用效果,抑菌浓度指数按照公式(1)计算。
(1)
式中:![]() 化合物A单用时
化合物A单用时![]() 化合物B单用时
化合物B单用时![]() 种化合物联用时达到相同药效(等效位点)时化合物A的浓度,
种化合物联用时达到相同药效(等效位点)时化合物A的浓度,![]() 种化合物联用时达到等效位点时化合物B的浓度,mol/mL。结果评价:FIC≤0.5,协同作用;0.5
种化合物联用时达到等效位点时化合物B的浓度,mol/mL。结果评价:FIC≤0.5,协同作用;0.5
1.3.4 nisin与黄芩素联用对S.aureus生物被膜的抑制机制
1.3.4.1 nisin与黄芩素联用对S.aureus生物被膜黏附力的影响
为探究nisin与黄芩素联用时对S.aureus生物被膜的抑制机制,设置如下分组:(1)nisin单用组:终质量浓度为0.062 5 mg/mL的nisin;(2)黄芩素单用组:终质量浓度为3.125 μg/mL的黄芩素;(3)nisin与黄芩素联用组:上述终浓度的二者混合物;(4)未加入药物的空白对照组:0.01 mol/L PBS。向12孔板每孔中加入600 μL 3%琼脂,凝固后插入盖玻片,加入100 μL菌液,按分组加入100 μL不同溶液,于37 ℃下培养24 h。培养后,吸取浮游细胞(supernatant cell)于第一个离心管中,PBS清洗黏附细胞(adhered cell),并吸取于第二个离心管中。于12 000 r/min下离心5 min,洗涤2次并重悬,于600 nm处测定吸光值,黏附率按照公式(2)计算。
黏附率![]() 100
100
(2)
1.3.4.2 nisin与黄芩素联用对S.aureus生物被膜自动聚集能力的影响
按1.3.4.1的方法培养生物被膜。培养后去菌液,转移至离心管中,于12 000 r/min下离心5 min,洗涤2次并重悬,调整OD600为0.5±0.05(ODinitial)。于37 ℃下培养8 h,培养后上层液体于600 nm测定吸光值(ODtreated)。
自动聚集能力![]()
(3)
1.3.4.3 nisin与黄芩素联用对S.aureus生物被膜疏水作用的影响
按1.3.4.2的方法制备调整吸光值后的细胞悬浮液(ODinitial)。将2 mL细胞悬浮液与0.5 mL氯仿混合,振荡2 min。37 ℃培养15 min,于600 nm处测定水层吸光值(ODtreated)。
疏水性![]()
(4)
1.3.4.4 nisin与黄芩素联用对S.aureus生物被膜胞外多糖(exopoly saccharides,EPS)产生量的影响
按1.3.4.1的方法培养生物被膜。培养后去菌液,转移至离心管中,于8 000 r/min下离心10 min,添加1 mL 1.5 mol/L NaCl溶液。于5 000 r/min下离心10 min,将60 μL上清液、60 μL 5%苯酚和4 mL硫酸混合。30 ℃培养10 min,于600 nm处测定吸光值,EPS产量按照公式(5)计算。
EPS产量![]()
(5)
1.3.4.5 nisin与黄芩素联用对S.aureus生物被膜eDNA产生量的影响
按1.3.4.1的方法培养生物被膜。培养后去菌液,洗涤2次并重悬,于10 000 r/min离心2 min,取上清液,按照TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒提取eDNA,eDNA产量按照公式(6)计算。
eDNA产生量![]()
(6)
1.3.5 nisin与黄芩素联用时S.aureus生物被膜的生长曲线
在96孔板中加入100 μL菌液,分别加入100 μL终质量浓度为0.062 5 mg/mL的nisin、3.125 μg/mL的黄芩素及二者的混合物(抑制组直接加入相应药物,清除组于37 ℃培养24 h后去除菌液再加入相应药物),以100 μL 0.01 mol/L PBS作空白对照,置于37 ℃培养,分别于3、6、9、12、18、24、36 h按1.3.2的方法测定生物被膜的抑制率和清除率。
1.3.6 nisin与黄芩素联用对S.aureus生物被膜形态结构的影响
在12孔板中依次放入圆形盖玻片,按1.3.4.1的方法培养生物被膜。培养后去菌液,洗涤2次,加入1 mL 2.5%戊二醛溶液固定8 h。洗涤3次,依次用50%、70%、85%、95%乙醇脱水1次,无水乙醇脱水2次,取出盖玻片进行真空干燥,对整个样品喷金后使用扫描电镜观察S.aureus生物被膜形态。
1.4 数据分析
结果均为3 次独立重复实验数据的平均值,采用GraphPad Prism 8进行数据分析和作图,并利用SPSS 17.0进行方差分析。P<0.05,差异显著,P<0.01,差异极显著。
2 结果与分析
2.1 可与nisin联用抑制S.aureusATCC 6538生物被膜的中药成分
中药成分对S.aureus生物被膜的抑制效果具有特异性。穿心莲内酯、黄芩素、nisin均可抑制3株S.aureus生物被膜(图1)。
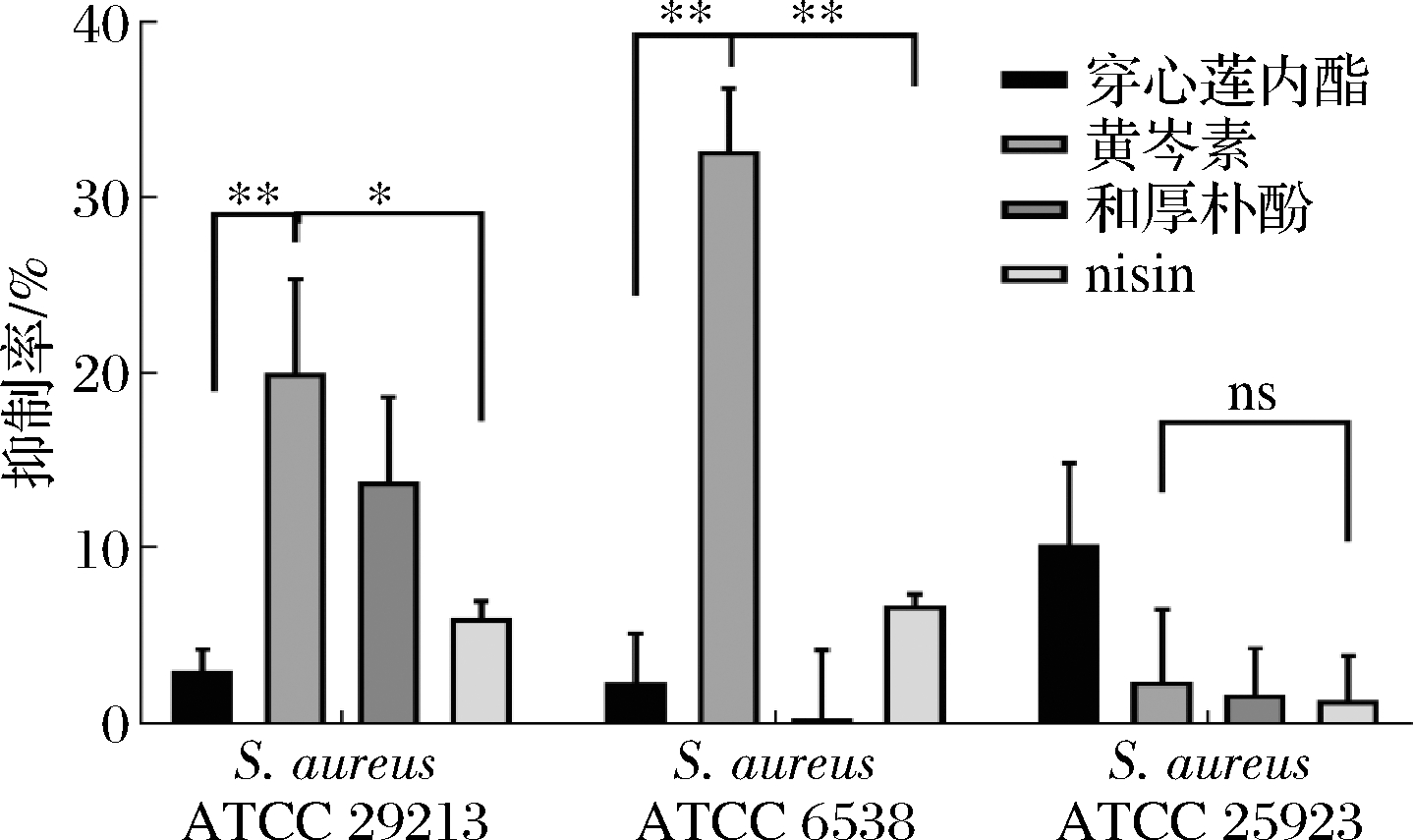
图1 天然活性成分对S.aureusBF的抑制率
Fig.1 Inhibition of natural active ingredients on S.aureusBF
其中,黄芩素对2株菌的抑制效果较好,而穿心莲内酯和和厚朴酚仅对1株菌有较好的抑制效果,相较于另两种中药成分黄芩素的抑制效果更广泛;黄芩素对S.aureusATCC 6538生物被膜的抑制效果最为显著,抑制率为34.85%,且与其他相比有极显著差异。因此,后续试验选用黄芩素,研究其与nisin联用时对S.aureusATCC 6538生物被膜的抑制效果。
2.2 nisin与黄芩素对S.aureusATCC 6538生物被膜的MIC50
采用二倍稀释法和XTT还原法测定nisin和黄芩素单用时对S.aureusATCC 6538生物被膜的半数抑制浓度(median inhibition concentration,MIC50),二者单用对生物被膜的抑制率随nisin浓度的降低而下降(图2)。nisin质量浓度为0.5 mg/mL时,对被膜的抑制率为66.19%(图2-a)。黄芩素质量浓度为0.1 mg/mL时,抑制率为51.01%;并当黄芩素浓度低于MIC50时抑制效果逐渐减弱(图2-b)。
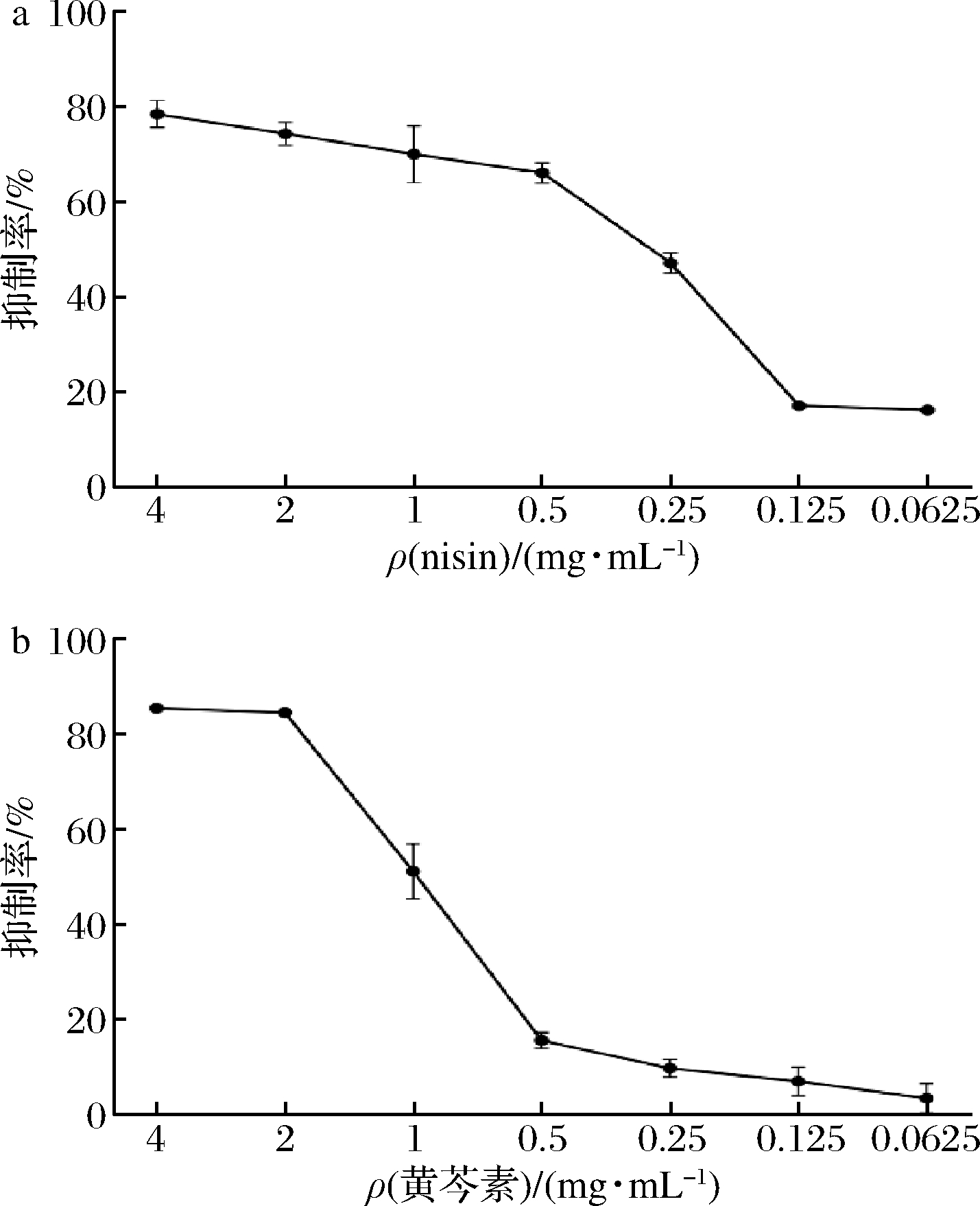
a-nisin对S.aureusATCC 6538 BF的抑制率; b-黄芩素对S.aureusATCC 6538 BF的抑制率
图2 不同浓度的nisin及黄芩素对S.aureus ATCC 6538 BF的抑制率
Fig.2 Inhibition of different concentrations of nisin and baicalein on S.aureusATCC 6538 BF
nisin和黄芩素对S.aureusATCC 6538生物被膜的MIC50值分别为0.5、0.1 mg/mL。结果表明,黄芩素的抑制效果要优于nisin,后续试验探讨二者联用对被膜的抑制效果。
2.3 nisin与黄芩素联用对生物被膜的抑制效果
采用基于LA理论非参数模型的FIC法,测定nisin与黄芩素联用时对S.aureusATCC 6538生物被膜的抑菌效果结果见图3。随着nisin与黄芩素浓度的降低,抑制率也随之所下降。
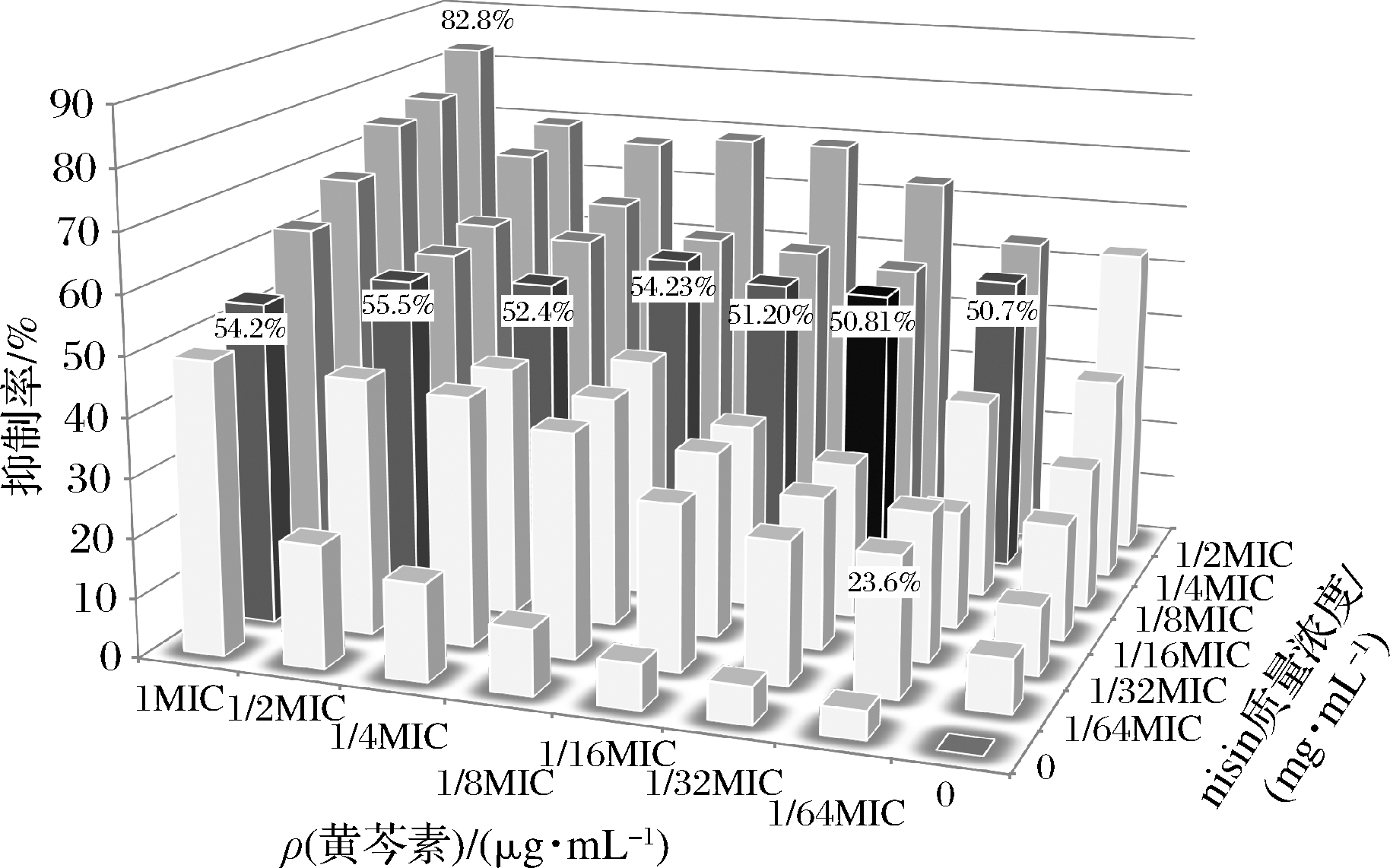
图3 nisin与黄芩素在不同浓度组合下对S.aureus ATCC 6538 BF的抑制率
Fig.3 Inhibition of S.aureusATCC 6538 BF by nisin and baicalein at different concentration combinations
二者在多个浓度组合下均对被膜的抑制率达到50%以上;最小的抑制效果是在1/64 MIC50的nisin与1/64 MIC50的黄芩素组合下,抑制率为23.6%;最大的抑制效果是在1/2 MIC50的nisin与1MIC50的黄芩素组合下,抑制率达到了82.8%。根据FIC值计算结果,可以得出nisin与黄芩素联用时的最佳配比质量浓度分别为0.062 5 mg/mL、3.125 μg/mL,此时的FIC值是0.281 25,对S.aureusATCC 6538生物被膜表现出协同抑菌效应,抑制率为50.8%(表1)。
表1 nisin与黄芩素在不同浓度组合下的 FIC值及药物联用关系
Table 1 FIC values and drug combination relationship of nisin and baicalin at different concentrations

浓度组合nisin黄芩素FIC值药物联用关系1/64 MIC501 MIC501.031 25无关1/32 MIC501/2 MIC500.562 5相加1/16 MIC501/4 MIC500.375协同1/8 MIC501/8 MIC500.375协同1/8 MIC501/16 MIC500.312 5协同1/8 MIC501/32 MIC500.281 25协同1/4 MIC501/64 MIC500.515 625相加
2.4 nisin与黄芩素联用抑制S.aureusATCC 6538生物被膜的形成过程
为研究nisin和黄芩素对S.aureusATCC 6538的抗被膜机制,检测了培养24 h成熟状态下生物被膜的黏附能力、自动聚集能力、疏水性和EPS、eDNA的含量。表2显示了nisin和黄芩素对S.aureusATCC 6538生物被膜表面特征的影响。结果表明,与空白对照相比,不论是二者单用还是联用均对被膜的黏附力、自动聚集和疏水作用均产生抑制效果;在黏附力试验中二者联用与nisin单用、空白对照相比有显著差异,抑制效果虽优于黄芩素单用但无显著差异,表明二者联用可在一定程度上增强nisin对被膜黏附能力的抑制效果;在自动聚集和疏水作用试验中,二者单用均可抑制被膜,并无显著性差异,且二者联用时抑制效果更显著。表明黄芩素能增加nisin对S.aureusATCC 6538生物被膜的抑制效果,当二者联用时可显著抑制被膜的黏附力、自动聚集和疏水作用。
表2 nisin与黄芩素联用对S.aureusATCC 6538 BF 表面特征的影响
Table 2 Effects of nisin and baicalein on cell surface characteristics of S.aureusATCC 6538 BF

表面特征空白nisin黄芩素nisin+黄芩素黏附力/%57.8±0.7a50.6±2.2b45.4±1.4c43.7±0.5c自动聚集/%26.7±3.6a13.3±3.1b8.5±2.1b2.7±1.3c疏水作用/%21.7±2.3a13.2±1.6b9.1±2.0b2.1±0.1c
图4显示了nisin和黄芩素对S.aureusATCC 6538生物被膜EPS、eDNA产生量的影响。结果表明,不论是二者单用还是联用,与对照组相比被膜的EPS、eDNA产生量均下降;黄芩素单用、nisin与黄芩素联用均可极显著抑制EPS、eDNA的产生,抑制效果要优于nisin单用。
以上结果可表明,nisin与黄芩素联用组可显著抑制S.aureusATCC 6538生物被膜形成的各个阶段,包括:(1)被膜黏附于介质上的黏附阶段;(2)通过自动聚集和疏水作用在被膜间建立连接、EPS产生的成长阶段;(3)eDNA起到维持和稳定的成熟阶段。
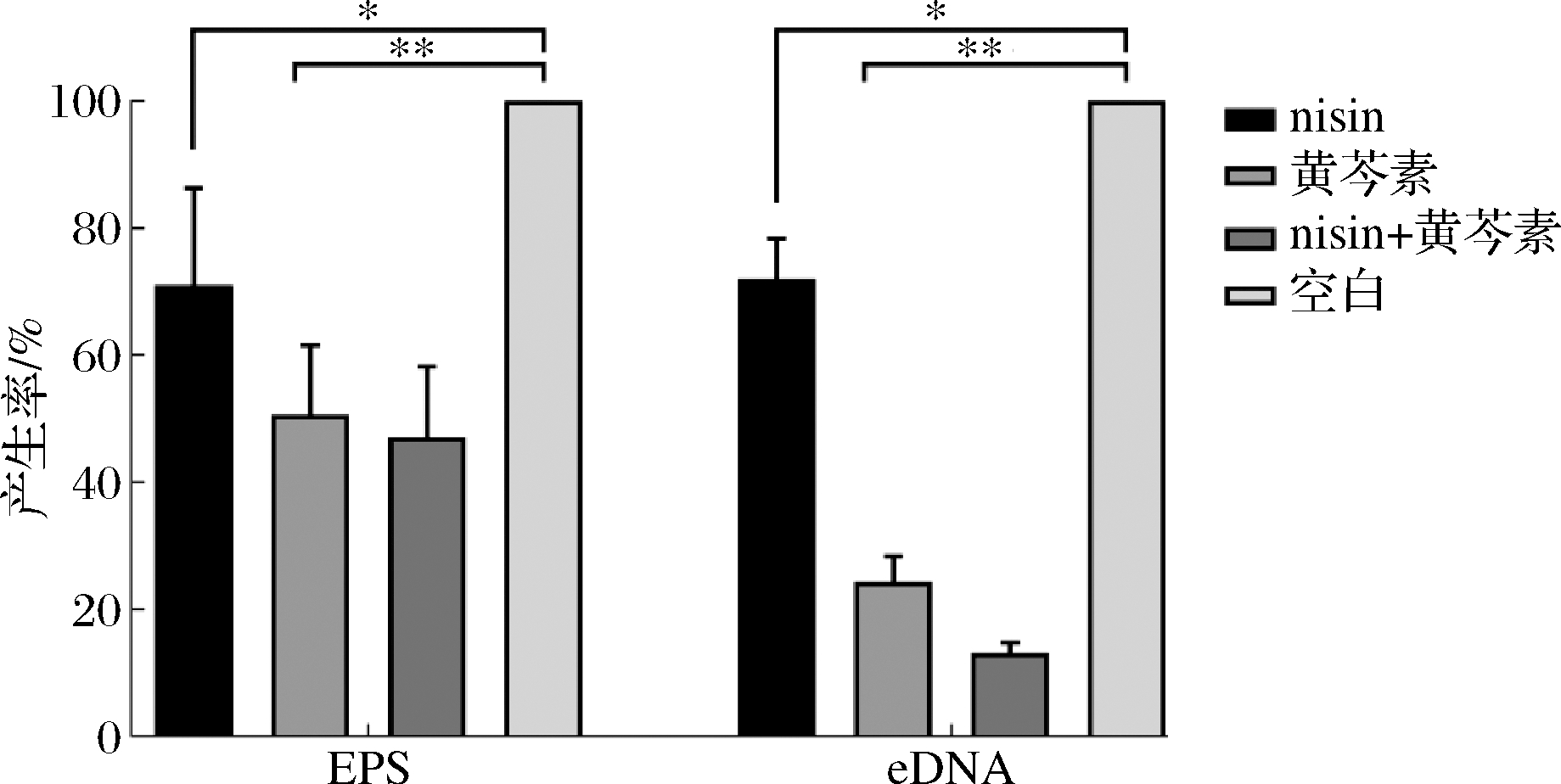
图4 Nisin与黄芩素联用对S.aureusATCC 6538 BF EPS、eDNA产生率的影响
Fig.4 Effects of nisin and baicalein on EPS and eDNA production of S.aureus ATCC 6538 BF
2.5 nisin与黄芩素联用影响S.aureusATCC 6538生物被膜的生长曲线
nisin与黄芩素单用及联用时均对S.aureusATCC 6538生物被膜具有抑制和清除效果,都在18 h时到达峰值,超过18 h后抑制率和清除率有所下降(图5)。
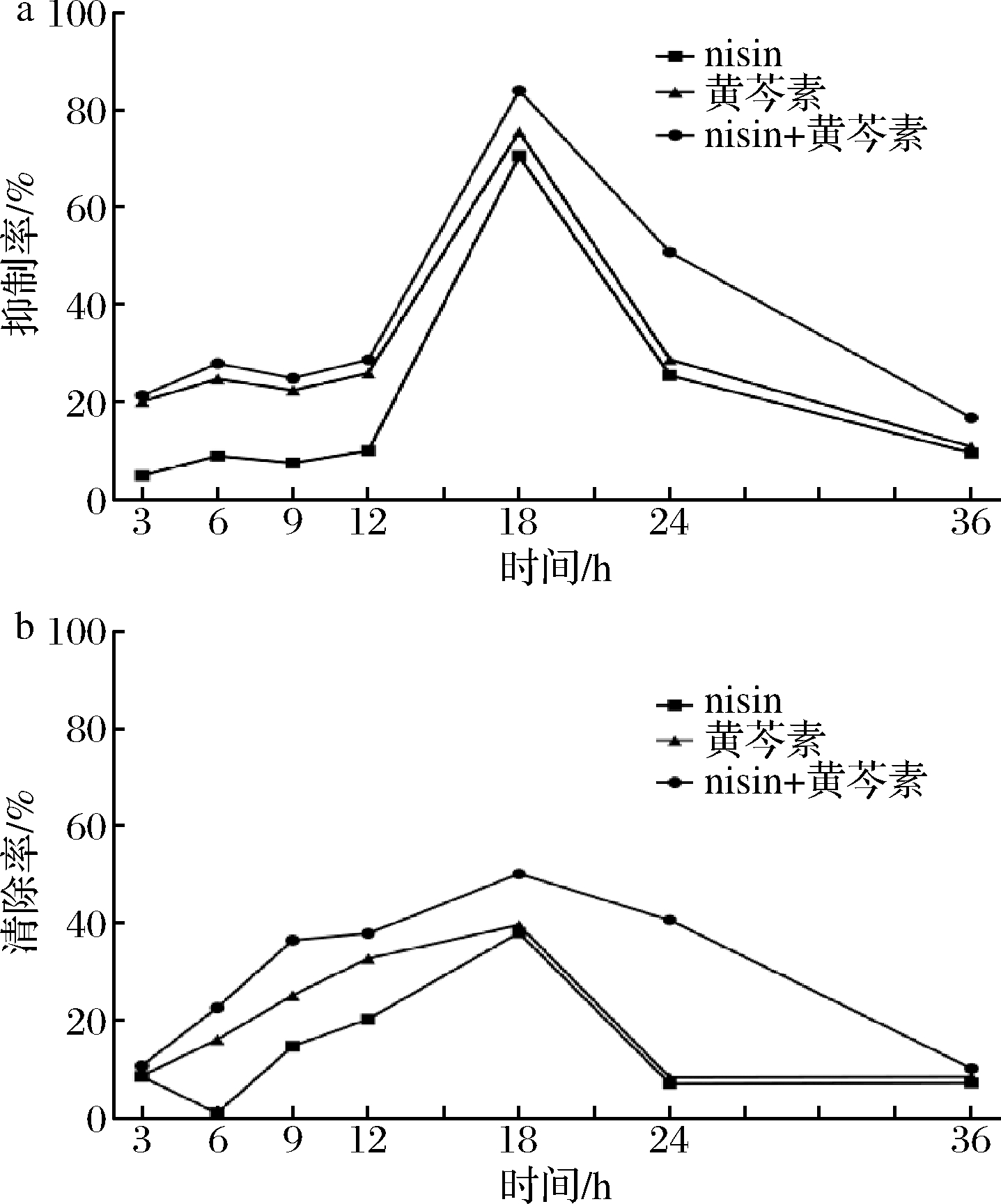
a-抑制率-时间曲线;b-清除率-时间曲线
图5 S.aureusATCC 6538 BF生长曲线
Fig.5 Growth curve of S.aureusATCC 6538 BF
且二者联用比单用时对被膜的抑制和清除效果更佳,在18 h时达到峰值,抑制率为84.1%,清除率仅为50.11%。此外,结果表明二者联用的抑制效果要优于清除效果。
2.6 nisin与黄芩素联用影响S.aureusATCC 6538生物被膜形态结构
扫描电子显微镜观察在最佳浓度配比下nisin与黄芩素联用对S.aureusATCC 6538生物被膜的形态结构变化的影响。在对照组中,形成了具有厚而多层、复杂且成团的被膜结构(图6-D、图6-d);nisin(图6-A、图6-a)与黄芩素(图6-B、图6-b)单用时,均对被膜产生了抑制效果,但还有明显的成团、多层现象;二者联用时(图6-C、图6-c),被膜附着大量减少,菌落分明。结果表明,SEM证实了nisin与黄芩素联用抑制了S.aureus ATCC 6538生物被膜的形成。

A-nisin(×1 000);B-黄芩素(×1 000); C-nisin+黄芩素(×1 000);D-空白(×1 000); a-nisin(×5 000);b-黄芩素(×5 000); c-nisin+黄芩素(×5 000);d-空白(×5 000)
图6 S.aureusATCC 6538 BF形态观察
Fig.6 Morphological observation of S.aureusATCC 6538 BF
3 讨论
本试验发现,当1/2MIC50的nisin与1MIC50的黄芩素联用时,达到了二者单用时对S.aureus生物被膜的抑制效果,并且还降低了药物浓度,有减量增效的抑制效果。其他研究也同样发现了这种减量增效的抑制效果,黄芩素在与左氧氟沙星联用时可以增强其对S.aureus生物被膜的抑制效果[16];左氧氟沙星联合黄连、黄芩、乌梅、五味子4种中药成分时,对鲍曼不动杆菌生物被膜的抑制效果均起到协同或相加作用[17]。但目前关于黄芩素影响细菌生物被膜形成的作用机制尚缺乏系统的研究。
为探究nisin与黄芩素联用时对S.aureusATCC 6538生物被膜的抑制作用机制,本试验检测了被膜的黏附能力、自聚集能力、疏水性、EPS和eDNA的产生量,这些都与被膜的形成相关[18-19]。生物被膜的形成是一个动态的过程,可以概括为4个阶段:黏附、生长、成熟、扩散[5]。其中,黏附是形成的关键步骤,ARCHER等[20]研究发现S.aureus生物被膜依赖于胞外多糖黏附因子,通过黏附因子对载体进行黏附而形成的。在本试验中,nisin与黄芩素联用对被膜的黏附力有显著的抑制效果,在KIM等[18]的研究中,同样发现了酿酒酵母无细胞上清液可抑制S.aureus生物被膜的黏附能力;ISLAM等[21]也发现1-deoxynojirimycin可在变形链球菌生物被膜形成的黏附阶段起到抑制作用。黏附在载体上的被膜通过自动聚集和疏水作用相互建立连接,是其成长阶段,并且在这个阶段还会大量释放EPS,使细菌形成微菌落,最终形成具有一定厚度的被膜。在本试验中,nisin与黄芩素联用对被膜的疏水作用与自动聚集有显著的抑制效果,且可显著降低EPS的产生率,表明二者联用也可对S.aureusATCC 6538生物被膜的生长阶段产生显著的抑制效果。在赵柳娅等[15]的研究中也证实黄芩素对致病菌生物被膜生长阶段的抑制效果,该研究发现黄芩素与氟康唑联用可降低白念珠菌生物被膜的细胞表面疏水性,由此影响被膜形成;SONG等[22]的研究表明葡萄柚籽提取物也可抑制大肠杆菌生物被膜的生长阶段,降低其疏水性和EPS产生量。此外,eDNA是S.aureusATCC 6538生物被膜中最常见的成分[23],在被膜的初始黏附阶段和后期成熟阶段发挥着重要作用,可维持并稳定成熟的被膜[24]。本试验研究结果显示nisin与黄芩素联用可降低S.aureusATCC 6538生物被膜的eDNA产生量,张洺嘉等[25]同样发现,nisin与黄芩素联用可降低S.aureus生物被膜的eDNA产生量,表明两种药物的联用可以显著抑制被膜的成熟阶段。总之,nisin与黄芩素联用可显著影响S.aureusATCC 6538生物被膜形成的全过程,从而抑制被膜的形成,最终达到抑制S.aureus的效果。
此外,药物对致病菌生物被膜的抑制效果也受作用时间的影响。本研究发现在18 h时nisin与黄芩素联用对S.aureus ATCC 6538生物被膜的抑制和清除效果最佳,而不是随时间的延长,抑制和清除效果也随之增长,可能是由于药物被菌株降解或生物被膜浓度过高所造成的。这一现象在ISLAM等[21]的研究中也同样出现,在该研究中1-deoxynojirimycin对变形链球菌生物被膜黏附性的抑制作用,在12 h时为最佳,抑制率为72.2%,高于20和24 h。以上结果表明,在探讨药物对致病菌生物被膜的抑制效果的作用机制的同时,也要关注药物作用时间对抑制效果的影响。
4 结论
本研究发现nisin与黄芩素对S.aureusATCC 6538生物被膜的MIC50分别为0.5、0.1 mg/mL;二者联用时多个浓度配比均协同抑制被膜,并可达到减量增效的抑制效果,其中最佳质量浓度配比为0.062 5 mg/mL的nisin联合3.125 μg/mL黄芩素;二者联用时对被膜的抑制与单用和空白对照相比均有显著的效果,且影响其形成的各个阶段:抑制被膜附着于介质表面的黏附阶段,发挥疏水作用、自动聚集能力并产生EPS的成长阶段,eDNA产生的成熟阶段;在18 h时二者联用对被膜的抑制和清除效果最佳;SEM也观察到二者联用时被膜附着大量减少,菌落分明。总之,nisin与黄芩素联用可协同抑制S.aureusATCC 6538生物被膜。下一步将继续研究与生物被膜合成相关基因的转录水平,从分子层面揭示nisin与黄芩素联用时对生物被膜的作用机制。
[1] ETTERD, SCHELIN J, SCHUPPLER M, et al.Staphylococcal enterotoxin C-an update on SEC variants, their structure and properties, and their role in foodborne intoxications[J].Toxins, 2020, 12(9):584.
[2] LISTERJ L, HORSWILL A R.Staphylococcus aureusbiofilms:Recent developments in biofilm dispersal[J].Frontiers in Cellular and Infection Microbiology, 2014, 4:178.
[3] CHICURELM.Slimebusters[J].Nature, 2000, 408(6 810):284-286.
[4] FIGUEIREDOA M S, FERREIRA F A, BELTRAME C O, et al.The role of biofilms in persistent infections and factors involved in ica-independent biofilm development and gene regulation in Staphylococcus aureus[J].Critical Reviews in Microbiology, 2017, 43(5):602-620.
[5] TOYOFUKUM, INABA T, KIYOKAWA T, et al.Environmental factors that shape biofilm formation[J].Bioscience, Biotechnology, and Biochemistry, 2016, 80(1):7-12.
[6] 郭志华,胡婷婷, 单玲玲.低浓度乙二胺四乙酸对金黄色葡萄球菌生物被膜形成的影响[J].食品与发酵工业, 2012, 38(12):22-25.
GUO Z H, HU T T, SHAN L L.Effect of low concentration of EDTA on biofilm formation of Staphylococcus aureus[J].Food and Fermentation Industries, 2012, 38(12):22-25.
[7] 谢丽斯,张文艳, 许佳晶, 等.食品添加剂对食源性金黄色葡萄球菌生物被膜的影响[J].食品科学, 2012, 33(17):154-157.
XIE L S, ZHANG W Y, XU J J, et al.Effects of some food additives on biofilm formation of food-borne Staphylococcus aureus[J].Food Science, 2012, 33(17):154-157.
[8] DELPOZO J L.Biofilm-related disease[J].Expert Review of Anti-Infective Therapy, 2018, 16(1):51-65.
[9] RICHTERK, VAN DEN DRIESSCHE F, COENYE T.Innovative approaches to treat Staphylococcus aureusbiofilm-related infections[J].Essays in Biochemistry, 2017, 61(1):61-70.
[10] GARCIA-GUTIERREZ E, O’CONNOR P M, COLQUHOUN I J, et al.Production of multiple bacteriocins, including the novel bacteriocin gassericin M, by Lactobacillus gasseriLM19, a strain isolated from human milk[J].Applied Microbiology and Biotechnology, 2020, 104(9):3 869-3 884.
[11] 马伊萨兰,张荣, 王洪志, 等.食品中金黄色葡萄球菌生物被膜形成基因分析及影响因素研究[J].食品工业科技, 2017, 38(15):129-133;139.
MA Y S L, ZHANG R, WANG H Z, et al.Analysis of biofilm formation related genes and its influence factors for Staphylococcus auresfood isolates[J].Science and Technology of Food Industry, 2017, 38(15):129-133;139.
[12] OKUDAK I, ZENDO T, SUGIMOTO S, et al.Effects of bacteriocins on methicillin-resistant Staphylococcus aureusbiofilm[J].Antimicrobial Agents and Chemotherapy, 2013, 57(11):5 572-5 579.
[13] TANGJ N, CHEN J, LI H H, et al.Characterization of adhesin genes, staphylococcal nuclease, hemolysis, and biofilm formation among Staphylococcus aureusstrains isolated from different sources[J].Foodborne Pathogens and Disease, 2013, 10(9):757-763.
[14] SUNL M, LIAO K, WANG D Y.Effects of magnolol and honokiol on adhesion, yeast-hyphal transition, and formation of biofilm by Candida albicans[J].PLoS One, 2015, 10(2):e0117695.
[15] 赵柳娅,蒋京辰, 姚响文, 等.黄芩素与氟康唑协同抗白念珠菌生物被膜作用研究[J].中国真菌学杂志, 2014, 9(2):70-74.
ZHAO L Y, JIANG J C, YAO X W, et al.Synergistic effect of baicalein in combination with fluconazole on Candida albicansbiofilm[J].Chinese Journal of Mycology, 2014, 9(2):70-74.
[16] 黄莹莹,陈一强, 孔晋亮, 等.黄芩素联合左氧氟沙星对金黄色葡萄球菌生物膜的体外作用[J].中华医院感染学杂志, 2013, 23(10):2 264-2 266.
HUANG Y Y, CHEN Y Q, KONG J L, et al.Effect of baicalein combined with levofloxacin on Staphylococcus aureus biofilm in vitro[J].Chinese Journal of Nosocomiology, 2013, 23(10):2 264-2 266.
[17] 何宇巍,黄颖华, 李晓君, 等.黄连等5种中药颗粒剂联合左氧氟沙星对鲍曼不动杆菌生物膜的作用研究[J].中医药临床杂志, 2021, 33(8):1 620-1 623.
HE Y W, HUANG Y H, LI X J, et al.Effect of five kinds of traditional Chinese medicine granules such as Huanglian combined with levofloxacin on Acinetobacter baumanniibiofilm[J].Clinical Journal of Traditional Chinese Medicine, 2021, 33(8):1 620-1 623.
[18] KIMB R, BAE Y M, HWANG J H, et al.Biofilm formation and cell surface properties of Staphylococcus aureusisolates from various sources[J].Food Science and Biotechnology, 2016, 25(2):643-648.
[19] MOORMEIERD E, BAYLES K W.Staphylococcus aureusbiofilm:A complex developmental organism[J].Molecular Microbiology, 2017, 104(3):365-376.
[20] ARCHERN K, MAZAITIS M J, COSTERTON J W, et al.Staphylococcus aureusbiofilms:Properties, regulation, and roles in human disease[J].Virulence, 2011, 2(5):445-459.
[21] ISLAMB, KHAN S N, HAQUE I, et al.Novel anti-adherence activity of mulberry leaves:Inhibition of Streptococcus mutansbiofilm by 1-deoxynojirimycin isolated from Morusalba[J].Journal of Antimicrobial Chemotherapy, 2008, 62(4):751-757.
[22] SONGY J, YU H H, KIM Y J, et al.Anti-biofilm activity of grapefruit seed extract against Staphylococcus aureusand Escherichiacoli[J].Journal of Microbiology and Biotechnology, 2019, 29(8):1 177-1 183.
[23] SUGIMOTOS, SATO F, MIYAKAWA R, et al.Broad impact of extracellular DNA on biofilm formation by clinically isolated Methicillin-resistant and-sensitive strains of Staphylococcus aureus[J].Scientific Reports, 2018, 8(1):1-11.
[24] MANNE E, RICE K C, BOLES B R, et al.Modulation of eDNA release and degradation affects Staphylococcus aureusbiofilm maturation[J].PLoS One, 2009, 4(6):e5822.
[25] 张洺嘉,谢明杰.黄芩素抑制金黄色葡萄球菌生物被膜的形成[J].中国生物化学与分子生物学报, 2018, 34(3):334-340.
ZHANG M J, XIE M J.Inhibition of Staphylococcus aureusbiofilm by baicalein[J].Chinese Journal of Biochemistry and Molecular Biology, 2018, 34(3):334-340.