据国家统计年鉴数据显示[1],2019年全国生活垃圾清运量已超过2.4亿t,且仍以每年8%~10%的速度增长。其中富含有机物的餐厨垃圾占比为50%~55%,有些城市可达60%甚至更高[2]。餐厨垃圾是指单位食堂、宾馆、饭店等产生的餐饮垃圾及居民家庭产生的废弃蔬菜瓜果、废弃肉类鱼虾、剩菜剩饭等各类混合物的总称[3]。
餐厨垃圾如果得不到及时处理,会对环境造成严重污染[4]。目前,我国餐厨垃圾的主要处理方法为填埋法或焚烧法[5],但是填埋场短缺,餐厨垃圾含水率平均在80%以上难以焚烧,影响了餐厨垃圾的有效处理。餐厨垃圾中含有丰富的营养物质(主要为淀粉、蛋白质、油脂、矿物元素、纤维素),十分适宜微生物生长繁殖,所以生物处理法成为处理餐厨垃圾的主要途径[6]。目前的研究大多集中在好氧与厌氧堆肥上,但是此方法对餐厨垃圾处理周期较长,每个周期普遍需要15~20 d,且需要对餐厨垃圾进行储存运输,中间流程繁琐。小型好氧处理法可以将餐厨垃圾原地减量化和资源化[7],更适用于居民住宅小区及各类型餐饮业和食堂等场所。不仅减少了收集运输过程中存在的环境问题,而且不需要大量的土地来建立发酵池[8]。
餐厨垃圾具有高盐(湿基盐质量分数为1%~3%)、高油(湿基游离油脂质量分数为2%~6%)的特点[9],造成餐厨垃圾出现渗透压高、透气性差、油脂易黏附在微生物表面等问题,直接或间接地影响微生物生长,从而造成餐厨垃圾生物降解率低[10]。国内研究学者主要通过改变餐厨垃圾的营养结构以及提高生化处理设备的性能来提高餐厨垃圾的降解率。赵紫萱[11]将餐厨垃圾与香蕉皮和花生壳进行营养复配,改变碳氮比结构,提高降解率,减重率达到63.9%。筛选耐高盐与高油的菌株也可有效提高餐厨垃圾的降解率,吉雨霁等[12]以2.8%含油量和1.2%含盐量作为筛选压力,筛选到一批可在50 ℃高温下对餐厨垃圾降解的菌株。时朝辉[13]以荞麦壳作为载体材料,通过自制复合菌剂对餐厨垃圾进行降解,24 h减重率可达到67.45%。
本文通过恒温摇瓶振荡模拟生化处理机,将微生物接种于餐厨垃圾,以降解率作为最终的评定指标,筛选出可高效降解高油高盐餐厨垃圾的菌株,从而达到餐厨垃圾高效无害化、减量化的目的。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料与筛选菌株
餐厨垃圾取自天津科技大学第四食堂,分拣出不可降解的杂物,沥干水分后通过食品破碎机初步粉碎后备用,其理化性质如表1所示。金龙鱼食用大豆油,市售;本研究所用菌株均来自教育部工业微生物重点实验室(天津科技大学)。
表1 餐厨垃圾理化性质
Table 1 Physical and chemical properties of kitchen waste

含水率/%pH挥发性固体/%总碳/(g·kg-1)总氮/(g·kg-1)73.45±0.515.93±0.4277.32±0.2334.28±0.343.43±0.11
1.1.2 主要试剂及培养基
酵母粉、胰蛋白胨、NaCl、MgSO4、MnCl2、可溶性淀粉,均为分析纯,天津市北方天医试剂公司;干酪素(总氮≥13.5%),北京索莱宝科技有限公司。
LB(Luria-Bertani)培养基(g/L):胰蛋白胨10、NaCl 10、酵母粉5,pH调至7.2,121 ℃灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptione dextrose ,YEPD)培养基(g/L):葡萄糖20、胰蛋白胨20、酵母粉10,pH调至6.0,115 ℃灭菌20 min。
细菌计数培养基(g/L):胰蛋白胨10、NaCl 50、酵母粉5、可溶性淀粉15,pH调至7.2,121 ℃灭菌20 min。
蛋白酶与淀粉酶发酵培养基(g/L):干酪素5、可溶性淀粉10、酵母粉5、NaCl 5、KH2PO41、MgSO40.2、MnCl20.1,pH调至7.0,121 ℃灭菌20 min。
1.1.3 仪器与设备
752紫外可见分光光度计,天津市华伟科技有限公司;LRH-250-A生化培养箱,韶关市泰宏医疗器械有限公司;DELTA320 pH计,梅特勒仪器(上海)有限公司;HYG摇床,上海欣蕊自动化设备有限公司;LDZX-50FB立式压力蒸汽灭菌器,上海申安医疗器械厂。
1.2 实验方法
1.2.1 餐厨垃圾预处理
将粉碎后的餐厨垃圾固形物分装于500 mL锥形瓶中(每瓶装入50 g固形物、120 mL自来水、3.6 g NaCl、7.2 g大豆油),最终盐含量为2%,游离脂肪含量为4%(均为质量分数,下同)。
1.2.2 菌株对餐厨垃圾降解试验
单菌株对餐厨垃圾降解:选取实验室保存的9株产酶(蛋白酶、淀粉酶、脂肪酶、半纤维素酶、纤维素酶)性能较好的菌株,为芽胞杆菌(BLE、BI1、BI2、LZM-2、LZM-B、N-2、B10-5、NK98、WL-BA-1)以及实验室保存的白地霉(HN-1),分别以3%细菌接种量、2%酵母接种量接种于餐厨垃圾中,30 ℃、230 r/min持续降解20 h后对餐厨垃圾降解产物的活菌数、降解率进行测量计算。
单菌株对高油高盐餐厨垃圾降解:分别以3%细菌接种量、2%酵母接种量接种于高油高盐餐厨垃圾(在餐厨垃圾中添加9 g NaCl、10.8 g大豆油,最终盐含量为5%,游离脂肪含量为6%)中,30 ℃、230 r/min持续降解20 h后对餐厨垃圾降解产物的活菌数、降解率进行测量计算,并在显微镜下观察降解产物中上清液中油脂情况。
多菌株对餐厨垃圾降解:以3%细菌接种量(2株细菌比例为1∶1)、2%酵母接种量接种于餐厨垃圾中,30 ℃、230 r/min持续降解20 h后对餐厨垃圾降解产物的活菌数、降解率进行测量计算。
1.2.3 单菌株对餐厨垃圾降解稳定性试验
将活化好的待测菌株在LB液体培养基中培养15 h备用,细菌3%接种量同时加入酵母2%接种量,混合接种于餐厨垃圾(A)中,30 ℃、230 r/min降解20 h,同时从餐厨垃圾(A)摇瓶中,取10%固液混合物接种于餐厨垃圾(A1与B1)中,30 ℃、230 r/min继续降解20 h,并从A1中取10%固液混合物接种于餐厨垃圾(A2与B2)中,B1则用于测量活菌计数、发酵液产物pH值和20 h降解率等指标(视为第1批次降解数据)。并以此方式继续持续反复多次,以检测菌株持续降解餐厨垃圾的稳定性。具体流程如图1。

图1 餐厨垃圾降解稳定性试验设计流程图
Fig.1 Design flow chart of degradation stability test of kitchen waste
1.2.4 菌株间拮抗性分析
挑取待测菌株A在LB固体培养基上划线,再用接种环挑取另一菌株B在距离待测菌5 mm处划一条平行线。37 ℃培养30 h,观察待测菌A与待测菌B之间是否出现相互生长抑制情况。
1.2.5 BLE与BI2耐盐性试验
将活化好的BLE与BI2分别挑至LB液体培养基中活化12 h,再以2%接种量分别接种于含盐量为1%、5%、10%的LB液体培养基中培养,定时取样,稀释10倍检测其OD600,以反映菌株生长情况。
1.2.6 BLE与BI2的蛋白酶、淀粉酶、乳化系数测定
淀粉酶活力测定方法:可见分光光度法[14];蛋白酶活力测定方法:福林法[15];乳化系数测定方法:发酵液6 000 r/min离心10 min,取6 mL上清液与4 mL大豆油混匀装至试管中,250 r/min振荡2 h,静置24 h,测量乳化层高度及有机相总高度。乳化系数EI24按公式(1)计算[16]。
(1)
式中:EI24,乳化系数,%;h1,乳化层高度,cm;h2,有机相总高度,cm。
1.2.7 活菌数及降解率的测定方法
稀释微量活菌计数法:取100 μL菌液在1.5 mL离心管中进行梯度稀释,最后将10 μL稀释菌液分别点在细菌计数平板和YEPD平板上计数[17]。
降解率(R)测定:将实验组菌株降解后的产物倾倒至200目(孔径为0.075 mm)筛网中,用清水冲洗2次,将筛网中残留固形物烘至恒重,降解率按公式(2)计算。
(2)
式中:R,降解率,%;m1,筛网中残留固形物烘至恒重的质量,g;m2,未进行降解的餐厨垃圾烘干至恒重的质量,g。
1.2.8 食堂餐厨垃圾理化性质测定
总氮测定:凯氏定氮法[18];总有机碳:重铬酸钾-硫酸法[18]。
2 实验结果
2.1 不同菌株对餐厨垃圾降解效果影响
针对餐厨垃圾的单菌株降解结果如图2-a所示。从9株菌株中选出降解率较高的前6株菌株,其中BLE、BI1、BI2、B10-5、WL-BA-1对餐厨垃圾固形物的降解率都高于95%,且BLE、BI1、BI2、B10-5在餐厨垃圾中活菌计数均高于1×109CFU/mL,占整个微生物菌落总数的95%以上,也说明所添加菌株在餐厨垃圾降解中起到主导作用[19]。

a-餐厨垃圾单菌株降解率;b-高油高盐餐厨垃圾降解率;c-餐厨垃圾原料;d-BLE降解20 h餐厨垃圾残留物; e-N-2降解20 h餐厨垃圾残留物;f-餐厨垃圾中油脂显微图片;g-BLE降解餐厨垃圾后油脂显微图片;h-N-2降解餐厨垃圾固形物
图2 不同菌株对餐厨垃圾的降解效果
Fig.2 Effects of different strains on the degradation effect of kitchen waste
单菌株对高油高盐餐厨垃圾降解实验结果如图2-b,在高油高盐条件下单菌株对餐厨垃圾的降解率均出现了明显下降,空白组的降解率仅为30.98%,也说明高油高盐是影响餐厨垃圾降解的重要原因,所以筛选抗逆性较好的菌株,同时提高菌株对餐厨垃圾中油脂的乳化及降解至关重要[20]。BLE与BI2在高油高盐的情况下仍表现出较高的降解率(≥90%)。
餐厨垃圾降解效果的情况如图2-c~图2-e,其中BLE、BI2等降解率较高,未降解的残留物多为菜叶、较大的肉块。而降解率低的菌株如N-2、LZM-2、LZM-B及空白中未降解物中均含有大量油腻的黄色漂浮物,肉眼观察为未被乳化的油脂、蛋黄剩余成分、菜叶、较大的肉块。餐厨垃圾中过量的油脂会包裹微生物细胞,影响细胞的呼吸作用,降低水解酶的产生,从而导致餐厨垃圾降解率的降低[21],说明去除油脂在餐厨垃圾降解中至关重要。餐厨垃圾中油脂的变化情况如图2-f~图2-g,添加BLE菌株的组别大部分油滴都被降解(或被乳化为乳化油)。图2-h为餐厨垃圾降解实验空白组和添加BLE菌株组的对照,可以看出无明显漂浮油滴。通过油滴的降解与乳化作用增强菌种与氧气的接触面积,从而提高餐厨垃圾的降解率,达到减量化的目的。
2.2 菌株间拮抗性分析
通过菌株之间生长拮抗试验,发现2菌株间相互无拮抗时可以重叠共生(图3-a),但之间存在拮抗时平行菌苔之间存在明显缝隙(图3-b)。

a-BLE/LZM-B和WL-BA-1/B10-5拮抗性; b-餐厨垃圾不同菌株组合降解率
图3 菌株之间拮抗性和协同降解餐厨垃圾
Fig.3 Antagonistic relationships between strains and co-degradation of kitchen waste
所筛选的6株菌株相互之间拮抗性分析结果如表2所示。
表2 细菌之间拮抗性试验结果
Table 2 Experimental results of antagonism between bacteria

菌株BLEBI1BI2B10-5WL-BA-1LZM-BBLE+-++-BI1+-++-BI2---+-B10-5++-++-WL-BA-1++++++LZM-B----+
注:-,没有拮抗作用;+,有一定拮抗作用;++,有严重的拮抗作用。
测试的菌株中存在多个相互拮抗现象,尤其是WL-BA-1与所有菌株均有较强的拮抗作用。最终选取BLE与BI2、BLE与LZM-B、BI1与BI2三组菌株互相搭配进行餐厨垃圾降解,并同时以BLE、BI1、BI2、LZM-B四株单菌株餐厨垃圾降解试验进行比较。2种菌株同时对餐厨垃圾降解实验结果如图3-b,从图上看单菌株对餐厨垃圾的降解与两菌株协同降解效率并无显著差异(P>0.05),推测菌株之间产酶种类较为接近,在降解过程中未起到互补增效作用。
2.3 单菌株对餐厨垃圾降解稳定性试验
如图4所示,BI2在前7 d对餐厨垃圾的降解率可以稳定在95%以上,从第8天起对餐厨垃圾的降解率开始逐渐降低,降至91.41%,第12天对餐厨垃圾的降解率降至90%左右。且从第6天起,BI2活菌计数中出现可耐受5%盐的杂菌,BI2活菌数呈现明显下降,但仍可保持在3×108CFU/mL以上,降解物中的游离油脂也在逐渐增加,说明BI2的乳化能力也在逐渐下降。
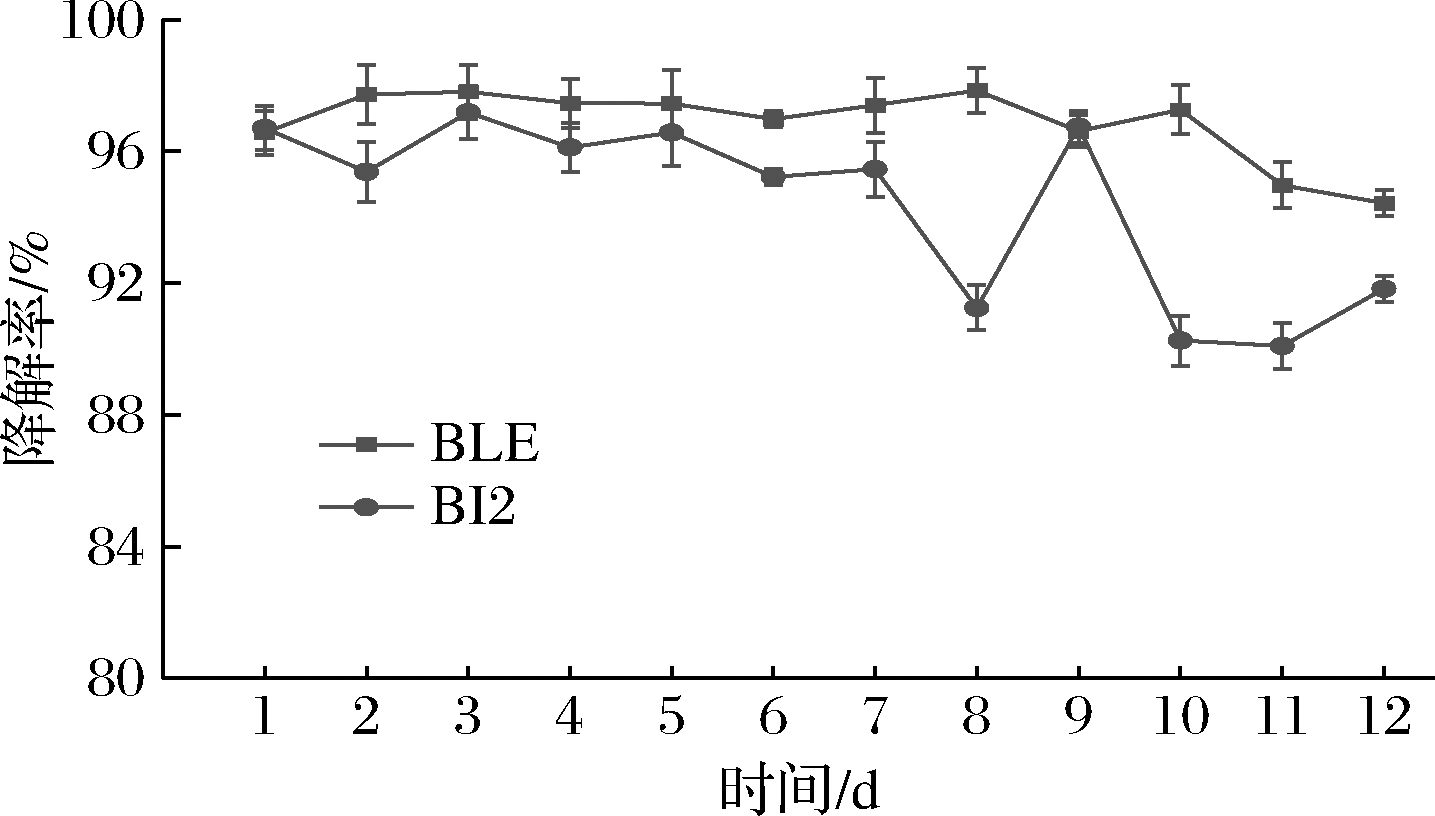
图4 单菌株对餐厨垃圾降解稳定性实验结果
Fig.4 Experimental results of degradation stability of kitchen waste by single strain
餐厨垃圾中表面悬浮的大量油脂严重阻碍微生物对淀粉和蛋白质的降解,这也是降解率下降及活菌数下降的原因。
BLE在前8 d对餐厨垃圾的降解率保持稳定的状态,降解率稳定在97%以上。从第9天起,对餐厨垃圾的降解率开始逐渐降低。第12天对餐厨垃圾的降解率降至94.47%。从以上结果中可看出BLE对餐厨垃圾的降解稳定性强于BI2。
2.4 BLE与BI2菌株产淀粉酶、蛋白酶、乳化系数和盐耐受性分析
从图5-a中可看出,BLE与BI2淀粉酶活力均呈现先下降再升高的趋势,在28 h达到最高值,BLE淀粉酶活力最高可达408.50 μmol/mL,BI2淀粉酶活力最高可达473.26 μmol/mL。22 h前,BLE淀粉酶活力高于BI2淀粉酶活力,22 h后,BI2酶活力高于BLE。图5-b是发酵液中淀粉含量的变化,16 h以前BLE与BI2发酵液中的淀粉含量快速下降,且BI2发酵液中淀粉含量略高于BLE发酵液,与酶活力结果较为一致。

a-淀粉酶活力;b-发酵液中淀粉含量;c-蛋白酶活力;d-乳化系数;e-BLE菌株盐耐适性;f-N-2菌株盐耐适性
图5 BLE与BI2菌株产淀粉酶、蛋白酶、乳化系数和盐耐适性分析
Fig.5 Analysis of amylase, protease, emulsification coefficient and salt tolerance with BLE and BI2 strain
从图5-c中可看出BLE与BI2蛋白酶活力均呈现逐渐下降的趋势,这与发酵液中营养物质减少有关。BLE在12 h时,蛋白酶活力达到最高值,最高可达19.67 μmol/mL。BI2在16 h时,蛋白酶活力达到最高值,为22.73 μmol/mL。
从图5-d中可看出,BI2乳化性能明显高于BLE,BI2在20 h的时候,就可以分泌大量高效的表面活性剂,而BLE的发酵液在24 h才可以达到同样的效果。在实际降解中,餐厨垃圾中的油脂会包裹在物料表面,阻碍微生物对餐厨垃圾的降解[22]。邓蒙轩等[23]通过混凝法对餐厨垃圾中的油脂进行去除,然后进行堆肥,成功地去除了80%的油脂,但是费时费力,增加了许多成本。张志波[24]发现向餐厨垃圾中加入表面活性剂可以通过保持水分、促进有机质溶解等方式提高餐厨垃圾的降解率,并且表面活性剂可对油脂进行乳化,具有多种好处。刘婕[25]通过菌株复配的方式将高产表面活性剂菌株CY-5与高产脂肪酶菌株CY-47搭配使用,在最佳降解条件下,72 h可降解98.81%的油脂,但未在实际应用中验证效果。所以本实验在选择菌株时,将菌株的乳化性能也作为筛选菌株的标准之一。表面活性剂的分泌不仅有利于油脂的乳化及降解,还促进流动性生物膜的形成,为垃圾颗粒高效率的降解创造条件[22]。
从以上结果可看出,BI2的淀粉酶与蛋白酶的最高酶活力及乳化能力均高于BLE,但BLE产淀粉酶与蛋白酶的速度快于BI2。从BLE与BI2对餐厨垃圾20 h降解率来看,BI2的降解率略高于BLE,但从稳定性试验来看,BLE对餐厨垃圾降解的稳定性显著优于BI2,推测BLE产酶较快及表面活性剂种类不同导致的。
垃圾处理设备可以对餐厨垃圾的油脂进行初步过滤,但无法对餐厨垃圾中的盐分进行有效去除,餐厨垃圾中盐分会不可避免地积累下来,对餐厨垃圾的降解造成一定程度的影响[26],所以研究菌株的耐盐性对餐厨垃圾的降解也有一定的指导意义。由图5-e可知高盐对BLE的生长具有一定的抑制作用,且随着盐浓度的增加,菌株的延迟期也在逐渐延长。但是BLE在5%与10%的条件下,进入稳定期的OD600值(稀释10倍)较为接近,说明BLE对高渗透的环境具有一定耐适性。
图5-f结果显示,高盐对BI2的生长具有抑制作用,但是BI2在高盐环境下的延滞期并未增长,生长趋势与1%盐含量时一致,其速度优于BLE增长速度,且进入稳定期后顶点也高于BLE OD600值,说明BI2对高渗环境的耐适性优于BLE,也可以说明在高油高盐情况下,BI2降解率略高于BLE的原因。
3 结论
从实验室保存的高产酶菌株中筛选出BLE与BI2两株菌,可以对餐厨垃圾进行高效降解,20 h内餐厨垃圾降解率到达95%以上,且BLE与BI2在高油高盐的条件下,对餐厨垃圾降解率也达到90%。经稳定性试验验证,BLE可以连续12批次对餐厨垃圾进行稳定降解(降解率>94%)。
对BLE与BI2菌株的淀粉酶活力、蛋白酶活力以及乳化能力进行能力测定,BLE淀粉酶活力最高可达408.50 μmol/mL,蛋白酶活力最高可达19.67 μmol/mL,培养24 h的发酵液乳化系数可达到97.22%,而且其产水解酶速度较快,在24 h内能达到产酶峰值,同时可以乳化油脂,是确保该菌株高效快速降解餐厨垃圾的基础。
本研究所筛选的菌株已应用于天津市多个湿垃圾处理试点(天津汇川酒店、佳和雅庭小区)的生化处理机中进行放大实验,在实际应用中,也达到了20 h内降解95%以上固形物的效果。投放菌剂后,可稳定降解6个月,设备所排放废水的化学需氧量与生化需氧量分别为237 mg/L和47.4 mg/L。证明通过摇瓶实验模拟生化处理机的降解过程筛选高效降解餐厨垃圾的微生物菌株的方法是可行的。
[1] 国家统计局.中国统计摘要-2020[M].北京:中国统计出版社, 2020.
National Bureau of Statistics.China Statistical Yearbook-2020[M].Beijing:China Statistics Press, 2020.
[2] 赵振振,张红亮, 殷俊, 等.对我国城市生活垃圾分类的分析及思考[J].资源节约与环保, 2021(8):128-131.
ZHAO Z Z, ZHANG H L, YIN J, et al.Analysis and thinking on the classification of municipal solid waste in China[J].Resources Economization&Environmental Protection, 2021(8):128-131.
[3] 余培斌,吴殿辉,蔡国林,等.餐厨垃圾发酵产乳酸菌种的筛选、鉴定及应用[J].食品与发酵工业,2023,49(3):53-59.
YU P B, WU D H, CAI G L, et al. Screening, identification and application of lactic acid producing bacteria from food waste fermentation[J].Food and Fermentation Industry, 2023,49(3):53-59.
[4] WUM K, HU J G, SHEN F, et al.Conceptually integrating a multi-product strategy for the valorization of kitchen waste towards a more sustainable management[J].Journal of Cleaner Production, 2021, 306:127292.
[5] 袁彧,陆新生.垃圾分类政策实施后国内厨余垃圾性质及处置现状研究[J].可持续发展, 2021(3):348-354.
YUAN Y, LU X.Research on the characteristic and disposal status of domestic kitchen waste after the implementation of the waste classification policy[J].Sustainable Development, 2021(3):348-354.
[6] 崔文静,陆敏博.餐厨垃圾处理现状及今后发展趋势[J].广东化工, 2021, 48(19):140-141.
CUI W J, LU M B.The present disposing situation and development trend of kitchen waste[J].Guangdong Chemical Industry, 2021, 48(19):140-141.
[7] 咸芳.餐厨垃圾高效处理复合微生物菌剂的研究[D].长春:吉林大学, 2009.
XIAN F.Research on effective microorganism agent for degradation of food wastes[D].Changchun:Jilin University, 2009.
[8] 阚丹,司马小峰.我国餐厨垃圾分类现状及处理技术展望[J].环境保护前沿, 2020(1):98-105.
DAN D, SIMA X F.Classification status and technology outlook of kitchen waste in China[J].Advances in Environmental Protection, 2020(1):98-105.
[9] LUD, ZHOU Z.Discussion on intelligent disposal system of high-fat food waste[J].Journal of Physics:Conference Series, 2021, 1 852(2):022001.
[10] 郝鑫,苏婧, 孙源媛, 等.餐厨垃圾与污泥、秸秆不同配比联合厌氧发酵对产气性能的影响[J].环境科学研究, 2020, 33(1):235-242.
HAO X, SU J, SUN Y Y, et al.Biogas production of anaerobic Co-digestion with different ratios of kitchen waste, sewage sludge and rice straw[J].Research of Environmental Sciences, 2020, 33(1):235-242.
[11] 赵紫萱,邱卫华, 王攀.餐厨垃圾营养复配及其在复合微生物菌剂作用下的好氧降解[J].环境工程, 2021, 39(4):92-99.
ZHAO Z X, QIU W H, WANG P.The aerobic degradation of nutritional complexed kitchen waste by mixed microbial flora[J].Environmental Engineering, 2021, 39(4):92-99.
[12] 吉雨霁,王娜, 杨宁, 等.餐厨垃圾高温好氧生物减量菌种的筛选及特性[J].微生物学通报, 2022, 49(11):4 513-4 524.
JI Y J, WANG N, YANG N, et al.Screening of bacteria for thermophilic aerobic biodegradation of food waste and the degradation characteristics[J].Microbiology China, 2022, 49(11):4 513-4 524.
[13] 时朝辉.餐厨垃圾微生物减量化处理研究[D].上海:华东师范大学, 2017.
SHI C H.Research on minimizing kitchen waste with microbial technology[D].Shanghai:East China Normal University, 2017.
[14] 张雪娇,田欢, 刘春叶, 等.可见分光光度法测定α-淀粉酶活力[J].化学与生物工程, 2020, 37(3):65-68.
ZHANG X J, TIAN H, LIU C Y, et al.Determination of the activity of α-amylase by visible spectrophotometry[J].Chemistry &Bioengineering, 2020, 37(3):65-68.
[15] 刘永康.碱性蛋白酶高产菌株的诱变选育[D].洛阳:河南科技大学, 2020.
LIU Y K.Mutagenesis and breeding of alkaline protease high-yield strain[D].Luoyang:Henan University of Science and Technology, 2020.
[16] 许燕博.中间苍白杆菌产生物乳化剂的发酵条件及产物分离[D].大连:大连工业大学, 2016.
XU Y B.Fermentation conditions and separation of bioemulsifier from Ochrobactrum intermedium[D].Dalian:Dalian Polytechnic University,2016.
[17] 李颖,王德培, 王勇, 等.一种简单准确的酵母微量活菌计数方法[J].中国酿造, 2008, 27(18):75-77.
LI Y, WANG D P, WANG Y, et al.A new method for counting living yeast cell number[J].China Brewing, 2008, 27(18):75-77.
[18] 李江东.餐厨垃圾好氧堆肥资源化利用及无害化处理的研究[D].南昌:南昌大学, 2021.
LI J D.Research on resource utilization and harmless treatment of food waste[D].Nanchang:Nanchang University, 2021.
[19] DENB J, GUDRUN O, SEBASTIAN G, et al.Enhancement of food waste management and its environmental consequences[J].Energies, 2021, 14(6):1790.
[20] ZENGZ T, LIU Y, ZHONG H, et al.Mechanisms for rhamnolipids-mediated biodegradation of hydrophobic organic compounds[J].Science of the Total Environment, 2018, 634:1-11.
[21] 程春平.餐厨垃圾油脂降解菌的筛选及其应用[D].合肥:安徽农业大学, 2020.
CHENG C P.Screening and application for oil degradation bacteria in food waste[D].Hefei:Anhui Agricultural University, 2020.
[22] 胡新军,张敏, 余俊锋, 等.中国餐厨垃圾处理的现状、问题和对策[J].生态学报, 2012, 32(14):4 575-4 584.
HU X J, ZHANG M, YU J F, et al.Food waste management in China:Status, problems and solutions[J].Acta Ecologica Sinica, 2012, 32(14):4 575-4 584.
[23] 邓蒙轩,周爱娟, 万方, 等.优化餐厨垃圾乳化液深度去油方案[J].科学技术与工程, 2020, 20(4):1 704-1 710.
DENG M X, ZHOU A J, WAN F, et al.Optimization of deeply oil removal method from food residue emulsion[J].Science Technology and Engineering, 2020, 20(4):1 704-1 710.
[24] 张志波.表面活性剂对堆肥中微生物产酶及有机质降解的影响研究[D].长沙:湖南大学, 2007.
ZHANG Z B.Effects on the production of enzymes from microorganisms and biodegradation by surfactants[D].Changsha:Hunan University, 2007.
[25] 刘婕.除油菌的筛选鉴定及油脂废水处理研究[D].广州:华南理工大学, 2010.
LIU J.Study on screening and identification of oil degradated strains and treatment of oil wastewater[D].Guangzhou:South China University of Technology, 2010.
[26] 何晓铮.盐分对餐厨垃圾厌氧产酸发酵的影响研究[D].杭州:浙江工商大学, 2020.
HE X Z.Study on the effect of salt on acidogenic fermentation of food waste[D].Hangzhou:Zhejiang Gongshang University, 2020.