苹果酒因独特的风味与丰富的营养,在欧洲尤其是西欧地区深受消费者们的喜爱,被誉为第二大果酒。根据欧洲苹果酒和果酒协会(European Cider and Fruit Wine Association,AICV)的报告[1],2018年西欧国家苹果酒消费量占全球消费总量的52.8%,亚洲国家消费量仅占1.4%。传统的苹果酒通常是以自然发酵酿造,需要数周甚至数月的时间。酿酒酵母属酵母是苹果酒酿造应用最广泛的菌株,具有高糖转化为乙醇的能力,纯种发酵苹果酒因缺乏风味而被一些挑剔的消费者所诟病[2]。近年来越来越多的酿酒师采用非酿酒酵母属酵母进行苹果酒酿造,以获得更健康、口感更丰富的苹果酒。例如,非酿酒酵母属的汉逊酵母(Hanseniaspora)能形成丰富的香气物质乙酸己酯和乙酸异戊酯[3]。粟酒裂殖酵母(Schizosaccharomyces pombe)能将味道尖锐的L-苹果酸转化为乙醇,使葡萄酒变得更顺滑易入口[4]。利用非酿酒酵母属酵母同样可以改善葡萄酒的香气风味。异常威克汉姆酵母(Wickerhamomyces anomaluse)与酿酒酵母(Saccharomyces cerevisiae)协同发酵可以提高乙酸酯、乙酯、高级醇、醛和酮的种类和含量[5]。因此,非酿酒酵母属与酿酒属酵母混合发酵也会给苹果酒带来不同的风味,可以成为传统苹果酒酿造的一种替代方法。
马克斯克鲁维酵母(Kluyveromyces marxianus)是常发现于酸奶制品中的一种非常规酵母,具有耐热性好、生长速度快、发酵碳源广等优点,通过了美国食品药品监督管理局公认为安全(Generally Recognized as Safe,GRAS)和欧盟的安全资格认证(Qualified Presumption of Safety,QPS)认证。K.marxianus可用于乙醇发酵,同时还被应用于生物酶、木糖醇,以及2-苯乙醇、乙酸乙酯等芳香物质的生产[6]。此外,K.marxianus能够分泌果胶酶,有利于提高果酒的芳香成分。研究表明,Albari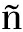 o葡萄酒发酵过程中添加来源于K.marxianus的多聚半乳糖醛酸酶(polygalacturonase, PGase),可以产生更为丰富的柠檬香、香料、辛辣和花香的香气[7]。赤霞珠葡萄酒发酵添加K.marxianus粗酶提取物,多酚含量增加了28%,而添加商业果胶酶,多酚含量仅增加了15%[8]。本研究将对比分析K.marxianus与传统苹果酒酿造的贝氏酵母(Saccharomyces bayanus)在发酵苹果酒的成分、抗氧化活性、风味与感官等方面的差异。
o葡萄酒发酵过程中添加来源于K.marxianus的多聚半乳糖醛酸酶(polygalacturonase, PGase),可以产生更为丰富的柠檬香、香料、辛辣和花香的香气[7]。赤霞珠葡萄酒发酵添加K.marxianus粗酶提取物,多酚含量增加了28%,而添加商业果胶酶,多酚含量仅增加了15%[8]。本研究将对比分析K.marxianus与传统苹果酒酿造的贝氏酵母(Saccharomyces bayanus)在发酵苹果酒的成分、抗氧化活性、风味与感官等方面的差异。
1 材料与方法
1.1 实验材料
K.marxianusFim-1分离自西藏那曲酸奶,保藏于中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center, CGMCC),保藏号10621。Saccharomyces bayanus SAF,法国乐斯福公司(S.I.Lesaffre)。
富士苹果采收于2020年10月云南大理,可溶性固形物含量约15°Brix,用HR1832飞利浦榨汁机榨汁后发酵。
1.2 试剂与设备
酵母提取物,Oxoid公司;蛋白胨,日本制药株式会社;葡萄糖,国药集团; DPPH、多聚半乳糖醛酸钠、2-氯苯丙氨酸,北京索莱宝科技有限公司;2-苯基- 4,4,5,5 -四甲基咪唑啉-1-氧基3-氧化物(2-phenyl-4,4,5,5-tetramethylimidazoline-3-oxide-1-oxyl,PTIO),麦克林试剂;色谱及质谱用甲酸、乙腈、甲酸铵、甲醇,美国赛默飞世尔科技。
LB32T便携式折射仪,广州市速为电子科技有限公司;高效液相色谱仪及其色谱柱,HS-SPME-GC-MS色谱仪及其色谱柱,安捷伦科技有限公司;Vanquish超高效液相色谱仪及其色谱柱、Q Exactive HF-X质谱,美国赛默飞世尔科技。
1.3 酵母菌发酵剂制备与苹果酒发酵
K.marxianus接种于50 mL的酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium, YPD)培养基(1%酵母提取物,2%蛋白胨,2%葡萄糖),30 ℃、220 r/min培养24 h,5 000 r/min离心5 min收集酵母细胞,用无菌水洗净、重悬。苹果汁于68 ℃巴氏杀菌30 min,接入初始OD600=0.2的K.marxianus 和S.bayanus,加入0.05 g/L焦亚硫酸钾,静置发酵。当可溶性固形物含量降至9°Brix时,发酵液于5 000 r/min离心5 min收集上清液,后用0.22 μm膜过滤获得苹果酒。苹果酒分装成50 mL/管,-20 ℃冻存用于成分检测,或充入0.15~0.17 MPa CO2(20 ℃),制成气泡苹果酒用于感官分析。
1.4 基本理化指标的测定
可溶性固形物采用便携式折射仪测定。乙醇含量用安捷伦MetaCarb 87H(300 mm×7.8 mm)为分析柱的高效液相色谱1260检测,流动相为2.9 mmol/LH2SO4,流速0.6 mL/min,检测器为示差折光检测器。总可滴定酸含量用0.1 mol/LNaOH滴定,并以苹果酸计。苹果酒色度用分光光度计在波长430 nm测定。Pase活性测定采用0.5%多聚半乳糖醛酸钠为底物,通过DNS方法测定,酶活力定义为每分钟释放1 μmol半乳糖醛酸所需的酶量为1个单位(U)。
1.5 顶空固相微萃取-气相色谱-质谱(head space-solid phase micro-extraction gas chromatography-mass spectrometry,HS-SPME-GC-MS)分析
取5 mL样品,用固相微萃取(SPME)(50/30 μm DVB/CARonPDMS)50 ℃萃取30 min。以2-辛醇为内标物,在Agilent 7890B-5977B气相色谱仪上用DB-wax色谱柱(30 mm×0.25 mm,0.25 μm)进行测试。连接器温度260 ℃,离子源和四极杆的温度分别为230和150 ℃。以99.999%He作为载气,流速1 mL/min。质谱分析采用了70 eV的电子冲击模式,核质比(m/z)扫描范围为20~400,并用标准谱库NIST 2014数据库鉴定分析化合物。
1.6 抗氧化实验及抗氧化成分分析
用DPPH和PTIO作为自由基清除剂测定抗氧化水平。取1 mL样品与100 μL的10 mmol/L DPPH或PTIO混合,室温下静止孵育30 min,检测吸光度(DPPH检测波长517 nm,PTIO检测波长557 nm)。
采用Vanquish UPLC与Q Exactive HF-X质谱联用测定苹果酒抗氧化成分。UPLC检测采用ACQUITY UPLC®HSS T3色谱柱(2.1 mm×150 mm, 1.8 μm) (Thermo Scientific, USA)。测试样品与4.0 μg/L 2-氯苯丙氨酸-甲醇溶液等体积混合,后用0.22 μm PTFE膜过滤。进样2 μL,阳性模型质谱的UPLC分析采用0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B)梯度洗脱,阴性模型用5 mmol/L甲酸铵水溶液(A)和乙腈溶液(B)梯度洗脱,流速均为0.25 mL/min。梯度程序如下:0~1 min,2% B;1~9 min,2%~50% B;9~12 min,50%~98% B;12~13.5 min,98% B;13.5~14 min,98%~2% B;14~20 min,2% B。
正负模式ESI-MS分别在3.5 kV和-2.5 kV的电压下进行,质量扫描范围为m/z81~1 000,采用动态排除过滤MS/MS谱。
1.7 感官分析
募集了20名未经培训的味觉品尝员(包括10名女性和10名男性),对冷藏气泡苹果酒的香味和味道进行了评估。香味标记为花香、果香,甜味、苹果味和酒香,味道分花香、甜味、酸度、果味和酒精味,香味和味道强度分为1~10分,感官分析结果以各分项的平均值表示。
2 结果与分析
2.1 K.marxianus和S.bayanus发酵苹果酒性能比较
在产乙醇酵母中,K.marxianus除了能发酵己糖、戊糖、木糖和阿拉伯糖等,还能分泌菊粉酶、乳糖酶/β-半乳糖苷酶和内聚半乳糖苷酶等天然酶[9]。然而,K.marxianus在苹果酒酿造中的发酵性能目前并不被了解。为此,我们研究了K.marxianus在温度范围为15~45 ℃内发酵苹果汁产生酒精的能力,结果如图1所示。K.marxianus Fim-1菌株在15~40 ℃表现出较高的酒精发酵能力。当发酵温度低于35 ℃,酒精发率随温度升高而升高,20、25、30和35 ℃发酵苹果汁糖度降至9°Brix,分别需要120、96、84和72 h,乙醇产量均在56.8 g/L左右。当发酵温度低于15或高于40 ℃发酵时,K.marxianus Fim-1糖消耗速度和乙醇产量明显下降,发酵120 h乙醇含量分别为39.25和52.34 g/L。
a-15 ℃;b-20 ℃;c-25 ℃;d-30 ℃;e-35 ℃;f-40 ℃
图1 K.marxianus Fim-1和S.bayanusSAF在不同发酵温度下的糖消耗和酒精产量
Fig.1 Sugar consumptions and alcoholic productions by K.marxianusFim-1 and S.bayanusSAF fermented at the different temperatures
与K.marxianusFim-1相似,S.bayanusSAF适合的苹果酒发酵温度范围也是15~35 ℃(图1)。S.bayanusSAF是从葡萄酒和苹果酒中分离的一种低温酵母,由于它在低温下良好的发酵能力,广泛应用于啤酒和葡萄酒发酵[10]。与之相比,K.marxianusFim-1在15 ℃低温条件下,耗糖速率(图1)和生长速度(图2)均高于S.bayanusSAF,但在15~35 ℃,温度对2种酵母菌株乙醇发酵没有明显影响,乙醇含量仅与糖消耗量有关。温度高于40 ℃,K.marxianusFim-1和S.bayanusSAF的发酵能力均明显下降。BAJPAI等[11]也发现发酵温度超过35 ℃时,K.marxianus乙醇发酵和细胞生物量都急剧下降。

a~e分别是15~40 ℃下的生长曲线
图2 K.marxianusFim-1和S.bayanus SAF不同发酵温度下生长曲线
Fig.2 The growth curves of K.marxianusFim-1 andS.bayanus SAF during cider fermentation at indicated temperatures
2.2 K.marxianus和S.bayanus发酵苹果酒的基本理化性质
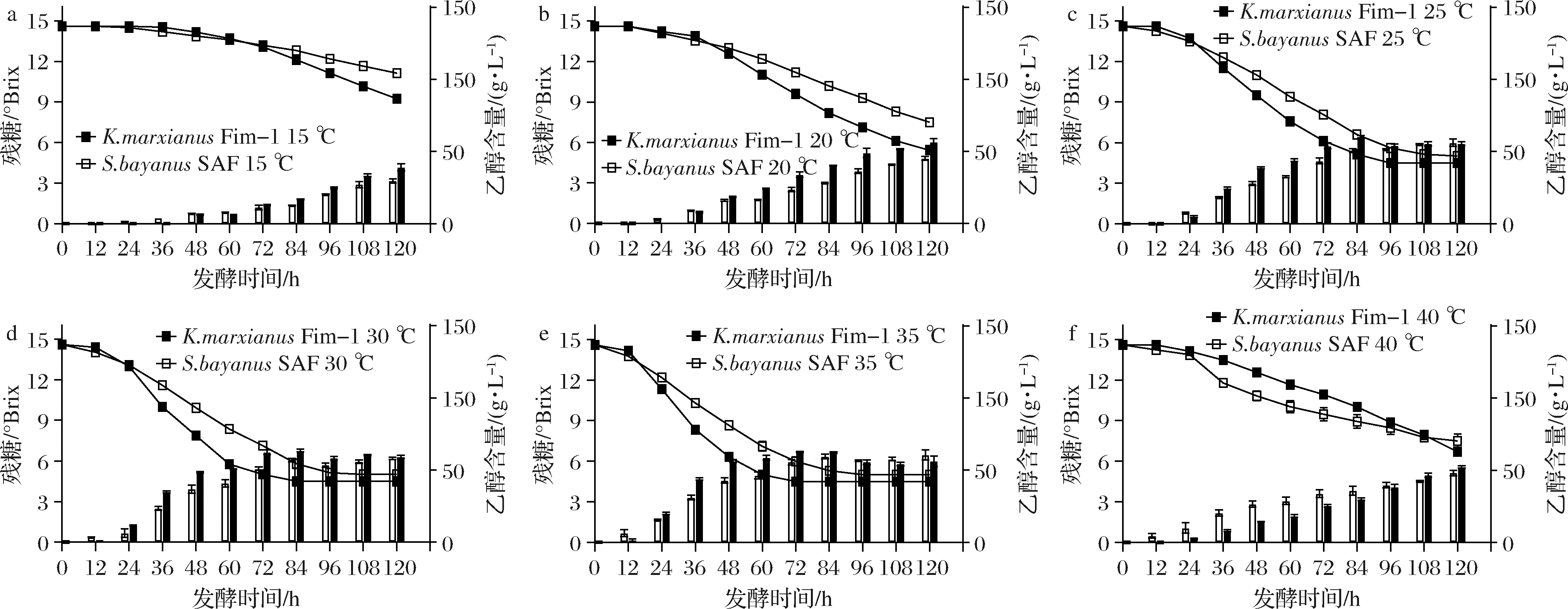
用于理化分析的K.marxianus和S.bayanus发酵苹果酒是在25 ℃发酵至可溶性固形物含量9.0°Brix时终止。苹果酒的残糖、乙醇、总酸等含量如表1所示。K.marxianusFim-1苹果酒的乙醇质量浓度为40.1 g/L,略低于S.bayanusSAF苹果酒41.0 g/L。2种酵母发酵后总酸均有所提高,其中K.marxianusFim-1苹果酒总酸含量为3.63 g/L,比苹果汁高47.6%。S.bayanus SAF苹果酒总酸含量为3.42 g/L,略低于K.marxianusFim-1苹果酒。总酸与酸味的感知密切相关,K.marxianusFim-1的产酸能力有助于提高总酸的含量,改善苹果酒的感官品质。
表1 苹果汁、K.marxianus Fim-1苹果酒和 S.bayanusSAF苹果酒的理化性质
Table 1 Physicochemical properties of apple juice, K.marxianusFim-1 cider andS.bayanus SAF cider
理化性质苹果汁Fim-1苹果酒SAF苹果酒残糖/°Brix159.29.2乙醇/(g·L-1)ND40.1±0.0341.0±0.05总酸/(g·L-1)2.46±0.453.63±0.283.42±0.34色值0.836±0.020.244±0.010.221±0.01PGase活性/(U·mL-1)ND4.26±0.130.59±0.21
在果酒酿酒过程中添加果胶酶可以提高出汁率和酒产出率,改善酒的风味和品质。BELDA等[12]从自发酵酒中分离了462株酵母菌,发现只有出芽短梗霉(Aureobasidium pullulans), 美极梅奇酵母(Metschnikowia pulcherrima)和美澳型核果褐腐病菌(Monilinia fructicola)有PGase活性。K.marxianus Fim-1能够高分泌内源性的PGase,酶活力达到4.26 U/mL,约为S.bayanus SAF的6倍。大多数酿酒酵母的基因组中都存在pgu1基因,但只有少数菌株表达果胶酶活性[13],这也是以酿酒酵母作为发酵剂时通常需要额外添加果胶酶的原因。K.marxianusFim-1天然产PGase,以及高乙醇发酵能力,在苹果酒酿造中具有明显的优势。
2.3 苹果酒中的挥发性成分
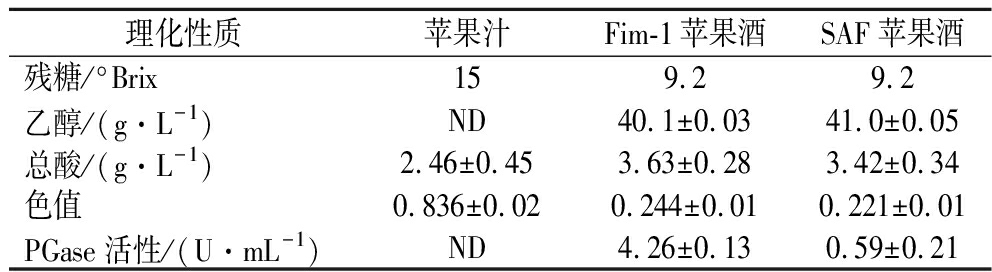
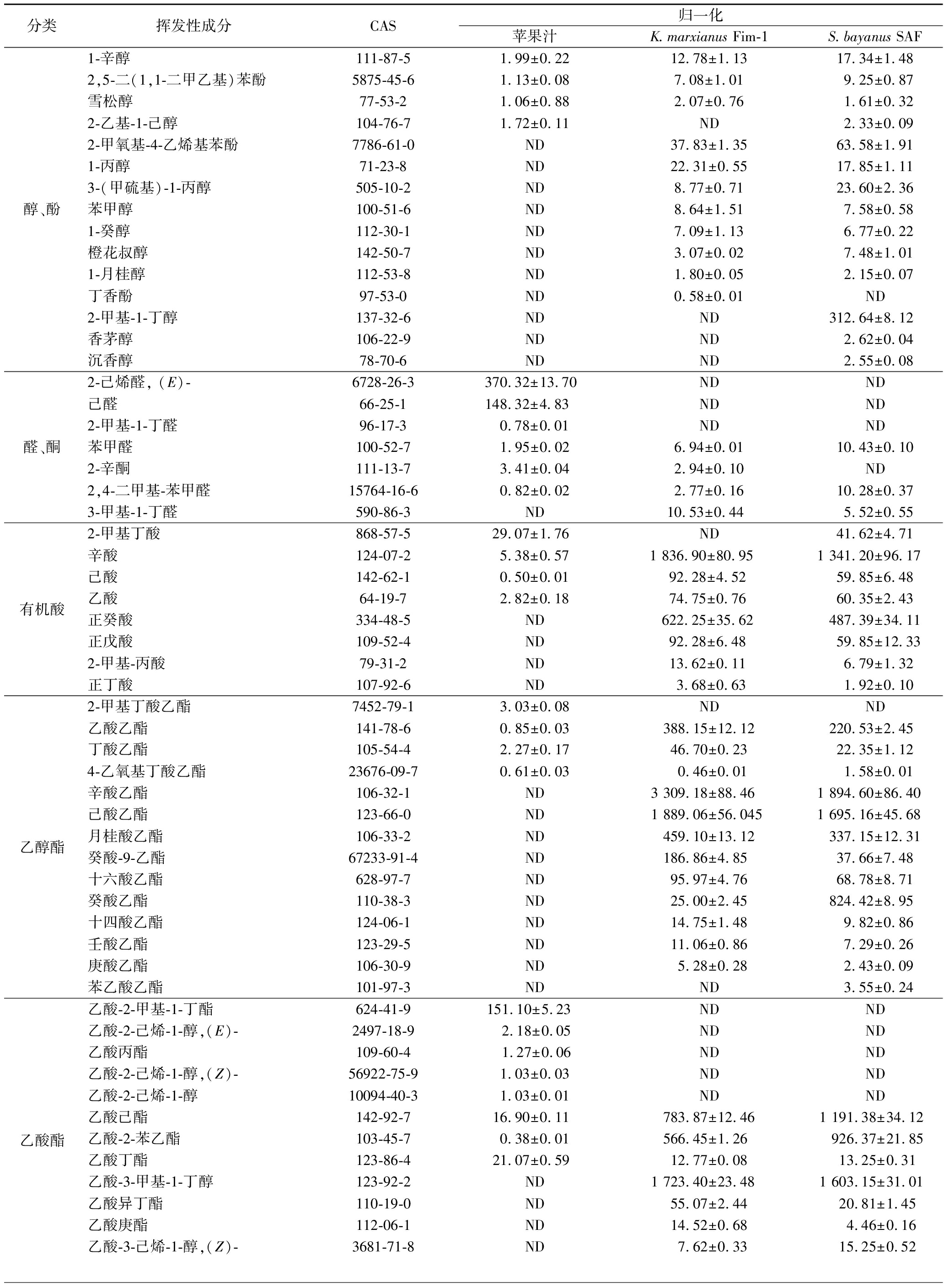
采用HS-SPME-GC-MS测定了苹果汁和苹果酒的挥发性成分。苹果汁中检测到了57种挥发成分,包括13种醇和酚、4种醛和酮、4种挥发性酸、4种乙醇酯、4种乙酸酯、11种其他酯和11种烷烃、烯烃等其他类挥发性化合物(表1)。苹果汁中有33种挥发成分,包括3种醛、5种醇和酚类、15种酯和10种其他类挥发成分(如庚烷、2,2,4,6,6-五甲基-十二烷、癸烷等),但在K.marxianusFim-1和S.bayanus SAF发酵的苹果酒中均没有检测到(表2),2种酵母发酵后产生的39种挥发成分主要是一些醇类和酯类。
依据HS-SPME-GC-MS检测结果,苹果汁的特征性挥发物有2-己烯醛、1-己醇、乙酸-2-甲基-1-丁醇酯、己醛、2-甲基-1-丁醇和1-丁醇。这一结果与韩国、中国和巴西的富士苹果成分分析一致[14-16]。其中,1-己醇和(E)2-己烯醛的含量最高,2-己烯醛是苹果风味的重要贡献者,而1-己醇对苹果香气起负面作用,抑制了苹果风味[17]。植物中C6-不饱和醛、(E)-2-己醛和己醛是通过亚麻酸LOX/HPL途径合成[18]。苹果成熟过程中乙醇脱氢酶(alcohol dehydrogenase,ADH)能催化产生苹果风味化合物2-己烯醛及其还原产物2-己烯-1-醇(E)[19],这些成分在K.marxianusFim-1和S.bayanusSAF苹果酒中都未检测到,可能是它们在ADH作用下分别被还原成己醇、2-己醇-1-醇和1-辛醇[19]。此外,(E)-2-己烯醛在葡萄酒发酵时可以作为硫醇前体合成3-巯基己-1-醇(3-mercapto-1-hexanol,3MH)和3-巯基乙酸酯(3-mercaptohexylacetate,3MHA)[20],但在K.marxianusFim-1和S.bayanusSAF苹果酒中均未检测到3MH和3MHA的存在,表明2种酵母可能通过ADH还原己烯醛替代硫醇反应。
表2 HS-SPME-GC-MS检测苹果汁、K.marxianus Fim-1苹果酒和S.bayanusSAF苹果酒的挥发性成分
Table 2 Volatile components of apple juice, K.marxianusFim-1 cider and S.bayanus SAF cider detected by HS-SPME-GC-MS
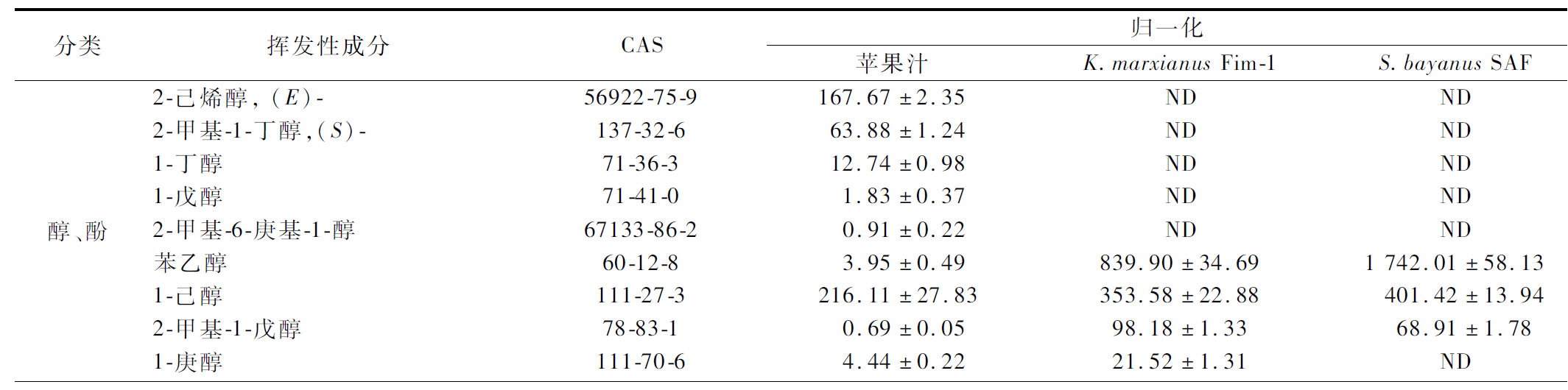
分类挥发性成分CAS归一化苹果汁K.marxianus Fim-1S.bayanus SAF醇、酚2-己烯醇, (E)-56922-75-9167.67±2.35NDND2-甲基-1-丁醇,(S)-137-32-663.88±1.24NDND1-丁醇71-36-312.74±0.98NDND1-戊醇71-41-01.83±0.37NDND2-甲基-6-庚基-1-醇67133-86-2 0.91±0.22NDND苯乙醇60-12-83.95±0.49839.90±34.691 742.01±58.131-己醇111-27-3216.11±27.83353.58±22.88401.42±13.942-甲基-1-戊醇78-83-10.69±0.0598.18±1.3368.91±1.781-庚醇111-70-64.44±0.2221.52±1.31ND
续表2
分类挥发性成分CAS归一化苹果汁K.marxianus Fim-1S.bayanus SAF醇、酚1-辛醇111-87-51.99±0.2212.78±1.1317.34±1.482,5-二(1,1-二甲乙基)苯酚5875-45-61.13±0.087.08±1.019.25±0.87雪松醇77-53-21.06±0.882.07±0.761.61±0.322-乙基-1-己醇104-76-71.72±0.11ND2.33±0.092-甲氧基-4-乙烯基苯酚7786-61-0ND37.83±1.3563.58±1.911-丙醇71-23-8ND22.31±0.5517.85±1.113-(甲硫基)-1-丙醇505-10-2ND8.77±0.7123.60±2.36苯甲醇100-51-6ND8.64±1.517.58±0.581-癸醇112-30-1ND7.09±1.136.77±0.22橙花叔醇142-50-7ND3.07±0.027.48±1.011-月桂醇112-53-8ND1.80±0.052.15±0.07丁香酚97-53-0ND0.58±0.01ND2-甲基-1-丁醇137-32-6NDND312.64±8.12香茅醇106-22-9NDND2.62±0.04沉香醇78-70-6NDND2.55±0.08醛、酮2-己烯醛, (E)-6728-26-3370.32±13.70 NDND己醛66-25-1148.32±4.83NDND2-甲基-1-丁醛96-17-30.78±0.01NDND苯甲醛100-52-71.95±0.026.94±0.0110.43±0.102-辛酮111-13-73.41±0.042.94±0.10ND2,4-二甲基-苯甲醛15764-16-60.82±0.022.77±0.1610.28±0.373-甲基-1-丁醛590-86-3ND10.53±0.445.52±0.55有机酸2-甲基丁酸868-57-529.07±1.76 ND41.62±4.71辛酸124-07-25.38±0.571 836.90±80.95 1 341.20±96.17己酸142-62-10.50±0.0192.28±4.5259.85±6.48乙酸64-19-72.82±0.1874.75±0.7660.35±2.43正癸酸334-48-5ND622.25±35.62487.39±34.11正戊酸109-52-4ND92.28±6.4859.85±12.332-甲基-丙酸79-31-2ND13.62±0.116.79±1.32正丁酸107-92-6ND3.68±0.631.92±0.10乙醇酯2-甲基丁酸乙酯7452-79-13.03±0.08NDND乙酸乙酯141-78-60.85±0.03388.15±12.12220.53±2.45 丁酸乙酯105-54-42.27±0.1746.70±0.2322.35±1.124-乙氧基丁酸乙酯23676-09-70.61±0.030.46±0.011.58±0.01辛酸乙酯106-32-1ND3 309.18±88.461 894.60±86.40己酸乙酯123-66-0ND1 889.06±56.0451 695.16±45.68月桂酸乙酯106-33-2ND459.10±13.12337.15±12.31癸酸-9-乙酯67233-91-4ND186.86±4.8537.66±7.48十六酸乙酯628-97-7ND95.97±4.7668.78±8.71癸酸乙酯110-38-3ND25.00±2.45824.42±8.95十四酸乙酯124-06-1ND14.75±1.489.82±0.86壬酸乙酯123-29-5ND11.06±0.867.29±0.26庚酸乙酯106-30-9ND5.28±0.282.43±0.09苯乙酸乙酯101-97-3NDND3.55±0.24乙酸酯乙酸-2-甲基-1-丁酯624-41-9151.10±5.23 NDND乙酸-2-己烯-1-醇,(E)-2497-18-92.18±0.05NDND乙酸丙酯109-60-41.27±0.06NDND乙酸-2-己烯-1-醇,(Z)-56922-75-91.03±0.03NDND乙酸-2-己烯-1-醇10094-40-31.03±0.01NDND乙酸己酯142-92-716.90±0.11783.87±12.461 191.38±34.12 乙酸-2-苯乙酯103-45-70.38±0.01566.45±1.26926.37±21.85乙酸丁酯123-86-421.07±0.5912.77±0.0813.25±0.31乙酸-3-甲基-1-丁醇123-92-2ND1 723.40±23.481 603.15±31.01乙酸异丁酯110-19-0ND55.07±2.4420.81±1.45乙酸庚酯112-06-1ND14.52±0.684.46±0.16乙酸-3-己烯-1-醇,(Z)-3681-71-8ND7.62±0.3315.25±0.52
续表2
分类挥发性成分CAS归一化苹果汁K.marxianus Fim-1S.bayanus SAF乙酸酯乙酸香叶酯105-87-3ND6.98±0.0412.19±0.21乙酸辛酯112-14-1ND6.71±0.179.17±0.07乙酸-3-甲氧基-丙酯16630-55-0ND5.82±0.2822.48±1.28乙酸-4-己烯-1-醇72237-36-6ND5.79±0.099.22±0.71乙酸苯甲酯140-11-4ND2.20±0.092.39±0.05乙酸氯癸酯6974-05-6ND1.72±0.05ND乙酸戊酯628-63-7ND1.58±0.01ND其他酯2-甲基丁酸丙酯37064-20-36.51±0.02NDND丙酸-2-戊酯54004-43-23.09±0.07NDND丙酸-2-甲基丁酯2438-20-22.89±0.03NDND2-甲基丁酸丁酯15706-73-72.84±0.01NDND丙酸丙酯106-36-52.56±0.02NDND丙酸-2-甲基-丁酯68039-26-91.84±0.01NDND碳酸十六烷基丙烯-1-烯-2-酯1000382-90-3(Pubchem CID 91692933)1.00±0.01NDND2-甲基丁酸-2-甲基丁基酯2445-78-50.49±0.01NDND丙酸己酯2445-76-30.43±0.01NDND双异丁酸-2,2,4-三甲基-1,3-戊二酯6846-50-011.51±0.5561.07±0.2215.25±0.05丁酸丁酯109-21-71.12±0.010.99±0.011.76±0.02辛酸-3-甲基丁酯2035-99-6ND109.79±1.9755.91±1.55五棕榈酸-3-甲基丁基酯2306-91-4ND54.13±3.1434.41±0.44己酸异戊酯2198-61-0ND21.45±0.66ND正辛酸异丁基酯5461-06-3ND16.50±0.15ND癸酸甲酯110-42-9ND9.99±0.014.78±0.04辛酸甲酯r111-11-5ND3.95±0.08ND十八酸乙酯111-61-5ND2.96±0.624.17±0.17己酸-2-甲酯105-79-3ND2.44±0.04NDβ-丁酸苯乙酯103-52-6ND1.75±0.052.69±0.09丙酸2-甲基-3-甲基丁酯2050-01-3ND1.65±0.01ND丁酸-3-己烯酯,(E)-53398-84-8NDND9.09±0.09己酸-2-苯乙酯6290-37-5NDND7.85±0.08异丁酸香叶酯2345-26-8NDND7.19±1.69十一酸甲酯1731-86-8NDND2.28±0.02碳酸二羰基乙烯基酯2243791-78-6NDND1.75±0.01其他2,2,4,6,6-五甲基-庚烷13475-82-65.61±0.11NDND十二烷112-40-32.04±0.04NDND癸烷629-92-51.55±0.01NDND乙苯100-41-41.06±0.02NDND1,3-二氯-5-甲基-苯25186-47-40.81±0.01NDND甲基巴豆酰乙酸33425-30-80.62±0.02NDND甲基庚烯酮110-93-00.61±0.01NDND草蒿脑140-67-00.33±0.01NDND1,3-二氯-2-甲基-苯118-69-40.29±0.02NDNDD-柠檬烯5989-27-50.27±0.01NDND大马酮23726-93-40.62±0.026.34±0.067.99±0.08正十一烷1120-21-40.86±0.01ND0.71±0.01乙酸铵631-61-8ND51.41±0.55 ND2,3-二羟基-香豆酮496-16-2ND18.77±0.7737.41±0.14正十四烷629-59-4ND7.37±0.31ND环辛烷292-64-8ND5.90±0.098.69±0.08环辛烯931-88-4ND3.93±0.02ND辛三烯40087-61-4ND2.64±0.02ND2-甲基-1,3-戊二烯,(E)-926-54-5ND2.51±0.01ND1-乙烯基-4-甲氧基-苯637-69-4ND2.16±0.12ND1-吲哚-十三烷35599-77-0ND2.07±0.15ND十九烷629-92-5ND1.85±0.183.63±0.13十三烷35599-77-0ND1.41±0.04ND2-甲基四氢噻吩-3-酮13679-85-1NDND42.69±1.94羟基丁酮513-86-0NDND7.87±0.064-甲基-环己烷591-47-9NDND2.86±0.072,4-己二烯592-46-1NDND2.12±0.061-吲哚-2-甲基十一烷73105-67-6NDND1.88±0.143-甲基-环己烷591-48-0NDND1.49±0.01
高级醇是发酵酒酯类重要前体,对酒的品质和风味有着重要的影响。相比之下,S.bayanusSAF比K.marxianus Fim-1多产生了2-乙基-1-己醇、2-甲基-1-丁醇、香茅醇和芳樟醇等4种醇,但没有丁香酚。具有玫瑰花香气的重要芳香醇苯乙醇的含量在K.marxianus Fim-1苹果酒和S.bayanus SAF苹果酒中分别增加了200倍和400倍[6]。
苹果汁中含有丁酸、2-甲基、辛酸、己酸和乙酸等4种挥发性酸。在K.marxianusFim-1和S.bayanusSAF苹果酒中,挥发性酸主要是正癸酸、戊酸和丙酸。S.bayanusSAF苹果酒还检测到2-甲基丁酸,但从含量上看,辛酸是2种苹果酒中最主要的挥发性酸。
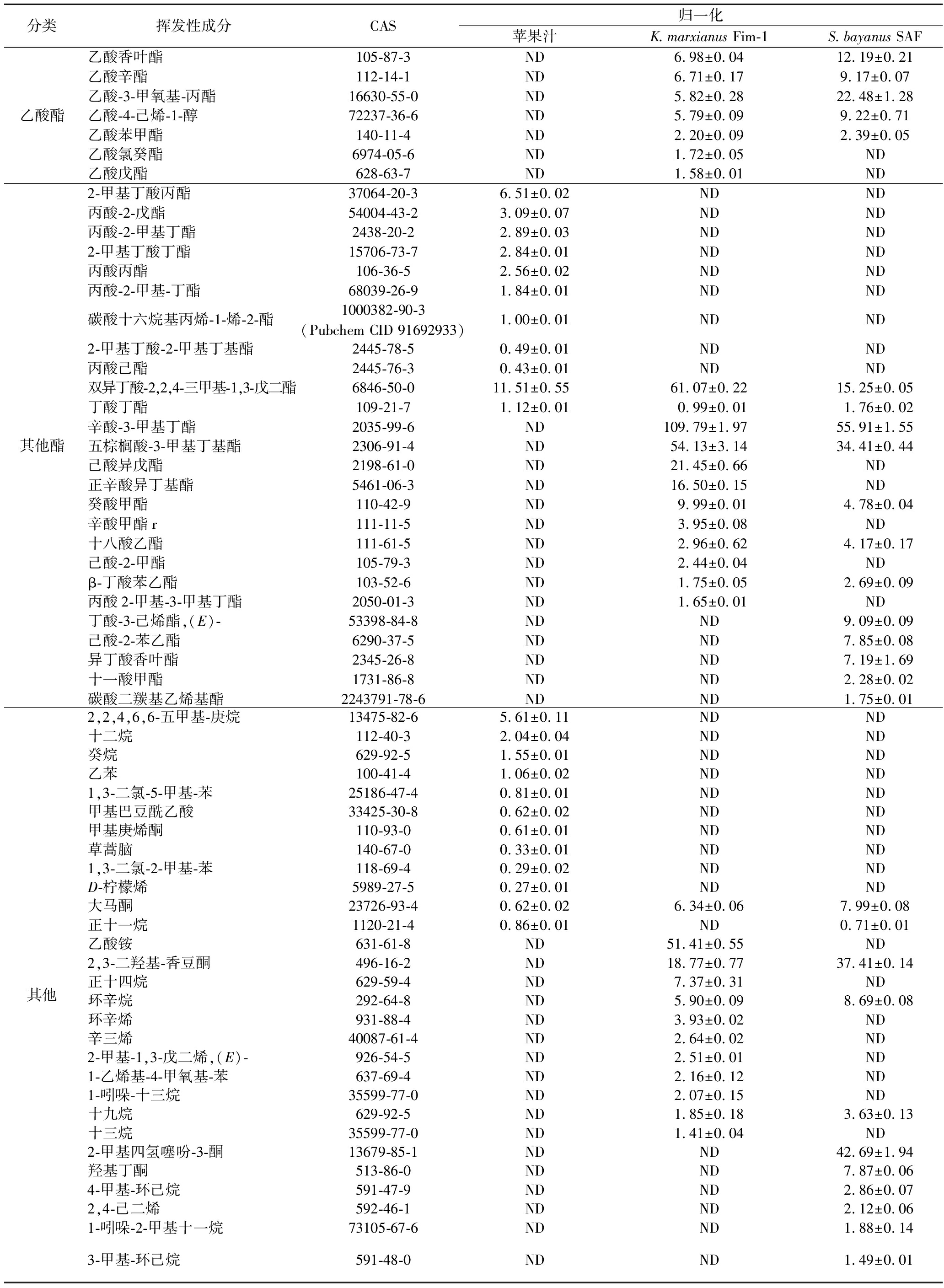
酯类是苹果酒中最为主要的挥发性物质,K.marxianusFim-1和S.bayanusSAF苹果酒分别有38种和37种酯类。这些酯类大多是在发酵过程由醇类物质酯化而成。在香味成分上,乙酸-3-甲基-1-丁酯、辛酸乙酯和己酸乙酯含量最高,具有果味、甜味、花香和香蕉味,并且苹果汁中并没有检测到,说明它们是酵母发酵的产物。相比之下,K.marxianusFim-1苹果酒中这些优势酯类的含量明显高于S.bayanusSAF苹果酒,说明K.marxianusFim-1在酿酒过程中能够产生更多的酯类,丰富了苹果酒的酯香。
2.4 多酚含量及抗氧化活性
多酚具有苦味和涩味,是直接影响苹果酒质量和感官的重要化合物,也是主要抗氧化物。根据其化学结构的多样性,多酚类物质可分为黄烷醇、羟基肉桂酸、二氢查耳酮、黄酮醇和花青素,也可以分为类黄酮和非类黄酮等六类[21]。本研究采用DPPH自由基和PTIO自由基测定了苹果酒的抗氧化活性。如图3所示,在DPPH自由基清除率上,K.marxianusFim-1苹果酒的抗氧化活性高于苹果汁,但低于S.bayanusSAF苹果酒。而对于PTIO自由基清除率,K.marxianus Fim-1苹果酒明显高于S.bayanus SAF苹果酒和苹果汁。DPPH自由基和PTIO自由基清除率结果不一致性可能是由于2种自由基的偏好性不同导致,其中PTIO自由基更适合测定多酚的抗氧化活性[22],由此说明K.marxianusFim-1苹果酒多酚含量可能高于S.bayanus SAF苹果酒。
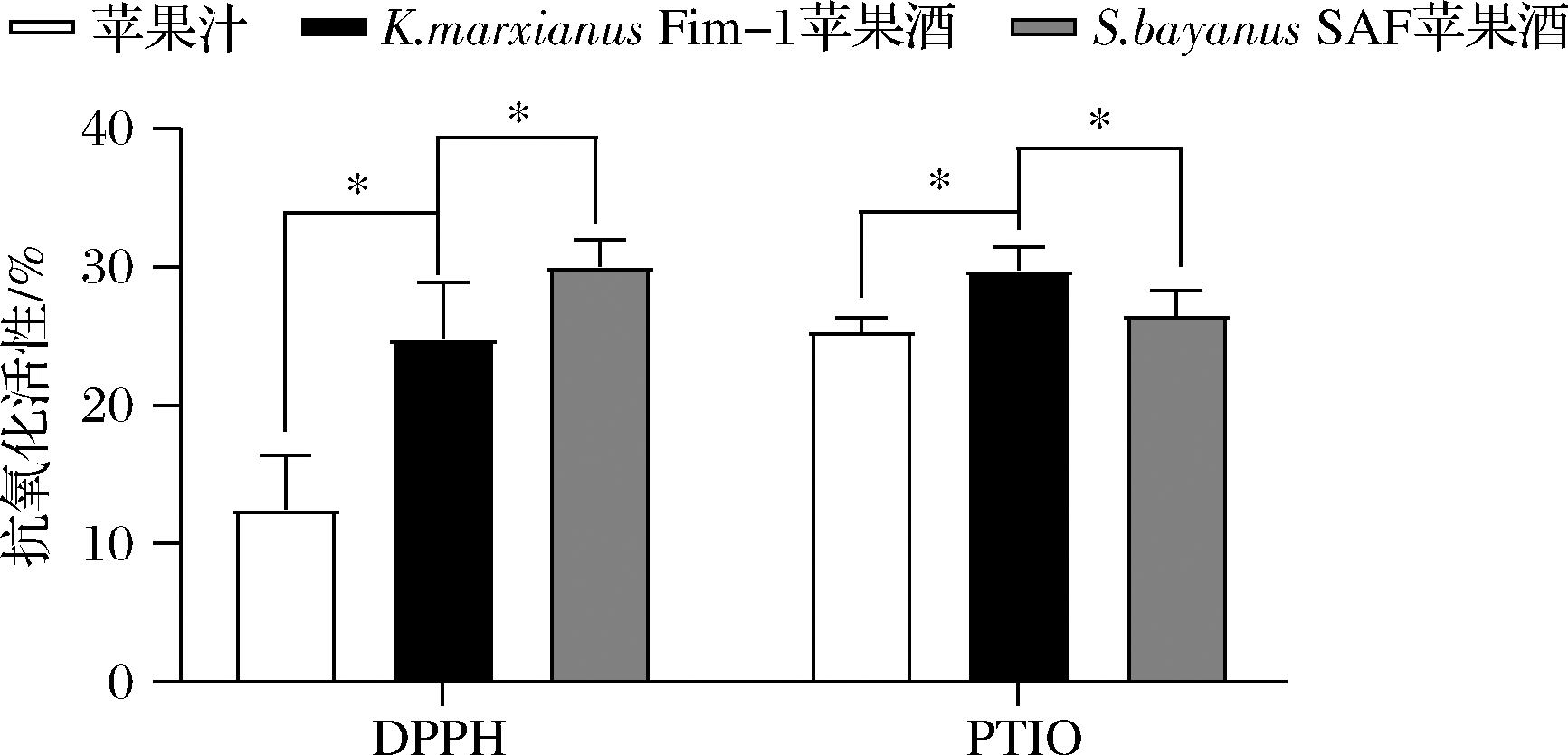
图3 K.marxianusFim-1和S.bayanus SAF 苹果酒的DPPH自由基和PTIO自由基清除率
Fig.3 Clearances rate of DPPH and PTIO for K.marxianus Fim-1 and S.bayanus SAF ciders 注:*表示P<0.05
进一步,使用UPLC-MS检测了苹果酒和苹果汁中的抗氧化成分,在苹果酒中发现了41种抗氧化成分,包括14种黄酮、3种查尔酮、2种花青色素类、5种香豆素类、6种肉桂酸类和其他11种抗氧化成分(表3)。K.marxianusFim-1苹果酒中多酚类成分含量最高的是槲皮素-3-O-葡萄糖苷,占总多酚的21.9%,此外还含有丰富的儿茶酚。与PTIO自由基清除率结果一致,K.marxianusFim-1苹果酒中的总多酚含量比S.bayanusSAF苹果酒提高了17.5%。然而,UPLC-MS结果表明苹果汁的多酚含量高于苹果酒,但自由基清除实验结果表明其抗氧化活性较低,这可能是苹果压榨过程发生了氧化,在多酚氧化酶的催化下多酚氧化成有颜色的o-醌[23]。在酵母发酵过程中,糖酵解厌氧代谢产生的高还原力,还原部分o-醌成多酚,提升了苹果酒的抗氧化活性。
表3 UPLC-MS检测苹果汁、K.marxianus Fim-1苹果酒和S.bayanusSAF苹果酒中的抗氧化成分
Table 3 Antioxidant ingredients of apple juice, K.marxianus Fim-1 cider and S.bayanusSAF cider detected by UPLC-MS
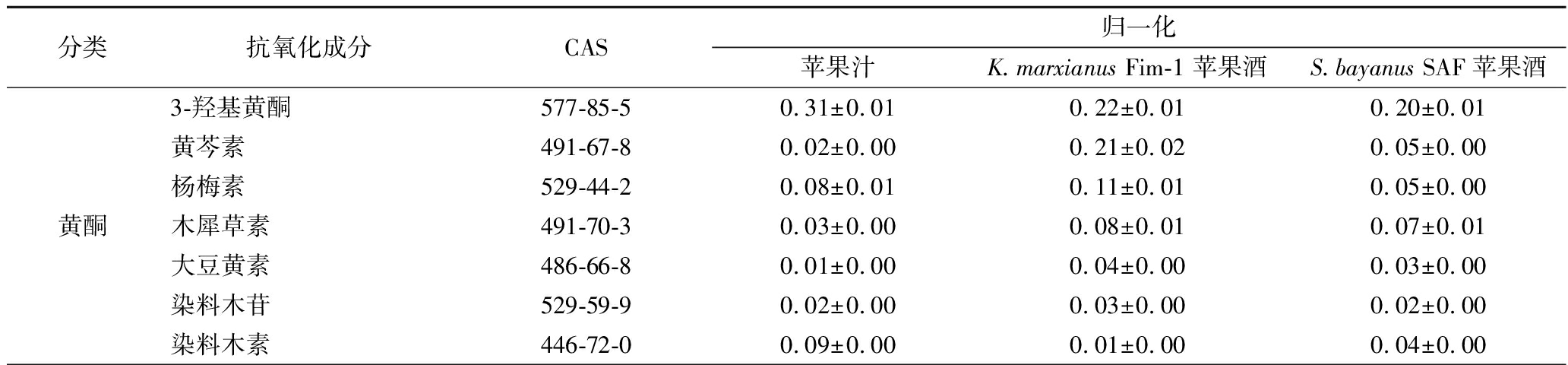
分类抗氧化成分CAS归一化苹果汁K.marxianus Fim-1 苹果酒S.bayanus SAF苹果酒黄酮3-羟基黄酮577-85-50.31±0.010.22±0.010.20±0.01黄芩素491-67-80.02±0.000.21±0.020.05±0.00杨梅素529-44-20.08±0.010.11±0.010.05±0.00木犀草素491-70-30.03±0.000.08±0.010.07±0.01大豆黄素486-66-80.01±0.000.04±0.000.03±0.00染料木苷529-59-90.02±0.000.03±0.000.02±0.00染料木素446-72-00.09±0.000.01±0.000.04±0.00
续表3
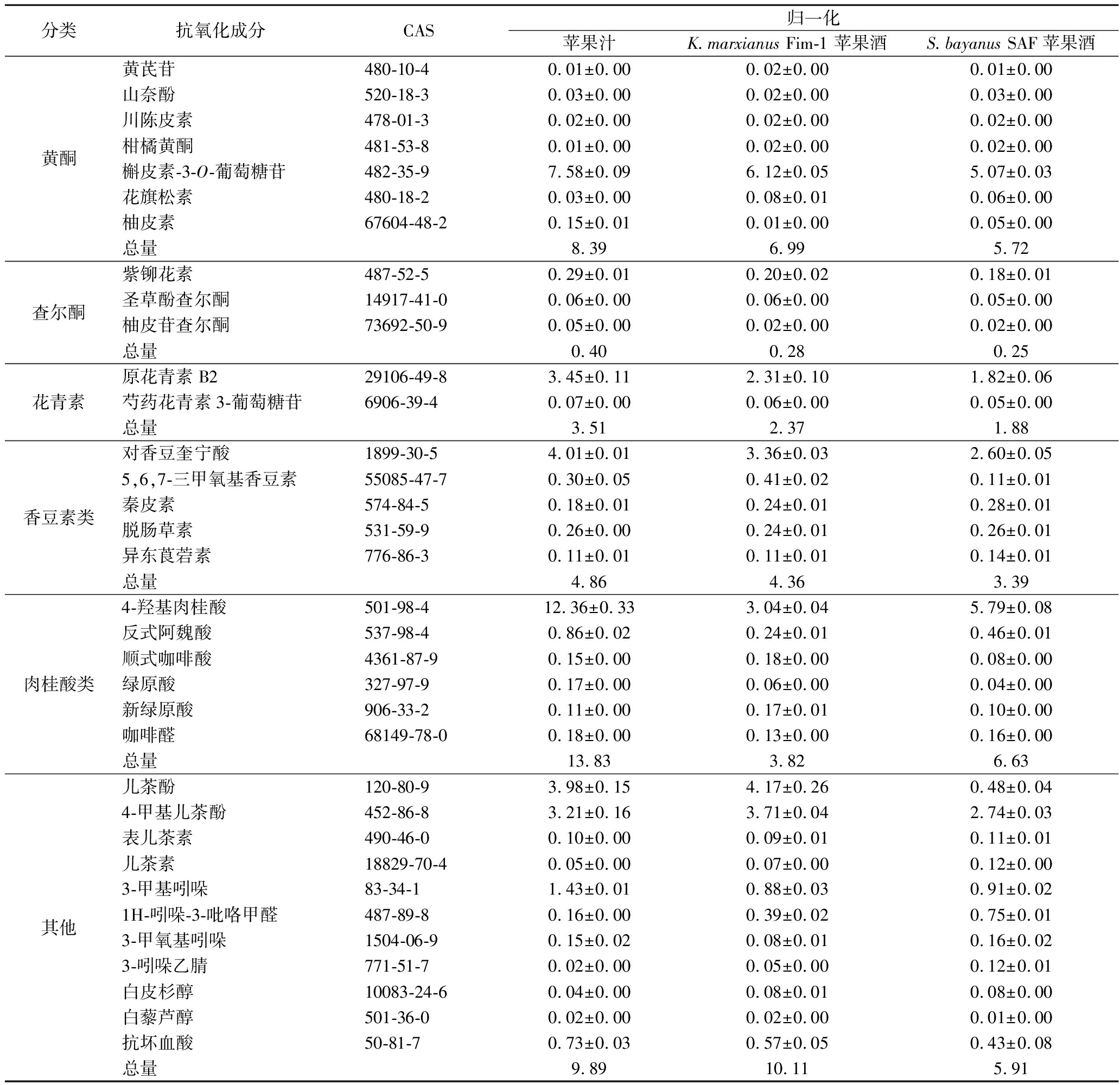
分类抗氧化成分CAS归一化苹果汁K.marxianus Fim-1 苹果酒S.bayanus SAF苹果酒黄酮黄芪苷480-10-40.01±0.000.02±0.000.01±0.00山奈酚520-18-30.03±0.000.02±0.000.03±0.00川陈皮素478-01-30.02±0.000.02±0.000.02±0.00柑橘黄酮481-53-80.01±0.000.02±0.000.02±0.00槲皮素-3-O-葡萄糖苷482-35-97.58±0.096.12±0.055.07±0.03花旗松素480-18-20.03±0.000.08±0.010.06±0.00柚皮素67604-48-20.15±0.010.01±0.000.05±0.00总量8.396.995.72查尔酮紫铆花素487-52-50.29±0.010.20±0.020.18±0.01圣草酚查尔酮14917-41-00.06±0.000.06±0.000.05±0.00柚皮苷查尔酮73692-50-90.05±0.000.02±0.000.02±0.00总量0.400.280.25花青素原花青素B229106-49-83.45±0.112.31±0.101.82±0.06芍药花青素3-葡萄糖苷6906-39-40.07±0.000.06±0.000.05±0.00总量3.512.371.88香豆素类对香豆奎宁酸1899-30-54.01±0.013.36±0.032.60±0.055,6,7-三甲氧基香豆素55085-47-70.30±0.050.41±0.020.11±0.01秦皮素574-84-50.18±0.010.24±0.010.28±0.01脱肠草素531-59-90.26±0.000.24±0.010.26±0.01异东莨菪素776-86-30.11±0.010.11±0.010.14±0.01总量4.864.363.39肉桂酸类4-羟基肉桂酸501-98-412.36±0.333.04±0.045.79±0.08反式阿魏酸537-98-40.86±0.020.24±0.010.46±0.01顺式咖啡酸4361-87-90.15±0.000.18±0.000.08±0.00绿原酸327-97-90.17±0.000.06±0.000.04±0.00新绿原酸906-33-20.11±0.000.17±0.010.10±0.00咖啡醛68149-78-00.18±0.000.13±0.000.16±0.00总量13.833.826.63其他儿茶酚120-80-93.98±0.154.17±0.260.48±0.044-甲基儿茶酚452-86-83.21±0.163.71±0.042.74±0.03表儿茶素490-46-00.10±0.000.09±0.010.11±0.01儿茶素18829-70-40.05±0.000.07±0.000.12±0.003-甲基吲哚83-34-11.43±0.010.88±0.030.91±0.021H-吲哚-3-吡咯甲醛487-89-80.16±0.000.39±0.020.75±0.013-甲氧基吲哚1504-06-90.15±0.020.08±0.010.16±0.023-吲哚乙腈771-51-70.02±0.000.05±0.000.12±0.01白皮杉醇10083-24-60.04±0.000.08±0.010.08±0.00白藜芦醇501-36-00.02±0.000.02±0.000.01±0.00抗坏血酸50-81-70.73±0.030.57±0.050.43±0.08总量9.8910.115.91
2.5 感官分析
如图4所示,20名未经训练的品尝员对苹果酒感官评价显示2种苹果酒的香味除了苹果香外几乎相同,但K.marxianus Fim-1苹果酒香味得分较高。风味评价上K.marxianus Fim-1和S.bayanus SAF苹果酒的风味评价得分为35.6分和32.1分。由于2种苹果酒的可溶性固形物含量基本一致,因而它们的甜味评价得分几乎一致。品尝员对K.marxianusFim-1苹果酒的酸度、苹果味、果味和酒味给了更高的得分,相比之下S.bayanus SAF苹果酒这些风味得分较低,表明K.marxianus Fim-1苹果酒口感更为丰富。
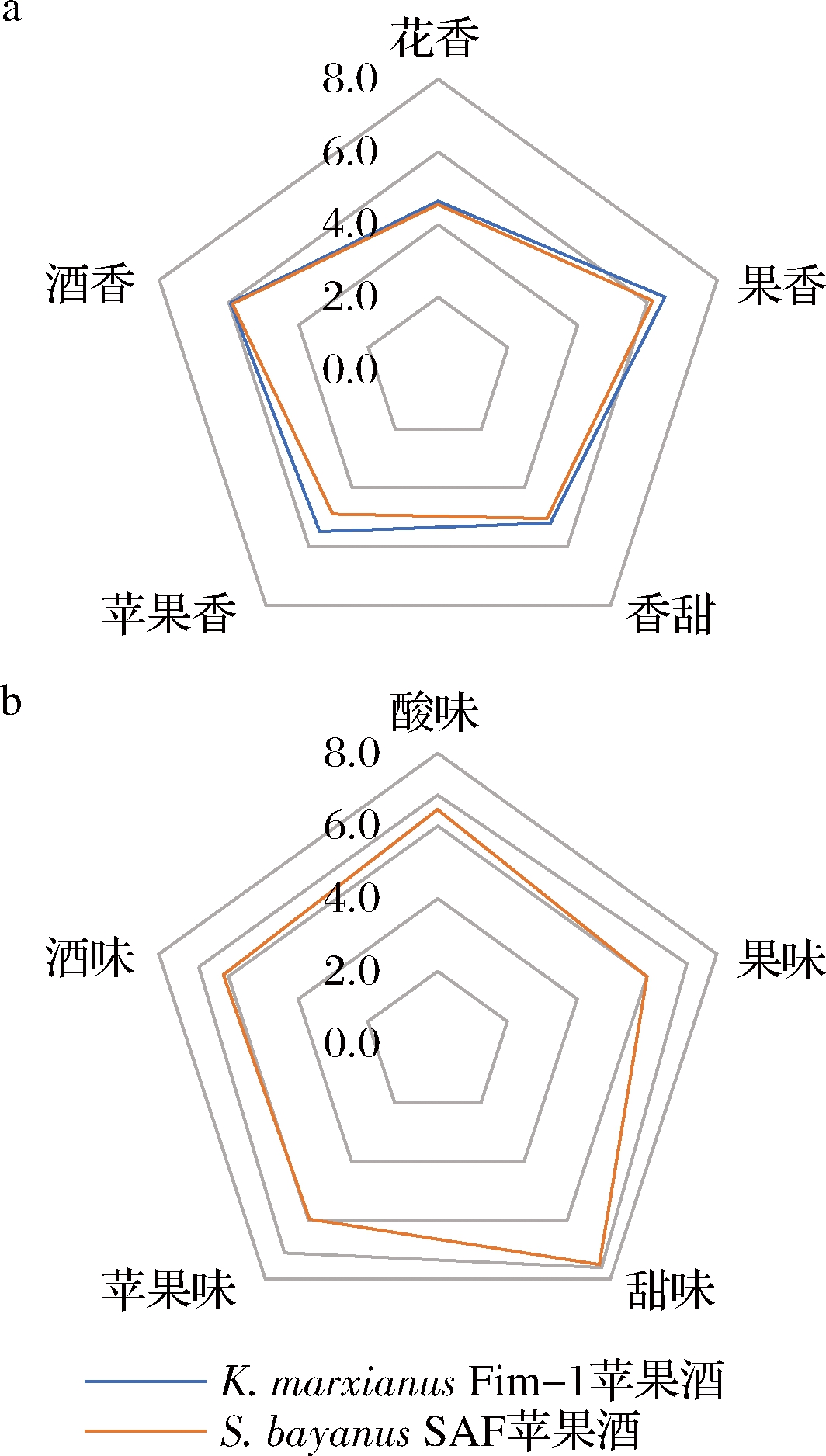
a-香气指标平均得分;b-味觉指标平均得分
图4 K.marxianusFim-1和S.bayanus SAF 苹果酒各感官评价指标的平均得分
Fig.4 Average scores of each sensory evaluation indicators for both K.marxianusFim-1 and S.bayanus SAF ciders
3 结论与讨论
本研究从乙醇发酵、挥发性成分和抗氧化多酚产量以及苹果酒感官方面的评价了K.marxianusFim-1发酵苹果酒的特征。与传统酿酒酵母S.bayanusSAF相比,K.marxianusFim-1在较宽的温度范围内均表现出更高的酒精发酵速率。以富士苹果为原料,添加K.marxianusFim-1酿制的苹果酒总酸含量提高了47.6%。由于我国苹果的品种以鲜食甜苹果为主,酸和单宁含量较低,通常<0.45%和<0.2%,K.marxianus的高产酸能力可增强甜苹果的酸味,丰富口感。
K.marxianus是一种耐高温酵母,最高耐受温度可达52 ℃以上。然而,在苹果酒发酵过程中,当发酵温度高于45 ℃时,K.marxianus的生长和乙醇发酵都受到抑制。通常情况下,高温会诱导酵母细胞积累产生更多活性氧和乙酸,一旦这些抑制剂逐渐积累到足以抑制酒精发酵,发酵就会停止[24]。但是,苹果酒发酵是在限制氧条件下进行,这可能有助于提高它们的生存能力和耐热性[25]。因此,我们推测K.marxianus在45 ℃下发酵不能进行可能与苹果汁低pH值有关。
此外,K.marxianusFim-1在苹果酒发酵过程能分泌PGase,这可能有利于工业上的发酵后处理。与S.bayanus SAF相比,K.marxianus发酵苹果酒酯类含量更丰富,而且多酚总量高出17.5%,其中黄芩素、儿茶酚、咖啡酸都有显著提高,分别提高3.2、7.7和1.3倍。PTIO的抗氧化水平也同样表明K.marxianus发酵更有利于保留苹果汁中多酚。综上所述,K.marxianusFim-1是一种苹果酒酿造的优良酵母,可用于生产高品质的苹果酒。
[1] AICV.AICV Cider Trends 2021[EB/OL].[2022-6-10] .https://aicv.org/files/attachments/.453/AICV_Cider_Trends_2021.pdf.
[2] PADILLAB, GIL J V, MANZANARES P.Past and future of non-Saccharomycesyeasts:From spoilage microorganisms to biotechnological tools for improving wine aroma complexity[J].Frontiers in Microbiology, 2016, 7:411.
[3] DEARRUDA MOURA PIETROWSKI G, ELEUTÉRIO DOS SANTOS C M, SAUER E, et al.Influence of fermentation with Hanseniasporasp.yeast on the volatile profile of fermented apple[J].Journal of Agricultural and Food Chemistry, 2012, 60(39):9 815-9 821.
[4] BENITO  , CALDER
, CALDER N F, PALOMERO F, et al.Combine use of selected Schizosaccharomyces pombeand Lachancea thermotoleransyeast strains as an alternative to the traditional malolactic fermentation in red wine production[J].Molecules (Basel, Switzerland), 2015, 20(6):9 510-9 523.
N F, PALOMERO F, et al.Combine use of selected Schizosaccharomyces pombeand Lachancea thermotoleransyeast strains as an alternative to the traditional malolactic fermentation in red wine production[J].Molecules (Basel, Switzerland), 2015, 20(6):9 510-9 523.
[5] YEM Q, YUE T L, YUAN Y H.Effects of sequential mixed cultures of Wickerhamomyces anomalusand Saccharomyces cerevisiaeon apple cider fermentation[J].FEMS Yeast Research, 2014, 14(6):873-882.
[6] QIANX J, YAN W, ZHANG W M, et al.Current status and perspectives of 2-phenylethanol production through biological processes[J].Critical Reviews in Biotechnology, 2019, 39(2):235-248.
[7] SIEIROC, VILLA T G, DA SILVA A F, et al.Albari o wine aroma enhancement through the use of a recombinant polygalacturonase from Kluyveromyces marxianus[J].Food Chemistry, 2014, 145:179-185.
o wine aroma enhancement through the use of a recombinant polygalacturonase from Kluyveromyces marxianus[J].Food Chemistry, 2014, 145:179-185.
[8] PIEMOLINI-BARRETOL T, ZACARIA J, DELAMARE A P L, et al.Variation in phenolic compounds, anthocyanins, and color in red wine treated with enzymatic extract of Kluyveromyces marxianus[J].World Journal of Microbiology and Biotechnology, 2014, 30(5):1 541-1 547.
[9] KARIMA, GERLIANI N, AÏDER M.Kluyveromyces marxianus:An emerging yeast cell factory for applications in food and biotechnology[J].International Journal of Food Microbiology, 2020, 333:108818.
[10] NAUMOVG I, NGUYEN H V, NAUMOVA E S, et al.Genetic identificationof Saccharomyces bayanusvar.uvarum, a cider-fermenting yeast[J].International Journal of Food Microbiology, 2001, 65(3):163-171.
[11] BAJPAIP, MARGARITIS A.The effect of temperature and pH on ethanol production by free and immobilized cells of Kluyveromyces marxianusgrown on Jerusalem artichoke extract[J].Biotechnology and Bioengineering, 1987, 30(2):306-313.
[12] BELDAI, CONCHILLO L B, RUIZ J, et al.Selection and use of pectinolytic yeasts for improving clarification and phenolic extraction in winemaking[J].International Journal of Food Microbiology, 2016, 223:1-8.
[13] DIVOLB, VAN RENSBURG P.PGU1gene natural deletion is responsible for the absence of endo-polygalacturonase activity in some wine strains of Saccharomyces cerevisiae[J].FEMS Yeast Research, 2007, 7(8):1 328-1 339.
[14] SONGH P, SHIM S L, LEE S I, et al.Analysis of volatile organic compounds of ‘Fuji’ apples following electron beam irradiation and storage[J].Radiation Physics and Chemistry, 2012, 81(8):1 084-1 087.
[15] QINL, WEI Q P, KANG W H, et al.Comparison of volatile compounds in ‘fuji’ apples in the different regions in China[J].Food Science and Technology Research, 2017, 23(1):79-89.
[16] DONADELJ Z, THEWES F R, DE OLIVEIRA ANESE R, et al.Key volatile compounds of ‘Fuji Kiku’ apples as affected by the storage conditions and shelf life:Correlation between volatile emission by intact fruit and juice extracted from the fruit[J].Food Research International, 2019, 125:108625.
[17] GUOJ, YUE T L, YUAN Y H, et al.Characterization of volatile and sensory profiles of apple juices to trace fruit origins and investigation of the relationship between the aroma properties and volatile constituents[J].LWT, 2020, 124:109203.
[18] ZHOUZ W, WU Q Y, YAO Z L, et al.Dynamics of ADH and related genes responsible for the transformation of C6-aldehydes to C6-alcohols during the postharvest process of oolong tea[J].Food Science &Nutrition, 2020, 8(1):104-113.
[19] LINJ, MASSONNET M, CANTU D.The genetic basis of grape and wine aroma[J].Horticulture Research, 2019, 6:81.
[20] HARSCHM J, BENKWITZ F, FROST A, et al.New precursor of 3-mercaptohexan-1-ol in grape juice:Thiol-forming potential and kinetics during early stages of must fermentation[J].Journal of Agricultural and Food Chemistry, 2013, 61(15):3 703-3 713.
[21] SINGLAR K, DUBEY A K, GARG A, et al.Natural polyphenols:Chemical classification, definition of classes, subcategories, and structures[J].Journal of AOAC INTERNATIONAL, 2019, 102(5):1 397-1 400.
[22] LIX C.2-phenyl-4, 4, 5, 5-tetramethylimidazoline-1-oxyl 3-oxide (PTIO•) radical scavenging:A new and simple antioxidant assay in vitro[J].Journal of Agricultural and Food Chemistry, 2017, 65(30):6 288-6 297.
[23] HOLDERBAUMD F, KON T, KUDO T, et al.Enzymatic browning, polyphenol oxidase activity, and polyphenols in four apple cultivars:Dynamics during fruit development[J].HortScience, 2010, 45(8):1 150-1 154.
[24] FUX F, LI P S, ZHANG L, et al.Understanding the stress responses of Kluyveromyces marxianusafter an arrest during high-temperature ethanol fermentation based on integration of RNA-Seq and metabolite data[J].Applied Microbiology and Biotechnology, 2019, 103(6):2 715-2 729.
[25] DAVIDSONJ F, WHYTE B, BISSINGER P H, et al.Oxidative stress is involved in heat-induced cell death in Saccharomyces cerevisiae[J].Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(10):5 116-5 121.