颜色是红葡萄酒的感官质量评价体系中的一个重要指标,通常是消费者判断葡萄酒质量的主要手段和购买决策的重要依据[1-2]。红葡萄酒的颜色主要取决于花色苷及其衍生物:在新红葡萄酒中,主要以单体花色苷为主;随着陈酿储存时间的推移,单体花色苷含量不断降低,它们通过氧化、聚合、环化或加成等作用形成更加复杂的花色苷衍生物,即不同种类的聚合花色苷等[3-4]。相应地,葡萄酒的颜色逐渐由宝石红、紫红色向瓦红色、砖红色转化,黄色、棕色色调不断加深[5]。然而,在我国西部葡萄酒产区,由于气候、土壤等条件的影响,葡萄原料普遍存在“糖高酸低”且成熟较快的特点;所酿红葡萄酒在贮运期间经常出现颜色褪去过快、香气和口感过早衰退等老化现象,严重影响了红葡萄酒的感官品质和营养价值,缩短了产品的“货架期”[6-8]。
有机酸作为葡萄酒的重要风味构成物质,其种类和浓度决定着葡萄酒的酸度和pH,对葡萄酒的感官质量、理化特性和微生物稳定性具有重要影响[2]。尤为重要的是,有机酸的相对浓度直接影响葡萄酒的pH:一方面,pH会影响葡萄酒中SO2的平衡反应,特别是游离态和分子态SO2的含量;另一方面,pH会影响不同形式花色苷之间的平衡转换,以及色素和酚类化合物在陈酿储存期间的氧化、聚合或缩合反应,从而影响红葡萄酒的颜色稳定性[2,9]。实际生产中,化学增酸是提高葡萄酒酸度的传统方法,包括调整发酵前葡萄汁酸度和发酵后葡萄酒酸度[2]。根据国际葡萄与葡萄酒组织(International Organization of Vine and Wine,O.I.V.)的规定,允许用于调整酸度的有机酸为酒石酸、苹果酸和乳酸,且最大限量为4.0 g/L(以酒石酸计)。但是不同国家规定不同,欧洲法律允许最大添加量(以酒石酸计)为:葡萄汁1.5 g/L,葡萄酒2.5 g/L;美国法律规定:经酸化后最终葡萄酒中最大固定酸含量为9.0 g/L(以酒石酸计)[2,10]。考虑到微生物发酵对发酵前调酸的影响(主要是发酵期间酒样酸度的不可控性),目前的研究集中于发酵后调酸处理,以此提升葡萄酒的颜色稳定性[10-11];然而,也有研究认为当葡萄汁pH值过高(>3.5)时,在发酵前调整酸度更有利于避免微生物活动带来的负面影响[2]。目前,国内的相关研究还很少。课题组在前期的预实验中发现,西部产区的葡萄达到工业成熟度时很多葡萄汁的pH值超过了3.5。
因此,试验以宁夏贺兰山东麓葡萄酒产区主要红色酿酒葡萄品种西拉为原料,采用在发酵前添加不同种类有机酸及其组合的方法酿造干红葡萄酒;通过检测酒样的理化指标,结合感官评价,探讨酒样储存期间颜色变化和品质之间的关系,明确有机酸对西拉红葡萄酒颜色和感官质量的影响及其潜在原因,为解决西部产区红葡萄酒颜色不稳定、老化过快问题提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 葡萄
西拉葡萄于2020年9月购自宁夏贺兰山东麓葡萄酒产区(红寺堡)。原料采收时,还原糖(以葡萄糖计)含量为249.5 g/L,总酸(以酒石酸计)含量为4.05 g/L,pH 3.98。
1.1.2 试剂
Bv818酵母,安琪酵母股份有限公司;BXL果胶酶,德国AB酶制剂公司;偏重亚硫酸钾,天津市福晨化学试剂厂;膨润土,德国爱普思乐集团。
L-酒石酸(99.5%)、L-苹果酸(99%)、柠檬酸(≥99.5%)、乳酸(≥85%)、琥珀酸(≥99.0%)、(+)-儿茶素、对二甲氨基肉桂醛、ABTS、DPPH、水溶性维生素E(Trolox)、乙醛(以上均为分析纯)、二甲花翠素-3-O-葡萄糖苷标准品(≥95%),美国Sigma-Aldrich公司;乙酸(≥99.5%),分析纯,广东光华科技股份有限公司;甲酸(≥88.0%),分析纯,天津市科密欧化学试剂有限公司;无水乙醇,分析纯,四川西陇科学有限公司;乙腈,色谱纯,美国Anaqua Chemicals Supply公司;去离子水(电阻率18.2 MΩ·cm)。
1.2 仪器与设备
Cary 60紫外可见分光光度计,美国Agilent公司;LC-20AT高效液相色谱仪,日本Shimadzu公司;FE20 pH计,美国Mettler Toledo公司;BT 25S电子天平,德国Sartorius公司;HZ85-2磁力搅拌机,北京中兴伟业仪器有限公司;CSAS-轻松感官分析软件系统,上海瑞芬智能科技有限公司;Clever S15超纯水系统,芷昂仪器(上海)有限公司。
1.3 实验方法
1.3.1 西拉干红葡萄酒的酿造和有机酸的添加
采用10 L褐色玻璃罐作为发酵容器,葡萄破碎入罐后添加40 mg/L果胶酶和60 mg/L SO2,低温(8~10 ℃)浸渍24 h;基于原料本身的总酸含量,以未加入有机酸为对照(CK),分别进行有机酸添加处理(所有处理的有机酸添加总量一致):添加3.0 g/L酒石酸(tartaric acid,TA),添加3.0 g/L苹果酸(malicacid,MA),添加2.5 g/L酒石酸和0.5 g/L柠檬酸(citric acid,CA)(TA+CA),添加1.5 g/L酒石酸和1.5 g/L苹果酸(TA+MA),添加1.25 g/L酒石酸、1.25 g/L苹果酸和0.5 g/L柠檬酸(TA+MA+CA);混匀后,接种300 mg/L商业酵母启动酒精发酵(19±2)℃;待发酵结束(残糖<4.0 g/L),添加60 mg/LSO2终止发酵,置于4 ℃冷库中稳定澄清;储存120 d时加入0.8 g/L膨润土下胶,过滤装瓶,置于地下酒窖储藏;陈酿期间(装瓶前)和装瓶时,向各酒样中补加等量SO2。每个处理重复2次,于酒精发酵结束后罐储期间(第46天)、装瓶后1周时(第130天)和瓶储2个月时(第190天)取样分析酒样理化指标和进行感官评价。
1.3.2 酒样基本理化指标的测定
参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》:还原糖(斐林试剂滴定法,以葡萄糖计),总酸(酸碱指示剂法,以酒石酸计),酒精度(密度瓶法),挥发酸(水蒸气带馏法,以醋酸计),pH值(pH计法),游离SO2和总SO2(直接碘量法)。
1.3.3 有机酸的测定
参照GRANT-PREECE等[12]的方法并有所调整,利用HPLC测定葡萄酒中的酒石酸等6种有机酸浓度。分析条件:BIO-RAD Aminex HPX-87 H+色谱柱(300 mm×7.8 mm),流动相5 mmol/L H2SO4溶液,等浓度洗脱30 min,流速0.50 mL/min,柱温55 ℃,检测波长215 nm,进样量20 μL。采用外标法对有机酸进行定量分析。
1.3.4 颜色指标的测定
参照CLIFF等[13]和LAN等[14]的方法,采用紫外可见分光光度计测定。
使用1 mm光程石英比色皿,测定样品在420、520、620 nm处的吸光度,读数校正乘以10,色度和色调按公式(1)和公式(2)计算。
色度=[(A420-A700)+(A520-A700)+(A620-A700)]×10
(1)
色调=(A420-A700)/(A520-A700)
(2)
辅色花色苷、单体花色苷、聚合花色苷和总花色苷的测定波长为520 nm:取20 μL 20%(体积分数)的乙醛加入到2 mL酒样中,室温下静置45 min后,使用1 mm比色皿测定(A乙醛);用模拟酒将酒样稀释20倍,取稀释样置于1 cm比色皿中测定(A酒样),计算时乘以稀释倍数20;将160 μL 50 g/L SO2溶液加入到2 mL酒样中,静置10 min后,使用1 mm比色皿测定(ASO2)。
不同种类花色苷按公式(3)~公式(6)计算:
辅色花色苷/Au=(A乙醛-A700)×10-(A酒样-A700)×20
(3)
单体花色苷/Au=(A酒样-A700)×20-(ASO2-A700)×10
(4)
聚合花色苷/Au=(ASO2-A700)×10
(5)
总花色苷/Au=(A乙醛-A700)×10
(6)
1.3.5 花色苷成分的测定
采用HPLC测定花色苷的含量[15]。色谱柱采用Synergi Hydro-RP C18(250 mm×4.6 mm,4 μm);流动相A:V(水)∶V(乙腈)∶V(甲酸)=32∶4∶1;流动相B:V(水)∶V(乙腈)∶V(甲酸)=16∶20∶1。洗脱程序为:0~45 min,0~35% B;45~46 min,35%~100% B;50~51 min,100%~0% B;流速:1.0 mL/min;柱温35 ℃;检测波长520 nm;进样量20 μL。
不同花色苷的含量以二甲花翠素-3-O-葡萄糖苷(malvidin-3-O-glucoside,Mv-3-O-Glu)等价值(mg/L)计。
1.3.6 酚类物质和抗氧化活性的测定
参照LI等[16]的方法,测定总酚含量(福林-肖卡法)、总黄烷醇含量(对二甲氨基肉桂醛法)和总类黄酮含量(亚硝酸钠-氯化铝法),结果以(+)-儿茶素等价值(g/L)表示;采用ABTS和DPPH自由基清除法测定葡萄酒抗氧化活性。结果以Trolox当量值TEAC(mmol/L)表示。
1.3.7 感官评价
参考杨洁等[17]的方法,品评员进行葡萄酒品评、香气参比样辨别测试和定量描述性分析等一系列训练后,进行考核和筛选,并组建可靠品评小组:共12人,男女比例1∶1,年龄在18~25岁,主要由西北农林科技大学葡萄酒学院大三、大四本科生和研究生组成。
感官评分:参照亚洲葡萄酒质量大赛评分标准[18],要求品评小组成员对酒样的外观(15分)、香气(30分)、口感(44分)和平衡性(11分)分别进行描述和打分。
定量描述性分析:借助轻松感官分析软件系统,利用线性标度法(0~10 cm)对感官特性进行定量描述分析。感官描述词为:黑色浆果、黑莓、桑葚、红色浆果、红醋栗、李子、树莓、植物香气、青椒、桂皮、薄荷、巧克力、焦糖、花香、水煮味、氧化味、酸味、甜味、苦味、涩味。
1.3.8 数据统计分析
利用Excel 2010和DPS V6.55进行数据统计和方差分析,采用新复极差法进行多重比较,结果以“平均值±标准差”形式表示;通过SPSS Statistics 26分析软件进行数据的相关性分析和主成分分析。
2 结果与分析
2.1 对基本理化指标的影响
酒样基本理化指标如表1所示。
表1 储存期间西拉红葡萄酒的基本理化指标
Table 1 Basic physical and chemical indexes of Syrah red wines during storage

储存时间/d酒样还原糖/(g·L-1)酒精体积分数/%总酸/(g·L-1)pH挥发酸/(g·L-1)游离SO2/(mg·L-1)总SO2/(mg·L-1)46CK3.23±0.11b14.58±0.69a3.52±0.06f4.08±0.01a0.45±0.13a 8.08±0.88b34.80±1.75aTA3.71±0.01ab15.24±0.24a6.14±0.01e3.39±0.02e0.42±0.04a6.84±0.88b36.67±0.88aMA3.26±0.09b15.41±0.47a7.19±0.15a3.68±0.02b0.43±0.05a11.81±0.88a35.42±0.88aTA+CA3.80±0.30ab14.58±0.69a6.45±0.08d3.51±0.03d0.35±0.05a8.39±0.44b29.21±0.88bTA+MA3.87±0.35a14.92±1.17a6.98±0.02b3.54±0.02cd0.36±0.01a9.01±1.32b29.83±1.75bTA+MA+CA3.81±0.28ab13.93±0.69a6.74±0.00c3.57±0.03c0.35±0.02a6.84±0.88b36.67±0.88a130CK3.46±0.12b14.38±0.58a3.14±0.13e4.23±0.02a0.90±0.07bc33.90±0.94b323.30±1.41cTA3.76±0.12ab15.21±0.35a5.60±0.05d3.39±0.04d0.80±0.03cd40.54±0.94a382.78±1.87aMA3.74±0.15ab15.29±0.46a6.78±0.05a3.74±0.03b0.98±0.09ab20.94±0.47c321.64±3.76cTA+CA3.69±0.04ab14.88±0.12a6.26±0.08b3.57±0.04c0.71±0.01d40.54±0.94a308.02±1.41dTA+MA3.84±0.14a14.47±0.70a6.60±0.05a3.61±0.01c0.87±0.02bc20.60±2.81c329.95±1.41bTA+MA+CA3.46±0.12b14.55±0.11a5.97±0.08c3.71±0.03b1.07±0.03a30.90±0.47b303.03±0.00e190CK2.09±0.50b13.57±0.34c3.43±0.05e4.04±0.04a0.81±0.07ab40.72±1.01e234.63±1.51cTA3.01±0.06a14.38±0.11ab5.89±0.06d3.35±0.04d0.69±0.00bc60.72±1.01a234.64±0.50cMA3.04±0.03a14.14±0.00b7.11±0.05a3.65±0.04b0.83±0.04a47.86±1.01c241.42±2.02bTA+CA3.01±0.19a14.55±0.12ab6.59±0.02b3.47±0.01c0.61±0.03c43.57±1.00d242.85±2.02bTA+MA2.94±0.14a14.71±0.11a6.64±0.05b3.49±0.02c0.65±0.06c43.57±1.00d247.85±1.01aTA+MA+CA3.02±0.04a14.38±0.11ab6.39±0.05c3.52±0.03c0.72±0.07abc53.57±1.00b240.71±1.01b
注:同一列不同字母表示处理间有显著性差异(P<0.05),所有显著性差异分析仅对同一储存时间内的不同处理(下同)
由于陈酿期间的补硫操作,酒样中游离SO2和总SO2含量变化较大;储存190 d时,酒样理化指标均符合GB/T 15037—2006《葡萄酒》的规定;与对照CK相比,发酵前添加有机酸(后文简称“加酸”),尤其是酒石酸及其混合酸处理,显著提高了总酸和游离SO2含量,降低了酒样pH值和挥发酸含量。较高的挥发酸含量会降低香气的纯正度和优雅度,带来不愉快的感官体验[18]。
2.2 对有机酸分布的影响
发酵结束后,酒样中的主要有机酸为酒石酸(1.89~3.24 g/L)、苹果酸(0.19~4.34 g/L)和琥珀酸(4.07~5.17 g/L),各种有机酸含量的差异主要与发酵前的添加量有关。酒样在储存期间(图1):酒石酸含量下降显著,但是发酵前的添加有效提升了其在酒中的含量;较高的乳酸含量很大程度上与苹果酸-乳酸发酵有关(尤其是CK酒样),这可能与罐储期间游离SO2含量的下降有关;柠檬酸、琥珀酸和乙酸含量的变化较小。这说明,与CK相比,发酵前添加有机酸(尤其是酒石酸及其混合酸)改变了酒样中不同有机酸的比例和分布,在提高总酸含量的同时,有效降低酒样的pH值(表1),这与相关文献的研究结果一致[2]。

a-酒石酸;b-苹果酸;c-柠檬酸;d-乳酸;e-琥珀酸;f-乙酸
图1 储存期间西拉红葡萄酒中有机酸含量的变化
Fig.1 Changes in the concentration of organic acids in Syrah red wines during storage 注:同一储存时间内,柱形图上的不同字母表示处理间有显著性差异(P<0.05)(下同)
2.3 对颜色指标的影响
2.3.1 色度、色调和花色苷种类
如图2所示,储存期间各酒样色度之间的差异不显著,且前期呈下降趋势(图2-a)。色度表示颜色的呈色强度[19],色度降低,表明酒样的颜色变浅。究其原因,这可能与酒样稳定澄清期间聚合色素的沉淀有关。此外,CK和加酸处理酒样的色调之间差异显著,且随时间呈上升趋势,CK的色调始终最高(图2-b)。色调表示酒体颜色的红黄偏向,色调上升,波长520 nm处的吸收作用变弱,具有红色调的花色苷含量降低,表明酒样逐渐失去鲜艳的紫红色,偏向黄色调[19]。储存190 d时,与CK相比,酒石酸及其混合酸处理酒样的色调值较低,表明红色色调突出,加酸处理延缓了酒样颜色由红色向黄色色调的转变。
如图3所示,罐储期间(46 d),酒样中以单体花色苷为主(48.25%~54.50%);随着时间的延长,单体花色苷含量逐步下降,辅色花色苷含量及比例明显增加,加酸处理的聚合花色苷含量上升,而CK的聚合花色苷含量有所下降,各酒样总花色苷含量略有下降,这与红葡萄酒陈酿期间各种花色苷的变化一致[3,20]。储存190 d时,与CK相比,加酸处理显著提升了总花色苷含量(11.42%~40.09%),主要表现为辅色花色苷含量及比例的提升(11.50%~28.74%),TA处理效果最明显。

a-色度;b-色调
图2 储存期间西拉红葡萄酒色度、色调的变化
Fig.2 Changes in color intensity and hue of Syrah red wines during storage
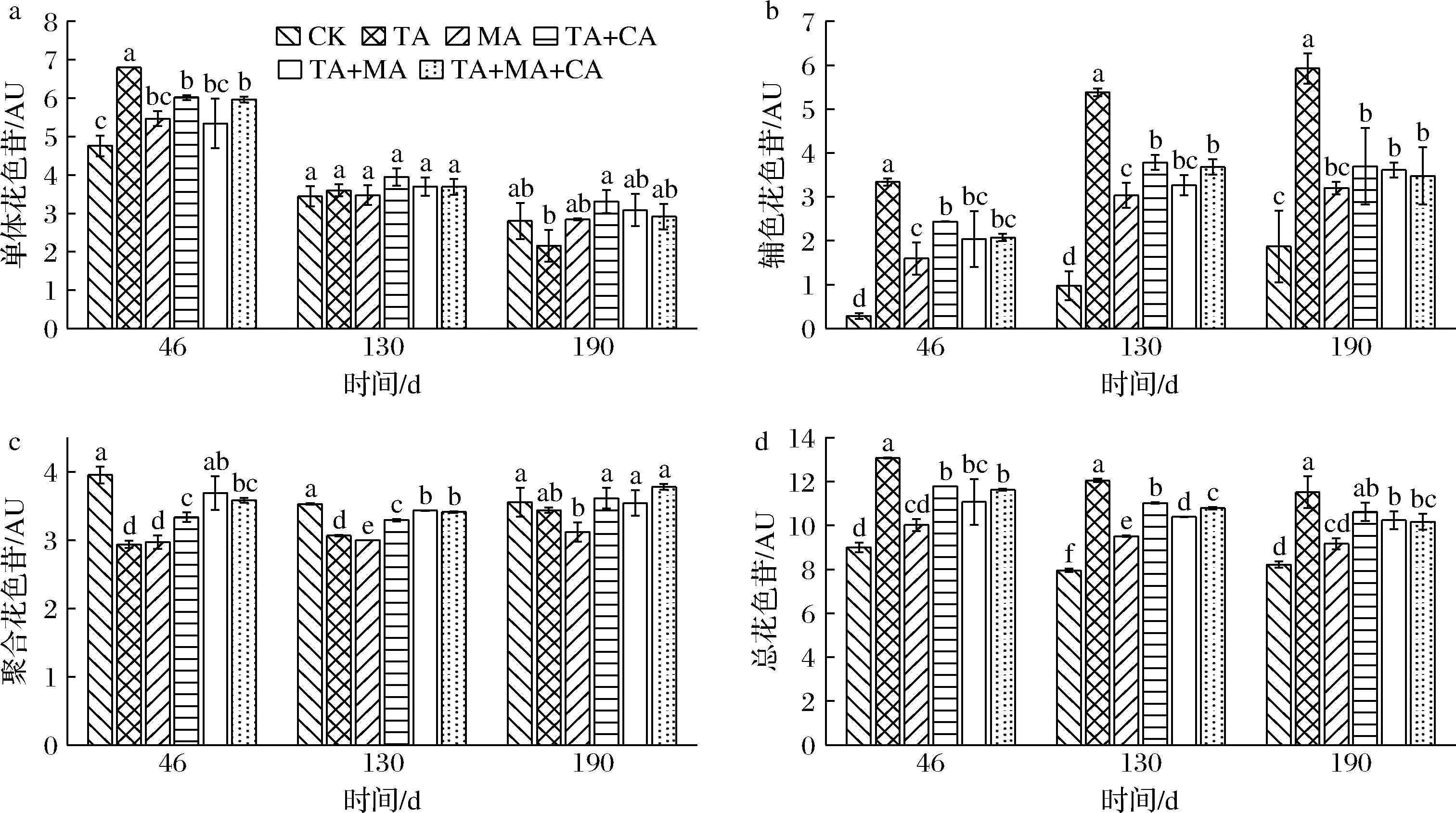
a-单体花色苷;b-辅色花色苷;c-聚合花色苷;d-总花色苷
图3 储存期间西拉红葡萄酒中各种花色苷的变化
Fig.3 Changes of different anthocyanins in Syrah red wines during storage
2.3.2 花色苷成分
从酒样中鉴定并定量检测出9种花色苷成分,包括5种常见花色苷单体、2种乙酰化花色苷和2种对香豆酰化花色苷(表2)。其中,Mv-3-O-Glu含量最多,为120~230 mg/L。
表2 储存期间西拉红葡萄酒中花色苷成分的含量 单位:mg/L
Table 2 Contents of anthocyanin monomers in Syrah red wines during storage

储存时间/d酒样花翠素3-O-葡萄糖苷花青素3-O-葡萄糖苷甲基花翠素3-O-葡萄糖苷甲基花青素3-O-葡萄糖苷二甲花翠素3-O-葡萄糖苷甲基花青素3-O-(6-O-乙酰)葡萄糖苷二甲花翠素3-O-(6-O-乙酰)葡萄糖苷甲基花青素3-O-(6-O-反式对香豆酰)葡萄糖苷二甲花翠素3-O-(6-O-反式对香豆酰)葡萄糖苷花色苷总量46CK3.80±0.93c0.62±0.18ab13.29±3.41b4.74±1.61c205.09±25.92ab8.82±2.56a80.83±19.93a3.53±1.36c15.30±4.67b336.01±60.58abTA10.39±0.08a0.78±0.05a21.60±0.25a13.59±0.76a225.43±8.83a11.31±0.66a91.85±7.21a7.01±0.73a23.07±0.22a404.99±13.99aMA6.89±1.20b0.49±0.16ab17.27±2.67ab8.54±1.89b205.23±17.87ab10.66±2.02a86.85±14.98a5.58±0.85ab19.47±2.41ab360.95±44.02abTA+CA7.18±0.47b0.49±0.06ab16.35±1.32b9.23±0.52b183.74±5.11b9.70±0.45a75.97±2.26a5.14±0.05abc17.50±0.46ab325.28±5.28abTA+MA6.03±0.42b0.45±0.04b14.98±0.58b7.75±0.16b185.96±6.37b7.67±0.24a73.69±3.00a4.17±0.12bc16.19±0.83b316.88±11.50bTA+MA+CA6.17±0.67b0.45±0.10b15.44±2.04b7.81±1.29b185.56±10.44b8.45±0.83a73.47±5.93a4.06±0.78bc15.16±1.94b316.56±24.03b130CK1.51±0.10b0.36±0.01b 7.14±0.11b2.52±0.05c135.28±17.39a4.34±0.34b47.99±6.18a1.93±0.18c9.61±1.73b210.68±25.99b TA5.38±1.53a0.55±0.07a18.06±5.82a10.28±2.62a184.41±27.51a8.56±1.71a71.91±10.76a5.46±1.05a18.36±6.31a322.95±57.40aMA3.05±0.58b0.34±0.00b12.80±0.17ab6.35±0.76b162.14±1.13a7.61±0.11a63.04±0.85a3.70±0.02b14.14±0.06ab273.16±1.36abTA+CA3.72±0.67ab0.41±0.01ab14.35±3.00ab7.58±1.32ab155.94±26.05a7.35±1.87ab60.35±11.82a3.87±0.81b14.02±3.21ab267.58±48.74abTA+MA2.87±0.61b0.49±0.13ab10.34±2.38b5.69±1.29bc139.46±28.64a5.82±1.66ab54.00±15.46a2.87±0.37bc11.25±3.04ab232.76±53.60abTA+MA+CA3.45±0.92ab0.42±0.00ab13.42±1.53ab6.83±1.05ab166.46±12.91a7.32±0.08ab64.20±0.79a3.52±0.53b13.49±1.81ab279.10±19.46ab190CK0.88±0.54c0.39±0.01a 6.35±1.58b3.34±1.85b121.67±23.86a5.05±0.99b47.12±10.13a2.01±0.47c8.65±2.84a195.44±41.19a TA4.88±1.52a0.54±0.20a15.60±5.14a9.57±1.67a160.15±15.92a7.97±1.70a60.76±12.12a4.95±1.25a16.64±6.57a281.02±46.10aMA2.47±0.60bc0.35±0.03a11.06±0.82ab5.65±0.73b142.17±0.35a7.38±0.13ab60.35±2.87a3.82±0.30ab13.06±0.29a246.29±5.37aTA+CA3.22±0.78ab0.49±0.17a11.77±3.60ab6.95±1.45ab132.56±27.82a6.98±1.10ab54.88±6.87a3.78±0.74ab12.23±3.54a232.83±46.08aTA+MA2.43±0.33bc0.37±0.04a9.31±2.04ab4.99±1.36b123.28±24.04a5.34±1.07ab51.43±16.06a2.97±0.58bc10.44±2.27a210.54±47.78aTA+MA+CA2.91±0.89abc0.37±0.01a11.38±1.68ab6.21±1.00ab146.38±10.27a6.64±0.31ab61.21±1.60a3.51±0.15abc12.02±1.24a250.61±13.94a
储存期间,酒样中不同组分的花色苷含量呈下降趋势,与上述单体花色苷含量(图3)的变化一致;与CK相比,加酸处理酒样中不同组分花色苷的含量和总量均更高,尤其TA处理的花色苷单体含量最高。
2.4 对酚类物质含量和抗氧化活性的影响
储存前期,不同酒样的总酚和总类黄酮含量无显著性差异,但随着储存时间延长,各酒样间开始出现差异,其中TA+MA+CA处理显著高于其他酒样(图4-a、图4-b);除MA、TA+CA酒样外,其他酒样中的总黄烷醇含量在陈酿期间显著下降,装瓶后基本趋于稳定(图4-c)。

a-总酚;b-总类黄酮;c-总黄烷醇;d-DPPH自由基清除活性;e-ABTS自由基清除活性
图4 储存期间西拉红葡萄酒酚类物质含量和抗氧化活性的变化
Fig.4 Changes of phenolic compounds and antioxidant activity of Syrah red wines during storage
这可能与陈酿储存期间酚类物质的氧化、聚合反应有关:与其他酚类物质相比,黄烷醇的邻苯二酚或没食子酰基结构使其很容易因氧化而降解[20];有机酸的添加(尤其是混合酸)一定程度上抑制了酚类物质的氧化,起到了抗氧化保护作用。
储存期间,DPPH和ABTS自由基清除活性均呈下降趋势,190 d时,与CK相比,MA和TA+MA+CA处理显著提高了酒样的抗氧化活性(图4-d、图4-e)。
2.5 理化指标之间的相关性分析
理化指标之间的Pearson相关性分析结果如表3所示。酒石酸与pH、色调之间显著负相关(P<0.05),与辅色花色苷、总花色苷之间显著正相关(P<0.05);苹果酸、琥珀酸与总酸之间显著正相关;总酸与色调之间显著负相关,与总花色苷之间显著正相关;pH与色调之间极显著正相关(P<0.01),与辅色花色苷、总花色苷之间极显著负相关(P<0.01)。这说明有机酸的添加有利于降低葡萄酒pH,提高总酸含量,尤其酒石酸的添加显著影响了花色苷的种类和含量,改善了葡萄酒的颜色,这与2.3分析结果一致。
表3 储存期间西拉红葡萄酒中理化指标之间的Pearson相关系数
Table 3 Pearson correlation coefficients between physical and chemical indexes in Syrah red wines during storage

指标酒石酸苹果酸琥珀酸总酸pH色度色调辅色花色苷单体花色苷聚合花色苷总花色苷总酚总类黄酮总黄烷醇DPPH自由基清除活性ABTS阳离子自由基清除活性总SO2游离SO2酒石酸1苹果酸-0.218 1琥珀酸 0.228 0.606∗∗1总酸 0.141 0.854∗∗ 0.743∗∗1pH-0.571∗-0.382-0.596∗∗-0.763∗∗1色度0.118-0.080-0.2680.023 0.0471色调-0.680∗∗-0.267-0.367-0.570∗ 0.653∗∗-0.600∗∗1辅色花色苷 0.500∗ 0.135 0.448 0.403-0.763∗∗-0.613∗∗-0.1511单体花色苷 0.379 0.082-0.093 0.201-0.122 0.908∗∗-0.789∗∗-0.4241聚合花色苷-0.345-0.455-0.316-0.392 0.313 0.158 0.325-0.334-0.1891总花色苷 0.819∗∗ 0.123 0.307 0.533∗-0.848∗∗ 0.288-0.863∗∗ 0.553∗ 0.500∗-0.3171
续表3
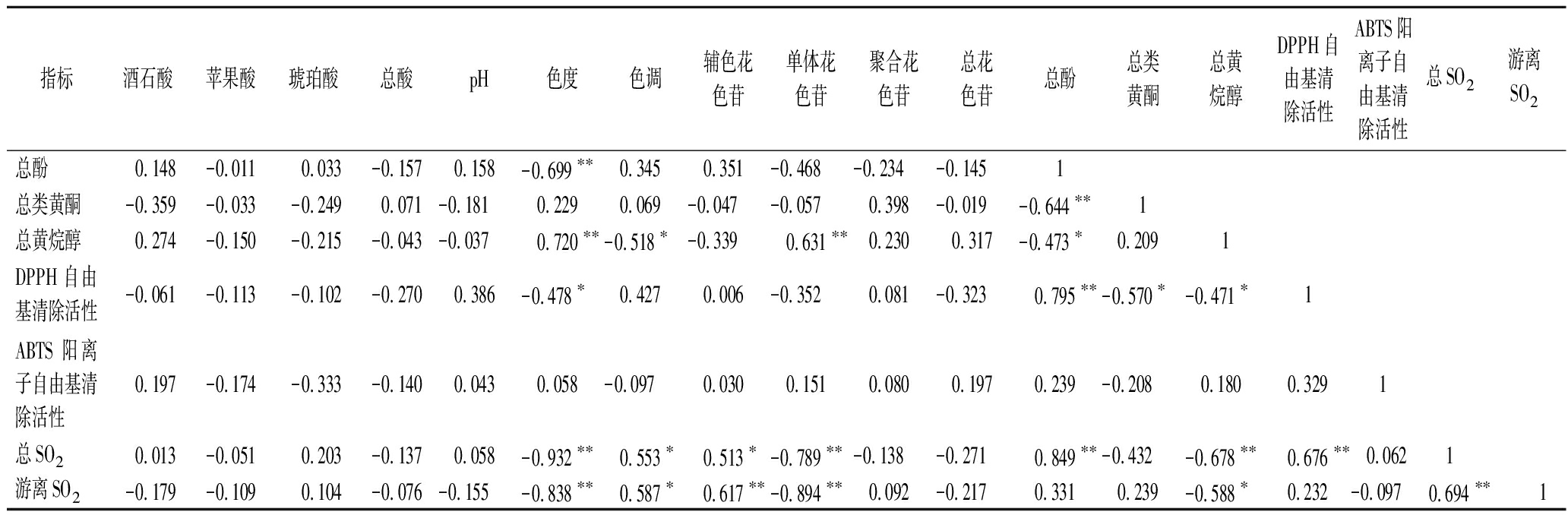
指标酒石酸苹果酸琥珀酸总酸pH色度色调辅色花色苷单体花色苷聚合花色苷总花色苷总酚总类黄酮总黄烷醇DPPH自由基清除活性ABTS阳离子自由基清除活性总SO2游离SO2总酚 0.148-0.011 0.033-0.157 0.158-0.699∗∗ 0.345 0.351-0.468-0.234-0.1451总类黄酮-0.359-0.033-0.249 0.071-0.181 0.229 0.069-0.047-0.057 0.398-0.019-0.644∗∗1总黄烷醇 0.274-0.150-0.215-0.043-0.037 0.720∗∗-0.518∗-0.339 0.631∗∗ 0.230 0.317-0.473∗ 0.2091DPPH自由基清除活性-0.061-0.113-0.102-0.270 0.386-0.478∗ 0.427 0.006-0.352 0.081-0.323 0.795∗∗-0.570∗-0.471∗1ABTS阳离子自由基清除活性 0.197-0.174-0.333-0.140 0.043 0.058-0.097 0.030 0.151 0.080 0.197 0.239-0.208 0.180 0.3291总SO2 0.013-0.051 0.203-0.137 0.058-0.932∗∗ 0.553∗ 0.513∗-0.789∗∗-0.138-0.271 0.849∗∗-0.432-0.678∗∗ 0.676∗∗ 0.0621游离SO2-0.179-0.109 0.104-0.076-0.155-0.838∗∗ 0.587∗ 0.617∗∗-0.894∗∗ 0.092-0.217 0.331 0.239-0.588∗ 0.232-0.097 0.694∗∗1
注:*代表显著相关(P<0.05),**代表极显著相关(P<0.01)
色度与色调、辅色花色苷、总酚、DPPH自由基清除活性之间显著负相关,与单体花色苷、总黄烷醇之间极显著正相关;色调与单体花色苷、总花色苷、总黄烷醇之间显著负相关;辅色花色苷与总花色苷之间显著正相关;单体花色苷与总花色苷和总黄烷醇之间显著正相关。这说明不同颜色指标、颜色指标与酚类物质之间存在密切联系;酒样储存期间,单体花色苷逐渐转化为辅色花色苷或与酚类物质反应生成聚合花色苷,并随着色素聚合度的不断增加可能产生沉淀或降解,致使总花色苷含量降低[21]。
此外,总SO2、游离SO2与色度、单体花色苷、总黄烷醇之间显著负相关,与色调、辅色花色苷之间显著正相关,总SO2还与总酚、DPPH自由基清除活性之间极显著正相关。这表明储存期间,酒样的颜色指标、酚类物质和抗氧化活性变化与SO2具有密切关系,相关指标的变化可能与储存期间葡萄酒的氧化反应有关。
2.6 对感官质量的影响
感官评分结果显示,储存期间,各酒样外观、香气、口感和总体评价得分均有上升;190 d时,TA、MA和TA+MA+CA总得分等级为“很好”(80~84分),其余酒样为“好”(70~79分),其中TA+MA+CA总分最高,CK总分最低(表4)。
表4 储存190 d时西拉红葡萄酒的感官评分
Table 4 Sensory scores of Syrah red wines after 190 days of storage

酒样外观(15分)香气(30分)口感(44分)平衡度(11分)总分CK12.17±2.29a23.92±2.71a32.92±4.10a8.75±1.06a77.75±8.96aTA12.75±2.05a24.17±2.66a34.08±2.27a8.75±1.71a79.75±6.54aMA12.08±1.93a24.50±2.84a34.58±2.94a9.42±0.67a80.58±6.61aTA+CA12.08±1.88a24.00±2.04a33.33±2.93a9.50±0.67a78.92±6.10aTA+MA12.00±2.70a23.25±3.14a33.58±4.74a9.17±1.03a78.00±10.36aTA+MA+CA12.25±1.96a23.92±1.83a35.42±2.47a9.58±0.67a81.17±5.59a
注:评分标准—完美:85~100;很好:80~84;好:70~79;一般:50~69;不好:<50[18]
为更直观地展示各酒样香气之间的区别与联系,对储存190 d时各酒样香气特性强度进行主成分分析,结果如图5所示。前2个主成分F1(50.46%)和F2(26.17%)可以解释感官香气属性总变异量的76.63%,解释度较高;不同酒样间存在显著差异:TA、MA、TA+CA和TA+MA处理中的品种香气(红色水果、黑色水果、薄荷)更为突出;而CK以陈酿香气(巧克力)为主,并带有一定的氧化味和水煮味;TA+MA+CA的香气特征不太明显。

图5 储存190 d时西拉红葡萄酒的香气描述词主成分分析
Fig.5 Principal component analysis of aroma descriptors of Syrah red wines after 190 days of storage
3 讨论与结论
本试验结果表明,发酵前添加有机酸对西拉红葡萄酒的颜色和感官质量具有显著影响。与CK相比,加酸处理酒样的色调更低,显著影响了花色苷种类及分布,主要表现为辅色花色苷含量及比例的提升和总花色苷含量的增加。相关性分析的结果也表明不同有机酸作用不同,尤其酒石酸对降低酒样pH、改善颜色等具有显著作用,有机酸添加对西拉红葡萄酒质量的影响是多个指标共同作用的结果。感官评价结果显示,加酸处理酒样的品种香气更为突出。红葡萄酒陈酿期间,外观和香气变化出现的先后顺序仍存在争议,但大部分研究发现颜色改变的同时香气也会发生变化[22]。
红葡萄酒陈酿储存期间,颜色除了与花色苷的种类和含量密切相关,还与花色苷辅色效应、聚合作用、氧化反应等机制有着密切关系[9,14,23-24]。尤应注意的是,发酵前添加有机酸显著降低了葡萄酒pH。pH是影响辅色作用的关键因素之一,辅色效应的最佳pH为3~5,当pH值在3.0左右时,辅色效应最强,随着pH值升高,更多花色苷转变为无色的甲醇假碱形态,辅色效应减弱;而辅色效应产生的辅色花色苷可能是陈酿期间聚合花色苷形成的前体[2,24]。另外,在pH 3~4时,花色苷的溶解度随着pH的增加而降低,较低的pH有利于花色苷红色黄 盐阳离子结构的存在[24-25]。本研究中CK比加酸处理酒样的聚合花色苷含量更高,辅色花色苷含量更低,且色调更高,说明发酵前添加有机酸可能减缓了颜色的演变进程。
盐阳离子结构的存在[24-25]。本研究中CK比加酸处理酒样的聚合花色苷含量更高,辅色花色苷含量更低,且色调更高,说明发酵前添加有机酸可能减缓了颜色的演变进程。
除此之外,储存期间葡萄酒颜色的演变还与氧化作用有关。众所周知,O2不能与葡萄酒中的酚类物质直接反应,需要过渡金属离子(特别是铁离子)的参与[20,22]。葡萄酒中的铁离子主要以络合态存在,而含量丰富、具有羧酸结构的有机酸是很好的铁离子配体;与乳酸和琥珀酸相比,酒石酸、苹果酸和柠檬酸与Fe3+的络合性较强,通过形成稳定的络合物抑制铁离子氧化具有邻羟基酚结构的物质,从而提高酚类物质和花色苷的稳定性[26-27](红葡萄酒中大部分花色苷及其衍生物为邻羟基酚结构[22,28])。同样,pH变化和有机酸种类还会影响铁离子与有机酸络合物的溶解性和稳定性[27]。另外,较低的pH值有利于提高分子态SO2在游离SO2中的比例;游离SO2则可通过与Fenton反应的中间产物H2O2或者酚类氧化产物醌反应[22],减少活性氧物质(如H2O2、HO2-、·OH)对葡萄酒多种物质的氧化[20,29],发挥其在葡萄酒中的抗氧化作用。
因此,发酵前添加有机酸改善了陈酿储存期间红葡萄酒的颜色和感官质量,其主要是通过调整有机酸比例分布、降低pH值等综合作用的结果。其中,酒石酸及其混合酸处理的酒样效果相对更好,研究结果为西部产区实际生产实践中调酸处理提供新思路,为解决西部产区红葡萄酒颜色不稳定、老化过快问题提供参考。
[1] FANZONEM, GONZ LEZ-MANZANO S, PÉREZ-ALONSO J, et al.Evaluation of dihydroquercetin-3-O-glucoside from malbec grapes as copigment of malvidin-3-O-glucoside[J].Food Chemistry, 2015, 175:166-173.
LEZ-MANZANO S, PÉREZ-ALONSO J, et al.Evaluation of dihydroquercetin-3-O-glucoside from malbec grapes as copigment of malvidin-3-O-glucoside[J].Food Chemistry, 2015, 175:166-173.
[2] COMUZZOP, BATTISTUTTA F.Acidification and pH Control in Red Wines[M]//Red Wine Technology.Amsterdam:Elsevier, 2019:17-34.
[3] ESCRIBANO-BAIL NM T, RIVAS-GONZALO J C, GARC
NM T, RIVAS-GONZALO J C, GARC A-ESTÉVEZ I.Wine Color Evolution and Stability[M]//Red Wine Technology.Amsterdam:Elsevier, 2019:195-205.
A-ESTÉVEZ I.Wine Color Evolution and Stability[M]//Red Wine Technology.Amsterdam:Elsevier, 2019:195-205.
[4] 张波,韩舜愈,马腾臻, 等.红葡萄酒中花色苷衍生物结构研究进展[J].食品科学, 2018, 39(5):284-295.
ZHANG B, HAN S Y, MA T Z, et al.Progress in understanding structures of anthocyanins derivatives in red wines[J].Food Science, 2018, 39(5):284-295.
[5] 李伟,席晓敏, 李辉, 等.贺兰山东麓赤霞珠干红葡萄酒陈酿过程中颜色变化研究[J].食品科学技术学报, 2020, 38(2):41-47.
LI W, XI X M, LI H, et al.Determination of color change during aging of Cabernet Sauvignon in eastern foothill of Helan mountain[J].Journal of Food Science and Technology, 2020, 38(2):41-47.
[6] 王晶,万智博, 许超丽, 等.新疆产区酿酒葡萄果实中有机酸的比较分析[J].现代食品科技, 2020, 36(2):249-254;69.
WANG J, WAN Z B, XU C L, et al.Comparative analysis of organic acids in wine grape fruits from Xinjiang[J].Modern Food Science and Technology, 2020, 36(2):249-254;69.
[7] 赵悦,韩宁, 孙玉霞, 等.不同产地酿酒葡萄“赤霞珠”果实中有机酸差异性研究[J].食品工业科技, 2016, 37(1):297-301.
ZHAO Y, HAN N, SUN Y X, et al.Difference of organic acids in ripen berry of wine grape(Cabernet Sauvignon) among production regions[J].Science and Technology of Food Industry, 2016, 37(1):297-301.
[8] 杨春霞,刘元柏, 葛谦.贺兰山东麓酿酒葡萄中有机酸含量分析[J].食品科技, 2016, 41(11):244-247.
YANG C X, LIU Y B, GE Q.Analysis of organic acid contents in wine grapes in eastern Helan Mountain[J].Food Science and Technology, 2016, 41(11):244-247.
[9] FORINOM, PICARIELLO L, RINALDI A, et al.How must pH affects the level of red wine phenols[J].LWT, 2020, 129:109546.
[10] WALKERT, MORRIS J, THRELFALL R, et al.Quality, sensory and cost comparison for pH reduction of Syrah wine using ion exchange or tartaric acid[J].Journal of Food Quality, 2004, 27(6):483-496.
[11] PICARIELLOL, RINALDI A, MARTINO F, et al.Modification of the organic acid profile of grapes due to climate changes alters the stability of red wine phenolics during controlled oxidation[J].Vitis,2019, 58(5):127-133.
[12] GRANT-PREECE P, BARRIL C, SCHMIDTKE L M, et al.Impact of fluorescent lighting on the browning potential of model wine solutions containing organic acids and iron[J].Food Chemistry, 2018, 243:239-248.
[13] CLIFFM A, KING M C, SCHLOSSER J.Anthocyanin, phenolic composition, colour measurement and sensory analysis of BC commercial red wines[J].Food Research International, 2007, 40(1):92-100.
[14] LANH J, LI S, YANG J, et al.Effects of light exposure on chemical and sensory properties of storing Meili Rosé wine in colored bottles[J].Food Chemistry, 2021, 345:128854.
[15] YANGP, YUAN C L, WANG H, et al.Stability of anthocyanins and their degradation products from cabernet sauvignon red wine under gastrointestinal pH and temperature conditions[J].Molecules (Basel, Switzerland), 2018, 23(2):354.
[16] LIH, WANG X Y, LI Y, et al.Polyphenolic compounds and antioxidant properties of selected China wines[J].Food Chemistry, 2009, 112(2):454-460.
[17] 杨洁,郭少鹏, 李金梁, 等.基于品评小组可靠性筛选葡萄酒的香气描述符[J].食品科学, 2021, 42(19):106-113.
YANG J, GUO S P, LI J L, et al.Screening for wine aromatic descriptors based on reliability evaluation of sensory panel[J].Food Science, 2021, 42(19):106-113.
[18] 李华.葡萄酒品尝学[M].北京:科学出版社, 2006.
LI H.Wine Tasting[M].Beijing:Science Press, 2006.
[19] CHIRAK, JOURDES M, TEISSEDRE P L.Cabernet sauvignon red wine astringency quality control by tannin characterization and polymerization during storage[J].European Food Research and Technology, 2012, 234(2):253-261.
[20] LIS Y, DUAN C Q.Astringency, bitterness and color changes in dry red wines before and during oak barrel aging:An updated phenolic perspective review[J].Critical Reviews in Food Science and Nutrition, 2019, 59(12):1 840-1 867.
[21] GIUFFRIDADE ESTEBANA M L, UBEDA C, HEREDIA F J, et al.Impact of closure type and storage temperature on chemical and sensory composition of Malbec wines (Mendoza, Argentina) during aging in bottle[J].Food Research International (Ottawa,Ont), 2019, 125:108553.
[22] ECHAVEJ, BARRAL M, FRAGA-CORRAL M, et al.Bottle aging and storage of wines:A review[J].Molecules (Basel,Switzerland), 2021, 26(3):713.
[23] HERAS-ROGERJ, ALONSO-ALONSO O, GALLO-MONTESDEOCA A, et al.Influence of copigmentation and phenolic composition on wine color[J].Journal of Food Science and Technology-Mysore, 2016, 53(6):2 540-2 547.
[24] 赵旭,张欣珂, 陈新军, 等.葡萄酒中的酚类物质Ⅱ:辅色效应与生物活性研究进展[J].食品科学, 2019, 40(17):284-294.
ZHAO X, ZHANG X K, CHEN X J, et al.Phenolics in wines II:Progress in research on copigmentation and bioactivities[J].Food Science, 2019, 40(17):284-294.
[25] FORINOM, GAMBUTI A, LUCIANO P, et al.Malvidin-3-O-glucoside chemical behavior in the wine pH range[J].Journal of Agricultural and Food Chemistry, 2019, 67(4):1 222-1 229.
[26] DANILEWICZJ C.Role of tartaric and malic acids in wine oxidation[J].Journal of Agricultural and Food Chemistry, 2014, 62(22):5 149-5 155.
[27] 李金梁,彭晶晶, 杨洁, 等.串联双柱固相萃取-原子吸收光谱法检测葡萄酒中Fe、Cu和Mn的形态[J].现代食品科技, 2021, 37(11):338-347.
LI J L, PENG J J, YANG J, et al.Determination of iron, copper and manganese fractionation in wine by tandem solid phase extraction and atomic absorption spectroscopy[J].Modern Food Science and Technology, 2021, 37(11):338-347.
[28] ZHANGZ W, LI J Y, FAN L P, et al.Effect of organic acid on cyanidin-3-O-glucoside oxidation mediated by iron in model Chinese bayberry wine[J].Food Chemistry, 2020, 310:125980.
[29] SATAKER, YANASE E.Mechanistic studies of hydrogen-peroxide-mediated anthocyanin oxidation[J].Tetrahedron, 2018, 74(42):6 187-6 191.