在食品加工和运输过程中,由于受到外界环境的影响,食品极易发生氧化褐变与腐败变质。食品一旦被氧化,就会产生酸败与褐变等现象,严重影响感官和品质。因此,食品工业上常通过添加抗氧化剂提高食品的稳定性。同时,由于食品中含有丰富的营养成分,环境中的微生物在适宜条件下迅速繁殖,造成食品腐败变质,甚至引起食物中毒。因而添加防腐剂防止食品腐败是最有效的措施。目前,食品防腐剂与抗氧化剂是食品工业不可或缺的食品添加剂,但大多为化学合成物质,远远不能满足消费者对食品安全的要求,因此,寻找天然无害的抗氧化剂和食品防腐剂迫在眉睫。
细菌素是微生物核糖体产生的一种抗菌多肽类物质,大多数细菌素对许多腐败菌和致病菌都有很强的抑制作用,作为一种天然无害的生物源食品防腐剂已被逐渐应用于食品行业[1]。前期研究发现,耐久肠球菌ML-72产的细菌素QY-C能抑制多种食源性致病菌和腐败菌,能在食品中起到防腐保鲜作用,是化学防腐剂的优良替代物[2]。但是细菌素在防腐应用时易与食品体系中的脂肪、蛋白质等复杂成分相互作用,影响其防腐效果。另外,虾青素是天然强氧化剂,有“超级维生素E”的称号,它能有效避免细胞因自由基引起的氧化反应所带来的伤害。但是虾青素结构中的长链不饱和双键和α-羟基酮电子效应非常活泼[3-4],极易在不利的环境因素(高温、光照、氧气、环境pH等)下降解[5],影响其抗氧化活性。同时,虾青素不溶于水,其生物利用率较低,无法很好地在食品中发挥其抗氧化能力[6]。
纳米脂质体是一种油包水结构的纳米双层囊泡,其高度有序的结构能够将虾青素与细菌素QY-C分别包埋在脂层与水层中,且互不影响[7-9],对两种物质的活性均起到很好的保护作用,从而提高活性物质的有效利用。为了维持纳米脂质体的稳定性,常使用具有潜在健康危害的胆固醇作为稳定剂,最新的研究发现虾青素也可作为纳米脂质体的稳定剂,提高纳米脂质体稳定性[10],进而提高了脂质体的安全性。
本研究采用纳米脂质体技术制备细菌素QY-C与虾青素复合纳米脂质体,并从包封率、表征、抑菌能力与抗氧化性方面进行评价,为细菌素QY-C与虾青素复合纳米脂质体的制备和应用提供依据,以期制备一种新型的食品防腐保鲜添加剂,为食品安全提供新的解决方案。
1 材料与方法
1.1 材料
1.1.1 实验菌株
耐久肠球菌ML-72(GenBank:JX258806.1),CAMT团队分离自中国南海海域牡蛎,用于生产细菌素QY-C;单增李斯特菌(ATCC 19111T),用作指示菌。
1.1.2 实验试剂
营养肉汤(nutrient broth,NB)、营养琼脂(nutrient agar,NA)、MRS肉汤培养基,北京陆桥技术股份有限公司;二氯甲烷、乙酸乙酯、无水乙醇,佛山西陇化工有限公司;大豆卵磷脂、BCA试剂盒,生工生物工程(上海股份有限公司);虾青素,北京索莱宝科技有限公司;细菌素QY-C,实验室制备;ABTS、DPPH,上海麦克林生化科技有限公司;过硫酸钾,上海阿拉丁生化科技有限公司;磷酸二氢钠、硫酸氢二钠,广东光华科技股份有限公司。
1.1.3 仪器与设备
ZETASIZER NANO ZSE纳米粒度电位仪,英国马尔文仪器有限公司;N-1100V-WB旋转蒸发仪,上海爱朗仪器有限公司;TGL-20MW台式高速冷冻离心机,湖南赫西仪器装备有限公司;Varioskan Flash全自动酶标仪,美国赛默飞世尔科技公司;FDU-1110冷冻干燥机,EYELA东京理化器械株式会社;SGW-1傅立叶红外光谱仪(Fourier transform infrared spectroscopy,FT-IR),上海上天精密仪器有限公司;DC-12氮吹仪, 上海安谱实验科技股份有限公司;SilentCrus均质机, 德国海道尔夫公司;QS-8510DTH超声波清洗器, 上海生析超声仪器有限公司;LDZX-50KBS高压蒸汽灭菌锅, 上海申安医疗器械厂;SW-CJ-1F超净工作台, 苏州净化设备有限公司。
1.2 实验方法
1.2.1 细菌素QY-C的制备
将甘油保存的菌株ML-72接种于灭菌的NB培养基,于32 ℃恒温摇床150 r/min培养14 h活化,连续活化2代,接种(3%,体积分数)于灭菌的MRS液体培养基中,32 ℃ 150 r/min培养48 h。将ML-72的发酵液在4 ℃条件下8 000 r/min离心10 min,收集上清液。
将发酵上清液与等体积乙酸乙酯混合,置于摇床120 r/min萃取12 h,收集上层乙酸乙酯,下层水相再用等体积的乙酸乙酯萃取2次。收集有机相,混合,使用旋转蒸发器除去乙酸乙酯,加入超纯水重新溶解,真空冷冻干燥后,产物即为细菌素QY-C,于-20 ℃保存备用。
1.2.2 空白纳米脂质体的制备
用反相蒸发法制备纳米脂质体体系[11]。避光环境下,精确称取130 mg的大豆卵磷脂置于50 mL铝箔密封的锥形瓶中,加入10 mL二氯甲烷,超声至固体完全溶解。将锥形瓶转移至均质机,冰水浴条件下提高转速至10 000 r/min,往溶液中缓慢加入2.5 mL超纯水。完全加入后,10 000 r/min均质5 min,得到均匀不分层的乳白色油包水(water/oil,W/O)乳液。转至棕色圆底烧瓶中,旋转蒸发(30 ℃,0.1 MPa)除去二氯甲烷,至烧瓶底部形成一层高黏性凝胶,然后加入2.5 mL超纯水于烧瓶中,超声处理至凝胶完全脱落。有机凝胶完全悬于水中后,反复超声(37 kHz)缩小粒径[12],开1 min,停1 min,重复进行10次。接着,使用纳米脂质体挤出器过200 nm聚碳酸酯膜,来回共11次,得空白纳米脂质体。
1.2.3 虾青素最佳添加量的确定
避光环境下,称取1 mg虾青素于20 mL棕色瓶,加入10 mL乙酸乙酯,振荡至完全溶解,制得100 μg/mL虾青素溶液,再用乙酸乙酯依次进行10倍稀释,质量浓度梯度分别为100、10、1.0、0.1 μg/mL,使用全自动酶标仪在475 nm处测定吸光值。用Origin软件对数据进行线性拟合,建立虾青素浓度-吸光值标准曲线的回归方程(R2=0.999),如公式(1)所示:
Y=0.097 72+0.057 61X
(1)
式中:X,虾青素质量浓度,μg/mL;Y,475 nm处的吸光值。
同1.2.2方法,分别在称取大豆卵磷脂的同时加入虾青素0.5、1.0、1.5、2.0、2.5 mg,制备不同虾青素添加量的虾青素脂质体。制得的脂质体悬液以8 000 r/min、4 ℃离心10 min,收集上层清液,加入等体积的乙酸乙酯,经涡旋振荡后萃取30 min,收集上层乙酸乙酯,并加入等体积乙酸乙酯再次萃取。收集的乙酸乙酯混合,使用全自动酶标仪在475 nm处测定吸光值,结合公式(1)计算未被负载的游离虾青素,根据公式(2)计算得虾青素纳米脂质体的包封率:
虾青素包封率![]()
(2)
其中将包封率最高的虾青素纳米脂质的添加量作为复合纳米脂质体虾青素的最佳添加量,并将包封率最高的虾青素纳米脂质样品保存至4 ℃冰箱,以备后续作为各种指标测定的对照。
1.2.4 细菌素QY-C最佳添加量的确定
用超纯水将细菌素QY-C梯度稀释,采用改良型BCA法测定蛋白浓度,用全自动酶标仪在562 nm处测定吸光度值,用Origin软件对数据进行线性拟合,建立细菌素QY-C浓度-吸光值标准曲线的回归方程(R2=0.998),如公式(3)所示:
Y=2.79×10-4 X+0.099
(3)
式中:X,细菌素QY-C质量浓度,μg/mL;Y,562 nm处的吸光值。
同1.2.2方法,但用2.5 mL的QY-C细菌素不同质量浓度(40、60、80、100 mg/mL)水溶液替代超纯水进行均质,制备不同细菌素浓度的QY-C纳米脂质体。制得的脂质体悬液以8 000 r/min、4 ℃离心10 min,收集上层清液,采用改良型BCA法测定游离的细菌素浓度,用全自动酶标仪在562 nm处测定吸光度值,结合公式(3)计算细菌素QY-C的量,根据公式(4)计算得细菌素QY-C纳米脂质体的包封率:
细菌素QY-C包封率![]()
(4)
其中将包封率最高的细菌素QY-C纳米脂质体的添加量作为复合脂质体细菌素的最佳添加量,并将包封率最高的细菌素纳米脂质体样品保存至4 ℃冰箱,以备后续作为各种指标测定的对照。
1.2.5 复合纳米脂质体的制备
将测得的包封率最高的虾青素添加量和细菌素QY-C添加量,按1.2.2方法制备细菌素QY-C与虾青素复合纳米脂质体。
1.2.6 复合纳米脂质体的粒径、多分散指数(polydispersity index,PDI)值及Zeta电位测量
采用马尔文ZETASIZER NANO Series测量纳米脂质体的粒径、PDI值和Zeta电位。制备好的纳米脂质体悬液用超纯水稀释(1%,体积分数)后,用动态光散射法(dynamic light scattering,DLS)测定平均粒径和PDI,用激光多普勒微电泳法测定Zeta电位,25 ℃检测3次。
1.2.7 复合纳米脂质体的FT-IR分析
将所有的纳米脂质体冻干,冻干后的纳米脂质体、大豆卵磷脂、虾青素、细菌素QY-C与溴化钾粉末分别混合,压制成薄片,使用FT-IR扫描4 000~400 cm-1的光谱信息。
1.2.8 复合纳米脂质体的抑菌活性评价
采用二倍稀释法测试复合纳米脂质体的最小抑菌浓度(minimal inhibitory concentration,MIC)。称取35 mg冻干后的复合脂质体,加入1 mL PBS缓冲液(pH=7),超声重悬得质量浓度为35 mg/mL的脂质体悬液。然后二倍稀释得质量浓度为17.5、8.75、4.375 mg/mL的脂质体悬液,室温下放置2 h。用生理盐水调节指示菌菌液至OD600=0.26,以1.5%(体积分数)的接种量加入到NA中,倾注冷凝得检测平板。每孔200 μL将纳米脂质体悬液加入到用牛津杯预制的孔中,4 ℃下扩散2 h,37 ℃培养16 h,记录抑菌圈大小,并计算效价[13]。
1.2.9 复合纳米脂质体的抗氧化活性评价
1.2.9.1 DPPH自由基清除能力的测定
在避光条件下,配制1.25 mmol/L的DPPH乙醇溶液,将复合纳米脂质体悬液与DPPH乙醇溶液等体积混合,室温避光反应1 h后,12 000 r/min离心3 min,收集上清液,用全自动酶标仪在325 nm处[14-15]测定上清液的吸光值;用等体积超纯水代替复合纳米脂质体,同样的操作测定吸光值,用作空白对照;用等体积乙醇代替DPPH乙醇溶液,加入复合纳米脂质体悬液,同样操作测定吸光值。
用相同体积的空白纳米脂质体悬液代替复合纳米脂质体悬液进行重复测定,并与复合纳米脂质体进行DPPH自由基清除率的比较,DPPH自由基清除率按公式(5)进行计算:
DPPH自由基清除率![]()
(5)
式中:A0、A1、A2分别是在325 nm处超纯水-DPPH乙醇溶液、复合纳米脂质体上清液-DPPH乙醇溶液、复合纳米脂质体上清液-乙醇溶液的吸光值。
1.2.9.2 ABTS阳离子自由基清除能力的测定
在避光条件下,配制7 mmol/L ABTS水溶液和140 mmol/L过硫酸钾水溶液。取5 mL ABTS溶液与88 μL过硫酸钾溶液混合于4 ℃避光反应,并静置12 h,作为ABTS储存液。ABTS储存液使用前加入无水乙醇稀释,使其在734 nm处的吸光值为0.80±0.02,即为ABTS工作液。将复合纳米脂质体悬液与ABTS工作液等体积混合,室温避光反应1 h后,12 000 r/min离心3 min,收集上清液,用全自动酶标仪在734 nm处测定上清液的吸光值;用等体积超纯水代替复合纳米脂质体悬液,同样的操作测定吸光值,用作空白对照;用等体积乙醇代替ABTS溶液,加入复合纳米脂质体悬液,同样操作测定吸光值。
用相同体积的空白纳米脂质体悬液代替复合纳米脂质体悬液进行重复测定,并与复合纳米脂质体进行ABTS阳离子自由基清除率的比较,ABTS阳离子自由基清除率按公式(6)进行计算:
ABTS阳离子自由基清除率![]()
(6)
式中:A3、A4、A5分别是在734 nm处超纯水-ABTS乙醇溶液、复合纳米脂质体上清液-ABTS乙醇溶液、复合纳米脂质体上清液-乙醇溶液的吸光值。
1.3 数据处理及统计分析
使用SPSS 22对数据进行显著性分析(P<0.05),Zetasizer Software进行粒径绘图,Origin 9.65进行线性拟合及作图。
2 结果与分析
2.1 虾青素纳米脂体化最佳添加量
根据在475 nm处测得的吸光值,并结合公式(1)、公式(2)计算,虾青素的添加量为1、1.5、2、2.5 mg时,包封率分别为98.53%、99.40%、99.67%、98.77%。由图1可知,4个添加量的包封率均高于98%,其中虾青素添加量为2 mg时,包封率最高(99.67%),与1 mg和2.5 mg的包封率存在显著性差异,但1.5 mg与2 mg的包封率无显著性差异,因此2 mg虾青素作为复合纳米脂质的最佳添加量。

图1 不同添加量下虾青素纳米脂质体的包封率
Fig.1 The encapsulation efficiency of astaxanthin nanoliposomes under different astaxanthin dosages
注:不同字母表示差异显著(P<0.05)(下同)
2.2 细菌素QY-C纳米脂体最佳添加量
根据在562 nm处测得的吸光值,并结合公式(3)、公式(4)计算,细菌素QY-C的质量浓度为40、60、80、100 mg/mL时,包封率分别80.05%、87.79%、89.43%、88.17%。由图2可知,4个质量浓度的包封率均高于80%,其中质量浓度为80 mg/mL时,包封率最高(89.43%),并与质量浓度为40、60、100 mg/mL的包封率存在显著性差异,因此选择80 mg/mL作为细菌素QY-C最佳添加量。

图2 不同用量下细菌素QY-C纳米脂质体的包封率
Fig.2 The encapsulation efficiency of bacteriocin QY-C nanoliposomes under different bacteriocin dosages
2.3 纳米脂质体的粒径、PDI值和Zeta电位
粒径是指纳米脂质体的平均直径,3个样品的粒径均<200 nm(表1),其中细菌素QY-C与虾青素复合纳米脂质体的粒径为158.03 nm,比细菌素QY-C纳米脂质体大22.55 nm,但比虾青素纳米脂质体小14.94 nm,原因是细菌素QY-C所带的正电荷与磷脂基团表面的负电荷之间的相互作用使纳米脂质体内外层具有结合吸引力,使粒径缩小,小的粒径有利于将活性物质更好的运输到食品体系中的各处,并提高纳米脂质体的利用率[16]。Zeta电位是测定纳米脂质体稳定趋势的重要物理参数,电位值越大,纳米脂质体之间的斥力也会越大,可以防止纳米脂质体之间的聚集[17],稳定性的分界线一般认为Zeta电位绝对值>30 mV,纳米脂质体体系是稳定的[18],细菌素QY-C与虾青素复合纳米脂质体的Zeta电位绝对值>30 mV,说明复合纳米体系具有良好的稳定性,可以在食品的复杂成分中保持稳定。PDI值反映的是纳米脂质体分散的均匀程度,PDI值越大,分子质量分布越宽;PDI值越小,分子质量分布越均匀,通常PDI<0.3,代表着体系具有良好的分散均匀性[19],本研究制备的细菌素QY-C纳米脂质体符合要求,而制备的细菌素QY-C与虾青素复合纳米脂质体的PDI值略大于0.3。但综合评价3个指标,采用反相蒸发法制备的菌素QY-C与虾青素复合纳米脂质体能够稳定其生物活性。PINILLA等[20]用磷脂酰胆碱制备了Nisin-大蒜提取物复合纳米脂质体,粒径为179.2 nm,PDI值为0.15,Zeta电位为-27.7 mV,本研究制备获得的复合纳米脂质体粒径更小,更稳定,推测是QY-C的正电性更强,与磷脂层表面的电子互相作用,使粒子内部紧密吸附。
表1 纳米脂质体的粒径、PDI值和Zeta电位
Table 1 Size, PDI value and Zeta potential of nanoliposomes
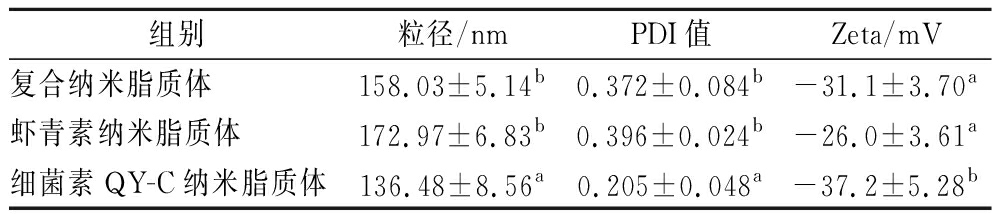
组别粒径/nmPDI值Zeta/mV复合纳米脂质体158.03±5.14b0.372±0.084b-31.1±3.70a虾青素纳米脂质体172.97±6.83b0.396±0.024b-26.0±3.61a细菌素QY-C纳米脂质体136.48±8.56a0.205±0.048a-37.2±5.28b
2.4 纳米脂质体的FT-IR分析
由图3可知,大豆卵磷脂有6个特征峰[21],分别是3 010 cm-1处和2 924 cm-1处不饱和酰链烯烃![]() C—H的伸展振动峰和反对称伸展振动峰,2 855 cm-1处酯链—CH2—的对称伸缩峰,1 735 cm-1处磷脂头基酯链上C
C—H的伸展振动峰和反对称伸展振动峰,2 855 cm-1处酯链—CH2—的对称伸缩峰,1 735 cm-1处磷脂头基酯链上C![]() O的伸缩振动峰,1 090 cm-1处磷酸基团P
O的伸缩振动峰,1 090 cm-1处磷酸基团P![]() O的对称伸缩峰,970 cm-1处胆碱头基上C—C—N的伸缩振动,在复合脂质体中,也发现了这6个峰,这些共同的吸收峰表明脂质体的基质是大豆卵磷脂。
O的对称伸缩峰,970 cm-1处胆碱头基上C—C—N的伸缩振动,在复合脂质体中,也发现了这6个峰,这些共同的吸收峰表明脂质体的基质是大豆卵磷脂。

图3 纳米脂质体红外光谱
Fig.3 FT-IR of nanoliposomes
细菌素QY-C位于1 290 cm-1的吸收峰可归因于蛋白质特有的酰胺Ⅲ带伸缩振动[22],在复合脂质体中也观察到该峰,说明QY-C已被包埋入脂质体体系。虾青素于2 920 cm-1处的吸收峰为CH2反对称伸缩振动峰,位于1 652 cm-1的吸收峰为六元环不饱和C![]() C双键的伸缩振动,位于1 074 cm-1的吸收峰为C—O的伸缩振动[23]。细菌素QY-C于2 924 cm-1处的吸收峰为C—H伸展振动峰,位于1 662 cm-1的吸收峰为酰胺 Ⅰ 带的伸缩振动,位于1 124 cm-1的吸收峰为羧基的C—O伸缩振动[22]。复合脂质体对比大豆卵磷脂没有出现新的吸收峰,但复合脂质体位于2 924、1 662、1 097 cm-1的吸收峰透过率显著增强,是大豆卵磷脂与虾青素、细菌素QY-C各自吸收峰叠加形成的,说明虾青素与细菌素QY-C已被包埋到复合脂质体中。另外,虾青素在1 550 cm-1处的吸收峰归因于六元环不饱和C
C双键的伸缩振动,位于1 074 cm-1的吸收峰为C—O的伸缩振动[23]。细菌素QY-C于2 924 cm-1处的吸收峰为C—H伸展振动峰,位于1 662 cm-1的吸收峰为酰胺 Ⅰ 带的伸缩振动,位于1 124 cm-1的吸收峰为羧基的C—O伸缩振动[22]。复合脂质体对比大豆卵磷脂没有出现新的吸收峰,但复合脂质体位于2 924、1 662、1 097 cm-1的吸收峰透过率显著增强,是大豆卵磷脂与虾青素、细菌素QY-C各自吸收峰叠加形成的,说明虾青素与细菌素QY-C已被包埋到复合脂质体中。另外,虾青素在1 550 cm-1处的吸收峰归因于六元环不饱和C![]() C双键伸缩振动[24],但是在复合脂质体中,没有观察到该峰,说明虾青素与卵磷脂存在相互作用。有研究表明,虾青素可以嵌入到磷脂双层中以提高脂质体的膜稳定性[10]。
C双键伸缩振动[24],但是在复合脂质体中,没有观察到该峰,说明虾青素与卵磷脂存在相互作用。有研究表明,虾青素可以嵌入到磷脂双层中以提高脂质体的膜稳定性[10]。
FT-IR结果表明,虾青素与细菌素都被成功包埋于脂质体中,其中虾青素与卵磷脂间存在相互作用,且虾青素改变了脂质体的结构。
2.5 纳米脂质体的抑菌活性
不同浓度的细菌素QY-C与虾青素复合纳米脂质体对单增李斯特菌(ATCC 19111T)的抑菌效果如图4所示,其中,复合脂质体质量浓度为17.5、8.75 mg/mL的抑菌圈直径分别为19.9、15.4 mm,质量浓度为4.375 mg/mL的无明显抑菌圈,所以复合纳米脂质体MIC为8.75 mg/mL,计算得效价为151.63 AU/mL,QY-C的加入使复合纳米脂质体具有良好的抑菌性能。

1~3-17.5、8.75、4.375 mg/mL复合纳米脂质体
图4 不同细菌素浓度的复合纳米脂质体抑菌活性
Fig.4 Antibacterial activity of composite nanoliposomes with different concentrations of bacteriocin
2.6 纳米脂质体的抗氧化活性
由于大豆卵磷脂自身具有一定抗氧化性[25-26],因此本研究采用空白纳米脂质体为空白组进行实验。根据测定结果,按公式(5)、公式(6)计算得细菌素QY-C与虾青素复合纳米脂质体DPPH自由基清除率为87.67%,ABTS阳离子自由基清除率为99.35%;空白纳米脂质体DPPH自由基清除率为71.84%,ABTS阳离子自由基清除率为30.53%(图5)。复合脂质体的抗氧化活性较空白脂质体显著提高,说明虾青素的添加有效提高了纳米脂质体的抗氧化活性。

图5 复合纳米脂质体与空白纳米脂质体DPPH自由基与ABTS阳离子自由基清除率
Fig.5 The scavenging rate of DPPH free radical and ABTS cationic free radical between composite nanoliposome and blank nanoliposome
3 结论
本研究以细菌素QY-C与虾青素制备纳米脂质体,通过反相蒸发法制备细菌素QY-C与虾青素复合纳米脂质体。80 mg/mL细菌素QY-C用量的纳米脂质体包封率最高,为99.67%;2 mg虾青素用量的纳米脂质体包封率最高,为89.43%。在此添加量下制备的复合纳米脂质体的平均粒径为158.03 nm、平均PDI值为0.372、平均Zeta电位为-31.1 mV。由于添加了细菌素QY-C抑菌物质,复合纳米脂质体有优良的抑菌活性,同时添加入了虾青素强抗氧化剂,细菌素QY-C与虾青素复合纳米脂质体有比空白纳米脂质体更优良的抗氧化性。本研究制备了细菌素QY-C与虾青素复合纳米脂质体,对纳米脂质体的包封率、表征、抑菌能力与抗氧化性进行了评价,复合纳米脂质体稳定,但粒径分布不太均匀,需要进一步调整原料的比例来降低PDI值。实际应用于食品保鲜领域仍需进行稳定性、货架期等评价。目前关于细菌素纳米脂质体制备的文章较少,所以本研究制备的细菌素QY-C与虾青素复合纳米脂质体具有良好的应用推广前景,旨在食品防腐保鲜领域解决食品安全的问题。
[1] 许育民, 任兰兰, 张颖, 等.抗食源性病原菌细菌素的筛选及特性研究[J].食品安全质量检测学报, 2022, 13(4):1 170-1 175.
XU Y M, REN L L, ZHANG Y, et al.Screening and characterization of bacteriocin against food pathogenic bacteria[J].Journal of Food Safety and Quality Inspection, 2022, 13(4):1 170-1 175.
[2] 陈全毅. 海洋源抗菌活性乳酸菌筛选与细菌素分离及对单增李斯特菌作用效应的研究[D].湛江:广东海洋大学, 2021.
CHEN Q Y.Screening of marine source antimicrobial active lactic acid bacteria and bacteriocin isolation and their effects on Listeria monocytogenes[D].Zhanjiang:Guangdong Ocean University, 2021.
[3] 高玥, 许倩楠, 蔡明刚, 等.海洋来源药食同源品开发利用研究进展[J].中草药, 2021, 52(17):5 455-5 464.
GAO Y, XU Q N, CAI M G, et al.Development and utilization of marine-derived medicine and food homologous products[J]. Chinese Traditional and Herbal Drugs, 2021, 52(17):5 455-5 464.
[4] 潘丽, 常振刚, 陈娟, 等.虾青素的生理功能及其制剂技术的研究进展[J].河南工业大学学报(自然科学版), 2019, 40(6):123-129.
PAN L, CHANG Z G, CHEN J, et al.Research progress on the physiological functions and preparation technology of astaxanthin[J].Journal of Henan University of Technology (Natural Science Edition), 2019, 40(6):123-129.
[5] QIAO X, YANG L, GU J Y, et al.Kinetic interactions of nano complexes between astaxanthin esters with different molecular structures and β-lactoglobulin[J].Food Chemistry, 2021, 335:127633.
[6] 赵英源, 刘俊霞, 陈姝彤, 等.虾青素生理活性的研究进展[J].中国海洋药物, 2020, 39(3):80-88.
ZHAO Y Y, LIU J X, CHEN S T, et al.Advances in physiological activities of astaxanthin[J]. Chinese Journal of Marine Drugs, 2020, 39(3):80-88.
[7] SHAKERI M, RAZAVI S H, SHAKERI S.Carvacrol and astaxanthin co-entrapment in beeswax solid lipid nanoparticles as an efficient nano-system with dual antioxidant and anti-biofilm activities[J].LWT, 2019, 107:280-290.
[8] TAMJIDI F, SHAHEDI M, VARSHOSAZ J, et al.Design and characterization of astaxanthin-loaded nanostructured lipid carriers[J].Innovative Food Science and Emerging Technologies, 2014, 26:366-374.
[9] PAN L, LI H, HOU L F, et al.Gastrointestinal digestive fate of whey protein isolate coated liposomes loading astaxanthin:Lipolysis, release, and bioaccessibility[J].Food Bioscience, 2022, 45:101464.
[10] DING L J, YANG J, YIN K R, et al.The spatial arrangement of astaxanthin in bilayers greatly influenced the structural stability of dppc liposomes[J].Colloids and Surfaces B:Biointerfaces, 2022, 212:112383.
[11] 王倩, 丁保淼.纳米脂质体制备方法及在食品工业中应用研究进展[J].食品与机械, 2020, 36(11):206-210.
WANG Q, DING B M.Research progress of preparation methods and application of nano-liposomes in food industry[J].Food and Machinery, 2020, 36(11):206-210.
[12] LOPES N A, BARRETO PINILLA C M, BRANDELLI A.Antimicrobial activity of lysozyme-nisin co-encapsulated in liposomes coated with polysaccharides[J].Food Hydrocolloids, 2019, 93:1-9.
[13] PEI J J, JIN W G, ABD EL-ATY A M, et al.Isolation, purification, and structural identification of a new bacteriocin made by Lactobacillus plantarum found in conventional kombucha[J].Food Control, 2020, 110:106923.
[14] 莫镜池, 李晓芬, 熊华斌, 等.虾青素清除ABTS自由基的紫外-可见吸收光谱研究[J].食品工业, 2018, 39(3):94-97.
MO J C, LI X F, XIONG H B, et al.UV-vis absorption spectrometric investigation of the astaxanthin against ABTS free radicals[J].The Food Industry, 2018, 39(3):94-97.
[15] 王宏雁, 张朋杰, 杨琴.白藜芦醇纳米脂质体的制备与抗氧化性能[J].粮食与油脂, 2018, 31(3):93-97.
WANG H Y, ZHANG P J, YANG Q.Preparation and antioxidant properties of resveratrol nanoliposomes[J].Cereals and Oils, 2018, 31(3):93-97.
[16] WANG H J, ZHAO P Q, LIANG X F, et al.Folate-PEG coated cationic modified chitosan-cholesterol liposomes for tumor-targeted drug delivery[J].Biomaterials, 2010, 31(14):4 129-4 138.
[17] 郝静, 涂心怡, 曹诗诺, 等. 壳聚糖-核桃多肽脂质体的制备及表征[J]. 食品与发酵工业, 2022, 48(13):135-140.
HAO J, TU X Y, CAO S N, et al. Preparation and characterization of chitosan-coated nanoliposome loaded with walnut (Juglans regia L.) polypeptide[J]. Food and Fermentation Industries, 2022, 48(13):135-140.
[18] WU J L, LIU H, GE S Y, et al.The preparation, characterization, antimicrobial stability and in vitro release evaluation of fish gelatin films incorporated with cinnamon essential oil nanoliposomes[J].Food Hydrocolloids, 2015, 43:427-435.
[19] PINILLA C M B, NORE A C P Z, BRANDELLI A.Development and characterization of phosphatidylcholine nanovesicles, containing garlic Extract, with antilisterial activity in milk[J].Food Chemistry, 2017, 220:470-476.
A C P Z, BRANDELLI A.Development and characterization of phosphatidylcholine nanovesicles, containing garlic Extract, with antilisterial activity in milk[J].Food Chemistry, 2017, 220:470-476.
[20] PINILLA C M B, BRANDELLI A.Antimicrobial activity of nanoliposomes co-encapsulating nisin and garlic extract against Gram-positive and Gram-negative bacteria in milk[J].Innovative Food Science and Emerging Technologies, 2016, 36:287-293.
[21] 张楠, 张佑红, 熊瑶, 等.大豆磷脂的分析与检测[J].贵州师范大学学报(自然科学版), 2013, 31(3):79-83.
ZHANG N, ZHANG Y H, XIONG Y, et al.Analysis and detection of soybean lecithin[J].Journal of Guizhou Normal University (Natural Sciences), 2013, 31(3):79-83.
[22] 刘怡菲, 齐艳梅, 冯俊霞, 等.玉米粉蛋白质二级结构的红外光谱研究[J].中国奶牛, 2015(1):1-4.
LIU Y F, QI Y M, FENG J X, et al.Study on secondary structure of maize meal protein by infrared spectroscopy[J]. China Dairy Cattle, 2015(1):1-4.
[23] 毛昕宇. 虾青素微纳米载体的制备与评价[D].南京:东南大学, 2019.
MAO X Y.The preparation and evaluation of astaxanthin micro-nano carriers[D].Nanjing:Southeast University, 2019.
[24] 黄玲. 脂肪酸介导虾青素—蛋白自组装及其复合物吸收特性研究[D].厦门:集美大学, 2021.
HUANG L.Study on astaxanthin-protein self-assembly mediated by fatty acids and its complex absorption properties[D].Xiamen:Jimei University, 2021.
[25] 张艳军, 王芸, 李根, 等.石斑鱼鱼鳞卵磷脂的提取工艺及抗氧化活性研究[J].化工技术与开发, 2020, 49(6):5-8.
ZHANG Y J, WANG Y, LI G, et al.Extraction technology and antioxidant activities of lecithin from Epinephelu ssp. scales[J]. Technology &Development of Chemical Industry, 2020, 49(6):5-8.
[26] 伍艳霞, 谭翠容, 娄悦, 等.卵磷脂的抗氧化性研究[J].广州化工, 2019, 47(1):46-48.
WU Y X, TAN C R, LOU Y, et al.Study on antioxidant properties of lecithin[J].Guangzhou Chemical Industry, 2019, 47(1):46-48.