哈密瓜(Cucumis melo L.),因其营养丰富、口感和风味俱佳,深受消费者青睐[1]。但是随着贮藏时间的延长,哈密瓜果实活性氧(reactive oxygen species,ROS)代谢极易失衡,产生大量的ROS,加速果实细胞膜脂过氧化进程,导致果实贮藏品质下降、腐烂变质等,缩短了哈密瓜的贮运期和货架期[1]。
采后果实通过酶促和非酶促的抗氧化系统来清除过量的ROS并维持果实品质。抗坏血酸-谷胱甘肽循环(glutathione-ascorbate cycle,AsA-GSH cycle)是一种抗氧化体系,可以清除ROS并缓解H2O2诱导的毒害作用[2],在植物抗氧化体系中具有维持氧化还原稳态的作用[2]。还原型谷胱甘肽(reduced glutathione,GSH)、抗坏血酸(ascorbic acid,AsA)都是酶活性的底物,在AsA-GSH循环的一系列反应中控制H2O2的水平。此循环系统如图1所示。
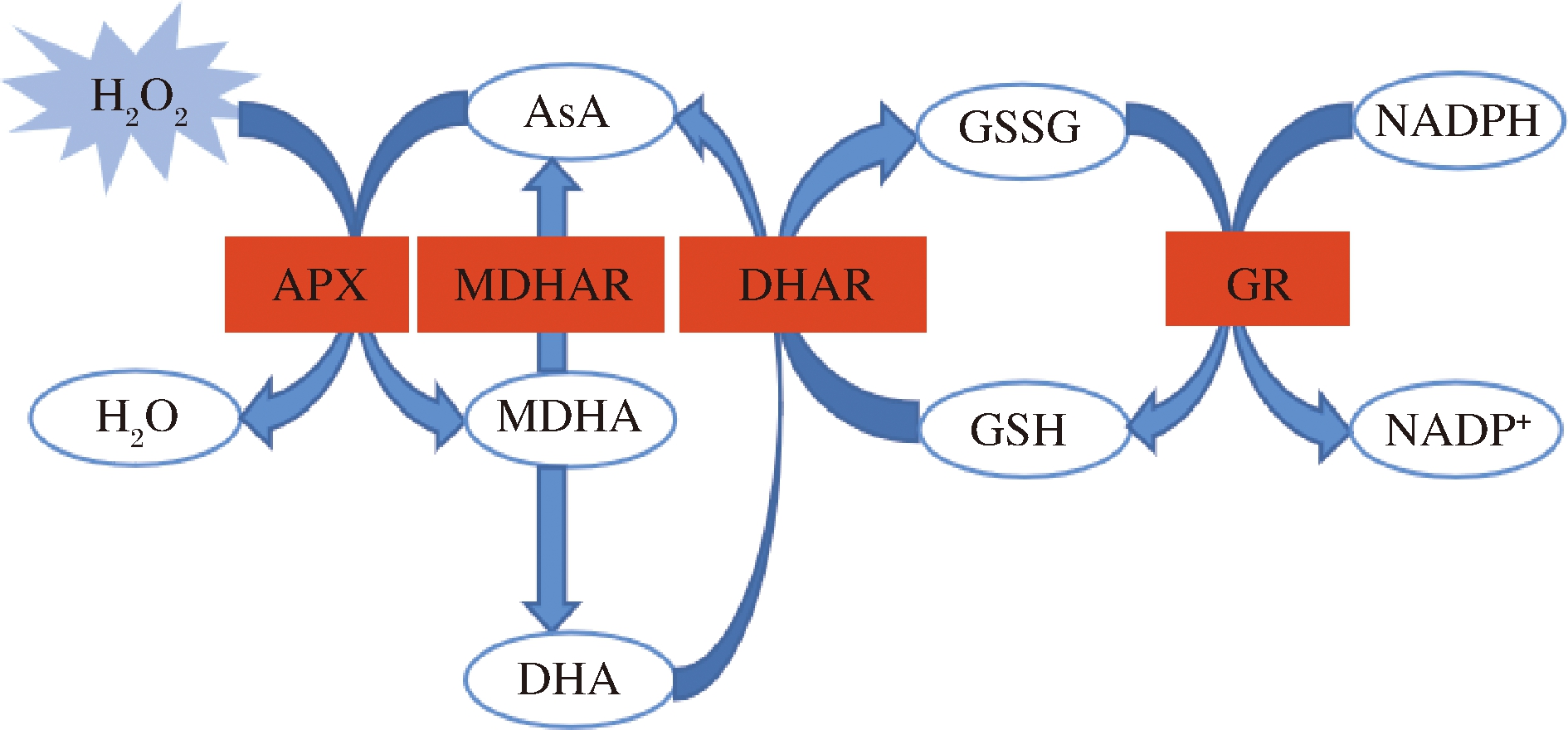
图1 植物中AsA-GSH循环体系
Fig.1 The AsA-GSH cycle in plants
注:首先,APX以AsA为电子供体将H2O2还原为H2O,[2AsA+H2O2→2MDHA+2H2O]。AsA可通过MDHAR还原MDHA中再生,[NADH+2MDHA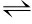 NAD++2AsA]。由于MDHA很不稳定,在歧化反应中生成AsA和DHA。DHAR以2个GSH分子为代价将DHA还原为AsA,[DHAR+2GSH→AsA+GSSG]。最后,氧化后的GSSG再次被GR,以NADH为代价还原[2]。AsA(ascorbic Acid,抗坏血酸);MDHA(monodehydroascorbic acid,单脱氢抗坏血酸);DHA(dehydroascorbate,脱氢抗坏血酸);GSH(reduced glutathione,还原型谷胱甘肽);GSSG(oxidized glutathione,氧化型谷胱甘肽);NADPH(reduced nicotinamide adenine dinucleotidephosphate,还原型烟酰胺腺嘌呤二核苷酸磷酸); NADP+(nicotinamide adenine dinucleotide phosphate,烟酰胺腺嘌呤二核苷酸磷酸);APX(ascorbate peroxidase,抗坏血酸过氧化物酶);MDHAR(monodehydroascorbate reductase,单脱氢抗坏血酸还原酶);DHAR(dehydroascorbate reductase,脱氢抗坏血酸还原酶);GR(glutathione reductase,谷胱甘肽还原酶)
NAD++2AsA]。由于MDHA很不稳定,在歧化反应中生成AsA和DHA。DHAR以2个GSH分子为代价将DHA还原为AsA,[DHAR+2GSH→AsA+GSSG]。最后,氧化后的GSSG再次被GR,以NADH为代价还原[2]。AsA(ascorbic Acid,抗坏血酸);MDHA(monodehydroascorbic acid,单脱氢抗坏血酸);DHA(dehydroascorbate,脱氢抗坏血酸);GSH(reduced glutathione,还原型谷胱甘肽);GSSG(oxidized glutathione,氧化型谷胱甘肽);NADPH(reduced nicotinamide adenine dinucleotidephosphate,还原型烟酰胺腺嘌呤二核苷酸磷酸); NADP+(nicotinamide adenine dinucleotide phosphate,烟酰胺腺嘌呤二核苷酸磷酸);APX(ascorbate peroxidase,抗坏血酸过氧化物酶);MDHAR(monodehydroascorbate reductase,单脱氢抗坏血酸还原酶);DHAR(dehydroascorbate reductase,脱氢抗坏血酸还原酶);GR(glutathione reductase,谷胱甘肽还原酶)
NO作为一种多功能的信号分子,在许多植物生理调控过程中扮演了重要的角色。NO可以延缓果实成熟衰老、维持果蔬品质和延长货架期[3],这可能与NO参与调控抗氧化相关酶基因表达或酶蛋白S-亚硝基化(S-nitrosylation)修饰有关[4]。
蛋白质S-亚硝基化修饰是内源NO发挥广泛生物活性的主要分子机制之一。该修饰形成的S-亚硝基硫醇(S-nitrosothiols,SNO)可调控蛋白质的结构、稳定性、细胞定位、蛋白质-蛋白质相互作用等[5]。蛋白组学研究表明,AsA-GSH循环中APX、单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MDHAR)和谷胱甘肽还原酶(glutathione reductase,GR)是NO介导的翻译后修饰的潜在靶蛋白。拟南芥中的APX被确定为S-亚硝基化的靶蛋白[6],而在水稻中GR被确定为S-亚硝化的靶蛋白[7]。在柑橘植物、水稻和拟南芥中MDHAR被确定为S-亚硝化靶蛋白[6-7]。因此,NO可以通过蛋白质S-亚硝基化影响AsA-GSH循环系统中相关酶的活性,进而影响该循环的清除能力。关于外源NO诱导的S-亚硝基化对哈密瓜AsA-GSH循环影响的研究鲜有报道。
因此,本文采用外源施加NO的方法,探讨外源NO通过缓解由衰老引起的氧化胁迫、保持哈密瓜品质的效应及其作用机制。通过对生理响应、S-亚硝基化水平、AsA-GSH循环的研究,分析哈密瓜采后贮藏过程中S-亚硝基化与抗氧化体系的内在联系。
1 材料与方法
1.1 材料与试剂
哈密瓜品种为“西州蜜17号”(Cucumis melo L.cv.‘Xizhoumi NO.17’),采摘自吐鲁番高昌区三堡乡种植园,立即运回新疆农业科学院农产品贮藏加工研究所冷库(7±1.0) ℃预冷24 h。挑选出成熟度一致、大小均匀、无病虫害和机械伤的果实,随机分组进行后续实验。
NO气体(纯度≥99.5%),乌鲁木齐鑫天意标准气体有限公司;还原型辅酶Ⅱ、S-亚硝基谷胱甘肽,上海麦克林生化科技有限公司;抗坏血酸,天津市福晨化学试剂厂;盐酸萘乙二胺,天津市化学试剂研究所有限公司;还原性谷胱甘肽、牛血清蛋白,瑞禧生物国产/进口有限公司。
1.2 仪器与设备
熏蒸罐,课题组自主设计;UV2100型紫外可见分光光度计,上海普析通公司;HC-3018R型高速冷冻离心机,上海力申科学仪器有限公司;MDF-682型-80 ℃冰箱,青岛海尔股份有限公司;GY-4型果实硬度计,山东莱恩德智能科技有限公司。
1.3 实验方法
1.3.1 样品处理
挑选大小基本一致、无机械损伤及病虫害的果实,随机分成2组进行试验。2种处理包括:(1)空气熏蒸作为对照处理(CK);(2)60 μL/L NO熏蒸处理。
NO熏蒸处理:课题组前期研究NO熏蒸哈密瓜适宜浓度和时间为60 μL/L、3 h[8]。哈密瓜置于熏蒸罐(100 cm×75 cm×75 cm)中,先抽真空,再注入氮气使罐内压力等于大气压力,然后使用气体进样针注入NO标准气体,立即拔出注射器针口,同时打开风扇,使NO气体在密封箱中均匀分布。
CK处理:熏蒸罐中放置哈密瓜但不充入NO气体,放置3 h。
处理后的哈密瓜置于(7±1.0) ℃,相对湿度为(40±5.0)%条件下进行贮藏。取样时间分短期贮藏组和长期贮藏组,分别在0、6、12、24、36、48、72、96 h和7、10、13、16、19、25、31、37 d各取5个哈密瓜测定硬度、腐烂率和失重率。随后将哈密瓜纵向中线切开,取距果皮1.5~2.5 cm处果肉,用液氮处理后迅速粉碎,装袋置于-80 ℃冰箱内,用于后续各项指标的测定。
1.3.2 测定指标与方法
1.3.2.1 硬度的测定
参照田全明等[9]的方法。将哈密瓜纵向中线切开,围绕果实赤道部位等间距的6个位置,用果实硬度计测定硬度,取平均值。单位:牛(N)。
1.3.2.2 失重率、腐烂率的测定
果实的失重率、腐烂率根据田全明等[9]的方法计算,计算方法如公式(1)、公式(2)所示:
失重率![]()
(1)
腐烂率![]()
(2)
1.3.2.3 内源NO含量的测定
内源NO含量的测定参照DING等[10]的方法并稍作修改。取2.00 g冷冻样品,加入6 mL 50 mmol/L冰醋酸缓冲液[pH 3.6,含4%(体积分数)乙酸锌],在10 000 r/min、4 ℃条件下离心20 min制备提取液。将2 mL的上清液和2 mL Griess试剂混匀,在室温下孵育30 min,测定540 nm下的吸光值。每个样品重复测定3次。
1.3.2.4 SNO含量的测定
SNO含量的测定参照FRUNGILLO等[11]的方法并稍作修改。取3.00 g冷冻样品,加入9 mL 0.1 mol/L磷酸盐溶液(pH 7.2,含1 mol/L四乙酸乙二胺和0.1 mol/L乙二醇双四乙酸),混匀后在4 ℃、10 000 r/min条件下离心20 min制得提取液。取2 mL提取液分别与2 mL溶液A[含1%(体积分数)磺胺、0.1%盐酸萘乙二胺]和2 mL溶液B(含1%磺胺、0.1%盐酸萘乙二胺和2 mmol/L 氯化汞)混合,黑暗条件下放置5~10 min,在540 nm下测吸光值。根据溶液A和B的测定值之差来量化SNO的含量。用亚硝基谷胱甘肽(S-nitrosoglutathione,GSNO)绘制标准曲线,根据标准曲线计算SNO的含量。每个样品重复测定3次。
1.3.2.5 S-亚硝基谷胱甘肽还原酶(S-nitrosoglutathione reductase,GSNOR)活性的测定
GSNOR活性的测定参照SAKAMOTO等[12]的方法稍作修改。取1.00 g冷冻样品,加入3 mL提取液[pH 8.0,含50 mmol/L 羟乙基哌嗪乙硫磺酸、20%(体积分数)甘油、10 mmol/L 氯化镁、1 mmol/L 四乙酸乙二胺、1 mmol/L 乙二醇双四乙酸和0.1%(体积分数)曲拉通-100],在4 ℃、10 000 r/min条件下离心20 min。取上清液0.5 mL加入3.5 mL分析液(pH 8.0,含20 mmol/L 三羟甲基氨基甲烷盐酸盐、0.2 mmol/L 还原型烟酰胺腺嘌呤二核苷酸和0.5 mmol/L 四乙酸乙二胺),加入10 μL 100 mmol/L GSNO溶液至终浓度为400 μmol/L,在340 nm下测定吸光值,每30 s测定一次,测4~5个数值。每个样品重复测定3次。
1.3.2.6 MDA含量的测定
参照曹建康等[13]的方法。取3.00 g冷冻样品,加5 mL 100 g/L三氯乙酸溶液研磨,研磨后的匀浆于4 ℃、10 000 r/min条件下离心20 min。取2 mL上清液,加2 mL体积分数为0.67%的2-硫代巴比妥酸溶液,混匀后煮沸20 min,冷却至室温后再进行一次离心。分别测定反应液在450、532、600 nm处的吸光值。每个样品重复测定3次。按公式(3)进行计算:
MDA含量![]()
(3)
式中:C,反应混合液中丙二醛浓度,mmol/L;V,样品提取液浓度,mL;V0,测定时所取样品提取液体积,mL;m,样品质量,g。
1.3.2.7 H2O2含量的测定
参照曹建康等[13]的方法并稍作修改。取4.00 g冷冻样品,加4 mL三氯乙酸(体积分数为0.1%)溶液研磨,研磨后的匀浆于4 ℃、10 000 r/min条件下离心15 min。取1 mL上清液加入2 mL 1 mol/L碘化钾溶液和1 mL 10 mmol/L磷酸盐(pH 7.0)溶液中。在390 nm处记录吸光值。每个样品重复测定3次。
1.3.2.8 AsA和DHA含量的测定
参照LAW等[14]的方法并稍作修改。取1.00 g冷冻样品,加入5 mL 5%三氯乙酸,4 ℃条件下充分研磨,于4 ℃、10 000 r/min条件下离心10 min,上清液立即用于AsA和DHA的测定。
AsA+DHA(总抗坏血酸)含量的测定:向1.0 mL上清液中加入0.5 mL 60 mmol/L二硫苏糖醇-乙醇溶液,用磷酸氢二钠-氢氧化钠混合液将溶液pH调至7~8,置于室温下10 min,然后加入0.5 mL 20%三氯乙酸,把pH调至1~2,在543 nm处测其吸光值。
AsA的测定:取1 mL上清液加入1 mL 5%三氯乙酸、1 mL乙醇摇匀,再依次加入0.5 mL 0.4%(体积分数)正磷酸-乙醇、1.0 mL 0.5%(体积分数)二苯甲酮-乙醇、0.5 mL 0.03%(体积分数)三氯化铁-乙醇。将溶液置于30 ℃下反应90 min,然后在543 nm下测定其吸光值。
DHA含量:总抗坏血酸含量减去AsA含量即为DHA的含量。每个样品重复测定3次。
1.3.2.9 GSH和GSSG含量的测定
参照BREHE等[15]的方法并稍作修改。取3.00 g冷冻样品,加入5 mL 6%(体积分数)偏磷酸(pH 2.8),4 ℃条件下研磨成匀浆,于4 ℃、10 000 r/min条件下离心20 min,上清液用于测定GSH和GSSG的含量。
GSH+GSSG(总谷胱甘肽)含量测定:500 μL粗酶液加入2.5 mL反应液,其中包含800 μL反应液A[110 mmol/L七水磷酸氢二钠、40 mmol/L磷酸二氢钠、15 mmol/L乙二胺四乙酸、0.3 mmol/L二硫代二硝基苯甲酸、0.04%(体积分数)牛血清蛋白]、800 μL反应液B(1 mmol/L乙二胺四乙酸、50 mmol/L咪唑和0.02%牛血清白蛋白)、800 μL反应液C(体积分数为5%的磷酸氢二钠,pH 7.5)和100 μL 9 mmol/L还原型烟酰胺腺嘌呤二核苷酸磷酸,以6%偏磷酸(pH 2.8)代替提取液作为对照,在412 nm下测定其吸光值。
GSSG含量测定:500 μL提取液加入2.5 mL乙烯吡啶,25 ℃下水浴1 h,在412 nm下测其吸光度。
GSH含量:总谷胱甘肽含量减去GSSG含量即为GSH含量。每个样品重复测定3次。
1.3.2.10 APX活性的测定
粗酶液的提取:参照NAKANO等[16]的方法。取3.00 g冷冻样品于4 ℃预冷的研钵中,加5 mL 50 mmol/L磷酸缓冲液[pH 7.0,含1 mmol/L AsA、1 mmol/L乙二胺四乙酸、2%(体积分数)聚乙烯吡咯烷酮、0.25%曲拉通-100]研磨,于4 ℃、10 000 r/min条件下离心20 min,上清液即为粗酶液。
取200 μL粗酶液分别加入2 mL 100 mmol/L的磷酸缓冲液(pH 7.5,含1 mmol/L乙二胺四乙酸)、0.8 mL 3 mmol/L AsA、0.5 mL 0.5 mmol/L H2O2,测定290 nm的吸光值。每个样品重复测定3次。
1.3.2.11 GR活性的测定
粗酶液的提取:参照曹建康等[13]的方法并稍作修改。取5.00 g冷冻样品于4 ℃预冷的研钵中,加5 mL 0.1 mol/L磷酸缓冲液(pH 7.5,含1 mmol/L乙二胺四乙酸)研磨,于4 ℃、10 000 r/min条件下离心20 min,上清液即为粗酶液。
取0.4 mL粗酶液分别加入5 mL 0.1 mol/L的磷酸缓冲液(pH 7.5,含1 mmol/L乙二胺四乙酸)、0.2 mL 5 mmol/L GSSG,最后加入80 μL 4 mmol/L还原型烟酰胺腺嘌呤二核苷酸磷酸溶液以启动反应,记录340 nm的吸光值,每隔30 s记录一次,连续测定4~5个数值。每个样品重复测定3次。
1.3.2.12 DHAR活性的测定
粗酶液的提取与1.3.2.11相同。参照NAKANO等[16]的方法取0.3 mL粗酶液,加入2.1 mL 50 mmol/L磷酸缓冲液、0.3 mL 20 mmol/L GSH、0.3 mL 2 mmol/L DHA,以不加酶液为对照,在265 nm处测定其吸光度值。每个样品重复测定3次。
1.3.2.13 MDHAR活性的测定
粗酶液的提取与1.3.2.11相同。参照NAKANO等[16]的方法取90 μL粗酶液,加入2.7 mL 50 mmol/L磷酸缓冲液(pH 7.0,含2 mmol/L AsA)、0.12 mL抗坏血酸氧化酶,最后加入0.09 mL 2 mmol/L还原型烟酰胺腺嘌呤二核苷酸磷酸溶液启动反应,以不加酶液为对照,在340 nm处测定其吸光值,每隔30 s记录一次,连续测定4~5个数值。每个样品重复测定3次。
1.4 数据统计与分析
使用Excel 2010进行数据处理,使用SPSS 20.0(SAS Institute Inc.USA)进行单因素方差分析(ANOVA),Graphpad prism 8.0.2(Systat software, Inc.USA)用于绘图。
2 结果与分析
2.1 NO对果实采后品质的影响
由表1可知,随着贮藏时间的延长,各组果实的硬度呈下降趋势,失重率和腐烂率都呈上升趋势,但在各个时间点处理组的硬度都明显高于对照组,失重率和腐烂率都明显小于对照组。整个贮藏过程中处理组硬度下降10.16%,对照组硬度下降21.61%。处理组硬度下降幅度相对平缓;第7天后,对照组失重率始终高于处理组。第19天时,处理组失重率比对照组低了23.25%(P<0.05);第19天时,对照组果实开始腐烂,但是处理组果实外观无明显变化。在第25天时,对照组的腐烂率是处理组的4倍。结果表明,NO可以保持哈密瓜果实采后的贮藏品质,延长果实的货架期。
表1 NO熏蒸对哈密瓜硬度、失重率和腐烂率的影响
Table 1 Effect of NO fumigation on firmness, weight loss rate, and rot index of cantaloupe
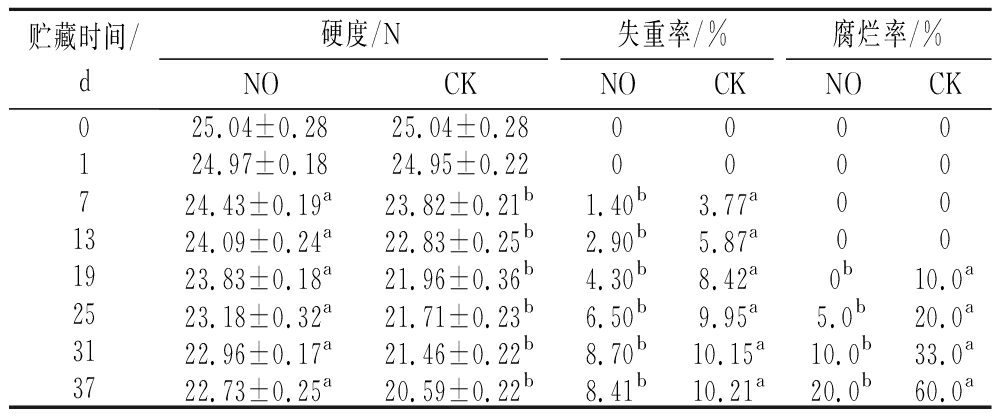
贮藏时间/d硬度/N失重率/%腐烂率/%NOCKNOCKNOCK025.04±0.2825.04±0.280000124.97±0.1824.95±0.220000724.43±0.19a23.82±0.21b1.40b3.77a001324.09±0.24a22.83±0.25b2.90b5.87a001923.83±0.18a21.96±0.36b4.30b8.42a0b10.0a2523.18±0.32a21.71±0.23b6.50b9.95a5.0b20.0a3122.96±0.17a21.46±0.22b8.70b10.15a10.0b33.0a3722.73±0.25a20.59±0.22b8.41b10.21a20.0b60.0a
注:同一贮藏时间,不同字母表示差异显著(P<0.05)
2.2 NO对果实中S-亚硝基化水平的影响
由图2可知,处理组SNO和内源NO含量都呈先上升后下降的趋势,36 h时含量达到最大值,而对照组的SNO、内源NO含量在整个贮藏期上下波动不大,NO显著提高了果实SNO和内源NO的含量(图2-A、图2-B)。36 h时,处理组SNO含量是对照组的1.80倍,内源NO含量是对照组的2.22倍。NO对内源NO和SNO含量的影响很大;处理组GSNOR活性呈先下降后上升趋势,而对照组GSNOR活性在整个贮藏期上下波动不大。NO显著抑制了果实GSNOR活性(P<0.05)(图2-C)。处理组GSNOR的活性也是在36 h时达最低值,比对照组低了51.75%。结果表明,NO提高了哈密瓜果实的S-亚硝基化水平。
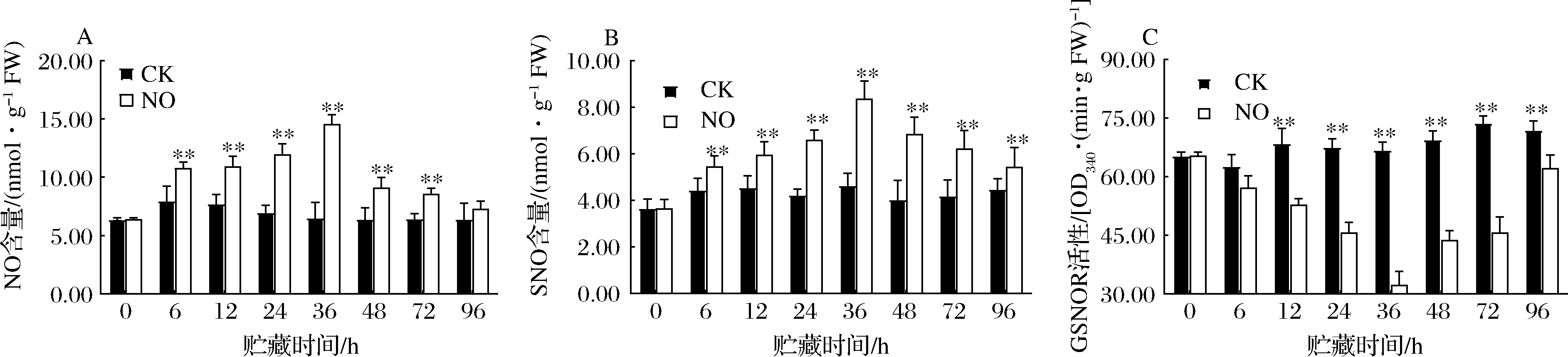
A-NO含量;B-SNO含量;C-GSNOR活性
图2 NO熏蒸对哈密瓜NO、SNO含量和GSNOR活性的影响
Fig.2 Effects of NO fumigation on NO, SNO contents, and GSNOR activity of cantaloupe
注:同一贮藏时间,**表示在0.05水平(双侧)上差异显著(下同)
2.3 NO对果实中内源NO、H2O2和MDA含量的影响
由图3-A可知,对照组内源NO含量一直呈下降趋势,处理组NO含量在1 d时快速上升达到最大值,到7 d时快速下降,7~37 d呈下降趋势,1~25 d显著高于对照(P<0.05)。果实中H2O2含量随着贮藏时间的延长不断上升,而处理组H2O2含量在13 d前无显著差异,13 d后显著低于对照组,在19 d时处理组H2O2含量比对照组低了28.58%(P<0.05)(图3-B);各组果实MDA含量呈上升趋势,处理组MDA含量低于对照组,第25天时低于对照59.00%(P<0.05)(图3-C)。结果表明,NO可以抑制贮藏期间哈密瓜H2O2的过量积累,显著减缓了MDA的增加。
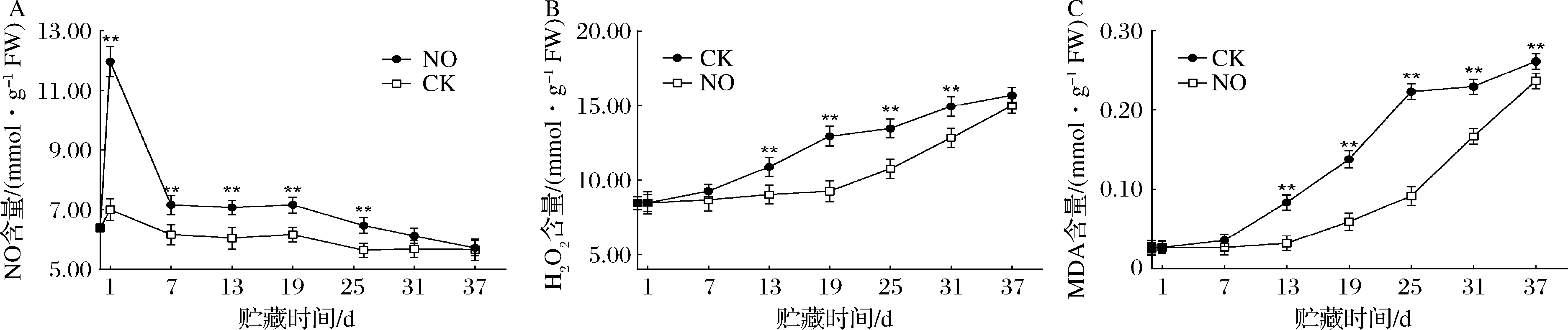
A-NO含量;B-H2O2含量;C-MDA含量
图3 NO熏蒸对哈密瓜内源NO、H2O2和MDA含量的影响
Fig.3 Effects of NO fumigation on the contents of endogenous NO, H2O2,and MDA in cantaloupe
2.4 NO对果实中AsA-GSH循环系统底物及产物含量的影响
在贮藏期,各组果实AsA含量总体呈逐渐下降的趋势,处理组AsA含量始终高于对照组(图4-A)。第19天时,处理组AsA含量比对照组高了17.70%(P<0.05);各组果实DHA含量在贮藏期间呈先上升后下降趋势,处理组DHA含量明显低于对照组,处理后第7天低于对照11.32%(P<0.05)(图4-B);果实中AsA/DHA在贮藏期间呈逐渐减小的趋势,处理组始终维持了较高的AsA/DHA(图4-C)。NO增加了果实AsA含量并且降低了DHA的含量,因此维持了较高的AsA/DHA比值,从而调节了哈密瓜贮藏期间的氧化还原状态。

A-AsA含量;B-DHA含量;C-AsA/GSH;D-GSH含量;E-GSSH含量;F-GSH/GSSH
图4 NO熏蒸对哈密瓜AsA、DHA、GSH、GSSH含量及AsA/GSH、GSH/GSSH的影响
Fig.4 Effects of NO fumigation on AsA, DHA, GSH, and GSSH contents, and AsA/GSH, GSH/GSSH of cantaloupe
由图4-D可知,各组果实GSH含量随着贮藏时间的延长呈先上升后下降并趋于平稳,处理组GSH含量始终高于对照组,在7~31 d时差异显著(P<0.05),13 d时达到最大值,比同时期对照组高了10.47%;果实中GSSG含量在贮藏期间逐渐下降,7~19 d时,对照组GSSG含量显著高于处理组(P<0.05),在31~37 d时,处理组GSSG的含量则低于对照组(图4-E);果实中GSH/GSSG在贮藏期间逐渐增加,处理组始终维持了较高的GSH/GSSG(图4-F)。结果表明,NO增加了果实GSH的含量并且降低了GSSG的含量,因此维持了较高的GSH/GSSG,从而调节了哈密瓜贮藏期间的氧化还原状态。
2.5 NO对果实中AsA-GSH循环系统关键酶活性的影响
由图5-A可知,在贮藏过程中,各组果实APX活性呈下降的趋势,7 d时达到最大值,处理组APX活性始终显著高于对照组(P<0.05);各组果实GR活性呈先上升后下降并趋于平稳的趋势,处理组始终保持了较高的GR活性,在第13天时比对照组高了76.74%(P<0.05)(图5-B);果实MDHAR活性先上升后下降,处理组维持了较高的MDHAR活性,在第13天时,处理组MDHAR活性比对照组高17.36%(P<0.05)(图5-C);各组果实DHAR活性呈先上升后下降趋势,在第19天时活性达到最大值,随后逐渐下降,处理组DHAR活性始终高于对照组,13 d后差异显著(P<0.05)(图5-D)。结果表明,NO能显著提高哈密瓜AsA-GSH循环中关键酶的活性。
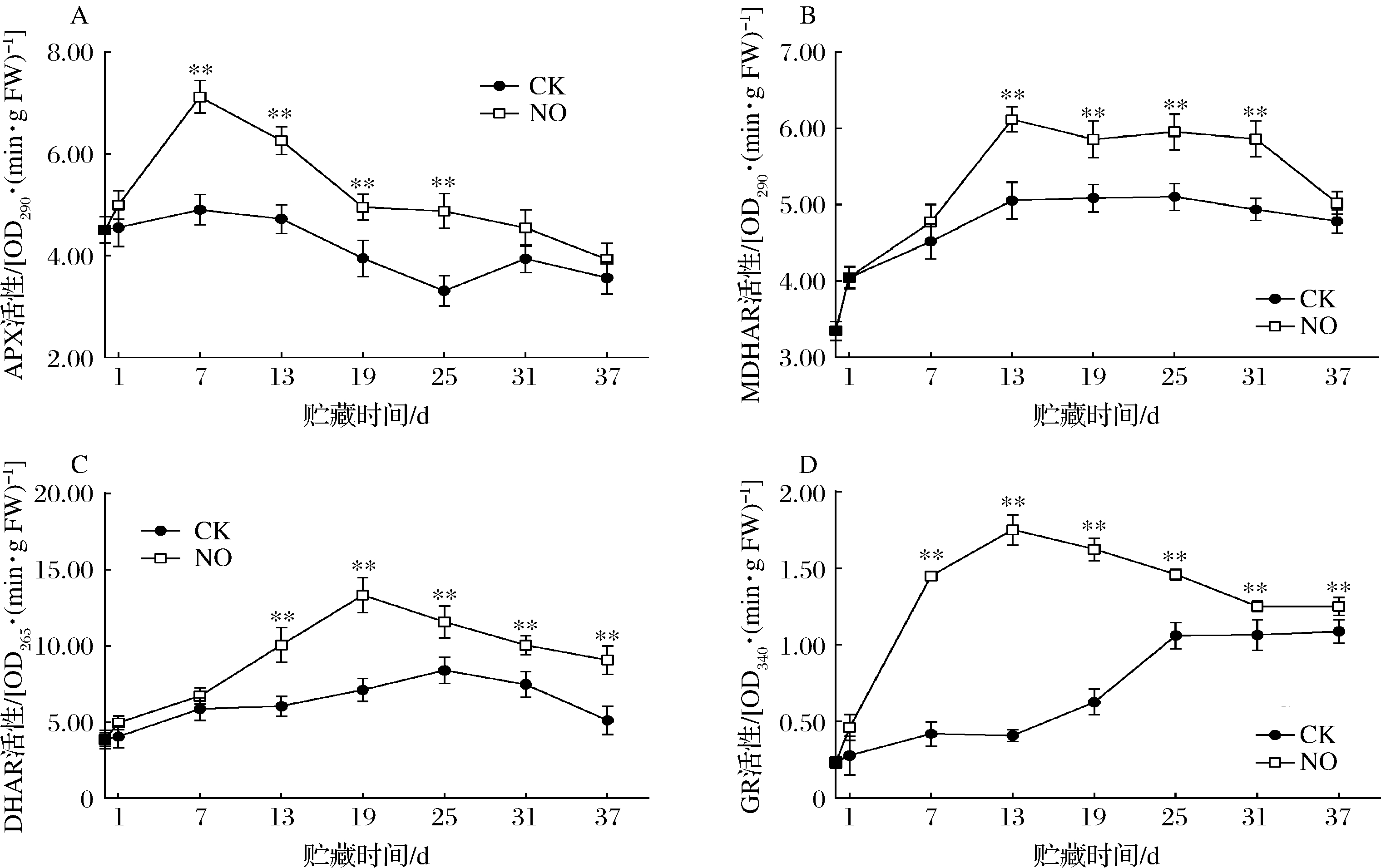
A-APX酶活性;B-MDHAR酶活性;C-DHAR酶活性;D-GR酶活性
图5 NO熏蒸对哈密瓜APX、MDHAR、DHAR和GR酶活性的影响
Fig.5 Effects of NO fumigation on enzyme activities of APX, MDHAR, DHAR, and GR in cantaloupe
3 讨论
抗氧化防御系统失衡导致ROS积累、氧化膜损伤、细胞壁结构破坏和抗病原菌能力减弱,加剧采后果实的失水变软和致病菌感染[1]。本文中,相对于对照组果实,果实经NO熏蒸处理后有效降低了腐烂率,抑制了果实水分的流失,较好地保持了果实硬度,维持了哈密瓜的采后品质。CAI等[17]研究报道了NO可延缓采后桃果实的衰老,维持采后贮藏品质,这与本文的结果一致。
WANG等[18]用不同浓度的NO供体硝普钠(sodium nitroprusside dihydrate,SNP)处理苎麻叶片后发现,S-亚硝基化水平与外源施加的NO浓度含量存在正相关关系,并使用特异性的NO清除剂(c-PTIO)证明了外源NO提高细胞S-亚硝基化水平很可能是由于其促进了苎麻叶片细胞内源NO含量的增加。由图2-A可知,施加NO使内源NO快速积累并在36 h时含量达到最高。GSNOR可以调节植物体内整体S-亚硝基化的水平[6]。GSNOR通过特异性识别和降解GSNO可分解为GSSG和NH3来调节真核细胞中GSNO和SNO的水平[19]。NO可能通过抑制GSNOR1的活性从而阻止GSNOR对亚硝基化水平的抑制[6]。在本文中,由于NO降低了哈密瓜GSNOR的活性,导致GSNOR对GSNO的降解活性下降,导致SNO在哈密瓜果实中积累。由图2-B和图2-C可知,NO在36 h时可能抑制了GSNOR酶活性并提高了内源SNO的产生,这说明GSNOR在NO诱导过程中调节了SNO的总含量。这也进一步说明了外源施加NO可能提高了S-亚硝基化水平。LINDERMAYR等[20]研究报道了同样研究结果,用NO气体处理的拟南芥植物SNO含量明显高于未处理组。此外NIU等[21]研究发现,GSNO显著提高了黄瓜NO、SNO含量,降低了GSNOR酶活性,并鉴定S-亚硝基化蛋白后发现,GSNO提高了S-亚硝基化蛋白的丰富度。
H2O2在抗氧化系统失衡的的情况下,能够被迅速地诱导,并且大量产生[2]。高浓度H2O2会加速膜脂过氧化,产生MDA,对细胞进一步造成氧化损伤,导致果蔬品质下降。由图3-B和图3-C可知,贮藏过程中处理组哈密瓜H2O2、MDA含量被抑制了。这可能是NO激活了抗氧化机制的信号,提高了哈密瓜对H2O2的清除能力,减少了MDA的生成,保持了哈密瓜果实的品质。在香蕉中也发现了类似的NO效应[22]。外源NO诱导的内源NO含量在贮藏前期快速升高并快速下降,说明内源NO的积累只能持续较短时间,而H2O2含量在贮藏中后期维持着较低的水平。这表明,外源NO通过提高内源NO依赖的S-亚硝基化水平来维持较高的H2O2清除能力,抑制后续过多H2O2的积累,保持哈密瓜的贮藏品质。
AsA和GSH能在多种酶促或非酶促反应中作为电子供体参与缓解氧化胁迫对细胞的伤害[2],是直接和间接的ROS清除剂。AsA和GSH含量以及AsA/DHA和GSH/GSSG反映了植物的氧化还原状态,较高的还原电位有利于维持植物正常的细胞功能和抵抗氧化胁迫[2]。在本文中,与对照组相比NO处理组以增加AsA和GSH的含量(图4-A,图4-D)和降低DHA和GSSG含量(图4-B,图4-E)来维持了较高比例的AsA/DHA和GSH/GSSG(图4-C,图4-F)。外源NO能够通过提高AsA/DHA和GSH/GSSG维持氧化还原稳态,从而在哈密瓜抗氧化胁迫中发挥重要的作用。MA等[23]研究发现冷胁迫下,NO通过提高AsA、GSH含量和AsA/DHA、GSH/GSSG,显著缓解了黑麦草幼苗叶片的MDA和H2O2的积累。
蛋白质S-亚硝基化是调控蛋白质活性的重要机制[6]。NO可以通过硝化和/或S-亚硝基化调控AsA-GSH循环中的大多数酶[4]。在AsA-GSH循环过程中,APX、GR、MDHAR和DHAR是参与AsA-GSH的必要抗氧化酶,这些关键酶相互协调作用从而激活了AsA-GSH的再循环过程[5]。由图5-A~图5-D可知,处理组APX、DHAR、GR、MDHAR的酶活性显著提高。NO虽然通过提高APX活性提高AsA消耗,但也通过提高MDHAR、DHAR活性加速MDHA、DHA的还原生成AsA,导致AsA含量的升高。由于MDHAR活性提高,更多的MDHA转化成了AsA,少部分的MDHA歧化生成了DHA,导致DHA含量下降。可能因为DHAR活性的增加加速了DHA的转化,使DHA含量下降,从而提高AsA/DHA。GR活性的增加加快了GSSG转化成GSH的速度,降低了GSSG含量,提高了GSH含量,也可能因为DHAR活性的上升增加了对GSH的需求,提高了GSH的含量和GSH/GSSG。增加的APX活性提升了H2O2转化成H2O的速度。可以推测,较高的S-亚硝基化水平激活酶活性,并促进了DHA和GSSG的还原,加速了AsA和GSH的再生,从而提高了AsA-GSH再循环的能力,抑制了H2O2含量的增加。上述结果解释了NO如何能减少ROS的积累,从而维持哈密瓜品质。YANG等[24]研究发现拟南芥胞质APX1的Cys32为S-亚硝化位点,S-亚硝基化使其酶活性增强。BEGARA-MORALES等[25]研究确定了豌豆APX、DHAR的硝化和S-亚硝化位点,S-亚硝化使APX活性增加,而使DHAR性降低。
综上所述,外源NO在短期内诱导的内源NO可能通过较高的S-亚硝基化水平调控长期的植物代谢相协调的抗氧化作用。NO提高了哈密瓜S-亚硝基化水平,激活了APX、DHAR和GR的活性,从而提高了氧化胁迫下哈密瓜AsA-GSH循环清除ROS的能力,维持了细胞氧化还原平衡,保持了哈密瓜的品质。此外,本文验证了S-亚硝基化是外源NO重要的作用方式之一,为研究一氧化氮调控果实采后的抗氧化机制提供了新思路。
[1] 张润光, 王良艳, 黄丽婉.甜瓜贮藏保鲜技术研究进展[J].保鲜与加工, 2011, 11(1):36-39.
ZHANG R G, WANG L Y, HUANG L W.Research progress on storage technology of muskmelon[J].Storage and Process, 2011, 11(1):36-39.
[2] 王懿, 侯媛媛, 马钰晴, 等.甘氨酸甜菜碱处理对桃果实冷害及抗坏血酸-谷胱甘肽循环代谢的影响[J].食品科学, 2021, 42(13):158-165.
WANG Y, HOU Y Y, MA Y Q, et al.Effect of glycine betaine treatment on chilling injury and ascorbic acid-glutathione cycle metabolism in peach fruit[J].Food Science, 2021, 42(13):158-165.
[3] CORPAS F J, BARROSO J B.Nitric oxide from a “green” perspective[J].Nitric Oxide, 2015, 45:15-19.
[4] 张静. 盐胁迫下NO和蛋白质S-亚硝基化对番茄幼苗生长发育的影响[D].兰州:甘肃农业大学, 2020:1-79.
ZHANG J.Effects of NO and protein S-nitrosylation on tomato seedlings growth and development under salt stress[D].Lanzhou:Gansu Agricultural University, 2020:1-79.
[5] 黄波, 陈畅.一氧化氮的功能及其作用机制(Ⅱ):蛋白质巯基亚硝基化修饰[J].生物物理学报, 2012, 28(4):268-277.
HUANG B, CHEN C.Function and mechanism of nitric oxide (Ⅱ):Mechanism and protein S-nitrosation[J].Acta Biophysica Sinica, 2012, 28(4):268-277.
[6] FARES A, ROSSIGNOL M, PELTIER J B.Proteomics investigation of endogenous S-nitrosylation in Arabidopsis[J].Biochemical and Biophysical Research Communications, 2011, 416(3-4):331-336.
[7] LIN A H, WANG Y Q, TANG J Y, et al.Nitric oxide and protein S-nitrosylation are integral to hydrogen peroxide-induced leaf cell death in rice[J].Plant Physiology, 2012, 158(1):451-464.
[8] 王鲁阳, 吴斌, 敬媛媛, 等.一氧化氮(NO)熏蒸提高哈密瓜果实采后贮藏的耐冷性[J].现代食品科技, 2018, 34(4):114-120;178.
WANG L Y, WU B, JING Y Y, et al.Enhancement of chilling tolerance of hami melon fruits in postharvest storage period by using nitric oxide fumigation[J].Modern Food Science &Technology, 2018, 34(4):114-120;178.
[9] 田全明, 王曼, 魏佳, 等.真空预冷结合氮气处理对新疆小白杏采后品质的影响[J].食品与发酵工业, 2021,47(19):189-194.
TIAN Q M, WANG M, WEI J, et al.The effect of vacuum precooling combined with nitrogen treatment on postharvest quality of Xiaobai apricot in Xinjiang[J].Food and Fermentation Industries, 2021,47(19):189-194.
[10] DING A H, NATHAN C F, STUEHR D J.Release of reactive nitrogen intermediates and reactive oxygen intermediates from mouse peritoneal macrophages.Comparison of activating cytokines and evidence for independent production[J].Journal of Immunology(Baltimore, Md.: 1950), 1988, 141(7):2 407-2 412.
[11] FRUNGILLO L, DE OLIVEIRA J F P, SAVIANI E E, et al.Modulation of mitochondrial activity by S-nitrosoglutathione reductase in Arabidopsis thaliana transgenic cell lines[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2013, 1 827(3):239-247.
[12] SAKAMOTO A, UEDA M, MORIKAWA H.Arabidopsis glutathione-dependent formaldehyde dehydrogenase is an S-nitrosoglutathione reductase[J].FEBS Letters, 2002, 515(1-3):20-24.
[13] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007:28-34.
CAO J K, JIANG W B, ZHAO Y M.Experimental Guidance on Physiology and Biochemistry of Fruits and Vegetable after Harvest[M].Beijing:China Light Industry Press, 2007:28-34.
[14] LAW M Y, CHARLES S A, HALLIWELL B.Glutathione and ascorbic acid in spinach (Spinacia oleracea) chloroplasts.The effect of hydrogen peroxide and of Paraquat[J].The Biochemical Journal, 1983, 210(3):899-903.
[15] BREHE J E, BURCH H B.Enzymatic assay for glutathione[J].Analytical Biochemistry, 1976, 74(1):189-197.
[16] NAKANO Y, ASADA K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].Plant and Cell Physiology, 1981, 22(5):867-880.
[17] CAI H F, HAN S, YU M L, et al.Exogenous nitric oxide fumigation promoted the emission of volatile organic compounds in peach fruit during shelf life after long-term cold storage[J].Food Research International, 2020, 133:109135.
[18] WANG D F, LIU Y G, TAN X F, et al.Effect of exogenous nitric oxide on antioxidative system and S-nitrosylation in leaves of Boehmeria nivea (L.) Gaud under cadmium stress[J].Environmental Science and Pollution Research, 2015, 22(5):3 489-3 497.
[19] LIU L M, HAUSLANDEN A, ZENG M, et al.A metabolic enzyme for S-nitrosothiol conserved from bacteria to humans[J].Nature, 2001, 410(6 827):490-494.
[20] LINDERMAYR C, SAALBACH G, DURNER J.Proteomic identification of S-nitrosylated proteins in Arabidopsis[J].Plant Physiology, 2005, 137(3):921-930.
[21] NIU L J, YU J H, LIAO W B, et al.Proteomic investigation of S-nitrosylated proteins during no-induced adventitious rooting of cucumber[J].International Journal of Molecular Sciences, 2019, 20(21):5363.
[22] WANG Y S, LUO Z S, DU R X.Nitric oxide delays chlorophyll degradation and enhances antioxidant activity in banana fruits after cold storage[J].Acta Physiologiae Plantarum, 2015, 37(4):74.
[23] MA Y Y, HUANG D D, CHEN C B, et al.Regulation of ascorbate-glutathione cycle in peaches via nitric oxide treatment during cold storage[J].Scientia Horticulturae, 2019, 247:400-406.
[24] YANG H J, MU J Y, CHEN L C, et al.S-nitrosylation positively regulates ascorbate peroxidase activity during plant stress responses[J].Plant Physiology, 2015, 167(4):1 604-1 615.
[25] BEGARA-MORALES J C, S NCHEZ-CALVO B, CHAKI M, et al.Dual regulation of cytosolic ascorbate peroxidase (APX) by tyrosine nitration and S-nitrosylation[J].Journal of Experimental Botany, 2014, 65(2):527-538.
NCHEZ-CALVO B, CHAKI M, et al.Dual regulation of cytosolic ascorbate peroxidase (APX) by tyrosine nitration and S-nitrosylation[J].Journal of Experimental Botany, 2014, 65(2):527-538.