馅料作为众多食品中必不可缺的构成部分和食品工业的重要基础原辅料,其市场潜力巨大,发展前景广阔。报道表明,2018年我国焙烤食品行业市场规模为2 471亿元,其利润增长速度明显超过行业平均增速[1-2]。受益于消费者对新鲜水果口味的喜爱和即食焙烤食品的需求,带有果蔬类馅料的焙烤食品成为目前食品行业增长最快的部分之一[3],作为焙烤食品中的重要构成部分,食品馅料的作用日益突出。
果蔬类馅料是食品馅料的一种,是以果蔬原料或其制品为基料,添加或者不加糖及其他辅料,经预处理、加热成型、杀菌和包装等工序所制备的产品[4]。不恰当的加工方式和贮藏环境会提高果蔬类馅料褐变速率,并导致负面的颜色变化,不仅影响馅料综合感官品质,更会降低消费者的购买欲望。果蔬类馅料褐变是酶促褐变和非酶促褐变共同作用的结果,酶促褐变是多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)作用的结果,主要发生于果蔬原料前处理过程中,其原因可解释为由于果蔬原料结构被破坏,其内部酚类化合物被氧化成醌,从而使其颜色发生褐变[5]。目前针对果蔬原料加工前处理所发生的酶促褐变已有较为成熟的应对方法,采用护色剂或适当热处理可以有效抑制果蔬原料过程中的酶促褐变[6],而果蔬类馅料加工与贮藏期间的褐变积累主要归因于非酶促褐变反应[7],抗坏血酸、类胡萝卜素、多酚等活性物质降解、氧化-缩合反应及美拉德反应被认为是导致果蔬类馅料褐变的主要非酶反应途径[8]。食品系统的非酶褐变反应中,多种途径可能同时发生,非酶褐变反应的机制是复杂的,不同的类型产品其褐变主导反应类型亦存在差异。因此,探究不同产品中褐变的主要途径,并通过采取对应措施控制其关键因素,可达到有效缓解产品褐变的目的。
目前,针对果蔬类食品馅料研究主要集中于对产品加工工艺的优化,产品品质评价与控制,不同类型馅料产品的创制等方向,而对于其褐变途径和色泽控制的探究相对较少。本试验以枸杞馅料为原料,探究不同贮藏温度条件下枸杞馅料贮藏过程中的褐变度及褐变相关物质变化情况,并通过相关性和主成分分析(principal components analysis,PCA)探究影响其褐变主要因素,为不同贮藏条件下食品馅料褐变提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
宁夏枸杞,中宁县茂源枸杞商贸有限公司;冬瓜蓉,自制;麦芽糖醇,山东福田药业有限公司;真空包装袋(PET材质),北国包装有限公司。
正己烷、丙酮、乙醇、乙酸、乙腈(色谱纯)、盐酸、甲醇、碳酸钠、DPPH、福林酚、2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT),国药集团化学试剂公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
PB12X1-10B破壁机,美的集团有限公司;DHG 101-3A型电热恒温烘箱,上海喆钛机械制造有限公司;BCD-521WDPW型海尔冰箱,青岛海尔股份有限公司;MJX-250B-Z型培养箱,上海博讯视野有限公司;CR22GⅢ高速冷冻离心机,上海仪电科技股份有限公司;LC-20AT液相色谱仪,日本岛津公司;UV-1800紫外/可见分光光度计,日本Shimadzu公司。
1.3 枸杞馅料制备及贮藏
1.3.1 冬瓜蓉制备
取若干质量冬瓜原料,经削皮去瓤后,切成均匀块状,清洗后至于破壁机中,获得水分含量(78.0±1.2)%冬瓜蓉样品,随后置于-20 ℃冷库中速冻存储备用。
1.3.2 枸杞馅料制备
取若干质量枸杞干果[水分含量(15.0±0.2)%],按料液比1∶3(质量比)复水30 min,复水完成后晾置10 min去除多余水分,将复水后枸杞置于打浆机中破碎2 min,制备得枸杞浆[水分含量(83.0±0.7)%]。
参考唐晓凤[9]馅料制备工艺,略作修改。将枸杞浆与冬瓜蓉按1∶4(质量比)置于炒锅中斩拌均匀,加入一定质量的麦芽糖醇,定温120 ℃炒制17 min,炒制枸杞馅料水分含量为(38.0±0.5)%,糖含量为(50.0±0.8)%,随即对所得馅料进行真空包装。
1.3.3 枸杞馅料贮藏试验方案
将炒制完成的枸杞馅料用真空包装后,分别置于4、25、37 ℃条件下贮藏60 d,每隔10 d测定其褐变度、5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)、类胡萝卜素、抗坏血酸、总酚、还原糖、氨基态氮含量。
1.4 实验方法
1.4.1 褐变度
参考ALAGÖEZ等[10]方法并略作修改,将样品用蒸馏水稀释至11.5°Brix,在10 000 r/min下离心5 min,取上清液,以蒸馏水为对照,420 nm处测量上清液吸光值,以馅料样品在420 nm处的吸光度表征其贮藏过程中的褐变度。
1.4.2 总类胡萝卜素含量测定
参考KNOCKAERT等[11]方法并略作修改,称取不同贮藏温度条件下枸杞馅料各0.5 g置于100 mL三角瓶中,加入50 mL提取液(含体积分数为50%的正己烷,25%的丙酮,25%的乙醇,质量分数为0.1%的BHT),搅拌20 min。向上述溶液中加入15 mL蒸馏水和0.5 g NaCl,搅拌10 min,将混合物放入分液漏斗,收集有机相并定容。定容后样品在450 nm下测定吸光值,以含0.1% BHT的正己烷为空白,总类胡萝卜素质量分数按照公式(1)计算:
总类胡萝卜素含量![]()
(1)
式中:A为450 nm处的吸光值;V为提取液总体积,mL;m为样品质量,![]() 为β-胡萝卜素在正己烷中的消光系数,2 560。整个操作在避光条件下进行。
为β-胡萝卜素在正己烷中的消光系数,2 560。整个操作在避光条件下进行。
1.4.3 5-HMF含量测定
参考ALAGÖEZ等[10]的方法制备测定液,采用高效液相色谱法测定测定5-HMF含量。液相分析条件:色谱柱Agilent Zorbax Eclipse XDB-C18(4.6 mm×250 mm,5 μm),柱温30 ℃;紫外检测波长为284 nm;流动相A为乙腈,流动相C为0.4%乙酸。梯度洗脱程序如下:0~8 min,5% C;8~30 min,5%~20% C;30~35 min,5% C;流速1 mL/min;进样量10 μL。每组样品测定3次。
1.4.4 总酚含量测定
参考吕海洋[12]方法并略作修改,采用分光光度计法测定总多酚含量。
1.4.5 氨基态氮含量测定
参考GB/T 12143—2008,采用甲醛值法测定枸杞馅料中氨基态氮的含量,计算如公式(2)所示:
(2)
式中:X为每100 g中馅料样品中氨基态氮毫克数,mg/100 g;c为NaOH滴定液的浓度,mol/L;V为样品消耗的NaOH滴定液的体积,mL;K为稀释比,m为样品质量,g。
1.4.6 还原糖含量测定
还原糖的测定参考WANG等[13]方法,采用3,5-二硝基水杨酸法进行测定。
1.5 数据处理
每组实验3个平行,数据用Excel 2015进行整理,采用SPSS 23.0进行单因素方差分析(ANOVA)、邓肯(Duncan)多重比较、相关性分析及PCA,结果均以“平均值±标准差”表示。用Origin 2017进行图表绘制。
2 结果与分析
2.1 不同温度下枸杞馅料褐变度变化
褐变度常被用于表示贮藏过程中样品棕色色素的生成程度[14],样品褐变度的增加主要是因其贮藏过程中非酶促褐变所导致的棕色物质的形成和积累,因此可将褐变度作为评价样品非酶促褐变程度的指标[15]。不同贮藏温度条件下枸杞馅料褐变度如图1所示,随着贮藏时间的延长,不同温度下枸杞馅料的褐变度呈现不同变化,4 ℃贮藏样品褐变度略有上升,但差异不显著(P>0.05),而25 ℃和37 ℃贮藏样品褐变度显著上升(P<0.05)。整个贮藏期内,25 ℃贮藏样品的褐变度数值始终低于37 ℃,这与TÜRKY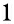 LMAZ等[16]在5、20、30 ℃下贮藏杏干的研究结果类似,随着贮藏温度的提高,样品褐变程度显著增大,表明高温会加快样品非酶促褐变速率。
LMAZ等[16]在5、20、30 ℃下贮藏杏干的研究结果类似,随着贮藏温度的提高,样品褐变程度显著增大,表明高温会加快样品非酶促褐变速率。

图1 不同贮藏温度对枸杞馅料褐变度的影响
Fig.1 Effects of different storage temperature conditions on browning degree of wolfberry fillings
注:大写字母不同表示相同温度不同贮藏时间样品差异显著(P<0.05),小写字母不同表示相同贮藏时间不同温度间样品显著差异(P<0.05)(下同)
2.2 不同温度下枸杞馅料5-HMF含量变化
5-HMF是果糖或葡萄糖等物质在高温或者酸性条件下,经加氢或脱水反应而生成的一类醛类化合物[17],美拉德反应与焦糖化反应被认为是热加工过程中生成5-HMF的主要途径[18],作为其反应中产生的重要特征产物,5-HMF积累与褐变速率有紧密联系。由图2可知,炒制完成后馅料中5-HMF含量为(2.86±0.07) mg/kg,随着贮藏时间的延长,不同贮藏温度下枸杞馅料中5-HMF含量显著增加(P<0.05),不同温度条件下贮藏10 d枸杞馅料与未贮藏枸杞馅料5-HMF含量无显著差异(P >0.05),而贮藏10 d后其5-HMF含量显著增加(P<0.05),说明贮藏过程中5-HMF的生成是一个逐步积累过程,且后期生成速率略高于前期。贮藏60 d后,枸杞馅料内5-HMF含量高低排序为37 ℃>25 ℃>4 ℃,且存在显著性差异(P<0.05),说明在4~37 ℃,枸杞馅料中5-HMF含量增长速率与贮藏温度呈正相关。研究表明,糖含量较高食品在热加工及贮藏过程中易生成5-HMF,其含量可用于衡量食品热加工处理及贮藏时间、温度合理程度[19],贮藏30 d后37 ℃贮藏枸杞馅料5-HMF含量显著高于4 ℃和25 ℃贮藏样品,说明枸杞馅料更适宜于4 ℃和25 ℃条件下贮藏。

图2 不同贮藏温度对枸杞馅料5-HMF含量的影响
Fig.2 Effects of different storage temperature conditions on 5-HMF content of wolfberry fillings
2.3 不同温度下枸杞馅料总类胡萝卜素含量变化
类胡萝卜素是一类存在于枸杞原料中的主要色素物质,枸杞中主要类胡萝卜素物质为玉米黄质双棕榈酸酯、玉米黄素、β-胡萝卜素和叶黄素,其对色素性视网膜炎和白内障具有预防作用,并对激素、免疫、基因等功能具有调节作用[20]。枸杞馅料的加工与贮藏导致了类胡萝卜素等物质的流失,由图3可知,经炒制后的枸杞馅料总类胡萝卜素含量为(97.85±0.95) μg/g,随着贮藏时间的延长,不同温度下枸杞馅料类胡萝卜素含量均显著降低(P<0.05),表明类胡萝卜素在贮藏期间出现降解现象,而贮藏期间4 ℃下贮藏的枸杞馅料中类胡萝卜素含量始终高于25 ℃和37 ℃,说明低温条件更有利于延缓枸杞馅料类胡萝卜素的降解。COOPERSTONE等[21]研究表明,氧、光照和酸性环境是导致类胡萝卜素降解的重要因素,低温条件下类胡萝卜素稳定,高温易导致其降解,而高温和酸性环境的降解作用主要源于类胡萝卜素的异构化,温度升高,类胡萝卜素异构化现象加剧,导致降解速率提升。

图3 不同贮藏温度对枸杞馅料类胡萝卜素含量的影响
Fig.3 Effects of different storage temperature conditions on carotenoid content of wolfberry fillings
2.4 不同温度下枸杞馅料总酚含量变化
酚类物质的氧化聚合及抗坏血酸的氧化分解被认为是非酶促褐变的主要途径之一[22],炒制后枸杞馅料中未检出抗坏血酸物质(数据未展示),这可能是由于馅料高温炒制过程中抗坏血酸被完全降解。不同贮藏温度条件下枸杞馅料总酚含量变化结果如图4所示,炒制后枸杞馅料总酚含量为(1.07±0.14) mg/g,随着贮藏时间的延长,不同温度组别总酚含量均显著降低(P<0.05),其中37 ℃贮藏组总酚含量下降最快,贮藏0~60 d其含量下降73.8%,说明枸杞馅料内部大部分酚类物质被氧化聚合,25 ℃ 和4 ℃贮藏组与37 ℃组下降幅度类似,但总酚保留率较37 ℃组更高。ZHAO等[23]研究表明,酚类物质在酸性条件下易发生氧化聚合,并生成棕色物质,其内部酚类物质的降解说明其在贮藏过程中参与了非酶促褐变反应。

图4 不同贮藏温度对枸杞馅料总酚含量的影响
Fig.4 Effects of different storage temperature conditions on total polyphenols content of wolfberry fillings
2.5 不同温度下枸杞馅料还原糖和氨基态氮含量变化
还原糖与氨基酸在酸性条件下所发生的羰氨反应是美拉德反应体系的重要特性之一,会对馅料的风味和颜色产生重要影响[24],如图5所示,随着贮藏时间的延长,各组还原糖含量与氨基态氮含量呈下降趋势,贮藏初期4 ℃组和25 ℃组下降缓慢,30 d时还原糖含量仅下降9.33%~21.12%,30 d后各组还原糖下降速度较30 d前提升,贮藏60 d后,4 ℃组和25 ℃组还原糖含量为初始值的57.95%~62.49%;而37 ℃组,仅为初始值的32.54%。

a-还原糖;b-氨基态氮
图5 不同贮藏温度对枸杞馅料还原糖和氨基态氮的影响
Fig.5 Effects of different storage temperature conditions on reducing sugar and amino nitrogen content of wolfberry fillings
与还原糖变化趋势类似,不同温度条件下,各组氨基态氮含量均呈下降趋势,37 ℃组氨基态氮含量下降趋势最为显著,表明37 ℃贮藏过程中馅料中氨基态氮损失量最大。贮藏温度越高,枸杞馅料还原糖和氨基酸损失越大。研究显示,具有羰基结构的还原糖与氨基结构的氨基酸在酸性条件下通过聚合、缩合发生羰氨反应,并生成代表性产物5-HMF,贮藏过程中羰氨反应的反应速率随褐变温度条件的变化而变化,高温条件会加速其羰氨反应,从而导致还原糖与氨基酸损失更大[25]。
2.6 相关性分析
以褐变度来表征枸杞馅料非酶促褐变情况,由表1可知,25 ℃组与37 ℃组类胡萝卜素、总酚、还原糖和氨基态氮的含量均与褐变度呈负相关,而5-HMF含量与褐变度呈正相关。4 ℃贮藏温度下褐变度与各因子间均不存在显著相关(P >0.05),这可能是由于4 ℃条件下馅料褐变度低;而25 ℃组和37 ℃组褐变度与5-HMF、总酚、还原糖、氨基态氮呈极显著相关(P<0.01)。4 ℃组与25 ℃组褐变度与类胡萝卜素不存在显著相关,而37 ℃组褐变度与类胡萝卜素同样呈显著相关(P < 0.05),说明在4 ℃和25 ℃条件下,类胡萝卜素含量变化并非影响枸杞馅料褐变主要因素。相关性研究结果表明,枸杞馅料贮藏过程中褐变度受不同温度影响显著。
表1 不同贮藏温度下枸杞馅料各项指标相关性分析
Table 1 Correlation analysis of various indexes of wolfberry fillings under different storage temperature conditions

温度/℃测定指标褐变度5-HMF类胡萝卜素总酚还原糖氨基态氮褐变度10.224-0.1260.1020.042-0.575-HMF1-0.923**-0.803*-0.72-0.6814类胡萝卜素10.956**0.855*0.634总酚10.838*0.467还原糖10.684氨基态氮1褐变度10.920**-0.751-0.953**-0.898**-0.828*5-HMF1-0.907**-0.835*-0.982**-0.966**25类胡萝卜素10.985**0.926**0.971**总酚10.853*0.926**还原糖10.962**氨基态氮1褐变度10.918**-0.802*-0.936**-0.971**-0.967**5-HMF1-0.883**-0.947**-0.974**-0.938**37类胡萝卜素10.967**0.899**0.918**总酚10.759*0.798*还原糖10.983**氨基态氮1
注:*表示两个指标在0.05水平上存在显著相关性(双边);**表示两个指标在0.01水平上存在显著相关性(双边)
2.7 主成分分析法评价影响枸杞馅料褐变主要因素
不同温度下枸杞馅料褐变的影响因子之间存在密切关联,对不同温度条件下枸杞馅料的褐变度、5-HMF、类胡萝卜素、总酚、还原糖、氨基态氮进行PCA,主成分特征值及贡献率结果见表2。PCA法共提取出2个主成分,第一主成分PC1贡献率达到87.037%,第二主成分PC2贡献率为9.226%,2个主成分累计贡献率达96.263%,说明其可充分反映样品褐变因子的主要信息。
表2 主成分特征值及贡献率
Table 2 Principal component eigenvalue and contribution rate

成分特征值贡献率/%累计贡献率/%15.22287.03787.03720.5549.22696.263
由图6可知,不同温度下枸杞馅料PC1中大于0.8的指标有褐变度、5-HMF含量、类胡萝卜素含量、总酚含量、还原糖含量和氨基态氮含量,表明非酶褐变过程中可能发生的主要化学转化包括美拉德反应等褐变反应[26]。美拉德反应包括一系列复杂的反应,样品中活性羰基(如还原糖的羰基)与氨基(通常来自蛋白质或氨基酸)发生结合,并生成棕色物质[27]。枸杞馅料中还原糖和氨基态氮含量成分载荷最高,表明贮藏过程中馅料发生的美拉德反应是导致馅料褐变的主要因素。

图6 不同贮藏温度枸杞馅料PCA得分与载荷图
Fig.6 PCA score and load diagram of wolfberry fillings at different storage temperature conditions
氨基态氮与还原糖均分布于Y轴右侧且距离较近,说明其关联程度较高,而5-HMF与褐变度均分布于Y轴左上方,说明5-HMF含量增加与褐变度存在直接联系。不同温度处理组前期主要分布于Y轴右侧区域,说明前期褐变的积累主要与活性物质降解及美拉德反应有关,可认为贮藏前期类胡萝卜素物质、酚类物质、还原糖及氨基酸均参与了枸杞馅料褐色物质的生成,此时不同反应同时进行,但反应速率及途径各不相同。37 ℃组40~60 d其主要位于Y轴左上方,靠近5-HMF与褐变度分布,说明37 ℃条件下,枸杞馅料贮藏后期其褐色物质的积累主要来源于美拉德反应。
3 结论与讨论
对不同温度下枸杞馅料贮藏过程中色泽及成分变化进行分析,随着贮藏时间延长,枸杞馅料褐变度、5-HMF含量上升,而总酚、类胡萝卜素、还原糖、氨基态氮含量下降,说明枸杞馅料贮藏过程中存在褐变现象,其中4 ℃褐变度最低,25 ℃次之,而37 ℃最高,说明不同温度条件对馅料褐变影响较大,25 ℃和37 ℃下枸杞馅料贮藏过程中所发生的非酶促褐变是酚类物质氧化和美拉德反应等综合作用的结果,37 ℃组后期褐色物质的积累主要来源于美拉德反应。
非酶促褐变是食品贮藏过程中普遍存在的现象,不同类型食品其非酶促褐变反应速率和主要反应途径存在差异,牛丽影等[28]通过研究影响不同温度条件下草莓脯褐变因素,表明草莓脯褐变主要由氧化褐变和美拉德褐变两种途径形成。DAMASCENO等[29]研究表明,抗坏血酸的降解是导致橙汁贮藏过程中褐变的主要因素。枸杞馅料作为一类高糖食品,温度与时间会对馅料非酶促褐变产生重要影响,37 ℃馅料贮藏条件下馅料褐变速度加快,说明枸杞馅料更适宜于低温或常温贮藏,而高温条件会加速其美拉德反应的发生,提高褐变速率,从而降低色泽品质。因此,通过采取有效措施,改进包装方式或改善贮藏条件等,对减缓贮藏过程中馅料品质劣变速率,推动馅料产业发展具有重要意义。
[1] 佳音. 我国烘焙行业潜力大增速快[J].中国食品工业, 2021(11):94-97.
JIA Y.China′s baking industry has great potential and fast growth[J].China Food Industry, 2021(11):94-97.
[2] 周康宁. 果酥馅料热加工过程中内源性有害物形成规律及影响因素研究[D].广州:暨南大学, 2020.
ZHOU K N.Research on the formation of endogenous harmful substances during the preparation of fruit-filled pastries and their influencing factors[D].Guangzhou:Jinan University, 2020.
[3] CROPOTOV A J, TYLEWICZ U, DELLAROSA N, et al.Effect of freezing on microstructure and degree of syneresis in differently formulated fruit fillings[J].Food Chemistry, 2016, 195(15):71-78.
[4] ZHENG J, WU Z J, YANG N, et al.Widely targeted UHPLC-MS/MS metabolomic analysis on the chemical variation in blueberry-filled pastries during processing[J].Frontiers in Nutrition, 2020, 7:569172.
[5] MOON K M, KWON E B, LEE B, et al.Recent trends in controlling the enzymatic browning of fruit and vegetable products[J].Molecules, 2020, 25(12):2754.
[6] SANCHEZ-VEGA R, MUJICA-PAZ H, MARQUEZ-MELENDEZ R, et al.Enzyme inactivation on apple juice treated by ultrapasteurization and pulsed electric fields technology[J].Journal of Food Processing and Preservation, 2009, 33(4):486-499.
[7] CHEN Y Y, ZHANG M, MUJUMDAR A S, et al.Combination of epigallocatechin gallate with l-cysteine in inhibiting Maillard browning of concentrated orange juice during storage[J].LWT, 2022, 154:112604.
[8] BHARATE S S, BHARATE S B.Non-enzymatic browning in citrus juice:Chemical markers, their detection and ways to improve product quality[J].Journal of Food Science and Technology, 2014, 51(10):2 271-2 288.
[9] 唐晓凤. 柿子全果月饼馅料的研制及贮藏特性研究[D].武汉:华中农业大学, 2016.
TANG X F.The development of the whole persimmon moon cake′s fillings and the study on their storage properties[D].Wuhan:Huazhong Agricultural University, 2016.
[10] ALAGÖEZ S, TÜERKYILMAZ M, ![]() S, et al.Effects of different sorbic acid and moisture levels on chemical and microbial qualities of sun-dried apricots during storage[J].Food Chemistry, 2015, 174:356-364.
S, et al.Effects of different sorbic acid and moisture levels on chemical and microbial qualities of sun-dried apricots during storage[J].Food Chemistry, 2015, 174:356-364.
[11] KNOCKAERT G, LEMMENS L, VAN BUGGENHOUT S, et al.Changes in β-carotene bioaccessibility and concentration during processing of carrot puree[J].Food Chemistry, 2012, 133(1):60-67.
[12] 吕海洋. 枸杞多酚的结构鉴定及抗氧化活性评价[D].北京:中国农业科学院, 2016.
LYU H Y.Structural identification and antioxidant activity evaluation of Lycium barbarum polyphenols[D].Beijing:Chinese Academy of Agricultural Sciences, 2016.
[13] WANG C, ZHANG X L, GAO Y, et al.Path analysis of non-enzymatic browning in Dongbei Suancai during storage caused by different fermentation conditions[J].Food Chemistry, 2021, 335:127620.
[14] KRISHNAN J G, PADMAJA G, MOORTHY S N, et al.Effect of pre-soaking treatments on the nutritional profile and browning index of sweet potato and yam flours[J].Innovative Food Science and Emerging Technologies, 2010, 11(2):387-393.
[15] PHAM H T T, BAZMAWE M, KEBEDE B, et al.Changes in the soluble and insoluble compounds of shelf-stable orange juice in relation to non-enzymatic browning during storage[J].Journal of Agricultural and Food Chemistry, 2019, 67(46):12 854-12 862.
[16] TÜRKY LMAZ M,
LMAZ M, ![]()
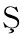 , ÖZKAN M..Changes in chemical and microbial qualities of dried apricots containing sulphur dioxide at different levels during storage[J].Food and Bioprocess Technology, 2013, 6(6):1 526-1 538.
, ÖZKAN M..Changes in chemical and microbial qualities of dried apricots containing sulphur dioxide at different levels during storage[J].Food and Bioprocess Technology, 2013, 6(6):1 526-1 538.
[17] 彭健, 王蔚婕, 唐道邦, 等.分段式远红外-热泵干燥对龙眼品质的影响[J].食品科学, 2020, 41(19):118-123.
PENG J, WANG W J, TANG D B, et al.Effect of multi-stage far-infrared radiation-assisted heat pump drying on the quality characteristics of Longan[J].Food Science, 2020, 41(19):118-123.
[18] NGUYEN H T, VAN DER FELS-KLERX H J, VAN BOEKEL M A J S.Acrylamide and 5-hydroxymethylfurfural formation during biscuit baking.part II:Effect of the ratio of reducing sugars and asparagine[J].Food Chemistry, 2017, 230:14-23.
[19] 孙颖, 张莉莉, 张玉玉, 等.6种糖-酶解液模型体系中5-羟甲基糠醛的形成动力学分析[J].食品科学, 2018, 39(23):73-79.
SUN Y, ZHANG L L, ZHANG Y Y, et al.Kinetic studies on 5-hydroxymethylfurfural formation in six sugar-enzymatic protein hydrolysate model systems[J] Food Science, 2018, 39(23):73-79.
[20] LUO Y M, LIU Y, GUO H, et al.Evaluation of the bioaccessibility of carotenoid esters from Lycium barbarum L.in nano-emulsions:A kinetic approach[J].Food Research International, 2020, 136:109611.
[21] COOPERSTONE J L, FRANCIS D M, SCHWARTZ S J.Thermal processing differentially affects lycopene and other carotenoids in cis-lycopene containing, tangerine tomatoes[J].Food Chemistry, 2016, 210:466-472.
[22] ZHOU Z Q, XIAO J, FAN H X, et al.Polyphenols from wolfberry and their bioactivities[J].Food Chemistry, 2017, 214:644-654.
[23] ZHAO X, HRYNETS Y, BETTI M.Cold non-enzymatic browning of glucosamine in the presence of metmyoglobin induces glucosone and deoxymyoglobin formation[J].Food Chemistry, 2020, 305:125504.
[24] PARAVISINI L, PETERSON D G.Mechanisms non-enzymatic browning in orange juice during storage[J].Food Chemistry, 2019, 289:320-327.
[25] CHEN Y Z, LIN H T, LI Y J, et al.Non-enzymatic browning and the kinetic model of 5-hydroxymethylfurfural formation in residual solution of vinegar soaked-soybean[J].Industrial Crops and Products, 2019, 135:146-152.
[26] NGUYEN H T, VAN DER FELS-KLERX H J, PETERS R J B, et al.Acrylamide and 5-hydroxymethylfurfural formation during baking of biscuits:Part I:Effects of sugar type[J].Food Chemistry, 2016, 192:575-585.
[27] ROLANDELLI G, FAVRE L C, MSHICILELI N, et al.The complex dependence of non-enzymatic browning development on processing conditions in maize snacks[J].LWT, 2021, 147:111636.
[28] 牛丽影, 胡丽丽, 李大婧, 等.草莓脯贮藏期间非酶褐变的化学途径分析[J].食品科学, 2022,43(17):248-254.
NIU L Y, HU L L, LI D J, et al.Chemical pathway analysis of non-enzymatic browning of preserved strawberry during storage[J].Food Science, 2022,43(17):248-254.
[29] DAMASCENO L F, FERNANDES F A N, MAGALH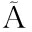 ES M M A, et al.Non-enzymatic browning in clarified cashew apple juice during thermal treatment:Kinetics and process control[J].Food Chemistry, 2008, 106(1):172-179.
ES M M A, et al.Non-enzymatic browning in clarified cashew apple juice during thermal treatment:Kinetics and process control[J].Food Chemistry, 2008, 106(1):172-179.