镇远道菜是以笋子芥(Brassica juncea L.var.crassicaulis Chen &Yang)为主要原料,配以食盐、白酒等辅料,经盐渍、发酵、日晒、搓揉等工艺制作而成的固态酱腌菜[1]。笋子芥,别称棒菜,是泡菜加工的常用原料,具有风味鲜香、质地脆嫩等特性[2-3],含有硫代葡萄糖苷、黄酮、多酚和异硫氰酸酯类活性物质[4-5]。传统自然发酵蔬菜因缺乏对发酵过程的有效控制而导致亚硝酸盐和生物胺(biogenic amines,BAs)等物质出现积累甚至超标[6]。BAs是一类含氮有机化合物,主要由氨基酸脱羧酶阳性菌(产胺菌)在适宜条件下对各类游离氨基酸脱羧而成,食品中常见的BAs有组胺、酪胺、色胺、腐胺、亚精胺、苯乙胺和尸胺[7-8]。
近年来研究发现,部分微生物可抑制食品发酵过程中BAs的形成[9],SIVAMARUTHI等[10]指出植物乳杆菌(Lactobacillus plantarum)、戊糖片球菌(Pediococcus pentosaceus)、解淀粉芽胞杆菌(Bacillus amyloliquefaciens)等作为发酵剂时能有效降低发酵样品中BAs的含量。RABIE等[11]研究证实接种干酪乳杆菌(Lactobacillus casei)、植物乳杆菌能有效降低酸菜中BAs的含量。夏学超等[12]对比辣椒自然发酵和接种降胺菌发酵过程中BAs的变化,结果表明接种植物乳杆菌发酵的辣椒中BAs含量显著降低。
随着现代仪器分析技术的发展,发酵食品中BAs的研究热点正逐渐从降胺菌的筛选向降胺菌对发酵产品风味的影响方向延伸。王德宝等[13]利用植物乳杆菌与肉葡萄球菌(Staphylococcus meatus)发酵香肠,在有效抑制产品中亚硝酸盐和BAs生成的同时,形成了己醛、硝酸乙酯、2-甲基-丙酸甲酯等独特的风味物质。SUN等[14]研究发现纯种发酵不仅能降低哈尔滨发酵红肠中BAs的含量,还能保持其典型风味和品质。LIU等[15]在黄酒工艺前段接入植物乳杆菌JN01,结果发现接种降胺菌的实验组和自然发酵对照组之间基本理化性质和风味成分无显著差异,但实验组的BAs含量较对照组明显降低了31.7%。目前,暂无关于道菜发酵过程降胺菌对产品风味物质和BAs含量的研究报道。
气相离子迁移谱法(headspace-gas chromatography-ion mobility spectroscopy,GC-IMS)是近年来出现的一种适用于挥发性有机化合物痕量检测的技术,具有灵敏度高、分辨率高、操作简便、分析高效等优点[16]。本研究以镇远道菜为研究对象,采用GC-IMS和HPLC对原料笋子芥及其不同发酵方式下道菜产品中挥发性风味物质和BAs含量进行测定与分析,结合主成分分析(principal component analysis,PCA)确定不同发酵方式对道菜风味的影响,为推进生物胺降解菌在发酵蔬菜加工中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
笋子芥(样品编号1):采自贵州省黔东南苗族侗族自治州镇远县;道菜(样品编号SC):来源于贵州省黔东南苗族侗族自治州镇远县李氏食品有限责任公司。
丹磺酰氯、腐胺、尸胺、亚精胺、色胺、苯乙胺、组胺、酪胺均为色谱纯,上海麦克林生化科技有限公司;乙腈(色谱纯),美国TEDIA公司;其他相关试剂均为国产分析纯;MRS培养基、LB培养基,上海微博微生物科技有限公司。
植物乳杆菌、戊糖片球菌和肠膜明串珠菌(Leuconostoc mesenteroides),来源于广东省生物菌种保藏中心;LS1-002-014解淀粉芽孢杆菌和LS1-003-016枯草芽孢杆菌(Bacillus subtilis),分离筛选自发酵道菜中,保藏于贵州省发酵工程与生物制药重点实验室。
1.2 仪器与设备
YXQ-LS-75G立式压力蒸汽灭菌锅、BMJ-250C培养箱,上海博讯实业有限公司医疗设备;JJ-CJ-IFD型超净工作台,苏州市金净净化设备科技有限公司;正置荧光显微镜,奥林巴斯Olympus;Heraeus Multifuge X3R冷冻离心机,美国Thermo Fisher公司;1260Infinity高效液相色谱仪,美国安捷伦有限公司;FlavourSpec®气相离子迁移谱联用仪,德国G.A.S.公司;JYL-C020E九阳榨汁搅拌机,九阳股份有限公司。
1.3 实验方法
1.3.1 不同发酵方式下道菜的制备
(1)道菜自然发酵后样品编号为SY1,工艺流程如下:
新鲜笋子芥→清洗→晾干→切分→搓盐(2.5%,质量分数)→挤干→发酵(28 ℃下发酵5 d)
(2)道菜纯种发酵工艺流程如下:
新鲜笋子芥→清洗→消毒[0.015%(质量分数)次氯酸钠浸泡10 min])→晾干→切分→搓盐(2.5%,质量分数)→挤干→接种发酵菌剂→发酵(28 ℃下发酵5 d)
设计以下3组发酵方式(每组设置3个平行):(1)降胺菌纯种发酵(样品编号SY2):发酵菌剂为解淀粉芽孢杆菌、枯草芽孢杆菌,质量比1∶1。(2)商业菌株发酵(样品编号SY3):发酵菌剂为植物乳杆菌、戊糖片球菌和肠膜明串珠菌,质量比1∶1∶1。(3)降胺菌+商业菌株发酵(样品编号SY4),发酵菌剂为解淀粉芽孢杆菌、枯草芽孢杆菌、植物乳杆菌、戊糖片球菌和肠膜明串珠菌,质量比1∶1∶1∶1∶1。
各发酵菌剂种子液于5 000 r/min离心10 min后收集菌泥,将收集的菌泥制备成约108 CFU/mL的菌悬液后备用,固定接种量为0.5%。
1.3.2 HPLC法测定BAs含量
1.3.2.1 色谱条件
SHIMADZU C18-AQ型色谱柱(5 μm,250 mm×4.6 mm);流动相A为水;流动相B为乙腈;进样量20 μL;柱温35 ℃;紫外检测波长254 nm,梯度洗脱程序参照文献[17]。
1.3.2.2 样品处理
参照SUN等[14]的方法进行BAs提取,称取5 g已破碎均匀的样品置于50 mL具塞离心管中,加入20 mL浓度为0.4 mol/L的高氯酸,混匀、振荡提取30 min,再置于4 ℃、5 000 r/min条件下离心10 min,取上清液备用。沉淀使用上述步骤再提取1次,合并上清液后用0.4 mol/L高氯酸定容至50 mL。标准曲线的绘制方法及柱前衍生方法参照文献[17]。
1.3.2.3 生物胺降解率计算
BAs降解率计算如公式(1)所示:
生物胺降解率![]()
(1)
式中:A1为自然发酵SY1组的生物胺含量,mg/kg;A2为纯种发酵实验组的生物胺含量,mg/kg。
1.3.3 GC-IMS法测定挥发性风味物质
1.3.3.1 样品处理和顶空进样条件
取样品2.0 g置于20 mL顶空瓶中,于60 ℃、500 r/min条件下孵化15 min,进样量为500 μL。
1.3.3.2 GC-IMS条件
GC条件:载气 N2(纯度≥99.999%);进样针温度85 ℃;MXT-5色谱柱(15 m×0.53 mm,1 μm);载气流量:0~2 min,2 mL/min;2~20 min,100 mL/min;分析时间20 min。
IMS 条件:漂移管长度98 mm;漂移管温度45 ℃;漂移气为高纯氮气(纯度≥99.999%);漂移气流速150 mL/min;β射线,3H为放射源;正离子化模式。
1.4 数据处理
GC-IMS配套的分析软件包括VOCal和三款插件(Reporter、Gallery Plot和Dynamic PCA),可以分别从不同角度对样品风味进行分析;每个指标测定重复3次,利用SPSS 26.0软件对数据进行标准化处理,Oringin 2018软件作图。
2 结果与分析
2.1 不同发酵方式下BAs含量的变化
BAs标准曲线的色谱图如图1所示,该方法对7种BAs具有较好的分离效果。
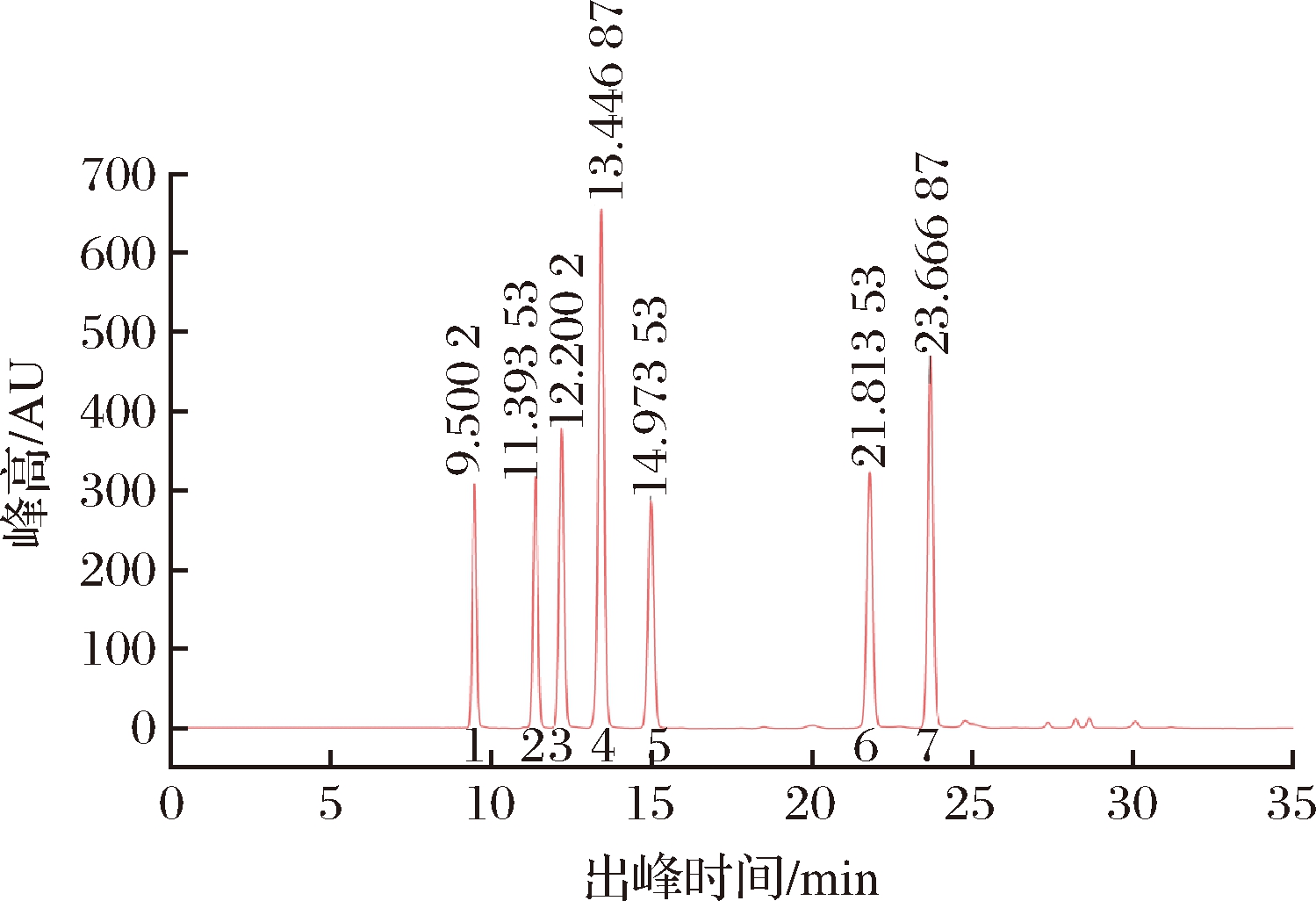
1-色胺;2-苯乙胺;3-腐胺;4-尸胺;5-组胺;6-酪胺;7-亚精胺
图1 七种标准生物胺的色谱图
Fig.1 Chromatogram of seven kinds of standard biogenic amines
将7种不同浓度的混合BAs从低浓度到高浓度依次进样后采用外标法定量测定,根据各BAs的峰面积与浓度关系进行线性回归,线性回归方程和相关系数如表1所示。
表1 七种BAs的线性回归方程和相关系数
Table 1 Linear regression equation and correlation coefficient of seven kinds of biogenic amine

BAs保留时间/min回归方程相关系数(R2)色胺 9.500 2y=25.478x+23.9890.997苯乙胺11.393 5y=27.79x+39.8760.999腐胺 12.200 2y=45.361x+9.9980.998尸胺 13.446 9y=40.28x+31.6380.999组胺 14.973 5y=34.22x+17.6690.999酪胺 21.835y=39.103x+58.1310.999亚精胺23.666 9y=65.97x+123.540.999
由表1可知,7种BAs标准曲线的相关系数都大于0.996,已满足线性分析要求。根据各BAs的线性回归曲线,计算出样品中BAs的含量。
由表2可知,道菜原料笋子芥经发酵后,成品中BAs的含量有不同程度的增加,不同发酵方式下道菜产品中BAs的含量和种类各不相同。就BAs种类而言,自然发酵道菜中检测出6种,纯种发酵道菜中有5种;就含量而言,自然发酵与纯种发酵样品间BAs含量具有显著性差异(P<0.05),且纯种发酵实验组中总BAs含量明显低于自然发酵组。结果发现工厂自然发酵的道菜中苯乙胺、组胺和酪胺含量较高,实验室自然发酵和纯种发酵的道菜中组胺和酪胺含量较高,这与夏学超等[12]的研究结论相似,其研究发现组胺和酪胺是发酵辣椒中含量最多的2种BAs;而YE等[18]研究也证实东北酸菜中BAs主要有尸胺、组胺、酪胺和亚精胺。研究还发现纯种发酵组样品中组胺、酪胺和亚精胺的含量较自然发酵组显著降低,说明BAs降解菌应用于道菜发酵过程中能降解组胺、酪胺和亚精胺等毒性较强的BAs,其中以SY4组样品中BAs降解效果最佳,对亚精胺、组胺和酪胺的降解率依次为58.08%、52.54%、43.42%。
表2 笋子芥及不同发酵方式下道菜中BAs的含量 单位:mg/kg
Table 2 The content of biogenic amines in Brassica juncea and Daocai in different fermentation methods

BAs1SCSY1SY2SY3SY4色胺 —0.067±0.002b0.743±0.015a———苯乙胺 —32.449±0.268a1.623±0.107c1.341±0.155c2.078±0.185b1.751±0.093c腐胺 ——————尸胺 0.790±0.026d0.562±0.002d1.519±0.106c3.063±0.085b3.689±0.252a1.636±0.192c组胺 1.581±0.024d16.386±0.083a10.152±1.756b9.905±1.577b6.582±1.055c4.818±0.166c酪胺 3.121±0.048d6.503±0.392b7.826±0.657a6.458±0.283b5.824±0.995b4.428±0.389c亚精胺 —2.661±0.078b3.633±0.011a2.954±0.033b3.030±0.487b1.523±0.125c总生物胺5.492±0.035e58.628±0.663a25.496±2.233b23.710±1.576bc21.203±1.029c14.156±0.128d
注:-表示未检出;每一行数据上标的字母不同,代表这两个数据之间具有显著性差异(P<0.05)
2.2 不同发酵方式道菜GC-IMS风味成分谱图分析
对不同发酵方式制作的道菜的风味成分分析,气相离子迁移谱结果如图2中所示,SY1-1、SY2-1、SY3-1、SY4-1分别对应4种不同发酵方式下道菜的GC-IMS二维图谱。纵坐标代表气相色谱的保留时间,横坐标代表离子迁移时间,整个图的背景为深蓝色,RIP峰两侧的每一个点代表一种挥发性有机物,颜色越深代表浓度越大,白色表示浓度低,红色表示浓度高。从色彩角度观察图2,发现4个不同发酵组道菜之间的挥发性有机化合物较为相似但又存在区别,仅从色彩角度直观分析不好区分。

图2 不同发酵方式下道菜的气相离子迁移谱
Fig.2 Gas phase ion migration spectra in fermented Daocai with different fermentation methods
图3为离子迁移谱差异图,以最左侧SY1为参照,其他几张谱图中浓度相同的物质颜色抵消为白色。被参比样品中的蓝色区域表示该物质浓度低于参比样品,蓝色越深,表示浓度越低;被参比样品中的红色区域表示该物质浓度高于参比样品,红色越深,表示浓度越高。由图3中方框内颜色差异可知,接种了商业菌的样品SY3、SY4中某些挥发性物质含量更高。该发现与LIANG等[19]研究结果一致,植物乳杆菌可显著提高酸菜中醇、酯、醛等挥发性化合物的浓度。

图3 不同发酵方式下道菜的 GC-IMS差谱图
Fig.3 GC-IMS differential chart in Daocai with different fermented methods
2.3 不同发酵方式下道菜样品中挥发性物质定性分析
根据挥发性风味物质的迁移时间、保留时间和保留指数,与GC-IMS的数据库对比,实现对挥发性风味物质的定性。不同发酵方式下道菜样品中共鉴定出47种挥发性物质,其中异硫氰酸酯类4种,酯类12种,醇类10种,酮类3种,醛类9种,酸类3种,杂环类4种,烯类2种,如表3所示。
表3 不同发酵方式下道菜样品中挥发性物质定性分析结果
Table 3 Qualitative analysis of volatile substances in Daocai samples with different fermentation methods

分类编号名称化学式分子质量/Da保留指数保留时间/s漂移时间/s1异硫氰酸烯丙酯C4H5 NS99.2887.3254.1421.089 82异硫氰酸酯类24-异硫氰酸戊烯酯C6H9 NS127.21 079.3463.7681.173 9831-丁烯4-异硫氰酸酯C5H7 NS113.2984.8335.0291.133 124异硫氰酸丁酯C5H9 NS115.2929.4288.191.143 3712-丁烯酸己酯C10H18O2170.31 334.4830.111.447 662琥珀酸二乙酯C8H14O4174.21 191.5624.8541.303 583乙酸叶醇酯C8H14O2142.21 009.9364.1531.814 264乙酸丁酯C6H12O2116.2802.7210.1821.624 865乙酸丙酯C5H10O2102.1703.4167.6531.480 34酯类6乙酸乙酯C4H8O288.1596.5137.2961.340 667丁酸甲酯C5H10O2102.1724.2176.1171.417 588丙位辛内酯C8H14O2142.21 283.2756.5861.332 469异丁酸甲酯C5H10O2102.1653.4152.3441.443 7510乙酸异丁酯C6H12O2116.2760.8191.0271.616 9211异丁酸乙酯C6H12O2116.2749.8186.5641.575 5212乙酸异戊酯C7H14O2130.2872.9246.6461.748 521芳樟醇C10H18O154.31 097489.2391.245 892(E)-2-己烯醇C6H12O100.2851.1235.3131.510 4932-甲基-3-呋喃硫醇C5H6OS114.2865.1242.6191.142 6742-乙基己醇C8H18O130.21 030.7394.0921.399醇类5乙醇C2H6O46.1442.596.6451.136 861-戊醇C5H12O88.1760.8191.0271.518 157顺-2-戊烯-1-醇C5H10O86.1777.3197.7251.445 528正己醇C6H14O102.2872.9246.6461.640 069苯乙醇C8H10O122.21 061.7438.5661.293 810异戊醇C5H12O88.1725.9176.8191.504 7113-羟基-2-丁酮(乙偶姻)C4H8O288.1687.2161.2641.336 15酮类22,3-丁二酮C4H6O286.1547.2124.2761.158 2331-辛烯-3-酮C8H14O126.2979.4330.4351.691 021丙醛C3H6O58.1495.9110.731.156 442乙醛C2H4O44.1421.691.1070.987 033反式-2,4-庚二烯醛C7H10O110.21 010.2364.6191.194 7142,4-庚二烯醛C7H10O110.21 000.8351.1011.203 39醛类5(E)-2-庚烯醛C7H12O112.2954.7309.5581.669676反-2-辛烯醛C8H14O126.21 054.8428.5921.333 477反-2-壬烯醛C9H16O140.21 164.6586.2771.401 068糠醛C5H4O296.1825.2221.8661.090 049戊醛C5H10O86.1690.4162.3591.422 34酸类12-甲基丁酸C5H10O2102.1869.1244.6971.475 032丙酸C3H6O274.1706.7168.9781.101 93己酸C6H12O2116.21 013.4369.2251.648 1512,4,5-三甲基噻唑C6H9 NS127.2983.4333.8581.560 86杂环类22-乙基呋喃C6H8O96.1675.4158.1381.309 0132,3,5-三甲基吡嗪C7H10N2122.21 000.5350.6651.176 14四氢呋喃C4H8O72.1640.9149.0231.227 25烯类11-氰基丙烯C4H5 N67.1643.2149.6291.245 362α-水芹烯C10H16136.21 003.6355.1581.224 87
2.4 笋子芥及不同发酵方式道菜的挥发性物质指纹图谱分析
为了更加全面地对比不同样品间挥发性有机物组分的差异,选取谱图中所有的待分析峰生成指纹图谱,结果如图4所示。
将图4与表3结合分析,由图4A区域可知,道菜原料笋子芥中2-丁烯酸己酯、琥珀酸二乙酯、反式-2-壬烯醛、芳樟醇、4-异硫氰酸戊烯酯、乙酸叶醇酯、2,4,5-三甲基噻唑、糠醛、反式-2-戊烯醛、2,5-二甲基呋喃、3-羟基-2-丁酮、1-氰基丙烯、2,3,5-三甲基吡嗪等风味物质含量较高,而上述物质经发酵后含量下降。由图4B区域可知,原料笋子芥经发酵后,产生了乙酸丁酯、乙酸丙酯、乙酸乙酯、丙位辛内酯、2-甲基-3-呋喃硫醇、乙醇、顺-2-戊烯-1-醇、异戊醇、戊醛、2-甲基丁酸、四氢呋喃等风味物质,随着这些物质的增加,使道菜风味更佳。此结论与LIU等[20]的研究结果一致,发酵后芥菜中异硫氰酸酯浓度明显降低,醇类(乙醇、苯乙醇)、酯类(乙酸乙酯、乙酸丙酯)和酮类(1-戊烯-3-酮)的含量不断增加,这些风味物质为发酵芥菜增加了果香、甜香、青草香及蘑菇香的香气。

图4 笋子芥及不同发酵方式道菜的挥发性物质指纹图谱
Fig.4 Fingerprint of volatile matter in Brassica juncea and Daocai with different fermentation methods
注:数字表示未鉴定出来的化合物
利用归一化法,根据不同风味物质的离子峰体积,对笋子芥及不同发酵方式下道菜中各类挥发性风味物质进行定量,得到其相对含量,如图5所示,SY1、SY2、SY3、SY4四组发酵道菜样品间物质占比没有显著差异。
由图5可知,酯类物质(27%~35%)含量最多,是发酵过程中酸跟醇反应产生的[21],赋予道菜独特的香味,其中乙酸异戊酯具有强烈的香蕉、生梨、苹果的甜水果香气,并带有梨的甜酸味。

图5 笋子芥及不同发酵方式道菜的挥发性物质相对含量
Fig.5 Relative content of volatile substances in Brassica juncea and Dcaocai with different fermentation methods
醛类物质(20%~22%)由脂质氧化产生,通常贡献麦芽、奶酪、水果香味[22],是道菜挥发性物质的重要组成成分,该类物质能够作用于感官使得香气更为明显,增加了道菜的香气。
醇类物质(17%~24%),主要来源于多不饱和脂肪酸的降解[23],其中芳樟醇具有浓青带甜的木青,既有紫丁香、铃兰与玫瑰的花香,又有木香、果香味。YANG等[24]在纯种发酵的四川泡菜中也检出了芳樟醇、香叶醇等气味物质,醇类物质对发酵蔬菜的香气具有十分重要的影响。
酮类物质(3%~9%)是由多不饱和脂肪酸的热氧化或氨基酸降解产生的[25],从发酵道菜中鉴定出3-羟基-2-丁酮(乙偶姻)、2,3-丁二酮、1-辛烯-3-酮3种酮类物质,分别为道菜提供草莓、奶油、蘑菇的香味。
酸类物质(2%)一般是通过脂质和碳水化合物代谢产生的,提供酸味香气的同时,可与醇类物质成为酯的前体,赋予产品新鲜的气味,故酸类物质是发酵蔬菜风味的重要因素[26]。
呋喃和吡嗪类物质是杂环化合物(5%~7%),是通过美拉德反应和硫胺素的热降解而产生的,为道菜提供草香味、坚果味[27]。
采用PCA法分析道菜挥发性成分与发酵方式之间的关系。如图6所示,第一主成分PC1的贡献率为32%,第二主成分PC2的贡献率为29%,这两个主成分的累计贡献率达到61%,表明这两个主成分能够代表原始数据的绝大部分有效信息,分析所得数据能够反映出不同发酵方式道菜的总体特征[28]。4个发酵组的样品未体现出明显的分布规律,表明它们之间的挥发性物质不存在明显差异。

图6 不同发酵方式道菜 PCA
Fig.6 PCA in Daocai with different fermentation methods
3 结论
对原料笋子芥以及不同发酵方式下道菜中BAs的含量进行测定,研究发现笋子芥经发酵后产生了不同种类和含量的BAs,且自然发酵和纯种发酵方式下道菜样品中的BAs含量存在显著差异(P<0.05)。与自然发酵组相比,纯种发酵样品组中组胺、酪胺和亚精胺的含量明显降低,其中以SY4组样品中此三者的降解率最高,分别为52.54%、43.42%、58.08%,说明BAs降解菌与商业乳酸菌复合纯种发酵道菜安全性更高。此外,研究还发现,纯种发酵组样品与自然发酵组样品中挥发性风味物质无显著差异,说明接种降胺菌纯种发酵道菜总BAs含量下降的同时对产品的风味并未产生不良影响,笋子芥经发酵后异硫氰酸酯类含量下降,酯类、酮类等含量增加,赋予道菜花香、果香、蘑菇香等特征风味。通过研究不同发酵方式对发酵道菜产品BAs和风味的影响,为BAs降解菌的工业化应用提供理论依据。
[1] 何丝汀,王力,任艳玲.镇远陈年道菜的制作工艺及乳酸菌的分离与鉴定[J].现代食品, 2020(11):164-166.
HE S T, WANG L, REN Y L.Study on producing process, isolation and identification of lactic acid bacteria in Zhenyuan Daocai[J].Modern Food, 2020(11):164-166.
[2] TIAN Y, DENG F M, ZHAO L Y, et al.Characterization of extractable components of fresh and fermented Huarong large-leaf mustard and their inhibitory effects on human colon cancer cells[J].Food Bioscience, 2021, 43:101280.
[3] LI X N, PANG W X, PIAO Z Y.Omics meets phytonutrients in vegetable brassicas:For nutritional quality breeding[J].Horticultural Plant Journal, 2017, 3(6):247-254.
[4] BASSAN P, BHUSHAN S, KAUR T, et al.Extraction, profiling and bioactivity analysis of volatile glucosinolates present in oil extract of Brassica juncea var.raya[J].Physiology and Molecular Biology of Plants, 2018, 24(3):399-409.
[5] JEONG Y J, CHO H J, CHUNG F L, et al.Isothiocyanates suppress the invasion and metastasis of tumors by targeting FAK/MMP-9 activity[J].Oncotarget, 2017, 8(38):63 949-63 962.
[6] LY D, MAYRHOFER S, DOMIG K J.Significance of traditional fermented foods in the lower Mekong subregion:A focus on lactic acid bacteria[J].Food Bioscience, 2018, 26:113-125.
[7] DABADÉ D S, JACXSENS L, MICLOTTE L, et al.Survey of multiple biogenic amines and correlation to microbiological quality and free amino acids in foods[J].Food Control, 2021, 120:107497.
[8] FONG F L Y, EL-NEZAMI H, SZE E T P.Biogenic amines—Precursors of carcinogens in traditional Chinese fermented food[J].NFS Journal, 2021, 23:52-57.
[9] 董春晖,石硕,钟强,等.发酵剂抑制发酵肉制品中酪胺形成机制及效果的研究进展[J].食品科学,2021,42(19):317-324.
DONG C H, SHI S, ZHONG Q, et al.Progress in the inhibitory effect and mechanism of starter cultures on the formation of tyramine in fermented meat products[J].Food Science,2021,42(19):317-324.
[10] SIVAMARUTHI B S, KESIKA P, CHAIYASUT C.A narrative review on biogenic amines in fermented fish and meat products[J].Journal of Food Science and Technology, 2021, 58(5):1 623-1 639.
[11] RABIE M A, SILIHA H, EI-SAIDY S, et al.Reduced biogenic amine contents in sauerkraut via addition of selected lactic acid bacteria[J].Food Chemistry, 2011, 129(4):1 778-1 782.
[12] 夏学超,于金换,曲桂武.强化发酵对辣椒中生物胺及理化指标影响的研究[J].食品科技, 2021,46(10):13-18.
XIA X C, YU J H, QU G W.Effect of intensified fermentation on biogenic amines and physicochemical indexes of chili[J].Food Science and Technology, 2021,46(10):13-18.
[13] 王德宝,赵丽华,田建军,等.不同发酵剂对发酵香肠中风味物质释放及有害生物胺控制的影响[J].中国食品学报, 2019, 19(8):89-96.
WANG D B, ZHAO L H, TIAN J J, et al.Effects of different starter cultures on the flavor release and control of the harmful biogenic amines in the fermented mutton sausages[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(8):89-96.
[14] SUN Q X, SUN F D, ZHENG D M, et al.Complex starter culture combined with vacuum packaging reduces biogenic amine formation and delays the quality deterioration of dry sausage during storage[J].Food Control, 2019, 100:58-66.
[15] LIU S P, SUN H L, LIU C X, et al.Reducing biogenic amine in seriflux and huangjiu by recycling of seriflux inoculated with Lactobacillus plantarum JN01[J].Food Research International, 2021, 150:110793.
[16] 于怀智,姜滨,孙传虎,等.顶空气相离子迁移谱技术对不同产地水蜜桃的气味指纹分析[J].食品与发酵工业, 2020, 46(16):231-235.
YU H Z, JIANG B, SUN C H, et al.Analysis of nectarine odor fingerprints based on headspace-gas chromatography-ion mobility spectroscopy[J].Food and Fermentation Industries, 2020, 46(16):231-235.
[17] 徐智虎,王雪郦,刘雪婷,等.贵州镇远道菜中生物胺降解菌的筛选及鉴定[J].食品与发酵工业, 2022,48(7):126-133.
XU Z H, WANG X L, LIU X T,et al.Screening and identification of biogenic amine-degrading bacteria from Zhenyuan Daocai in Guizhou[J].Food and Fermentation Industries, 2022,48(7):126-133.
[18] YE H Q, LANG X S, JI Y Y, et al.The interaction between Lactobacillus plantarum SC-5 and its biogenic amine formation with different salt concentrations in Chinese Dongbei Suancai[J].Food Research International, 2021,150:110813.
[19] LIANG H P, HE Z, WANG X Y, et al.Effects of salt concentration on microbial diversity and volatile compounds during Suancai fermentation[J].Food Microbiology, 2020, 91:103537.
[20] LIU D Q, ZHANG C C, ZHANG J M, et al.Metagenomics reveals the formation mechanism of flavor metabolites during the spontaneous fermentation of potherb mustard (Brassica juncea var.multiceps)[J].Food Research International, 2021, 148:110622.
[21] WANG Y Q, LI C S, ZHAO Y Q, et al.Novel insight into the formation mechanism of volatile flavor in Chinese fish sauce (Yu-lu) based on molecular sensory and metagenomics analyses[J].Food Chemistry, 2020, 323:126839.
[22] ZHAO Y, WANG Y Q, LI C S, et al.Novel insight into physicochemical and flavor formation in naturally fermented tilapia sausage based on microbial metabolic network[J].Food Research International, 2021, 141:110122.
[23] ZHU W H, LUAN H W, BU Y, et al.Flavor characteristics of shrimp sauces with different fermentation and storage time[J].LWT, 2019, 110:142-151.
[24] YANG Z Y, LUO F P, ZHONG K, et al.Effect of Bacillus subtilis Y61 inoculation on bacterial community and metabolic profile of sichuan paocai fermentation[J].LWT, 2021, 137:110393.
[25] ZHANG J H, CAO J, PEI Z S, et al.Volatile flavour components and the mechanisms underlying their production in golden pompano (Trachinotus blochii) fillets subjected to different drying methods:A comparative study using an electronic nose, an electronic tongue and SDE-GC-MS[J].Food Research International, 2019, 123:217-225.
[26] LIANG H P, HE Z, WANG X Y, et al.Bacterial profiles and volatile flavor compounds in commercial Suancai with varying salt concentration from Northeastern China[J].Food Research International, 2020, 137:109384.
[27] FLORES M.Understanding the implications of current health trends on the aroma of wet and dry cured meat products[J].Meat Science, 2018, 144:53-61.
[28] CHEN X A, CHEN H Q, XIAO J, et al.Variations of volatile flavour compounds in finger citron (Citrus medica L.var.sarcodactylis) pickling process revealed by E-nose, HS-SPME-GC-MS and HS-GC-IMS[J].Food Research International, 2020, 138:109717.